Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 12, стр. 1639-1654
Влияние пробиотических штаммов на размер инфаркта миокарда, биохимические и иммунологические параметры у крыс с синдромом системного воспалительного ответа и полиморбидностью
Ю. Ю. Борщев 1, Д. Л. Сонин 1, 2, И. Ю. Буровенко 1, В. Ю. Борщев 2, Ю. В. Чебуркин 1, О. В. Борщева 1, М. М. Галагудза 1, 2, *
1 Национальный медицинский исследовательский центр им. В.А. Алмазова Министерства
здравоохранения Российской Федерации
Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет
им. академика И.П. Павлова Министерства здравоохранения Российской Федерации
Санкт-Петербург, Россия
* E-mail: galagudza@almazovcentre.ru
Поступила в редакцию 28.08.2022
После доработки 31.10.2022
Принята к публикации 01.11.2022
- EDN: VFTRHG
- DOI: 10.31857/S0869813922120020
Аннотация
Многочисленные экспериментальные и клинические исследования показали эффективность различных пробиотических штаммов при нарушениях обмена веществ, заболеваниях желудочно-кишечного тракта и печени, патологии иммунной системы. В меньшей степени изучены эффекты пробиотиков при нарушениях функции сердечно-сосудистой системы. Разработка и валидация новой экспериментальной модели на крысах, включающей ожирение, острый воспалительный процесс толстой кишки и антибиотик-индуцированный дисбиоз, обладающей общими характеристиками синдрома системного воспалительного ответа (ССВО), стала основой для исследования влияния пробиотических препаратов на устойчивость миокарда к ишемическому-реперфузионному повреждению с использованием модели коронароокклюзионного инфаркта in vivo. У крыс стока Вистар с моделированием ССВО обнаружено увеличение размера инфаркта миокарда на 24% по сравнению с контрольными животными (р < 0.05), а также существенные изменения лейкоформулы, биохимических и иммунологических показателей. Введение животным с ССВО смеси штаммов Lactobacillus acidophilus (LA-5) и Bifidobacterium animalis subsp. lactis (BB-12) вызвало уменьшение размера инфаркта до значения близкого к контролю. У крыс, получавших LA-5 и BB-12, при сравнении с группой с ССВО, а также с группами, получавшими другие пробиотические штаммы, также отмечена нормализация количества лейкоцитов, уровня желчных кислот, трансформирующего фактора роста-β, интерлейкинов: IL-1α, IL-2, IL-6, IL-8, фактора некроза опухолей-α, липополисахарида и моноцитарного хемоаттрактантного белка-1 в крови. Полученные данные убедительно показывают перспективность дальнейшего изучения кардиотропного потенциала пробиотических микроорганизмов в трансляционных исследованиях.
В настоящее время ожирение рассматривается не только как самостоятельный иммуновоспалительный процесс [1], но и признается одним из предикторов летального исхода от COVID-19 [2] с характерным паттерном гиперцитокинемии. Также известно, что наличие у пациента сердечно-сосудистых заболеваний (ССЗ) и факторов их риска повышает уязвимость к COVID-19, который, в свою очередь, может усугубить ССЗ и спровоцировать новые сердечно-сосудистые осложнения [3]. Одним из общих патогенетических звеньев вышеуказанных патологий является системный воспалительный ответ. Наиболее важными маркерами системного воспалительного ответа низкой интенсивности являются IL-6, TNF-α, IL-1α, IL-10 и MCP-1, тогда как для цитокинового шторма характерно значительное увеличение концентрации в крови еще и IL-2, IL-7, IFNγ [4, 5]. Патогенез цитокинового шторма связан с избыточным эффектом цитокинов на клетки и возникающим при этом вторичном повреждении органов-мишеней, а именно печени, легких, почек и центральной нервной системы. Клиническая значимость проблемы придает дополнительный импульс к поиску общих терапевтических мишеней и инструментов для предотвращения формирующейся при системном воспалении и цитокиновом шторме полиорганной недостаточности.
В контексте связи ожирения, воспалительного процесса и изменений состава кишечной микробиоты [6] с развитием ССЗ для разработки стратегии защиты миокарда от ишемического и реперфузионного повреждения, основанной на управляемом изменении состава кишечной микробиоты с помощью пробиотических препаратов, нами была предложена новая экспериментальная модель синдрома системного воспалительного ответа (ССВО) [7]. Данная модель ССВО у крыс включает в качестве базового повреждающего воздействия химически индуцированное воспаление толстой кишки на фоне первичного висцерального ожирения и антибиотик-индуцированного дисбиоза. По результатам исследования влияния различных антимикробных препаратов [8] и качественного состава жироуглеводной диеты [9] у крыс с ССВО, нами были получены данные, подтверждающие положительное влияние пробиотических штаммов на устойчивость миокарда к ишемическому-реперфузионному повреждению на модели изолированного сердца, перфузируемого по Лангендорфу [10].
Целью данной работы стало изучение терапевтического потенциала пробиотических микроорганизмов в отношении толерантности миокарда к ишемическому-реперфузионному повреждению (ИРП) in vivo, на фоне внутрижелудочного введения смеси пробиотических лакто- и бифидобактерий, а также сахаромицетов и энтерококков. В данной работе на модели ССВО на крысах стока Wistar использовали методику коронароокклюзионного инфаркта миокарда. Основной задачей исследования являлась проверка гипотезы о влиянии пробиотических штаммов на течение локальных и системных воспалительных реакций с кардиопротективным эффектом. Дополнительной задачей являлась оценка влияния пробиотических препаратов на биохимические и иммунологические показатели.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты выполнены на 80 крысах самцах стока Wistar SPF-категории (Пущино) в условиях улучшенного конвенционального вивария, массой 300–350 г, в соответствии с Директивой Европейского Совета по соблюдению этических принципов в работе с лабораторными животными, согласно дизайну эксперимента (рис. 1), утвержденного решением биоэтического комитета Института экспериментальной медицины Национального медицинского исследовательского центра им. В.А. Алмазова, протокол-заявка 21-09ПЗ#V1 от 21.05.2021. Животные случайным образом распределялись в одну из пяти групп (n = 16 в каждой группе): 1) контроль (CTR) – крысы получали стандартный корм и питьевую воду ad libitum; 2) синдром системного воспалительного ответа (ССВО). Крысам с первичным висцеральным ожирением, индуцированным жироуглеводной диетой, на основе контролируемого потребления ненасыщенных жирных кислот (2 г) и сахарозы (1 г) соответственно на 1 крысу в сутки, в течение 28 дней до моделирования ССВО и далее до окончания опыта [9], осуществлялось моделирование ССВО [7]. Животным однократно ректально вводили смесь 3%-ного раствора уксусной кислоты и 3%-ного раствора этанола в физиологическом растворе, общим объемом 1 мл, индуцируя острое воспаление толстого кишечника. Начиная со следующего дня, этим животным внутрижелудочно вводили смесь антимикробных препаратов (амоксициллин, метронидазол и кларитромицин) в следующем режиме: 1 мл раствора антимикробных препаратов в суточной дозе по 15 мг каждого препарата на крысу в течение трех дней, что провоцировало антибиотик-индуцированный дисбиоз; 3) ССВО с введением смеси пробиотических лакто- и бифидобактерий (SIRS + LBS) – крысам с ССВО вместо 1 мл физиологического раствора в течение 8 дней вводили 1 мл раствора смеси пробиотических штаммов Lactobacillus acidophilus (LA-5) и Bifidobacterium animalis subsp. lactis (BB-12), в концентрации не менее 108 колониеобразующих единиц (КОЕ) каждого штамма на одно животное; 4) ССВО с введением сахаромицетов (SIRS + SB) – крысам данной группы в 1 мл физиологического раствора вводили 25 мг лиофилизированных Saccharomyces boulardii на одно животное; 5) ССВО с введением энтерококков (SIRS + EF) – крысам данной группы в качестве пробиотических микроорганизмов вводили лиофилизированные Enterococcus faecium L3 в дозе 108 КОЕ на одно животное. Краткие сведения об использованных штаммах приведены в обсуждении.
Рис. 1.
Дизайн эксперимента. CTR – контроль, SIRS – синдром системной воспалительной реакции, SIRS + LBS – ССВО и смесь LA-5 и BB-12, SIRS + SB – ССВО и S. boulardii, SIRS + EF – ССВО и E. faecium L3, AA + E – смесь уксусной кислоты и этанола, HFCD – жироуглеводная диета, Veh – физиологический раствор, AMC – смесь антимикробных препаратов.

На 8-й день после моделирования ССВО, на 40 рандомно отобранных крысах для соответствующих групп (n = 8), проводили опыт по методике окклюзии левой коронарной артерии под изофлурановым наркозом, которая включала в себя следующие этапы: индукция анестезии, трахеостомия, катетеризация сонной артерии, катетеризация бедренной вены, торакотомия, моделирование ишемически-реперфузионного повреждения миокарда, включающее период стабилизации исходных значений, ишемию (30 мин) и реперфузию (120 мин). В конце эксперимента анестезия углублялась с 2%-ного до 5%-ного раствора изофлурана, выполнялась реокклюзия коронарной артерии и вводилось 2.5 мл синего Эванса (2%-ный раствор). Через 10 с после выявления четкой границы между перфузируемым и ишемизированным отделом сердца его быстро вырезали, промывали в физиологическом растворе и разрезали на 5 поперечных фрагментов толщиной 1.5–2.0 мм. Планиметрическую оценку размера инфаркта проводили путем окраски срезов сердца 1%-ным раствором трифенилтетразолия хлорида при температуре 37°С в течение 15 мин. Определяли размер зоны риска и размер инфаркта, которые выражали в процентах от общей площади среза и от площади зоны риска соответственно и вычисляли средние значения для данного сердца по результатам анализа 5 срезов [11].
У оставшихся 40 крыс соответствующих групп под краткосрочным наркозом брали цельную кровь (2 мл) из большой подкожной вены для гематологического, биохимического и иммунологического анализа. Клинический анализ крови выполняли на автоматическом ветеринарном гематологическом анализаторе (URIT-3000 Vet Plus, URIT Medical Electronic, Китай). Концентрацию кальция (Са2+), желчных кислот (ЖК), щелочной фосфатазы (ЩФ), мочевой кислоты и мочевины оценивали с помощью биохимического анализатора (BioChem Analette, HTI, CША). Уровень трансформирующего фактора роста-β (TGF-β), фактора некроза опухолей-α (TNF-α), провоспалительных цитокинов IL-1α, IL-2, IL-6, IL-8, липополисахарида (LPS), моноцитарного хемоаттрактантного белка-1 (МСР-1) оценивали иммуноферментным методом (MR-96A, Mindray, Китай).
Посмертно измерялась масса некоторых внутренних органов – слепой кишки как макроскопического показателя антибиотик-индуцированного дисбиоза, печени – полифункционального органа, вырабатывающего желчь, почек – основы мочевыделительной системы, и селезенки как самого большого лимфоидного органа. Массовый коэффициент органов как процентное отношение массы органа к массе тела [12] в данной модели вычисляли без массы слепой кишки в связи с кратным увеличением внутрипросветного содержимого, индуцированного дисбиозом в результате введения антибиотиков. На протяжении всего эксперимента, ежедневно с 9 до 10 утра проводили оценку потребления корма и воды, а также массы тела животных.
Статистическую обработку экспериментальных данных проводили с помощью программного пакета STATISTICA 10.0. Статистический анализ дискретных значений проводился с использованием непараметрического H-критерия Краскела–Уоллиса для обнаружения статистически значимых различий, с последующим апостериорным сравнением с использованием критерия Манна–Уитни. Для повторных измерений непрерывного типа, проверку гипотезы о равенстве средневыборочных величин в нескольких независимых выборках проводили методами дисперсионного анализа ANOVA c проведением post-hoc теста (Tukey HSD). В таблицах использованы медианные значения (Mе) и значения для нижнего и верхнего квартиля (25%; 75%). Для построения графических изображений использовали средние значения и стандартные отклонения (SD). Статистически значимыми считали различия при уровне значимости р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Масса тела и внутренних органов
Масса тела крыс в группе CTR, начиная со дня моделирования ССВО до окончания опыта, в среднем увеличивалась на 1.5 ± 0.6 г/сутки, тогда как в группах SIRS, SIRS + LBS, SIRS + SB и SIRS + EF наблюдали уменьшение массы тела животных на 3.9 ± 0.4; 3.6 ±1.4; 3.9 ± 1.1 и 2.3 ± 0.2 г/сутки соответственно (p < 0.05 в сравнении с группой CTR). Потребление воды животными за этот же период, из расчета на 100 г массы тела, в группе CTR составило 7.1 ± 0.6 мл/сутки, что значимо не отличалось от значений данного показателя в остальных группах (7.5 ± 0.5; 7.3 ± 1.3; 8.3 ± 0.8 и 6.3 ± 1.2 мл/сутки для групп SIRS, SIRS + LBS, SIRS + SB и SIRS + EF соответственно). Потребление корма в группах из расчета на 100 г массы тела в сутки, начиная с дня моделирования, для крыс из группы CTR составило 3.9 ± 0.2; SIRS – 1.5 ± 0.03; SIRS + LBS – 1.6 ± 0.1; SIRS + SB – 1.8 ± 0.1; и SIRS + EF – 1.6 ± 0.2 г/100 г/сутки, показывая сокращение в опытных группах в 1.9–2.5 раза (р < 0.05) по отношению к контролю (рис. 2а, b, c).
Рис. 2.
Динамика изменения массы тела (а), потребление воды (b) и корма (c) со дня моделирования ССВО до окончания опыта, среднее значение (± SD). CTR – контроль; SIRS – синдром системного воспалительного ответа; SIRS + LBS – ССВО и смесь LA-5 и BB-12; SIRS + SB – ССВО и S. boulardii; SIRS + EF – ССВО и E. faecium L3. * – р < 0.05 по отношению к группе CTR.

В группе SIRS произошло уменьшение массового коэффициента печени на 16% (р < 0.05), в группе SIRS + LBS на 10% (р < 0.05), SIRS + EF на 19% (р < 0.05) по отношению к группе CTR, тогда как в группе SIRS + SB этот показатель не отличался от такового в группе CTR. Для селезенки отмечено уменьшение массового коэффициента в группе SIRS на 12% (р < 0.05) по сравнению с группой CTR. В группе SIRS + SB массовый коэффициент селезенки был на 12% выше, чем в группе CTR. Значимое увеличение массового коэффициента почек на 12% наблюдали в группе SIRS (табл. 1).
Таблица 1.
Массовые коэффициенты органов, критерий Краскела–Уоллиса, (Me; 25%; 75%), n = 8
| Группа | CTR | SIRS | SIRS + LBS | SIRS + SB | SIRS + EF |
|---|---|---|---|---|---|
| Слепая кишка |
1.41# (1.39; 1.45) |
5.92* (4.64; 6.90) |
2.68# (2.66; 2.68) |
3.29*, # (3.03; 3.32) |
3.25*, # (3.20; 3.29) |
| Печень | 3.00# (2.96; 3.08) |
2.69* (2.68; 2.70) |
2.78* (2.77; 2.79) |
3.08# (3.01; 3.17) |
2.53*, # (2.51; 2.57) |
| Селезенка | 0.18# (0.175; 0.182) |
0.14* (0.136; 0.145) |
0.17# (0.170; 0.175) |
0.2*, # (0.197; 0.212) |
0.17# (0,165; 0,178) |
| Почки | 0.52# (0.509; 0.527) |
0.57* (0.574; 0.576) |
0.53 (0.532; 544) |
0.56 (0.535; 0.566) |
0.52# (0.522; 0.531) |
Клинический анализ крови
Значимых изменений числа эритроцитов и их характеристик в опытных группах по отношению к контролю не произошло (табл. 2). В группах SIRS и SIRS + EF отмечено увеличение тромбоцитов на 25% (р < 0.05 в сравнении с группой CTR). Описание лейкограммы в данной работе ограничено возможностями использованного анализатора второго класса, в связи с чем сделан акцент на процентном соотношении основных фракций лейкоцитов: LYM, MID, GRAN. В группе SIRS показано увеличение общего числа лейкоцитов на 13%, причем существенный вклад внесла популяция лимфоцитов (LYM) с увеличением на 45% (р < 0.05 в сравнении с группой CTR) с соответствующим относительным снижением представительства средних лейкоцитов MID и гранулоцитов на 23% (р > 0.05), хотя в абсолютном выражении их число, как и MID, также увеличилось. В группе SIRS + SB количество лейкоцитов уменьшилось на 32% по отношению к группе CTR и на 40% к группе SIRS (р < 0.05), а также произошло увеличение популяции MID на 45% (р < 0.05). В группах SIRS + LBS и SIRS + EF распределение числа исследованных фракций лейкоцитов по отношению к контролю существенно не отличалось, хотя в последней группе значимо уменьшилось количество MID на 45% (р < 0.05).
Таблица 2.
Гематологические показатели, критерий Краскела–Уоллиса, Me (25%; 75%), n = 8
| Параметр | Группа | ||||
|---|---|---|---|---|---|
| CTR | SIRS | SIRS + LBS | SIRS + SB | SIRS + EF | |
| WBC, 109/л | 7.5 (6.7; 8.5) |
8.5 (7; 11.3) |
7.3 (5.8; 8.1) |
5.1# (4.3; 6.2) |
7.4 (6.4; 8.0) |
| LYM, % | 27# (26; 35) |
49* (40; 55) |
35 (26; 51) |
49* (43; 54) |
36 (24; 44) |
| MID, % | 9.5 (8.3; 11.4) |
7.3 (6.5; 9.5) |
8.2 (4.5; 8.9) |
9.7 (9.1; 10.6) |
5.2* (4.2; 9.3) |
| GRAN, % | 61 (54; 68) |
47 (40; 67) |
58 (47; 65) |
53 (44; 58) |
58 (55; 65) |
| RBC, 1012/л | 7.9 (7.6; 8.6) |
7.6 (7.3; 7.9) |
7.3 (6.9; 7.9) |
8 (7.4; 8.4) |
7.9 (7.8; 8) |
| PLT, 109/л | 657# (646; 767) |
876* (860; 1010) |
883 (812; 918) |
735 (639; 849) |
857* (731; 118) |
* – р < 0.05 по отношению к группе CTR, # – р < 0.05 по отношению к группе SIRS. CTR – контроль; SIRS – синдром системного воспалительного ответа; SIRS + LBS – ССВО и смесь LA-5 и BB-12; SIRS + SB – ССВО и S. boulardii; SIRS + EF – ССВО и E. faecium L3. WBC – лейкоциты, LYM – лимфоциты, MID – популяция средних лейкоцитов, GRAN – гранулоциты, RBC – эритроциты, PLT – тромбоциты.
Биохимические параметры крови
Результаты анализа биохимических показателей крови представлены в табл. 3. В группе SIRS по сравнению с группой CTR отмечено значимое снижение уровня мочевины и желчных кислот (p < 0.05). При этом уровень мочевой кислоты, кальция, ЩФ и ЛДГ был, напротив, значимо выше в этой группе (p < 0.05 в сравнении с группой CTR). В группе SIRS + LBS значения уровня кальция, желчных кислот и ЩФ не отличались от группы CTR, т.е. происходила нормализация данных показателей. При этом сохранялись повышенная активность ЛДГ и повышенная концентрация мочевой кислоты, а также сниженный уровень мочевины, отмеченные в группе SIRS (p < 0.05). В группе SIRS + SB значения уровня мочевой кислоты, кальция и ЛДГ не отличались от группы CTR, но при этом сохранялись сниженный уровень мочевины и желчных кислот (p < 0.05). В группе SIRS + EF значения уровней мочевины, кальция, ЩФ и ЛДГ не отличались от таковых в группе CTR при сохраняющемся повышении концентрации мочевой кислоты и снижении уровня желчных кислот (p < 0.05). Таким образом, ССВО сопровождался существенными отклонениями всех оцениваемых биохимических параметров от нормы, а применение различных режимов пробиотической коррекции приводило к частичной нормализации этих параметров, однако характер нормализации зависел от типа пробиотика.
Таблица 3.
Биохимические показатели крови, критерий Краскела–Уоллиса, Me (25%; 75%), n = 8
| Группа | CTR | SIRS | SIRS + LBS | SIRS + SB | SIRS + EF |
|---|---|---|---|---|---|
| Мочевина, мг/дл | 25.1# (22.5; 25.4) |
14.8* (12.2; 15.5) |
14.2* (11.5; 17.2) |
12.3* (10.3; 12.8) |
21.2# (20.1; 25.3) |
| Мочевая кислота, мкмоль/л | 19.8# (11.8; 27.8) |
42.8* (28.8; 60.4) |
40.6* (33.8; 45.1) |
25.4# (21.9; 34.7) |
32.1 (19.9; 35.5) |
| Кальций, ммоль/л |
2.05# (0.95; 2.75) |
3.10* (2.25; 3.5) |
2.55 (1.40; 2.85) |
2.35 (2.05; 2.65) |
2.5 (2.20; 3.05) |
| Желчные кислоты, мкмоль/л | 12.8# (11.3; 19.8) |
3.7* (2.2; 6.1) |
9.5*,# (8.6; 11.6) |
3.3* (2.4; 4.2) |
4* (1.9; 6.8) |
| Щелочная фосфатаза, Ед/л | 22.8# (18.2; 31.7) |
36.3* (35.2; 37.8) |
21.5# (14.6; 25.5) |
21.3# (20; 28) |
25# (19.9; 29.1) |
| Лактат дегидрогеназа, Ед/л |
555# (486; 615) |
835* (746; 852) |
913* (909; 950) |
396# (210; 421) |
739 (389; 872) |
Иммунологические показатели
Гиперпродукция всех иммунологических показателей крови, представленных в табл. 4, имела место в группе SIRS cо значимым (р < 0.05) увеличением их концентрации в крови по сравнению с контролем. Увеличение показателей TNF-α на 28% и TGF-β на 29%, IL-1α на 26%, IL-2 на 33%, MCP-1 на 41% в группе SIRS можно считать умеренными по сравнению с ростом IL-6 более чем в 2 раза, IL-8 в 3 раза и LPS почти в 10 раз (р < 0.05). В группе SIRS + LBS показано уменьшение концентрации IL-2, IL-8, MCP-1, TNF-α приблизительно до контрольных значений, что указывает на блокирование продукции плейотропных цитокинов и метаболитов под влиянием пробиотической терапии, выраженное в стабилизации показателей воспалительного статуса. В группе SIRS + SB также отмечена нормализация уровней IL-2, МСР-1, TNF-α и TGF-β, а в группе SIRS + EF – всех кроме IL-1α, IL-6 и МСР-1.
Таблица 4.
Иммунологические показатели крови, критерий Краскела–Уоллиса, Me (25%; 75%), n = 8
| Группа | CTR | SIRS | SIRS + LBS | SIRS + SB | SIRS + EF |
|---|---|---|---|---|---|
| IL-1α, пг/мл | 74# (66; 78) |
100* (93; 109) |
42*, # (31; 51) |
48*, # (39; 50) |
47*, # (45; 49) |
| IL-2, пг/мл | 4.01# (3.15; 4.62) |
6.01* (4.43; 6.54) |
3.02# (2.90; 4.93) |
3.80 (3.75; 4.24) |
3.6# (3.12; 3.81) |
| IL-6, пг/мл | 21# (19; 25) |
48* (41; 64) |
7.8*, # (7.6; 8.5) |
5.4*, # (3.7; 7) |
4.1*, # (3.3; 5.3) |
| IL-8, пг/мл | 19# (18; 24) |
57* (53; 66) |
31# (30; 35) |
67* (30; 93) |
15# (14; 21) |
| MCP-1, пг/мл | 4.87# (3.54; 5.68) |
8.31* (7.26; 11.5) |
4.11# (3.71; 4.68) |
5.45# (4.09; 6.55) |
6.91* (6.61; 8.22) |
| TNF-α, пг/мл | 18# (17; 19) |
25* (22; 26) |
17# (16; 18) |
17# (16; 18) |
17# (16; 17) |
| TGF-β, пг/мл | 4.35# (3.98; 4.59) |
6.13* (5.63; 6.39) |
6.76* (4.32; 7.78) |
3.26# (3.05; 3.3) |
4.93 (3.57; 4.93) |
| LPS, пг/мл | 8.3# (7.9; 10) |
71* (68; 75) |
11.5# (10.7; 12.8) |
50*, # (46; 54) |
8.9# (8.0; 10.5) |
Размер инфаркта и гемодинамические показатели
Непараметрический анализ различий гемодинамических показателей программным пакетом для повторных измерений непрерывного типа (ANOVA) показал, что исходные показатели, данные для 5-й минуты ишемии, а также для 90-й и 120-й минуты реперфузии между группами не различались. В группе SIRS, начиная с 10-й минуты ишемии и до 60-й минуты реперфузии, уровень среднего артериального давления (САД) и частота сердечных сокращений (ЧСС) с начала ишемии и до 90-й минуты реперфузии, были значимо ниже по отношению к контролю (р < 0.05). В группе SIRS + SB в ходе всего наблюдения показатели ЧСС были значимо меньше, чем в группе CTR, а для САД были близкими к контрольным. В группе SIRS + LBS показатели САД были меньше контроля, начиная с 5-й до 40-й минуты реперфузии, при уменьшении ЧСС с 30-й минуты ишемии до 60-й минуты реперфузии, а в группе SIRS + EF САД уменьшилось с 10-й минуты ишемии до 40-й минуты реперфузии (р < 0.05), при ЧСС близкой к контролю (рис. 3а, b).
Рис. 3.
Динамика изменения среднего артериального давления (a) и частоты сердечных сокращений (b) на протяжении ишемии и реперфузии, среднее значение (± SD). CTR – контроль, SIRS – синдром системной воспалительной реакции, SIRS + LBS – ССВО и смесь LA-5 и BB-12, SIRS + SB – ССВО и S. boulardii, SIRS + EF – ССВО и E. faecium L3. Значимость в отдельных точках * – р < 0.05 по отношению к группе CTR указана в тексте.

Медианные значения размера зоны риска от общей площади исследованной части миокарда составили 47% (39; 48), 45% (36; 48), 44% (38; 53), 43% (42; 50), 46% (40; 55) в группах CTR, SIRS, SIRS + LBS, SIRS + SB и SIRS + EF соответственно (р > 0.05), (рис. 2), что показывает равенство методических условий во всех экспериментальных группах. Размер инфаркта в группе CTR составил 42% (41; 46), а в группе SIRS – 55% (53; 59) от зоны риска, что значимо больше на 24%, тогда как в группе SIRS + LBS – 47% (41; 50) значение этого показателя было близким к контролю. В группах SIRS + SB и SIRS + EF размер инфаркта миокарда составил 59% (47; 61) и 58% (50; 59) соответственно, что больше чем в контроле на 40 и 38% (p < 0.05), и практически равно показателю в группе SIRS, это указывает на отсутствие кардиопротекции в этих группах, (рис. 4а, b).
Рис. 4.
Зона риска и зона некроза миокарда, Me (25%; 75%). CTR – контроль, SIRS – синдром системной воспалительной реакции, SIRS + LBS – ССВО и смесь LA-5 и BB-12, SIRS + SB – ССВО и S. boulardii, SIRS + EF – ССВО и E. faecium L3. * – р < 0.05 по отношению к группе CTR.
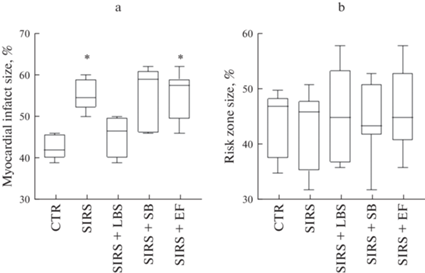
Первичный анализ результатов позволяет заключить, что ССВО значимо увеличивает размер инфаркта на фоне существенного снижения САД и ЧСС, тогда как после пробиотической терапии в группе с введением лакто- и бифидобактерий этот показатель был близок к контролю, что говорит о возможной кардиопротекции в условиях ССВО. Для этой группы SIRS + LBS, после стабильности в период ишемии, показано снижение артериального давления в начале периода реперфузии с сопутствующим падением ЧСС по отношению к CTR, с последующим подъемом, что, видимо, носит компенсаторный характер. Введение других двух пробиотиков не отразилось на размере инфаркта после моделирования ССВО, несмотря на стабильность САД в группе SIRS + SB, и стабильность ЧСС в группе SIRS + EF, что показывает специфические особенности влияния различных пробиотических штаммов на координацию регуляторных механизмов функциональности миокарда. Все три пробиотика нормализовали, в той или иной степени, гематологические, биохимические, иммунологические и функциональные параметры, но только в группе SIRS + LBS помимо стабилизации большинства биохимических и иммунологических показателей, произошло уменьшение размера инфаркта до контрольных значений.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В данной работе были исследованы кардиотропные эффекты трех пробиотических препаратов на модели регионарной ишемии–реперфузии миокарда у крыс с ССВО, включающим первичное висцеральное ожирение, антибиотик-индуцированный дисбиоз и острое воспаление толстого кишечника. Клинические исследования штаммов LA-5 и BB-12 показали благоприятное воздействие на микрофлору кишечника и местный иммунитет у здоровых людей и людей с заболеваниями желудочно-кишечного тракта. Под влиянием BB-12 происходит повышение продукции иммуноглобулина А в слизистой оболочке кишечника, что способствует повышению ее противоинфекционной резистентности [13, 14]. Saccharomyces boulardii проявляет антагонизм к ряду патогенных и условно патогенных микроорганизмов, подавляет их развитие; повышает местную иммунную защиту вследствие увеличения продукции иммуноглобулина А и других иммуноглобулинов, оказывает иммунобиологическое и антидиарейное действие [15]. Пробиотический штамм Enterococcus faecium L3 – непатогенный энтерококк, выделенный из молочной закваски с выраженным антагонизмом к патогенной и условно патогенной флоре с иммуномодулирующими и витаминообразующими свойствами [16, 17]. Максимальное увеличение массы слепой кишки в нашей работе было отмечено в группе SIRS при сравнении с группой CTR, что подтверждает антибиотик-индуцированное нарушение пищеварительной и эвакуаторной функций тонкой кишки [18, 19]. Общая картина изменений состава лейкоцитов, полученная в данном исследовании, в целом характерна для ожоговой травмы и сопровождается снижением числа гранулоцитов при увеличении представительства лимфоцитов и эозинофилов в группе SIRS [20]. В условиях моделирования ССВО на фоне увеличения основных субпопуляций лейкоцитов (LYM и MID) выявлены специфические особенности влияния пробиотических препаратов на изменения состава лейкоцитов. По отношению к группе SIRS интересно существенное снижение количества LYM и MID в группах SIRS + LBS и SIRS + EF, причем самое заметное уменьшение субпопуляции MID отмечено у крыс последней группы, что указывает на специфические особенности действия исследованных пробиотических препаратов.
Известно, что усиление лейкопоэза возникает под влиянием таких провоспалительных цитокинов, как IL-1, IL-6, IL-8, а также под влиянием ряда медиаторов воспаления. Универсальными стимуляторами гранулоцитарно-моноцитарного лейкопоэза являются гормоны адаптации – катехоламины и глюкокортикоиды, реализующие свои эффекты на костный мозг через усиление образования колониестимулирующих факторов и интерлейкинов. К числу стимуляторов лейкопоэза относятся витамин В12, аскорбиновая кислота, фолиевая кислота, железо. Подавление костномозгового кроветворения возможно под влиянием ряда медиаторов воспаления, таких как простагландины, IL-10, IL-13, TNF-α, TGF-β, а также лактоферрин и кислый изоферритин [21]. Однако анализ результатов экспериментального моделирования воспаления в нашем случае усложняется введением во внутреннюю среду организма с локальным химически индуцированным повреждением толстой кишки пробиотических штаммов, обладающих собственным про- и противовоспалительным потенциалом [22]. В нашей работе отмечено увеличение большинства провоспалительных цитокинов в группе c моделированием ССВО и снижение устойчивости миокарда к ИРП, тогда как в группе SIRS + LBS с размером инфаркта, не отличавшимся от контроля, отмечено уменьшение уровня провоспалительных цитокинов во всех исследованных случаях, а в группе SIRS + SB – отсутствие нормализации уровней LPS и IL-8, что может быть косвенно связано с отсутствием эффекта кардиопротекции. Однако нет оснований утверждать, что именно LPS или IL-8 является прямой причиной снижения устойчивости миокарда к ИРП, т.к. в группе SIRS + EF эффект кардиопротекции также не наблюдали при близости показателей этих маркеров к контрольным. Предпосылку к подобным рассуждениям дают сведения о возможной супрессии лейкопоэза под действием TNF-α, TGF-β и др., как контур обратной регуляции при гипервозбуждении в системе воспаления. Можно предположить, что максимальный показатель TGF-β в группе SIRS + LBS объясняет сопряженное уменьшение комплекса медиаторов до близких к нормальным значениям, что способствует регуляции процессов лейкопоэза и гибели лейкоцитов, а также определенной стадийности дифференцировки элементов миелоидного, лимфоидного и мегакариоцитарного рядов с сохранением регуляторных механизмов устойчивости миокарда к ИРП.
Следует отметить, что показатели гемодинамики (АД и ЧСС) в группе SIRS были достоверно ниже параметров, регистрируемых в контроле, тогда как в группах SIRS + LBS и SIRS + EF ЧСС, а в группе SIRS + SB среднее АД за период наблюдения достоверно отличалась в сторону увеличения от группы SIRS.
К настоящему времени в литературе убедительно продемонстрировано, что уровень в крови провоспалительных цитокинов, и в частности TNF-α у пациентов с хронической сердечной недостаточностью ассоциирован с тяжестью клинических проявлений [23]. В связи с задачей исследования по выяснению кардиопротективной роли пробиотических микроорганизмов на фоне ССВО необходимо обратить внимание на изменения размера инфаркта миокарда в связи с концентрацией пула желчных кислот (ЖК) в крови животных. Остается открытым вопрос: являются ли ЖК маркером патологии энтерогепатической циркуляции или непосредственным участником патофизиологической цепочки “макроорганизм–ЖКТ–микробиота–воспаление–миокард”. Первичные ЖК образуются в печени, непосредственно участвуют в пищеварении и метаболизируются ферментами определенных представителей кишечной микробиоты, обладают прямым и косвенным антимикробным действием, выступают в роли эндогенных лигандов к рецепторам некоторых гормонов, регуляторных белков, витамина D3 и др. Вторичные ЖК принимают участие в процессах ожирения, воспаления и канцерогенеза [24]. В патофизиологическом смысле являются интересными сведения о кишечном дисбиозе с воспалительными заболеваниями кишечника в связи с недостаточностью вторичных ЖК, немногими известными продуцентами которых являются представители семейств Lachnospiraceae и Ruminococcaceae, тогда как в процессе деконьюгации и гидролизе первичных ЖК участвуют многие кишечные комменсалы таких обширных родов, как Bacteroides, Clostridium и Enterococcus [25]. В наших предыдущих исследованиях на модели ССВО мы показали прямую корреляционную связь между увеличением площади некроза миокарда изолированного сердца и концентрацией в плазме крови уксусной и пропионовой кислоты, продуцентами которых являются факультативные и облигатные анаэробы, в т.ч. патогенные и условно-патогенные [7]. С другой стороны, продуцентами короткоцепочечных жирных кислот являются представители вышеупомянутых семейств Lachnospiraceae и Ruminococcaceae, что дает повод к неоднозначному и порой противоречивому толкованию роли и значения отдельных представителей микробиоты, часто рассматриваемых однозначными симбионтами [26]. Возвращаясь к результатам данного исследования о сочетанном снижении значений пула ЖК, ряда ключевых провоспалительных маркеров (TNF-α, IL-1, IL-8, MCP-1), нормализации лейкограммы и уменьшения площади некроза в группе SIRS + LBS после моделирования ССВО, можно предположить, что определенные представители кишечной микробиоты и пробиотические штаммы, а также их композиции в состоянии индуцировать как кардиопротективный ответ, так и напротив, снижать устойчивость миокарда к ИРП, что требует дальнейших исследований.
ЗАКЛЮЧЕНИЕ
Экспериментальная модель, включающая в себя первичное висцеральное ожирение, острое воспаление толстого кишечника и антибиотик-индуцированный дисбиоз, разработана для изучения потенциала пробиотических препаратов в отношении изучения возможности модуляции устойчивости миокарда к ишемии–реперфузии в условиях несбалансированного увеличения уровня цитокинов в крови. Данная модель отражает известную клиническую картину ССВО и требует комплексного изучения общих и специфических реакций организма на локальное и системное повреждение. В работе подтверждено, что ССВО сопровождается существенными отклонениями биохимических, гематологических и иммунологических показателей от нормы и приводит к увеличению размера инфаркта, т.е. снижает устойчивость миокарда к ишемическому-реперфузионному повреждению. Показано, что все три использованных пробиотика в разной степени нормализуют возникающие при ССВО отклонения биохимических, гематологических и иммунологических показателей, при этом только смесь LA-5 и BB-12 приближает размер инфаркта к контрольному значению, т.е. обладает кардиопротективным потенциалом в условиях ССВО. Два остальных изученных пробиотика, несмотря на частичную нормализацию биохимических и иммунологических параметров на фоне ССВО, не обладают кардиопротективным действием. Главным выводом данной работы можно считать тот факт, что на экспериментальной модели ССВО различные пробиотические штаммы специфическим образом воздействуют на устойчивость миокарда к ишемическому-реперфузионному повреждению. Полученные результаты могут быть использованы для исследования кардиопротективного потенциала пробиотических препаратов в рамках концепции трансляционной медицины.
Список литературы
Breton E, Fotso Soh J, Booij L (2022) Immunoinflammatory processes: Overlapping mechanisms between obesity and eating disorders? Neurosci Biobehav Rev 138: 104688. https://doi.org/10.1016/j.neubiorev.2022.104688
Wise J (2021) Covid-19: Highest death rates seen in countries with most overweight populations. Br Med J 372: n623. https://doi.org/10.1136/bmj.n623
Bansal M (2020) Cardiovascular disease and COVID-19. Diabetes & Metabol Syndr 14(3): 247–250. https://doi.org/10.1016/j.dsx.2020.03.013
de Leeuw A, Oude Luttikhuis M, Wellen AC, Müller C, Calkhoven CF (2021) Obesity and its impact on COVID-19. J Mol Med (Berlin, Germany) 99(7): 899–915. https://doi.org/10.1007/s00109-021-02072-4
Вахитов ТЯ, Ситкин СИ (2014) Концепция суперорганизма в биологии и медицине. Экспер клин гастроэнтерол 107 (7): 72–85. [Vakhitov TYa, Sitkin SI (2014) The superorganism concept in biology and medicine. Exp Clin Gastroenterol 107 (7): 72–85. (In Russ)].
Megur A, Daliri EB, Baltriukienė D, Burokas A (2022) Prebiotics as a tool for the prevention and treatment of obesity and diabetes: classification and ability to modulate the gut microbiota. Int J Mol Sci 23(11): 6097. https://doi.org/10.3390/ijms23116097
Борщев ЮЮ, Буровенко ИЮ, Карасева АБ, Минасян СМ, Борщев ВЮ, Семенова НЮ, Бо-рщева ОВ, Половинкин ВВ, Родионов ГГ, Суворов АН, Галагудза ММ (2020) Моделирование синдрома системной воспалительной реакции химической индукцией травмы толстого кишечника у крыс. Мед иммунол 22(1): 87–98. [Borschev YuYu, Burovenko IYu, Karaseva AB, Minasyan SM, Borschev VYu, Semenova NYu, Borshcheva OV, Polovinkin VV, Rodionov GG, Suvorov AN, Galagudza MM (2020) Modeling of systemic inflammatory response syndrome by chemical induction of colon injury in rats. Med Immunol (Russia) 22(1): 87–98. (In Russ)]. https://doi.org/10.15789/1563-0625-MOS-1839
Борщев ЮЮ, Минасян СМ, Буровенко ИЮ, Борщев ВЮ, Процак ЕС, Борщева ОВ, Галагудза ММ (2020) Влияние азитромицина на устойчивость миокарда к ишемии–реперфузии в условиях синдрома системной воспалительной реакции на фоне алиментарного ожирения. Бюл экспер биол мед 170 (11): 569–574. [Borshchev YuYu, Minasian SM, Burovenko IYu, Borshchev VYu, Protsak ES, Borshcheva OV, Galagudza MM (2020) The effect of azithromycin on myocardial resistance to ischemia/reperfusion in the setting of systemic inflammatory response syndrome and alimentary obesity. Bull Exp Biol Med 170(11): 569–574. (In Russ)]. https://doi.org/10.47056/0365-9615-2020-170-11-569-574
Борщев ЮЮ, Буровенко ИЮ, Карасева АБ, Минасян СМ, Процак ЕС, Борщев ВЮ, Семенова НЮ, Борщева ОВ, Суворов АН, Галагудза ММ (2021) Влияние качественного состава высокожировой диеты на уровень цитокинов и устойчивость миокарда к ишемии–реперфузии у крыс с синдромом системного воспалительного ответа. Мед иммунол 23(5): 1089–1104. [Borschev YuYu, Burovenko IYu, Karaseva AB, Minasyan SM, Protsak ES, Borschev VYu, Semenova NYu, Borshcheva OV, Suvorov AN, Galagudza MM (2021) Effect of the qualitative composition of a high-fat diet in rats with systemic inflammatory response syndrome upon myocardial resistance to ischemic-reperfusion injury and cytokine levels. Med Immunol (Russia) 23(5): 1089–1104. (In Russ)]. https://doi.org/10.15789/1563-0625-EOT-2166
Borshchev YY, Sinitsa AV, Zakharchenko MM, Borshchev VY, Burovenko IY, Galagudza MM (2019) Effect of antibiotic-induced disbiosis and its correction with probiotics on myocardial tolerance to ischemia-reperfusion injury in SPF rats. Bull Exp Biol Med 166(4): 440–443. https://doi.org/10.1007/s10517-019-04368-5
Sonin D, Papayan G, Pochkaeva E, Chefu S, Minasian S, Kurapeev D, Vaage J, Petrishchev N, Galagudza M (2016) In vivo visualization and ex vivo quantification of experimental myocardial infarction by indocyanine green fluorescence imaging. Biomed Opt Express 8(1): 151–161. https://doi.org/10.1364/BOE.8.000151
Луговик ИА, Макарова МН (2021) Токсикологические исследования. Референтные интервалы массовых коэффициентов внутренних органов на выборке, состоящей из 1000 аутбредных крыс. Лабор животные для научн исследов 1: 3–11. [Lugovik IA, Makarova MN (2021) Toxicological Studies. Reference intervals of mass coefficients of internal organs in a sample of 1000 rats. Labor Animals for Study 1: 3–11. (In Russ)]. https://doi.org/10.29296/2618723X-2021-01-01
Ситкин СИ, Вахитов ТЯ, Демьянова ЕВ (2018) Микробиом, дисбиоз толстой кишки и воспалительные заболевания кишечника: когда функция важнее таксономии. Альманах клин мед 46 (5): 396–425. [Sitkin SI, Vakhitov TY, Demyanova EV (2018) Microbiome, gut dysbiosis and inflammatory bowel disease: That moment when the function is more important than taxonomy. Almanac Clin Med 46(5): 396–425. (In Russ)]. https://doi.org/10.18786/2072-0505-2018-46-5-396-425
Zubadalashvili NG, Makhviladze MA, Diasamidze MT, Abdulashvili NN (2009) The comparative study of Linex and Lacto-G in treatment of adult patients with dysbacteriosis. Georgian Med News 170: 38–42. PMID: 19556637
Ардатская МД, Бельмер СВ, Добрица ВП, Захаренко СМ, Лазебник ЛБ, Минушкин ОН, Орешко ЛС, Ситкин СИ, Ткаченко ЕИ, Суворов АН, Хавкин АИ, Шендеров БА (2015) Дисбиоз (дисбактериоз) кишечника: современное состояние проблемы. Комплексная диагностика и лечебная коррекция. Экспер клин гастроэнтерол 5 (117): 13–50. [Ardatskaya MD, Belmer SV, Dobrica VP, Zakharenko SM, Lazebnik LB, Minushkin ON, Oreshko LS, Sitkin SI, Tkachenko EI, Suvorov AN, Khavkin AI, Shenderov BA (2015) Dysbiosis (dysbacteriosis) of the intestine: current state of the problem. Comprehensive diagnostics and therapeutic correction. Exp Clin Gastroenterol 5 (117): 13–50. (In Russ)].
Суворов АН (2010) Клинические и профилактические возможности использования пробиотиков на основе Enterococcus faecium L3. Санкт–Петербург – Гастро-2010: материалы XII Междунар Славяно-Балт науч конгр СПб. М85. [Suvorov AN (2010) Clinical and prophylactic possibilities of using probiotics based on Enterococcus faecium L3. St. Petersburg – Gastro-2010: Materials of the XII Int Slavic-Baltic Scientific Congr SPb. M85. (In Russ)].
Бондаренко ВМ, Суворов АН (2008) Симбиотические энтерококки и проблемы энтерококковой оппортунистической инфекции. Журн микробиол эпидемиол иммунобиол 3: 14. [Bondarenko VM, Suvorov AN (2008) Symbiotic enterococci and problems of enterococcal opportunistic infection. J Microbiol Epidemiol Immunobiol 3: 14. (In Russ)].
Борщев ЮЮ, Громова ЛВ, Ермоленко ЕИ, Грефнер НМ, Борщева ИЮ, Груздков АА (2012) Реакция пептидгидролаз тонкой и толстой кишки крыс на введение антибиотиков. Рос физиол журн им ИМ Сеченова 98(6): 724–733. [Borshchev YuYu, Gromova LV, Ermolenko EI, Grefner NM, Borshcheva IYu, Gruzdkov AA (2012) Reaktsiya peptidgidrolaz tonkoy i tolstoy kishki krys na vvedeniye antibiotikov. Russ J Physiol 98(6): 724–733. (In Russ)].
Буровенко ИЮ, Борщев ЮЮ, Минасян СМ, Процак ЕС, Шептицкий ВА, Галагудза ММ (2019) Исследование всасывания моносахаридов в изолированной петле тонкой кишки и устойчивости миокарда к ишемии–реперфузии у крыс при введении антимикробных препаратов. Экспер клин гастроэнтерол 3(163): 43–50. [Burovenko IYu, Borshchev YuYu, Minasian SM, Protsak ES, Sheptitskii VA, Galagudza MM (2019) The study of absorption of monosaccharides in the isolated intestine and resistance of the myocardium to ischemia-reperfusion in rats after administration of antimicrobial agents. Exp Clin Gastroenterol (3): 43–50. (In Russ)].
Ажикова АК, Журавлева ГФ (2016) Исследование гематологических показателей крыс в норме и в условиях термического воздействия. Совр пробл науки образов 2: 284. [Azhikova AK, Zhuravleva GF (2016) Research of hematologic indicators of rats is normal and in theconditions of thermal influence. Modern Probl Sci Educat 2: 284. (In Russ)].
Чеснокова НП, Понукалина ЕВ, Полутова НВ, Бизенкова МН, Жевак ТН, Моррисон ВВ (2015) Лекция 1. Лейкоциты крови: общая характеристика, классификация, лейкопоэз и его регуляция. Междунар журн прикладн фундамент исследован 4(2): 280–284. [Chesnokova NP, Ponukalina YEV, Polutova NV, Bizenkova MN, Zhevak TN, Morrison VV (2015) Lection 1. Blood leukocytes: general characteristics, classification, leukopoiesis and its regulation. Int J Appl Found Investig 4(2): 280–284. (In Russ)].
Аверина ОВ, Ермоленко ЕИ, Ратушный АЮ, Тарасова ЕА, Борщев ЮЮ, Леонтьева ГФ, Крамская ТА, Котылева МП, Даниленко ВН, Суворов АН (2015) Влияние пробиотиков на продукцию цитокинов в системах in vitro и in vivo. Мед иммунол 17(5): 443–454. [Averina OV, Ermolenko EI, Ratushniy AYu, Tarasova EA, Borschev YuYu, Leontieva GF, Kramskaya TA, Kotyleva MP, Danilenko VN, Suvorov AN (2015) Influence of probiotics on cytokine production in the in vitro and in vivo systems. Med Immunol (Russia) 17(5): 443–454. (In Russ)]. https://doi.org/10.15789/1563-0625-2015-5-443-454
Bozkurt B, Kribbs SB, Clubb FJ Jr, Michael LH, Didenko VV, Hornsby PJ, Seta Y, Oral H, Spinale FG, Mann DL (1998) Pathophysiologically relevant concentrations of tumor necrosis factor-alpha promote progressive left ventricular dysfunction and remodeling in rats. Circulation 97(14): 1382–1391. https://doi.org/10.1161/01.cir.97.14.1382
Jia W, Xie G, Jia W (2018) Bile acid-microbiota crosstalk in gastrointestinal inflammation and carcinogenesis. Nat Rev Gastroenterol Hepatol 15(2): 111–128. https://doi.org/10.1038/nrgastro.2017.119
Sinha SR, Haileselassie Y, Nguyen LP, Tropini C, Wang M, Becker LS, Sim D, Jarr K, Spear ET, Singh G, Namkoong H, Bittinger K, Fischbach MA, Sonnenburg JL, Habtezion A (2020) Dysbiosis-induced secondary bile acid deficiency promotes intestinal inflammation. Cell Host Microbe 27(4): 659–670. https://doi.org/10.1016/j.chom.2020.01.021
Vacca M, Celano G, Calabrese FM, Portincasa P, Gobbetti M, De Angelis M (2020) The Controversial Role of Human Gut Lachnospiraceae. Microorganisms 8(4): 573. https://doi.org/10.3390/microorganisms8040573
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


