Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 12, стр. 1695-1705
Микроэлектростимуляция латеральной орбитальной коры крысы вызывает специфические реакции систем кровообращения и дыхания
Т. Н. Кокурина 1, Е. А. Губаревич 1, Г. И. Рыбакова 1, Т. С. Туманова 1, 2, В. Г. Александров 1, *
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 Российский государственный педагогический университет им. А.И. Герцена
Санкт-Петербург, Россия
* E-mail: aleksandrovv@infran.ru
Поступила в редакцию 30.09.2022
После доработки 05.11.2022
Принята к публикации 10.11.2022
- EDN: DSZJYM
- DOI: 10.31857/S0869813922120068
Аннотация
К настоящему времени установлено, что области т.н. “автономной” префронтальной коры, расположенные на медиальной и латеральной поверхностях больших полушарий, входят в состав центральной автономной сети и принимают участие в контроле функций дыхания и кровообращения. Результаты морфологических исследований указывают на то, что области коры на орбитальной и фронтальной поверхностях полушария образуют прямые связи с автономной корой и другими структурами центральной автономной сети. Эти данные позволяют предположить участие орбитофронтальной коры в контроле автономных функций. Целью настоящего исследования стала экспериментальная проверка гипотезы о возможном участии латеральной орбитальной области коры в контроле функций дыхания и кровообращения. С этой целью в острых экспериментах на крысах, анестезированных уретаном, были зарегистрированы реакции систем кровообращения и дыхания на локальную микроэлектростимуляцию латеральной орбитальной и медиальной префронтальной (инфралимбической) коры сериями прямоугольных импульсов тока. Эксперименты показали, что стимуляция каждой из указанных областей коры одного и того же экспериментального животного вызывала специфические реакции системы дыхания, которые проявлялись в характерных изменениях объемно-временных параметров внешнего дыхания. Система кровообращения реагировала на стимуляцию исследованных областей коры постепенным снижением артериального давления на фоне продолжающейся стимуляции, причем депрессорные ответы на стимуляцию инфралимбической и латеральной орбитальной коры отличались по амплитуде и временному течению. Таким образом, было установлено, что микроэлектростимуляция латеральной орбитальной коры анестезированной крысы вызывает специфические реакции систем дыхания и кровообращения. Полученные результаты подтвердили гипотезу о возможном участии латеральной орбитальной коры в контроле функций дыхания и кровообращения. Возможно, что латеральная орбитальная кора реализует свое влияние на функции дыхания и кровообращения путем взаимодействия с висцеромоторной инфралимбической корой, однако это предположение требует экспериментальной проверки.
К числу областей коры больших полушарий, участвующих в контроле автономных функций, относят поля префронтальной коры (prefrontal cortex, PFC), расположенные на медиальной, латеральной и, вероятно, орбитофронтальной поверхностях больших полушарий [1, 2]. Предполагается, что эти области коры реализуют свои автономные функции, взаимодействуя с так называемой центральной автономной сетью (central autonomic network, CAN), в которую также входит ряд структур, расположенных на разных уровнях нервной оси, вплоть до продолговатого и спинного мозга [3, 4]. Автономные функции медиальной и латеральной PFC изучены довольно подробно. Установлено, в частности, что медиальная префронтальная, в том числе инфралимбическая кора (infralimbic cortex, IL), участвует в контроле функций кровообращения [5, 6] и дыхания [7, 8]; она нередко рассматривается в качестве эффекторной или висцеромоторной автономной коры. Еще одна область представительства висцеральных систем идентифицирована в пределах латеральной префронтальной или островковой коры (insular cortex, IC) [9]. Что же касается коры орбитофронтальной поверхности (orbitofrontal cortex, OFC), то, в отличие от IL и IC эта область исследуется главным образом в контексте ее участия в реализации когнитивных и эмоциональных процессов [10, 11]. Однако имеются основания к тому, чтобы предполагать наличие в составе OFC одной или нескольких зон, которые способны взаимодействовать с CAN и участвовать в контроле активности автономных систем, в том числе систем дыхания и кровообращения [2]. Это предположение основано, главным образом, на результатах морфологических исследований, которые показали, в частности, что латеральная орбитальная кора (lateral orbital, LO) имеет связи не только с IL и IC [12], но и с другими структурами, входящими в CAN [13]. Еще одним важным критерием, которому должна соответствовать область коры, участвующая в контроле автономных функций, является изменение активности висцеральных систем при электрическом или химическом раздражении этой области коры [2, 14]. В некоторых старых работах содержатся экспериментальные данные о респираторных и циркуляторных эффектах электрической стимуляции больших областей OFC [15, 16], однако эти данные достаточно фрагментарны, и автономные эффекты стимуляции OFC по-прежнему требуют систематического экспериментального исследования. Ранее нами было установлено, что микроэлектростимуляция двух областей OFC вызывает изменения артериального давления анестезированной крысы [17]. Целью настоящего исследования стала дальнейшая экспериментальная проверка гипотезы о возможном участии OFC в контроле функций дыхания и кровообращения. Для этого следовало получить новые данные о влиянии микроэлектростимуляции латеральной орбитальной коры (lateral orbital, LO), которая входит в состав OFC, на параметры внешнего дыхания. Предполагалось сравнить в одних и тех же экспериментах респираторные и циркуляторные эффекты стимуляции LO с эффектами стимуляции IL, участие которой в контроле автономных функций установлено предшествующими исследованиями. Проявление специфических эффектов микроэлектростимуляции LO следовало бы рассматривать как подтверждение указанной гипотезы.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты были проведены на самцах крыс линии Wistar (n = 6) массой тела 250–300 г из ЦКП “Биоколлекция” Института физиологии им. И.П. Павлова РАН. Условия содержания животных, а также процедуры, которым их подвергали при подготовке и проведении экспериментов соответствовали Приказу Минздрава РФ от 01.04.16 г. № 199н “Об утверждении правил надлежащей лабораторной практики” и были апробированы Комиссией по контролю за содержанием и использованием лабораторных животных при Институте физиологии им. И.П. Павлова РАН (заключение Комиссии № 09/14 от 14 сентября 2022 г.).
Крыс вводили в состояние общей анестезии внутрибрюшинной инъекцией раствора уретана (1600 мг/кг); глубину анестезии контролировали, ориентируясь по реакции на неповреждающий болевой стимул (ущемление хвоста) и по выраженности роговичного рефлекса. Температуру тела измеряли и поддерживали на уровне 36.5–37.5°С при помощи термоконтроллера (ML295/R, ADInstruments,Новая Зеландия). Производили трахеостомию, в трахею вводили трахеостомическую трубку; в правой бедренной артерии устанавливали катетер, заполненный гепаринизированным (50 Ед/мл) физиологическим раствором. Животное переводили в прональную позицию, голову закрепляли в стереотаксическом аппарате (SR-6R-HT, Narishige, Япония) и производили локальную краниотомию над областями введения раздражающих электродов.
К трахеостомической трубке присоединяли пневмометрический датчик (MLT10L), подключенный ко входу пневмотахометра (FE141); артериальный катетер соединяли с датчиком давления (MLT1199), сигнал с которого поступал на вход мостового усилителя (FE224). Сигналы пневмотахограммы (pneumotachogram, PTG) и артериального давления (arterial pressure, AP) поступали на вход устройства сбора данных (PL35/8), регистрировались и обрабатывались в режимах on- и off-line при помощи специализированного пакета программ (LabChart 7). Помимо регистрации PTG и AP производили расчет объемно-временных параметров дыхания, которые позволяют объективно характеризовать паттерн дыхания, в том числе дыхательный объем (tidal volume, Vt), общую длительность дыхательного цикла (total respiratory cycle time, Ttot), максимальный воздушный поток на вдохе (maximum inspiratory flow, Vimax) и максимальный воздушный поток на выдохе (maximum expiratory flow, Vemax). Кроме того, в режиме on-line рассчитывали среднее артериальное давление (mean AP, MAP) и частоту сердечных сокращений (heart rate, HR).
Для стимуляции коры использовали монополярные вольфрамовые электроды с диаметром кончика 2–3 мкм, сопротивлением 0.1 МОм; индифферентный электрод погружали в мышцы шеи. Серии прямоугольных импульсов тока отрицательной полярности силой 150–200 мкА, длительностью 1 мс, частотой 50 имп/с подавали на электроды, используя изолированный стимулятор (модель 4100, A-M Systems, США). Продолжительность серий составляла 10 с. Характеристики раздражающих электродов и параметры электрических стимулов, использованных в наших экспериментах, обеспечивали условия для микроэлектростимуляции, то есть стимуляции ограниченного объема нервной ткани. Этот объем был локализован в пределах исследуемых областей коры, поскольку при смещении концов электродов за пределы IL и LO характерные ответы на их раздражение ослабевали и исчезали. Микроэлектростимуляции подвергались точки с координатами: 4.0–4.5 мм глубина от поверхности мозга, +2.5 мм относительно уровня bregma, 0.5 мм латеральнее сагиттальной плоскости (IL); 4.2 мм глубина от поверхности мозга, +3.2 мм относительно bregma; 3.2 мм латеральнее сагиттальной плоскости (LO). Координаты определяли по стереотаксическому атласу мозга крысы.
Эксперимент продолжался 2 ч. Через 20 мин после начала регистрации производили первую стимуляцию IL, еще через 20 мин – первую стимуляцию LO. В дальнейшем эти экспериментальные воздействия чередовали с интервалом 20 мин и, таким образом, в каждом эксперименте по три раза стимулировалась каждая из исследуемых областей коры. В общей сложности в 6 экспериментах было зарегистрировано по 18 ответов на стимуляцию каждой из областей коры.
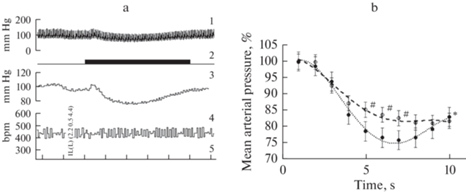
Рис. 1.
Депрессорные эффекты микроэлектростимуляции IL и LO. a – репрезентативный пример эффекта стимуляции IL. 1 – AP, 2 – отметка раздражения, 3 – MAP, 4 – HR, 5 – отметка времени, 2 с. b – изменение MAP, развивающиеся в результате стимуляции LO (светлые маркеры) и IL (темные маркеры). Величина MAP выражена в процентах к величине этого показателя непосредственно перед нанесением стимула. На графиках представлены средние значения величин (n = 18) и стандартные ошибки. Пунктирами обозначены линии трендов, полученные в результате полиноминальной аппроксимации стандартными средствами Excel. # – различия между LO и IL достоверны (при p < 0.05); * – величина MAP на 10-й с стимуляции IL достоверно (при p < 0.05) больше его величины на 7-й с. Достоверность различий оценивали при помощи однофакторного дисперсионного анализа.
При обработке экспериментальных данных определяли средние значения абсолютных величин учитываемых параметров и стандартную ошибку среднего. Для количественного описания эффектов микроэлектростимуляции исследуемых областей коры средствами пакета программ LabChart 7.0 производили посекундное измерение регистрируемых и рассчитываемых параметров до и во время стимуляции. Значения, полученные во всех экспериментах для каждой области коры (n = 18), заносили в таблицы MS Excel и подвергали дальнейшей обработке, выражая величину параметров после начала микроэлектростимуляции коры в процентах к их значениям до начала раздражения. Для каждой секунды рассчитывали среднее арифметическое и стандартную ошибку среднего; эти величины использовали при построении графиков, отражающих изменения учитываемых параметров под влиянием микроэлектростимуляции коры. Достоверность различий между величинами определяли, используя метод однофакторного дисперсионного анализа и U‑критерий Манна–Уитни. Критический уровень значимости при проверке нулевой гипотезы принимался равным 0.05. По завершении эксперимента животное усыпляли передозировкой анестетика и мозг извлекали для последующего гистологического контроля. Точки стимуляции верифицировали по трекам, остававшимся после извлечения электродов.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Величина MAP в начале эксперимента, на 5-й минуте регистрации, составляла в среднем 98 ± 3 мм рт. ст., а HR равнялась 438 ± 4 уд./мин. В дальнейшем фоновые значения обоих показателей не претерпевали достоверных изменений, оставаясь стабильными до конца эксперимента. Непосредственно перед началом стимуляции IL величина MAP составляла в среднем102 ± 3 мм рт. ст., а перед началом стимуляции LO 96 ± 4 мм рт. ст. Стимуляция каждой из этих областей вызывала снижение MAP, которое не сопровождалось заметными изменениями HR (рис. 1a).
Абсолютная величина амплитуды депрессорных ответов, измеренных на 7-й с стимуляции для LO, составляла 18 ± 2 мм рт. ст. а для IL эта величина равнялась 28 ± 1 мм рт. ст.; различия были достоверны при p < 0.01. Были обнаружены определенные отличия в динамике развития депрессорных ответов (рис. 1b). Они заключались в том, что на фоне стимуляции LO происходило постепенное снижение MAP до минимальных значений, которые сохранялись до окончания действия стимула. Напротив, депрессорный эффект стимуляции IL постепенно ослабевал на фоне действующего стимула
Специфические перестройки паттерна дыхания наблюдались в ответ на стимуляцию как LO (рис. 2a, 1), так и IL (рис. 2b, 1). Раздражение LO приводило к уменьшению Vt (рис. 2a, 3) и Ttot (рис. 2a, 4 ), а также увеличению Vimax (рис. 2a, 5 ), при том, что каких-либо определенных изменений Vemax наблюдать не удавалось (рис. 2a, 6 ). Стимуляция IL также уменьшала Vt (рис. 2b, 3) и Ttot (рис. 2b, 4 ), увеличивала Vimax (рис. 2a, 5 ), но, в отличие от LO, увеличивала также и Vemax (рис. 2b, 6 ).
Рис. 2.
Реакции системы внешнего дыхания анестезированной крысы на микроэлектростимуляцию LO (a) и IL (b). 1 – PTG; 2 – отметка раздражения; 3, 4, 5, 6 – соответственно Vt, Ttot, Vimax, Vemax; 7 – отметка времени, 2 с.

Рис. 3.
Изменение объемно-временных параметров дыхания под влиянием стимуляции LO (темные кружки) и IL (светлые кружки). а, b, c и d – соответственно Vt, Ttot, Vimax и Vemax. Все величины выражены в процентах к их значениям непосредственно перед нанесением стимула. На графиках представлены средние значения величин (n = 18) и стандартные ошибки. Пунктирами обозначены линии трендов, полученные в результате полиноминальной аппроксимации стандартными средствами Excel.
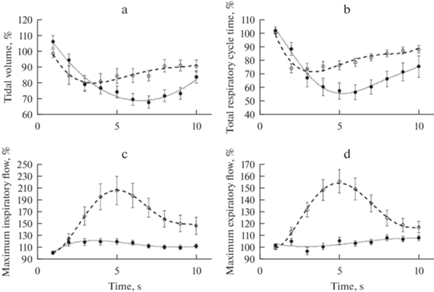
Количественный анализ объемно-временных параметров дыхания подтвердил эти наблюдения и позволил обнаружить некоторые характерные особенности в динамике этих параметров на фоне стимуляции каждой из исследованных областей (рис. 3). Под влиянием стимуляции LO величина Vt снижалась до минимальных значений, которые составляли 80 ± 5% от исходной величины уже на 3-й с раздражения (рис. 3a). В дальнейшем Vt увеличивался, “ускользая” из-под действия стимула и, начиная с 7-й с, стабилизировался на уровне 90% от исходного. На фоне стимуляции IL снижение Vt происходило значительно дольше; этот показатель достигал минимальной величины, которая составляла около 70 ± 4% от исходных значений, на 6-й с. После достижения минимума этот показатель начинал постепенно расти, достигая 84 ± 7% от исходной величины на последней секунде стимуляции. Сходным образом изменялась длительность дыхательного цикла (рис. 3b). В течение первых 2-х с стимуляции LO этот параметр уменьшался до 74 ± 3%, затем Ttot постепенно увеличивалась, достигая 90% от исходной величины к концу стимуляции. На фоне стимуляции IL длительность дыхательного цикла снижалась в течение 5 с до 57 ± 5% от исходной величины. Электростимуляция LO приводила к быстрому росту максимальных потоков на вдохе, которые в течение первых двух секунд стимуляции увеличивались на 20 ± 6% от исходной величины, оставались на достигнутом уровне в течение 3-х последующих секунд, а затем постепенно снижались, не достигая исходной величины (рис. 3c). Изменения максимальных потоков на выдохе оказались статистически недостоверными (рис. 3d). В отличие от LO, стимуляция IL увеличивала максимальные потоки как на вдохе (рис. 3с), так и на выдохе (рис. 3d). Оба параметра росли в течение первых 5 с стимуляции, а затем также ускользали из-под действия раздражителя (рис. 3c, d). Таким образом, эксперименты показали, что микроэлектростимуляция LO анестезированной крысы приводит к кратковременному падению MAP, такой же эффект вызывала стимуляция IL. Стимуляция LO вызывала стабильно воспроизводящуюся перестройку паттерна дыхания, которая имела характерные отличия от изменений, вызванных раздражением IL.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Депрессорный эффект стимуляции IL, который воспроизводился в наших экспериментах, наблюдался ранее и другими авторами. Так, в экспериментах на лабораторных крысах, анестезированных галотаном, монополярное раздражение медиальной префронтальной коры отрицательными импульсами тока приводило к падению MAP в среднем на 15 ± 5 мм рт. ст. [19], что весьма близко к величине ответов, зарегистрированных в настоящей работе. Сходные результаты были получены и в более поздних исследованиях [20, 21]. В некоторых экспериментах депрессорные ответы сопровождались небольшим снижением HR [22], однако мы подобного эффекта не наблюдали. В целом реакция системы кровообращения на стимуляцию IL, которая воспроизводилась в наших экспериментах, напоминала ту, которая наблюдалась другими авторами, что свидетельствует, в том числе, и об адекватности условий наших экспериментов. Механизмы, реализующие депрессорный эффект стимуляции IL достаточно хорошо изучены. Известно, в частности, что стимуляция приводит к торможению симпатовозбуждающих нейронов, расположенных в пределах ростральной части вентролатеральной области продолговатого мозга и ослаблению симпатического драйва [19, 21]. Установлено, что влияние медиальной префронтальной коры на пресимпатические нейроны продолговатого мозга опосредуется нейронами латерального гипоталамуса (lateral hypothalamus, LH) и, возможно, центрального серого вещества (periaqueductal gray, PAG) [23]. Кроме того, есть данные о том, что в этот процесс вовлечены нейроны ядра одиночного тракта, принимающего афферентные потоки от барорецепторов, инициирующих барорефлекс [24]. Возможно, что отсутствие изменений HR, связанных с депрессорными ответами на стимуляцию IL, можно объяснить снижением барорефлекторной чувствительности, поскольку известно, что медиальная префронтальная кора способна модулировать активность парасимпатического плеча барорефлекса [25].
Депрессорные ответы на стимуляцию OFC были впервые описаны нами в предшествующей работе [17]. Было установлено, в частности, что преобладающей реакцией на микроэлектростимуляцию передних отделов LO (на уровне +2.5 мм относительно уровня bregma) были также депрессорные ответы, но несколько меньшей амплитуды, чем те, которые описаны в настоящем исследовании. Этот результат может быть связан с тем обстоятельством, что задние отделы LO, которые подвергались стимуляции в настоящей работе, образуют более плотные связи со стволовыми автономными центрами [13]. Поскольку нисходящие проекции из OFC и, в частности, из LO, достигают уровня LH и PAG, можно предположить, что механизмы реализации депрессорных эффектов стимуляции LO близки к тем, которые установлены для IL. Вместе с тем следует учитывать, что LO не образует прямых проекций к структурам продолговатого мозга и, следовательно, в отличие от IL не может оказывать прямого воздействия на рефлекторные механизмы кардиореспираторного контроля. Кроме того, в настоящей работе впервые описана динамика АД анестезированной крысы на фоне продолжающейся стимуляции OFC и было установлено, что депрессорные ответы на стимуляцию LO и IL отличаются не только по амплитуде (ответы на стимуляцию IL достоверно больше), но и по временному течению. Поэтому пути реализации депрессорного эффекта стимуляции LO, по-видимому, имеют определенные особенности по сравнению с IL и требуют дополнительного экспериментального исследования. Учитывая наличие прямых связей между LO и IL, а также общеизвестную висцеромоторную функцию IL, можно предположить, что IL принимает участие в реализации депрессорных ответов на стимуляцию LO.
Система внешнего дыхания анестезированной крысы реагировала на микроэлектростимуляцию каждой из исследованных областей коры специфическими изменениями паттерна дыхания. Стимуляция IL приводила к увеличению Vimax, Vemax, а также к уменьшению Vt и Ttot, причем наблюдалось постепенное “ускользание” системы дыхания из-под действия раздражителя. Подобная реакция на раздражение IL уже была описана нами в одной из предшествующих работ [7]. Реакция респираторной системы анестезированной крысы на стимуляцию LO впервые описана в настоящей работе, и она имеет вполне определенные черты как сходства, так и отличия по сравнению с реакцией на стимуляцию IL. Прежде всего, на фоне стимуляции LO не меняется Vemax, а изменения остальных параметров в процентном отношении менее значительны. Кроме того, динамика изменений учитываемых параметров при раздражении IL и LO различна, поскольку Vт и Ttot снижаются до минимальных значений, а Vemax достигает максимальных величин быстрее на фоне стимуляции LO, чем на фоне стимуляции IL.
Как известно, объемно-временные параметры дыхания определяются сложной сетью респираторных нейронов, расположенных на уровне продолговатого мозга и моста [26]. Однако паттерн дыхания может модулироваться структурами, расположенными на более высоких уровнях CAN, в том числе структурами переднего мозга и различными областями коры [27]. Специальные эксперименты с введением ретроградного маркера в PAG, а также в ядра, образующие бульбо-понтинный генератор паттерна дыхания, в том числе в мостовое субпарабрахиальное ядро Келликера–Фузе (KFn), в комплексы пре-Бетцингера и Бетцингера образующие вентральную респираторную группу, показали, что IL образует связи с большинством из перечисленных структур, причем наибольшей плотностью обладают связи с PAG и KFn [27]. Подобные связи образовывали и многие другие области коры, в том числе IC, моторная и соматосенсорная кора. Однако в OFC, в том числе в LO, меченые нейроны отсутствовали и, следовательно, LO не образует прямых связей с бульбопонтинным генератором паттерна дыхания. Вместе с тем, по другим данным, LO образует выраженные проекции к PAG [13, 28], которое принимает участие в модуляции дыхания при вокализации и оборонительном поведении [29, 30 ] .
Таким образом, полученные результаты показали, что микроэлектростимуляция LO вызывает специфические кардиореспираторные реакции и подтвердили предположение о возможном участии этой области OFC в контроле функций дыхания и кровообращения. Можно полагать, что LO реализует свое влияние на эти функции, взаимодействуя со структурами CAN на кортикальном и стволовом уровне. Один из наиболее вероятных вариантов такого взаимодействия может обеспечиваться известными прямыми связями между LO и висцеромоторной IL, однако это предположение требует прямой экспериментальной проверки.
Список литературы
Smith R, Thayer JF, Khalsa SS, Lane RD (2017) The hierarchical basis of neurovisceral integration. Neurosci Biobehav Rev 75: 274–296. https://doi.org/10.1016/j.neubiorev.2017.02.003
Aleksandrov VG, Kokurina TN, Rybakova GI, Tumanova TS (2021) Autonomic functions of the prefrontal cortex. Human Physiol 47(5): 571–578. https://doi.org/10.1134/S0362119721050029
Benarroch EE (1993) The central autonomic network: functional organization, dysfunction, and perspective. Mayo Clinic Proc 68(10): 988–1001. https://doi.org/10.1016/s0025-6196(12)62272-1
Lamotte G, Shouma K, Benarroch EE (2021) Stress and central autonomic network. Auton Neurosci 235: 102870. https://doi.org/10.1016/j.autneu.2021.102870
Sévoz-Couche C, Comet MA, Bernard JF, Hamon M, Laguzzi R (2006) Cardiac baroreflex facilitation evoked by hypothalamus and prefrontal cortex stimulation: role of the nucleus tractus solitarius 5-HT2A receptors. Am J Physiol Regul Integr Comp Physiol 291(4): R1007–R1015. https://doi.org/10.1152/ajpregu.00052.2006
Hassan SF, Cornish JL, Goodchild AK (2013) Respiratory, metabolic and cardiac functions are altered by disinhibition of subregions of the medial prefrontal cortex. J Physiol 591(23): 6069–6088. https://doi.org/10.1113/jphysiol.2013.262071
Alexandrov VG. Ivanova TG, Alexandrova NP (2007) Prefrontal control of respiration. J Physiol Pharmacol 58 Suppl 5(Pt 1): 17–23.
Aleksandrov VG, Mercuriev VA, Ivanova TG, Tarasievich AA, Aleksandrova NP (2009) Cortical control of Hering-Breuer reflexes in anesthetized rats. Eur J Med Res (Suppl 4): 1–5. https://doi.org/10.1186/2047-783x-14-s4-1
Aleksandrov VG, Aleksandrova NP (2015) The role of the insular cortex in the control of visceral functions. Human Physiol 41(5): 553–561. https://doi.org/10.1134/S0362119715050023
Rempel-Clower NL (2007) Role of orbitofrontal cortex connections in emotion. Ann N Y Acad Sci 1121: 72–86. https://doi.org/10.1196/annals.1401.026
Izquierdo A (2017) Functional heterogeneity within rat orbitofrontal cortex in reward learning and decision making. J Neurosci 37(44): 10529–10540. https://doi.org/10.1523/JNEUROSCI.1678-17.2017
Barreiros IV, Ishii H, Walton ME, Panayi MC (2021) Defining an orbitofrontal compass: Functional and anatomical heterogeneity across anterior-posterior and medial-lateral axes. Behav Neurosci 135(2): 165–173. https://doi.org/10.1037/bne0000442
Babalian A, Eichenberger S, Bilella A, Girard F, Szabolcsi V, Roccaro D, Alvarez-Bolado G, Xu C, Celio MR (2019) The orbitofrontal cortex projects to the parvafox nucleus of the ventrolateral hypothalamus and to its targets in the ventromedial periaqueductal grey matter. Brain Struct Funct 224(1): 293–314. https://doi.org/10.1007/s00429-018-1771-5
Cechetto DF, Saper CB (1990) Role of the cerebral cortex in autonomic function. Central Regulation of Autonomic Functions. New York.Oxford Univer Press.
Kaada BR (1951) Somato-motor, autonomic and electrocorticographic responses to electrical stimulation of rhinencephalic and other structures in primates, cat, and dog; a study of responses from the limbic, subcallosal, orbito-insular, piriform and temporal cortex, hippocampus-fornix and amygdala. Acta Physiol Scand Suppl 24(83): 1–262.
Neafsey EJ (1990) Prefrontal cortical control of the autonomic nervous system: anatomical and physiological observations. Prog Brain Res 85: 147–165. https://doi.org/10.1016/s0079-6123(08)62679-5
Александров ВГ, Губаревич ЕА, Туманова ТС, Кокурина ТН, Маркова АЮ, Рыбакова ГИ (2021) Влияние электростимуляции орбитофронтальной коры на систему кровообращения анестезированной крысы. Интеграт физиол 2(3): 297–306. [Aleksandrov VG, Gubarevich EA, Tumanova TS, Кokurina TN, Markova AYu, Rybakova GI (2021) The effect of electrical stimulation of the orbitofrontal cortex on the circulatory system of an anesthetized rat. Integrat Physiol 2(3): 297–306. (In Russ)]. https://doi.org/10.1016/s0079-6123(08)62679-5.
Paxinos G, Watson C (1998) The rat brain in stereotaxic coordinates. Fourth edition. G Paxinos, C Watson (eds) Acad Press.
Verberne AJ (1996) Medullary sympathoexcitatory neurons are inhibited by activation of the medial prefrontal cortex in the rat. Am J Physiol 270(4 Pt 2): R71371–71379. https://doi.org/10.1152/ajpregu.1996.270.4.R713
Owens NC, Verberne AJ (2000) Medial prefrontal depressor response: involvement of the rostral and caudal ventrolateral medulla in the rat. J Auton Nerv Syst 78(2–3): 86–93. https://doi.org/10.1016/s0165-1838(99)00062-4
Resstel LB, Corrêa FM (2006) Involvement of the medial prefrontal cortex in central cardiovascular modulation in the rat. Auton Neurosci (126–127): 130–138. https://doi.org/10.1016/j.autneu.20.06.02.022
Sévoz-Couche C, Comet MA, Bernard JF, Hamon M, Laguzzi R (2006) Cardiac baroreflex facilitation evoked by hypothalamus and prefrontal cortex stimulation: role of the nucleus tractus solitarius 5-HT2A receptors. Am J Physiol Regul Integr Comp Physiol 291(4): R1007–R1015. https://doi.org/10.1152/ajpregu.00052.2006
Fisk GD, Wyss JM (1997) Pressor and depressor sites are intermingled in the cingulate cortex of the rat. Brain Res 754(1–2): 204–212. https://doi.org/10.1016/s0006-8993(97)00076-0
Owens NC, Sartor DM, Verberne A. (1999) Medial prefrontal cortex depressor response: role of the solitary tract nucleus in the rat. Neuroscience 89(4): 1331–1346. https://doi.org/10.1016/s0306-4522(98)00389-3
Resstel LB, Fernandes KB, Corrêa FM (2004) Medial prefrontal cortex modulation of the baroreflex parasympathetic component in the rat. Brain Res 1015(1–2): 13–144. https://doi.org/10.1016/j.brainres.2004.04.065
Rybak IA, Shevtsova NA, Paton JF, Dick TE, St-John WM, Mörschel M, Dutschmann M (2004) Modeling the ponto-medullary respiratory network. Respir Physiol Neurobiol 143(2–3): 307–319. https://doi.org/10.1016/j.resp.2004.03.020
Trevizan-Baú P, Dhingra RR, Furuya WI, Stanić D, Mazzone SB, Dutschmann M (2021) Forebrain projection neurons target functionally diverse respiratory control areas in the midbrain, pons, and medulla oblongata. J Comp Neurol 529(9): 2243–2264. https://doi.org/10.1002/cne.25091
Bilella A, Alvarez-Bolado G, Celio MR (2016) The Foxb1-expressing neurons of the ventrolateral hypothalamic parvafox nucleus project to defensive circuits. J Comp Neurol 524(15): 2955–2981. https://doi.org/10.1002/cne.24057
Subramanian HH, Balnave RJ, Holstege G (2008) The midbrain periaqueductal gray control of respiration. J Neurosci 28(47): 12274–12283. https://doi.org/10.1002/cne.24057
Faull OK, Subramanian HH, EzraM, PattinsonKT (2019) The midbrain periaqueductal gray as an integrative and interoceptive neural structure for breathing. Neurosci Biobehav Rev 98: 135–144. https://doi.org/10.1016/j.neubiorev.2018.12.020
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


