Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 12, стр. 1706-1724
Сократительная функция капсулы брыжеечных лимфатических узлов быка на ранней стадии воспаления
Г. И. Лобов *
ФГБУН Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: lobovgi@infran.ru
Поступила в редакцию 27.09.2022
После доработки 27.10.2022
Принята к публикации 01.11.2022
- EDN: RATFSZ
- DOI: 10.31857/S0869813922120093
Аннотация
Воспаление выявляется не только при инфекциях или травмах, но и при многих других патологических процессах, связанных с нарушением функции тканей, таких, как сахарный диабет 2-го типа, атеросклероз, инфаркт миокарда и др. В процессы развития и разрешения воспаления во всех случаях вовлекается лимфатическая система, и в частности лимфатические узлы (ЛУ), в которые поступают продукты деградации тканей, фрагменты бактерий, антигенпрезентирующие клетки и различные цитокины из очага воспаления. Целью работы было исследование механизмов ингибирования сократительной функции капсулы брыжеечных ЛУ быка, способствующих ремоделированию ЛУ на ранней стадии воспаления. Изолированные полоски капсулы ЛУ, обработанные липополихасаридом (LPS), исследовали в миографе. Полученные данные показывают, что при воздействии LPS растяжимость капсулы ЛУ возрастает вследствие ингибирования сократительной функции гладкомышечных клеток, входящих в состав капсулы. Установлено, что действие LPS приводит к экспрессии в клетках капсулы ЛУ индуцибельной NO-синтазы, циклооксигеназы 2 и цистатионин-γ-лиазы. Продуцируемые этими ферментами NO, простагландины и H2S не только угнетают фазную сократительную функцию гладкомышечных клеток капсулы, но и приводят к существенному снижению тонуса. Продуцируемый в значительном количестве NO активирует сигнальный путь NO → sGC → cGMP → PKG → KATP –каналы гладкомышечных клеток, кроме этого он оказывает непосредственное влияние и на другие регуляторные механизмы. Впервые показано, что H2S, синтезированный цистатионин-γ-лиазой в капсуле ЛУ, обработанной LPS, не только оказывает непосредственный релаксирующий эффект, но и усиливает NO-опосредованную релаксацию гладкомышечных клеток капсулы. Таким образом, результаты данного исследования предоставляют доказательства, что уже на ранней стадии LPS-индуцируемого воспаления в капсуле брыжеечных ЛУ быка происходят изменения, направленные на создание условий для увеличения размеров ЛУ и накопления иммунных клеток.
У млекопитающих наряду с кровеносной системой, доставляющей в ткани кислород и питательные вещества, а также обеспечивающей быстрое удаление из тканей метаболитов, имеется и вторая транспортная система – лимфатическая, представленная лимфатическими сосудами и лимфатическими узлами (ЛУ), встроенными в сеть лимфатических сосудов [1, 2]. Лимфатическая сосудистая сеть представляет собой открытую систему однонаправленного транспорта жидкости (из тканей в кровь), функционирующую под низким переменным давлением. В лимфатической системе нет централизованного насоса, транспорт лимфы осуществляется лимфатическими сосудами, имеющими в составе стенки гладкомышечные клетки и клапаны, разделяющие лимфатические сосуды на отдельные лимфангионы [3, 4]. Лимфатические сосуды транспортируют лимфу и таким образом выполняют несколько важных функций: (1) поддерживают гомеостаз интерстициальной жидкости, (2) обеспечивают транспорт хиломикронов, образующихся в процессе абсорбции пищевых жиров, (3) переносят крупномолекулярные гормоны, продуцируемые нейроэндокринными клетками и (4) доставляют иммунные клетки и антигены из периферических тканей в лимфатические узлы (ЛУ) и [1, 2]. Лимфа содержит множество антигенов, при этом максимальная концентрация антигенов выявляется в кишечной лимфе (антигены из состава пищи, антигены комменсальной флоры и аутоантигены) [5]. Хотя лимфатические сосуды не относятся к иммунной системе, они являются важнейшими участниками иммунного процесса [6]. Лимфатические сосуды модулируют иммунные реакции, транспортируя бактерии, чужеродные антигены, твердые частицы, экзосомы и иммунные клетки в регионарные ЛУ [7].
ЛУ являются обязательными элементами лимфатической системы млекопитающих, у человека их число варьирует от 500 до 800. ЛУ расположены в лимфатической сосудистой сети в стратегически важных участках, и весь объем образующейся в организме лимфы проходит через один, а чаще – через несколько ЛУ [8]. В ЛУ, выполняющих функции биологических фильтров, происходит встреча антигенпрезентирующих клеток и лимфоцитов, в их фолликулах осуществляется клональная экспансия антигенспецифических Т- и В-лимфоцитов [9]. Основными резидентными клетками ЛУ являются стромальные (фибробластные ретикулярные клетки, FRC) и лимфатические эндотелиальные клетки (LEC). В ЛУ человека идентифицировано шесть типов FRC, они формируют кондуитную систему ЛУ и продуцируют различные хемокины, градиенты которых обеспечивают передвижение иммунных клеток и их упорядоченное расположение в ЛУ. В ЛУ также идентифицировано до шести типов LEC, выполняющих различные функции. Основная функция LEC, расположенных на полу и потолке субкапсулярного синуса – регуляция проникновения дендритных клеток и антигенов в кору ЛУ. LEC паракортикального синуса создают градиент сфингозин-1-фосфата (S1P) и таким образом регулируют выход T-лимфоцитов из ЛУ [10]. Лимфоциты являются транзитными клетками в ЛУ, они поступают в ЛУ двумя путями: 1) из крови через стенку венул с высоким эндотелием (HEV), 2) с афферентной лимфой из дренируемого органа и выходят из ЛУ по эфферентным лимфатическим сосудам.
Установлено, что приток в ЛУ чужеродных антигенов (растворимых или поглощенных дендритными клетками) вызывает быстрое увеличение проникновения в ЛУ лимфоцитов, активации и пролиферации FRC и LEC, что приводит к ремоделированию ЛУ и увеличению его размеров [11]. ЛУ обладают уникальной особенностью значительно изменять размеры при воспалении. Их объем может увеличиваться за несколько дней в 10–20 раз по сравнению с размером в физиологическом состоянии, при этом увеличение размеров сопровождается пролиферативным расширением и ремоделированием сосудисто-стромального компартмента ЛУ с сохранением его основополагающей структуры [12].
С внешней стороны ЛУ покрыты капсулой. Основой капсулы и отходящих от нее трабекул являются соединительнотканные элементы – коллаген и эластин [13]. Капсула и трабекулы выполняют в ЛУ функцию соединительнотканного каркаса, поддерживающего форму и размеры ЛУ, и являются наиболее жесткими элементами ЛУ [14, 15]. В капсуле ЛУ различных видов животных и человека помимо коллагена и эластина представлены также и активные элементы – гладкомышечные клетки, расположенные пучками, ориентированными в разных направлениях [16]. Показано, что максимальное количество гладкомышечных клеток находится на выпуклой стороне ЛУ, противоположной по отношению к воротам, а в области ворот плотность миоцитов минимальна [17]. Установлено, что гладкомышечные клетки капсулы ЛУ синхронно сокращаются и развивают значительную силу, достаточную для повышения давления в ЛУ и продвижения лимфы по синусам и кондуитам ЛУ [18, 19]. Таким образом, ЛУ, выполняя в организме сложные иммунные функции, вместе с тем наряду с лимфатическими сосудами, являются и активными насосами в лимфатической системе. “При сокращении мышечных элементов ЛУ лимфа выжимается из него, как из губки…” [20].
В последнее десятилетие функции различных клеток ЛУ интенсивно изучались как in vivo и in vitro, так и посредством моделирования [5, 21]. Ежегодно в Pubmed индексируются от 1000 до 1500 работ с описанием иммунных реакций в ЛУ. При этом на фоне значительного объема информации о роли FRC и LEC в процессе воспалительного увеличения размеров ЛУ, практически нет данных об участии в процессе ремоделирования клеток капсулы ЛУ. С учетом важности процессов ремоделирования и гипертрофии ЛУ при воспалении целью данной работы было исследование механических свойств капсулы ЛУ и функционального состояния гладкомышечных клеток капсулы при моделировании воспаления ex vivo.
МЕТОДЫ ИССЛЕДОВАНИЯ
Все процедуры, выполненные в данном исследовании, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям этической комиссии Института физиологии им. И.П. Павлова РАН (Протокол № 17/6 от 11.04.2022 г.). Материал для исследования получали в цехе забоя животных племенного завода “Приневское”. Брыжеечные ЛУ второго порядка забирали у молодых быков (Bos Taurus, возраст – 18–20 мес., n = 19) через 10–12 мин после обескровливания животных и доставляли в лабораторию в охлажденном (2–4°С) физиологическом солевом растворе (PSS). Состав раствора: N-aCl – 120.4; KCl – 5.9; CaCl2 – 2.5; MgCl2 – 1.2; NaH2PO4 – 1.2; NaHCO3 – 15.5; глюкоза – 11.5 мМ (все вещества х. ч., производства Химпром, РФ) + 10 г/л бычьего сывороточного альбумина (Sigma-Aldrich). В лаборатории из каждого ЛУ вырезали 2–3 полоски капсулы (рис. 1а). При определении локализации и направления полосок капсулы ЛУ мы исходили из литературных данных, свидетельствующих, что максимальное количество гладкомышечных клеток располагается в капсуле ЛУ на стороне, противоположной воротам [22]. Полоски капсулы шириной 2 мм тщательно очищали от прилежащей соединительной ткани и перикапсулярного жира. В состав полоски входили капсула, содержащая гладкомышечные клетки, фибробласты и некоторое количество макрофагов, и субкапсулярный синус, основную массу которого составляли эндотелиальные клетки ЛУ. Подготовленные полоски до исследования хранили в PSS в холодильнике на льду. Перед опытом полоски капсулы ЛУ в случайном порядке были разделены на две группы. Все полоски инкубировали (CO2-инкубатор CO48300001, Eppendorf, Германия) на протяжении 6 ч в среде F-10 Ham (“ДИА-М”, Россия) с добавлением бензилпенициллина (100 ЕД/мл) и стрептомицина (10 мг/мл) при 38°C. Всего было изучено 52 полоски капсулы ЛУ: 22 из них инкубировали в среде F-10 Ham (контрольная группа) и 30 – в F-10 Ham + липополисахарид (LPS Escherichia coli 0111:B4) [23]. 7 полосок из второй группы инкубировали в среде с LPS + циклогексимид.
Рис. 1.
Сократительная активность капсулы брыжеечных ЛУ быка, инкубированных в среде F-10 Ham и в среде F-10 Ham + LPS: (a) – схема ЛУ и расположение в ЛУ полоски капсулы, используемой в эксперименте, (b) – сила, развиваемая капсулой, инкубированной в среде F-10 Ham, (c) – сила, развиваемая капсулой, инкубированной в среде F-10 Ham + LPS. Кривые в левой части рисунка отражают сократительную функцию капсулы ЛУ при увеличении длины на 0.5 мм, в средней части – то же при увеличении длины на 1.0 мм, в правой части – то же при увеличении длины на 2.0 мм.

По завершении инкубации препараты дважды промывали PSS и к концам полосок прикрепляли шелковые лигатуры таким образом, чтобы расстояние между ними составляло 5 мм. Размеры полосок определяли под микроскопом МССО с измерительным окуляром (ЛОМО, РФ). Подготовленные полоски размещали в термостатируемой камере миографа, через которую непрерывно со скоростью 2 мл/мин протекал PSS, аэрированный газовой смесью, состоящей из 95% О2 и 5% СО2. Температуру раствора поддерживали на уровне 38 ± 0.1°С, рН 7.40 ± 0.02. Одну лигатуру прикрепляли к датчику силы FORT-10 (WPI, США), а вторую – к микроманипулятору с микрометром, позволяющему изменять и измерять длину полоски. Сигнал от датчика поступал на вход усилителя INA333 (Texas Instruments Incorporated), далее – в сигма-дельта АЦП, встроенный в микроконтроллер STM32F373 (S-TMicroelectronics). Затем поток данных с частотой 50 Гц поступал на USB-порт компьютера и обрабатывался программой регистрации, разработанной Институтом экспериментальной медицины и написанной на языке (С++), обеспечивавшей непрерывную запись информации с датчика на протяжении всего эксперимента.
В первой серии опытов исследовали механические свойства полосок капсулы ЛУ. После уравновешивания полосок капсулы в ненагруженном состоянии на протяжении 40 мин их подвергали процедуре растяжения-активации. Длину полосок пошагово увеличивали (с шагом 500 мкм), по завершении релаксации и установления стабильного уровня силы полоски активировали посредством замены в камере миографа PSS на активирующий раствор (AS), в котором весь Na+ был заменен на К+ + 20 мкМ норадреналина. АS действовали до развития полосками максимальной силы. После этого из камеры миографа удаляли АS и заменяли его на проточный PSS до установления постоянного натяжения полосок. Затем вновь увеличивали длину полоски капсулы. Поэтапное увеличение длины полосок капсулы осуществляли до развития ими максимальной активной силы и последующего ее снижения до ~60% от максимальной [19]. После каждого шага увеличения длины измеряли пассивную силу и рассчитывали пассивное натяжение посредством деления зарегистрированной силы (в Н) на длину полоски (в м), а после активации полоски – общую силу и рассчитывали общее натяжение (при тоническом сокращении). Активное натяжение определяли посредством вычитания из общего натяжения полоски величины ее пассивного натяжения. С целью сравнения натяжений среди полосок капсулы ЛУ разного диаметра, длину полосок (L) нормализовали к оптимальной длине (Lo), при которой полоски капсулы генерировали максимальное активное натяжение. Соответственно, длину полосок на графиках выражали как отношение реальной длины к Lo (L/Lo).
Во второй серии опытов полоски подвергали исходному натяжению в 2.2 N/m. При таком исходном натяжении после 30-минутной стабилизации натяжение полосок капсулы ЛУ контрольной группы устанавливалось на уровне, соответствующем трансмуральному давлению в ЛУ около 4 см водн. ст. [19]. В опытах по исследованию механизмов ингибирующего действия LPS на сократительную функцию капсулы ЛУ полоски обрабатывали на протяжении 20 мин ингибиторами ферментов, продуцирующих NO, простагландины и H2S с последующим измерением величины сокращений при действии AS. В настоящей работе использовали следующие реактивы (все приобретены в Sigma-Aldrich): циклогексимид (Cycloheximide), 10 мкМ; норадреналин (Norepinephrine bitartrate), 20 мкМ; папаверин (Papaverine hydrochloride), 10 мкМ; 1400W (N-([3-(Aminomethyl)phenyl] methyl)ethanimidamide dihydrochloride), 20 мкМ; DL-пропаргилглицин (DL-Propargylglycine, PPG), 10 мкМ; целекоксиб (Celecoxib), 10 мкМ; 1H-[1, 2, 4]Oxadiazolo[4,3-a]quinoxalin-1-one (ODQ), 10 мкМ; Rp-8-bromo-cGMPS, 30 мкМ; глибенкламид (Glibenclamide), 10 мкМ; липополисахарид (LPS Escherichia coli O55:B5), 100 нг/мл. При инкубировании полосок капсулы ЛУ применяли антибиотики: бензилпенициллина натриевая соль производства “Красфарма”, Россия, 100 ЕД/мл и стрептомицин производства “Фармасинтез”, Россия, 10 мг/мл. Реактивы растворяли в PSS непосредственно перед каждым экспериментом. Циклогексимид растворяли в этаноле, целекоксиб и глибенкламид – в ДМСО и перед экспериментом добавляли необходимое количество концентрата в PSS. Этанол в разведении 1/2000 и ДМСО в разведении 1/1000 не вызывали статистически значимых изменений параметров сократительной активности полосок капсулы ЛУ.
Статистическую обработку полученных результатов проводили с помощью программ Microsoft Excel и InStat (GraphPad Software), версия 3.1. Нормальность распределения полученных данных была подтверждена посредством использования критерия Шапиро–Уилка. Результаты исследования представлены в виде среднего арифметического значения и стандартной ошибки (M ± m). Для сравнения данных использовали t-критерий Стьюдента для непарных выборок. Различия считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
ЛУ брыжейки быка второго порядка имели форму слегка уплощенной сферы. Их диаметр в среднем составил 26.3 ± 2.4 мм. Толщина капсулы ЛУ без субкапсулярного синуса составляла от 218 до 263 мкм, средняя ширина субкапсулярного синуса – 48.3 ± 4.4 мкм.
На первом этапе мы оценили сократительную активность полосок капсулы брыжеечных ЛУ быка, инкубированных в среде F-10 Ham. Полоски капсулы контрольной группы, так же, как и свежие, доставленные в лабораторию в течение часа после забоя животных, при определенном натяжении генерировали фазные сокращения, амплитуда которых значительно изменялась при увеличении длины полосок (рис. 1). Увеличение длины на 0.5 мм сопровождалось небольшой релаксацией, но не приводило к спонтанной сократительной активности. Увеличение натяжения капсулы ЛУ на 1.0 мм запускало спонтанные фазные сокращения небольшой амплитуды. Дальнейшее увеличение длины на 2.0 мм приводило к генерации ритмичных высокоамплитудных фазных сокращений (рис. 1b). При одинаковой длине полоски, обработанные LPS, развивали намного меньшее натяжение по сравнению с полосками контрольной группы. Второе важное отличие заключалось в отсутствие спонтанных фазных сокращений полосок капсулы, обработанных LPS, во всем диапазоне длин. Были зарегистрированы лишь небольшие волны изменения тонуса полосок капсулы с частотой, близкой к частоте спонтанных фазных сокращений полосок контрольной группы (рис. 1c). Реакции полосок капсулы ЛУ, инкубированных в среде с добавлением LPS и циклогексимида, при растяжении не имели достоверных различий при сравнении с полосками капсулы контрольной группы.
Важной особенностью капсулы ЛУ является ее высокая растяжимость, показанная в наших предыдущих работах [19]. В данном исследовании увеличение длины полосок капсулы ЛУ контрольной группы до 0.87 Lo не приводило к увеличению силы, с которой полоски сопротивлялись растяжению. Натяжение полосок начинало заметно возрастать при их удлинении более 0.93 Lo, а при длинах более 1.13 график зависимости натяжения от длины становился более крутым (рис. 2a). Реакции полосок капсулы ЛУ, обработанные LPS, заметно отличались. Действие LPS приводило к значительному увеличению растяжимости капсулы ЛУ, график зависимости пассивного натяжения полосок капсулы брыжеечных ЛУ от длины был сдвинут вправо по сравнению с графиком, отражающим состояние полосок капсулы контрольной группы (рис. 2b). Активное натяжение, развиваемое полосками капсулы, обработанными LPS, при длинах более 0.73 Lo было достоверно ниже по сравнению с аналогичным показателем полосок контрольной группы (p < 0.05). Пассивное и активное натяжение в зависимости от длины полосок капсулы ЛУ, инкубированных в среде с добавлением LPS + циклогексимид, практически не отличались от полосок капсулы контрольной группы.
Рис. 2.
Зависимость пассивного (1), общего (2) и активного (3) натяжения полосок капсулы брыжеечных ЛУ быка, инкубированных в среде F-10 Ham (а) и в среде F-10 Ham + LPS (b) от длины при тонических сокращениях, вызванных действием активирующего раствора. (c) – схематическое изображение волокон эластина, коллагена и гладкомышечных клеток капсулы ЛУ в нерастянутом состоянии (слева) и при удлинении (справа). Lo – длина полосок капсулы, при которой они генерировали максимальную активную силу. Различия величин пассивного, общего и активного натяжения полосок капсулы брыжеечных ЛУ, инкубированных в среде F-10 Ham и в среде F-10 Ham + LPS достоверны на всех трех графиках начиная с длины 0.8 Lo, p < 0.05.

Модуль упругости полосок капсулы ЛУ контрольной группы и полосок, обработанных LPS, при длинах 0.6–0.8 Lo был практически одинаковым, в среднем (2.2 ± 0.2) × 104 Н/м2. Различие величин модуля упругости полосок капсулы ЛУ разных групп выявлялось при большем растяжении и достигало максимума при длинах 1.0–1.13 Lo (7.3 ± 0.5) × 104 Н/м2 и (5.2 ± 0.4) × 104 Н/м2 для полосок капсулы контрольной группы и полосок, обработанных LPS, соответственно. Дальнейшее увеличение длины полосок капсулы обеих групп сопровождалось значительным возрастанием модуля упругости, при этом при всех длинах модуль упругости полосок капсулы ЛУ, обработанных LPS, был достоверно ниже по сравнению с полосками капсулы контрольной группы. При длинах полосок капсулы контрольной группы 1.34 Lo их модуль упругости достигал (3.3 ± 0.4) × 105 Н/м2, а в полосках, обработанных LPS, составил (2.9 ± 0.3) × 105 Н/м2. Модуль упругости полосок капсулы ЛУ, инкубированных в среде с добавлением LPS + циклогексимид, не имел достоверных различий от аналогичного показателя характеризующего полоски капсулы контрольной группы.
Для выяснения роли гладкомышечных клеток в изменении растяжимости капсулы ЛУ в результате воздействия LPS были проведены эксперименты с добавлением в PSS папаверина. Папаверин приводил к выраженной релаксации полосок капсулы ЛУ контрольной группы (натяжение при длине, равной Lo уменьшилось c 2.72 до 1.19 N/m) и значительно меньшему ослаблению натяжения полосок капсулы ЛУ, инкубированных в среде с LPS (натяжение при длине Lo уменьшилось c 1.86 до 1.02 N/m).
Известно, что воспаление и эндотоксемия при введении LPS сопровождаются значительным повышением концентрации в различных тканях NO, провоспалительных простагландинов и H2S [24, 25], продуцируемых индуцибельной NO-синтазой (iNOS) и экспрессированными циклооксигеназой-2 (COX 2) и цистатиоин-γ-лиазой (CSE) [26, 27]. С учетом этих данных, мы провели исследование возможного участия NO, простагландинов и H2S в релаксации и ингибировании спонтанной сократительной активности гладкомышечных клеток капсулы ЛУ при действии LPS.
Эксперименты по исследованию возможного участия NO, H2S и простагландинов в релаксации гладкомышечных клеток капсулы ЛУ при действии LPS проводились по следующей схеме. После стабилизации длину полосок капсулы ЛУ, инкубированных в среде F-10 Ham (n = 10) и в среде F-10 Ham + LPS (n = 16), увеличивали до Lo и измеряли натяжение, установившееся после завершения релаксации. В полосках капсулы ЛУ контрольной группы среднее пассивное натяжение составило 0.71 ± 0.06 N/m, в полосках, обработанных LPS – 0.38 ± 0.03 N/m, а в полосках, инкубированных в среде F-10 Ham + LPS + циклогексимид – 0.67 ± 0.05 N/m. Разницу между натяжениями полосок капсулы ЛУ первой и второй групп мы считали релаксацией, вызванной воздействием сигнальных молекул, продуцируемых клетками капсулы ЛУ под влиянием LPS.
В последующем в опытах на полосках капсулы ЛУ контрольной группы и инкубированных в среде F-10 Ham + LPS в PSS вводили ингибиторы: 1) 1400W – селективный ингибитор iNOS; 2) DL-Propargylglycine – ингибитор цистатионин-γ-лиазы, 3) сelecoxib – высокоселективный ингибитор циклооксигеназы-2. Через 20 мин измеряли силу, с которой полоски оказывали сопротивление растяжению и рассчитывали натяжение. Данные, полученные в этой серии опытов, представлены на рис. 3. Разницу между натяжением полосок капсулы ЛУ контрольной группы и полосок капсулы, обработанных LPS, считали LPS-индуцированной релаксацией, которую принимали за 100%. Применение 1400W значительно уменьшило релаксирующий эффект LPS, в этих опытах релаксация составила 38% от величины релаксации в PSS. Действие PPG и целекоксиба также сопровождалось достоверным уменьшением релаксации капсулы ЛУ. Изменения натяжения полосок капсулы ЛУ контрольной группы при действии 1400W и целекоксиба были незначительными и недостоверными. В то же время в результате действия PPG натяжение полосок капсулы контрольной группы достоверно возросло на 9% (p < 0.05).
Рис. 3.
Релаксация полосок капсулы брыжеечных ЛУ быка, обработанных LPS, на фоне действия ингибиторов ферментов, продуцирующих сигнальные молекулы, обладающие релаксирующим эффектом: PSS – в физиологическом растворе (принята за 100%), 1400W – при действии ингибитора iNOS – 1400W; PPG – при действии ингибитора цистатионин-γ-лиазы – DL-Propargylglycine; 1400W + PPG – при действии ингибиторов iNOS и цистатионин-γ-лиазы; Сelecoxib – при действии ингибитора циклооксигеназы 2. Различия достоверны: # – р < 0.01, * – р < 0.05.
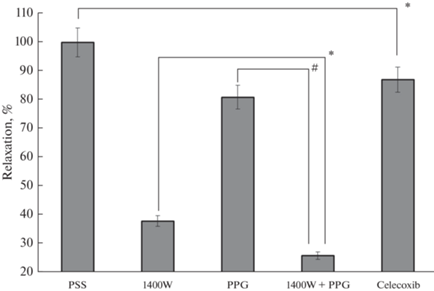
Мы также оценили величину релаксирующего эффекта при совместном применении 1400W и PPG. Действие двух ингибиторов приводило к уменьшению релаксации, при этом амплитуда релаксации была меньше суммы амплитуд при раздельном применении 1400W и PPG.
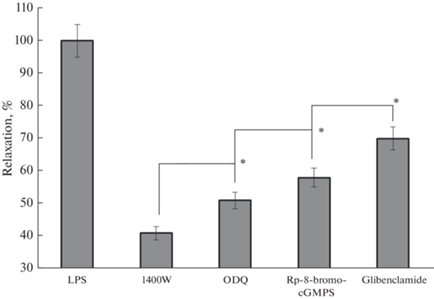
В следующей серии опытов мы оценили роль сигнальной цепочки: NO → растворимая NO-зависимая гуанилатциклаза → цГМФ → PKG → АТФ-чувствительные К+-каналы (KATP) в релаксации полосок капсулы ЛУ, обработанных LPS. Результаты данной серии опытов представлены на рис. 4. Длину полоски капсулы ЛУ устанавливали на уровне Lo. Ингибирование iNOS селективным ингибитором 1400W сопровождалось уменьшением релаксации до 41% от амплитуды релаксации полосок капсулы ЛУ в PSS. При ингибировании sGC амплитуда LPS-индуцированной релаксации составила 51%, а при ингибировании PKG – 58%. Блокирование (KATP)-каналов мембраны гладкомышечных клеток приводило к ослаблению LPS-индуцированной релаксации капсулы ЛУ до 70%.
Рис. 4.
Релаксация полосок капсулы брыжеечных ЛУ быка, обработанных LPS, при действии ингибиторов различных сигнальных путей. 1400W – ингибитор iNOS, ODQ – ингибитор растворимой гуанилатциклазы, Rp-8-bromo-cGMPS – ингибитор PKG. Релаксация полосок в PSS принята за 100%. * – различия достоверны, p < 0.05.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Традиционные определения воспаления сводятся к тому, что этот процесс является реакцией иммунной системы на инфекцию или повреждение [28]. Однако данные, полученные в последние два десятилетия, показывают, что признаки воспаления регистрируются при самых разных патологических процессах, связанных с нарушением функции тканей (сахарный диабет 2-го типа, атеросклероз, инфаркт миокарда, инсульты, рак и др. патологические состояния [29, 30]). Во всех этих случаях в процессах развития и разрешения воспаления принимает участие лимфатическая система. При воспалении в различных клетках тканей и непосредственно в лимфатических сосудах и ЛУ происходит экспрессия ряда генов, что в итоге приводит к увеличению образования цитокинов и ферментов, продуцирующих большое количество различных сигнальных молекул, изменяющих функции тканей, в т.ч. лимфатических сосудов и ЛУ [31, 32].
В нашей работе в качестве объекта исследования были выбраны брыжеечные ЛУ, которые являются самыми большими ЛУ в организме [33]. ЛУ брыжейки подвергаются массивной антигенной нагрузке (у человека ежедневно с пищей в кишечник поступает около 100 г чужеродного белка, кроме этого, кишечник человека колонизирован примерно 1013 бактерий [34]). Через ЛУ брыжейки протекает большой объем лимфы, при этом скорость лимфотока изменяется в значительных пределах (на пике пищеварения и при воспалении кишечника может возрастать в 10 раз [35]). Соответственно, ЛУ брыжейки должны достаточно быстро изменять свои механические и транспортные характеристики в значительных пределах.
ЛУ имеют строение, позволяющее выполнять три взаимозависимых функции: фильтрацию лимфы, индукцию иммунных ответов и активный транспорт лимфы. Во внутренней части ЛУ принято выделять корковое и мозговое вещество. Корковый слой характеризуется скоплением лимфоцитов и является местом, где инициируются адаптивные иммунные реакции, а мозговое вещество характеризуется относительно низкой плотностью клеток и сложной сетью кровеносных сосудов и лимфатических синусов [36, 37]. Морфология третьей структуры – капсулы, хорошо изучена, известно, что основу капсулы составляет соединительнотканный каркас со встроенными в него группами гладкомышечных клеток [13, 15]. При этом функции капсулы ЛУ исследованы недостаточно. Остаются неизученными реакции различных клеток капсулы в процессе воспаления, хотя хорошо известно, что воспаление сопровождается увеличением объема ЛУ в 10–20 раз [12]. Подобное быстрое ремоделирование ЛУ уникально. Несмотря на быстрое увеличение размеров, внутреннее строение ЛУ практически не изменяется, при этом они выполняют свои иммунные функции более эффективно по сравнению с физиологическими условиями.
LPS, являющийся компонентом наружной мембраны грамотрицательных бактерий – сильно действующий воспалительный агент, приводящий к образованию в тканях цитокинов и молекул адгезии [38], широко применяется в экспериментах на животных при моделировании воспаления [39]. Образующиеся цитокины активируют в различных клетках множество сигнальных путей, в т.ч. способствующих экспрессии ряда генов, результатом которой является продукция NO [40], простагландинов [41] и H2S [42], которые в настоящее время принято считать медиаторами воспаления [43]. В нашем исследовании мы изучили LPS-индуцированные механизмы релаксации гладкомышечных клеток капсулы ЛУ, реализуемые с участием NO, простагландинов и H2S.
При исследовании механических характеристик капсулы ЛУ, обработанных LPS, установлено, что они обладают значительно большей растяжимостью по сравнению с полосками контрольной группы. Пассивное натяжение в полосках контрольной группы при удлинения их до 0.8 Lo возрастало незначительно, составляя при этом около 0.12 N/m. В полосках капсулы ЛУ, обработанных LPS, при аналогичном удлинении натяжение не превышало 0.08 N/m. При длине полосок, равной Lo разница в натяжении возрастала: в контрольной группе этот показатель составлял 0.71 N/m, в то время, как в полосках, обработанных LPS, натяжение было 0.34 N/m. Действие LPS оказывало выраженное влияние и на активное натяжение полосок капсулы ЛУ: при длине, равной Lo полоски капсулы контрольной группы развивали активное натяжение 2.72 N/m, а полоски, обработанные LPS – 1.86 N/m. Активное натяжение в сосудах и полых органах создается за счет сокращения гладкомышечных клеток [44], поэтому выраженная разница в величинах натяжения полосок капсулы контрольной группы и обработанных LPS позволила нам предположить, что LPS в капсуле ЛУ оказывает влияние преимущественно на гладкомышечные клетки. Для подтверждения этого предположения мы провели опыты с применением папаверина. Папаверин, вызывающий мощную релаксацию сосудов и внутренних органов [45], в наших экспериментах приводил к выраженной релаксации полосок капсулы ЛУ в контроле и небольшому ослаблению натяжения полосок капсулы, инкубированных в среде с LPS. Мы полагаем, что слабая реакция на папаверин полосок капсулы ЛУ, обработанных LPS, объясняется тем, что гладкомышечные клетки капсулы, подвергавшиеся воздействию LPS и образующихся под его воздействием сигнальных молекул, уже находятся в состоянии расслабления и в связи с этим применение экзогенного вазодилататора малоэффективно.
Важным параметром, характеризующим механические свойства объектов является модуль упругости Юнга. Мы определили эффективный модуль упругости полосок капсулы ЛУ при различной длине. В полосках капсулы ЛУ контрольной группы и полосках, обработанных LPS, при длинах 0.6–0.8 Lo их модуль упругости был практически одинаковым, различие появлялось при большем растяжении и достигало максимума при длине Lo. Рассчитанный модуль упругости полосок капсулы ЛУ представляется очень низким, однако полученные нами величины близки к данным, зарегистрированным на лимфатических сосудах. Так, в исследовании Azuma и соавт. [39] окружный модуль упругости брыжеечных лимфатических сосудов быка находился в пределах 4.2 × 103–2.7 × 104 Н/м2. Мы полагаем, что низкая величина модуля упругости капсулы ЛУ объясняется особенностями ее строения (неупорядоченное расположение волокон эластина и коллагена, отсутствие эластических мембран и разнонаправленная ориентация пучков гладкомышечных клеток) [16]. По-видимому, на первых этапах растяжения капсулы происходит изменение направления волокон эластина и коллагена (рис. 2с), и лишь при дальнейшем удлинении растяжению начинают подвергаться гладкомышечные клетки, что приводит к значимому возрастанию модуля упругости и появлению достоверных различий этого показателя при сравнении полосок контрольной группы и обработанных LPS. При длинах полосок капсулы L > Lo в процесс сопротивления растяжению дополнительно вовлекаются волокна эластина и коллагена, что сопровождается значительным возрастанием модуля упругости.
При исследовании полосок капсулы ЛУ, инкубированных в среде с LPS и циклогексимидом, было показано, что их механические характеристики (и в частности активное натяжение) практически не отличаются от характеристик полосок контрольной группы. Поскольку циклогексимид является ингибитором синтеза белка [46], то эти данные являются подтверждением, что воздействие LPS на гладкомышечные клетки капсулы ЛУ опосредовано сигнальными молекулами, продуцируемыми ферментами, экспрессированными под влиянием LPS и которые в физиологических условиях отсутствуют или их концентрация очень низкая. С учетом этих данных мы провели ряд экспериментов по изучению механизмов релаксирующего эффекта LPS на гладкомышечные клетки капсулы ЛУ.
Известно, что одной из основных транскрипционных мишеней LPS является iNOS. В физиологических условиях iNOS в клетках отсутствует и экспрессируется только тогда, когда клетка индуцируется, как правило, провоспалительными цитокинами и/или LPS. Появление в цитоплазме клеток этого индуцируемого фермента приводит к образованию NO, ключевого медиатора иммунной активации и воспаления [47]. iNOS не требует активации и вырабатывает значительное количество NO, которое сохраняется в тканях до инактивации фермента [48]. Ранее iNOS была обнаружена в различных клетках, в т.ч. в эндотелиальных и мышечных клетках лимфатических сосудов, в которых максимальная концентрация iNOS достигалась через 6 ч инкубации с LPS [49].
На первом этапе мы оценили участие iNOS в LPS-индуцированной релаксации капсулы ЛУ. Ингибирование iNOS посредством добавления в раствор высокоселективного ингибитора – 1400W приводило к значительному уменьшению LPS-индуцированной релаксации капсулы ЛУ, амплитуда релаксации составила 41% от LPS-индуцированной релаксации в PSS (рис. 4). В аналогичных опытах на полосках капсулы ЛУ, не подвергавшихся действию LPS, 1400W не приводил к значимым изменениям натяжения полосок. Полученные данные дают основание для заключения о том, что одной из сигнальных молекул, образующихся в капсуле ЛУ при действии LPS, является NO, продуцируемый iNOS. Поскольку механизм действия NO, продуцируемого iNOS в капсуле ЛУ, практически не изучен, в последующих экспериментах мы исходили из классических представлений о действии NO в гладкомышечных клетках кровеносных [50] и лимфатических сосудов [51]: NO активирует в гладкомышечных клетках растворимую гуанилатциклазу (sGC), что приводит к образованию цГМФ (cGMP), активации протеинкиназы G (PKG) и открыванию KATP-каналов. Развивающаяся при этом гиперполяризация мембраны гладкомышечных клеток приводит к их расслаблению [52].
ODQ, являющийся селективным ингибитором чувствительной к NO sGC, приводил к значительному ослаблению LPS-индуцированной релаксации капсулы ЛУ (релаксация составила 51% от величины LPS-индуцированной релаксации в PSS). В свою очередь, ингибирование PKG посредством добавления в PSS Rp-8-bromo-cGMPS также изменяло величину LPS-индуцированной релаксации капсулы ЛУ, в этом случае релаксация была достоверно больше по сравнению с эффектами 1400W и ODQ. На фоне глибенкламида – блокатора KATP-каналов, релаксация капсулы была большей по сравнению с эффектами ингибиторов sGC и PKG. На основании этих данных мы предполагаем, что в гладкомышечных клетках капсулы ЛУ при экспрессии iNOS и значительном повышении концентрации NO кроме сигнальной цепи NO → sGC → PKG → KATP-каналы, функционируют еще несколько механизмов релаксации. В частности, достоверное различие амплитуд релаксации капсулы ЛУ, обработанных LPS, при ингибировании iNOS и sGC дает основания считать, что NO оказывает непосредственное влияние на другие регуляторные механизмы в гладкомышечных клетках, возможно, посредством активации BKCa-каналов мембраны [53]. Помимо этого, различие величин релаксации при ингибировании sGC и PKG позволяет предположить, что cGMP в гладкомышечных клетках капсулы ЛУ не только активирует PKG, но и изменяет активность некоторых регуляторных белков, например посредством дефосфорилирования легкой цепи миозина, как это было обнаружено в кровеносных сосудах [54]. И наконец, различие амплитуд релаксации при ингибировании PKG и блокировании KATP-каналов свидетельствует о том, что в гладкомышечных клетках капсулы ЛУ PKG не только открывает KATP -каналы, но действует и на другие регуляторные системы, например, может фосфорилировать потенциалзависимые Са2+-каналы мембраны или ингибировать киназу легкой цепи миозина, как это было установлено в гладкомышечных клетках других тканей [55, 56].
Ингибирование iNOS в наших экспериментах уменьшало, но не предотвращало LPS-индуцированную релаксацию капсулы ЛУ, что послужило основанием для поиска других сигнальных молекул, образующихся в капсуле ЛУ под действием LPS и оказывающих релаксирующий эффект. В соответствии с классическими представлениями, в процессе воспаления в тканях экспрессируется COX 2, под действием которой и соответствующих синтаз арахидоновая кислота трансформируется в простагландины, оказывающие непосредственное воздействие на гладкомышечные клетки [57]. Простагландины играют решающую роль в физиологических и патофизиологических процессах, они активно участвуют в воспалительном процессе. Было установлено, что клетки стенки ЛС непосредственно продуцируют простагландины [58], и в частности ЛС ноги человека и брыжейки быков синтезируют PGE2 и простациклин [1, 59]. В нашей работе добавление в PSS ингибитора COX 2, целекоксиба, приводило к возрастанию натяжения капсулы ЛУ, обработанных LPS, но не оказывало значимого влияния на натяжение полосок капсулы контрольной группы. Разница между величинами натяжения полосок капсулы, обработанных LPS в PSS и при добавлении целекоксиба, составила 12% (p < 0.05). На основании этих результатов мы полагаем, что часть релаксирующего эффекта LPS на капсулу ЛУ реализуется за счет производства простагландинов. Мы не проводили идентификацию конкретных простагландинов, но с учетом того, что в эндотелии ЛС при воспалении образуются PGE2 и простациклин [60, 61] и общего происхождения эндотелия лимфатических сосудов и ЛУ [62], мы полагаем, что под действием LPS в клетках капсулы ЛУ экспрессируется COX 2, что ведет к образованию PGE2 и простациклина, которые оказывают релаксирующий эффект на гладкомышечные клетки капсулы ЛУ.
В заключительной серии экспериментов мы исследовали возможное участие H2S в LPS-индуцированной релаксации капсулы ЛУ. H2S является одной из трех известных газообразных сигнальных молекул или “газотрансмиттеров”, играющих важную роль в сердечно-сосудистой и других системах в физиологических и патофизиологических условиях [63]. Установлено, что H2S, как правило, оказывает сосудорасширяющее действие посредством регуляции сигнального пути sGC → PKG [64] или через KATP-каналы [65]. Доклинические и клинические исследования показали, что в тканях H2S преимущественно синтезируется ферментами – цистатионин-γ-лиазой (CSE), цистатионин-β-синтазой и 3-меркаптосульфуртрансферазой. В сердечно-сосудистой системе важнейшим H2S-образующим ферментом является CSE [66]. В капсуле ЛУ основным ферментом, продуцирующим H2S, также является CSE [46, 67]. Учитывая эти данные, в наших опытах мы применяли ингибитор CSE–DL-Propargylglycine.
Действие на протяжении 20 мин PPG на полоски капсулы ЛУ, обработанные LPS, сопровождалось увеличением их натяжения (или уменьшением релаксации) на 19% (рис. 3). Ослабление LPS-индуцированной релаксации капсулы ЛУ при действии PPG дает основания предположить, что при моделировании воспаления в капсуле ЛУ образуется H2S, который оказывает релаксирующий эффект на гладкомышечные клетки капсулы. Ранее было показано, что при сепсисе значительно увеличивается концентрация мРНК CSE в печени у мышей [68], повышение активности CSE выявлено и при воспалительных заболеваниях кишечника [69]. Установлено также, что действие LPS повышает H2S-синтезирующую функцию в макрофагах человека [70]. Мы полагаем, что значительное возрастание доли релаксации, осуществляющейся за счет действия H2S в полосках капсулы ЛУ, обработанных LPS, по сравнению с полосками капсулы контрольной группы дает основания для заключения об экспрессии в клетках капсулы ЛУ под действием LPS или образующихся цитокинов H2S-продуцирующих ферментов, в частности CSE. Повышенная продукция H2S приводит к увеличению LPS-индуцированной релаксации капсулы ЛУ.
Релаксирующее действие H2S и механизмы его действия на гладкомышечные клетки капсулы ЛУ в физиологических условиях были изучены нами ранее [67]. Было установлено, что в капсуле ЛУ релаксирующий эффект H2S реализуется за счет ингибирования в гладкомышечных клетках фосфодиэстеразы и открывания KATP-каналов, что ведет к гиперполяризации мембраны и расслаблению гладкомышечных клеток. В данном исследовании на полосках капсулы ЛУ, обработанных LPS, получены новые данные, которые демонстрируют взаимодействие NO и H2S в процессе реализации релаксирующего эффекта. Ингибирование CSE посредством добавления PPG в PSS сопровождалось ослаблением релаксации на 19%. В то же время в полосках капсулы ЛУ, у которых было заблокировано производство NO, подавление синтеза H2S с помощью PPG приводило к ослаблению релаксации лишь на 10%. Т.е. непосредственный релаксирующий эффект H2S в отсутствие NO в капсуле ЛУ составлял 10%, а при наличии NO H2S-опосредованное расслабление капсулы ЛУ возрастало до 19% от LPS-индуцируемой релаксации. Полученные данные позволяют предположить, что эндогенный H2S в капсуле ЛУ так же, как и в других тканях, взаимодействует с NO. Результатом этого взаимодействия могут быть сложные метаболиты NO (нитрозоперсульфид, сульфинилнитрит и др.), которые оказывают непосредственный релаксирующий эффект на гладкомышечные клетки [71, 72] или усиливают биологическое действие NO, оказывая влияние на NO-опосредуемый сигнальный путь NO → sGC → cGMP → PKG, стабилизируя sGC или образуя 8-SH-cGMP, форму cGMP, более устойчивую к фосфодиэстеразе [73]. Таким образом, H2S в клетках капсулы брыжеечных ЛУ быка, обработанных LPS, так же, как и в кровеносных сосудах [74] с одной стороны является важным независимым эффектором, приводящим к релаксации капсулы ЛУ, а с другой – усилителем NO-опосредованной релаксации.
В заключение, полученные в нашем исследовании данные, показывают, что при моделировании воспаления растяжимость капсулы ЛУ возрастает вследствие ингибирования сократительной функции гладкомышечных клеток, входящих в состав капсулы. Показано, что LPS вызывает экспрессию в клетках капсулы ЛУ индуцибельной NO-синтазы, циклооксигеназы 2 и цистатионин-γ-лиазы. Продуцируемые этими ферментами NO, простагландины и H2S не только угнетают фазную сократительную функцию гладкомышечных клеток капсулы, но и приводят к существенному снижению тонуса. Продуцируемый в значительном количестве NO не ограничивается активацией классического сигнального пути NO → → sGC → cGMP → PKG → KATP –каналы гладкомышечных клеток, но и, по-видимому, оказывает непосредственное влияние на другие регуляторные механизмы. Впервые показано, что H2S, синтезированный цистатионин-γ-лиазой в капсуле ЛУ, обработанной LPS, не только оказывает непосредственный релаксирующий эффект, но и усиливает NO-опосредованную релаксацию гладкомышечных клеток капсулы ЛУ. Таким образом, результаты данного исследования предоставляют доказательства, что уже на ранней стадии LPS-индуцируемого воспаления в капсуле брыжеечных ЛУ быка происходят изменения, направленные на создание условий для увеличения размеров ЛУ и накопления иммунных клеток.
Список литературы
Breslin JW, Yang Y, Scallan JP, Sweat RS, Adderley SP, Murfee WL (2018) Lymphatic Vessel Network Structure and Physiology. Compr Physiol 9(1): 207–299. https://doi.org/10.1002/cphy.c180015
Лобов ГИ (2022) Лимфатическая система в норме и при патологии. Успехи физиол наук 53: 15–38. [Lobov GI (2022) The lymphatic system in normal and pathological conditions. Progress Physiol Sci 53: 15–38. (In Russ)]. https://doi.org/10.31857/S0301179822020060
Борисов АВ (2005) Функциональная анатомия лимфангиона. Морфология 128(6):18-27. [Borisov AV (2005) Functional anatomy of lymphangion. Morfologiia 128(6): 18–27. (In Russ)].
Орлов РС, Лобов ГИ (1984) Механизм действия внутрисосудистого давления на электрическую и сократительную активность лимфангионов. Физиол журн СССР им ИМ Сеченова 70(12): 1636–1644. [Orlov RS, Lobov GI (1984) Mechanism of action of intravascular pressure on the electrical and contractile activity of lymphangions. Fiziol Zh SSSR Im I M Sechenova 70(12): 1636–1644. (In Russ)].
Hokari R, Tomioka A (2021) The role of lymphatics in intestinal inflammation. Inflamm Regen 41(1): 25. https://doi.org/10.1186/s41232-021-00175-6
Randolph GJ, Ivanov S, Zinselmeyer BH, Scallan JP (2017) The Lymphatic System: Integral Roles in Immunity. Annu Rev Immunol 35: 31–52. https://doi.org/10.1146/annurev-immunol-041015-055354
Trevaskis NL, Kaminskas LM, Porter CJ (2015) From sewer to saviour – targeting the lymphatic system to promote drug exposure and activity. Nat Rev Drug Discov 14: 781–803. https://doi.org/10.1038/nrd4608
Cakala-Jakimowicz M, Kolodziej-Wojnar P, Puzianowska-Kuznicka M (2021) Aging-Related Cellular, Structural and Functional Changes in the Lymph Nodes: A Significant Component of Immunosenescence? An Overview. Cells 10(11): 3148. https://doi.org/10.3390/cells10113148
von Andrian UH, Mempel TR (2003) Homing and cellular traffic in lymph nodes. Nat Rev Immunol 3: 867–878. https://doi.org/10.1038/nri1222
Mendoza A, Fang V, Chen C, Serasinghe M, Verma A, Muller J, Chaluvadi VS, Dustin ML, Hla T, Elemento O, Chipuk JE, Schwab SR (2017) Lymphatic endothelial S1P promotes mitochondrial function and survival in naive T cells. Nature 546(7656): 158–161. https://doi.org/10.1038/nature22352
Gregory JL, Walter A, Alexandre YO, Hor JL, Liu R, Ma JZ, Devi S, Tokuda N, Owada Y, Mackay LK, Smyth GK, Heath WR, Mueller SN (2017) Infection Programs Sustained Lymphoid Stromal Cell Responses and Shapes Lymph Node Remodeling upon Secondary Challenge. Cell Rep 18(2): 406–418. https://doi.org/10.1016/j.celrep.2016.12.03
Acton SE, Reis e Sousa C (2016) Dendritic cells in remodeling of lymph nodes during immune responses. Immunol Rev 271(1): 221–229. https://doi.org/10.1111/imr.12414
Faroon OM, Henry RW, al-Bagdadi FK (1987) Smooth muscle distribution in the capsule and trabeculae of the caprine superficial cervical lymph node. Histol Histopathol 2(3): 313–315.
Lobov GI, Pan’kova MN (2011) Mechanical properties of lymph node capsule. Bull Exp Biol Med 151(1): 5–8. https://doi.org/10.1007/s10517-011-1246-7
Lobov GI, Pan’kova MN, Dvoretsky DP, Sergeev IV (2010) Characteristic of the active and passive mechanical properties of the lymph node capsule. Dokl Biol Sci 434: 310–312. https://doi.org/10.1134/S0012496610050054
Folse DS, Beathard GA, Granholm NA (1975) Smooth muscle in lymph node capsule and trabeculae. Anat Rec 183(4): 517–521.
Castenholz A (1990) Architecture of the lymph node with regard to its function. Curr Top Pathol 84 (Pt 1): 1–32. https://doi.org/10.1007/978-3-642-75519-4_1
Лобов ГИ, Панькова МН, Абдрешов СН (2015) Транспортная функция лимфатических узлов у молодых и старых животных. Успехи геронтол 28(4): 681–686. [Lobov GI, Pan’kova MN, Abdreshov SN (2015) Transport function of the lymph nodes in young and old animals. Adv Gerontol 28(4): 681–686. (In Russ)].
Lobov GI, Kosareva ME (2022) Comparative characteristics of the mechanical properties of the capsule of the mesenteric lymph nodes young and old bulls. J Evol Biochem Phys 58: 1353–1366. https://doi.org/10.1134/S0022093022050076
Иосифов ГМ (1914) Лимфатическая система человека с описанием аденоидов и органов движения лимфы. Томск. Изд. Томского Университета. 274 с. [Iosifov GM (1914) The human lymphatic system with a description of the adenoids and organs of lymphatic movement. Tomsk. Ed. Tomsk University. 274 p. (In Russ)].
Novkovic M, Onder L, Cheng HW, Bocharov G, Ludewig B (2018) Integrative Computational Modeling of the Lymph Node Stromal Cell Landscape. Front Immunol 9: 2428. https://doi.org/10.3389/fimmu.2018.02428
Pastukhova IA (1986) Myocytes of the inguinal lymph nodes. Arkh Anat Gistol Embriol 90(6): 32–37.
Suba EA, McKenna TM, Williams TJ (1992) In vivo and in vitro effects of endotoxin on vascular responsiveness to norepinephrine and signal transduction in the rat. Circ Shock 36(2): 127–133.
Ricciotti E, FitzGerald GA (2011) Prostaglandins and inflammation. Arterioscler Thromb Vasc Biol 31(5): 986–1000. https://doi.org/10.1161/ATVBAHA.110.207449
El-Haj L, Bestle MH (2017) Nitric oxide and sepsis. Ugeskr Laeger 179(44):V01170086.
Boncoeur É, Bouvet GF, Migneault F, Tardif V, Ferraro P, Radzioch D, de Sanctis JB, Eidelman D, Govindaraju K, Dagenais A, Berthiaume Y (2013) Induction of nitric oxide synthase expression by lipopolysaccharide is mediated by calcium-dependent PKCα-β1 in alveolar epithelial cells. Am J Physiol Lung Cell Mol Physiol 305(2): L175–184. https://doi.org/10.1152/ajplung.00295.2012
Wang M, Guo Z, Wang S (2014) The binding site for the transcription factor, NF-κB, on the cystathionine γ-lyase promoter is critical for LPS-induced cystathionine γ-lyase expression. Int J Mol Med 34(2): 639–645. https://doi.org/10.3892/ijmm.2014.1788
Medzhitov R (2008) Origin and physiological roles of inflammation. Nature 454(7203): 428–435. https://doi.org/10.1038/nature07201
Coussens LM, Werb Z (2002) Inflammation and cancer. Nature 420(6917): 860–867. https://doi.org/10.1038/nature01322
Libby P (2002) Inflammation in atherosclerosis. Nature 420(6917): 868–874. https://doi.org/10.1038/nature01323
Schwager S, Detmar M (2019) Inflammation and Lymphatic Function. Front Immunol 10: 308. https://doi.org/10.3389/fimmu.2019.00308
Wilting J, Becker J, Buttler K, Weich HA (2009) Lymphatics and inflammation. Curr Med Chem 16(34): 4581–4592. https://doi.org/10.2174/092986709789760751
Houston SA, Cerovic V, Thomson C, Brewer J, Mowat AM, Milling S (2016) The lymph nodes draining the small intestine and colon are anatomically separate and immunologically distinct. Mucosal Immunol 9: 468–478.
Sender R, Fuchs S, Milo R (2016) Revised estimates for the number of human and bacteria cells in the body. PLoS Biol 14: e1002533. https://doi.org/10.1371/journal.pbio.1002533
Telinius N, Drewsen N, Pilegaard H, Kold-Petersen H, de Leval M, Aalkjaer C, Hjortdal V, Boedtkjer DB (2010) Human thoracic duct in vitro: diameter-tension properties, spontaneous and evoked contractile activity. Am J Physiol Heart Circ Physiol 299(3): H811–818. https://doi.org/10.1152/ajpheart.01089.2009
Sainte-Marie G (2010) The Lymph Node Revisited: Development, Morphology, Functioning, and Role in Triggering Primary Immune Responses. Anat Rec 293: 320–337. https://doi.org/10.1002/ar.21051
Kastenmüller W, Torabi-Parizi P, Subramanian N, Lämmermann T, Germain R N (2012) A Spatially-Organized Multicellular Innate Immune Response in Lymph Nodes Limits Systemic Pathogen Spread. Cell 150: 1235–1248. https://doi.org/10.1016/j.cell.2012.07.021
Adib-Conquy M, Cavaillon JM (2012) Host inflammatory and anti-inflammatory response during sepsis. Pathol Biol (Paris) 60(5): 306–313. https://doi.org/10.1016/j.patbio.2012.03.011
Cavaillon JM (2018) Exotoxins and endotoxins: Inducers of inflammatory cytokines. Toxicon 149: 45–53. https://doi.org/10.1016/j.toxicon.2017.10.016
Wolkow PP (1998) Involvement and dual effects of nitric oxide in septic shock. Inflamm Res 47(4): 152–166. https://doi.org/10.1007/s000110050309
Ricciotti E, FitzGerald GA (2011) Prostaglandins and inflammation. Arterioscler Thromb Vasc Biol 31(5): 986–1000. https://doi.org/10.1161/ATVBAHA.110.20744
Sun HJ, Wu ZY, Nie XW, Bian JS (2020) Role of Endothelial Dysfunction in Cardiovascular Diseases: The Link Between Inflammation and Hydrogen Sulfide. Front Pharmacol 10: 1568. https://doi.org/10.3389/fphar.2019.01568
Bhatia M, Gaddam RR (2021) Hydrogen Sulfide in Inflammation: A Novel Mediator and Therapeutic Target. Antioxid Redox Signal 34(17): 1368–1377. https://doi.org/10.1089/ars.2020.8211
Clark JF, Radda GK, Boehm EA (2000) The effects of anti-hypertensive therapy on the structural, mechanical and metabolic properties of the rat aorta. J Muscle Res Cell Motil 21(3): 255–267. https://doi.org/10.1023/a:1005646614308
Rahimi N, Dehpour AR, Javadi-Paydar M, Sohanaki H, Rabbani S, Ansari M, Tafti SH (2011) Effect of DETA-NONOate and papaverine on vasodilation of human internal mammary artery. Can J Physiol Pharmacol 89(12): 945–951. https://doi.org/10.1139/y11-092
Лобов ГИ (2021) Роль сероводорода в релаксации капсулы лимфатических узлов при ЛПС-индуцированном воспалении. Рос физиол журн им ИМ Сеченова 107(11): 1372–1384. [Lobov GI (2021) The role of hydrogen sulfide in relaxation of the lymph node capsule in LPS-induced inflammation. Ross Physiol Zhurn im IM Sechenov 107(11): 1372–1384. (In Russ)]. https://doi.org/10.31857/S0869813921110066
Cinelli MA, Do HT, Miley GP, Silverman RB (2020) Inducible nitric oxide synthase: Regulation, structure, and inhibition. Med Res Rev 40(1): 158–189. https://doi.org/10.1002/med.21599
Thiemermann C (1997) Nitric oxide and septic shock. Gen Pharmacol 29(2): 159–166. https://doi.org/10.1016/s0306-3623(96)00410-7
Chen Y, Rehal S, Roizes S, Zhu HL, Cole WC, von der Weid PY (2017) The pro-inflammatory cytokine TNF-α inhibits lymphatic pumping via activation of the NF-κB-iNOS signaling pathway. Microcirculation 24(3): https://doi.org/10.1111/micc.12364.10.1111/micc.12364
Mutchler SM, Straub AC (2015) Compartmentalized nitric oxide signaling in the resistance vasculature. Nitric Oxide 49: 8–15. https://doi.org/10.1016/j.niox.2015.05.003
Mathias R, von der Weid PY (2013) Involvement of the NO-cGMP-K(ATP) channel pathway in the mesenteric lymphatic pump dysfunction observed in the guinea pig model of TNBS-induced ileitis. Am J Physiol Gastrointest Liver Physiol 304(6): G623–634. https://doi.org/10.1152/ajpgi.00392.2012
Derbyshire ER, Marletta MA (2012) Structure and regulation of soluble guanylate cyclase. Annu Rev Biochem 81: 533–559. https://doi.org/10.1146/annurev-biochem-050410-100030
Lang RJ, Harvey JR, McPhee GJ, Klemm MF (2000) Nitric oxide and thiol reagent modulation of Ca2+-activated K+ (BKCa) channels in myocytes of the guinea-pig taenia caeci. J Physiol 525 (2): 363–376. https://doi.org/10.1111/j.1469-7793.2000.00363.x
Murad F, Waldman S, Molina C, Bennett B, Leitman D (1987) Regulation and role of guanylate cyclase-cyclic GMP in vascular relaxation. Prog Clin Biol Res 249: 65–76.
Waldman S.A, Murad F (1987) Cyclic GMP synthesis and function. Pharm. Rev 39: 163–196.
da Silva GM, da Silva MC, Nascimento DVG, Lima Silva EM, Gouvêa FFF, de França Lopes LG, Araújo AV, Ferraz Pereira KN, de Queiroz TM (2021) Nitric Oxide as a Central Molecule in Hypertension: Focus on the Vasorelaxant Activity of New Nitric Oxide Donors. Biology (Basel) 10(10): 1041. https://doi.org/10.3390/biology10101041
Bishop-Bailey D, Hla T, Mitchell JA (1999) Cyclo-oxygenase-2 in vascular smooth muscle. Int J Mol Med 3(1): 41–48. https://doi.org/10.3892/ijmm.3.1.41
Chan AK, Vergnolle N, Hollenberg MD, von der Weid P-Y (2004) Proteinase-activated receptor 2 modulates guinea-pig mesenteric lymphatic vessel pacemaker potential and contractile activity. J Physiology 560: 563–576. https://doi.org/10.1113/jphysiol.2004.071399
Kashiwagi S, Hosono K, Suzuki T, Takeda A, Uchinuma E, Majima M (2011) Role of COX-2 in lymphangiogenesis and restoration of lymphatic flow in secondary lymphedema. Lab Invest 91(9): 1314–1325. https://doi.org/10.1038/labinvest.2011.84
Rehal S, Blanckaert P, Roizes S, von der Weid PY (2009) Characterization of biosynthesis and modes of action of prostaglandin E2 and prostacyclin in guinea pig mesenteric lymphatic vessels. Br J Pharmacol 158(8): 1961–1970. https://doi.org/10.1111/j.1476-5381.2009.00493.x
Sinzinger H, Kaliman J, Mannheimer E (1994) Arachidonic acid metabolites of human lymphatics. Lymphology 17(2): 39–42.
Blum KS, Pabst R (2006) Keystones in lymph node development. J Anat 209(5): 585–595. https://doi.org/10.1111/j.1469-7580.2006.00650.x
Kolluru GK, Shackelford RE, Shen X, Dominic P, Kevil CG (2022) Sulfide regulation of cardiovascular function in health and disease. Nat Rev Cardiol 5: 1–17. https://doi.org/10.1038/s41569-022-00741-6
Bucci M, Papapetropoulos A, Vellecco V, Zhou Z, Zaid A, Giannogonas P, Cantalupo A, Dhayade S, Karalis KP, Wang R, Feil R, Cirino G (2012) cGMP-dependent protein kinase contributes to hydrogen sulfide-stimulated vasorelaxation. PLoS One 7(12): e53319. https://doi.org/10.1371/journal.pone.0053319
Elies J, Scragg JL, Huang S, Dallas ML, Huang D, MacDougall D, Boyle JP, Gamper N, Peers C (2014). Hydrogen sulfide inhibits Cav3.2 T-type Ca2+ channels. FASEB J 28(12): 5376–5387. https://doi.org/10.1096/fj.14-257113
Wang R (2002) Two’s company, three’s a crowd: can H2S be the third endogenous gaseous transmitter? FASEB J 16: 1792–1798. https://doi.org/10.1096/fj.02-0211hyp
Lobov GI (2020) Relaxing Effect of Hydrogen Sulfide on Isolated Bovine Mesenteric Lymph Nodes. Bull Exp Biol Med 169(2): 192–196. https://doi.org/10.1007/s10517-020-04848-z
Zhang H, Zhi L, Moore PK, Bhatia M (2006) Role of hydrogen sulfide in cecal ligation and puncture-induced sepsis in the mouse. Am J Physiol Lung Cell Mol Physiol 290(6): L1193–1201. https://doi.org/10.1152/ajplung.00489.2005
Zhu Z, Chambers S, Zeng Y, Bhatia M (2022) Gases in Sepsis: Novel Mediators and Therapeutic Targets. Int J Mol Sci 23(7): 3669. https://doi.org/10.3390/ijms23073669
Badiei A, Gieseg S, Davies S, Izani Othman M, Bhatia M (2015) LPS Up-Regulates Cystathionine γ -Lyase Gene Expression in Primary Human Macrophages via NF-κB/ERK Pathway. Inflamm Allergy Drug Targets 14(2): 99–104. https://doi.org/10.2174/1871528114666151201201719
Huang YQ, Jin HF, Zhang H, Tang CS, Du JB (2021) Interaction among Hydrogen Sulfide and Other Gasotransmitters in Mammalian Physiology and Pathophysiology. Adv Exp Med Biol 1315: 205–236.https://doi.org/10.1007/978-981-16-0991-6_9
Berenyiova A, Grman M, Mijuskovic A, Stasko A, Misak A, Nagy P, Ondriasova E, Cacanyiova S, Brezova V, Feelisch M, Ondrias K (2015) The reaction products of sulfide and S-nitrosoglutathione are potent vasorelaxants. Nitric Oxide 46: 123–130. https://doi.org/10.1016/j.niox.2014.12.008
Nishida M, Toyama T, Akaike T (2014) Role of 8-nitro-cGMP and its redox regulation in cardiovascular electrophilic signaling. J Mol Cell Cardiol 73: 10–17. https://doi.org/10.1016/j.yjmcc.2014.02.003
Szabo C (2017) Hydrogen sulfide, an enhancer of vascular nitric oxide signaling: mechanisms and implications. Am J Physiol Cell Physiol 312: C3–C15. https://doi.org/10.1152/ajpcell.00282.2016
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


