Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 2, стр. 134-156
Влияние бега на развитие диабета и индуцированных диабетом осложнений
Т. Т. Подвигина 1, *, Н. И. Ярушкина 1, Л. П. Филаретова 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: tpodvigina@yandex.ru
Поступила в редакцию 12.11.2021
После доработки 02.12.2021
Принята к публикации 02.12.2021
- EDN: LAHZCB
- DOI: 10.31857/S0869813922020078
Аннотация
Физическая активность оказывает благотворное влияние на все жизненно важные функции организма как в норме, так и при патологии. В обзоре анализируются клинические данные и результаты экспериментов на животных о влиянии физической активности (бега) на развитие диабета 1-го и 2-го типа и осложнения, индуцированные этим заболеванием в нервной, сердечно-сосудистой, выделительной и зрительной системах. Особое внимание уделяется влиянию бега на патологические изменения, индуцированные диабетом, в желудочно-кишечном тракте. Анализ данных, включающих и результаты собственных исследований авторов, свидетельствует о том, что физическая активность (бег) уменьшает степень выраженности как признаков диабета, так и связанных с ним осложнений. Обсуждаются возможные механизмы позитивных эффектов бега при диабете и зависимость этих эффектов от интенсивности бега.
В настоящее время не вызывает сомнения, что малоподвижный образ жизни может быть причиной целого ряда хронических заболеваний. Отсутствие физической активности может увеличивать риск большого количества хронических заболеваний, среди которых гипертензия, атеросклероз, ревматоидный артрит, метаболический синдром, ожирение, депрессия и, в том числе, диабет, при этом по некоторым данным список включает до 35 хронических заболеваний [1].
Диабет является одним из наиболее распространенных хронических заболеваний, приводящих к инвалидности и смертности. Согласно прогнозу Международной федерации по диабету (International Diabetes Federation), к 2045 г. количество пациентов с диабетом во всем мире достигнет примерно 700 миллионов человек, по сравнению с 463 миллионами в 2019 г. В 2019 г. диабет стал причиной смерти более 4 миллионов человек в возрасте 20–79 лет [2]. Традиционно выделяют два основных типа диабета, имеющих разную этиологию: диабет 1-го типа, обусловленный разрушением бета-клеток поджелудочной железы, продуцирующих инсулин, и диабет 2-го типа, связанный с резистентностью тканей (главным образом, мышечной) к действию инсулина. Моделирование диабета 1-го типа в экспериментах на животных (крысах и мышах) осуществляется с помощью введения стрептозотоцина, избирательно поражающего бета-клетки поджелудочной железы. Для изучения диабета 2-го типа обычно используют генетически модифицированные линии крыс или мышей, а также модели диабета, индуцированные, в том числе, длительным содержанием животных на высококалорийной диете в сочетании с введением небольшой дозы стрептозотоцина [3, 4].
Физическая активность и особенно бег, являющийся естественной активностью для человека и животных, оказывает благотворное влияние на все жизненно важные функции организма как в норме, так и при патологии, включая диабет. Результаты клинических исследований и экспериментов на животных, полученные за последние 15 лет, свидетельствуют о том, что физические упражнения уменьшают не только риск проявления диабетических осложнений, но и степень выраженности признаков развития самого диабета как 1-го [5–8], так и 2-го типа [5, 9–11]. Физическая активность рекомендуется в качестве ключевого компонента образа жизни для пациентов, имеющих данное заболевание или находящихся в группе риска [12]. Однако несмотря на многочисленность экспериментальных данных, закономерности влияния физических упражнений на признаки диабета и развитие его осложнений точно не установлены, вследствие этого отсутствуют четкие критерии, позволяющие обосновать индивидуальный выбор той или иной программы физических упражнений (тип упражнений, интенсивность и длительность физической нагрузки) у пациентов с диабетом. Для выявления этих закономерностей необходим анализ не только клинических исследований, но и данных, полученных в экспериментах на животных с использованием стандартных моделей физической активности. К таким стандартным моделям относятся принудительный бег в тредбане с определенными, заранее установленными, параметрами (интенсивностью и продолжительностью) и добровольный бег в колесе, отражающий естественную активность животного [13, 14]. Показателем, характеризующим интенсивность бега, является максимальное потребление кислорода VO2max (максимальный объем кислорода, который организм может использовать из вдыхаемого воздуха за 1 мин при максимальной нагрузке). В экспериментах на животных бег в тредбане с низкой интенсивностью обычно характеризуется 30–40% VO2max (8–10 м/мин); с умеренной интенсивностью – 60–70% VO2max (15–20 м/мин) и с высокой интенсивностью – 85–90% VO2max (24–30 м/мин и более). В настоящем обзоре внимание, преимущественно, было сфокусировано на результатах экспериментов, полученных с использованием модели принудительного бега в тредбане у крыс и мышей с диабетом 1-го и 2-го типа, позволяющей оценить влияние интенсивности и длительности физической нагрузки как на развитие самого диабета, так и связанных с ним осложнений.
Развитие диабета негативно сказывается на состоянии всего организма в целом. В обзоре рассматриваются как общие, так и специфические механизмы, лежащие в основе сдерживающего влияния физической активности (бега) на развитие осложнений, вызванных диабетом. Большинство исследований сосредоточено на изучении влияния физической активности на сердечно-сосудистую, выделительную и нервную системы [6, 15–18], поскольку патологические изменения, развивающиеся в данных системах при диабете, существенно ухудшают качество жизни и представляют особую опасность для организма. Влияние физической активности на патологические изменения в желудочно-кишечном тракте при диабете является одним из наименее изученных аспектов данной проблемы. В последнее время появляется все больше исследований, демонстрирующих важную роль микробиоты в развитии диабета [19, 20]. В связи с этим изучение влияния физической активности на желудочно-кишечный тракт (ЖКТ) при диабете приобретает все большую актуальность. В настоящее время имеются данные о влиянии бега на кишечник при диабете [21], тогда как вопрос о влиянии физической активности на чувствительность слизистой оболочки желудка к действию ульцерогенных стимулов остается не изученным.
Цель обзора заключалась в анализе данных о влиянии физической активности, преимущественно бега, на развитие диабета 1-го и 2-го типа и осложнения, индуцированные этим заболеванием у животных и человека. Представленный обзор состоит из 2-х разделов: в первом анализируются данные о влиянии физической активности на развитие диабета как 1-го, так и 2-го типа; во втором разделе приводятся данные о влиянии физической активности на осложнения, индуцированные диабетом, в различных органах и тканях.
ВЛИЯНИЕ ФИЗИЧЕСКОЙ АКТИВНОСТИ НА РАЗВИТИЕ ДИАБЕТА
Несмотря на разную этиологию диабета 1-го и 2-го типа, признаки развития заболевания при разных формах диабета во многом совпадают. Основным признаком диабета и одним из главных “повреждающих” факторов является гипергликемия (рис. 1а). Гипергликемия усиливает процесс гликирования (или гликозилирования) белков (неферментативная реакция между углеводами и свободными аминогруппами белков, скорость которой пропорциональна уровню гликемии), что вызывает изменение конфигурации белков и их функциональных свойств [22]. После ряда биохимических преобразований гликированных белков образуются так называемые “конечные продукты гликирования”, которые оказывают повреждающее действие на клетки и ткани организма.
Рис. 1.
Признаки диабета и индуцированные диабетом осложнения (a). Влияние бега на признаки диабета и индуцированные диабетом осложнения (b).
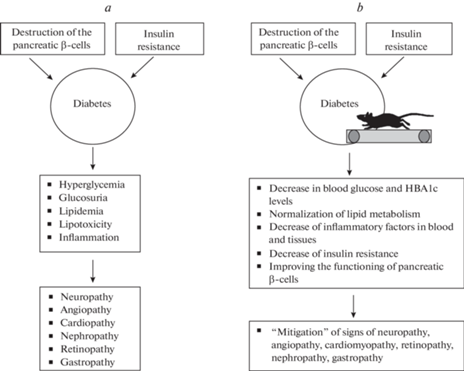
Большинство исследований свидетельствует о том, что физическая активность у животных как со стрептозотоцин-индуцированным диабетом 1-го типа, так и диабетом 2-го типа может приводить к снижению уровня глюкозы в крови, которое обнаруживается после длительного (от 2 до 8 нед.) периода ежедневных тренировок [9, 23, 24]. Этот эффект проявляется как у мышей со стрептозотоцин-индуцированным диабетом при добровольном или принудительном беге с низкой интенсивностью (10 м/мин), так и в модели диабета 2-го типа у крыс Zucker diabetic fatty (ZDF крысы) при умеренной интенсивности бега (15 м/мин, 50–70% VO2max). Однако несмотря на достоверное снижение, уровень глюкозы в крови после бега может оставаться высоким и соответствовать показателям диабета. Более того, через некоторое время, даже при продолжающихся тренировках, уровень глюкозы снова повышается и достигает исходных, зарегистрированных до начала тренировок, значений [23]. Кроме того, имеется целый ряд работ с использованием модели стрептозотоцин-индуцируемого диабета, в которых вообще не было обнаружено снижения уровня глюкозы после бега с низкой или умеренной интенсивностью, хотя при этом был показан их “смягчающий” эффект на осложнения, вызванные диабетом [25–27]. Данные о временном снижении уровня глюкозы в крови, вызванном бегом, или отсутствие этого снижения указывают на то, что даже при регулярной физической активности необходима терапия, поддерживающая нормальный уровень глюкозы в крови, в том числе и введение инсулина.
В клинических исследованиях, наряду с определением уровня глюкозы в крови “натощак”, обычно оценивают уровень гликированного гемоглобина (HbA1c), увеличение которого в крови является признаком диабета. В отличие от уровня глюкозы в крови, этот показатель является более стабильным, поскольку он отражает состояние гликемической регуляции приблизительно за 1.5–2 мес. (период полужизни эритроцита), т.е. отражает все возможные колебания уровня глюкозы за длительный срок, тогда как уровень глюкозы в крови отражает гликемию в определенный момент [28–30]. Кроме того, зависимость между уровнем HbA1c и развитием диабета не зависит от пола, возраста, индекса массы тела, принятия пищи, гипертонии или курения [30], что позволяет обнаружить признаки диабета на ранних стадиях его развития [29, 31], а также проконтролировать течение и успешность лечения данного заболевания [32, 33]. Данные, полученные при изучении влияния физических упражнений на уровень HbA1c у пациентов с диабетом, хорошо согласуются с результатами экспериментов на животных, демонстрирующих снижение уровня глюкозы после бега [9, 34–37]. Действительно, длительный бег вызывает снижение уровня HbA1c, и, следовательно, уменьшение гипергликемии у пациентов с диабетом 2-го типа, при этом падение уровня HbA1c увеличивается с ростом интенсивности бега (от умеренной к высокой) [11, 38]. В некоторых случаях физическая активность не оказывала значимого влияния на уровень глюкозы у человека, но при этом она способствовала уменьшению дозы инсулина, необходимой для стабилизации уровня глюкозы, как это было показано у пациентов с диабетом 1-го типа [39]. Эти данные свидетельствуют о позитивном влиянии физических упражнений на механизмы, поддерживающие гомеостаз глюкозы (рис. 1b).
В то же время сочетание регулярной физической активности с инсулинотерапией может приводить к чрезмерному снижению уровня глюкозы в крови (гипогликемии). Гипогликемия, развивающаяся вследствие интенсивной физической нагрузки и/или вследствие использования слишком высокой (в условиях регулярной физической активности) дозы инсулина может быть не менее опасна для пациентов с диабетом, чем гипергликемия [40]. Показано, что интенсивный бег в сочетании с подкожной имплантацией инсулина вызывает снижение уровня глюкозы в крови (ниже базального уровня) у крыс с диабетом 2-го типа, что сопровождается усилением активности симпато-адреналовой системы, повышением уровня эпинефрина и высвобождением глюкагона [35]. Подобная ситуация у пациентов с диабетом может приводить к сердечно-сосудистой патологии или усугублять ее [40]. Эти данные указывают на необходимость постоянного мониторинга уровня глюкозы для определения наиболее эффективного и безопасного сочетания инсулинотерапии и интенсивности физической нагрузки при диабете.
Наблюдаемое улучшение общего состояния диабетических животных после длительных физических упражнений при отсутствии изменений уровня глюкозы, можно объяснить множественными механизмами влияния физических нагрузок на организм, в том числе не связанными напрямую с уровнем глюкозы в крови. Один из таких механизмов может быть обусловлен влиянием физических упражнений на липидный обмен, который существенно меняется при диабете как 1-го, так и 2-го типа.
Изменение регуляции липидного обмена наблюдается уже в преддиабетических состояниях, таких как ожирение или “метаболический синдром”, при которых еще не наблюдается постоянного повышения уровня глюкозы в крови, но уже происходит увеличение толерантности к глюкозе. Основными признаками нарушения липидного обмена являются повышенные уровни общего холестерина, триглицеридов, свободных жирных кислот, холестерина липопротеинов низкой плотности в крови животных и человека. Регуляция метаболизма липидов тесно связана с регуляцией гликемии, поскольку оба процесса регулируются инсулином. Инсулин способствует синтезу липидов и липопротеинов, главным образом в жировой ткани. Дефицит инсулина или снижение чувствительности к нему приводит, напротив, к распаду липидов и выбросу жирных кислот в кровь. Ранее считалось, что основным фактором, вызывающим осложнения при диабете, является гипергликемия. Однако в последнее время пристальное внимание уделяется липидному метаболизму как одному из ключевых факторов в патологии диабета [41–44]. Липотоксичность, связанная с увеличением количества жирных кислот в крови и в тканях при диабете, может быть одной из причин инсулиновой резистентности в скелетных мышцах и дисфункции бета-клеток поджелудочной железы [45, 46]. Важным фактором в этих нарушениях является окисление жирных кислот [46]. У млекопитающих окисление жирных кислот происходит двумя различными путями: в митохондриях с образованием АТФ и в пероксисомах с образованием перекиси водорода, свободных радикалов кислорода и других продуктов перекисного окисления липидов, которые могут служить причиной клеточного повреждения, вызывая так называемый “оксидативный стресс”. При диабете 1-го и 2-го типа увеличивается окисление жирных кислот, в том числе и перекисное, и снижается активность антиоксидантных энзимов [46, 47]. Нарушение липолиза при диабете 2-го типа приводит к аккумуляции липидных капель в островках поджелудочной железы, что вызывает дисфункцию бета-клеток [48].
Показан нормализующий эффект физических упражнений на липидный метаболизм при диабете 1-го и 2-го типа как у людей, так и у животных. Обнаружено снижение уровня холестерина, триглицеридов [49–51], жирных кислот как в крови, так и в отдельных органах [45, 52], липопротеинов низкой плотности, и в то же время – повышение липопротеинов высокой плотности [50–52]. Показано, что умеренные упражнения снижают экспрессию энзимов липогенеза в печени, окисление жирных кислот в мышцах и поджелудочной железе мышей [46]. Таким образом, метаболическая дисрегуляция при диабете связана не только с гипергликемией, но также и с изменениями в системном и локальном липидном обмене. Нормализующий эффект физических упражнений на липидный метаболизм может быть одним из механизмов их благотворного влияния на осложнения при диабете
Изменение функционирования еще одной системы сопровождает развитие диабета и его осложнений, а именно иммунной системы. При диабете как 1-го, так и 2-го обнаружено увеличение уровня провоспалительных цитокинов, в том числе фактора некроза опухоли TNF-α (alpha tumor necrosis factor ), интерлейкина-6 (IL-6) как в крови, так и в отдельных тканях [53–55]. В целом, физические упражнения оказывают противовоспалительный эффект, что может быть одним из механизмов их позитивного эффекта на развитие диабета и его осложнений. Бег умеренной интенсивности (6 нед.) снижает уровень провоспалительных цитокинов в крови и в ганглии дорзальных корешков спинного мозга у крыс со стрептозотоциновой моделью диабета [55]. Плавание в течение 11 нед. (1 ч/день) уменьшает уровень TNF-α и IL-6 в крови и в бета-клетках поджелудочной железы, что, по мнению авторов, оказывает благоприятный эффект на функцию бета-клеток у ZDF крыс с диабетом 2-го типа [54]. Однако IL-6 может проявлять и противовоспалительные свойства, действуя как миокин, продуцирующийся в мышце при ее сокращении. Физическая активность (плавание 1 ч/день в течение 8 недель) увеличивает поглощение глюкозы мышечными клетками, что сопровождается значительным увеличением уровня IL-6 в крови у крыс с диабетом 1-го типа [53]. IL-6, продуцирующийся во время бега, стимулирует высвобождение противовоспалительных цитокинов (IL-10, IL-1ra (антагонист рецептора интерлейкина-1)) и подавляет продукцию провоспалительного цитокина TNF-α [56]. Благоприятное действие IL-6 при диабете может быть также связано с тем, что увеличение его количества во время упражнений стимулирует секрецию глюкагон-подобного пептида из L-клеток кишечника и альфа-клеток поджелудочной железы, что способствует увеличению секреции инсулина [57]. Авторы полагают, что этот контур регуляции следует учитывать при поисках возможностей повлиять на продукцию инсулина при диабете.
Однако несмотря на то, что большинство исследований подтверждают противовоспалительное действие бега при диабете, имеются данные, свидетельствующие о резком увеличении концентрации провоспалительных цитокинов IL-1β (в 3 раза) и TNF-α (в 2 раза) у крыс с диабетом через 24 ч после бега с высокой интенсивностью (VO2max 70%; 33 м/мин, 20 мин) [58]. Эти данные позволяют предположить, что, возможно, именно интенсивность бега определяет баланс про- и противоспалительных цитокинов при диабете.
Характерным признаком диабета является повышение активности гипоталамо-гипофизарно-адренокортикальной системы (ГГАКС). Развитие диабета приводит к хронической активации ГГАКС, о чем свидетельствует повышение базального и стрессорного уровня кортикостерона, наряду с гипертрофией надпочечников, в разные сроки после введения стрептозотоцина [59, 60]. Однако вопрос о вкладе гормонов ГГАКС в развитие диабета не изучен. Как показали наши опыты на адреналэктомированных крысах, повышенный уровень кортикостерона в крови крыс со стрептозотоцин-индуцированным диабетом может быть ответственен за катаболический эффект и, частично, за повышенный уровень глюкозы в крови [61]. Только в нескольких работах удалось найти данные об изменении уровня кортикостерона в крови крыс с диабетом 2-го типа после физической нагрузки. Было показано, что добровольный бег в течение 10 нед. у ZDF крыс предотвращает повышение уровня кортикостерона в крови, а также и уровня глюкозы, наблюдающееся у контрольных (не бегавших) крыс с диабетом [62]. Аналогичные данные получены в другой работе, в которой авторы показали, что у ZDF крыс уровень кортикостерона повышался через 2 нед. после добровольного бега, но к 4-й нед. снижался до этого показателя у контрольных крыс и сохранялся на этом уровне до конца эксперимента (11 нед.) [10]. В своих исследованиях с использованием бега в тредбане (9 м/мин, 15 мин/день) в течение двух недель мы обнаружили у бегающих крыс со стрептозотоцин-индуцированным диабетом такой же высокий уровень кортикостерона, как и у не бегающих животных (27.4 ± 1.7 мкг/дл и 31.3 ± 1.7 мкг/дл соответственно). Необходимы дальнейшие исследования для определения роли гормонов ГГАКС в развитии диабета и влияния физических нагрузок на активность этой системы.
Какие бы изменения метаболизма не сопровождали течение диабета, причина этих изменений связана с дефицитом инсулина прямым (при диабете 1-го типа) или косвенным (при диабете 2-го типа) образом. Диабет 2-го типа характеризуется резистентностью к инсулину, которая является следствием нарушения передачи сигналов инсулина через его рецепторы [63]. Поскольку большинство соматических клеток экспрессируют рецепторы к инсулину, он обладает широким спектром влияния на организм, действуя не только на метаболизм углеводов, жиров и белков, но также на транспорт ионов, клеточную пролиферацию, дифференциацию и апоптоз, на сосудистую функцию, на процессы воспаления [63, 64]. Тем не менее, основное влияние инсулина направлено на углеводный обмен, а ключевым моментом этого влияния является стимуляция транспорта глюкозы через клеточные мембраны в мышечной и жировой ткани. Транспорт глюкозы в клетки этих тканей осуществляется с помощью единственного инсулинозависимого транспортера глюкозы – GLUT4 [65, 66]. Активация инсулинового рецептора запускает внутриклеточный механизм встраивания транспортера глюкозы (GLUT4) в клеточную мембрану, посредством которого глюкоза и проникает в клетку [65, 66]. Механизм поломки этой системы, приводящей к инсулинорезистентности, пока не ясен. В клетки других тканей транспорт глюкозы осуществляется инсулин-независимыми транспортерами (GLUT1, GLUT2, GLUT3, GLUT5).
Важно отметить, что GLUT4 контролирует транспорт глюкозы в мышечную ткань не только в ответ на инсулин, но также в ответ на физическую нагрузку [66]. Показано увеличение экспрессии GLUT4-белка после 8-недельных тренировочных упражнений у пациентов с ожирением и диабетом 2-го типа [67]. Этот эффект упражнений коррелировал с увеличением поглощения глюкозы мышечной тканью и синтеза гликогена в ней, что свидетельствует об увеличении чувствительности мышц к инсулину. О снижении резистентности к инсулину после физических упражнений свидетельствуют данные, полученные в других работах, как на животных (db/db мышах при добровольном беге в течение 4 нед.), так и на людях с диабетом 2-го типа после упражнений на батуте (30 мин/день в течение 12 нед., 3 раза в нед.) [50, 51].
Физические упражнения влияют не только на резистентность к инсулину, но и на функцию бета-клеток поджелудочной железы. Так, показано, что добровольный бег мышей в течение 6 нед. значительно увеличивал содержание инсулина и его секрецию в островках Лангерганса у мышей с диабетом 1-го типа [23]. Бег малой интенсивности приводил к увеличению площади инсулин-иммунореактивных бета-клеток поджелудочной железы у крыс с диабетом 1-го типа [24]. Обнаружен положительный эффект бега на функцию бета-клеток поджелудочной железы у крыс с диабетом 2-го типа [10, 68]. У контрольных крыс (не бегающие крысы с диабетом) показано снижение мРНК инсулина и запасов инсулина в бета-клетках, добровольный бег в течение 6 нед. предотвращал это снижение [10]. Авторы считают, что поддержание функции бета-клеток путем физической активности при диабете 2-го типа нужно для компенсации инсулиновой резистентности. Длительный предварительный бег у крыс до введения стрептозотоцина значительно снижал разрушение бета-клеток поджелудочной железы, которое происходило после его введения у не бегающих крыс [47].
Таким образом, физическая активность оказывает позитивное влияние на основные показатели развития диабета 1-го и 2-го типа как у животных, так и у людей: снижается содержание гликированного гемоглобина, улучшаются показатели липидного обмена, снижаются показатели воспалительного процесса, повышается чувствительность к инсулину, улучшается функция бета-клеток поджелудочной железы. Тем не менее, и люди, и животные с диабетом 2-го типа более чувствительны к положительному влиянию бега, чем представители с диабетом 1-го типа [9, 10, 26, 27, 38, 39]. Наблюдаемое действие физических упражнений во многом зависит от их интенсивности и длительности, от типа упражнений и других условий эксперимента.
ВЛИЯНИЕ БЕГА НА ОСЛОЖЕНИЯ, ИНДУЦИРОВАННЫЕ ДИАБЕТОМ
Развитие диабета оказывает негативное влияние на функционирование всех жизненно важных систем организма [69]. Длительная гипергликемия вызывает патологические изменения в нервной системе, сердечно-сосудистой системе, почках и сетчатке (рис. 1а). Каскад метаболических нарушений, вызванных гипергликемией, приводит, в конечном счете, к высвобождению провоспалительных цитокинов и активных форм кислорода, действие которых вызывает повреждение нервов и кровеносных сосудов [70, 71]. Нарушение гемостаза при диабете, характеризующееся повышенным уровнем факторов коагуляции в плазме и снижением активности антикоагуляционной системы, приводит к тромбозам, нарушению микроциркуляции и развитию сосудистых осложнений [72]. Наряду с гипергликемией, нарушение системного и локального липидного обмена также вносит вклад в патогенез осложнений при диабете [46, 47], а в некоторых случаях может иметь ключевое значение для их развития [43, 44, 73]. Повышение уровня триглицеридов, общего холестерина и холестерина липопротеинов низкой плотности вызывает повреждение эндотелиальных клеток и, как следствие, нарушение микроциркуляции [74, 75]. Осложнения диабета принято делить на микрососудистые, которые включают повреждения нервной системы (нейропатия), почек (нефропатия), сетчатки (ретинопатия), и макрососудистые осложнения, включающие сердечно-сосудистые заболевания, инсульт и заболевания периферических сосудов [76].
Клинические исследования свидетельствуют о необходимости физической активности, особенно бега, для профилактики и лечения осложнений при диабете [77, 78]. Однако вопросы, касающиеся специфичности эффектов бега на различные системы и органы при диабете, зависимость терапевтического эффекта бега от его интенсивности, длительности и стадии развития диабета остаются до конца не выясненными, что затрудняет использование физической активности для лечения осложнений диабета и требует дополнительного изучения в экспериментах на животных. В большинстве исследований при изучении влияния физической активности на осложнения, вызванные диабетом, использовалась модель принудительного бега, позволяющая варьировать интенсивность и длительность бега.
Одним из наиболее распространенных осложнений диабета является диабетическая нейропатия (поражение периферической нервной системы), развивающаяся вследствие ишемии и метаболических нарушений в нерве и микрососудах [79, 80]. Следствием этих патологических процессов является изменение соматической и проприоцептивной чувствительности, истончение и ослабление мышц голени и стопы, что приводит к двигательным нарушениям.
Повреждениям, развивающимся при диабетической нейропатии, предшествует снижение уровня липидов, входящих в состав миелина, которое происходит в периферических нервах, дорсальных корешках спинного мозга, спинном и головном мозге на ранних стадиях развития диабета у Leprdb (db/db) мышей, имеющих аутосомно-рецессивную мутацию в гене рецептора лептина [81]. Показано, что дефицит липидов, входящих в состав митохондриальной мембраны – кардиолипина и миелина, не зависит от гипергликемии или инсулинорезистентности и обусловлен нарушением липидного обмена, это свидетельствует в пользу того, что дисрегуляция липидного метаболизма может играть ключевую роль в патогенезе диабетической нейропатии [81, 82]. Физическая активность, включающая бег, уменьшает липотоксичность и воспалительные эффекты гиперлипидемии и ожирения, что, в свою очередь, препятствует повреждению нервов и развитию диабетической нейропатии [15].
Физическая активность (бег) улучшает состояние поврежденных при диабете нервов. Бег в тредбане с низкой интенсивностью в течение 4 нед. уменьшал патологические изменения в седалищном нерве, вызванные разрушением миелина у крыс с диабетом, индуцированным стрептозотоцином (40 мг/кг) [24]. Повреждение нервных волокон при диабете приводит к нарушению их функционирования, о чем свидетельствует уменьшение амплитуды потенциала действия, вызванного электростимуляцией чувствительного нерва у крыс со стрептозотоцин-индуцированным диабетом [83]. Умеренный бег (10–20 м/мин, 60 мин/день, 6–8 нед.) способствует сохранению проводящей функции нерва: уменьшает снижение амплитуды потенциала действия у крыс с диабетом [83]. Защитное действие бега при диабетической нейропатии, возможно, опосредуется белками теплового шока, которые вовлекаются в нейропротекцию и могут вносить вклад в регенерацию поврежденных нервов, о чем свидетельствует вызванное бегом увеличение экспрессии белков теплового шока (HSP70 и Hsp72) в ганглиях дорсальных корешков, периферическом нерве и спинном мозге при диабете, индуцированном стрептозотоцином [55, 84].
Клиническим проявлением диабетической нейропатии является хроническая боль. Лечение нейропатической боли фармакологическими методами не всегда эффективно, что стимулирует поиск других нефармакологических подходов. Данные, полученные в экспериментах на животных, свидетельствуют о том, что физическая активность может использоваться в качестве дополнительного немедикаментозного подхода при лечении нейропатической боли [85]. Показано, что бег в тредбане уменьшает нейропатическую боль и задерживает ее возникновение в условиях диабета. Так, у бегавших в тредбане (20 м/мин, 60 мин, 8 нед.) крыс с диабетом, индуцированным стрептозотоцином (65 мг/кг), признаки нейропатической боли: тактильная аллодиния (проявление болевой реакции на действие “не болевых” в норме механических стимулов) и термическая гипералгезия (усиление чувствительности к действию термического болевого стимула) наблюдались на 21-й и 56-й дни после начала тренировок, тогда как у небегавших диабетических крыс эти признаки развивались через 14 дней [84]. Дополнительное введение инсулина, нормализующее уровень глюкозы, усиливало эффект бега и предотвращало развитие термической гипералгезии [84], что свидетельствует в пользу сочетания инсулиновой терапии и физической активности при лечении осложнений диабета.
Развитие нейропатической боли при диабете сопровождается увеличением уровня провоспалительных цитокинов в ганглиях дорсальных корешков, спинном мозге и периферических нервах. Умеренный бег в течение 4–6 нед. (10 м/мин) восстанавливает баланс про- и противовоспалительных цитокинов, что сопровождается уменьшением воспаления и нейропатической боли. Показано, что бег, с одной стороны, уменьшает уровень провоспалительных цитокинов (IL-1b, IL-6 и TNF-α) и их рецепторов в ганглии дорсальных корешках спинного мозга [55, 86], а с другой стороны, увеличивает экспрессию противовоспалительных цитокинов (IL10) в спинном мозге у крыс с диабетом, индуцированным стрептозотоцином (50–60 мг/кг) [83]. Кроме того, бег увеличивает уровень опиоидных пептидов (энкефалина) в ганглиях дорсальных корешков и уменьшает экспрессию потенциал-зависимых ионных каналов TRPM8 и TRPV1, вовлекающихся в развитие термической аллодинии и гипералгезии у крыс со стрептозотоцин-индуцированным диабетом, что также препятствует развитию воспаления и нейропатической боли [55, 83]. В то же время интенсивный бег при увеличении скорости беговой дорожки в течение 20 мин до уровня VO2max 70% (35 м/мин) может оказывать неблагоприятное воздействие и приводить к сдвигу баланса в сторону воспаления [58], тем самым, наоборот, усиливая нейропатическую боль при стрептозотоцин-индуцированном диабете.
Усиление нейропатической боли при диабете может быть обусловлено чрезмерной механической нагрузкой на конечности [87]. Объясняется это нарушением реактивности микрососудов на внешние механические воздействия и повышенной чувствительностью поврежденных периферических нервов к механическим стимулам [88]. Увеличение механической нагрузки на передние лапы в тредбане (24 м/мин, 3 ч/день, 12 нед.) у крыс со стрептозотоцин-индуцированным диабетом приводило к усилению у них механической аллодинии, что сопровождалось усилением дегенерации нервных волокон (уменьшением их плотности) в передних лапах [89].
Таким образом, чрезмерная физическая активность может усугублять симптомы диабетической нейропатии, способствовать травматизации мягких тканей стопы и возникновению язв на поздних стадиях развития диабета, тогда как умеренные нагрузки могут быть полезны и не только облегчать нейропатическую боль при диабете, но и оказывать позитивное влияние на двигательные функции.
Одним из широко распространенных осложнений при диабете является диабетическая ретинопатия, характеризующаяся повреждением клеток эндотелия сосудов сетчатки и ишемией сетчатки [90]. Бег в тредбане с низкой интенсивностью (8 м/мин, 20 мин, 1 нед.) уменьшает апоптоз в сетчатке у крыс с диабетом, индуцированным стрептозотоцином (50 мг/кг), экспрессию фактора роста эндотелия сосудов VEGF (vascular endothelial growth factor), избыточный уровень которого приводит к нарушению проницаемости сосудов, окклюзии капилляров и неоваскуляризации сетчатки (разрастание сосудов сетчатки, вызывающее ухудшение зрения) [91]. О позитивном действии бега при ретинопатии свидетельствует улучшение функциональных характеристик сетчатки, которые оценивались с помощью электроретинограммы, и оптомоторных реакций, тестируемых с помощью виртуальной оптокинетической системы у крыс с диабетом, индуцированным стрептозотоцином (100 мг/кг), после умеренного бега в тредбане (15 м/мин, 30 мин, 8 нед.) [26, 92]. Несмотря на то, что у пациентов с диабетом 2-го типа была обнаружена зависимость между развитием ретинопатии и содержанием липопротеидов высокой плотности [93], данные о влиянии бега на гиперлипидемию при диабетической ретинопатии отсутствуют.
Проблема сердечно-сосудистых осложнений занимает одно из центральных мест в исследованиях, посвященных диабету. Диабетическая кардиомиопатия, характеризующаяся структурными и молекулярными изменениями миокарда, ведущими к развитию сердечной недостаточности, относится к числу наиболее опасных осложнений при диабете. Последние исследования показывают, что 30–40% пациентов с сердечной недостаточностью имеют диабет [94].
Важную роль в развитии диабетической кардиомиопатии играет дисбаланс про- и антиангиогенных факторов. При диабете происходит, с одной стороны, уменьшение экспрессии проангиогенных факторов, регулирующих взаимодействие клеток друг с другом и компонентами внутриклеточного матрикса, активацию, миграцию и пролиферацию эндотелиальных клеток, а с другой стороны, увеличение экспрессии антиангиогенных факторов. Следствием этого дисбаланса является фиброз и снижение плотности капилляров в левом желудочке. Однако умеренный бег в течение 8 нед. со скоростью, соответствующей 50–60% VO2max, предотвращал эти патологические изменения у крыс с диабетом, индуцированным двухнедельной диетой с высоким содержанием жира (58% жира, 25% белка, 17% углеводов) с последующим введением стрептозотоцина (35 мг/кг) [16].
Проявлением диабетической кардиомиопатии является гипертрофия левого желудочка, сопровождающаяся систолической (снижение сократительной способности желудочка с уменьшением сердечного выброса) и диастолической дисфункцией (снижение расслабления, растяжимости и наполнения желудочка кровью) [95]. Бег в тредбане (10–11 м/мин, 350 м, 5 нед.) улучшал сократительные свойства кардиомиоцитов у db/db мышей: предотвращал дефицит коннексина 43, повышающего межклеточное взаимодействие и сцепление миоцитов [96]. Восстановление сократительных свойств кардиомиоцитов уменьшало функциональные нарушения, вызванные диабетом у бегавших db/db мышей и крыс с диабетом, индуцированным содержанием на диете, включающей 30% жира и 20% фруктозы, в течение 16 нед. [96, 97]. Трансторакальная эхокардиография левого желудочка показала увеличение как фракции выброса (отношение объема крови, перекачиваемой из левого желудочка за удар к объему крови в левом желудочке в конце диастолического наполнения (EF)), так и фракции укорочения размера левого желудочка (общее количество крови, выбрасываемой при каждом сокращении (FS)), свидетельствующее об уменьшении сердечной дисфункции, вызванной у db/db мышей [96].
Ключевым фактором развития сердечной недостаточности при диабете является ремоделирование левого желудочка – нарушение структуры желудочка, влекущее за собой изменение его “геометрии”, увеличение массы миокарда и дилатацию полостей (увеличение объема камеры без изменения толщины сердечной стенки). Бег в тредбане (13 м/мин, 40 мин/день, 4 нед.) устранял ремоделирование левого желудочка и восстанавливал его нормальную “геометрию” и содержание коллагена у крыс с диабетом, индуцированным стрептозотоцином (40 мг/кг) [98].
Действие бега на сердечно-сосудистые функции при диабете является наиболее эффективным на ранних стадиях развития патологии и проявляется независимо от его интенсивности. Бег в тредбане как умеренный (9–13 м/мин, 65–70% VO2max, наклон 10°), так и интенсивный (12–15 м/мин, 85–90% VO2max, наклон 10°) в течение 8 нед. предотвращал начало коронарной и сердечной дисфункции у db/db мышей 8-недельного возраста с признаками диабета [99]. Однако если тренировки начинали позже, в 16-недельном возрасте, когда у мышей уже была выявлена систолическая и диастолическая дисфункция и структурное ремоделирование сердца, устранение патологических изменений наблюдалось только после интенсивного бега [72, 99, 100]. Важно подчеркнуть, что режим бега, при котором осуществляется чередование кратковременного бега с высокой и низкой интенсивностью (85–90% VO2max, 3 мин, затем 1 мин 30–35% VO2max), в большей степени улучшает функции миокарда (увеличивает EF% и FS%) по сравнению с непрерывным продолжительным бегом с одной и той же скоростью, соответствующей умеренной интенсивности бега (60% VO2max, 30 мин) у крыс как с диабетом, индуцированным стрептозотоцином (55 мг/кг), так и диабетом, индуцированным длительным содержанием крыс на высококалорийной диете [97, 101, 102]. Эти данные свидетельствуют о том, что активация некоторых защитных механизмов при беге происходит только при его высокой интенсивности.
Развитие диабета приводит к нарушению вегетативного контроля сердечно-сосудистой системы, что проявляется в снижении активности парасимпатических эфферентов, повышении симпатического тонуса сосудов и уменьшении чувствительности барорецепторов [103]. В условиях умеренной гликемии (9–17 мM) у крыс c диабетом наблюдалось уменьшение частоты сердечных сокращений, нарушение барорефлекса, которое было особенно ярко выражено при брадикардии, а также повышенный симпатический тонус сосудов, о чем свидетельствовало резкое падение артериального давления после введения блокатора альфа-1-адренергических рецепторов крысам с диабетом, индуцированным многократным введением стрептозотоцина (20 мг/кг) [34]. В то же время у крыс с диабетом, бегавших в тредбане в течение 10 нед. (27 м/мин, 1 ч/день, наклон 6°), эти патологические изменения отсутствовали [34].
Ранним симптомом сердечно-сосудистой патологии при диабете является уменьшение вариабельности сердечного ритма HRV (Heart Rate Variability) – изменение интервала между началами двух соседних сердечных циклов. Анализ высокочастотных (отражающих парасимпатическую активность) и низкочастотных (отражающих симпатическую активность) компонентов HRV и их соотношения свидетельствует о дисбалансе активности симпатической и парасимпатической систем при диабете. У крыс с диабетом, индуцированным стрептозотоцином (45 мг/кг), наблюдалось угнетение активности парасимпатической (вагусной) системы и преобладание активности симпатической нервной системы. Однако интенсивный бег в тредбане (конечная скорость и длительность бега составляли 24–27 м/мин, 1 ч/день, наклон 6°–10°) в течение 8–10 нед. приводил к смещению баланса в сторону увеличения парасимпатической активности [27, 34]. Таким образом, интенсивный бег может улучшать сердечно-сосудистые показатели при диабете. Важно подчеркнуть, что улучшение сердечно-сосудистых показателей, вызванное бегом, не зависело от модели и типа диабета и проявлялось как при диабете, индуцированном стрептозотоцином [98], так и в генетической модели диабета 2-го типа у db/db мышей [99].
Диабетическая нефропатия характеризуется постепенным снижением фильтрационной способности почек, развивающейся вследствие морфологических и структурных изменений в клубочках и канальцах (разрастание соединительной ткани между капиллярами клубочка, склероз кровеносных сосудов, утолщение базальной мембраны клубочков и потеря ее селективных свойств). Важную роль в патогенезе данного заболевания, наряду с длительной гипергликемией, играют высокое артериальное давление и нарушение липидного метаболизма [104].
Бег в тредбане оказывает ренопротективное действие: он ослабляет гломерулосклероз, уменьшает гипертрофию клубочков и тубулоинтерстициальные повреждения. Защитное действие бега проявляется в моделях диабета 1-го и 2-го типа как у крыс с диабетом, индуцированным стрептозотоцином (40 мг/кг) [6, 17], так и у крыс с диабетом, индуцированным диетой с высоким содержанием жира в сочетании с последующим введением стрептозотоцина (30 мг/кг), а также у ZDF крыс [9, 18], что сопровождается уменьшением глюкозурии, протеинурии (альбуминоурии), экспрессии фибронектина и коллагена IV и TGF-β1 (transforming growth factor beta 1) трансформирующего фактора роста бета 1. Несмотря на то, что большинство экспериментальных данных, полученных на крысах со стрептозотоцин-индуцированным диабетом, ZDF крысах и db/db мышах, демонстрирует замедление развития диабетической нефропатии и ее ослабление после бега [105–108], в некоторых случаях этого не происходит. Так, у мышей линии BTBR с ob/ob (с генетически обусловленным дефицитом лептина), характеризующихся наличием признаков диабета 2-го типа (гипергликемией, ожирением и гиперлипидемией) и прогрессирующим развитием диабетической нефропатии, не было обнаружено влияния бега на патологические изменения в почках даже после 20-недельного бега (конечная скорость 10 м/мин, 1 ч/день) в тредбане [109], что, возможно, объясняется как генетическими особенностями данной линии, так и низкой интенсивностью бега.
Роль гиперлипидемии в развитии диабетической нефропатии менее исследована по сравнению с гипергликемией. Однако имеются данные, свидетельствующие о том, что с повышенным уровнем глюкозы связано лишь начало поражения почек, тогда как ведущую роль в развитии данного заболевания играют гипертриглицеридемия и низкий уровень липопротеинов высокой плотности [110]. Предполагается, что гиперлипидемия приводит к повреждению эндотелиальных клеток клубочков и отложению липидов в мезангиальной ткани, что ведет к развитию гломерулосклероза, расширению мезангиального матрикса и повреждению митохондрий [74]. Однако данные о роли гиперлипидемии в развитии диабетической нефропатии неоднозначны. Бег в тредбане уменьшает уровень триглицеридов в сыворотке крови, экспрессию провоспалительных цитокинов и накопление липидов в печени и почках у мышей, содержащихся на диете с высоким содержанием жиров [111, 112]. Однако устранение повышенного уровня триглицеридов не уменьшало протеинурию и другие проявления диабетической нефропатии, включая потерю подоцитов, клеток, покрывающих капилляры клубочков [113]. В то же время введение лептина мышам BTBR ob/ob с признаками диабета 2-го типа, нормализующее липидный обмен, приводило к устранению морфологических и функциональных проявлений диабетической нефропатии. Эти данные, с одной стороны, указывают на необходимость дальнейшего изучения влияния нарушений липидного обмена на развитие диабетической нефропатии, а с другой, свидетельствуют о возможном сочетании гиполипидемической терапии, включающей бег, и с иными средствами лечения диабетической нефропатии.
Терапевтический эффект бега на функцию почек усиливается, если бег инициируется еще до индукции диабета (введение стрептозотоцина) [6, 36]. Так, бег в тредбане (интенсивность бега увеличивалась в течение 20 мин до 70% VO2max) в течение 4-х нед., предшествующих введению стрептозотоцина (40 мг/кг), и затем в течение 8-ми нед. после индукции диабета, предотвращает тубулоинтерстициальное поражение почек по сравнению с крысами, которые начали бегать после индукции диабета [17]. Следует отметить, что при этом только у предварительно тренированных крыс с диабетом наблюдалось увеличение массы тела, снижение экспрессии транскрипционного фактора NF-κB, контролирующего экспрессию генов иммунного ответа, и увеличение в моче и почках уровня NO, с которым связан один из возможных защитных механизмов бега при диабетической нефропатии [6, 36, 114]. Эти данные хорошо согласуются с результатами исследований о защитном прекондиционирующем действии бега (в течение 4-х нед. с постепенным увеличением интенсивности и длительности) при поражении почек, вызванном ишемией/реперфузией (пережатие почечных артерий в течение 45 мин), о чем свидетельствует уменьшение уровня креатинина в моче и плазме и уменьшение структурных изменений в почечных канальцах и интерстициального отека [115]. Возможно, что эти позитивные эффекты прекондиционирующего бега проявляются и при нарушении кровотока в условиях диабета.
Действие бега на нефропатию, как и на другие осложнения при диабете, зависит от его интенсивности. Большинство исследований подтверждают позитивное действие умеренного бега, который может не только ослаблять, но даже предотвращать альбуминурию/протеинурию у крыс со стрептозотоцин-индуцированным диабетом и восстанавливать окислительный баланс [36, 116, 117]. В то же время интенсивный бег (30 м/мин, 1 ч/день, 10 нед.) может усугублять поражение почек у крыс с признаками диабета 2-го типа и увеличивать протеинурию [118, 119]. Сравнение эффектов бега с различной интенсивностью в течение 1 нед. на развитие нефропатии в одной и той же модели диабета, вызванного длительным содержанием крыс на диете с высоким содержанием жира и последующим введением стрептозотоцина (30 мг/кг), показало, что защитный эффект проявляется только при умеренном (15 м/мин, наклон 5°) или интенсивном беге (20 м/мин, наклон 10°), тогда как действие бега с низкой интенсивностью (8 м/мин, наклон 0°) не было эффективным [18]. Действительно, только при умеренном и интенсивном (для данной модели) беге наблюдалось снижение уровня воспалительных цитокинов IL‑6 и TNF‑α и уменьшение поражения почечных канальцев и клубочков [18]. Таким образом, “смягчение” признаков нефропатии, вызванное бегом, проявлялось в моделях диабета как 1-го, так и 2-го типа: в условиях стрептозотоцин-индуцированного диабета [6, 17]; диабета, индуцированного длительной высококалорийной диетой в сочетании с небольшой дозой стрептозотоцина [18], а также в генетических моделях диабета у крыс [9, 107] и мышей [105]. В то же время у ob/ob мышей с признаками диабета 2-го типа не было обнаружено влияния бега на нефропатию [109], что, возможно, было обусловлено недостаточной интенсивностью бега, используемой в данной модели.
Влияние физической активности на желудочно-кишечный тракт при диабете наименее исследовано по сравнению с другими системами. Гипергликемия нарушает целостность плотных контактов между эпителиальными клетками кишечника у мышей с диабетом, увеличивая проницаемость кишечного барьера, что, в свою очередь, способствует активации иммунной системы и воспалению [69]. Введение инсулина устраняет дисфункцию кишечного барьера и предотвращает распространение инфекции у мышей со стрептозотоцин-индуцированным диабетом [120]. Изменение микробиоты кишечника может индуцировать диабет 2-го типа или вызывать его усугубление [121], причем, широко используемый противодиабетический препарат метформин восстанавливает “здоровую” микробиоту и улучшает целостность кишечного барьера при диабете [122]. Анализ экспериментальных данных, полученных на крысах и мышах, свидетельствует о том, что бег, предшествующий индукции колита, уменьшает поражение слизистой оболочки кишечника за счет благотворного влияния на микробиоту и баланс про- и противовоспалительных цитокинов [123]. Защитное влияние физической активности на кишечник проявляется и при диабете [124]. Физические упражнения в течение 6-ти мес. вызывают уменьшение гипергликемии, что сопровождается уменьшением повышенной при диабете проницаемости кишечника и воспаления у пациентов с диабетом 2‑го типа [21]. Данные о влиянии физической активности на желудок в условиях диабета отсутствуют, поэтому мы провели собственное исследование. В экспериментах на крысах со стрептозотоцин-индуцированным диабетом было исследовано влияние бега на чувствительность слизистой оболочки желудка к ульцерогенному действию индометацина. Поскольку физические упражнения, начатые до введения стрептозотоцина и продолжающиеся после его индукции, оказывают более выраженный сдерживающий эффект на развитие диабета и его осложнений [6, 36], мы использовали эту модель в своих экспериментах: бег в тредбане был инициирован до введения стрептозотоцина (70 мг/кг) и продолжался после индукции диабета. Проведенные эксперименты подтвердили полученные нами ранее результаты [60, 61] о значительном увеличении площади эрозий слизистой оболочки желудка, вызванных введением индометацина (35 мг/кг), у крыс с диабетом по сравнению с контрольными значениями (26.6 ± 4.8 и 4.3 ± 0.8 мм2 соответственно). Ежедневный бег в тредбане в течение 7 дней до введения стрептозотоцина с постепенным увеличением интенсивности и длительности бега (от 10 до 15 см/с, от 10 до 20 мин/день) и продолжающийся еще неделю после введения стрептозотоцина приводил к достоверному снижению (p < 0.05) площади эрозий желудка у крыс с диабетом по сравнению со значением у не бегающих диабетических крыс (9.3 ± 2.1 и 26.6 ± 4.8 мм2 соответственно). Снижение площади эрозий наблюдалось и у контрольных (без диабета) бегающих крыс по сравнению с таковой у не бегающих животных (1.9 ± 0.6 и 4.3 ± 0.8 мм2). Однократный бег непосредственно перед введением индометацина уменьшил площадь эрозий у контрольных крыс, однако не повлиял на этот показатель у крыс с диабетом. Представленные результаты свидетельствуют о том, что регулярная физическая активность, предшествующая развитию диабета, оказывает защитное действие на желудок путем снижения чувствительности слизистой оболочки желудка к ульцерогенному действию индометацина.
Таким образом, физическая активность, в том числе бег, уменьшает негативное действие гипергликемии на нервную, сердечно-сосудистую, выделительную, зрительную системы и желудочно-кишечный тракт и может замедлять развитие некоторых осложнений (рис.1). Важное значение для проявления терапевтического эффекта бега имеет физическая активность, предшествующая развитию диабета, которая усиливает защитное действие бега во время развития этой патологии.
ЗАКЛЮЧЕНИЕ
Физическая активность (бег) оказывает позитивное влияние на основные показатели развития диабета как 1-го, так и 2-го типа у животных и человека: снижается содержание глюкозы и гликированного гемоглобина, улучшаются показатели липидного обмена, снижаются показатели воспалительного процесса, повышается чувствительность к инсулину, улучшается функция бета-клеток поджелудочной железы (рис. 1b)
Физическая активность (бег) оказывает сдерживающее влияние на развитие осложнений при диабете, уменьшая и замедляя патологические изменения, вызванные длительной гипергликемией, в сердце и сосудах, почках, периферических нервах и ЖКТ. Бег восстанавливает нарушение метаболизма углеводов и липидов и микроциркуляцию, уменьшает липотоксичность и воспалительные эффекты гиперлипидемии и способствует уменьшению хронической боли.
Бег оказывает как профилактическое, так и терапевтическое действие, которое усиливается, если физическая активность предшествует развитию диабета. Защитное действие бега при диабете зависит от его интенсивности и является наиболее эффективным при умеренных, наиболее безопасных нагрузках. Однако в некоторых случаях, например, при диабетической кардиопатии, как это было показано в экспериментах на животных, для проявления защитного действия бега требуется увеличение его интенсивности.
Физическая активность уменьшает дозу инсулина, необходимую для нормализации уровня глюкозы. Эти данные свидетельствуют о необходимости коррекции дозы инсулина при регулярной физической нагрузке, которая требуется для того, чтобы избежать состояния гипогликемии. В связи с этим при диабете очень важен выбор программы физической активности, который должен быть индивидуальным, поскольку характер действия упражнений у людей с диабетом зависит от возраста, пола, уровня физической подготовки, массы тела, образа жизни и даже от генетической предрасположенности к восприятию эффектов физической активности [125]. Биохимические показатели, например, изменение баланса про- и противовоспалительных цитокинов могут рассматриваться в качестве критерия адекватности данной программы и ее эффективности в отношении уменьшения признаков диабета и его осложнений.
Список литературы
Booth FW, Roberts CK, Thyfault JP, Ruegsegger GN, Toedebusch RG (2017) Role of Inactivity in Chronic Diseases: Evolutionary Insight and Pathophysiological Mechanisms. Physiol Rev 97: 1351–1402. https://doi.org/10.1152/PHYSREV.00019.2016
Williams R, Karuranga S, Malanda B, Saeedi P, Basit A, Besançon S, Bommer C, Esteghamati A, Ogurtsova K, Zhang P, Colagiuri S (2020) Global and regional estimates and projections of diabetes-related health expenditure: Results from the International Diabetes Federation Diabetes Atlas, 9th ed. Diabetes Res Clin Pract 162: 108072. https://doi.org/10.1016/J.DIABRES.2020.108072
Kennedy AJ, Ellacott KLJ, King VL, Hasty AH (2010) Mouse models of the metabolic syndrome. Disease Model Mech 3: 156–166. https://doi.org/10.1242/DMM.003467
Islam MS, Loots DT (2009) Experimental rodent models of type 2 diabetes: a review. Methods Find Exp Clin Pharmacol 31: 249–261. https://doi.org/10.1358/MF.2009.31.4.1362513
Cannata F, Vadalà G, Russo F, Papalia R, Napoli N, Pozzilli P (2020) Beneficial Effects of Physical Activity in Diabetic Patients. Funct Morphol Kinesiol 5(3):70. https://doi.org/10.3390/JFMK5030070
De Brito Amaral LS, Souza CS, Volpini RA, Shimizu MHM, De Bragança AC, Canale D, Seguro AC, Coimbra TMH, De Magalhães ACM, De Jesus Soares T (2018) Previous Exercise Training Reduces Markers of Renal Oxidative Stress and Inflammation in Streptozotocin-Induced Diabetic Female Rats. J Diabetes Res 2018: 6170352. https://doi.org/10.1155/2018/6170352
De Senna PN, Xavier LL, Bagatini PB, Saur L, Galland F, Zanotto C, Bernardi C, Nardin P, Gonçalves CA, Achaval M (2015) Physical training improves non-spatial memory, locomotor skills and the blood brain barrier in diabetic rats. Brain Res 1618: 75–82. https://doi.org/10.1016/J.BRAINRES.2015.05.026
Tikkanen-Dolenc H, Wadén J, Forsblom C, Harjutsalo V, Thorn LM, Saraheimo M, Elonen N, Rosengård-Bärlund M, Gordin D, Tikkanen HO, Groop PH (2017) Frequent and intensive physical activity reduces risk of cardiovascular events in type 1 diabetes. Diabetologia 60(3): 574–580. https://doi.org/10.1007/S00125-016-4189-8
Ito D, Cao P, Kakihana T, Sato E, Suda C, Muroya Y, Ogawa Y, Hu G, Ishii T, Ito O, Kohzuki M, Kiyomoto H (2015) Chronic Running Exercise Alleviates Early Progression of Nephropathy with Upregulation of Nitric Oxide Synthases and Suppression of Glycation in Zucker Diabetic Rats. PLoS One 10(9): e0138037. https://doi.org/10.1371/JOURNAL.PONE.0138037
Delghingaro-Augusto V, Décary S, Peyot ML, Latour MG, Lamontagne J, Paradis-Isler N, Lacharité-Lemieux M, Akakpo H, Birot O, Nolan CJ, Prentki M, Bergeron R (2012) Voluntary running exercise prevents β-cell failure in susceptible islets of the Zucker diabetic fatty rat. Am J Physiol Endocrinol Metab 302(2): E254–E264. https://doi.org/10.1152/AJPENDO.00360.2011
Sanz C, Gautier JF, Hanaire H (2010) Physical exercise for the prevention and treatment of type 2 diabetes. Diabetes Metab 36(5): 346–351. https://doi.org/10.1016/J.DIABET.2010.06.001
Zhao X, He Q, Zeng Y, Cheng L (2021) Effectiveness of combined exercise in people with type 2 diabetes and concurrent overweight/obesity: a systematic review and meta-analysis. BMJ Open 11: e046252. https://doi.org/10.1136/bmjopen-2020-046252
Pitcher MH (2018) The Impact of Exercise in Rodent Models of Chronic Pain. Curr Osteoporos Rep 16: 344–359. https://doi.org/10.1007/s11914-018-0461-9
Yarushkina NI, Komkova OP, Filaretova LP (2020) Influence of forced treadmill and voluntary wheel running on the sensitivity of gastric mucosa to ulcerogenic stimuli in male rats. J Physiol Pharmacol 71: 1–13. https://doi.org/10.26402/JPP.2020.6.04
Singleton JR, Foster-Palmer S, Marcus RL (2021) Exercise as Treatment for Neuropathy in the Setting of Diabetes and Pre-diabetic Metabolic Syndrome: a Review of Animal Models and Human Trials. Curr Diabetes Rev Sep 23. https://doi.org/10.2174/1573399817666210923125832
Yazdani F, Shahidi F, Karimi P (2020) The effect of 8 weeks of high-intensity interval training and moderate-intensity continuous training on cardiac angiogenesis factor in diabetic male rats. J Physiol Biochem 76: 291–299. https://doi.org/10.1007/S13105-020-00733-5
Amaral LS de B, Silva FA, Correia VB, Andrade CEF, Dutra BA, Oliveira M V., Magalhães AC de, Volpini RA, Seguro AC, Coimbra TM, Soares T de J (2016) Beneficial effects of previous exercise training on renal changes in streptozotocin-induced diabetic female rats. Exp Biol Med (Maywood) 241(4): 437–445. https://doi.org/10.1177/1535370215609696
Lin S, Jin S, Zhou F, Hu Y, Zhang M (2021) Effects of endurance exercise on serum inflammatory cytokine level and kidney structure in a rat diabetes model. Exp Ther Med 22(4): 1125. https://doi.org/10.3892/ETM.2021.10559
Han H, Li Y, Fang J, Liu G, Yin J, Li T, Yin Y (2018) Gut Microbiota and Type 1 Diabetes. Int J Mol Sci 19(4): 995. https://doi.org/10.3390/IJMS19040995
Scheithauer TPM, Rampanelli E, Nieuwdorp M, Vallance BA, Verchere CB, van Raalte DH, Herrema H (2020) Gut Microbiota as a Trigger for Metabolic Inflammation in Obesity and Type 2 Diabetes. Front Immunol 11: 571731. https://doi.org/10.3389/FIMMU.2020.571731
Pasini E, Corsetti G, Assanelli D, Testa C, Romano C, Dioguardi FS, Aquilani R (2019) Effects of chronic exercise on gut microbiota and intestinal barrier in human with type 2 diabetes. Minerva Med 110: 3–11. https://doi.org/10.23736/S0026-4806.18.05589-1
Cao H, Chen T, Shi Y (2015) Glycation of human serum albumin in diabetes: impacts on the structure and function. Curr Med Chem 22(1): 4–13. https://doi.org/10.2174/0929867321666140912155738
Huang HH, Farmer K, Windscheffel J, Yost K, Power M, Wright DE, Stehno-Bittel L (2011) Exercise increases insulin content and basal secretion in pancreatic islets in type 1 diabetic mice. Exp Diabetes Res 2011: 481427. https://doi.org/10.1155/2011/481427
Gulsen I, Demiroglu M, Aycan A, Ucler R, Alaca I, Orhon ZN, Kanter M (2016) Effects of Low-Intensity Treadmill Exercise on Sciatic Nerve in Experimental Diabetic Neuropathy. Anal Quant Cytopathol Histopathol 38(2): 95–102.
Kim DY, Jung SY, Kim CJ, Sung YH, Kim JD (2013) Treadmill exercise ameliorates apoptotic cell death in the retinas of diabetic rats. Mol Med Rep 7(6): 1745–1750. https://doi.org/10.3892/MMR.2013.1439
Allen RS, Hanif AM, Gogniat MA, Prall BC, Haider R, Aung MH, Prunty MC, Mees LM, Coulter MM, Motz CT, Boatright JH, Pardue MT (2018) TrkB signalling pathway mediates the protective effects of exercise in the diabetic rat retina. Eur J Neurosci 47(10): 1254–1265. https://doi.org/10.1111/EJN.13909
Nakos I, Kadoglou NPE, Gkeka P, Tzallas AT, Giannakeas N, Tsalikakis DG, Katsimpoulas M, Mantziaras G, Kostomitsopoulos N, Liapis CD, Kakisis J (2018) Exercise Training Attenuates the Development of Cardiac Autonomic Dysfunction in Diabetic Rats. In Vivo 32(6): 1433–1441. https://doi.org/10.21873/INVIVO.11396
Nawale RB, Mourya VK, Bhise SB (2006) Non-enzymatic glycation of proteins: a cause for complications in diabetes. Indian J Biochem Biophys 43(6): 337–344.
Bennett CM, Guo M, Dharmage SC (2007) HbA(1c) as a screening tool for detection of Type 2 diabetes: a systematic review. Diabetic Med 24(4): 333–343. https://doi.org/10.1111/J.1464-5491.2007.02106.X
Tatsch E, Bochi G V., Piva SJ, Pereira RS, Kober H, De Carvalho JAM, Sangoi MB, Duarte MMMF, Moresco RN (2012) Hba(1c) as a tool for the diagnosis of type 2 diabetes: comparison with fasting glucose. Clin Lab 58: 347–350.
Kim KS, Kim SK, Lee YK, Park SW, Cho YW (2008) Diagnostic value of glycated haemoglobin HbA(1c) for the early detection of diabetes in high-risk subjects. Diabetic Med 25: 997–1000. https://doi.org/10.1111/J.1464-5491.2008.02489.X
Siddiqui Z, Faisal M, Alatar AR, Ahmad S (2019) Prevalence of auto-antibodies against D-ribose-glycated-hemoglobin in diabetes mellitus. Glycobiology 29:409–418. https://doi.org/10.1093/GLYCOB/CWZ012
Qian K, Dong H, Qian J, Gong J (2020) Effect of glycosylated hemoglobin protein molecule in treating diabetes. Cell Mol Biol (Noisy-le-Grand, France) 66(5): 45–48. https://doi.org/10.14715/cmb/2020.66.5.9
Grisé KN, Olver TD, McDonald MW, Dey A, Jiang M, Lacefield JC, Shoemaker JK, Noble EG, Melling CWJ (2016) High Intensity Aerobic Exercise Training Improves Deficits of Cardiovascular Autonomic Function in a Rat Model of Type 1 Diabetes Mellitus with Moderate Hyperglycemia. J Diabetes Res 2016: 8164518. https://doi.org/10.1155/2016/8164518
McDonald MW, Murray MR, Grise KN, Dylan Olver T, Dey A, Kevin Shoemaker J, Noble EG, James Melling CW (2016) The glucoregulatory response to high-intensity aerobic exercise following training in rats with insulin-treated type 1 diabetes mellitus. Appl Physiol Nutr Metab 41(6): 631–639. https://doi.org/10.1139/APNM-2015-0558
Silva KA dos S, Luiz R da S, Rampaso RR, de Abreu NP, Moreira ÉD, Mostarda CT, de Angelis K, de Paulo Castro Teixeira V, Irigoyen MC, Schor N (2012) Previous exercise training has a beneficial effect on renal and cardiovascular function in a model of diabetes. PLoS One 7(11): e48826. https://doi.org/10.1371/JOURNAL.PONE.0048826
Chen YW, Chiu CC, Hsieh PL, Hung CH, Wang JJ (2015) Treadmill training combined with insulin suppresses diabetic nerve pain and cytokines in rat sciatic nerve. Anesth Analg 121(1): 239–246. https://doi.org/10.1213/ANE.0000000000000799
Bweir S, Al-Jarrah M, Almalty A-M, Maayah M, Smirnova I V, Novikova L, Stehno-Bittel L (2009) Resistance exercise training lowers HbA1c more than aerobic training in adults with type 2 diabetes. Diabetol Metabol Syndr 1: 27. https://doi.org/10.1186/1758-5996-1-27
D’hooge R, Hellinckx T, Van Laethem C, Stegen S, De Schepper J, Van Aken S, Dewolf D, Calders P (2011) Influence of combined aerobic and resistance training on metabolic control, cardiovascular fitness and quality of life in adolescents with type 1 diabetes: a randomized controlled trial. Clin Rehabil 25(4): 349–359. https://doi.org/10.1177/0269215510386254
Hanefeld M, Duetting E, Bramlage P (2013) Cardiac implications of hypoglycaemia in patients with diabetes – a systematic review. Cardiovasc Diabetol 12: 135. https://doi.org/10.1186/1475-2840-12-135
Eid S, Sas KM, Abcouwer SF, Feldman EL, Gardner TW, Pennathur S, Fort PE (2019) New insights into the mechanisms of diabetic complications: role of lipids and lipid metabolism. Diabetologia 62: 1539–1549. https://doi.org/10.1007/S00125-019-4959-1
Tan YM, Gao Y, Teo G, Koh HWL, Tai ES, Khoo CM, Choi KP, Zhou L, Choi H (2021) Plasma Metabolome and Lipidome Associations with Type 2 Diabetes and Diabetic Nephropathy. Metabolites 11(4): 228. https://doi.org/10.3390/METABO11040228
Mitrofanova A, Burke G, Merscher S, Fornoni A (2021) New insights into renal lipid dysmetabolism in diabetic kidney disease. World J Diabetes 12(5): 524–540. https://doi.org/10.4239/WJD.V12.I5.524
Gewin LS (2021) Sugar or Fat? Renal Tubular Metabolism Reviewed in Health and Disease. Nutrients 13(5): 1580. https://doi.org/10.3390/NU13051580
Acosta-Montaño P, Rodríguez-Velázquez E, Ibarra-López E, Frayde-Gómez H, Mas-Oliva J, Delgado-Coello B, Rivero IA, Alatorre-Meda M, Aguilera J, Guevara-Olaya L, García-González V (2019) Fatty Acid and Lipopolysaccharide Effect on Beta Cells Proteostasis and its Impact on Insulin Secretion. Cells 8: 884. https://doi.org/10.3390/CELLS8080884
Langlois A, Forterre A, Pinget M, Bouzakri K (2021) Impact of moderate exercise on fatty acid oxidation in pancreatic β-cells and skeletal muscle. J Endocrinol Invest 44(9): 1815–1825. https://doi.org/10.1007/S40618-021-01551-2
Coskun O, Ocakci A, Bayraktaroglu T, Kanter M (2004) Exercise training prevents and protects streptozotocin-induced oxidative stress and beta-cell damage in rat pancreas. The Tohoku J Exp Med 203(3): 145–154. https://doi.org/10.1620/TJEM.203.145
Liu S, Promes JA, Harata M, Mishra A, Stephens SB, Taylor EB, Burand AJ, Sivitz WI, Fink BD, Ankrum JA, Imai Y (2020) Adipose triglyceride lipase is a key lipase for the mobilization of lipid droplets in human β-cells and critical for the maintenance of syntaxin 1A levels in β-cells. Diabetes 69: 1178–1192. https://doi.org/10.2337/DB19-0951/-/DC1
Williams PT, Thompson PD (2013) Walking versus running for hypertension, cholesterol, and diabetes mellitus risk reduction. Arterioscler Thromb Vasc Biol 33: 1085–1091. https://doi.org/10.1161/ATVBAHA.112.300878
Marchianti ACN, Arimura E, Ushikai M, Horiuchi M (2014) Voluntary exercise under a food restriction condition decreases blood branched-chain amino acid levels, in addition to improvement of glucose and lipid metabolism, in db mice, animal model of type 2 diabetes. Environ Health Prev Med 19(5): 339–347. https://doi.org/10.1007/S12199-014-0400-Z
Nuhu JM, Maharaj SS (2018) Influence of a mini-trampoline rebound exercise program on insulin resistance, lipid profile and central obesity in individuals with type 2 diabetes. J Sports Med Phys Fitness 58(4): 503–509. https://doi.org/10.23736/S0022-4707.17.07120-1
Conners RT, Caputo JL, Coons JM, Fuller DK, Morgan DW (2019) Impact of Underwater Treadmill Training on Glycemic Control, Blood Lipids, and Health-Related Fitness in Adults With Type 2 Diabetes. Clin Diabetes 37: 36–43. https://doi.org/10.2337/CD17-0066
Bonyadi M, Badalzadeh R, Mohammadi M, Poozesh S, Salehi I (2009) The effect of regular training on plasma cytokines response in healthy and diabetic rats. Saudi Med J 30(11): 1390–1394. https://pubmed.ncbi.nlm.nih.gov/19882048/
Teixeira de Lemos E, Reis F, Baptista S, Pinto R, Sepodes B, Vala H, Rocha-Pereira P, Correia da Silva G, Teixeira N, Silva AS, Carvalho L, Teixeira F, Das UN (2009) Exercise training decreases proinflammatory profile in Zucker diabetic (type 2) fatty rats. Nutrition 25: 330–339. https://doi.org/10.1016/j.nut.2008.08.014
Yoon HJ, Thakur V, Isham D, Fayad M, Chattopadhyay M (2015) Moderate exercise training attenuates inflammatory mediators in DRG of Type 1 diabetic rats. Exp Neurol 267: 107–114. https://doi.org/10.1016/J.EXPNEUROL.2015.03.006
Pedersen BK (2006) The anti-inflammatory effect of exercise: its role in diabetes and cardiovascular disease control. Essays Biochem 42: 105–117. https://doi.org/10.1042/BSE0420105
Ellingsgaard H, Hauselmann I, Schuler B, Habib AM, Baggio LL, Meier DT, Eppler E, Bouzakri K, Wueest S, Muller YD, Hansen AMK, Reinecke M, Konrad D, Gassmann M, Reimann F, Halban PA, Gromada J, Drucker DJ, Gribble FM, Ehses JA, Donath MY (2011) Interleukin-6 enhances insulin secretion by increasing glucagon-like peptide-1 secretion from L cells and alpha cells. Nature Med 17: 1481–1489. https://doi.org/10.1038/NM.2513
Bortolon JR, Silva Junior AJDA, Murata GM, Newsholme P, Curi R, Pithon-Curi TC, Hatanaka E (2012) Persistence of inflammatory response to intense exercise in diabetic rats. Exp Diabetes Res 2012: 213986. https://doi.org/10.1155/2012/213986
Zelena D, Filaretova L, Mergl Z, Barna I, Tóth ZE, Makara GB (2006) Hypothalamic paraventricular nucleus, but not vasopressin, participates in chronic hyperactivity of the HPA axis in diabetic rats. Am J Physiol Endocrinol Metab 290(2): E243–E250. https://doi.org/10.1152/AJPENDO.00118.2005
Подвигина ТТ, Багаева ТР, Морозова ОЮ, Филаретова ЛП (2011) Чувствительность слизистой оболочки желудка к ульцерогеному действию индометацина в разные сроки развития стрептозотоцин-индуцируемого диабета у крыс. Рос физиол журн им ИМ Сеченова 97(9): 957–967. [Podvigina TT, Bagaeva TR, Morozova OIu, Filaretova LP (2011) Gastric mucosal susceptibility for ulcerogenic effect of indometacin at different time points of streptozotocin-induced diabetes development. Russ J Physiol 97(9): 957–967. (In Russ)].
Подвигина ТТ, Филаретова ЛП (2020) Чувствительность слизистой оболочки желудка к ульцерогенным факторам и активность гипоталамо-гипофизарно-адренокортикальной системы при развитии стрептозотоцин-индуцированного диабета. Рос физиол журн им ИМ Сеченова106(2): 176–188. [Podvigina TT, Filaretova LP (2020) The gastric mucosa sensitivity to ulcerogenic factors and the activity of the hypothalamic-pituitary-adrenocortical system in the development of streptozotocin-induced diabetes. Russ J Physiol 106(2): 176–188. (In Russ)].
Campbell JE, Király MA, Atkinson DJ, D’Souza AM, Vranic M, Riddell MC (2010) Regular exercise prevents the development of hyperglucocorticoidemia via adaptations in the brain and adrenal glands in male Zucker diabetic fatty rats. Am J Physiol Regul Integr Comp Physiol 299(1): 168–176. https://doi.org/10.1152/ajpregu.00155.2010
Iaccarino G, Franco D, Sorriento D, Strisciuglio T, Barbato E, Morisco C (2021) Modulation of Insulin Sensitivity by Exercise Training: Implications for Cardiovascular Prevention. J Cardiovasc Transl Res 14(2): 256–270. https://doi.org/10.1007/S12265-020-10057-W
Shpakov AO (2011) Signal protein-derived peptides as functional probes and regulators of intracellular signaling. J Amino Acids 2011: 1–25. https://doi.org/10.4061/2011/656051
Leto D, Saltiel AR (2012) Regulation of glucose transport by insulin: traffic control of GLUT4. Nat Rev Mol Cell Biol 13(6): 383–396. https://doi.org/10.1038/NRM3351
Klip A, McGraw TE, James DE (2019) Thirty sweet years of GLUT4. J Biol Chem 294(30): 11369–11381. https://doi.org/10.1074/JBC.REV119.008351
Christ-Roberts CY, Pratipanawatr T, Pratipanawatr W, Berria R, Belfort R, Kashyap S, Mandarino LJ (2004) Exercise training increases glycogen synthase activity and GLUT4 expression but not insulin signaling in overweight nondiabetic and type 2 diabetic subjects. Metabolism 53(9): 1233–1242. https://doi.org/10.1016/J.METABOL.2004.03.022
Király MA, Bates HE, Kaniuk NA, Yue JTY, Brumell JH, Matthews SG, Riddell MC, Vranic M (2008) Swim training prevents hyperglycemia in ZDF rats: mechanisms involved in the partial maintenance of beta-cell function. Am J Physiol Endocrin Metab 294(2): E271–E283. https://doi.org/10.1152/AJPENDO.00476.2007
Daryabor G, Atashzar MR, Kabelitz D, Meri S, Kalantar K (2020) The Effects of Type 2 Diabetes Mellitus on Organ Metabolism and the Immune System. Front Immunol 11: 1582. https://doi.org/10.3389/FIMMU.2020.01582
Papachristoforou E, Lambadiari V, Maratou E, Makrilakis K (2020) Association of Glycemic Indices (Hyperglycemia, Glucose Variability, and Hypoglycemia) with Oxidative Stress and Diabetic Complications. J Diabetes Res 2020: 7489795. https://doi.org/10.1155/2020/7489795
Maruhashi T, Higashi Y (2021) Pathophysiological Association between Diabetes Mellitus and Endothelial Dysfunction. Antioxidants (Basel) 10(8): 1306. https://doi.org/10.3390/ANTIOX10081306
Li H, Hastings MH, Rosenzweig A (2020) Exercise Training in Diabetes: Start Earlier or Exercise Harder. Circul Res 127: 1401–1403. https://doi.org/10.1161/CIRCRESAHA.120.318219
Nakamichi R, Hayashi K, Itoh H (2021) Effects of High Glucose and Lipotoxicity on Diabetic Podocytes. Nutrients 13: 1–11. https://doi.org/10.3390/NU13010241
Toma L, Stancu CS, Sima AV (2020) Endothelial Dysfunction in Diabetes Is Aggravated by Glycated Lipoproteins; Novel Molecular Therapies. Biomedicines 9: 1–28. https://doi.org/10.3390/BIOMEDICINES9010018
O’Brien ST, Neylon OM, O’Brien T (2021) Dyslipidaemia in Type 1 Diabetes: Molecular Mechanisms and Therapeutic Opportunities. Biomedicines 9(7): 826. https://doi.org/10.3390/BIOMEDICINES9070826
Deshpande AD, Harris-Hayes M, Schootman M (2008) Epidemiology of diabetes and diabetes-related complications. Phys Ther 88(11): 1254–1264. https://doi.org/10.2522/PTJ.20080020
Ahmad I, Verma S, Noohu MM, Shareef MY, Ejaz Hussain M (2020) Sensorimotor and gait training improves proprioception, nerve function, and muscular activation in patients with diabetic peripheral neuropathy: A randomized control trial. J Musculoskelet Neuronal Interact 20(2): 234–248.
Gilbertson NM, Mandelson JA, Hilovsky K, Akers JD, Hargens TA, Wenos DL, Edwards ES (2019) Combining supervised run interval training or moderate-intensity continuous training with the diabetes prevention program on clinical outcomes. Eur J Appl Physiol 119(7): 1503–1512. https://doi.org/10.1007/S00421-019-04137-2
Eftekharpour E, Fernyhough P (2021) Oxidative stress and mitochondrial dysfunction associated with peripheral neuropathy in type 1 diabetes. Antioxid Redox Signal https://doi.org/10.1089/ARS.2021.0152
Feldman EL, Callaghan BC, Pop-Busui R, Zochodne DW, Wright DE, Bennett DL, Bril V, Russell JW, Viswanathan V (2019) Diabetic neuropathy. Nat Rev Dis Primers 5(1): 42. https://doi.org/10.1038/S41572-019-0092-1
Palavicini JP, Chen J, Wang C, Wang J, Qin C, Baeuerle E, Wang X, Woo JA, Kang DE, Musi N, Dupree JL, Han X (2020) Early disruption of nerve mitochondrial and myelin lipid homeostasis in obesity-induced diabetes. JCI Insight 5(21): e137286. https://doi.org/10.1172/JCI.INSIGHT.137286
Iqbal Z, Bashir B, Ferdousi M, Kalteniece A, Alam U, Malik RA, Soran H (2021) Lipids and peripheral neuropathy. Curr Opin Lipidol 32(4):249–257. https://doi.org/10.1097/MOL.0000000000000770
Thakur V, Gonzalez M, Pennington K, Nargis S, Chattopadhyay M (2016) Effect of exercise on neurogenic inflammation in spinal cord of Type 1 diabetic rats. Brain Res 1642: 87–94. https://doi.org/10.1016/J.BRAINRES.2016.03.012
Chen YW, Hsieh PL, Chen YC, Hung CH, Cheng JT (2013) Physical exercise induces excess hsp72 expression and delays the development of hyperalgesia and allodynia in painful diabetic neuropathy rats. Anesth Analg 116(2): 482–490. https://doi.org/10.1213/ANE.0B013E318274E4A0
Senba E, Kami K (2017) A new aspect of chronic pain as a lifestyle-related disease. Neurobiol Pain 1: 6–15. https://doi.org/10.1016/j.ynpai.2017.04.003
Ma XQ, Qin J, Li HY, Yan XL, Zhao Y, Zhang LJ (2019) Role of Exercise Activity in Alleviating Neuropathic Pain in Diabetes via Inhibition of the Pro-Inflammatory Signal Pathway. Biol Res Nurs 21(1): 14–21. https://doi.org/10.1177/1099800418803175
Singh R, Kishore L, Kaur N (2014) Diabetic peripheral neuropathy: current perspective and future directions. Pharmacol Res 80: 21–35. https://doi.org/10.1016/J.PHRS.2013.12.005
Jan YK, Shen S, Foreman RD, Ennis WJ (2013) Skin blood flow response to locally applied mechanical and thermal stresses in the diabetic foot. Microvasc Res 89: 40–46. https://doi.org/10.1016/J.MVR.2013.05.004
Do JG, Noh SU, Chae SW, Yoon KJ, Lee YT (2020) Excessive walking exercise precipitates diabetic neuropathic foot pain: hind paw suspension treadmill exercise experiment in a rat model. Sci Rep 10(1): 10498. https://doi.org/10.1038/S41598-020-67601-6
Quiroz J, Yazdanyar A (2021) Animal models of diabetic retinopathy. Ann Transl Med 9(15): 1272. https://doi.org/10.21037/ATM-20-6737
Ji E-S, Ko I-G, Cho J-W, Davis RW, Hwang G-Y, Jee Y-S, Lim B-V (2013) Treadmill exercise inhibits apoptotic neuronal cell death with suppressed vascular endothelial growth factor expression in the retinas of the diabetic rats. J Exerc Rehabil 9: 348–353. https://doi.org/10.12965/JER.130043
Allen RS, Feola A, Motz CT, Ottensmeyer AL, Chesler KC, Dunn R, Thulé PM, Pardue MT (2019) Retinal Deficits Precede Cognitive and Motor Deficits in a Rat Model of Type II Diabetes. Invest Ophthalmol Vis Sci 60(1): 123–133. https://doi.org/10.1167/IOVS.18-25110
Müller M, Schönfeld CL, Grammer T, Krane V, Drechsler C, Genser B, Kohnen T, Wanner C, März W (2020) Risk factors for retinopathy in hemodialysis patients with type 2 diabetes mellitus. Sci Rep 10(1): 14158. https://doi.org/10.1038/S41598-020-70998-9
Tromp J, Voors AA, Sharma A, Ferreira JP, Ouwerkerk W, Hillege HL, Gomez KA, Dickstein K, Anker SD, Metra M, Lang CC, Ng LL, van der Harst P, van Veldhuisen DJ, van der Meer P, Lam CSP, Zannad F, Sama IE (2020) Distinct Pathological Pathways in Patients With Heart Failure and Diabetes. JACC Heart Fail 8(3): 234–242. https://doi.org/10.1016/J.JCHF.2019.11.005
Boudina S, Abel ED (2010) Diabetic cardiomyopathy, causes and effects. Rev Endocr Metab Disord 11(1): 31–39. https://doi.org/10.1007/S11154-010-9131-7
Veeranki S, Givvimani S, Kundu S, Metreveli N, Pushpakumar S, Tyagi SC (2016) Moderate intensity exercise prevents diabetic cardiomyopathy associated contractile dysfunction through restoration of mitochondrial function and connexin 43 levels in db/db mice. J Mol Cell Cardiol 92: 163–173. https://doi.org/10.1016/J.YJMCC.2016.01.023
Khakdan S, Delfan M, Heydarpour Meymeh M, Kazerouni F, Ghaedi H, Shanaki M, Kalaki-Jouybari F, Gorgani-Firuzjaee S, Rahimipour A (2020) High-intensity interval training (HIIT) effectively enhances heart function via miR-195 dependent cardiomyopathy reduction in high-fat high-fructose diet-induced diabetic rats. Arch Physiol Biochem 126(3): 250–257. https://doi.org/10.1080/13813455.2018.1511599
Silva FS, Bortolin RH, Araújo DN, Marques DES, Lima JPMS, Rezende AA, Vieira WHB, Silva NB, Medeiros KCP, Ackermann PW, Abreu BJ, Dias FAL (2017) Exercise training ameliorates matrix metalloproteinases 2 and 9 messenger RNA expression and mitigates adverse left ventricular remodeling in streptozotocin-induced diabetic rats. Cardiovasc Pathol 29: 37–44. https://doi.org/10.1016/J.CARPATH.2017.05.003
Lew JKS, Pearson JT, Saw E, Tsuchimochi H, Wei M, Ghosh N, Du CK, Zhan DY, Jin M, Umetani K, Shirai M, Katare R, Schwenke DO (2020) Exercise Regulates MicroRNAs to Preserve Coronary and Cardiac Function in the Diabetic Heart. Circ Res 127(11): 1384–1400. https://doi.org/10.1161/CIRCRESAHA.120.317604
Lew JKS, Pearson JT, Schwenke DO, Katare R (2017) Exercise mediated protection of diabetic heart through modulation of microRNA mediated molecular pathways. Cardiovasc Diabetol 16(1): 10. https://doi.org/10.1186/S12933-016-0484-4
Van Rooij E, Olson EN (2012) MicroRNA therapeutics for cardiovascular disease: opportunities and obstacles. Nat Rev Drug Discov 11(11): 860–872. https://doi.org/10.1038/NRD3864
Delfan M, Delphan M, Kordi MR, Ravasi AA, Safa M, Gorgani-Firuzjaee S, Fatemi A, Bandarian F, Nasli-Esfahani E (2020) High intensity interval training improves diabetic cardiomyopathy via miR-1 dependent suppression of cardiomyocyte apoptosis in diabetic rats. J Diabetes Metab Disord 19(1): 145–152. https://doi.org/10.1007/S40200-019-00485-0
Salgado HC, Fazan R, Fazan VPS, Dias da Silva VJ, Barreira AA (2001) Arterial baroreceptors and experimental diabetes. Ann N Y Acad Sci 940: 20–27. https://doi.org/10.1111/J.1749-6632.2001.TB03663.X
Шпаков АО, Казначеева ЕВ (2021) Подоциты и сахарный диабет: функциональные нарушения и их молекулярные механизмы. СПб. ПОЛИТЕХ-ПРЕСС [Shpakov AO, Kaznacheeva EV (2021) Podocytes and Diabetes Mellitus: Functional Disorders and Their Molecular Mechanisms SPb. POLITEKH-PRESS. (In Russ)].
Ghosh S, Khazaei M, Moien-Afshari F, Ang LS, Granville DJ, Verchere CB, Dunn SR, McCue P, Mizisin A, Sharma K, Laher I (2009) Moderate exercise attenuates caspase-3 activity, oxidative stress, and inhibits progression of diabetic renal disease in db/db mice. Am J Physiol Renal Physiol 296(4): F700–F708. https://doi.org/10.1152/AJPRENAL.90548.2008
Somineni HK, Boivin GP, Elased KM (2014) Daily exercise training protects against albuminuria and angiotensin converting enzyme 2 shedding in db/db diabetic mice. J Endocrinol 221: 235–251. https://doi.org/10.1530/JOE-13-0532
Boor P, Celec P, Behuliak M, Grančič P, Kebis A, Kukan M, Pronayová N, Liptaj T, Ostendorf T, Šebeková K (2009) Regular moderate exercise reduces advanced glycation and ameliorates early diabetic nephropathy in obese Zucker rats. Metabolism 58(11): 1669–1677. https://doi.org/10.1016/J.METABOL.2009.05.025
Lappalainen J, Oksala NKJ, Laaksonen DE, Khanna S, Kokkola T, Kaarniranta K, Sen CK, Atalay M (2018) Suppressed heat shock protein response in the kidney of exercise-trained diabetic rats. Scand J Med Sci Sports 28: 1808–1817. https://doi.org/10.1111/SMS.13079
Everaert I, He J, Hanssens M, Stautemas J, Bakker K, Albrecht T, Zhang S, Van Der Stede T, Vanhove K, Hoetker D, Howsam M, Tessier FJ, Yard B, Baba SP, Baelde HJ, Derave W (2020) Carnosinase-1 overexpression, but not aerobic exercise training, affects the development of diabetic nephropathy in BTBR ob/ob mice. Am J Physiol Renal Physiol 318: F1030–F1040. https://doi.org/10.1152/AJPRENAL.00329.2019
Russo G, Piscitelli P, Giandalia A, Viazzi F, Pontremoli R, Fioretto P, De Cosmo S (2020) Atherogenic dyslipidemia and diabetic nephropathy. J Nephrol 33(5): 1001–1008. https://doi.org/10.1007/S40620-020-00739-8
Muller CR, Américo ALV, Fiorino P, Evangelista FS (2018) Aerobic exercise training prevents kidney lipid deposition in mice fed a cafeteria diet. Life Sci 211: 140–146. https://doi.org/10.1016/J.LFS.2018.09.017
Tóth ME, Dukay B, Péter M, Balogh G, Sűcs G, Zvara Á, Szebeni GJ, Hajdu P, Sárközy M, Puskás LG, Török Z, Csont T, Vígh L, Sántha M (2021) Male and Female Animals Respond Differently to High-Fat Diet and Regular Exercise Training in a Mouse Model of Hyperlipidemia. Int J Mol Sci 22(8): 4198. https://doi.org/10.3390/IJMS22084198
Attie AD, Schueler KM, Keller MP, Mitok KA, Simonett SP, Hudkins KL, Mehrotra K, Graham MJ, Lee RG, Alpers CE (2021) Reversal of hypertriglyceridemia in diabetic BTBR ob/ob mice does not prevent nephropathy. Lab Invest 101: 935–941. https://doi.org/10.1038/S41374-021-00592-8
Oe Y, Miyazaki M, Takahashi N (2021) Coagulation, Protease-Activated Receptors, and Diabetic Kidney Disease: Lessons from eNOS-Deficient Mice. Tohoku J Exp Med 255(1): 1–8. https://doi.org/10.1620/TJEM.255.1
de Lima W V., Visona I, Schor N, Almeida WS (2019) Preconditioning by aerobic exercise reduces acute ischemic renal injury in rats. Physiol Rep 7(14): e14176. https://doi.org/10.14814/PHY2.14176
Rodrigues AM, Bergamaschi CT, Araújo RC, Mouro MG, Rosa TS, Higa EMS (2011) Effects of training and nitric oxide on diabetic nephropathy progression in type I diabetic rats. Exp Biol Med (Maywood) 236(10): 1180–1187. https://doi.org/10.1258/EBM.2011.011005
Kurdak H, Sandikçi S, Ergen N, Dogan A, Kurdak SS (2010) The effects of regular aerobic exercise on renal functions in streptozotocin induced diabetic rats. J Sports Sci Med 9: 294–299.
Gündüz F, Kuru O, Şentürk ÜK (2003) Effect of nitric oxide on exercise-induced proteinuria in rats. J Appl Physiol 95(5): 1867–1872. https://doi.org/10.1152/JAPPLPHYSIOL.00599.2003
Christensen CK (1984) Abnormal albuminuria and blood pressure rise in incipient diabetic nephropathy induced by exercise. Kidney Int 25: 819–823. https://doi.org/10.1038/KI.1984.95
Thaiss CA, Levy M, Grosheva I, Zheng D, Soffer E, Blacher E, Braverman S, Tengeler AC, Barak O, Elazar M, Ben-Zeev R, Lehavi-Regev D, Katz MN, Pevsner-Fischer M, Gertler A, Halpern Z, Harmelin A, Aamar S, Serradas P, Grosfeld A, Shapiro H, Geiger B, Elinav E (2018) Hyperglycemia drives intestinal barrier dysfunction and risk for enteric infection. Science (New York) 359: 1376–1383. https://doi.org/10.1126/SCIENCE.AAR3318
Adeshirlarijaney A, Gewirtz AT (2020) Considering gut microbiota in treatment of type 2 diabetes mellitus. Gut Microbes 11: 253–264. https://doi.org/10.1080/19490976.2020.1717719
Ouyang J, Isnard S, Lin J, Fombuena B, Marette A, Routy B, Chen Y, Routy JP (2020) Metformin effect on gut microbiota: insights for HIV-related inflammation. AIDS Res Ther 17(1): 10. https://doi.org/10.1186/S12981-020-00267-2
Ярушкина НИ, Шульга ПМ, Филаретова ЛП (2021) Влияние бега на желудочно-кишечный тракт. Успехи физиол наук 52(4): 18–32. [Yarushkina NI, Shulga PM, Filaretova LP (2021) Effect of Running on the Gastrointestinal Tract. Usp Fiziol Nauk 52(4):18–32. (In Russ)].
Codella R, Luzi L, Terruzzi I (2018) Exercise has the guts: How physical activity may positively modulate gut microbiota in chronic and immune-based diseases. Dig Liver Dis 50(4): 331–341. https://doi.org/10.1016/J.DLD.2017.11.016
Bouchard C, Antunes-Correa LM, Ashley EA, Franklin N, Hwang PM, Mattsson CM, Negrao CE, Phillips SA, Sarzynski MA, Wang P-Y, Wheeler MT (2015) Personalized preventive medicine: genetics and the response to regular exercise in preventive interventions. Prog Cardiovasc Dis 57(4): 337–346. https://doi.org/10.1016/J.PCAD.2014.08.005
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


