Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 2, стр. 157-169
Анализ экспрессии амилоид-деградирующего фермента неприлизина в структурах мозга трансгенных мышей линии 5xFAD
Д. С. Васильев 1, Н. М. Дубровская 1, Н. Л. Туманова 1, Н. Н. Наливаева 1, *
1 Институт эволюционной физиологии и биохимии им. И.M. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: natalia.nalivaeva@outlook.com
Поступила в редакцию 01.12.2021
После доработки 20.12.2021
Принята к публикации 21.12.2021
- EDN: RSOCMV
- DOI: 10.31857/S0869813922020108
Аннотация
Неприлизин (НЕП) представляет собой нейропептидазу, участвующую в передаче различных нейрональных стимулов. Он также является основным ферментом, расщепляющим амилоидный Aβ пептид в ткани мозга, и его дефицит может приводить к нейродегенерации и развитию болезни Альцгеймера (БА). Как мы недавно показали на крысах, НЕП высоко экспрессируется в обонятельных луковицах, и снижение уровня его экспрессии в структурах мозга, участвующих в обонянии, коррелируют с нарушением обонятельной функции. В данном исследовании мы провели анализ экспрессии НЕП в структурах мозга взрослых трансгенных мышей линии 5xFAD – общепринятой модели БА, у которых с возрастом имеет место существенное накопление Aβ по сравнению с мышами дикого типа С57Bl. Мы обнаружили, что у мышей С57Bl, как и у крыс, самые высокие уровни мРНК НЕП приходятся на стриатум (Str) и обонятельные луковицы (OB), тогда как в энторинальной коре (EC), теменной коре (PC) и гиппокампе (Hip) они примерно в 5 раз ниже, чем в Str. У мышей линии 5xFAD уровни мРНК НЕП в Str и OB не отличались от животных дикого типа, тогда как в EC, PC и Hip они были ниже примерно на 30%. Снижение экспрессии НЕП в EC, PC и Hip у мышей линии 5xFAD коррелировало с накоплением Aβ, нарушением памяти (тест водного лабиринта Морриса) и обоняния (тест на предпочтение запаха) по сравнению с мышами дикого типа. Наши данные подтверждают предположение о том, что нарушение обонятельной функции, характерное для БА, может быть связано со снижением экспрессии НЕП в структурах мозга, проводящих обонятельные стимулы, в частности, в EC и Hip.
Хорошо известно, что развитие нейродегенеративных расстройств, таких как болезни Паркинсона, Хантингтона и Альцгеймера (БА), часто сопровождается ухудшением восприятия запахов, которое нередко предшествует появлению когнитивных нарушений или других симптомов заболевания [1–3]. Это также было подтверждено на зоотропных моделях нейродегенеративных расстройств [4], в частности, БA [5]. В нашем предыдущем исследовании мы обнаружили, что у крыс нарушение обонятельной функции коррелирует со снижением уровня экспрессии нейропептидазы неприлизина (EC3.4.24.11, нейтральная эндопептидаза, НЕП) [6]. Снижение уровня мРНК НЕП в обонятельных луковицах в процессе старения или в гиппокампе, энторинальной и теменной коре у молодых крыс после пренатальной гипоксии приводило к нарушению предпочтения запаха и эффективности поиска пищи [6].
НЕП является основным ферментом, расщепляющим амилоидный пептид в ткани мозга [7, 8], и дефицит его содержания или подавление его активности приводит к накоплению амилоидного Aβ пептида (Aβ) и образованию в мозге амилоидных бляшек, которые являются отличительной чертой БA [9, 10]. Хотя роль НЕП в патогенезе БА изучена достаточно широко, до сих пор сведения о его участии в событиях, приводящих к нарушению обоняния, весьма малочисленны. О возможном участии НЕП в нарушении обоняния при БА косвенно свидетельствует снижение уровня одного из его субстратов, соматостатина, в переднем обонятельном ядре пациентов с БА [11]. Поскольку соматостатин регулирует экспрессию НЕП, было высказано предположение, что повышение Aβ в мозге пациентов с БА может быть связано со снижением экспрессии и активности НЕП, спровоцированным снижением уровня соматостатина [12]. Есть также данные, свидетельствующие, что интраназальное введение фосфорамидона (ингибитора НЕП и эндотелин-конвертирующего фермента (ЕСЕ-1)) приводило к значительному повышению уровня Aβ в мозге мышей дикого типа. Этот эффект был еще более выражен, когда ингибитор вводили мышам, у которых отсутствовали гены НЕП и его гомолога НЕП2, что свидетельствует также о роли ЕСЕ-1 в расщеплении Aβ [13].
Трансгенные мыши линии 5xFAD представляют собой одну из моделей животных, которая, реплицируя характерные признаки БА, широко используется в научных исследованиях. Эти мыши экспрессируют мутантные гены человека, содержащие пять мутаций, характерных для семейных форм БА, в частности шведской (K670N, M671L), флоридской (I716V) и лондонской (V717I) мутаций в белке-предшественнике амилоида (APP) и M146L и L286V мутациями в белке пресенилине 1 (PS1), являющегося частью γ-секретазного комплекса, участвующего в амилоидогенном процессинге АРР [14]. Эти мыши характеризуются накоплением наиболее токсичной формы амилоидного пептида Aβ42, которая быстро агрегирует, начиная с 1.5-месячного возраста, что приводит к развитию когнитивных нарушений [14, 15] и двигательного дефицита у мышей в процессе старения [16]. Имеются противоречивые данные о состоянии обоняния у мышей линии 5xFAD. Так, некоторые авторы сообщали об отсутствии у этих мышей дефицита обонятельной памяти [15, 17], в то время как другие исследователи показывали накопление Aβ в сенсорных нейронах обонятельных луковиц и снижение реакции на одоранты [18]. Также было показано, что дефицит НЕП у мышей 5хFAD/NEP+/– еще больше усугубляет патологию амилоидного пептида Aβ42 и ухудшение пространственной рабочей памяти [19], однако данные об экспрессии НЕП в обонятельной системе этих мышей отсутствуют.
Целью нашего исследования был анализ уровней экспрессии мРНК НЕП в обонятельных луковицах, энториальной и теменной коре, гиппокампе и стриатуме мышей дикого типа и мышей линии 5xFAD, а также сопоставление их когнитивной и обонятельной функций.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные. В данном исследовании использовались шестимесячные самцы мышей двух линий C57Bl (дикий тип) и 5xFAD (патология болезни Альцгеймера) из питомника “Черноголовка”. Животные содержались в стандартных условиях вивария Института эволюционной физиологии и биохимии им. И.M. Сеченова РАН (ИЭФБ РАН) в режиме 12 ч день/12 ч ночь, по 4–5 особей в клетке со свободным доступом к воде и пище. Эксперименты проводились в соответствии с протоколом использования лабораторных животных ИЭФБ РАН, основанным на директиве Европейского сообщества о гуманном обращении с лабораторными животными (Directive #86 ⁄ 609 for the Care of Laboratory Animals) и инструкциях ARRIVE [20].
Световая микроскопия. Для светооптического исследования ткань мозга мышей дикого типа (n = 6) и 5xFAD (n = 6) фиксировали при помощи транскардиальной перфузии 10%-ным нейтральным формалином в фосфатном буфере (PBS, 4°C, pH 7.4). Замороженные фронтальные срезы мозга толщиной 20 мкм готовили с помощью криостата Leica CM 1510S (Leica Microsystems, Германия). Для исследования участки обонятельной луковицы (4.0–2.5 мм от bregma), гиппокампа, дорсолатерального стриатума и энторинальной коры головного мозга (2.0–3.3 мм от bregma в каудальном направлении) согласно [21], окрашивали красителем Congo Red (4%-ный водный раствор) и крезилвиолетом по Нисслю, с последующим обезвоживанием в спиртовых растворах восходящей концентрации, и заливали канадским бальзамом. С помощью микроскопа ImagerA (Цейсс, Германия) анализировали состояние нервной ткани и накопление амилоидных отложений, окрашенных Congo Red, в обозначенных структурах мозга.
Анализ мРНК НЕП. Мышей как дикого типа, так и трансгенных мышей 5xFAD анестезировали Золетилом (100 мг/кг массы тела), декапитировали при помощи гильотины и проводили диссекцию обонятельных луковиц (блок ткани 4.0–2.5 мм от bregma [21]), энторинальной коры (2.5–3.3 мм от bregma), гиппокампа (2.5–3.3 мм от bregma), теменной коры (2.0–2.5 мм от bregma) и стриатума (2.0–2.5 мм от bregma) из обоих полушарий мозга. Выделение общей РНК проводили с использованием реагента TRI (Molecular Research Center, Inc.) в соответствии с инструкциями производителя. Кодирующую ДНК (кДНК) получали с использованием обратной транскриптазы M-MLV (Promega, США). Концентрацию нуклеиновых кислот определяли спектрофотометрически с помощью мультимодального ридера Clariostar Plus (Clariostar, Германия) с учетом коэффициента разбавления. кДНК амплифицировали с помощью ПЦР в режиме реального времени, выполненной в термоциклере iCycler с многоцветной системой обнаружения (Bio-Rad, Великобритания), анализирующей включение красителя SYBR Green и образование амплификата. Стандартная реакционная смесь состояла из смеси iQ SYBR Green (Bio-Rad, Великобритания), прямых и обратных праймеров в конечной концентрации 500 нМ каждый, 10 пг кДНК, воды без ДНКазы до конечного объема 20 мкл. Смесь нагревали до 95°С в течение 3 мин с последующими 35-ю циклами с денатурацией при 95°С в течение 30 с, отжигом при 57°С в течение 30 с и элонгации при 72°С в течение 30 с. Уровень экспрессии мРНК НЕП (NEP) определяли относительно мРНК циклофилина А (CycA). Праймеры, используемые в экспериментах были следующими:
NEP-F: 5'-GGATCTTGTAAGCAGCCTCAGC-3'
NEP-R: 5'-AGTTGGCACACCGTCTCCAG-3'.
CycA-F: 5'-AGGATTCATGTGCCAGGGTG-3'
CycA-R: 5'-CTCAGTCTTGGCAGTGCAGA-3'.
Тест в водном лабиринте Морриса. Формирование пространственной памяти у мышей изучали в водном лабиринте Морриса [22]. Эксперименты проводились в круглом бассейне диаметром 1.5 м. Бассейн был заполнен водой (t = 23 ± 1°С), замутненной сухим молоком. Четыре ориентира в виде геометрических фигур были размещены на стенках бассейна. Эксперимент состоял из обучения мышей поиску платформы для отдыха, который длился 4 дня с 2-мя циклами ежедневных тренировок, состоящих из 3 заплывов, с перерывом в 1 ч. Платформа находилась на 1.5 см ниже уровня воды. В ходе эксперимента фиксировалось время в секундах, затраченное животным на поиск платформы. Мышь запускалась для плавания из разных точек бассейна. Платформа всегда оставалась на одном и том же месте. Продолжительность одной попытки составляла 60 с; если животное не могло самостоятельно найти платформу в течение 60 с, то экспериментатор помогал ему подняться на платформу. Животные отдыхали на платформе перед очередным заплывом, а также в конце серии заплывов в течение 30 с. После заплыва животных снимали с платформы, вытирали и возвращали в домашнюю клетку.
Тест на предпочтение запаха. Для тестирования предпочтений запаха использовали протокол, описанный нами ранее [6]. Мышам в течение 8 дней ежедневно предлагали набор из 8 флаконов (диаметр 30 мм, высота 30 мм), содержащих натуральные масла (апельсиновое, гвоздичное, жасминовое, мятное, эвкалиптовое, полынное, лавандовое и валериановое) и в течение 15 мин регистрировали время, в течение которого животное принюхивалось к каждому флакону. Положение флаконов в каждом испытании было разным. Усредненное время принюхиваний для каждого флакона за 15 мин тестирования в течение 8 дней эксперимента, выражали в % от суммарного времени принюхивания ко всем флаконам.
Статистический анализ. Статистический анализ данных проводился с использованием программных пакетов SPSS SigmaStat 3.0 или GraphPad Prism 9. Нормальность распределения проверялась по критерию Колмогорова–Смирнова. Параметрическая статистика использовалась для анализа нормально распределенных данных. Сравнение между экспериментальной и контрольной группами проводили с использованием t-теста Стьюдента (для двух групп) или One-Way ANOVA (для нескольких групп), за которым следовал пост-хок тест Тьюки–Крамера или Стьюдента–Ньюмана–Кеулса. Если данные не имели нормального распределения, использовали H-тест Крускала–Уоллиса, за которым следовал пост-хок-анализ Тьюки–Крамера или Стьюдента–Ньюмана–Кеулса (для нескольких групп). Все результаты представлены как среднее ± SEM. Различия считались статистически значимыми на уровне p ≤ 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ экспрессии НЕП в структурах мозга мышей дикого типа и линии 5xFAD. Результаты анализа ПЦР в реальном времени показали, что у мышей дикого типа самый высокий уровень экспрессии гена НЕП наблюдается в стриатуме (рис. 1а). В обонятельных луковицах экспрессия НЕП также довольно высока, но примерно на 28% ниже, чем в стриатуме (t-тест, t = 2.91; p = 0.0102). В теменной коре, энторинальной коре и гиппокампе уровни мРНК НЕП были примерно в 5 раз ниже, чем в стриатуме (One-Way ANOVA, p < 0.001).
Рис. 1.
Экспрессия НЕП в структурах мозга мышей дикого типа С57Bl и мышей линии 5xFAD. a – экспрессия НЕП на уровне мРНК, проанализированная методом ПЦР в реальном времени в теменной коре (РС), энторинальной коре (ЕС), гиппокампе (Hip), стриатуме (Str) и обонятельных луковицах (OB) мышей дикого типа. b – экспрессия НЕП на уровне мРНК в стриатуме (Str) и обонятельных луковицах (OB) мышей дикого типа (WT) и мышей линии 5xFAD; c – экспрессия НЕП на уровне мРНК в теменной коре (PC), энторинальной коре (EC) и гиппокампе (Hip) мышей дикого типа (WT) и мышей линии 5xFAD. Данные представлены в виде точечных графиков с указанием средних значений и стандартной ошибки среднего (М ± SEM) относительно CycA (n = 9 в каждой группе), каждый образец протестирован троекратно. p < 0.001 (тест Крускала–Уоллиса и пост-хок тест Тьюки).
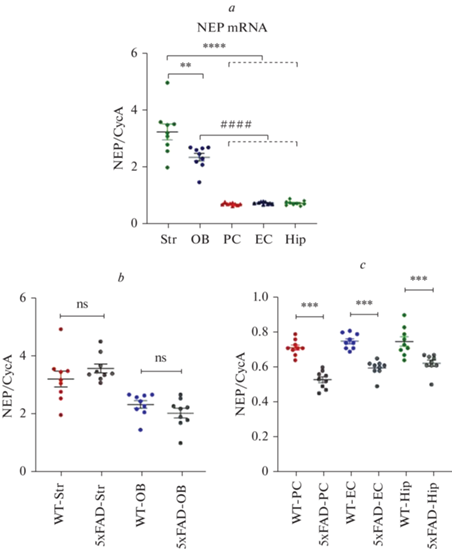
Сравнительный анализ уровней мРНК НЕП в структурах мозга дикого типа и 5xFAD мышей не продемонстрировал существенных различий между значениями как в стриатуме, так и в обонятельных луковицах (p = 0.2677 и p = 0.1827 соответственно, по t-тесту) (рис. 1b). Тем не менее, наблюдалось значительное снижение экспрессии гена НЕП в теменной коре, энторинальной коре и гиппокампе (рис. 1c), где уровни мРНК НЕП у мышей линии 5xFAD были ниже на 25, 21 и 17%, соответственно по сравнению с диким типом (p < 0.001 для каждой структуры).
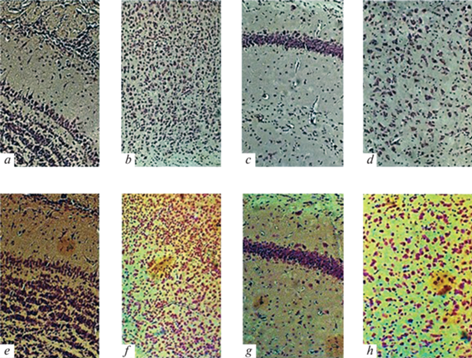
Накопление агрегатов Aβ у мышей 5xFAD. Чтобы подтвердить, что мыши линии 5xFAD, используемые в наших экспериментах, накапливают амилоидные отложения с возрастом и развивают фенотип БA, мы использовали краситель Congo Red, который представляет собой низкомолекулярный органический краситель, предпочтительно связывающийся с поперечно-β-листовыми структурами, и широко используется для маркировки амилоидных бляшек в гистологических образцах [23]. Как видно из рис. 2, в обонятельной луковице, энторинальной коре, области CA1 гиппокампа и стриатуме мышей дикого типа отсутствуют амилоидные агрегаты. Тем не менее, у мышей 5xFAD имеет место наличие больших амилоидных отложений Aβ во всех изученных структурах, подтверждающее, что у этих мышей развиваются основные морфологические характеристики Aβ патологии.
Рис. 2.
Выявление агрегатов Aβ у мышей линии 5xFAD. Анализ с помощью световой микроскопии не выявил агрегатов Aβ в обонятельных луковицах (a), теменной коре (b), СА1 области гиппокампа (c) и стриатуме (d) 6-месячных мышей дикого типа, в то время как четко видны отложения Aβ в тех же структурах мозга трансгенных мышей линии 5xFAD (e–h соответственно). Двойное окрашивание по Нисслю (синий цвет) и Конго красным для выявления агрегированного Aβ (коричнево-красный цвет). Масштаб: 50 мкм.
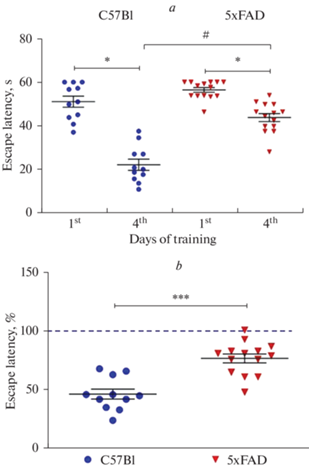
Тестирование в водном лабиринте Морриса. Используя тест водного лабиринта Морриса, было обнаружено, что мыши как дикого типа, так и линии 5xFAD способны научиться находить скрытую под водой платформу (текст Крускала-Уолеса, H = 34.1, p < 0.05, рис. 3а). Однако в конце обучения (на 4-й день исследования) группа мышей линии 5xFAD по сравнению с мышами дикого типа продемонстрировала на 30% более длительную задержку нахождения платформы (t-тест, t = –5.388, p < 0.001, рис. 3a, b), что указывает на ухудшение пространственной памяти у трансгенных мышей.
Рис. 3.
Сравнительный анализ поведения в водном лабиринте Морриса между мышами C57Bl (n = 11) и 5xFAD (n = 14). а – среднее время в секундах до достижения платформы (escape latency) в водном лабиринте Морриса в первый и последний (4-й) дни тренировки. Для сравнения групп использовался критерий Крускала–Уоллиса, H = 34.1, p ≤ 0.001 с последующим пост-хок тестом Данна. Данные представлены в виде точечных графиков с указанием средних значений и стандартной ошибки среднего (М ± SEM) (* – p ≤ 0.05 – статистически значимые различия между первым и четвертым днями обучения, # – p ≤ 0.05 – статистически значимые различия между мышами дикого типа и линии 5xFAD). b – среднее время достижения платформы (escape latency) в водном лабиринте Морриса в последний день обучения, выраженное в процентах от времени, необходимого для достижения платформы в первый день обучения. Данные представлены в виде точечных графиков с указанием средних значений и стандартной ошибки среднего (М ± SEM). Горизонтальная линия указывает среднее время достижения платформы в первый день обучения, принятое за 100%. *** – p < 0.001 – статистически значимые различия между группами (t-тест Стьюдента).
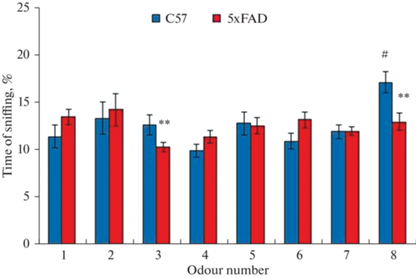
Анализ предпочтений запаха у мышей дикого типа показал, что они предпочитали запах масла валерианы, которое имеет феромональное значение для грызунов. Продолжительность обнюхивания флакона с маслом валерианы (запах № 8) была наиболее длительной по сравнению с другими запахами и составила 17.1 ± 1.1% (One-Way ANOVA, F7; 71 = 3.9, p = 0.001 с пост-хок анализом Стьюдента–Ньюмана–Кеулса, p < 0.05) (рис. 4). Сравнивая обонятельное поведение мышей дикого типа и 5xFAD, мы обнаружили, что у трансгенных мышей предпочтение масла валерианы было снижено на 25% (t-тест, t = 3,1, p = 0,005) и не отличалось от интереса, проявленного к другим индифферентным запахам (H = 13.2, p = 0.07). Более того, они проявляли меньший интерес к жасминовому маслу и посещали его реже, чем мыши дикого типа. Отсутствие предпочтения запаха валерианы среди других индифферентных запахов мы интерпретируем как свидетельство нарушения обонятельной функции у мышей линии 5xFAD.
Рис. 4.
Сравнительный анализ предпочтений запаха у мышей линий C57Bl и 5xFAD. Ордината: средняя продолжительность принюхивания к каждому из предъявляемых запахов, выраженная в % от суммарного времени принюхивания ко всем запахам в течение периода тестирования у мышей С57Bl (n = 11) и 5xFAD (n =14). # – p < 0.05, различия в предпочтении запахов у мышей дикого типа, One-Way ANOVA с пост-хок тестом Стьюдента-Ньюмана-Кеулса; ** – p < 0.01 различия между мышами дикого типа и 5xFAD; t-тест. Абсцисса: номера предъявляемых запахов: 1 – апельсин, 2 – гвоздика, 3 – жасмин, 4 – мята, 5 – эвкалипт, 6 – полынь, 7 – лаванда, 8 – валериана.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
О возможном участии НЕП в обонянии свидетельствует тот факт, что у крыс единственной структурой мозга, в которой экспрессия НЕП обнаруживается еще до рождения, является внешний слой обонятельных луковиц [24]. Проведенное нами ранее исследование на крысах также продемонстрировало высокий уровень мРНК НЕП в обонятельных луковицах крысят вскоре после рождения, который неуклонно увеличивался в течение первого месяца постнатального развития [6], а затем снижался с возрастом, коррелируя с ухудшением восприятия запахов. Кроме того, участие субстрата НЕП соматостатина в обонятельной сигнализации также подразумевает роль этого фермента в обонянии [25]. Важная роль НЕП в обонятельной системе также следует из исследований C. elegans, которые показали, что гомолог НЕП (НЕП-2) необходим для обонятельной пластичности и восприятия феромонной сигнализации этих нематод [26]. На фруктовых мушках Drosophila melanogaster также было показано, что продукты четырех НЕП-подобных генов участвуют в обонятельной памяти [27]. Кроме того, оверэкспрессия гена НЕП-1 улучшала обонятельную ассоциативную память мух, которая была нарушена после введения им Aβ [28].
В данном исследовании, как и у крыс, самые высокие уровни мРНК НЕП у мышей дикого типа C57Bl наблюдались в стриатуме и обонятельных луковицах, в то время как в кортикальных структурах (энторинальной и теменной коре) и гиппокампе они были значительно ниже (рис. 1). У мышей линии 5xFAD существенных различий в экспрессии мРНК НЕП в обонятельных луковицах и стриатуме по сравнению с мышами дикого типа не наблюдалось, но в энторинальной и теменной коре, а также в гиппокампе экспрессия НЕП была значительно ниже. Это свидетельствует о том, что развитие патологии БА и накопление Aβ в этих структурах мозга у мышей линии 5xFAD может быть связано с дефицитом экспрессии НЕП.
В нашей предыдущей работе мы обнаружили, что в возрасте 1 мес. уровни экспрессии НЕП в обонятельных луковицах и стриатуме крыс статистически не отличались. Однако с возрастом наблюдалось значительное снижение экспрессии НЕП в обонятельных луковицах, и в возрасте 9 мес. уровни его мРНК были на 30% ниже, чем в стриатуме, что коррелировало с нарушением обонятельной функции старых крыс [6]. В данном исследовании экспрессия НЕП в обонятельных луковицах мышей дикого типа и мышей линии 5xFAD в возрасте 6 мес. также была примерно на 30% ниже, чем в стриатуме, что может обуславливать ухудшение обоняния у стареющих мышей, описанное в литературе [29].
Хотя роль стриатума в обонянии до конца не ясна, имеются данные о том, что обонятельный бугорок, входящий в состав вентрального стриатума, получает моносинаптический вход из обонятельной луковицы [30]. Регистрация клеточных ответов in vivo показала, что 65% клеток обонятельного бугорка реагируют на запахи и 27% на звуковые раздражители. Это предполагает не только наличие некоторого физиологического взаимодействия между восприятием запахов и звука, но и вовлеченность стриатума в осуществление обонятельной функции [31]. Кроме того, один из субстратов НЕП соматостатин является эндогенным стриатальным нейропептидом [32], и его иммунореактивность была обнаружена в нервных волокнах, идущих от энторинальной коры и амигдалы до прилежащего ядра, которое составляет часть вентрального стриатума [33]. Таким образом, высокий уровень экспрессии НЕП в стриатуме свидетельствует о его важной роли в проведении сигналов, поступающих в эту структуру от обонятельных луковиц и других областей мозга, в частности из энторинальной и теменной коры, а также из гиппокампа, которые взаимосвязаны системой аксональных проекций [34]. Поскольку у мышей линии 5xFAD быстро развивается значительное количество амилоидных агрегатов, которые обнаруживаются во всех структурах мозга, но, в основном, в кортикальных областях и гиппокампе, вызывая гибель нейронов и потерю синапсов [15, 35], логично предположить, что этот процесс связан со снижением экспрессии НЕП в этих областях, выявленным в нашем исследовании. Также можно предположить, что накопление агрегатов Aβ повреждает нейрональные контакты между структурами, участвующими в распространении обонятельных стимулов. Помимо когнитивного дефицита, наблюдаемого у мышей линии 5xFAD при обучении в водном лабиринте Морриса, мы также наблюдали нарушение их обоняния и потерю предпочтения к запаху масла валерианы, компоненты которого имеют феромонную значимость для грызунов [36]. Поскольку, как уже отмечалось выше, мы не обнаружили существенных изменений в экспрессии НЕП в обонятельных луковицах и стриатуме, нарушение проведения обонятельных сигналов может быть обусловлено дефицитом НЕП и расщепления соматостатина или других нейропептидов, осуществляющих проведение нервных импульсов, в энторинальной и теменной коре, а также в гиппокампе. Более того, дефицит активности НЕП также является одной из причин накопления амилоидных агрегатов, наблюдаемых в этих структурах мозга у мышей линии 5xFAD.
Обнаружение у стареющих мышей линии 5xFAD амилоидных бляшек в обонятельных луковицах и стриатуме, где экспрессия НЕП высока, говорит о том, что скорость производства амилоидных пептидов у этого типа трансгенных мышей, экспрессирующих мутантные белки человека, вызывающие развитие ранних форм БА [14], и образование амилоидных агрегатов в процессе старения очень высока, а активность НЕП недостаточна для его удаления во всем мозге. Важно отметить, что накопление амилоидных отложений в стриатуме и обонятельных луковицах пациентов с БА, происходит значительно позже, чем в корковых областях [37, 38], где экспрессия НЕП значительно ниже. Есть также данные, что у мышей линии 5xFAD первыми областями, где начинает накапливаться амилоид, являются гиппокамп и кортикальные области [14]. Это позволяет предположить защитную роль высокого содержания НЕП в стриатуме и обонятельных луковицах, которые ингибируют амилоидогенез и задерживают образование бляшек. С другой стороны, амилоидные бляшки рассматриваются как защитный механизм для уменьшения количества более токсичных низкомолекулярных образований Aβ и олигомеров в ткани мозга, которые являются основной причиной синаптического дефицита и гибели клеток при патологии БА [39]. Более того, НЕП не может расщеплять амилоидные олигомеры и бляшки, но уменьшает количество мономерных пептидов Aβ, которые их образуют, тогда как другие протеолитические ферменты, например, инсулин-деградирующий фермент, могут расщеплять амилоидные фибриллы (для обзора см. [40]). Имеются ли изменения в экспрессии этих ферментов у мышей линии 5xFAD, пока не известно.
Есть данные, свидетельствующие, что увеличение экспрессии НЕП у мышей линии 5xFAD с применением различных подходов может снизить амилоидную нагрузку и улучшить когнитивные функции животных. Как показали Калинин и соавт. [41], пероральное введение GW742 – агониста γ-рецептора, активируемого пролифераторами пероксисом, мышам линии 5xFAD приводило к уменьшению содержания амилоидных бляшек и воспалению в головном мозге, что сопровождалось повышенной экспрессией НЕП и инсулин-деградирующего фермента. Другое исследование также показало, что внутримозговое введение мышам 5xFAD индуцированных плюрипотентных макрофагов человека, полученных из стволовых клеток, экспрессирующих ген НЕП-2, кодирующий фермент, гомологичный НЕП, снижало уровни Aβ в мозге мышей путем повышения Aβ клиренса этим ферментом [42]. Скрещивание мышей линии 5xFAD с мышами, обладающими повышенной экспрессией НЕП (гемизиготные трансгенные мыши на основе C57Bl/6), приводило к смягчению фенотипических проявлений БА, предотвращению гибели холинергических нейронов и дефицита памяти у старых животных при тестировании их в парадигме обусловленного контекстом страха [43]. Эти данные убедительно подтверждают профилактическую роль повышения экспрессии НЕП в развитии патологии БА и открывают возможности для разработки терапевтических стратегий для предотвращения обонятельного и когнитивного дефицита, вызванного развитием БА.
Список литературы
Murphy C (2019) Olfactory and other sensory impairments in Alzheimer disease. Nat Rev Neurol 15: 11–24. https://doi.org/10.1038/s41582-018-0097-5
Doty RL (2012) Olfactory dysfunction in Parkinson disease. Nat Rev Neurol 8: 329–339. https://doi.org/10.1038/nrneurol.2012.80
Barresi M, Ciurleo R, Giacoppo S, Foti Cuzzola V, Celi D, Bramanti P, Marino S (2012) Evaluation of olfactory dysfunction in neurodegenerative diseases. J Neurol Sci 323: 16–24. https://doi.org/10.1016/j.jns.2012.08.028
Prediger RD, Schamne MG, Sampaio TB, Moreira ELG, Rial D (2019) Animal models of olfactory dysfunction in neurodegenerative diseases. Handb Clin Neurol 164: 431–452. https://doi.org/10.1016/B978-0-444-63855-7.00024-1
Roddick KM, Roberts AD, Schellinck HM, Brown RE (2016) Sex and Genotype Differences in Odor Detection in the 3Tg-AD and 5XFAD Mouse Models of Alzheimer’s Disease at 6 Months of Age. Chem Senses 41: 433–440. https://doi.org/10.1093/chemse/bjw018
Vasilev DS, Dubrovskaya NM, Zhuravin IA, Nalivaeva NN (2021) Developmental Profile of Brain Neprilysin Expression Correlates with Olfactory Behaviour of Rats. J Mol Neurosci 71: 1772–1785. https://doi.org/10.1007/s12031-020-01786-3
Shirotani K, Tsubuki S, Iwata N, Takaki Y, Harigaya W, Maruyama K, Kiryu-Seo S, Kiyama H, Iwata H, Tomita T, Iwatsubo T, Saido TC (2001) Neprilysin degrades both amyloid β peptides 1-40 and 1-42 most rapidly and efficiently among thiorphan- and phosphoramidon-sensitive endopeptidases. J Biol Chem 276: 21895–21901. https://doi.org/10.1074/jbc.M008511200
Nalivaeva NN, Zhuravin IA, Turner AJ (2020) Neprilysin expression and functions in development, ageing and disease. Mech Ageing Dev 192: 111363. https://doi.org/10.1016/j.mad.2020.111363
Farris W, Schütz SG, Cirrito JR, Shankar GM, Sun X, George A, Leissring MA, Walsh DM, Qiu WQ, Holtzman DM, Selkoe DJ. (2007) Loss of neprilysin function promotes amyloid plaque formation and causes cerebral amyloid angiopathy. Am J Pathol 171: 241–251. https://doi.org/10.2353/ajpath.2007.070105
Mouri A, Zou LB, Iwata N, Saido TC, Wang D, Wang MW, Noda Y, Nabeshima T (2006) Inhibition of neprilysin by thiorphan (i.c.v.) causes an accumulation of amyloid β and impairment of learning and memory. Behav Brain Res 168: 83–91. https://doi.org/10.1016/j.bbr.2005.10.014
Saiz-Sanchez D, Ubeda-Bañon I, de la Rosa-Prieto C, Argandoña-Palacios L, Garcia-Muñozguren S, Insausti R, Martinez-Marcos A (2010) Somatostatin, tau, and beta-amyloid within the anterior olfactory nucleus in Alzheimer disease. Exp Neurol 223: 347–350. https://doi.org/10.1016/j.expneurol.2009.06.010
Saito T, Iwata N, Tsubuki S, Takaki Y, Takano J, Huang SM, Suemoto T, Higuchi M, Saido TC (2005) Somatostatin regulates brain amyloid beta peptide Aβ42 through modulation of proteolytic degradation. Nat Med 11: 434–439. https://doi.org/10.1038/nm1206
Hanson LR, Roeytenberg A, Martinez PM, Coppes VG, Sweet DC, Rao RJDL Marti, Hoekman JD, Matthews RB, Frey WH, II, Panter SS (2009) Intranasal Deferoxamine Provides Increased Brain Exposure and Significant Protection in Rat Ischemic Stroke. J Pharmacol Exp Ther 330: 679–686. https://doi.org/10.1124/jpet.108.149807
Oakley HO, Cole SL, Logan S, Maus E, Shao P, Craft J, Guillozet-Bongaarts A, Ohno M, Disterhoft J, Van Eldik L, Berry R, Vassar R (2006) Intraneuronal β-Amyloid Aggregates, Neurodegeneration, and Neuron Loss in Transgenic Mice with Five Familial Alzheimer’s Disease Mutations: Potential Factors in Amyloid Plaque Formation. J Neurosci 26: 10129–10140. https://doi.org/10.1523/JNEUROSCI.1202-06.2006
Girard SD, Jacquet M, Baranger K, Migliorati M, Escoffier G, Bernard A, Khrestchatisky M, Féron F, Rivera S, Roman FS, Marchetti E (2014) Onset of hippocampus-dependent memory impairments in 5XFAD transgenic mouse model of Alzheimer’s disease. Hippocampus 24: 762–772. https://doi.org/10.1002/hipo.22267
O'Leary TP, Mantolino HM, Stover KR, Brown RE (2020) Age-related deterioration of motor function in male and female 5xFAD mice from 3 to 16 months of age. Genes Brain Behav 19: e12538. https://doi.org/10.1111/gbb.12538
O'Leary TP, Stover KR, Mantolino HM, Darvesh S, Brown RE (2020) Intact olfactory memory in the 5xFAD mouse model of Alzheimer’s disease from 3 to 15 months of age. Behav Brain Res 393: 112731. https://doi.org/10.1016/j.bbr.2020.112731
Son G, Yoo SJ, Kang S, Rasheed A, Jung DH, Park H, Cho B, Steinbusch HWM, Chang KA, Suh YH, Moon C (2021) Region-specific amyloid-β accumulation in the olfactory system influences olfactory sensory neuronal dysfunction in 5xFAD mice. Alzheimers Res Ther 13: 4. https://doi.org/10.1186/s13195-020-00730-2
Hüttenrauch M, Baches S, Gerth J, Bayer TA, Weggen S, Wirths O (2015) Neprilysin deficiency alters the neuropathological and behavioral phenotype in the 5XFAD mouse model of Alzheimer’s disease. J Alzheimers Dis 44: 1291–1302. https://doi.org/10.3233/JAD-142463
Kilkenny C, Browne WJ, Cuthill IC, Emerson M, Altman DG (2010) Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biol 8: e1000412. https://doi.org/10.1371/journal.pbio.1000412
Paxinos G, Franklin KBJ (2001) The mouse brain in stereotaxic coordinates. 2nd Edition. Acad Press. San Diego.
Morris RGM (1981) Spatial localization does not require the presence of local cues. Learning and Motivation 12: 239–260. https://doi.org/10.1016/0023-9690(81)90020-5
Stepanchuk AA, Heyne B, Stys PK (2021) Complex Photophysical Properties of K114 Make for a Versatile Fluorescent Probe for Amyloid Detection. ACS Chem Neurosci 12: 1273–1280. https://doi.org/10.1021/acschemneuro.1c00101
Dutriez I, Salès N, Fournié-Zaluski MC, Roques BP (1992) Pre- and post-natal ontogeny of neutral endopeptidase 24–11 ('enkephalinase') studied by in vitro autoradiography in the rat. Experientia 48: 290–300. https://doi.org/10.1007/bf01930479
Nocera S, Simon A, Fiquet O, Chen Y, Gascuel J, Datiche F, Schneider N, Epelbaum J, Viollet C (2019). Somatostatin Serves a Modulatory Role in the Mouse Olfactory Bulb: Neuroanatomical and Behavioral Evidence. Front Behav Neurosci 13: 61. https://doi.org/10.3389/fnbeh.2019.00061
Yamada K, Hirotsu T, Matsuki M, Butcher RA, Tomioka M, Ishihara T, Clardy J, Kunitomo Y, Iino Y (2010) Olfactory plasticity is regulated by pheromonal signaling in Caenorhabditis elegans. Science 329: 1647–1650. https://doi.org/10.1126/science.1192020
Turrel O, Lampin-Saint-Amaux A, Préat T, Goguel V (2016) Drosophila Neprilysins Are Involved in Middle-Term and Long-Term Memory. J Neurosci 36: 9535–9546. https://doi.org/10.1523/JNEUROSCI.3730-15.2016
Turrel O, Goguel V, Preat T (2017) Drosophila Neprilysin 1 Rescues Memory Deficits Caused by Amyloid-β Peptide. J Neurosci 37: 10334–10345. https://doi.org/10.1523/JNEUROSCI.1634-17.2017
Patel RC, Larson J (2009) Impaired olfactory discrimination learning and decreased olfactory sensitivity in aged C57Bl/6 mice. Neurobiol Aging 30: 829–837. https://doi.org/10.1016/j.neurobiolaging.2007.08.007
Xiong A, Wesson DW (2016) Illustrated Review of the Ventral Striatum’s Olfactory Tubercle. Chem Senses 41: 549–555. https://doi.org/10.1093/chemse/bjw069
Wesson DW, Wilson DA (2010) Smelling sounds: olfactory-auditory sensory convergence in the olfactory tubercle. J Neurosci 30: 3013–3021. https://doi.org/10.1523/JNEUROSCI.6003-09.2010
Kawaguchi Y, Wilson CJ, Augood SJ, Emson PC (1995) Striatal interneurons – chemical, physiological and morphological characterization. Trends Neurosci 18: 527–535. https://doi.org/10.1016/0166-2236(95)98374-8
Aylward RL, Totterdell S (1993) Neurons in the ventral subiculum, amygdala and entorhinal cortex which project to the nucleus accumbens: their input from somatostatin-immunoreactive boutons. J Chem Neuroanat 6: 31–42. https://doi.org/10.1016/0891-0618(93)90005-o
Arszovszki A, Borhegyi Z, Klausberger T (2014) Three axonal projection routes of individual pyramidal cells in the ventral CA1 hippocampus. Front Neuroanat 8: 53. https://doi.org/10.3389/fnana.2014.00053
Ali F, Baringer SL, Neal A, Choi EY, Kwan AC (2019) Parvalbumin-Positive Neuron Loss and Amyloid-β Deposits in the Frontal Cortex of Alzheimer’s Disease-Related Mice. J Alzheimers Dis 72: 1323–1339. https://doi.org/10.3233/JAD-181190
Мельник СА, Гладышева ОС, Крылов ВН (2009) Возрастные изменения обонятельной чувствительности самцов мышей к запаху изовалериановой кислоты. Сенсорные системы 23: 151–155. [Melnik SA, Gladysheva OS, Krylov VN (2009) Age-related changes in the olfactory sensitivity of male mice to the smell of isovaleric acid. Sensory Systems 23: 151–155. (In Russ)].
Thal DR, Rub U, Orantes M, Braak H (2002) Phases of Aβ-deposition in the human brain and its relevance for the development of AD. Neurology 58: 1791–1800. https://doi.org/10.1212/wnl.58.12.1791
Attems J, Lintner F, Jellinger KA (2005) Olfactory involvement in aging and Alzheimer’s disease: an autopsy study. J Alzheimers Dis 7: 149–157. https://doi.org/10.3233/jad-2005-7208
Li S, Selkoe DJ (2020) A mechanistic hypothesis for the impairment of synaptic plasticity by soluble Aβ oligomers from Alzheimer’s brain. J Neurochem 154: 583–597. https://doi.org/10.1111/jnc.15007
Nalivaeva NN, Turner AJ (2019) Targeting amyloid clearance in Alzheimer’s disease as a therapeutic strategy. Br J Pharmacol 176: 3447–3463. https://doi.org/10.1111/bph.14593
Kalinin S, Richardson JC, Feinstein DL (2009) A PPARγ agonist reduces amyloid burden and brain inflammation in a transgenic mouse model of Alzheimer’s disease. Curr Alzheimer Res 6: 431–437. https://doi.org/10.2174/156720509789207949
Takamatsu K, Ikeda T, Haruta M, Matsumura K, Ogi Y, Nakagata N, Uchino M, Ando Y, Nishimura Y, Senju S (2014) Degradation of amyloid β by human induced pluripotent stem cell-derived macrophages expressing Neprilysin-2. Stem Cell Res 13: 442–453. https://doi.org/10.1016/j.scr.2014.10.001
Devi L, Ohno M (2015) A combination Alzheimer’s therapy targeting BACE1 and neprilysin in 5XFAD transgenic mice. Mol Brain 8: 19. https://doi.org/10.1186/s13041-015-0110-5
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


