Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 2, стр. 279-290
Метод регистрации биоэлектрической активности коры головного мозга у крыс в условиях хронического эксперимента
Ю. И. Сысоев 1, 2, 3, 4, В. А. Приходько 1, 4, *, Р. Д. Идиятуллин 1, Р. Т. Черняков 1, В. Е. Карев 5, С. В. Оковитый 1, 4
1 Санкт-Петербургский государственный химико-фармацевтический университет
Санкт-Петербург, Россия
2 Институт трансляционной биомедицины, Санкт-Петербургский государственный
университет
Санкт-Петербург, Россия
3 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
4 Институт мозга человека им. Н.П. Бехтеревой РАН
Санкт-Петербург, Россия
5 Детский научно-клинический центр инфекционных болезней ФМБА
Санкт-Петербург, Россия
* E-mail: veronika.prihodko@pharminnotech.com
Поступила в редакцию 21.11.2021
После доработки 24.12.2021
Принята к публикации 24.12.2021
- EDN: RRVZUU
- DOI: 10.31857/S0869813922020091
Аннотация
Регистрация и анализ электрокортикограмм (электрокортикография, ЭКоГ) у мелких лабораторных животных широко используются в биомедицинских исследованиях. На сегодняшний день разработано множество методических подходов к изготовлению и имплантации ЭКоГ электродов. Многие фирмы-изготовители нейрофизиологического оборудования предлагают широкий выбор таких электродов, от простых игольчатых или концентрических до гибких микроэлектродных матриц. Несмотря на это, в силу разных причин нейрофизиологические методы (в том числе и ЭКоГ) гораздо реже используются в исследовательской работе по сравнению с поведенческими тестами или молекулярно-генетическими методами. В настоящей работе предложен простой метод изготовления и имплантации ЭКоГ электродов для крыс. Регистрация биоэлектрической активности головного мозга у испытуемых животных позволяет оценивать функциональное состояние нервной системы, эффекты фармакологического воздействия, а также работу сенсорных систем при записи зрительных или соматосенсорных вызванных потенциалов. Предложенный метод может быть полезен для проведения нейрофизиологических и нейрофармакологических экспериментов и служить полезным дополнением к традиционным методам биомедицинских исследований.
Нейрофизиологические методы исследования, такие как электроэнцефалография (ЭЭГ) или электрокортикография (ЭКоГ), позволяют решать широкий диапазон задач в нейробиологии. Например, регистрация активности коры головного мозга у мелких лабораторных животных может быть использована для оценки функционального состояния как отдельных структур, так и церебральной функции в целом, что может быть важно при моделировании различных патологических состояний и поиска новых терапевтических подходов к их коррекции [1, 2]. Отдельные исследования направлены на поиск коррелятов ЭКоГ активности и эмоциональных аспектов поведения животных [3, 4]. Получаемые данные могут быть полезны для изучения физиологии поведения или активности новых психоактивных препаратов. Регистрация и анализ ответов коры головного мозга на различные стимулы (например, накожная электрическая стимуляция, фотостимуляция) часто используются нейрофизиологами для изучения работы сенсорных систем или проводящих путей [5–7]. Приведенные примеры лишь частично демонстрируют, насколько разнообразными могут быть цели регистрации ЭКоГ у мелких лабораторых животных.
Несмотря на многие преимущества методов ЭЭГ и ЭКоГ в нейробиологических исследованиях, лишь малое число исследовательских групп используют их в своей работе, все больше отдавая предпочтения поведенческим тестам, по возможности дополняя их молекулярно-генетическими методами (вестерн-блоттинг, метод полимеразной цепной реакции и др.). Причиной этого могут быть сложности в изготовлении и/или имплантации ЭЭГ/ЭКоГ электродов. Существует ряд учебных пособий [8, 9], в которых достаточно подробно описаны подходы к изготовлению микроэлектродов. Однако, несмотря на это, при знакомстве с методом ЭКоГ нередко возникает вопрос, какие именно электроды необходимо использовать для решения конкретных экспериментальных задач. Кроме того, изготовление ряда электродов требует специальных навыков. Коммерчески доступные электроды (простые игольчатые или концентрические, или более сложные, например, гибкие микроэлектродные матрицы), выпускаемые фирмами-производителями нейрофизиологического оборудования, как правило, изготавливаются за рубежом, под заказ, и вследствие этого имеют достаточно высокую стоимость. Кроме того, точное расположение регистрирующих электродов определяет необходимость использования стереотаксического аппарата, что также делает такие исследования дорогими и недоступными многим лабораториям.
В связи с вышесказанным, целью настоящей работы была разработка простого метода изготовления и имплантации ЭКоГ электродов у крыс, позволяющего регистрировать спонтанную биоэлектрическую активность головного мозга, а также ответы коры на фото- и соматосенсорную стимуляцию.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проводили в соответствии с принципами Базельской декларации, Приказом Минздрава РФ от 01.04.2016 г. № 199н “Об утверждении правил надлежащей лабораторной практики” и рекомендациями биоэтической комиссии ФГБОУ ВО СПХФУ Минздрава России. Эксперименты были выполнены на белых беспородных крысах-самцах массой 250–300 г, полученных из ФГУП ПЛЖ “Рапполово” (Ленинградская область, Россия). Перед началом исследований все животные прошли карантин в течение 14 суток. Крыс содержали в стандартных условиях вивария на обычном пищевом рационе, со свободным доступом к воде.
Кортикографические электроды изготавливали из нихромовой проволоки диаметром 0.5 мм (для регистрирующих и референтного электродов) и диаметром 0.16 мм – для заземляющего электрода. Изоляцию осуществляли термоусадочной трубкой (1.5/0.5 мм); длина регистрирующей (неизолированной) части ≈1 мм. Все электроды объединяли в гнездо на кабель BLS-8 (Connfly Electronic Co. Ltd., КНР) c шагом 2.54 мм (рис. 1).
Для проведения хирургических манипуляций животных предварительно наркотизировали хлоралгидратом (MilliporeSigma, США; 400 мг/кг, внутрибрюшинно) или тилетамином/золазепамом 50 (Золетил®, Virbac, Франция; 10 мг/кг, внутримышечно). Выбор конкретного анестетика зависел от продолжительности запланированного эксперимента. Ввиду высокой токсичности хлоралгидрат не рекомендовано использовать для длительных исследований, поскольку у испытуемых животных со временем могут развиваться такие нежелательные реакции, как тяжелая атоническая непроходимость кишечника [10] и язва желудка [11]. По нашим собственным наблюдениям, нарушение перистальтики кишечника у крыс может возникать спустя одну-две недели после однократного введения наркозной дозы хлоралгидрата. Поэтому для длительных экспериментов мы рекомендуем использовать тилетамин/золазепам в указанной выше дозе, либо ингаляционный анестетик изофлуран.
По достижении стадии глубокого наркоза у крыс обривали и обрабатывали раствором йода поверхность головы, после чего фиксировали в стереотаксическом аппарате (RWD Life Science Inc., США). Перед проведением дальнейших манипуляций на глаза наносили карбомер 974Р (Офтагель®, Santen Oy, Финляндия), для предотвращения пересыхания роговицы. Разрез кожи головы осуществляли в рострокаудальном направлении от точки между глазами до начала шейного отдела. После подготовки поверхности черепа (удаления мышечно-фасциального слоя, надкостницы, коагуляции кровоточащих участков (рис. 2a)) просверливали отверстия соответствующих диаметров для электродов (рис. 2b) и фиксирующих винтов (рис. 2c) (глубина погружения сверла – до 1 мм). Для предупреждения нагревания головного мозга сверление осуществляли короткими интервалами. Далее осуществляли имплантацию фиксирующих винтов (рис. 2d) и кортикографических электродов (рис. 2e).
Рис. 2.
Этапы имплантации электрокортикографических электродов. (a) – фиксация животного в стереотаксической установке и подготовка поверхности черепа, (b) – высверливание отверстий для регистрирующих и референтного электродов, (c) – высверливание отверстий для фиксирующих винтов, (d) – имплантация фиксирующих винтов, (e) – электроды, объединенные в гнездо на кабель, (f) – имплантация регистрирующих и референтного электродов, (g) – заливка основы стоматологической пластмассой, (h) – имплантация тонкого заземляющего электрода под кожу в области шеи, (i) – покрытие массива электродов стоматологической пластмассой, (j) – ушивание разреза кожи, (k) – помещение прооперированного животного в отдельную клетку.
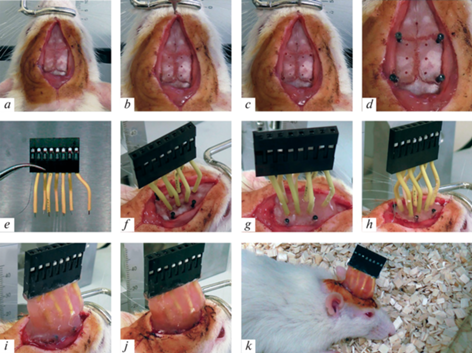
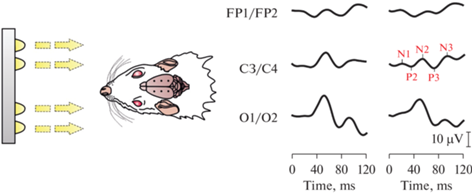
Координаты расположения электродов определяли с помощью стереотаксического атласа мозга крысы Paxinos и Watson [12]. Регистрирующие электроды были равномерно и симметрично распределены по поверхности полушарий головного мозга. Электроды FP1 и FP2 располагали в области первичной двигательной коры (AP = 0.0, ML = 2.0, DV = 1.0), С3 и С4 – первичной соматосенсорной коры (AP = –4.0, ML = 2.0, DV = 1.0), а O1 и O2 – вторичной зрительной коры (AP = –7.0, ML = 2.0, DV = 1.0). Референтный электрод устанавливали на ≈5 мм ростральнее электродов FP1 и FP2 (рис. 2f). Полученную конструкцию заливали жидким раствором стоматологической пластмассы Villacryl S (Zhermack SpA, Италия) для формирования прочной основы (рис. 2g). После затвердевания первого слоя пластмассы заземляющий электрод имплантировали под кожу в области шеи (рис. 2h). Далее электроды покрывали пластмассой с помощью шприца и шпателя (рис. 2i). После этого ушивали разрез кожи и проводили антисептическую обработку швов и прилежащей области (рис. 2j).
Прооперированных крыс содержали в индивидуальных клетках (тип III для IVC-систем BIO. A.S.®, Bioscape/Zoonlab GmbH, Германия) (рис. 2k) со свободным доступом к воде и корму в течение всего периода исследования. Состояние животных отслеживали сразу после выхода из наркоза и далее ежедневно утром и вечером; по необходимости обрабатывали швы раствором йода. Для профилактики возникновения инфекции сразу после операции животным вводили бензатина бензилпенициллин/бензилпенициллина калиевую/натриевую, новокаиновую соли (Бициллин®-3, ОАО “Синтез”, Россия; 5000 ЕД/кг, подкожно), для снятия послеоперационной боли – кетопрофен (Кетопрофен®, ООО “Велфарм”, Россия; 2.5 мг/кг, подкожно 1 раз в день в течение 3 дней). Во избежание обезвоживания крысам вводили подкожно 0.9%-ный раствор натрия хлорида (ООО “Гротекс”, Россия; 5 мл 1 раз в день, подкожно) в течение первых 3 дней после операции.
Запись спонтанной биоэлектрической активности коры головного мозга у животных осуществляли с помощью 8-канального энцефалографа Нейрон-Спектр-1 (ООО “Нейрософт”, Россия) c полосой пропускания 0.5–35 Гц и частотой квантования 500 Гц. Регистрацию сигнала проводили одновременно с видеорегистрацией поведения в условиях домашней клетки при искусственном освещении.
Регистрацию зрительных вызванных потенциалов (ЗВП) осуществляли в темном помещении. Для вызова ответов коры на фотостимуляцию животных, надежно зафиксированных в руках экспериментатора, располагали напротив фотостимулятора ФС-1 (ООО “Нейрософт”, Россия) со светодиодами белого свечения. Частота стимуляции составляла 3 Гц, длительность стимуляции – 30 с, длительность стимула – 50 мс. Выбор оптимальных параметров фотостимуляции был основан на данных публикаций других авторов [13, 14], а также собственных наблюдений.
Перед регистрацией соматосенсорных вызванных потенциалов (ССВП) животных наркотизировали внутрибрюшинным введением хлоралгидрата (400 мг/кг). Осуществляли токовую стимуляцию n. sciaticus поочередно с правой и левой стороны с помощью токового стимулятора “Нейро-МВП” (ООО “Нейрософт”, Россия) (сила тока 2 мА, прямоугольная волна, длительность стимула 0.1 мс, частота 1 Гц). Как и при регистрации ЗВП, выбор параметров стимуляции, достаточных для вызова выраженного моторного ответа, был основан на данных литературы [15] с изменениями после собственных предварительных исследований.
На 7-й день после имплантации животных эвтанизировали углекислым газом (бокс для эвтаназии Bioscape/Zoonlab GmbH, Германия). Извлеченный головной мозг фиксировали 10%-ным нейтральным формалином в течение 24 ч, после чего вскрывали таким образом, чтобы вертикальный разрез проходил через зону имплантации электродов, и вырезали образцы ткани в виде пластин толщиной 0.2–0.3 см. Полученные образцы подвергали гистологической проводке, пропитыванию и заливке в парафин по общепринятой методике. Из парафиновых блоков при помощи ротационного микротома изготавливали срезы ткани, размещали на предметных стеклах, окрашивали гематоксилином и эозином, после чего обезвоживали и заключали под покровные стекла. Гистологические препараты подвергали тотальному сканированию при помощи сканирующей системы для лабораторных исследований с комплектом программ для обработки изображений Pannoramic MIDI (3DHISTECH Kft., Венгрия).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Регистрация спонтанной биоэлектрической активности
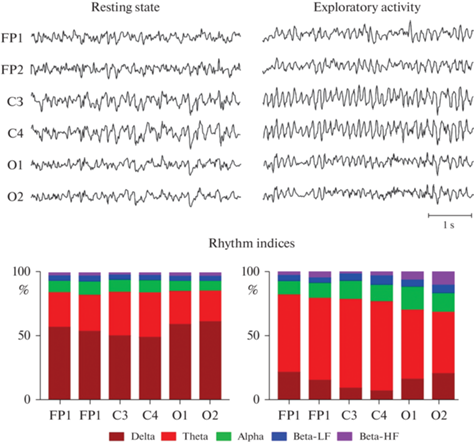
В состоянии бодрствующего покоя у испытуемых животных преобладали дельта-ритмы, индекс которых мог достигать 50% и выше. Около 20–30% занимали тета-волны, оставшееся время делили между собой альфа- и низко- и высокочастотные бета-ритмы. В случае возникновения у крыс поисково-исследовательской активности (например, во время обнюхивания стенки клетки или выглядывания из-за нее), во всех отведениях и, в особенности, в области теменной коры над гиппокампом (электроды C3 и C4) начинали доминировать тета-ритмы (рис. 3).
Рис. 3.
Пример записи биоэлектрической активности коры головного мозга крысы в покое (Resting state) и во время исследовательской активности (Exploratory activity). Снизу (Rhythm indices) представлены диаграммы, показывающие соотношения дельта- (Delta, 0.5–4 Гц), тета- (Theta, 4–8 Гц), альфа- (Alpha, 8–14 Гц), бета-низкочастотных (Beta-LF, 14–20 Гц) и бета-высокочастотных (Beta-HF, 20–35 Гц) ритмов в данные отрезки времени.
Регистрация спонтанной биоэлектрической активности после фармакологического воздействия
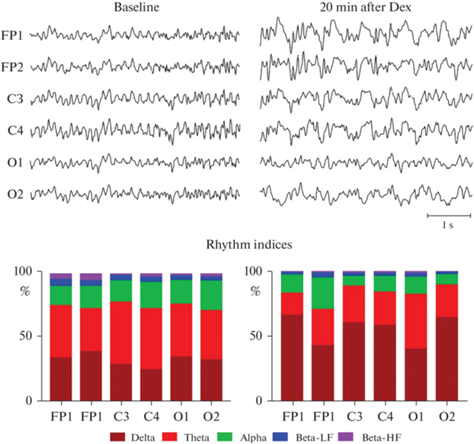
ЭКоГ сигнал является чувствительным не только к функциональному состоянию нервной системы (покой/исследовательская активность), но и к действию психоактивных препаратов. Так, при внутрибрюшинном введении агониста альфа-2-адренорецепторов дексмедетомидина, применяемого в клинической практике в качестве седативного средства, у испытуемых крыс уже через несколько минут наблюдали подъем активности дельта-ритмов во всех отведениях. Данные изменения были наиболее выражены в области лобных и теменных электродов (FP1/FP и C3/C4 соответственно) и проявлялись в виде характерных медленных высокоамплитудных волн (рис. 4).
Рис. 4.
Фоновая запись биоэлектрической активности головного мозга (Baseline) и запись спустя 20 мин после внутрибрюшинного введения дексмедетомидина (Dex) в дозе 100 мкг/кг (20 min after Dex). Снизу (Rhythm indices) представлены диаграммы, показывающие соотношения дельта- (Delta, 0.5–4 Гц), тета- (Theta, 4–8 Гц), альфа- (Alpha, 8–14 Гц), бета-низкочастотных (Beta-LF, 14–20 Гц) и бета-высокочастотных (Beta-HF, 20–35 Гц) ритмов в данные отрезки времени.
Запись ЗВП
При фотостимуляции с частотой 3 Гц у крыс во всех отведениях наблюдали ответы в виде пиков N1 (≈20 мс), P2 (≈40 мс), N2 (≈60 мс), P3 (≈80 мс) и N3 (≈110 мс). Амплитуды регистрируемых волн уменьшались в каудально-ростральном направлении (по мере удаления от затылочной области с электродами O1 и O2). Стоит отметить, что у некоторых животных в отдельных отведениях мог отсутствовать тот или иной пик (рис. 5).
Запись ССВП
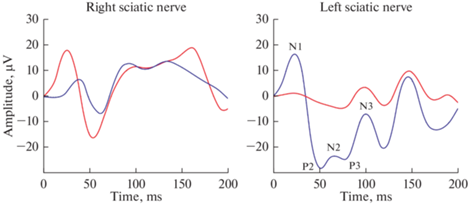
При электрической стимуляции n. sciaticus у крыс кривые ССВП двигательной коры контрлатерального полушария включали в себя пики N1 (≈30 мс,), P2 (≈50 мс), N2 (≈70 мс), P3 (≈80 мс) и N3 (≈100 мс). Ипсилатеральные ответы имели аналогичные компоненты и, как правило, их ранние пики N1 и P2 имели меньшую амплитуду и большую латентность по сравнению с контрлатеральными. Латентности и амплитуды поздних волн N2, P3 и N3, как правило, не отличались между полушариями. Как и в случае ЗВП, некоторые компоненты у отдельных крыс могли отсутствовать (рис. 6).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Предложенный в настоящей статье метод изготовления и имплантации ЭКоГ электродов прост в применении и не требует каких-либо специальных навыков или оборудования. Несмотря на то, что в своей работе мы используем стереотаксическую установку для более точной и симметричной локализации электродов, ее использование не всегда дает выраженные преимущества. В первую очередь, это связано с тем, что толщина регистрирующих электродов достаточно большая (0.5 мм), следовательно, площадь коры головного мозга, с которой регистрируется сигнал, также достаточно велика. Другой проблемой является необходимость надежной фиксации животного в стереотаксической установке, что, с одной стороны, увеличивает время операции, с другой же – предъявляет особые требования к глубине и длительности наркоза. Поэтому, в зависимости от целей и задач исследования, имплантация электродов может осуществляться без использования стереотаксической установки.
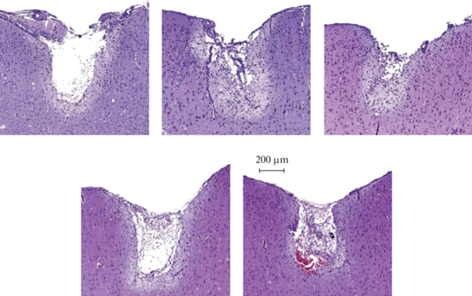
Принципиальным вопросом любого нейрофизиологического исследования, связанного с хронической имплантацией, является безопасность и длительность фиксации используемых электродов или электродных матриц. В наших исследованиях мы не наблюдали признаков болевой реакции, которые у грызунов могут выражаться в снижении общей двигательной и исследовательской активности, повышенной агрессивности, треморе, отсутствии груминга, нарушении дыхания или изменении позы [16]. Также у животных не было отмечено внешних патологических неврологических признаков – нарушения поддержки нормального положения головы, спастичности, судорог, стереотипий, парезов или параличей конечностей [16]. Последнее особенно важно ввиду того, что электроды имплантировали, в числе прочего, в зону двигательной коры. Гистоморфологическая картина области имплантации на 7-е сутки после операции характеризовалась формированием небольшой зоны некроза вокруг места локализации электрода, слабовыраженной экссудативной клеточной реакцией и распространенной глиальной реакцией мозговой ткани вокруг области имплантации (рис. 7). Ввиду того, что используемые электроды не оказывали негативного влияния на состояние испытуемых крыс, при аккуратной эксплуатации зафиксированная на черепе конструкция могла держаться от нескольких недель до нескольких месяцев.
Рис. 7.
Гистоморфологическая картина ткани мозга в области имплантации электродов на 7-й день после операции. Окраска гематоксилином и эозином.
Другим важным вопросом является насколько используемые электроды могут регистрировать локальные (специфические) изменения биоэлектрической активности того или иного отдела головного мозга. Представленные в настоящей работе результаты демонстрируют, что во время исследовательской активности наиболее выраженный подъем тета-ритмов фиксируется в области электродов C3/C4, расположенных в области первичной сенсорной коры над гиппокампом (рис. 3). Данная особенность закономерна ввиду того, что именно гиппокамп у крыс является основным генератором тета-активности, которая во многом связана с исследовательской активностью и запоминанием [17, 18]. Увеличение амплитуды ответов ЗВП по мере продвижения в рострокаудальном направлении, а также бóльшая амплитуда ССВП контрлатерального полушария (по сравнению с ипсилатеральным) при стимуляции седалищного нерва аналогично говорят в пользу специфичности регистрируемой биоэлектрической активности в области того или иного электрода.
Настоящая методика ЭКоГ была использована нами ранее для изучения характерных изменений спонтанной биоэлектрической активности, а также ЗВП и ССВП, возникающих у крыс в острый (3-и сутки) и подострый (7-е сутки) периоды после черепно-мозговой травмы. Были выявлены изменения амплитудно-спектральных характеристик ЭКоГ [19], нарушения работы межполушарных и внутриполушарных связей (посредством кросскорреляционного и когерентного анализа) [20], а также изменения латентностей и амплитуд ранних и поздних ответов ЗВП [21] и ССВП [22]. В дальнейшем в исследовании с использованием всех перечисленных методов анализа была подтверждена нейропротекторная активность агониста альфа-2-адренорецепторов мафедина [2]. Это демонстрирует, что используемые электроды позволяют регистрировать не только эффекты препаратов, оказывающих выраженное влияние на психоэмоциональное состояние крыс (как, например, представленный в настоящей работе дексмедетомидин), но и достаточно деликатные изменения, которые могут вносить нейропротекторные средства в течение патологических процессов при черепно-мозговой травме.
Таким образом, в настоящей работе предложена методика изготовления и имплантации ЭКоГ электродов, которая может быть доступна для большинства лабораторий, занимающихся нейробиологическими исследованиями. Опыт использования данных электродов позволяет говорить о том, что они хорошо переносятся испытуемыми животными, не вызывая признаков болевой реакции или неврологических нарушений, а также выраженных изменений гистоморфологической картины ткани мозга в области имплантации.
Список литературы
Ганцгорн ЕВ, Хлопонин ДП, Макляков ЮС (2017) Анализ выживаемости и частотно-пространственного распределения электроэнцефалографических показателей крыс при глобальной ишемии головного мозга. Кубанск научн мед вестн 2:43–49. [Gantsgorn EV, Khloponin DP, Maklyakov YuS (2017) Survival analysis and spatial-frequency distribution of EEG-indices in rats’ global cerebral ischemia. Kubansk nauchn med vestn 2: 43–49. (In Russ)]. https://doi.org/10.25207/1608-6228-2017-2-43-49
Sysoev YI, Prikhodko VA, Chernyakov RT, Idiyatullin RD, Musienko PE, Okovityi SV (2021) Effects of Alpha-2 adrenergic agonist mafedine on brain electrical activity in rats after traumatic brain injury. Brain Sci 11: 981. https://doi.org/10.3390/brainsci11080981
Кожечкин СН (2003) Сравнительная электроэнцефалографическая оценка анксиолитиков афобазола и диазепама на инбредных крысах линий MR и MNRA с разным уровнем тревожности. Эксп клин фармакол 66: 38–41. [Kozhechkin SN (2003) Comparative EEG study of the anxiolytics afobazole and diazepam in MR and MNRA rats. Exp Clin Pharmacol 66: 38–41. (In Russ)].
Апраксина НК, Авалиани ТВ, Цикунов СГ (2021) Изменение электрокортикографических показателей крыс в ситуации реальной угрозы жизни в модели витального стресса. Рос физиол журн им ИМ Сеченова 107:1553–1567. [Apraksina NK, Avaliany TV, Tsicunov SG (2021) Change of Electrocorticographic Indicators of Rats in a Situation of a Real Threat to Life in the Model of Vital Stress. Russ J Physiol 107: 1553–1567. (In Russ)]. https://doi.org/10.31857/S0869813921120025
Muthuswamy J, Tran P, Rangarajan R, Lenz FA, Hanley DF, Thakor NV (1999) Somatosensory stimulus entrains spindle oscillations in the thalamic VPL nucleus in barbiturate anesthetized rats. Neurosci Lett 262: 191–194. https://doi.org/10.1016/s0304-3940(99)00081-6
Kim H, Park MY, Lee SD, Lee W, Chiu A, Yoo SS (2015) Suppression of EEG visual-evoked potentials in rats through neuromodulatory focused ultrasound. Neuroreport 26: 211–215. https://doi.org/10.1097/WNR.0000000000000330
Li R, Huang ZC, Cui HY, Huang ZP, Liu JH, Zhu QA, Hu Y (2021) Utility of somatosensory and motor-evoked potentials in reflecting gross and fine motor functions after unilateral cervical spinal cord contusion injury. Neural Regen Res 16: 1323–1330. https://doi.org/10.4103/1673-5374.301486
Качалов ЮП, Гнетов АВ, Ноздрачев АД (1980) Металлический микроэлектрод. Л. Наука. [Kachalov YuP, Gnetov AV, Nozdrachev AD (1980) The metallic microelectrode. Leningrad. Nauka. (In Russ)].
Ноздрачев АД, Поляков ЕЛ, Гнетов АВ (1987) Исследования функций головного мозга: некоторые современные методы. Учебное пособие. Л. Изд-во Ленинградск универ [Nozdrachev AD, Polyakov EL, Gnetov AV (1987) Studying brain functions: Some modern methods. A study guide. Leningrad. Leningrad Univer Press. (In Russ)].
Fleischman RW, McCracken D, Forbes W (1977) Adynamic ileus in the rat induced by chloral hydrate. Lab Anim Sci 27: 238–243.
Ogino K, Hobara T, Kobayashi H, Iwamoto S (1990) Gastric mucosal injury induced by chloral hydrate. Toxicol Lett 52: 129–133. https://doi.org/10.1016/0378-4274(90)90146-d
Paxinos G, Watson C (2013) The Rat Brain in Stereotaxic Coordinates, 7th ed. Cambridge. MA. USA. Acad Press.
Creel D, Dustman RE, Beck, EC (1974) Intensity of flash illumination and the visually evoked potential of rats, guinea pigs and cats. Vision Res 14: 725–729. https://doi.org/10.1016/0042-6989(74)90070-4
Hetzler BE, Martin EI (2006) Nicotine-ethanol interactions in flash-evoked potentials and behavior of Long-Evans rats. Pharmacol Biochem Behav 83: 76–98. https://doi.org/10.1016/j.pbb.2005.12.009
Sakatani K, Iizuka H, Young W (1990) Somatosensory Evoked Potentials in Rat Cerebral Cortex Before and After Middle Cerebral Artery Occlusion. Stroke 21: 124–132. https://doi.org/10.1161/01.str.21.1.124
Ferry B, Gervasoni D, Vogt C (2014) Stereotaxic Neurosurgery in Laboratory Rodent. New York. Springer Publ.
Olvera-Cortés ME, Guevara M, González-Burgos I (2004) Increase of the hippocampal theta activity in the Morris water maze reflects learning rather than motor activity. Brain Res Bull 62: 379–384. https://doi.org/10.1016/j.brainresbull.2003.10.003
McNaughton N, Ruan M, Woodnorth MA (2006) Restoring theta-like rhythmicity in rats restores initial learning in the Morris water maze. Hippocampus 16: 1102–1110. https://doi.org/1002/hipo.20235
Сысоев ЮИ, Крошкина КА, Пьянкова ВА, Карев ВЕ, Оковитый СВ (2019) Изменение амплитудных и спектральных параметров электрокортикограмм крыс, перенесших черепно-мозговую травму. Биомедицина 15: 107–120. [Sysoev YuI, Kroshkina KA, P’yankova VA, Karev VE, Okovitiy SV (2019) Amplitude and spectral analysis of electrocorrticograms in rats with traumatic brain injury. J Biomed 15: 107–120. (In Russ)]. https://doi.org/10.33647/2074-5982-15-4-107-120
Sysoev YI, Pyankova VA, Kroshkina KA, Karev VE, Okovityi SV (2020) Cross-Correlation and Coherence Analysis of Electrocortigrams in Rats Subjected to Craniocerebral Trauma. Neurosci Behav Physiol 50: 1216–1223. https://doi.org/10.1007/s11055-020-01023-9
Сысоев ЮИ, Черняков РТ, Идиятуллин РД, Крошкина КА, Пьянкова ВА, Приходько ВА, Оковитый СВ (2020) Изменения зрительных вызванных потенциалов у крыс, перенесших черепно-мозговую травму. Биомедицина 16: 68–77. [Sysoev YuI, Chernyakov RT, Idiyatullin RD, Kroshkina KA, Piankova VA, Prikhodko VA, Okovitiy SV. Changes of Visually Evoked Potentials in Rats after Brain Trauma. J Biomed 16: 68–77. (In Russ)]. https://doi.org/10.33647/2074-5982-16-2-68-77
Сысоев ЮИ, Крошкина КА, Оковитый СВ (2019) Особенности соматосенсорных вызванных потенциалов у крыс после черепно-мозговой травмы. Рос физиол журн им ИМ Сеченова 105: 749–760. [Sysoev YuI, Kroshkina KA, Okovityi SV (2019) Characteristic of Somatosensory Evoked Potentials in Rats after Traumatic Brain Injury. Russ J Physiol 105: 749–760. (In Russ)]. https://doi.org/10.1134/S0869813919060074
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова