Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 2, стр. 262-278
Инсулин и ганглиозиды мозга предотвращают нарушения метаболизма, вызванные активацией свободнорадикальных реакций, при двухсосудистой ишемии переднего мозга крыс и реперфузии
И. О. Захарова 1, Л. В. Баюнова 1, И. И. Зорина 1, А. О. Шпаков 1, Н. Ф. Аврова 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: avrova@iephb.ru
Поступила в редакцию 29.11.2021
После доработки 23.12.2021
Принята к публикации 23.12.2021
- EDN: VTLFCR
- DOI: 10.31857/S086981392202011X
Аннотация
Изучена способность инсулина и ганглиозидов при их раздельном и совместном применении повышать жизнеспособность нейронов в культуре в условиях окислительного стресса и нормализовать нарушения метаболизма в коре мозга крыс, вызванные активацией свободнорадикальных реакций, при ишемии переднего мозга и последующей реперфузии. Найдено, что преинкубация нейронов коры мозга крыс с инсулином и ганглиозидом GM1 значительно повышает жизнеспособность этих клеток, подвергнутых воздействию перекиси водорода. Показано, что при двухсосудистой ишемии переднего мозга крыс и реперфузии в коре мозга происходит достоверное увеличение ряда продуктов перекисного окисления липидов и окислительная инактивация Na+,K+-АТФазы. Найдено, что введение инсулина (0.25 МЕ/крысу, интраназально) или ганглиозидов мозга (15 мг/кг массы тела, внутривенно) предотвращает накопление Шиффовых оснований и повышает активность Na+,K+-АТФазы в коре мозга крыс с ишемией/реперфузией мозга. При совместном введении инсулина и ганглиозидов в указанных относительно низких дозах не выявлено достоверного усиления эффектов друг друга этими нейропротекторами. Эффект интраназального введения инсулина в дозе 0.5 МЕ/крысу более выражен, чем эффект его введения в дозе 0.25 МЕ/крысу. Введение 0.5 МЕ инсулина нормализует уровень конъюгированных диенов и триенов, Шиффовых оснований и активность Na+,K+-АТФазы в коре мозга крыс с ишемией/реперфузией мозга. Таким образом, показана способность инсулина и ганглиозидов мозга частично или полностью предотвращать снижение числа выживших нейронов в культуре в условиях окислительного стресса и нарушения метаболизма в коре мозга, вызванные активацией свободнорадикальных реакций, при ишемии/реперфузии переднего мозга. При этом аддитивность эффектов инсулина и ганглиозидов отсутствовала.
Одной из основных причин гибели нервных клеток мозга при нейродегенеративных, ишемических, диабетических и травматических поражениях мозга является чрезмерная активация свободнорадикальных реакций и, как следствие, развитие окислительного стресса. Инсулин и основные ганглиозиды мозга (GM1, GD1a, GD1b и GT1b) обладают защитным и антиоксидантным эффектами при действии на нейроны мозга и клетки нейрональных линий [1–6]. Однако их способность нормализовать нарушения метаболизма, связанные с активацией свободнорадикальных реакций, при ишемии и последующей реперфузии мозга в настоящее время слабо изучена.
Исследования последних лет убедительно доказали, что инсулин является одним из наиболее перспективных нейропротекторов. В многочисленных опытах показано, что инсулин, вводимый интраназально животным с нейродегенеративными или диабетическими поражениями мозга, оказывает отчетливо выраженный нейропротекторный эффект [7–9]. Нейропротекторное действие интраназально вводимого инсулина подтверждено также в клинических испытаниях инсулина при лечении пациентов с болезнями Альцгеймера и Паркинсона [10–14]. Это обусловлено тем, что при нейродегенеративных заболеваниях инсулиновая сигнализация в мозге ослабевает в результате активации негативных регуляторов инсулинового сигналинга; при этом повышение уровня инсулина, вызванное его интраназальным введением, по крайней мере частично восстанавливает инсулиновый сигналинг в нейронах [15]. В свою очередь, при сахарном диабете 2-го типа и метаболическом синдроме, особенностью которых является развитие периферической инсулиновой резистентности, нарушается транспорт инсулина в мозг через гематоэнцефалический барьер и, как следствие, содержание инсулина в мозге падает [16, 17]. Интраназально вводимый инсулин в этом случае компенсирует дефицит гормона в ЦНС. Необходимо отметить, что ослабление инсулинового сигналинга в мозге ведет не только к нарушению метаболизма и функций мозга, но и к ослаблению центральной регуляции физиологических и биохимических процессов в периферических органах и тканях [18, 19]. При интраназальном введении инсулин попадает непосредственно в мозг при участии клеток обонятельного и тройничного нервов, минуя гематоэнцефалический барьер [20–22], что приводит к быстрому повышению уровня инсулина и нормализации инсулинового сигналинга в гиппокампе и других районах мозга.
При системном введении инсулина его защитный эффект на нейроны мозга при поступлении через гематоэнцефалический барьер может в значительной мере нивелироваться его гипогликемическим эффектом, который способен оказывать опосредованное негативное влияние на жизнеспособность и метаболизм нервных клеток мозга. Крайним выражением отрицательного влияния системного введения инсулина на мозг является инсулиновая кома. При интраназальном же введении инсулина он попадает непосредственно в мозг [20–22] и не способен оказывать выраженного влияния на уровень глюкозы в крови. Более того, при сахарном диабете 2-го типа и метаболическом синдроме системное введение инсулина только усугубляет инсулиновую резистентность и при этом не восполняет дефицит инсулина в мозге из-за вызванных его воздействием нарушений в работе гематоэнцефалического барьера, т.к. его образующие клетки становятся резистентными к инсулину [16, 17]. При интраназальном же введении инсулина его поступление в мозг, как уже указывалось, не зависит от работы барьера между кровью и мозгом [21, 22].
Важно отметить, что в литературе нам не встретилось работ, посвященных изучению эффектов интраназального введения инсулина животным с ишемией мозга и его последующей реперфузией. Исключение составляют лишь отдельные работы нашей лаборатории, в которых, в частности, изучались различия в развитии поражения мозга и в эффектах интраназально вводимого инсулина у старых и молодых крыс с ишемией и реперфузией мозга [23, 24]. Дело в том, что при ишемии мозга (в отличие от нейродегенеративных и диабетических патологий) исследователи сосредоточились в основном на изучении эффектов интраназально вводимого инсулиноподобного фактора роста (IGF-1), а не инсулина. Показано, что вводимый интраназально IGF-1 обладает нейропротекторным эффектом при разных формах ишемии и реперфузии мозга (см., например, [25, 26]). Однако IGF-1 характеризуется высоким онкогенным потенциалом и последствия от его применения в клинике мало изучены. Поэтому инсулин, вводимый интраназально, является более перспективным нейропротектором для применения в клинике, чем IGF-1 [27]. Тем самым, изучение защитных и антиоксидантных эффектов инсулина при его интраназальном введении животным с ишемическим и реперфузионным поражением мозга является актуальным. Следует отметить, что в литературе имеются отдельные данные о нейропротекторном эффекте инсулина при его системном [28, 29] или интрацеребровентрикулярном [30] введении животным с ишемией и реперфузией мозга. В рамках этих исследований делались попытки изучить причины усиления ишемического поражения мозга у животных с диабетом 2-го типа [29]. Однако в клинике такие подходы могут оказаться либо малоэффективными (системное введение), либо малопригодными для широкого применения (введение в спинномозговую жидкость).
Ганглиозиды также обладают нейропротекторным эффектом. Это показано не только в опытах in vitro [1–4], но и в опытах in vivo [31–33]. Так, введение ганглиозидов животным при нейродегенеративных, ишемических и других неблагоприятных воздействиях на мозг повышает жизнеспособность нейронов мозга, предотвращает их гибель и улучшает состояние животных [31–33]. Несмотря на то, что это показано преимущественно на примере введения животным наиболее стабильного ганглиозида GM1, другие основные ганглиозиды мозга также обладают хорошо выраженным защитным эффектом на нейроны мозга в опытах in vitro и in vivo (см., например, [3, 34]).
Мы судили об эффектах инсулина и ганглиозидов мозга в опытах in vivo по их способности предотвращать накопление продуктов перекисного окисления липидов (ПОЛ) и окислительную инактивацию Na+,K+-АТФазы при введении крысам, подвергнутым двухсосудистой ишемии переднего мозга в сочетании с гипотензией и последующей реперфузией. В связи с тем, что развитие окислительного стресса при этой патологии является одним из основных факторов, приводящих к гибели нервных клеток, полученные данные позволяют судить о наличии не только антиоксидантного, но и защитного эффекта инсулина и ганглиозидов мозга. В отношении вводимого интраназально инсулина такого рода исследования других авторов на животных с ишемическим поражением мозга в литературе нам не встретились. В отношении ганглиозидов мозга, ранее было показано [35, 36], что введение ганглиозида GM1 крысам с поражением мозга вследствие ишемии/реперфузии приводит к снижению накопления таких продуктов ПОЛ, как малоновый диальдегид (МДА) и 4-гидроксиноненаль (4-HNE). При этом проведенное нами исследование дополняет эти данные. Так, нами показано снижение в коре мозга крыс с ишемией/реперфузией мозга при введении им ганглиозидов уровня других продуктов ПОЛ – Шиффовых оснований, а также конъюгированных диенов и триенов.
Большой интерес для будущих клинических испытаний представляет выявление нейропротекторов, усиливающих защитное и антиоксидантное действие друг друга на нервные клетки. Экспериментальная проверка того, способны ли инсулин и основные ганглиозиды мозга усиливать (аддитивно или синергически) нейропротекторный эффект друг друга, ранее не проводилась. Между тем показано, что ганглиозид GM1 и фактор роста нервов NGF синергически усиливают протекторный эффект друг друга на нейроны спинного мозга в условиях эксайтотоксичности [2]. Нами поставлена задача изучить, способны ли инсулин и ганглиозиды мозга усиливать защитные и антиоксидантные эффекты друг друга на нейроны коры мозга в культуре, находящиеся в состоянии окислительного стресса, и при введении животным с поражением мозга, вызванным его ишемией и реперфузией. Совместное использование нейропротекторов, обладающих способностью аддитивно или синергически усиливать эффекты друг друга благодаря модуляции сигнальных путей, может быть одним из подходов для повышения их потенциала противостоять развитию нейропатий при нейродегенеративных, ишемических или диабетических поражениях мозга.
Целью работы было сравнительное изучение способности инсулина и ганглиозидов мозга предотвращать или уменьшать гибель нейронов, находящихся в состоянии окислительного стресса, а также при раздельном и совместном введении этих протекторов крысам с двухсосудистой ишемией переднего мозга и последующей реперфузией восстанавливать нарушения метаболизма в коре мозга крыс, вызванные активацией свободнорадикальных реакций. Нами показано, что инсулин и ганглиозиды мозга обладают нейропротекторным и антиоксидантным эффектами при действии на нейроны коры мозга крыс в опытах in vitro и in vivo, но при этом не выявлено их способности достоверно усиливать эффекты друг друга.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования на животных проведены в соответствии с принципами международных норм по биоэтике, рекомендациям комиссии по биоэтике Института эволюционной физиологии и биохимии им. И.М. Сеченова, заседание 10 от 29.10.2020, протокол #10/2020.
Реактивы. Перекись водорода, 3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2H-тетразолия бромида (МТТ), додецилсульфат натрия, NADH, хлоралгидрат, поли-d-лизин и инсулин приобретены у фирмы Sigma (США). Диметилформамид (х. ч.) приобретен у фирмы Вектон (Россия). Среда инкубации Neurobasal medium и ростовые добавки B-27 и B-27 без инсулина произведены фирмой Gibco (Великобритания).
Первичные культура нейронов коры мозга. Нервные клетки выделяли из коры мозга эмбрионов крыс линии Вистар на 17–18-й дни развития, как это описано ранее [37]. При работе с животными соблюдали все международные нормы по биоэтике. Суспензию клеток высеивали по 5 × 105 в каждую лунку в 24-луночные планшеты, покрытые поли-d-лизином, в среде Neurobasal medium с 2% ростовой добавкой B-27. Опыты in vitro начинали на 6–7-й дни культивирования клеток в этой среде. Клетки промывали дважды фосфатным буфером Dulbecco, переводили в среду Neurobasal medium, содержащую 1% ростовой добавки B-27 без инсулина, за 18 ч до начала эксперимента. Преинкубацию нейронов коры мозга с 1 мкМ инсулином или 10 мкМ ганглиозидом GM1 или с обоими нейропротекторами одновременно проводили в течение 1 ч. После этого нейроны коры мозга подвергали действию 100 мкМ перекиси водорода в течение 6 ч.
Определение жизнеспособности нейронов коры мозга в культуре. Оценку жизнеспособности нейронов коры мозга проводили, используя колориметрический метод, который базируется на способности митохондрий жизнеспособных клеток восстанавливать 3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2H-тетразолий бромид (МТТ) в окрашенный МТТ-формазан [38]. В разных опытах нейроны коры мозга были выделены из мозга эмбрионов крыс, полученных от разных самок. Обычно брали эмбрионы от двух или трех самок (в зависимости от числа эмбрионов у каждой из них).
МТТ добавляли к пробам в конечной концентрации 0.05% на 2 ч. Образовавшийся нерастворимый МТТ-формазан растворяли в лизирующем растворе (его добавляли в количестве 167 мкл на лунку планшета) и проводили измерение экстинкций проб при 595 нм. Для приготовления лизирующего раствора использовали 36 г додецилсульфата натрия, 90 мл диметилформамида и 90 мл 0.1 М соляной кислоты. Экстинкцию контрольных проб принимали за 100%, экстинкции других проб выражали в процентах от контроля. В каждом опыте проводили по 3 параллельных определения.
Двухсосудистая ишемия переднего мозга крыс. Двухсосудистую ишемию переднего мозга вызывали у самцов крыс линии Вистар массой 270–330 г, наркотизированных хлоралгидратом в дозе 400 мг на 1 кг массы тела крыс, путем пережатия каротидных артерий на 20 мин в сочетании с гипотензией (снижением артериального давления до 40 мм рт. ст.) [39]. Реперфузию мозга проводили в течение 1 ч, разжимая каротидные артерии и возвращая в кровяное русло кровь с гепарином, отобранную шприцом на стадии ишемии, как описано ранее [39]. Ложнооперированных крыс использовали в качестве контрольных животных. При работе с животными соблюдали все международные нормы по биоэтике. Сразу же по окончании периода реперфузии наркотизированных крыс декапитировали, извлекали мозг, промывали его охлажденным физиологическим раствором и помещали на лед для отделения коры от других структур мозга. Для анализа всех показателей использовалась кора мозга целиком, без специального разделения на зоны. Анализ активности Na+,K+-АТФазы проводили в тот же день. В опытах по определению содержания продуктов ПОЛ получение из суммарной навески коры мозга крыс липидного хлороформ-метанолового экстракта проводилось по методу Фолча и соавт. [40] в тот же день. Взятие аликвот этого экстракта и анализ содержания в них (после упаривания хлороформа и метанола) разных продуктов ПОЛ в соответствии с рекомендуемыми процедурами также осуществляли в день ишемического и реперфузионного воздействия на мозг крыс.
Инсулин в дозе 0.25 и 0.5 МЕ на крысу вводили интраназально за 1 ч до окклюзии – в каждую ноздрю по 10 мкл раствора, содержащего 0.5 или 1 мг инсулина в 1 мл цитратного буфера соответственно. Цитратный буфер готовили как смесь равных объемов 100 мМ лимонной кислоты и 100 мМ цитрата натрия, pH 4.4.
Ганглиозиды выделяли из серого вещества мозга быка по методу Фолча и соавт. [40], верхний водно-метанольный слой после расслоения очищали от возможных примесей, оставшихся в верхнем слое липидов, промывкой равным объемом нижнего хлороформ-метанольного слоя. Для избавления от низкомолекулярных примесей препарат очищали диализом в дистиллированной воде (в течение 5–6 дней со сменой воды 1 раз в сутки). Затем раствор, содержащий ганглиозиды, лиофилизировали. Препарат (для освобождения от оставшихся белковых и других примесей) растворяли в смеси хлороформ–метанол (1 : 1) с последующей фильтрацией через обезжиренный бумажный фильтр. Затем его подвергали очистке на колонках Сефадекс-25 (fine), используя в качестве элюента смесь хлороформ–метанол–вода (60 : 30 : 4.5). 15 мг ганглиозидов на кг массы тела вводили крысам внутривенно за 20 мин до ишемического воздействия.
Определение содержания продуктов ПОЛ и активности Na+,K+-АТФ-азы в коре мозга крыс с ишемией и реперфузией мозга и ложнооперированных животных. Содержание продуктов ПОЛ в коре мозга на мг общих липидов определяли, как это описано ранее для конъюгированных диенов и триенов [41] и для Шиффовых оснований [42]. В опытах по определению содержания продуктов ПОЛ в коре мозга у разных групп крыс, которым вводили 0.25 МЕ инсулина на крысу или 15 мг ганглиозидов на кг массы тела или оба протектора, использовали 57 крыс. Кроме того, опыты по определению влияния на эти показатели 0.5 МЕ инсулина на крысу были поставлены на 19 крысах. В один опыт в каждой группе животных брали по одной крысе. В каждом опыте делали по 3 параллельных определения.
Определение активности Na+,K+-АТФ-азы проводили во фракции неочищенных синаптосом (P2 фракции), выделенной из коры мозга крыс методом дифференциального центрифугирования в 0.32 М сахарозе, приготовленной на 40 мМ Трис-НСl (pH 7.4), 135 мМ NaCl, как это было описано ранее [43]. Активность фермента измеряли по убыли NADH при длине волны 340 нм, используя сопряженную реакцию в присутствии избытка пируваткиназы, лактатдегидрогеназы и фосфоэнолпирувата [39, 43]. Активность Mg2+-АТФазы определяли в присутствии строфантина G, как это описано ранее [39, 43]. Активность Na+,K+-АТФ-азы вычисляли по разнице между суммарной ферментативной активностью и активностью Mg2+-АТФазы [39, 43]. Активность Na+,K+-АТФ-азы выражали в мкмолях неорганического фосфата (Фн) на 1 мг белка за 1 ч. Всего для определения активности Na+,K+-АТФ-азы у разных групп животных использовали 67 крыс. В один опыт в каждой группе животных брали по одной крысе. В каждом опыте кинетику убыли NADH прописывали дважды.
Статистическая обработка данных. Данные представлены как среднее ± SEM. Статистическую достоверность различий, если речь идет о трех и более группах данных, определяли методом однофакторного дисперсионного анализа (ANOVA) с использованием Tukey’s теста для множественных сравнений, а сравнении двух групп данных проводили по t-критерию Стьюдента, используя Prizm 7.0. Достоверными различия считали при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
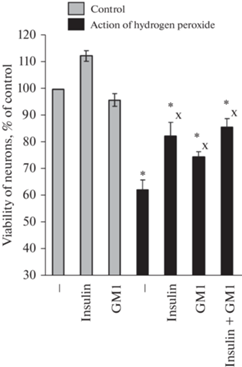
Нейропротекторный эффект инсулина и ганглиозида GM1 на нейроны коры мозга в культуре. Нами изучен защитный эффект инсулина и ганглиозидов мозга (на примере наиболее стабильного основного ганглиозида мозга GM1) на нейроны коры мозга в культуре, подвергнутые действию перекиси водорода. Показано, что 1 мкМ инсулина и 10 мкМ ганглиозида достоверно повышают жизнеспособность культивируемых нейронов коры мозга в условиях окислительного стресса. При совместном действии инсулина и ганглиозида GM1 достоверного увеличения жизнеспособности нейронов по сравнению с эффектом каждого из этих нейропротекторов не выявлено (рис. 1).
Рис. 1.
Влияние 1 мкМ инсулина, 10 мкМ ганглиозида GM1 и обоих нейропротекторов на жизнеспособность нейронов коры мозга крыс в культуре при действии перекиси водорода. Данные получены с помощью МТТ-метода. Они приведены как процент от контроля. Данные представлены как среднее ± SEM из результатов поставленных опытов. На рисунке показаны данные для: контрольных клеток (n = 7); контрольных клеток + инсулин (n = 5); контрольных клеток + GM1 (n = 7); для клеток при действии одной перекиси водорода (n = 7); для клеток при действии перекиси водорода + инсулин или + GM1 или + инсулин + GM1 (n = 6 в каждом случае). Различия достоверны согласно однофакторному анализу ANOVA с использованием теста Tukey’s для множественных сравнений по сравнению: * – с контролем, x – с действием одной перекиси водорода, p < 0.05.
Увеличение содержания продуктов ПОЛ и окислительная инактивация Na+,K+-АТФазы в коре мозга крыс при двухсосудистой ишемии и последующей реперфузии переднего мозга. Исследовалась способность интраназально введенного инсулина и внутривенно введенных ганглиозидов мозга нормализовать нарушения метаболизма, вызванные активацией свободнорадикальных реакций, в коре мозга крыс c двухсосудистой ишемией переднего мозга в сочетании с гипотензией и последующей реперфузией. Найдено, что содержание таких продуктов ПОЛ, как Шиффовы основания, конъюгированные диены и триены, значительно и достоверно увеличивается (рис. 2, табл. 1), а Na+,K+-АТФаза подвергается окислительной инактивации (рис. 3).
Рис. 2.
Влияние введения инсулина (0.25 МЕ/крысу, интраназально), ганглиозидов (15 мг на кг массы тела крыс, внутривенно) или обоих нейропротекторов на содержание Шиффовых оснований в коре мозга крыс при двухсосудистой ишемии переднего мозга и реперфузии. Данные выражены в условных единицах на мг липидов и представляют собой среднее ± SEM из результатов поставленных опытов. Сокращения: gangl. – gangliosides. На рисунке представлены данные для ложнооперированных крыс – ЛО (n = 12); для ЛО + инсулин (n = 6); для ЛО + ганглиозиды (n = 7); для ЛО + инсулин + ганглиозиды (n = 6); для крыс с ишемией и реперфузией мозга – И/Р (n = 7); И/Р + инсулин (n = 6); И/Р + ганглиозиды (n = 7); И/Р + инсулин + ганглиозиды (n = 6). Различия достоверны согласно однофакторному анализу ANOVA с использованием теста Tukey’s для множественных сравнений по сравнению: * – с данными по ложнооперированным крысам, x – с данными по крысам с ишемией и реперфузией, которым не вводили протекторы, p < 0.01 во всех случаях.
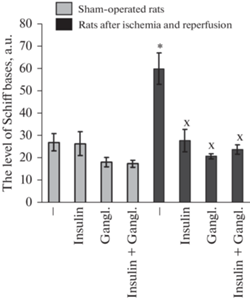
Таблица 1.
Влияние двухсосудистой ишемии и реперфузии переднего мозга, введения инсулина (0.25 и 0.5 МЕ/крысу, интраназально) или ганглиозидов (15 мг на кг внутривенно) или обоих нейропротекторов на содержание конъюгированных диенов и триенов в коре мозга крыс (условные единицы, на мг липидов)
| Группы крыс | Число опытов | Содержание диеновых конъюгатов | Содержание триеновых конъюгатов |
|---|---|---|---|
| Ложнооперированные крысы# | n = 12 | 55.6 ± 1.36 | 13.7 ± 0.4 |
| Крысы c ишемией и реперфузией мозга | n = 7 | 76.1 ± 6.1** | 18.7 ± 1.6** |
| Крысы с ишемией и реперфузией мозга + + 0.25 МЕ/крысу инсулина | n = 5 | 67.4 ± 5.36* | 16.2 ± 1.4* |
| Крысы с ишемией и реперфузией мозга + + 15 мг ганглиозидов на кг массы тела | n = 5 | 61.8 ± 2.13* | 16.1 ± 1.2* |
| Крысы с ишемией и реперфузией мозга + + 0.25 МЕ/крысу инсулина + 15 мг ганглиозидов на кг массы тела | n = 5 | 66.2 ± 2.29* | 16.35 ± 0.7* |
| Ложнооперированные крысы | n = 7 | 58.0 ± 2.7 | 14.1 ± 0.5 |
| Крысы с ишемией и реперфузией мозга | n = 6 | 76.0 ± 6.2** | 17.9 ± 1.5** |
| Крысы с ишемией и реперфузией мозга + + 0.5 МЕ/крысу инсулина | n = 6 | 59.8 ± 5.5 | 13.6 ± 1.1x |
Примечание. Содержание конъюгированных диенов и триенов выражали в условных единицах в расчете на мг липидов. Данные представлены как среднее ± SEM из результатов поставленных опытов. Число опытов для разных групп животных показано в отдельной графе таблицы. Различия достоверны по сравнению: * и ** – с контролем (ложнооперированными крысами), * – p < 0.05, ** – p < 0.001; x – с данными по крысам с ишемией и реперфузией мозга, p < 0.05.
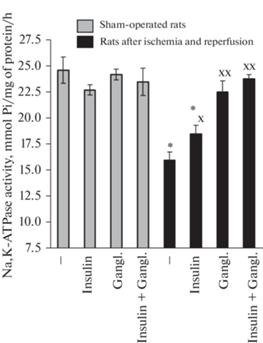
Рис. 3.
Влияние введения инсулина (0.25 МЕ/крысу, интраназально), ганглиозидов (15 мг на кг массы тела крыс, внутривенно) и обоих нейропротекторов на активность Na+,K+-АТФазы в коре мозга крыс при двухсосудистой ишемии переднего мозга и реперфузии (мкмоль Фн /мг белка/ч). Данные представляют собой среднее ± SEM из результатов поставленных опытов. Сокращения: gangl. – gangliosides. На рисунке представлены данные для ложнооперированных крыс – ЛО (n = 11); ЛО + инсулин, (n = 6); ЛО + GM1 (n = 7); ЛО + инсулин + ганглиозиды (n = 6); для крыс с ишемией и реперфузией переднего мозга – И/Р (n = 6); И/Р + инсулин (n = 7); И/Р + ганглиозиды (n = 6); И/Р + инсулин + ганглиозиды (n = 6). Различия достоверны по t-критерию Стьюдента по сравнению: * – с контролем (ложнооперированными крысами), p < 0.01; x, хх– c крысами, подвергнутыми ишемии и реперфузии и не получавшими протекторов, х – p < 0.05, хх – p < 0.01.
Нормализация уровня продуктов ПОЛ в коре мозга крыс с двухсосудистой ишемией переднего мозга и последующей реперфузией при введении инсулина или ганглиозидов. Нами показано, что введение инсулина (интраназально, 0.25 МЕ/крысу) или ганглизидов мозга (внутривенно, 15 мг/кг массы тела крыс) приводит к достоверному снижению уровня одного из конечных продуктов ПОЛ – Шиффовых оснований в коре мозга крыс до значений, наблюдаемых у ложнооперированных животных (рис. 2).
При совместном применении инсулина и ганглизидов мозга уровень Шиффовых оснований в коре мозга крыс с ишемией/реперфузией мозга не отличался от значений, наблюдаемых при введении одного из этих нейропротекторов (рис. 2). Не выявлено способности этих соединений достоверно усиливать действие друг друга.
Для выявления аддитивности или синергизма в защитном эффекте инсулина и ганглиозидов мозга в их способности нормализовать нарушения метаболизма, вызванные активацией свободнорадикальных реакций, мы вводили эти нейропротекторы крысам в относительно низких дозах – инсулин интраназально в дозе 0.25 МЕ/крысу и ганглиозиды внутривенно в дозе 15 мг/кг массы тела крыс. Обычно при исследовании протекторного эффекта этих соединений на крысах применяют их в существенно более высоких дозах. Нами показано, что даже применение таких относительно низких доз этих соединений приводит к достоверному снижению в коре мозга крыс с ишемией и реперфузией переднего мозга такого конечного продукта ПОЛ, как Шиффовы основания (рис. 2). При совместном их введении в указанных дозах также происходило снижение уровня Шиффовых оснований в коре мозга ишемических крыс, но оно достоверно не превышало снижение этого продукта ПОЛ, вызванное инсулином или ганглиозидами.
Что касается ди- и триеновых конъюгатов, то их накопление в коре мозга крыс при ишемии и репеперфузии было также достоверным (табл. 1). При введении крысам 0.25 МЕ инсулина/крысу интраназально или 15 мг ганглиозидов на кг массы тела крыс, внутривенно, наблюдалась тенденция к снижению этих продуктов ПОЛ, однако их содержание продолжало оставаться повышенным по сравнению с их содержанием в коре мозга контрольных ложнооперированных крыс (табл. 1). Совместное введение обоих нейропротекторов в указанных дозах также не предотвращало накопление этих продуктов ПОЛ в коре мозга крыс. Оно не было более эффективным, чем применение одного из этих нейропротекторов (табл. 1). Таким образом, аддитивности в эффекте инсулина и ганглизидов мозга не отмечалось и при анализе данных по их влиянию на содержание ди- и триеновых конъюгатов в коре мозга крыс после ишемии и реперфузии (табл. 1).
В то же время, нами показано, что более высокие дозы этих нейропротекторов могут быть более эффективными. Так, интраназальное введение 0.5 МЕ/инсулина/крысу, то есть в дозе, обычно применяемой при изучении его защитных эффектов, предотвращало накопление ди- и триеновых конъюгатов в коре мозга крыс, подвергнутых ишемии и реперфузии, снижая их содержание практически до уровня ложнооперированных крыс (табл. 1).
Нормализация или повышение активности Na+,K+-АТФазы в коре мозга крыс, сниженной при ишемии и реперфузии мозга, под влиянием введения инсулина или ганглиозидов. Мы изучали также влияние ишемии и реперфузии переднего мозга на активность Na+,K+-АТФазы (рис. 3). На рис. 3 видно достоверное и хорошо выраженное снижение активности фермента Na+,K+-АТФазы при ишемии и реперфузии мозга крыс (c 24.6 ± 1.3 до 15.9 ± 0.8 мкмоль Фн/мг белка/ч), что связано с активацией свободнорадикальных реакций в мозге крыс. Введение ганглиозидов крысам даже в относительно низких дозах (15 мг/кг, внутривенно) полностью нормализовало активность фермента, повышая ее до 22.5 ± 1.1 мкмоль Фн/мг белка/ч (p < 0.01), т.е. до контрольных величин (рис. 3). Инсулин же в дозе 0.25 МЕ/крысу также достоверно увеличивал активность фермента – до 18.5 ± 0.8 мкмоль Фн/мг белка/ч (p < 0.05), но при этом она продолжала оставаться существенно ниже контрольных величин (p < 0.01).
Следует отметить, что в более высоких дозах, а именно в дозе 0.5 МЕ/крысу, инсулин повышал активность Na+,K+-АТФазы до 22.6 ± 2.8 мкмоль Фн/мг белка/ч, то есть до величин, примерно равных контрольным, наблюдаемым у ложнооперированных крыс (p < 0.01) (табл. 2).
Таблица 2.
Влияние 0.25 и 0.5 МЕ инсулина на крысу на активность Na+,K+-АТФазы в коре мозга крыс с двухсосудистой ишемией переднего мозга и реперфузией (мкмоль Фн/мг белка/ч)
| Дозы введенного инсулина | Ложнооперированные крысы | Число опытов | Крысы с ишемией и реперфузией мозга | Число опытов |
|---|---|---|---|---|
| Без введения инсулина# | 24.6 ± 1.3 | n =11 | 15.9 ± 0.8** | n = 6 |
| Введение 0.25 МЕ инсулина на крысу | 22.7 ± 0.6 | n = 6 | 18.5 ± 0.8*х | n = 7 |
| Введение 0.5 МЕ инсулина на крысу | 22.8 ± 2.29 | n = 6 | 22.6 ± 2.8х | n = 6 |
Примечание. Данные представлены как среднее ± SEM из результатов поставленных опытов. Число опытов приведено в отдельных графах справа от значений активности фермента. Различия достоверны по t-критерию Стьюдента по сравнению: * и ** – с контролем (ложнооперированными крысами), * – p < 0.05, ** – p < 0.01; x – с крысами, подвергнутыми ишемии и реперфузии мозга, x – p < 0.05.
Таким образом, в работе показана высокая эффективность инсулина и ганглиозидов как нейропротекторов, повышающих жизнеспособность нейронов в условиях окислительного стресса и нормализующих нарушения метаболизма в тканях мозга, связанные с активацией свободнорадикальных реакций при двухсосудистой ишемии и реперфузии мозга. При этом аддитивности или синергизма в защитном воздействии инсулина и ганглиозидов при их совместном применении выявлено не было ни в одной из серий проведенных опытов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Неконтролируемое увеличение образования активных форм кислорода является одной из основных причин гибели нервных клеток мозга при разных видах патологии – при нейродегенеративном, ишемическом, эксайтотоксическом или травматическом поражении мозга. Как указывалось во введении, существует явно выраженный пробел в изучении защитных и антиоксидантных эффектов инсулина при его интраназальном введении животным с поражением мозга, вызванным ишемическим и последующим реперфузионным воздействием на него. Это объясняется тем, что основное внимание исследователей было до последнего времени сосредоточено на изучении защитного действия IGF-1 при этой патологии [25, 26]. Антиоксидантные эффекты ганглиозидов при их введении животным с ишемическим повреждением мозга также пока изучены недостаточно и ограничены отдельными публикациями [35–38]. Настоящая работа во многом восполняет этот пробел.
В работе показано, что двухсосудистая ишемия мозга крыс в сочетании с гипотензией и последующей реперфузией приводит к достоверному повышению в коре мозга таких продуктов ПОЛ как ди- и триеновые конъюгаты и Шиффовы основания, а также вызывает окислительную инактивацию Na+, K+-АТФазы. Эти результаты согласуются с данными других авторов о накоплении в ткани мозга крыс, подвергнутых ишемии и реперфузии, различных продуктов ПОЛ [35, 36].
В качестве протекторов мы использовали инсулин и ганглиозиды мозга быка. Основными ганглиозидами мозга млекопитающих являются GM1, GD1a, GD1b и GT1b. Все они обладают сходным нейропротекторным эффектом и сходной структурой углеводной цепи, различаясь лишь по числу (от одного до трех) и местоположению остатков сиаловой кислоты [3, 34].
Согласно полученным нами данным, интраназальное введение инсулина или системное введение ганглиозидов мозга крысам перед двухсосудистой ишемией и последующей реперфузией мозга способно нормализовать нарушения метаболизма в коре мозга крыс, обусловленные чрезмерной активацией свободнорадикальных реакций при этой патологии. Так, содержание в коре мозга Шиффовых оснований, относящихся к конечным продуктам ПОЛ, достоверно снижалось при внутривенном введении крысам 15 мг ганглиозидов на кг массы тела крыс за 20 мин до двухсосудистой ишемии и последующей реперфузии мозга (рис. 2). Эти данные согласуются с данными других авторов [35, 36], изучавших влияние введения крысам GM1 (наиболее стабильного из основных ганглиозидов мозга) на содержание других продуктов ПОЛ. Они показали, что под влиянием введения ганглиозида GM1 происходит снижение в ткани мозга крыс с ишемией и реперфузией мозга малонового диальдегида (МДА) и 4-гидроксиноненаля (4-HNE).
В настоящей работе нами было применено введение крысам двух разных доз инсулина – 0.25 и 0.5 МЕ гормона на крысу. При введении 0.25 МЕ инсулина он достоверно снижал и полностью нормализовал содержание в коре мозга крыс с ишемией/реперфузией мозга такого продукта ПОЛ, как Шиффовы основания (рис. 2). При этом существенного изменения уровня конъюгированных ди- и триенов под влиянием введения 0.25 МЕ инсулина не происходило. В то же время по нашим данным введение 0.5 МЕ инсулина крысам с ишемией/реперфузией мозга снижало содержание и этих продуктов ПОЛ практически до контрольного уровня (табл. 1). У нас нет возможности сравнить эти результаты с данными других авторов, так как работы по изучению влияния введения интраназального инсулина на накопление каких-либо продуктов ПОЛ в ткани мозга при ишемии и реперфузии в литературе нам не встретились.
В настоящей работе мы изучили также влияние двухсосудистой ишемии и реперфузии и введения инсулина и ганглиозидов на активность Na+,K+-АТФазы. Этот фермент является важным компонентом различных клеток организма животных. Основной функцией Na+,K+-АТФазы является поддержание потенциала покоя клеток и регуляция их объема. Различия в концентрации ионов натрия и калия в нейронах и в межклеточном пространстве, которые создаются прежде всего благодаря активности Na+,K+-АТФазы, используются для распространения нервных импульсов [44, 45]. Активность этого фермента можно рассматривать как интегральный показатель, отражающий степень поражения мозга при патологических состояниях. Резкое снижение активности Na+,K+-АТФазы свидетельствует о развитии окислительного стресса и нарушении обмена ионов, тогда как увеличение активности Na+,K+-АТФазы под влиянием протекторов может свидетельствовать о нормализации обменных процессов в клетках и их функций.
Уменьшение активности Na+,K+-АТФазы в мозге при ишемии и последующей реперфузии может быть результатом инактивации фермента из-за токсического действие некоторых продуктов ПОЛ, содержащих альдегидные группы в своем составе, прежде всего из-за действия 4-HNE [46–48]. При действии нейропротекторов, обладающих антиоксидантными свойствами, активность фермента может возрастать или даже полностью нормализоваться.
Мы наблюдали практически полную нормализацию активности Na+,K+-АТФазы при введении крысам с ишемией и реперфузией переднего мозга 15 мг ганглиозидов на кг массы тела крыс. Активность фермента увеличивалась при таком воздействии с 15.9 ± 0.8 до 22.5 ± 1.1 мкмоль Фн/мг белка/ч (p < 0.01) и не отличалась от величин, характерных для мозга ложнооперированных крыс (рис. 3). Такое воздействие относительно низких доз ганглиозидов связано, очевидно, преимущественно с их антиоксидантным эффектом [3] и способностью стабилизировать нейрональные мембраны [2, 3]. При введении 0.25 МЕ инсулина на крысу наблюдалось также достоверное увеличение активности фермента – с 15.9 ± 0.8 до 18.5 ± 0.8 мкмоль Фн/мг белка/ч (p < 0.05). Но при этом активность фермента оставалось достоверно ниже контрольных величин, характерных для ложнооперированных животных (рис. 3). Очевидно, это связано с тем, что мы использовали относительно низкие дозы инсулина (0.25 МЕ/крысу) в наших основных опытах, рассчитывая, что таким образом будет легче уловить аддитивный или синергический эффект в действии инсулина и ганглиозидов, если он существует. При введении животным 0.5 МЕ инсулина на крысу наблюдалась полная нормализация активности фермента, которая увеличивалась в коре мозга до 22.6 ± 2.8 мкмоль Фн/мг белка/ч у крыс с ишемией и реперфузией переднего мозга и достоверно не отличалась от величин, наблюдаемых у ложнооперированных животных. Данные в отношении влияния инсулина на активность Na+,K+-АТФазы в мозгу крыс с ишемией и реперфузией мозга были получены нами впервые.
Одной из целей нашей работы была оценка способности инсулина и ганглиозидов усиливать эффекты друг друга. Выявление нейропротекторов, усиливающих эффекты друг друга, и их совместное использование может способствовать более эффективному лечению различных нейропатий, возникающих при нейродегенеративных, диабетических и ишемических поражениях мозга. Это особенно важно в случае таких соединений, как инсулин, поскольку при длительном применении его в высоких концентрациях развивается резистентность клеток-мишеней к его воздействию, что характерно для сахарного диабета 2-го типа и метаболического синдрома, а также для клеток при болезнях Альцгеймера и Паркинсона [9, 49]. Так, показано, что препарат инсулина Detemir с пролонгированным действием при его относительно коротком применении (21 день) улучшает состояние пациентов с болезнью Альцгеймера [10], но не эффективен при использовании в течение нескольких месяцев [11]. Мы не выявили способности инсулина и ганглиозидов усиливать защитный эффект друг друга при действии на нейроны коры мозга в культуре (рис. 1). Не выявлено нами и способности этих нейропротекторов усиливать антиоксидантный эффект (и, как следствие, защитный эффект) друг друга при введении крысам, подвергнутым ишемии и последующей реперфузии переднего мозга.
ЗАКЛЮЧЕНИЕ
Полученные результаты показали, что интраназальное введение инсулина и системное введение ганглиозидов мозга способны нормализовать метаболические нарушения в коре мозга, возникающие в результате чрезмерной активации свободнорадикальных реакций при двухсосудистой ишемии и реперфузии мозга. В опытах на нейронах коры мозга в культуре показано, что инсулин и ганглиозид GM1 (наиболее устойчивый из основных ганглиозидов мозга) значительно повышают жизнеспособность этих клеток в условиях окислительного стресса. Полученные данные свидетельствуют о том, что антиоксидантные эффекты инсулина и ганглиозидов мозга вносят, очевидно, весомый вклад в их нейропротекторный эффект при ишемии и реперфузии мозга. При этом предположение о способности инсулина и ганглиозидов усиливать защитный эффект друг друга при действии на нейроны коры мозга в культуре в условиях окислительного стресса и взаимно усиливать антиоксидантный эффект при введении крысам с ишемией и реперфузией мозга нами не было подтверждено.
Список литературы
Bachis A, Rabin SJ, Del Fiacco M, Mocchetti I (2002) Gangliosides prevent excitotoxicity through activation of TrkB receptor. Neurotox Res 4: 225–234. https://doi.org/10.1080/10298420290015836
Huang F, Dong X, Zhang L, Zhang X, Zhao D, Bai X, Li Z (2010) GM1 and nerve growth factor modulate mitochondrial membrane potential and neurofilament light mRNA expression in cultured dorsal root ganglion and spinal cord neurons during excitotoxic glutamate exposure. J Clin Neurosci 17: 495–500. https://doi.org/10.1016/j.jocn.2009.07.112
Avrova NF, Victorov IV; Tyurin VA, Zakharova IO, Sokolova TV, Andreeva NA, Stelmaschuk EV, Tyurina YY, Gonchar VS (1998) Inhibition of glutamate-induced intensification of free radical reactions by gangliosides: possible role in their protective effect in rat cerebellar granule cells and brain synaptosomes. Neurochem Res 23: 945–952. https://doi.org/10.1023/a:1021076220411
Zakharova IO, Sokolova TV, Vlasova YA, Furaev VV, Rychkova MP, Avrova NF (2014) GM1 ganglioside activates ERK1/2 and Akt downstream of Trk tyrosine kinase and protects PC12 cells against hydrogen peroxide toxicity. Neurochem Res 39: 2262–2275.https://doi.org/10.1007/s11064-014-1428-6
Ramalingam M, Kim SJ (2015) Insulin exerts neuroprotective effects via Akt/Bcl-2 signaling pathways in diffrentiated SH-SY5Y cells. J Recep Signal Transduct Res 35: 1–7. https://doi.org/10.3109/10799893.2014.922576
Zakharova IO, Sokolova TV, Bayunova LV, Zorina II. Rychkova MP, Shpakov AO, Avrova NF (2019) The protective effect of insulin on rat cortical neurons in oxidative stress and its dependence on the modulation of Akt, GSK-3beta, ERK1/2, and AMPK activities. Int J Mol Sci 20: pii: E3702. https://doi.org/10.3109/10799893.2014.92257610.3390/ijms20153702
Chen Y, Guo Z, Mao YF, Zheng T, Zhang B (2018) Intranasal insulin ameliorates cerebral hypometabolism, neuronal loss, and astrogliosis in streptosotocin-induced Alzheimer’s rat model. Neurotox Res 33: 716–724. https://doi.org/10.1007/s12640-017-9809-7
Song Y, Ding W, Bei Y, Xiao Y, Tong HD, Wang LB, Ai LY (2018) Insulin is a potential antioxidant for diabetes-associated cognitive decline via regulating Nrf2 dependent antioxidant enzymes. Biomed Pharmacother 104: 474–484. https://doi.org/10.1016/j.biopha.2018.04.097
Fine JM, Stroebel BM, Faltesek KA, Terai K, Haase L, Knutzen K.E, Kosyakovsky J, Bowe TJ, Fuller A.K, Frey WH, Hanson LR (2020) Intranasal delivery of low-dose insulin ameliorates motor dysfunction and dopaminergic cell death in a 6-OHDA rat model of Parkinson’s Disease. Neurosci Lett 714: 134567. https://doi.org/10.1016/j.neulet.2019.134567
Claxton A, Baker LD, Hanson AJ, Trittschuh EH, Collerton B, Morgan A, Callaghan M, Arbuckle M, Behl C, Craft S (2015) Long-acting insulin Detemir improves cognition for adults with mild cognitive impairment or early-stage Alzheimer’s disease dementia. J Alzheimers Dis 44: 897–906. https://doi.org/10.3233/JAD-141791
Craft S, Claxton A, Baker LD, Hanson AJ, Collerton B, Trittschuh EH, Dahl D, Caulder E, Neth B, Montine TJ, Jung Y, Maldjian J, Whitlow C, Friedman S (2017) Effects of regular and long-acting insulin on cognition and Alzheimer’s disease biomarkers: A pilot clinical trial. J Alzheimers Dis 57: 1325–1334. https://doi.org/:10.3233/JAD-161256
Avgerinos KI, Kalaitzidis G, Malli A, Kalaitzoglou D, Myserlis PG, Lioutas VA (2018) Intranasal insulin in Alzheimer’s dementia or mild cognitive impairment. A systematic review. J Neurol 265: 1497–1510. https://doi.org/10.1007/s00415-018-8768-0
Novak P, Maldonado DAP, Novak V (2019) Safety and preliminary efficacy of intranasal insulin for cognitive impairment in Parkinson disease and multiple system atrophy: A double-blinded placebo-controlled pilot study. PLoS One 14: e0214364. https://doi.org/10.1371/journal.pone.0214364
Hallschmid M (2021) Intranasal insulin. J Neuroendocrinol 33: e12934. https://doi.org/10.1111/jne.12934
Shpakov AO, Derkach KV, Berstein LM (2015) Brain signaling systems in the Type 2 diabetes and metabolic syndrome: promising target to treat and prevent these diseases. Future Sci OA 1: FSO25. https://doi.org/10.4155/fso.15.23
Romanova IV, Derkach KV, Mikhrina AL, Sukhov IB, Mikhailova EV, Shpakov AO (2018) The Leptin, Dopamine and Serotonin Receptors in Hypothalamic POMC-Neurons of Normal and Obese Rodents. Neurochem Res 43: 821–837. https://doi.org/10.1007/s11064-018-2485-z
Derkach K, Zakharova I, Zorina I, Bakhtyukov A, Romanova I, Bayunova L, Shpakov A (2019) The evidence of metabolic-improving effect of metformin in Ay/a mice with genetically-induced melanocortin obesity and the contribution of hypothalamic mechanisms to this effect. PLoS One. 14: e0213779. https://doi.org/10.1371/journal.pone.0213779
Minokoshi Y, Alquier T, Furukawa N, Kim YB, Lee A, Xue B, Mu J, Foufelle F, Ferre P, Birnbaum MJ, Stuck BJ, Kahn BB (2004) AMP-kinase regulates food intake by responding to hormonal and nutrient signals in the hypothalamus. Nature 428: 569–574. https://doi.org/10.1038/nature02440
Erichsen JM, Calva CB, Reagan, LP, Fadel JR (2021) Intranasal insulin and orexins to treat age-related cognitive decline. Physiol Behav 234: 113370. https://doi.org/10.1016/j.physbeh.2021.113370
Lochhead JJ, Kellohen KL, Ronaldson PT, Davis TP (2019) Distribution of insulin in trigeminal nerve and brain after intranasal administration. Sci Rep 9: 2621. https://doi.org/10.1038/s41598-019-39191-5
Fan LW, Carter K, Beatt A, Pang Y (2019) Rapid transport of insulin to the brain following intranasal administration in rats. Neural Regen Res 14: 1046–1051. https://doi.org/10.4103/1673-5374.250624
Tashima T (2020) Shortcut approaches to substance delivery into the brain based on intranasal administration using nanodelivery strategies for insulin. Molecules 25(21): 5188. https://doi.org/10.3390/molecules25215188
Zorina II, Galkina OV, Bayunova LV, Zakharova IO (2019) Effect of insulin on lipid peroxidation and glutathione levels in a two-vessel occlusion model of rat forebrain ischemia followed by reperfusion. J Evol Biochem Physiol 35: 333–335. https://doi.org/10.1134/S0022093019040094
Zorina II, Fokina EA, Zakharova IO, Bayunova LV, Shpakov AO (2020) Characteristics of changes in lipid peroxidation and Na+/K+-ATPase activity in the cortex of old rats in conditions of two-vessel cerebral ischemia/reperfusion. Adv Geront 10: 156–161. https://doi.org/10.1134/s2079057020020162
Kooijman R, Sarre S, Michotte Y, De Keyser J (2009) Insulin-like growth factor-I: a potential neuroprotective compound for the treatment of acute ischemic stroke? Stroke 40: e83–e88. https://doi.org/10.1161/STROKEAHA.108.528356
Shen H, Gu X, Wei ZZ, Wu A, Liu X (2021) Combinatorial intranasal delivery of bone marrow mesenchymal stem cells and insulin-like growth factor-1 improves neurovascularization and functional outcomes following focal cerebral ischemia in mice. Exp Neurol 337: 113542. https://doi.org/10.1016/j.expneurol.2020.113542
Lioutas VA, Alfaro-Martinez F, Bedoya F, Chung CC, Pimentel DA, Novak V (2015) Intranasal insulin and insulin-like growth factor-1 as neuroprotectants in acute ischemic stroke. Transl Stroke Res 6: 264–275. https://doi.org/10.1007/s12975-015-0409-7
Sanderson TH, Kumar R, Murariu-Dobrin AC, Page AB, Krause GS, Sullivan JM (2009) Insulin activates the PI3K-Akt survival pathway in vulnerable neurons following global brain ischemia. Neurol Res 31: 947–958. https://doi.org/10.1179/174313209X382449
Huang SS, Lu YJ, Huang JP., Wu YT, Day YJ, Hung LM (2014) The essential role of endothelial nitric oxide synthase activation in insulin-mediated neuroprotection against ischemic stroke in diabetes. J Vasc Surg 59: 483–491. https://doi.org/10.1016/j.jvs.2013.03.023
Russo V, Candeloro P, Malara N, Perozziello G, Iannone M, Scicchitano M, Mollace R, Musolino V, Gliozzi M, Carresi C, Morittu VM, Gratteri S, Palma E, Muscoli C., Di Fabrizio E, Mollace V (2019) Key role of cytochrome C for apoptosis detection using Raman microimaging in an animal model of brain ischemia with insulin treatment. Appl Spectrosc 73: 1208–1217. https://doi.org/10.1177/0003702819858671
Su D, Ma J, Yang J, Kang Y, Lv M, Li Y (2017) Monosialotetrahexosyl-1 ganglioside attenuates diabetes-associated cerebral ischemia/reperfusion injury through suppression of the endoplasmic reticulum stress-induced apoptosis. J Clin Neurosci 41: 54–59. https://doi.org/10.1016/j.jocn.2017.03.047
Schneider JS, Aras R, Williams CK, Koprich JB, Brotchie JM, Singh V (2019) GM1 ganglioside model of Parkinson’s disease. Sci Rep 9: 8362. https://doi.org/10.1038/s41598-019-42847-x
Zhang Z, Liu W, Shen M, Ma X, Li R, Jin X, Bai H, Gao L (2021) Protective effect of GM1 attenuates hippocampus and cortex apoptosis after ketamine exposure in neonatal rat via PI3K/AKT/GSK3β pathway. Mol Neurobiol 58: 3471–3483. https://doi.org/10.1007/s12035-021-02346-5
Yamamoto HA, Mohanan PV (2003) Ganglioside GT1b and melatonin inhibit brain mitochondrial DNA damage and seizures induced by kainic acid in mice. Brain Res 964: 100–106. https://doi.org/10.1016/s0006-8993(02)04083-0
Zhang J, Fang X, Zhou Y, Deng X, Lu Y, Li J, Li S, Wang B, Xu R (2015) The possible damaged mechanism and the preventive effect of monosialotetrahexosylganglioside in a rat model of cerebral ischemia-reperfusion injury. J Stroke Cerebrovasc Dis 24: 1471–14788. https://doi.org/10.1016/j.jstrokecerebrovasdis.2015.02.008
Li-Mao, Liao YJ, Hou GH, Yang ZB, Zuo ML (2016) Monosialotetrahexosylganglioside protect cerebral ischemia/reperfusion injury through upregulating the expression of tyrosine hydroxylase by inhibiting lipid peroxidation. Biomed Pharmacother 84: 1923–1929. https://doi.org/10.1016/j.biopha.2016.11.019
Mironova EV, Evstratova AA, Antonov SM (2007) A fluorescence vital assay for the recognition and quantification of excitotoxic cell death by necrosis and apoptosis using confocal microscopy on neurons in culture J Neurosci Methods 163: 1–8. https://doi.org/10.1016/j.jneumeth.2007.02.010
Zorina II, Bayunova LV, Zakharova IO, Avrova NF (2018)The dependence of the protective effect of insulin on its concentration and modulation of ERK1/2 activity under the conditions of oxidative stress in cortical neurons. Neurochem J 12: 111–116. https://doi.org/10.1134/S1819712417040110
Molchanova SM, Moskvin AN, Zakharova IO, Yurlova LA, Nosova IY, Avrova NF (2005) The effect of two-vessel forebrain ischemia and administration of indomethacin and quinacrine on Na+,K+-ATPase activity in different areas of the rat brain. J Evol Biochem Physiol 41: 33–38.
Folch J, Lees M, Sloane Stanley GH (1957) A simple method for the isolation and purification of total lipids from animal tissues. J Biol Chem 226: 497–509.
Ferenczi S, Kuti D, Cserháti M, Krifaton C, Szoboszlay S, Kukolya J, Szőke Z, Albert M, Kriszt B, Kovács KJ, Mézes M, Balogh K (2020) Effects of single and repeated oral doses of ochratoxin A on the lipid peroxidation and antioxidant defense systems in mouse kidneys. Toxins (Basel) 12: 732. https://doi.org/10.3390/toxins12110732
Sarieva, KV, Lyanguzov AY, Galkina OV, Vetrovoy OV (2019) The effect of severe hypoxia on HIF1- and Nrf2-mediated mechanisms of antioxidant defense in the rat neocortex. Neurochem J 13: 145–155. https://doi.org/10.1134/S1819712419020107
Leon A, Facci L, Toffano G, Sonnino S, Tettamanti G (1981) Activation of Na+,K+-ATPase by nanomolar concentrations of GM1 ganglioside. J Neurochem 37: 350–357. https://doi.org/10.1111/j.1471-4159.1981.tb00462.x
Pasantes-Morales H, Tuz K (2006) Volume changes in neurons: hyperexcitability and neuronal death. Contrib Nephrol 152: 221–240. https://doi.org/10.1159/000096326
Shao LR, Janicot R, Stafstrom CE (2021) Na+-K+-ATPase functions in the developing hippocampus: regional differences in CA1 and CA3 neuronal excitability and role in epileptiform network bursting. J Neurophysiol 125: 1–11. https://doi.org/10.1152/jn.00453.2020
Kadoya A, Miyake H, Ohyashiki T (2003) Contribution of lipid dynamics on the inhibition of bovine brain synaptosomal Na+-K+-ATPase activity induced by 4-hydroxy-2-nonenal. Biol Pharm Bull 26: 787–793. https://doi.org/10.1248/bpb.26.787
Miyake H, Kadoya A, Ohyashiki T (2003) Increase in molecular rigidity of the protein conformation of brain Na+-K+-ATPase by modification with 4-hydroxy-2-nonenal. Biol Pharm Bull 26: 1652–1656. https://doi.org/10.1248/bpb.26.1652
Abdalla FH, Schmatz R, Cardoso AM, Carvalho FB, Baldissarelli J, de Oliveira JS, Rosa MM, Goncalves Nunes MA, Rubin MA, da Cruz IB, Barbisan F, Dressler VL, Pereira LB, Schetinger MR, Morsch VM, Gonçalves JF, Mazzanti CM (2014) Quercetin protects the impairment of memory and anxiogenic-like behavior in rats exposed to cadmium: Possible involvement of the acetylcholinesterase and Na+,K+-ATPase activities. Physiol Behav 135: 152–167. https://doi.org/10.1016/j.physbeh.2014.06.008
Hendrickx JO, Moudt S, Calus E, Martinet W, Pieter-Jan DF, Guns P-JD, Roth L, Peter P, De Deyn PP, Debby Van Dam D, De Meyer GRY (2021) Serum corticosterone and insulin resistance as early biomarkers in the hAPP23 overexpressing mouse model of Alzheimer’s disease. Int J Mol Sci 22: 6656. https://doi.org/10.3390/ijms22136656
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


