Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 3, стр. 379-396
Исследование влияния бактериального липополисахарида на уровни транскрипции генов транспортеров семейства Slc в микроглии in vitro
И. А. Старовойтова 1, И. Н. Доминова 1, *
1 Институт живых систем Балтийского федерального университет им. И. Канта
Калининград, Россия
* E-mail: irinadominova@gmail.com
Поступила в редакцию 28.09.2021
После доработки 12.01.2022
Принята к публикации 13.01.2022
- EDN: SVJODS
- DOI: 10.31857/S0869813922030098
Аннотация
Нейродегенеративные заболевания мозга сопровождаются процессами воспаления и эксайтотоксичностью, в которых важную роль играют микроглия и астроциты. Однако сегодня нет ясной картины, отображающей точные механизмы взаимодействия и влияния глиальных клеток друг на друга в процессах, связанных с воспалительными реакциями в мозге. Цель исследования заключалась в определении влияния бактериального липополисахарида (ЛПС) как индуктора воспалительных реакций на уровни транскрипции генов транспортеров семейства Slc в микроглии in vitro в зависимости от астроцитарного окружения, а также в выявлении региональных различий в уровнях транскрипции этих генов в зависимости от региона мозга, из которого была извлечена микроглия. Исследование проводилось на клетках микроглии в условиях монокультивирования и кокультивирования с астроцитами. Микроглия и астроциты были выделены из коры и гиппокампа 21‑дневных крыс популяции Вистар. Активацию микроглии вызывали с помощью ЛПС. Анализ уровней транскрипции генов, кодирующих транспортеры семейства Slc, проводили методом обратной транскрипции с последующей полимеразной цепной реакции – ОТ-ПЦР. Показано повышение ЛПС-индуцированных уровней транскрипции генов транспортера возбуждающих аминокислот 3 (Slc1a1, EAAT3), транспортера возбуждающих аминокислот 4 (Slc1a6, EAAT4), транспортера везикулярного глутамата 1 (Slc17a7, VGLUT1) и транспортера монокарбоксилата 1 (Slc16a1, MCT1) в клетках микроглии in vitro как при монокультивировании, так и в присутствии астроцитов. В культурах клеток микроглии в ответ на добавление ЛПС уровни транскрипции генов транспортеров семейства Slc значимо повышались на 33.5–63.3%, в культуре, кокультивированной с астроцитами – на 30.8–172.3%, а в культуре, кокультивированной с астроцитами в ответ на ЛПС – на 17.8–76.0% по сравнению с неактивированными (контрольными) культурами. Более того, были продемонстрированы региональные отличия в уровнях транскрипции исследованных генов транспортеров в ответ на введение ЛПС. Таким образом, было подтверждено изменение профиля транскрипции глутаматных и монокарбоксилатных транспортеров при активации микроглии, вызванной ЛПС, а также участие астроцитарного окружения в изменении уровней транскрипции генов этих транспортеров в микроглии. В ходе данного исследования было показано, что в ответ на действие провоспалительного фактора (ЛПС) в клетках микроглии активируется транскрипция генов семейства Slc.
Воспаление и эксайтотоксичность играют важную роль в патогенезе нейродегенеративных заболеваний (среди которых болезнь Паркинсона, рассеянный склероз, нейропатическая боль, боковой амиотрофический склероз, инсульт и другие заболевания), являющихся одними из самых распространенных неинфекционных заболеваний в мире, занимая третье место после сердечно-сосудистых и онкологических заболеваний [1]. При этом воспалительный ответ и эксайтотоксичность опосредуются резидентными макрофагами нервной ткани – активированной микроглией. С одной стороны, микроглия реагирует на повреждение нейронов и удаляет поврежденные клетки путем фагоцитоза. С другой стороны, хроническая активация микроглии может вызвать повреждение нейронов, связанное с избыточным высвобождением глутамата [2].
Таким образом, при травмах мозга и нейродегенеративных заболеваниях, связанных с воспалением, отмечаются изменения в работе глутаматных транспортеров и снижение обратного захвата глутамата из внеклеточного пространства, вследствие чего глутамат накапливается в нем, вызывая явление эксайтотоксичности, приводящее, в конечном итоге, к гибели нейронов. Большие количества глутамата могут выделяться при активации клеток микроглии и астроцитов, что было показано на моделях in vivo и in vitro [3, 4]. Основными транспортерами, ответственными за обратный захват глутамата в мозге являются транспортеры возбуждающих аминокислот (EAAT) [5], преимущественно экспрессирующиеся глиальными клетками [6–9]. При этом увеличение уровня глутамата может быть связано с повышением в активированных микроглиальных клетках уровня экспрессии глутаминазы – фермента, катализирующего гидролиз глутамина с образованием глутамата [10].
Метаболическое обеспечение нормального функционирования глутаматергической системы происходит за счет работы астроцитарно-нейронального лактатного челночного механизма, в котором лактат используется в качестве источника энергии, а это, в свою очередь, связано с работой монокарбоксилатных транспортеров [11]. Следовательно, дисфункции монокарбоксилатных транспортеров также будут ассоциированы с патологиями ЦНС, в том числе, и нейровоспалительными реакциями [12]. Так, в работе He и соавт. было показано, что хронические воспалительные реакции могут быть связаны с активацией астроцитов и увеличением экспрессии в них транспортера монокарбоксилата 1 (MCT1) [13]. Известно, что в активированной при воспалении микроглии интенсифицируется процесс гликолиза, одним из регуляторов которого являются транспортеры монокарбоксилата (MCT), транспортирующие избыточный лактат за пределы клетки [14]. В работе Moreira и соавт. было показано усиление экспрессии MCT1 (Slc16a1) в микроглии в ответ на стимуляцию клеток фактором некроза опухолей альфа (TNF-α) [15]. При этом нокдаун MCT1в микроглии подавляет уровень гликолиза и снижает ЛПС-индуцированную экспрессию провоспалительных цитокинов, доказывая тем самым, что повышение экспрессии MCT1 способствует классической активации микроглии и развитию воспалительных реакций [14].
Таким образом, помимо клеток микроглии, важную роль в патологических процессах в ЦНС играют астроциты. Однако на сегодняшний день нет четкого понимания механизмов взаимодействия и влияния глиальных (микроглия и астроцитов) клеток друг на друга.
Основной целью данного исследования было определить влияние бактериального липополисахарида (ЛПС) как индуктора воспалительных реакций на уровни транскрипции генов транспортеров семейства Slc в микроглии in vitro в зависимости от астроцитарного окружения, а также в выявлении региональных различий в уровнях транскрипции этих генов в зависимости от региона мозга, из которого была извлечена микроглия.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные
Исследование проводилось на крысах популяции Вистар в возрасте 21 день.
Все манипуляции с использованием животных осуществлялись в соответствии с этическими принципами, установленными Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей (принятой в Страсбурге 18.03.1986 и подтвержденной в Страсбурге 15.06.2006). Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям этического комитета Балтийского федерального университета им. И. Канта.
Культуры клеток
Объектами исследования являлись культуры клеток микроглии, выделенные из гиппокампа и префронтальной коры головного мозга крыс популяции Вистар в возрасте 21 день, а также культуры микроглии, кокультивированные с астроцитами, также выделенными из аналогичных регионов головного мозга крыс того же возраста.
Гиппокамп и префронтальная кора были выбраны на основании того, что эти регионы подвергаются наибольшему негативному воздействию при воспалительных реакциях. Так, например, была обнаружена связь между болезнью Альцгеймера и атрофией гиппокампа [16], более того, воспалительные реакции оказывают влияние на передачу сигналов между гиппокампом и черной субстанцией [17]. Также установлено, что префронтальная кора обладает повышенной восприимчивостью к воспалительным реакциям на фоне стрессового расстройства [18]. В другом исследовании было продемонстрировано различное влияние диеты, приводящей к системному воспалению, на префронтальную кору и гиппокамп: так, кора была чувствительна к высокому содержанию в рационе углеводов и жиров, тогда как гиппокамп был более чувствителен к диете с высоким содержанием жира [19]. Более того, известно, что микроглия из разных регионов мозга демонстрирует различия в уровнях экспрессии специфических микроглиальных маркеров, в частности, транскриптомный профиль микроглии коры ближе к профилю полосатого тела, чем к профилям гиппокампа и мозжечка [20].
Культуры микроглии и астроцитов из гиппокампа и префронтальной коры крыс получали в соответствии с протоколом, описанным Mecha и соавт. [21], с изменениями в части выбора регионов головного мозга и получения культур клеток из животных (P21). Согласно Collins и Bohlen [22] и Bohlen и соавт. [23] микроглия, полученная из мозга крыс в возрасте 21-го дня, имеет зрелый фенотип, поскольку к этому времени запускается экспрессия основных маркеров созревания [24]. Первичную смешанную культуру глиальных клеток инкубировали в культуральных флаконах, покрытых поли-L-лизином, в питательной среде DMEM (Thermo Fisher Scientific) с добавлением инактивированной фетальной бычьей сыворотки (10%) (Gibco) и антибиотиков (стрептомицина и пенициллина в концентрации 100 мкг/мл) в течение 11–14 дней при 37°С в увлажненном инкубаторе в атмосфере 5% СО2 и 95% воздуха, меняя питательную среду каждые три дня. Выделенные из смешанной культуры микроглию и астроциты выращивали в аналогичной питательной среде и условиях инкубирования в течение 72 ч. Чистота полученных культур клеток отслеживалась посредством визуального анализа фенотипа с помощью микроскопа Zeiss Primo Star (Carl Zeiss) при подсчете их количества в камере Горяева. Используемый метод подготовки глиальных культур на основе протокола Mecha и соавт. предполагает выделение микроглии с чистотой до 99.14% и астроцитов с чистотой 97.29% [21].
Кокультивирование микроглии и астроцитов проводилось в 24-луночных планшетах с использованием вставок с диаметром пор 1 мкм в PET мембране (BD Bioscience) в течение 24 ч. При этом микроглия высевалась на дно культурального планшета, а астроциты – на мембрану.
По истечении 24 ч в питательную среду части клеточных культур как в контрольных, так и в выращенных при кокультивировании с астроцитами, добавлялся бактериальный липополисахарид (ЛПС) Escherichia coli O127:B8 (Sigma-Aldrich) в концентрации 500 нг/мл, после чего культуры клеток инкубировали в течение 6 ч [25, 26].
Таким образом, было получено по четыре культуры клеток для каждого региона: 1) культура микроглии без добавления ЛПС (контроль № 1); 2) микроглия, кокультивированная с астроцитами без добавления ЛПС (контроль № 2); 3) культура микроглии с добавлением ЛПС в питательную среду; 4) микроглия, кокультивированная с астроцитами, с добавлением ЛПС. После инкубирования культур клеток с ЛПС анализировали уровни транскрипции генов транспортеров семейства Slc.
Анализ уровней транскрипции генов
Для анализа уровней транскрипции генов транспортеров была выделена РНК из 4 типов культур клеток с помощью набора RNeasy Plus Mini Kit (Qiagen) в соответствии с протоколом, рекомендованным производителем, с дополнительной обработкой ДНКазой и добавлением 10 мкл β-меркаптоэтанола на каждый 1 мл лизирующего буфера. Концентрацию РНК измеряли с помощью флуориметра Qubit 2.0 (Invitrogen) и набора реагентов Qubit® RNA BR Assay Kit (Invitrogen). В результате измерения было установлено, что среднее количество РНК для каждого образца составляет около 30 мкг.
Выделенная РНК использовалась для постановки обратной транскрипции c помощью набора MMLV RT (Евроген) в соответствии с протоколом, рекомендованным производителем.
Уровни транскрипции генов транспортеров семейства Slc определяли методом количественной ПЦР. В качестве референсного гена был выбран ген β-актина (ACTb), он является одним из наиболее стабильно экспрессирующихся генов в ЦНС крысы [27]. Для количественной ПЦР использовали ДНК-полимеразу Taq и 10x буфер Taq, 50x SYBR Green I, смесь dNTP (все Евроген). Амплификацию проводили в реакционной смеси, содержащей: 1x буфер Taq, 1х SYBR Green I, 0.25 мкМ смеси dNTP, 0.3 нМ смеси праймеров (последовательности приведены в табл. 1), 0.2 мкл Taq ДНК-полимеразы. Амплификацию проводили с помощью термоциклера CFX96 Thermal cycler (Bio-Rad) при следующих условиях: первичная денатурация при 95°С в течение 3 мин, затем 50 циклов: денатурация при 95°С в течение 10 с, отжиг праймеров при 59°С (в зависимости от используемых праймеров) в течение 20 с и элонгация цепи при 72°С в течение 30 с. Все исследуемые и контрольные образцы амплифицировали в пятикратной повторности.
Таблица 1.
Последовательности праймеров, использованных для анализа уровней транскрипции генов транспортеров семейства Slc
| Ген | Forward 5'–3' | Reverse 5'–3' | T отжига, °С |
|---|---|---|---|
| ACTb | GCGAGTACAACCTTCTTGCAG | TGAAGGTCTCAAACATGATCTGG | 59 |
| Slc1a1 (EAAT3) | CTCGTCATTCTGCCACTGATTA | AGGCTTGATGCTCACAACTAA | 59 |
| Slc1a6 (EAAT4) | TGGCATCCTTGGACAACAA | AACCATTAGGATGCCGATGAA | 59 |
| Slc17a7 (VGLUT1) | TGGCTACCTCCACCCTAAATA | CGAAGATGACACAGCCATAGT | 59 |
| Slc16a1 (MCT1) | CTTGTGGCGTGATCCTCAT | TCCTCTTTACCGTCCCTCTT | 59 |
Статистический анализ
Анализ всех полученных результатов осуществлялся с помощью программного обеспечения GraphPad Prism 7. Все результаты представлены как среднее ± стандартное отклонение. Статистическую обработку данных выполняли с помощью двухфакторного дисперсионного анализа ANOVA с последующим post hoc анализом с помощью критерия Tьюки. Различия между группами считались статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Для анализа влияния ЛПС на уровни транскрипции генов, кодирующих транспортеры семейства Slc, были отобраны 4, среди которых транспортеры глутамата [28, 29]: транспортер возбуждающих аминокислот 3 (Slc1a1, EAAT3), транспортер возбуждающих аминокислот 4 (Slc1a6, EAAT4) [30, 31] и транспортер везикулярного глутамата 1 (Slc17a7, VGLUT1) [32], а также транспортер монокарбоксилата 1 (Slc16a1, MCT1) [33, 34]. Таким образом, в анализ были взяты наименее изученные транспортеры глутамата, поскольку чаще всего при изучении влияния воспаления на транспорт глутамата, в том числе, в микроглии исследуют GLT-1 (Slc1a2, EAAT2) и GLAST (Slc1a3, EAAT1) [4, 35–37], а везикулярные транспортеры глутамата изучаются исключительно на примере нейронов [38, 39], хотя в недавней работе Brioschi и соавт. было продемонстрировано наличие экспрессии (мРНК) Slc17a7 в клетках микроглии [40].
Анализ уровней транскрипции генов транспортеров семейства Slc в гиппокампе
В результате проведенных нами исследований были установлены уровни транскрипции генов транспортеров возбуждающих аминокислот 3 (Slc1а1) (рис. 1a) и 4 (Slc1а6) (рис. 1b), монокарбоксилата 1 (Slc16a1) (рис. 1c) и везикулярного глутамата 1 (Slc17а7) (рис. 1d) в гиппокампе.
Рис. 1.
Уровни транскрипции генов Slc1а1, Slc1а6, Slc16а1 и Slc17а7 в гиппокампе, нормализованные на референсный ген, представленные в логарифмической шкале. Microglia – культура клеток микроглии (контроль); Microglia_LPS – культура клеток микроглии с добавлением ЛПС в питательную среду; Microglia_Astrocytes – микроглия, кокультивированная с астроцитами (контроль); Microglia_Astrocytes_LPS – микроглия, кокультивированная с астроцитами c добавлением ЛПС в питательную среду. * – p < 0.05; ** – p < 0.01; *** – p < 0.001; **** – p < 0.0001.
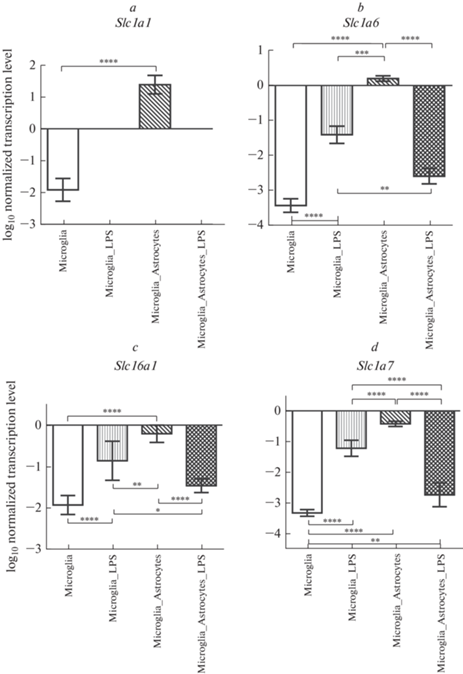
Транскрипция всех исследуемых генов в монокультурах клеток микроглии (контрольная культура клеток) отмечалась в пределах минус 1.92–минус 3.43 (в логарифмической шкале), при совместном культивировании клеток микроглии с астроцитами транскрипция генов усиливалась в разной степени, максимальное увеличение отмечалось для гена Slc1а1, уровень транскрипции составил 1.38 (в логарифмической шкале), тогда как минимальное было отмечено для гена Slc17a7, и уровень транскрипции составил минус 0.42 (в логарифмической шкале).
При добавлении ЛПС транскрипция гена Slc1а1 полностью прекращалась как в монокультурах, так и кокультивированных культурах клеток микроглии. Транскрипция генов Slc1а6, Slc16a1 и Slc17а7 изменялась сходным образом, существенно повышаясь в активированной монокультуре клеток микроглии по сравнению с контрольной культурой клеток, и существенно снижаясь до уровня не стимулированных монокультур в клетках микроглии, культивируемых совместно с астроцитами.
Более того, при активации уровень транскрипции гена Slc1а6 был выше в монокультуре клеток микроглии по сравнению с кокультивированными культурами клеток микроглии (p < 0.01). Также было установлено, что добавление ЛПС к кокультивированной культуре клеток микроглии приводило к ослаблению транскрипции гена Slc1а6 по сравнению с аналогичной не активированной культурой (p < 0.0001).
Схожая картина наблюдалась и при анализе уровней транскрипции генов транспортера монокарбоксилата 1 (Slc16a1) и транспортера везикулярного глутамата 1 (Slc17а7) в гиппокампе.
Анализ уровней транскрипции генов транспортеров семейства Slc в префронтальной коре головного мозга
Аналогичный анализ уровней транскрипции исследуемых генов в префронтальной коре головного мозга продемонстрировал присутствие трех генов транспортеров (рис. 2) за исключением гена Slc1а1, который либо не транскрибируется в этом регионе, либо уровень его транскрипции находится на столь низком уровне, что его невозможно детектировать с помощью ПЦР.
Рис. 2.
Уровни транскрипции генов Slc17а7, Slc16а1 и Slc1a6 в префронтальной коре, нормализованные на референсный ген, представленные в логарифмической шкале. Microglia – культура клеток микроглии (контроль); Microglia_LPS – культура клеток микроглии с добавлением ЛПС в питательную среду; Microglia_Astrocytes – микроглия, кокультивированная с астроцитами (контроль); Microglia_Astrocytes_LPS – микроглия, кокультивированная с астроцитами c добавлением ЛПС в питательную среду. * – p < 0.05; ** – p < 0.01; *** – p < 0.001; **** – p < 0.0001.
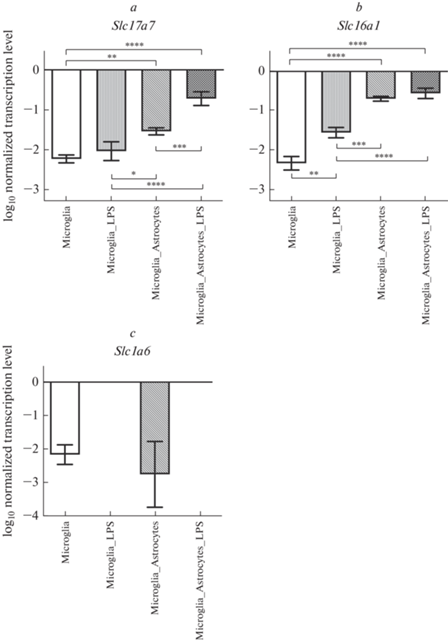
В префронтальной коре транскрипция трех обнаруженных генов в монокультурах клеток микроглии (контрольная культура клеток) отмечалась в довольно узком диапазоне от минус 2.16 до минус 2.33 (в логарифмической шкале), при совместном культивировании клеток микроглии с астроцитами усиливалась транскрипция Slc17a7 (рис. 2a) и Slc16a1 (рис. 2b) в разной степени, максимальное увеличение отмечалось для гена Slc16а1, уровень транскрипции составил минус 0.69 (в логарифмической шкале), тогда как уровень транскрипции гена Slc1а6 (рис. 2c) наоборот снижался.
При добавлении ЛПС транскрипция гена Slc1а6 в префронтальной коре полностью прекращалась как в монокультурах, так и кокультивированных культурах клеток микроглии. Транскрипция генов Slc17a7 и Slc16a1 изменялась сходным образом, существенно повышаясь. Особенно выраженное повышение транскрипции генов Slc17a7 и Slc16a1 (максимальный уровень транскрипции в данном регионе мозга) отмечалось в клетках микроглии, культивируемых совместно с астроцитами.
Также анализ уровней транскрипции гена Slc17а7 показал повышение транскрипции данного гена при кокультивировании культуры клеток микроглии с астроцитами по сравнению с активированной монокультурой клеток микроглии (p < 0.05). Однако, как уже было сказано выше, самый высокий уровень транскрипции гена Slc17а7 наблюдался при активации клеток микроглии, культивируемых совместно с астроцитами (p < 0.0001 по сравнению с монокультурой клеток микроглии).
Схожая картина наблюдалась и при анализе уровней транскрипции гена Slc16a6 в префронтальной коре головного мозга (рис. 2b), за исключением повышения уровня транскрипции данного гена при добавлении ЛПС к монокультуре клеток микроглии по сравнению с неактивированной монокультурой клеток микроглии (p < 0.01), поскольку для гена Slc17a7 уровни транскрипции в этих двух группах были примерно одинаковыми.
Изменения уровней транскрипции генов транспортеров семейства SLC относительно контрольной культуры клеток микроглии
Также нами были рассчитаны изменения уровней транскрипции генов транспортеров семейства SLC относительно неактивированной монокультуры клеток микроглии (контрольная культура клеток микроглии) для изучаемых регионов мозга (префронтальная кора и гиппокамп) (табл. 2). Изменения в уровнях транскрипции генов рассчитывались по следующей формуле:
Таблица 2.
Изменения уровней транскрипции генов транспортеров семейства SLC относительно контрольной культуры клеток микроглии
| Ген | Регион мозга | Изменения уровней транскрипции в анализируемых культурах клеток относительно культуры микроглия | ||
|---|---|---|---|---|
| микроглия_ЛПС | микроглия_астроциты | микроглия_астроциты_ЛПС | ||
| Slc1a1 | Префронтальная кора | Не экспрессируется | ||
| Гиппокамп | Не экспрессируется | 172.3% | Не экспрессируется | |
| Slc1a6 | Префронтальная кора | Не экспрессируется | –27.2% (ns) | Не экспрессируется |
| Гиппокамп | 58.9% | 105.3% | 24.4% (ns) | |
| Slc17a7 | Префронтальная кора | 8.7% (ns) | 30.9% | 67.7% |
| Гиппокамп | 63.3% | 87.2% | 17.7% | |
| Slc16a1 | Префронтальная кора | 33.3% | 70.2% | 76.1% |
| Гиппокамп | 55.4% | 89.2% | 24.1% (ns) | |
Таким образом, мы еще раз наглядно демонстрируем повышение уровней транскрипции всех изучаемых генов транспортеров семейства Slc во всех исследуемых группах относительно контрольной культуры микроглии без добавления ЛПС и без астроцитарного окружения.
Анализ региональной гетерогенности уровней транскрипции генов транспортеров семейства Slc в гиппокампе и префронтальной коре
После анализа уровней транскрипции генов транспортеров семейства Slc в гиппокампе и префронтальной коре в зависимости от условий культивирования, мы проанализировали региональные различия в уровнях транскрипции этих генов между двумя регионами (рис. 3). Так, уровни транскрипции генов Slc1а6 (рис. 3a) и Slc17а7 (рис. 3b) в неактивированной монокультуре клеток микроглии были выше в префронтальной коре по сравнению с гиппокампом, также уровни транскрипции генов Slc17a7 и Slc16a1 (рис. 3c) были выше в коре при кокультивировании микроглии с астроцитами при добавлении ЛПС. При этом уровни транскрипции генов Slc17а7 и Slc16a1 в гиппокампе были выше, чем в префронтальной коре в культуре стимулированных ЛПС клеток микроглии и в контрольных при кокультивировании микроглии с астроцитами без добавления ЛПС, последний факт также был характерен для транскрипции гена Slc1a6.
Рис. 3.
Региональная гетерогенность в уровнях транскрипции генов Slc1a6, Slc17а7 и Slc16а1 в префронтальной коре головного мозга (Cortex) и гиппокампе (Hippocampus), нормализованные на референсный ген, представленные в логарифмической шкале. Microglia – культура клеток микроглии (контроль); Microglia_LPS – культура клеток микроглии с добавлением ЛПС в питательную среду; Microglia_Astrocytes – микроглия, кокультивированная с астроцитами (контроль); Microglia_Astrocytes_LPS – микроглия, кокультивированная с астроцитами c добавлением ЛПС в питательную среду. * – p < 0.05; ** –p < 0.01; *** – p < 0.001; **** – p < 0.0001.
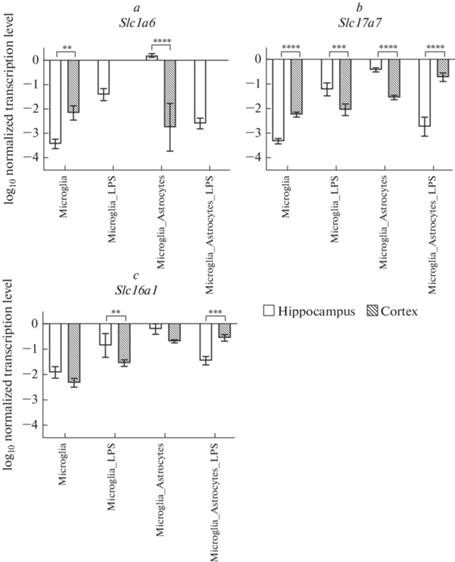
Результаты дисперсионного анализа влияния ЛПС на уровни транскрипции генов семейства Slc в зависимости от региона мозга приведены в табл. 3.
Таблица 3.
Результаты дисперсионного анализа (ANOVA) влияния ЛПС на уровни транскрипции генов семейства Slc в зависимости от региона мозга
| Ген | Факторы | ||
|---|---|---|---|
| регион мозга | ЛПС | регион мозга * ЛПС | |
| Slc1а1 | F = 5.32 p = 0.0300 |
F = 138.73 p < 0.0001 |
F = 138.73 p < 0.0001 |
| Slc1а6 | F = 18.11 p = 0.0003 |
F = 42.80 p < 0.0001 |
F = 78.56 p < 0.0001 |
| Slc16а1 | F = 4.66 p = 0.0411 |
F = 75.60 p < 0.0001 |
F = 20.52 p < 0.0001 |
| Slc17а7 | F = 15.35 p = 0.0006 |
F = 104.33 p < 0.0001 |
F = 107.35 p < 0.0001 |
Знак “*” в строке "Факторы” – взаимодействие факторов дисперсионного анализа. В ячейках таблицы приведены значения критерия Фишера (F) и уровни достоверности влияния соответствующих факторов и их взаимодействия на характеристики средних значений уровней транскрипции соответствующих генов семейства Slc.
Проанализировав данные, приведенные в табл. 3, можно заключить, что на уровни транскрипции генов транспортеров семейства Slc оказывает влияние как введение ЛПС в культуральную среду, так и первоначальная локализация клеток микроглии по регионам мозга (в обоих случаях p < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Микроглия составляет примерно 5–10% всех клеток головного мозга и выполняет роль иммунных клеток в ЦНС [41]. При различных патологических процессах в ЦНС она трансформируется, изменяя свою морфологию (из неактивной формы в активированную) и функции, что позволяет предположить факт изменения набора транскрибируемых генов в клетках под воздействием различных факторов [42].
Так, нами была обнаружена транскрипция генов Slc1а1 и Slc1а6, считающихся преимущественно нейрональными транспортерами глутамата [43]. Однако в случае гена Slc1a1 существуют доказательства его экспрессии в микроглиальных клетках [9, 44, 45], тогда как по литературным данным экспрессия гена Slc1a6 была обнаружена только в нейронах и астроцитах [9, 46]. Таким образом, обнаружение нами транскрипции данного гена может свидетельствовать либо об обнаружении еще одного типа клеток в головном мозге, экспрессирующего данный белок, либо лишь о присутствии мРНК данного гена и соответственно наличия в клетках микроглии механизмов блокирования трансляции белка с этих транскриптов. Для подтверждения одного из данных фактов необходимо проведение дальнейших исследований, в частности, двойное иммуногистохимическое окрашивание на микроглиальный маркер (IBA-1) и EAAT4 с целью выявления присутствия или отсутствия колокализации данных белков в клетках микроглии.
Кроме того, снижение до неопределяемого уровня транскрипции гена Slc1а1 в гиппокампе и в префронтальной коре при введении в культуру клеток микроглии ЛПС связано со способностью ЛПС активировать рецепторы TLR4 (Toll-like) и CD14 (кластер дифференцировки) на поверхности клеток микроглии [47] и запускать ряд сигнальных клеточных каскадов (в том числе, NF-κB, MAPK, JAK-STAT сигнальные пути) [48], способных приводить к изменению уровней экспрессии генов, опосредующих воспалительную реакцию, это, в свою очередь, оказывает влияние на экспрессию транспортеров различных веществ. Так, например, в астроцитах на подавление транскрипции генов глутаматных транспортеров оказывает влияние фактор некроза опухоли α (TNFα) [49], выделяемый как активированной микроглией, так и самими астроцитами. Подавление транскрипции глутаматных транспортеров запускается также другими провоспалительными цитокинами (интерлейкином-1, интерлейкином-6 и другими), нейротрофическими факторами (BDNF, GDNF), секретируемыми активированной микроглией. Эти данные позволяют предположить наличие похожих механизмов регуляции транскрипции генов в клетках микроглии и объяснить полученные результаты. Более того, как было показано в работе Takaki и соавт., на ранних стадиях нейровоспаления активация микроглии способствует повышению уровня внеклеточного глутамата за счет выделения его самими клетками микроглии, что приводит к повышению внутриклеточного глутамата в астроцитах [4]. В свою очередь, повышение внутриклеточного глутамата в астроцитах подавляет в них экспрессию глутаматных транспортеров, вследствие чего уровень внеклеточного глутамата увеличивается еще больше [4]. Данных о блокировании экспрессии (мРНК) глутаматных транспортеров в микроглии нет, однако, можно предположить наличие подобного механизма, как это происходит в астроцитах. При этом за накопление внеклеточного глутамата при воспалении ответственна также система цистин-глутаматного обмена. Продукция белков, входящих в состав этой системы, повышается по мере увеличения высвобождения провоспалительных цитокинов [50]. Таким образом, при введении ЛПС in vitro в клетках микроглии происходит делегирование нагрузки по выделению глутамата системе цистин-глутаматного обмена (белки которой продуцируются не только астроцитами, но и микроглией [51, 52]) вместо транспортеров возбуждающих аминокислот.
Как известно, микроглия играет важную роль в поддержании формирования и консолидации связей между нейронами [53], в том числе, в удалении части синапсов на стадиях раннего развития мозга [54]. В работе Brioschi и соавт. было впервые показано, что в микроглии экспрессируется ген транспортера везикулярного глутамата Slc17a. При этом было установлено повышение уровня экспрессии гена Slc17a7 при различных патологиях, в том числе, при воспалительных реакциях мозга, затрагивающих функционирование синапсов (например, болезнь Альцгеймера) [40]. С этими сведениями вполне согласуются наши данные относительно повышенного уровня транскрипции данного гена в клетках микроглии в присутствии ЛПС как в гиппокампе, так и префронтальной коре, а также при кокультивировании с астроцитами (только в коре).
При активации микроглии выделяют два фенотипа: провоспалительный (M1) и противоспалительный (M2), отличающиеся экспрессируемыми маркерами и набором цитокинов [55, 56]. Кроме того, появляется все больше данных, свидетельствующих о важности метаболических путей в репрограммировании микроглии и, в частности, демонстрирующих повышенный уровень гликолиза в М1-микроглии [57]. В то же время, транспортеры монокарбоксилата являются регуляторами гликолиза, выделяя избыточный лактат во внеклеточное пространство. Таким образом, уровень экспрессии транспортера монокарбоксилата прямо пропорционален уровню гликолиза в клетках микроглии и повышается при нейровоспалении [34]. Соответствующее увеличение уровней транскрипции гена Slc16a1 наблюдается для культур микроглии при введении ЛПС в обоих исследуемых регионах мозга, однако, астроцитарное окружение в случае гиппокампа нивелирует влияние ЛПС на микроглию, делая уровни транскрипции генов между контрольной культурой микроглии и микроглией, кокультивированной с астроцитами и ЛПС, практически не различимыми, тогда как в префронтальной коре астроцитарное окружение способствует повышению уровня транскрипции гена Slc16a1 независимо от присутствия ЛПС.
Повышение уровней транскрипции исследуемых генов в неактивированных ЛПС культурах клеток микроглии при кокультивировании с астроцитами по сравнению с контрольной культурой микроглии наблюдается как в префронтальной коре, так и в гиппокампе (кроме Slc1а6 в коре). Полученные уровни транскрипции данных генов транспортеров глутамата являются более близкими к физиологическим значениям и более приближенными к условиям in vivo, поскольку в подобных условиях астроглия и микроглия находятся в тесном контакте друг с другом, что дает им возможность обмениваться веществами, выделяемыми во внеклеточное пространство, и оказывать влияние друг на друга.
Выявленные региональные различия в уровнях транскрипции генов Slc1а6, Slc17а7 и Slc16a1 в гиппокампе и префронтальной коре, а также неопределяемые уровни транскрипции гена Slc1a1 могут быть объяснены специфическими профилями экспрессии генов в разных регионах мозга как для микроглии, так и для астроцитов. Например, полученные данные могут быть следствием гетерогенности именно астроцитов, которая была подтверждена ранее [58, 59], и на основе которой выделяют различные субпопуляции астроцитов. Предполагается, что разнообразие профилей продукции белков, ответственных за основные функции астроцитов, связано с избирательной уязвимостью отдельных регионов мозга к конкретным повреждающим факторам, в том числе, к воспалительным реакциям. При этом однозначно предсказать реакцию астроцитов на воспаление невозможно, поскольку эти клетки способны выделять в ответ на него противоположные по действию вещества (про- и противовоспалительные цитокины и хемокины, антиоксиданты, свободные радикалы и нейротрофические факторы) [60].
При этом есть исследования, согласно которым микроглия также обладает региональной гетерогенностью [61], в частности, увеличение плотности микроглии при нейровоспалении зависит не только от дозы ЛПС, но от региона мозга [62]. В другом исследовании были показаны различия в уровнях экспрессии основных микроглиальных маркеров в зависимости от региона головного мозга [63]. Более того, в работе Stratoulias и соавт. было продемонстрировано, что микроглия гиппокампа отличается от микроглии других регионов, экспрессируя специфические гены (например, фагоцитоз-ассоциированный ген Clec7a), характерные только для этого региона и, возможно, направленные на поддержание нейрогенеза в нейрогенных нишах [64], поскольку подтверждено участие микроглии в регуляции нейрогенеза в гиппокампе у взрослых [65]. В гиппокампе была обнаружена так называемая “темная” микроглия, демонстрирующая специфический профиль экспрессии генов [66]. Таким образом, региональные различия в уровнях транскрипции исследуемых нами генов транспортеров глутамата могут быть объяснены не только разнообразием популяций астроцитов в головном мозге, но и присутствием в этих регионах ЦНС специфических популяций микроглии, особенно в гиппокампе. Однако для подтверждения данного факта необходимы дополнительные исследования по определению популяций микроглии и астроцитов в гиппокампе и префронтальной коре.
В результате проведенного исследования нами были получены данные, свидетельствующие о влиянии ЛПС на уровни транскрипции генов нескольких транспортеров семейства SLC, вовлеченных в транспорт глутамата и монокарбоксилатов, в клетках микроглии in vitro в зависимости от астроцитарного окружения. Более того, нами были продемонстрированы региональные отличия в уровнях транскрипции данных генов транспортеров в ответ на введение бактериального ЛПС.
Таким образом, было подтверждено изменение профиля транскрипции генов глутаматных и монокарбоксилатных транспортеров, экспрессируемых в активированных ЛПС клетках микроглии, а также влияние астроцитарного окружения на изменение уровней транскрипции этих транспортеров в микроглии. Однако для выяснения механизмов взаимодействия микроглии и астроцитов, в том числе, при воспалительных реакциях в ЦНС требуются дальнейшие исследования.
Список литературы
Deuschl G, Beghi E, Fazekas F, Varga T, Christoforidi KA, Sipido E, Bassetti CL, Vos T, Feigin VL (2020) The burden of neurological diseases in Europe: an analysis for the Global Burden of Disease Study 2017. The Lancet Public Health 5: e551–e567. https://doi.org/10.1016/S2468-2667(20)30190-0
Bachiller S, Jiménez-Ferrer I, Paulus A, Yang Y, Swanberg M, Deierborg T, Boza-Serrano A (2018) Microglia in neurological diseases: A road map to brain-disease dependent-inflammatory response. Front Cell Neurosci 12: 488. https://doi.org/10.3389/FNCEL.2018.00488/FULL
Ward RJ, Colivicchi MA, Allen R, Schol F, Lallemand F, de Witte P, Ballini C, Corte L della, Dexter D (2009) Neuro-inflammation induced in the hippocampus of “binge drinking” rats may be mediated by elevated extracellular glutamate content. J Neurochem 111: 1119–1128. https://doi.org/10.1111/J.1471-4159.2009.06389.X
Takaki J, Fujimori K, Miura M, Suzuki T, Sekino Y, Sato K (2012) L-glutamate released from activated microglia downregulates astrocytic L-glutamate transporter expression in neuroinflammation: The “collusion” hypothesis for increased extracellular L-glutamate concentration in neuroinflammation. J Neuroinflammat 9: 1–17. https://doi.org/10.1186/1742-2094-9-275/FIGURES/9
O’Donovan SM, Sullivan CR, McCullumsmith RE (2017) The role of glutamate transporters in the pathophysiology of neuropsychiatric disorders. NPJ Schizophr 3(1): 32. https://doi.org/10.1038/s41537-017-0037-1
Persson M, Rönnbäck L (2011) Microglial self-defence mediated through GLT-1 and glutathione. Amino Acids 42: 207–219. https://doi.org/10.1007/S00726-011-0865-7
Rodríguez A, Ortega A (2017) Glutamine/Glutamate Transporters in Glial Cells: Much More Than Participants of a Metabolic Shuttle. Adv Neurobiol 16: 169–183. https://doi.org/10.1007/978-3-319-55769-4_8
Pajarillo E, Rizor A, Lee J, Aschner M, Lee E (2019) The role of astrocytic glutamate transporters GLT-1 and GLAST in neurological disorders: Potential targets for neurotherapeutics. Neuropharmacology 161. https://doi.org/10.1016/J.NEUROPHARM.2019.03.002
Liang J, Takeuchi H, Doi Y, Kawanokuchi J, Sonobe Y, Jin S, Yawata I, Li H, Yasuoka S, Mizuno T, Suzumura A (2008) Excitatory amino acid transporter expression by astrocytes is neuroprotective against microglial excitotoxicity. Brain Res 1210: 11–19. https://doi.org/10.1016/j.brainres.2008.03.012
Ding L, Xu X, Li C, Wang Y, Xia X, Zheng JC (2021) Glutaminase in microglia: A novel regulator of neuroinflammation. Brain Behav Immun 92: 139–156. https://doi.org/10.1016/J.BBI.2020.11.038
Mason S (2017) Lactate shuttles in neuroenergetics-homeostasis, allostasis and beyond. Front Neurosci 11: 43. https://doi.org/10.3389/FNINS.2017.00043
Pérez-Escuredo J, van Hée VF, Sboarina M, Falces J, Payen VL, Pellerin L, Sonveaux P (2016) Monocarboxylate transporters in the brain and in cancer. Biochim Biophys Acta 1863: 2481. https://doi.org/10.1016/J.BBAMCR.2016.03.013
He JH, Yu L, Wang ZY, Wang Q, Cao JL, Gu LB (2019) Inhibition Of Monocarboxylate Transporter 1 In Spinal Cord Horn Significantly Reverses Chronic Inflammatory Pain. J Pain Res 12: 2981. https://doi.org/10.2147/JPR.S219359
Kong L, Wang Z, Liang X, Wang Y, Gao L, Ma C (2019) Monocarboxylate transporter 1 promotes classical microglial activation and pro-inflammatory effect via 6-phosphofructo-2-kinase/fructose-2, 6-biphosphatase 3. J Neuroinflammation 16(1): 240. https://doi.org/10.1186/S12974-019-1648-4
Moreira TJTP, Pierre K, Maekawa F, Repond C, Cebere A, Liljequist S, Pellerin L (2009) Enhanced cerebral expression of MCT1 and MCT2 in a rat ischemia model occurs in activated microglial cells. J Cereb Blood Flow Metab 29: 1273–1283. https://doi.org/10.1038/JCBFM.2009.50
Cabinio M, Saresella M, Piancone F, LaRosa F, Marventano I, Guerini FR, Nemni R, Baglio F, Clerici M (2018) Association between Hippocampal Shape, Neuroinflammation, and Cognitive Decline in Alzheimer’s Disease. J Alzheimers Dis 66: 1131–1144. https://doi.org/10.3233/JAD-180250
Harrison NA, Cercignani M, Voon V, Critchley HD (2015) Effects of Inflammation on Hippocampus and Substantia Nigra Responses to Novelty in Healthy Human Participants. Neuropsychopharmacology 40:831. https://doi.org/10.1038/NPP.2014.222
de Pablos RM, Villarán RF, Argüelles S, Herrera AJ, Venero JL, Ayala A, Cano J, Machado A (2006) Stress Increases Vulnerability to Inflammation in the Rat Prefrontal Cortex. J Neurosci 26: 5709. https://doi.org/10.1523/JNEUROSCI.0802-06.2006
Antunes MM, Godoy G, Masi LN, Curi R, Bazotte RB (2021) Prefrontal Cortex and Hippocampus Inflammation in Mice Fed High-Carbohydrate or High-Fat Diets. J Med Food 25(1). https://doi.org/10.1089/JMF.2021.0026
Grabert K, Michoel T, Karavolos MH, Clohisey S, Kenneth Baillie J, Stevens MP, Freeman TC, Summers KM, McColl BW (2016) Microglial brain region-dependent diversity and selective regional sensitivities to ageing. Nat Neurosci 19: 504. https://doi.org/10.1038/NN.4222
Mecha M (2011) An easy and fast way to obtain a high number of glial cells from rat cerebral tissue: A beginners approach. Protoc Exch. https://doi.org/10.1038/PROTEX.2011.218
Collins HY, Bohlen CJ (2018) Isolation and culture of rodent microglia to promote a dynamic ramified morphology in serum-free medium. J Vis Exp 9 (133): 57122. https://doi.org/10.3791/57122
Bohlen CJ, Bennett FC, Tucker AF, Collins HY, Mulinyawe SB, Barres BA (2017) Diverse Requirements for Microglial Survival, Specification, and Function Revealed by Defined-Medium Cultures. Neuron 94: 759–773. https://doi.org/10.1016/J.NEURON.2017.04.043
Bennett ML, Bennett FC, Liddelow SA, Ajami B, Zamanian JL, Fernhoff NB, Mulinyawe SB, Bohlen CJ, Adil A, Tucker A, Weissman IL, Chang EF, Li G, Grant GA, Hayden Gephart MG, Barres BA, Giger RJ, Stevens B (2016) New tools for studying microglia in the mouse and human CNS. Proc Nat Acad Sci USA 113: E1738–E1746. https://doi.org/10.1073/pnas.1525528113
Taticchi A, Urbani S, Albi E, Servili M, Codini M, Traina G, Balloni S, Patria FF, Perioli L, Beccari T, Conte C (2019) In Vitro Anti-Inflammatory Effects of Phenolic Compounds from Moraiolo Virgin Olive Oil (MVOO) in Brain Cells via Regulating the TLR4/NLRP3 Axis. Molecules 10 (24): 453. https://doi.org/10.3390/MOLECULES24244523
Tarassishin L, Suh HS, Lee SC (2014) LPS and IL-1 differentially activate mouse and human astrocytes: Role of CD14. GLIA 62: 999–1013. https://doi.org/10.1002/glia.22657
Moura AC arolina de, Lazzari VM, Agnes G, Almeida S, Giovenardi M, Veiga AB eatriz G da (2014) Transcriptional expression study in the central nervous system of rats: what gene should be used as internal control? Einstein (Sao Paulo) 12: 336–341. https://doi.org/10.1590/S1679-45082014AO3042
Montiel T, Camacho A, Estrada-Sanchez AM, Massieu L (2005) Differential effects of the substrate inhibitor l-trans-pyrrolidine-2,4-dicarboxylate (PDC) and the non-substrate inhibitor DL-threo-beta-benzyloxyaspartate (DL-TBOA) of glutamate transporters on neuronal damage and extracellular amino acid levels in rat brain in vivo. Neuroscience 133: 667–678. https://doi.org/10.1016/J.NEUROSCIENCE.2004.11.020
Rosa JM, Farré-Alins V, Ortega MC, Navarrete M, Lopez-Rodriguez AB, Palomino-Antolín A, Fernández-López E, Sol VV, Decouty C, Narros-Fernández P, Clemente D, Egea J (2021) TLR4 pathway impairs synaptic number and cerebrovascular functions through astrocyte activation following traumatic brain injury. Br J Pharmacol 178: 3395–3413. https://doi.org/10.1111/BPH.15488
Zou JY, Crews FT (2005) TNF alpha potentiates glutamate neurotoxicity by inhibiting glutamate uptake in organotypic brain slice cultures: neuroprotection by NF kappa B inhibition. Brain Res 1034: 11–24. https://doi.org/10.1016/J.BRAINRES.2004.11.014
Gras G, Samah B, Hubert A, Léone C, Porcheray F, Rimaniol AC (2012) EAAT expression by macrophages and microglia: still more questions than answers. Amino Acids 42: 221–229. https://doi.org/10.1007/S00726-011-0866-6
Krishnan VS, Shavlakadze T, Grounds MD, Hodgetts SI, Harvey AR (2018) Age-related loss of VGLUT1 excitatory, but not VGAT inhibitory, immunoreactive terminals on motor neurons in spinal cords of old sarcopenic male mice. Biogerontology 19: 385–399. https://doi.org/10.1007/S10522-018-9765-5
Draoui N, Feron O (2011) Lactate shuttles at a glance: from physiological paradigms to anti-cancer treatments. Dis Model Mech 4: 727–732. https://doi.org/10.1242/DMM.007724
Jha MK, Morrison BM (2020) Lactate Transporters Mediate Glia-Neuron Metabolic Crosstalk in Homeostasis and Disease. Front Cell Neurosci 14: 589582. https://doi.org/10.3389/FNCEL.2020.589582/FULL
López-Redondo F, Nakajima K, Honda S, Kohsaka S (2000) Glutamate transporter GLT-1 is highly expressed in activated microglia following facial nerve axotomy. Brain Res Mol Brain Res 76: 429–435. https://doi.org/10.1016/S0169-328X(00)00022-X
Rönnbäck L, Hansson E (2004) On the potential role of glutamate transport in metal fatigue. J Neuroinflammat 1: 1–9. https://doi.org/10.1186/1742-2094-1-22/FIGURES/1
Tilleux S, Hermans E (2007) Neuroinflammation and Regulation of Glial Glutamate Uptake in Neurological Disorders. J Neurosci Res 85: 2059–2070. https://doi.org/10.1002/jnr.21325
Du X, Li J, Li M, Yang X, Qi Z, Xu B, Liu W, Xu Z, Deng Y (2020) Research progress on the role of type I vesicular glutamate transporter (VGLUT1) in nervous system diseases. Cell Biosci 10: 1–10. https://doi.org/10.1186/S13578-020-00393-4/METRICS
Leiguarda C, McCarthy CJ, Casadei M, Lundgren KH, Coronel MF, Trigosso-Venario H, Seal RP, Seroogy KB, Brumovsky PR (2020) Transcript Expression of Vesicular Glutamate Transporters in Rat Dorsal Root Ganglion and Spinal Cord Neurons: Impact of Spinal Blockade during Hindpaw Inflammation. ACS Chem Neurosci 11: 2602–2614. https://doi.org/10.1021/ACSCHEMNEURO.0C00272
Brioschi S, d’Errico P, Amann LS, Janova H, Wojcik SM, Meyer-Luehmann M, Rajendran L, Wieghofer P, Paolicelli RC, Biber K (2020) Detection of Synaptic Proteins in Microglia by Flow Cytometry. Front Mol Neurosci 13: 149. https://doi.org/10.3389/FNMOL.2020.00149/BIBTEX
Marín-Teva JL, Cuadros MA, Martín-Oliva D, Navascués J (2011) Microglia and neuronal cell death. Neuron Glia Biol 7: 25–40. https://doi.org/10.1017/S1740925X12000014
Graeber MB (2010) Changing face of microglia. Science (New York, NY) 330: 783–788. https://doi.org/10.1126/SCIENCE.1190929
Malik AR, Willnow TE (2019) Excitatory Amino Acid Transporters in Physiology and Disorders of the Central Nervous System. Int J Mol Sci 20: 5671. https://doi.org/10.3390/IJMS20225671
Liu C, Zhang Y, Liu Q, Jiang L, Li M, Wang S, Long T, He W, Kong X, Qin G, Chen L, Zhang Y, Zhou J (2018) P2X4-receptor participates in EAAT3 regulation via BDNF-TrkB signaling in a model of trigeminal allodynia. Mol Pain 14. https://doi.org/10.1177/1744806918795930
Liang J, Chao D, Sandhu HK, Yu Y, Zhang L, Balboni G, Kim DH, Xia Y (2014) δ-Opioid receptors up-regulate excitatory amino acid transporters in mouse astrocytes. Br J Pharmacol 171: 5417–5430. https://doi.org/10.1111/BPH.12857
Massie A, Cnops L, Smolders I, McCullumsmith R, Kooijman R, Kwak S, Arckens L, Michotte Y (2008) High-affinity Na+/K+-dependent glutamate transporter EAAT4 is expressed throughout the rat fore- and midbrain. J Comp Neurol 511: 155–172. https://doi.org/10.1002/CNE.21823
Ciesielska A, Matyjek M, Kwiatkowska K (2021) TLR4 and CD14 trafficking and its influence on LPS-induced pro-inflammatory signaling. Cell Mol Life Sci: CMLS 78: 1233–1261. https://doi.org/10.1007/S00018-020-03656-Y
O’Callaghan P, Li JP, Lannfelt L, Lindahl U, Zhang X (2015) Microglial Heparan Sulfate Proteoglycans Facilitate the Cluster-of-Differentiation 14 (CD14)/Toll-like Receptor 4 (TLR4)-Dependent Inflammatory Response. J Biol Chem 290: 14904–14914. https://doi.org/10.1074/JBC.M114.634337
Korn T, Magnus T, Jung S (2005) Autoantigen specific T cells inhibit glutamate uptake in astrocytes by decreasing expression of astrocytic glutamate transporter GLAST: a mechanism mediated by tumor necrosis factor-alpha. FASEB J 19: 1878–1880. https://doi.org/10.1096/FJ.05-3748FJE
Haroon E, Miller AH, Sanacora G (2016) Inflammation, Glutamate, and Glia: A Trio of Trouble in Mood Disorders. Neuropsychopharmacology 42: 193–215. https://doi.org/10.1038/npp.2016.199
Lewerenz J, Hewett SJ, Huang Y, Lambros M, Gout PW, Kalivas PW, Massie A, Smolders I, Methner A, Pergande M, Smith SB, Ganapathy V, Maher P (2013) The Cystine/Glutamate Antiporter System xc− in Health and Disease: From Molecular Mechanisms to Novel Therapeutic Opportunities. Antioxid Redox Signal 18: 522. https://doi.org/10.1089/ARS.2011.4391
Kitagawa Y, Nakaso K, Horikoshi Y, Morimoto M, Omotani T, Otsuki A, Inagaki Y, Sato H, Matsura T (2019) System xc− in microglia is a novel therapeutic target for post-septic neurological and psychiatric illness. Sci Rep 9: 1–13. https://doi.org/10.1038/s41598-019-44006-8
Miyamoto A, Wake H, Ishikawa AW, Eto K, Shibata K, Murakoshi H, Koizumi S, Moorhouse AJ, Yoshimura Y, Nabekura J (2016) Microglia contact induces synapse formation in developing somatosensory cortex. Nat Commun 7. https://doi.org/10.1038/NCOMMS12540
Filipello F, Morini R, Corradini I, Zerbi V, Canzi A, Michalski B, Erreni M, Markicevic M, Starvaggi-Cucuzza C, Otero K, Piccio L, Cignarella F, Perrucci F, Tamborini M, Genua M, Rajendran L, Menna E, Vetrano S, Fahnestock M, Paolicelli RC, Matteoli M (2018) The Microglial Innate Immune Receptor TREM2 Is Required for Synapse Elimination and Normal Brain Connectivity. Immunity 48: 979–991.e8. https://doi.org/10.1016/J.IMMUNI.2018.04.016
Tanaka T, Murakami K, Bando Y, Yoshida S (2015) Interferon regulatory factor 7 participates in the M1-like microglial polarization switch. Glia 63: 595–610. https://doi.org/10.1002/GLIA.22770
Miron VE, Boyd A, Zhao JW, Yuen TJ, Ruckh JM, Shadrach JL, van Wijngaarden P, Wagers AJ, Williams A, Franklin RJM, Ffrench-Constant C (2013) M2 microglia and macrophages drive oligodendrocyte differentiation during CNS remyelination. Nat Neurosci 16: 1211–1218. https://doi.org/10.1038/NN.3469
Kelly B, O’Neill LAJ (2015) Metabolic reprogramming in macrophages and dendritic cells in innate immunity. Cell Res 25: 771–784. https://doi.org/10.1038/CR.2015.68
Моргун АВ, Малиновская НА, Комлева ЮК, Лопатина ОЛ, Кувачева НВ, Панина ЮА, Таранушенко ТЕ, Солончук РЮ, Салмина АБ (2014) Структурная и функциональная гетерогенность астроцитов головного мозга: роль в нейродегенерации и нейровоспалении. Бюлл сибирск мед 13:138–148. [Morgun AV, Malinovskaja NA, Komleva JuK, Lopatina OL, Kuvacheva NV, Panina JuA, Taranushenko TE, Solonchuk RJu, Salmina AB (2014) Structural and functional Heterogenety of astrocytes in the brain: role in neurodegeneration and neuroinflammation. Bull Sib Med 13: 138–148. (In Russ)]. https://doi.org/10.20538/1682-0363-2014-5-138-148
Anderson MA, Ao Y, Sofroniew MV (2014) Heterogeneity of reactive astrocytes. Neurosci Lett 565: 23–29. https://doi.org/10.1016/J.NEULET.2013.12.030
Matias I, Morgado J, Gomes FCA (2019) Astrocyte Heterogeneity: Impact to Brain Aging and Disease. Front Aging Neurosci 11: 59. https://doi.org/10.3389/FNAGI.2019.00059/BIBTEX
Tan YL, Yuan Y, Tian L (2019) Microglial regional heterogeneity and its role in the brain. Mol Psychiatry 25: 351–367. https://doi.org/10.1038/s41380-019-0609-8
Furube E, Kawai S, Inagaki H, Takagi S, Miyata S (2018) Brain Region-dependent Heterogeneity and Dose-dependent Difference in Transient Microglia Population Increase during Lipopolysaccharide-induced Inflammation. Sci Rep 8. https://doi.org/10.1038/S41598-018-20643-3
Doorn KJ, Brevé JJP, Drukarch B, Boddeke HW, Huitinga I, Lucassen PJ, van Dam AM (2015) Brain region-specific gene expression profiles in freshly isolated rat microglia. Front Cell Neurosci 9: 84. https://doi.org/10.3389/FNCEL.2015.00084
Kreisel T, Wolf B, Keshet E, Licht T (2019) Unique role for dentate gyrus microglia in neuroblast survival and in VEGF-induced activation. Glia 67: 594–618. https://doi.org/10.1002/GLIA.23505
Stratoulias V, Venero JL, Tremblay M-È, Joseph B (2019) Microglial subtypes: diversity within the microglial community. EMBO J 38: e101997. https://doi.org/10.15252/EMBJ.2019101997
Bisht K, Sharma KP, Lecours C, Gabriela Sánchez M, el Hajj H, Milior G, Olmos-Alonso A, Gómez-Nicola D, Luheshi G, Vallières L, Branchi I, Maggi L, Limatola C, Butovsky O, Tremblay MÈ (2016) Dark microglia: A new phenotype predominantly associated with pathological states. Glia 64: 826–839. https://doi.org/10.1002/GLIA.22966
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


