Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 3, стр. 369-378
Влияние активации и блокады нитрергической нейропередачи на активность серотониновой системы медиальной префронтальной коры мозга крыс
Н. Б. Саульская 1, *, М. А. Бурмакина 1, Н. А. Трофимова 1
1 Институт физиологии им. И.П. Павлова Российской академии наук
Санкт-Петербург, Россия
* E-mail: saulskayanb@infran.ru
Поступила в редакцию 29.12.2021
После доработки 18.01.2022
Принята к публикации 21.01.2022
- EDN: LGNRKY
- DOI: 10.31857/S0869813922030086
Аннотация
Оксид азота (NO) и серотонин играют важную роль в обеспечении функционирования медиальной префронтальной коры, но их взаимодействие исследовано мало. Целью работы было изучение влияний локальных нитрергических сигналов на активность серотониновой системы этой корковой области. На крысах-самцах линии Спрег-Доули методом прижизненного внутримозгового микродиализа показано, что введения в медиальную префронтальную кору донора NO диэтиламин ноноата (0.1, 0.5, 1 мМ) приводят к увеличению уровня внеклеточного серотонина в этой области, коррелирующему в первые 15 мин введения с концентрацией вводимого препарата. Введение диэтиламин ноноата в концентрации 2.5 мМ снижало этот показатель. Инфузия в медиальную префронтальную кору ингибитора NO-синтазы N-нитро-L-аргинина (0.5 мМ) уменьшала фоновый уровень внеклеточного серотонина в данной области коры, а также задерживала и ослабляла подъем этого показателя, вызываемый локальным введением селективного ингибитора обратного захвата серотонина флуоксетина (10 мкМ). Полученные данные свидетельствуют, что в медиальной префронтальной коре в состоянии спокойного бодрствования тонические эндогенные нитрергические сигналы, а также их умеренное фармакологическое усиление введениями донора NO оказывают активационные влияния на серотониновую систему этой области путем увеличения пула внеклеточного серотонина, а более значительная нитрергическая стимуляция действует противоположным образом.
Газообразный межклеточный мессенджер оксид азота (NO), продуцируемый живыми организмами в ряду от бактерий до млекопитающих, играет важную роль в регуляции многих физиологических и патологических процессов, включая нейрогенез, нейротрансмиссию, модуляцию болевой чувствительности, сердечно-сосудистый гомеостаз, обучение, нейродегенерацию, воспаление и др. [1]. Нейроны, экспрессирующие нейронную изоформу NO-синтазы (nNOS – фермент, катализирующий образование NO из аргинина [2]), широко распространены в ЦНС [3]. У крыс высокая плотность иммунореактивности к nNOS выявлена в серотонинергических ядрах шва и средняя плотность – в иннервируемых этими ядрами областях мозга, включая медиальную префронтальную кору (мПК) [3], что создает предпосылки для NO-серотонинового взаимодействия. В соответствии с этим показано участие NO в регуляции синтеза, выброса, метаболизма и обратного захвата серотонина в ЦНС [4, 5]. В частности, в экспериментах in vivo (микродиализ, push-pull канюльная соперфузия) установлено, что NO регулирует высвобождение серотонина в ряде отделов мозга, причем, знак таких влияний варьирует от структуры к структуре и зависит от концентрации NO [4]. Ранее мы продемонстрировали, что в мПК локальные нитрергические сигналы тоже могут оказывать влияние на активность серотониновой системы этой области, поскольку введение в мПК донора NO диэтиламин ноноата (DEA, 1 мМ) приводит к кратковременному подъему в ней уровня внеклеточного серотонина [6]. Вместе с тем, остается не выясненным, является ли такой эффект экзогенной нитрергической стимуляции мПК дозозависимым, а значит, физиологически релевантным, нет сведений, участвуют ли эндогенные нитрергические сигналы мПК в регуляции активности серотониновой системы этой корковой области. Настоящая работа посвящена выяснению этих вопросов. С этой целью, во-первых, исследованы влияния нитрергической стимуляции мПК локальными введениями донора NO DEA в широком диапазоне концентраций (0.1–2.5 мМ) на уровень внеклеточного серотонина в этой области коры. Во-вторых, изучены эффекты введения в мПК ингибитора NO-синтазы N‑нитро-L-аргинина (блокирующего образование эндогенного NO) на фоновый уровень внеклеточного серотонина в мПК и на его увеличение, вызываемое локальной блокадой обратного захвата серотонина. Таких сведений в литературе нет. Актуальность этих исследований определяется важной ролью мПК в регуляции физиологических функций в норме и при психопатологии [7] и все возрастающим объемом сведений о вкладе в такую регуляцию как серотонинергических [8], так и нитрергических [9] механизмов мПК.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на самцах крыс линии Спрег-Доули (320–390 г) из биоколлекции “Коллекция лабораторных млекопитающих разной таксономической принадлежности” Института физиологии им. И.П. Павлова РАН. Животные этой линии характеризуются пониженным уровнем кортикостерона и гормонов щитовидной железы (T3 и T4) в крови по сравнению с крысами линии Вистар [10], что делает их более спокойными и удобными в работе в ходе длительных микродиализных экспериментов, проводимых нами без ограничений двигательной активности животного. Все процедуры, выполненные в исследованиях с участием крыс, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям комиссии по работе с животными Института физиологии им. И.П. Павлова РАН. Крыс содержали в условиях естественного светового режима и свободного доступа к воде и пище.
Крысам (n = 31) имплантировали диализные канюли в правую мПК. Детали имплантации опубликованы нами ранее [11]. Микродиализные эксперименты проводили через 2 дня после имплантации. Введения фармакологических препаратов осуществляли методом диализной инфузии, добавляя их в искусственную спинномозговую жидкость (ИСМЖ), постоянно протекающую через диализную канюлю в ходе эксперимента. Смену растворов вводимых препаратов осуществляли переключением потока жидкости с одного канала диализного насоса на другой. Эксперимент состоял из нескольких этапов. Коротко, у животного, находящегося в дневной домашней клетке, в течение часа проводили диализную перфузию мПК ИСМЖ (1 мкл/мин) без сбора диализата (стабилизационный период). Затем собирали 5 фоновых порций диализата (каждая по 15 мин), после чего животных разделяли на 4 группы. Крысам группы 1 (n = 8) в ИСМЖ добавляли донор NO – натриевую соль диэтиламин ноноата (DEA, “Sigma”, США) в концентрации 0.1 мМ, а крысам группы 2 (n = 8) – DEA в концентрации 1 мМ и собирали по 4 пятнадцатиминутных порции диализата. После этого с животными группы 2 эксперименты завершали, а крысам группы 1 продолжали вводить DEA в мПК сначала в концентрации 0.5 мМ, затем в концентрации 2.5 мМ (по 1 ч каждая концентрация). Животным группы 3 (n = 9) после сбора фоновых порций диализата в ИСМЖ для перфузии мПК добавляли селективный ингибитор обратного захвата серотонина флуоксетин (FLU, 10 мкМ), после чего собирали 5 порций диализата. Крысам группы 4 (n = 6) после сбора фоновых порций диализата в ИСМЖ добавляли сначала ингибитор NO- синтазы N-нитро-L-аргинин (NA, 0.5 мМ), а через 75 мин этот раствор заменяли на смесь 0.5 мМ NA и 10 мкМ FLU. Через 75 мин диализную перфузию завершали. Диализат собирали каждые 15 мин и немедленно анализировали в течение всего периода эксперимента.
Содержание серотонина в диализате мПК исследовали методом высокоэффективной жидкостной хроматографии с электрохимической детекцией, как было описано ранее [12]. Уровень серотонина в образцах диализата представляли сначала в нМ/л, а затем – в процентах к собственному среднему фоновому уровню. По завершении экспериментов животных забивали [см. 6] и извлекали мозг для последующего морфологического контроля. Критерием отбора животного для статистической обработки была локализация диализного участка канюли в мПК.
Для статистической обработки использовали пакет SigmaStat (3.0). Данные представляли как среднее ± стандартная ошибка среднего. Изменения уровня внеклеточного серотонина относительно фона оценивали методом однофакторного дисперсионного анализа (фактор – время; F-критерий) с апостериорным анализом (post hoc) по t-критерию Бонферрони. Для сравнения эффектов разных концентраций DEA на уровень внеклеточного серотонина применяли однофакторный дисперсионный анализ (фактор – концентрация; F-критерий) и анализ post hoc по t-критерию Бонферрони. Для межгруппового сравнения использовали двухфакторный дисперсионный анализ (факторы – группа и время, F-критерий) в сочетании с анализом post hoc по t-критерию Бонферрони. Коэффициент корреляции вычисляли по методу Пирсона.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Величины фонового уровня внеклеточного серотонина в диализате мПК животных экспериметальных групп были следующими: группа 1 – 0.23 ± 0.01 нМ (n = 8); группа 2 – 0.24 ± 0.03 нМ (n = 8), группа 3 – 0.24 ± 0.02 нМ (n = 9); группа 4 – 0.21 ± 0.01 нМ (n = 6), что близко к ранее опубликованным результатам [12]. Не было выявлено межгрупповых различий по этому показателю (F(3, 27) = 0.4, p = 0.8).
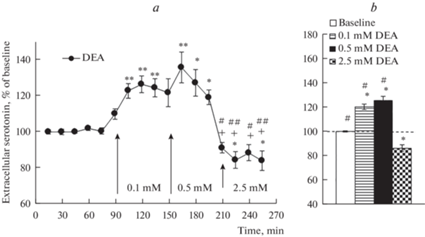
Диализная инфузия в мПК животных группы 1 0.1 мМ DEA вызывала подъем уровня внеклеточного серотонина в мПК по отношению к фону перед введением (рис. 1а; F(8, 56) = 15.2, p < 0.001) с максимумом 126 ± 5% через 45 мин после начала введения. Увеличение концентрации DEA до 0.5 мМ также характеризовалось ростом уровня серотонина в этой области (рис. 1а; F(8, 56) = 8.9, p < 0.001). Причем максимальный подъем (135 ± 8%) имел место через 30 мин после начала введения этой дозы DEA. Дальнейшее увеличение концентрации DEA до 2.5 мМ, напротив, снижало уровень серотонина в мПК (рис. 1a; F(8, 56) = 5.1, p < 0.001). Однофакторный дисперсионный анализ выявил значимое влияние концентрации DEA (рис. 1b; F(3, 124) = 51.4, p < 0.001) на уровень внеклеточного серотонина в мПК крыс группы 1. По данным post hoc анализа, средние (за час введения) уровни внеклеточного серотонина в мПК при введениях 0.1 мМ DEA и 0.5 мМ DEA превышали фоновые значения (t = 5.7, p < 0.001; t = 7.1, p < 0.001 соответственно), а уровень серотонина при введении 2.5 мМ DEA был ниже, чем этот показатель в фоне (t = 3.8, p < 0.001) и при введениях 0.1 мМ DEA (t = 9.4, p < 0.001) и 0.5 мМ DEA (t = 10.9, p < 0.001). Не было обнаружено значимых различий между средними (за час введения) подъемами уровня внеклеточного серотонина в мПК, вызываемыми введениями 0.1 мМ DEA и 0.5 мМ DEA (t = 1.4, p = 0.9).
Рис. 1.
(a) – изменения уровня внеклеточного серотонина в мПК при введении в эту область диэтиламин ноноата (DEA) в концентрациях 0.1, 0.5 и 2.5 мМ; (b) – средний (за весь период введения) уровень внеклеточного серотонина в мПК при введении каждой концентрации DEA. По оси X – время, мин; по оси Y – уровень серотонина, % к фону; разброс на графике и диаграмме – ошибка среднего; черные стрелки – начало введения разных концентраций DEA. (а) * – p < 0.05; ** – p < 0.001 – при сравнении с фоном; + – p < 0.001 – при сравнении с введением 0.1 мМ DEA; # – p < 0.01, ## – p < 0.001 – при сравнении с введением 0.5 мМ DEA. (b) * – p < 0.001; # – p < 0.001 – при сравнении с введением 2.5 мМ DEA.
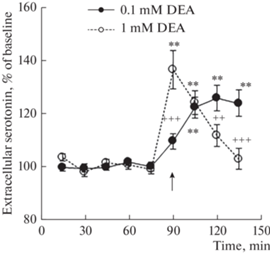
Введение в мПК крыс группы 2 1 мМ DEA приводило к росту уровня внеклеточного серотонина в этой области (рис. 2; F(8, 56) = 13.6, p < 0.001) с максимальным подъемом 139 ± 8% в первые 15 мин введения. После этого наблюдалось постепенное возвращение уровня серотонина мПК к фоновым показателям, что соответствует нашим прежним результатам [6]. Двухфакторный дисперсионный анализ выявил значимые различия между изменениями уровня внеклеточного серотонина в мПК, вызываемыми введениями 0.1 мМ DEA (группа 1) и 1 мМ DEA (группа 2) (рис. 1a; F(8, 126) = 7.6, p < 0.001). По данным post hoc анализа, введение в мПК 1 мМ DEA крысам группы 2 вызывало в первые 15 мин введения подъем уровня внеклеточного серотонина в мПК, превышающий этот показатель крыс группы 1 при введении им 0.1 мМ DEA (рис. 2; t = 5.9, p < 0.001). Вместе с тем, на 45-й и 60-й минутах введения уровень серотонина крыс группы 1 при введении 0.1 мМ DEA превышал этот показатель крыс группы 2 с введением 1 мМ DEA (t = 2.9, p = 0.004; t = 4.1, p < 0.001 соответственно).
Рис. 2.
Изменения уровня внеклеточного серотонина в мПК крыс с введениями в мПК 0.1 мМ DEA (группа 1) и 1 мМ DEA (группа 2). Черная стрелка – начало введения DEA. ++ – p < 0.01; +++ – p < 0.001 – при межгрупповом сравнении. Остальные обозначения, как на рис. 1а.
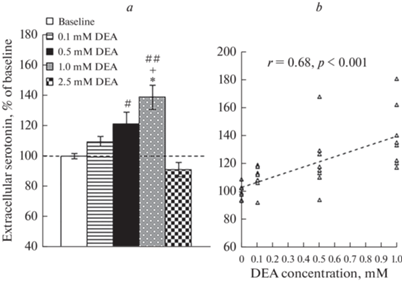
Сводный анализ (по группам 1 и 2) изменений уровня внеклеточного серотонина в мПК в первые 15 мин введений DEA в концентрациях 0.1, 0.5, 1, 2.5 мМ показал, что в этом временном интервале концентрация DEA значимо влияет на уровень серотонина в мПК с максимальным подъемом при введениях 1 мМ DEA (рис. 3a; F(4, 35) = 11.2, p < 0.001). Корреляционный анализ продемонстрировал, что в первые 15 мин введения DEA в концентрациях 0.1, 0.5 и 1 этот препарат дозозависимо увеличивал уровень внеклеточного серотонина в мПК (рис. 3b; r = = 0.68, p < 0.001, n = 32).
Рис. 3.
(а) – уровень внеклеточного серотонина в мПК крыс групп 1 и 2 в первые 15 мин введения каждой концентрации DEA. * – p < 0.001 – при сравнении с фоном; + – p < 0.01 – при сравнении с введением 0.1 мМ DEA; # – p < 0.01, ## – p < 0.001 – при сравнении с введением 2.5 мМ DEA; (b) – корреляция уровня внеклеточного серотонина в мПК и концентрации вводимого DEA (0.1–1 мМ). По оси Y – концентрация вводимого DEA. r – коэффициент корреляции. Остальные обозначения, как на рис. 1а.
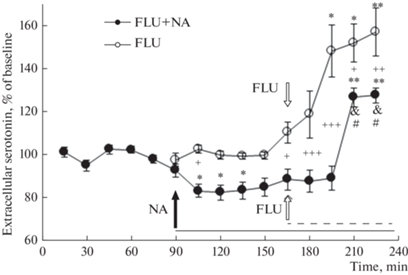
Введение в мПК крыс группы 3 ингибитора обратного захвата серотонина флуоксетина (FLU, 10 мкМ) сопровождалось ростом уровня внеклеточного серотонина в мПК относительно собственного фона, который становился достоверным через 45 мин введения, с максимумом 157 ± 11% (рис. 4; F(9, 72) = 13.4, p < 0.001). Введение в мПК животных группы 4 ингибитора NO-синтазы N-нитро-L-аргинина (NA, 0.5 мМ), напротив, снижало уровень внеклеточного серотонина в этой области относительно фона перед введением (рис. 4; F(9, 45) = 8.8, p < 0.001). Введение в мПК животным группы 4 FLU (10 мкМ) на фоне предварительного введения NA (0.5 мМ) вызывало подъем уровня внеклеточного серотонина в мПК (максимум 127 ± 4%), наблюдаемый с 60-й мин введения FLU (рис. 4; F(14, 70) = 17.7, p < 0.001). По результатам двухфакторного дисперсионного анализа животные с введением FLU на фоне введения NA (группа 4) демонстрировали меньший по амплитуде и запаздывающий по времени подъем уровня внеклеточного серотонина мПК по сравнению с крысами группы 3, подвергавшимися изолированному введению FLU (F(9, 130) = 2.4, p = 0.02).
Рис. 4.
Влияние введения в мПК 0.5 мМ NA на фоновый уровень внеклеточного серотонина, а также на его изменения, вызываемые введением в мПК 10 мкМ FLU. FLU – крысы группы 3 с введением в мПК FLU. FLU + NA – крысы группы 4 с введением в мПК FLU на фоне введения NA. Черная стрелка – начало введения NA крысам группы 4 (FLU + NA). Белые стрелки – начало введения FLU крысам группы 3 (FLU) и на фоне введения NA крысам группы 4 (FLU + NA). Сплошная горизонтальная линия – период введения NA крысам группы 4 (FLU + NA), пунктирная горизонтальная линия – период введения FLU изолированно крысам группы 3 (FLU) или на фоне ведения NA крысам группы 4 (FLU + NA). * – p < 0.05; ** – p < 0.001 – при сравнении с фоном; +– p < 0.05; ++ – p < 0.01; +++ – p < 0.001 – при межгрупповом сравнении. & – p < 0.001 – при сравнении с уровнем серотонина перед введением FLU + NA. # – p < 0.001 – при сравнении с уровнем серотонина в первые 45 мин после начала введения FLU+NA. Остальные обозначения, как на рис. 1a.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
мПК является важным интегративным центром, координирующим активность моторных, висцеральных, мотивационных, эмоциональных систем мозга и обеспечивающим перестройку их работы с учетом изменяющихся обстоятельств [7, 8, 13]. Нарушение нормального функционирования мПК наблюдается при хроническом стрессе [14] и при психопатологии (шизофрения, депрессия, аддикция) [13]. Большое влияние на работу этой области оказывают нитрергические сигналы, модулирующие нейронную активность, возбудимость и синаптическую пластичность [9, 15]. Источниками NO в мПК являются nNOS-содержащие ГАМКергические интернейроны [9], а также иннервирующие мПК отростки аксонов серотониновых нейронов ядер шва, в 80% которых выявлена иммунореактивность к nNOS [16].
Одной из важных функций NO является регуляция баланса синаптического выброса и обратного захвата нейромедиаторов [15, 17, 18], что отражается в уровне внеклеточных нейромедиаторов и их доступности для рецепторов. Так, для мПК показано дозозависимое увеличение уровня внеклеточного глутамата в ответ на локальные введения донора NO S-нитрозо-N-пеницилламина (0.5–5 мМ) [19]. Ранее мы продемонстрировали, что донор NO DEA при его введении в мПК в концентрации 1 мМ приводит к кратковременному подъему уровня внеклеточного серотонина в этой области с последующим снижением этого показателя [6]. В настоящей работе установлена дозозависимость стимулирующего действия такой экзогенной нитрергической активации на уровень внеклеточного серотонина в мПК в диапазоне концентраций DEA 0.1–1 мМ. Обнаруженный эффект, возможно, связан с торможением под действием NO обратного захвата серотонина в мПК, поскольку показано, что доноры NO дозозависимо уменьшают захват [3H]-серотонина синаптосомами коры [20], а генный нокаут nNOS, напротив, увеличивает скорость захвата серотонина (Vmax) и мембранную плотность его транспортеров в синаптосомах целого мозга [21]. Кроме того, NO может стимулировать процесс экзоцитоза через активацию растворимой гуанилатциклазы (sGC), одной из основных мишеней NO [2], что также может способствовать показанному в работе росту уровня внеклеточного серотонина в мПК при введениях DEA (0.1–1 мМ). Ранее c использованием аналогичного методического подхода было продемонстрировано участие такого sGC-зависимого механизма в усилении высвобождения серотонина в стриатуме крысы [22].
С другой стороны, NO может тормозить выброс нейромедиаторов за счет S-нитрозилирования комплексина, цитозольного белка, участвующего в экзоцитозе [17]. Поскольку для S-нитрозилирования требуются более высокие концентрации NO по сравнению с NO-зависимой активацией sGC [15], можно предположить, что наблюдаемое в работе снижение уровня внеклеточного серотонина в мПК при введении в эту область DEA в максимальной концентрации (2.5 мМ) опосредовано таким механизмом действия NO. Ранее sGC-независимые тормозные эффекты NO на высвобождение серотонина были продемонстрированы в вентральном гиппокампе [23]. Еще одной возможной причиной снижения уровня внеклеточного серотонина в мПК при введении 2.5 мМ DEA может быть вызываемая S-нитрозилированием десенситизация sGC [24] в ходе предварительного введения DEA в меньших концентрациях. Косвенным подтверждением такой возможности является продемонстрированное нами ранее перерастание активационного действия 1мМ DEA на высвобождение серотонина в мПК в тормозное при длительном введении этого препарата [6].
Значимым результатом работы являются данные, свидетельствующие, что серотониновая система мПК находится под тоническими активационными влияниями эндогенного NO, поскольку устранение таких влияний локальным введением ингибитора NO-синтазы NA (0.5 мМ) снижало уровень внеклеточного серотонина в этой области. Более того, введение NA ослабляло эффективность блокады обратного захвата серотонина в мПК, задерживая и уменьшая подъем уровня внеклеточного серотонина, вызываемый локальным введением флуоксетина (10мМ). Этот эффект NA, показанный нами in vivo, возможно, связан с усилением захвата серотонина в мПК в результате недостатка NO, поскольку такая закономерность была продемонстрирована ранее на синаптосомах целого мозга мышей с генным нокаутом nNOS [21]. Результаты этих экспериментов впервые свидетельствуют об участии эндогенных нитрергических сигналов мПК в регуляции активности ее серотониновой системы через регуляцию уровня внеклеточного серотонина.
В целом, полученные в работе новые данные позволяют заключить, что в мПК крыс в состоянии спокойного бодрствования тонические эндогенные нитрергические сигналы, а также их умеренное фармакологическое усиление введениями донора NO оказывают активационные влияния на серотониновую систему этой области путем увеличения пула внеклеточного серотонина, а более значительная нитрергическая стимуляция действует противоположным образом.
Список литературы
Porrini C, Ramarao N, Tran SL (2020) Dr. NO and Mr. Toxic – the versatile role of nitric oxide. Biol Chem 401: 547–572. https://doi.org/10.1515/hsz-2019-0368
Garthwaite J (2019) NO as a multimodal transmitter in the brain: discovery and current status. Br J Pharmacol 176: 197–211. https://doi.org/10.1111/bph.14532
Chong PS, Poon CH, Fung ML, Guan L, Steinbusch HWM, Chan YS, Lim WL, Lim LW (2019) Distribution of neuronal nitric oxide synthase immunoreactivity in adult male Sprague-Dawley rat brain. Acta Histochem 121: 151437. https://doi.org/10.1016/j.acthis.2019.08.004
Ghasemi M, Claunch J, Niu K (2019) Pathologic role of nitrergic neurotransmission in mood disorders. Prog Neurobiol 173: 54–87. https://doi.org/10.1016/j.pneurobio.2018.06.002
Zhou QG, Zhu XH, Nemes AD, Zhu DY (2018) Neuronal nitric oxide synthase and affective disorders. IBRO Rep 5: 116–132. https://doi.org/10.1016/j.ibror.2018.11.004
Saulskaya NB, Burmakina MA, Trofimova NA (2021) Nitric oxide inhibits the functional activation of the medial prefrontal cortex serotonin system during fear formation and decreases fear generalization. Neurochem J 15: 266–272. https://doi.org/10.1134/s1819712421030107
Jacobs DS, Moghaddam B (2021) Medial prefrontal cortex encoding of stress and anxiety. Int Rev Neurobiol. 158: 29–55. https://doi.org/10.1016/bs.irn.2020.11.014
Pastor V, Medina JH (2021) Medial prefrontal cortical control of reward- and aversion-based behavioral output: Bottom-up modulation Eur J Neurosci 53: 3039–3062. https://doi.org/10.1111/ejn.15168
Liang HY, Chen ZJ, Xiao H, Lin YH, Hu YY, Chang L, Wu HY, Wang P, Lu W, Zhu DY, Luo CX (2020) nNOS-expressing neurons in the vmPFC transform pPVT-derived chronic pain signals into anxiety behaviors. Nat Commun 11: 2501. https://doi.org/10.1038/s41467-020-16198-5
Kühn ER, Bellon K, Huybrechts L, Heyns W (1983) Endocrine differences between the Wistar and Sprague-Dawley laboratory rat: influence of cold adaptation. Horm Metab Res 15: 491–498. https://doi.org/10.1055/s-2007-1018767
Saulskaya NB, Sudorgina PV (2016) Activity of the nitrergic system of the medial prefrontal cortex in rats with high and low levels of generalization of a conditioned reflex fear reaction. Neurosci Behav Physiol 46: 964–970. https://doi.org/10.1007/s11055-016-0338-2
Saulskaya NB, Marchuk OE (2020) Inhibition of serotonin reuptake in the medial prefrontal cortex during acquisition of a conditioned reflex fear reaction promotes formation of generalized fear. Neurosci Behav Physiol 50: 432–438. https://doi.org/10.1007/s11055-020-00918-x
Riga D, Motos MR, Glas A, Smit AB, Spijker S, Van den Oever MC (2014) Optogenetic dissection of medial prefrontal cortex circuitry. Front Systemic Neurosci 8: 230. https://doi.org/10.3389/fnsys.2014.00230
Woo E, Sansing LH, Arnsten AFT, Datta D (2021) Chronic stress weakens connectivity in the prefrontal cortex: architectural and molecular changes. Chronic Stress 5: 1–22. https://doi.org/10.1177/24705470211029254
Hardingham N, Dachtler J, Fox K (2013) The role of nitric oxide in pre-synaptic plasticity and homeostasis. Front Cell Neurosci 7: 190. https://doi.org/10.3389/fncel.2013.00190
Lu Y, Simpson KL, Weaver KJ, Lin RC (2010) Coexpression of serotonin and nitric oxide in the raphe complex: cortical versus subcortical circuit. Anat Rec Hoboken 293: 1954–1965. https://doi.org/10.1002/ar.21222
Robinson SW, Bourgognon JM, Spiers JG, Breda C, Campesan S, Butcher A, Mallucci GR, Dinsdale D, Morone N, Mistry R., Smith TM, Guerra-Martin M, Challiss RAJ, Giorgini F, Steinert JR (2018) Nitric oxide-mediated posttranslational modifications control neurotransmitter release by modulating complexin farnesylation and enhancing its clamping ability. PLoS Biol 16: e2003611. https://doi.org/10.1371/journal.pbio.2003611
Garthwaite J (2007) Neuronal nitric oxide synthase and the serotonin transporter get harmonious. PNAS 104: 7739–7740. https://doi.org/10.1073/pnas.0702508104
Roenker NL, Gudelsky GA, Ahlbrant R, Horn PS, Richtand NM (2012) Evidence for involvement of nitric oxide and GABAb receptors in MK-801 – stimulated release of glutamate in rat prefrontal cortex. Neuropharmacology 63: 575–581. https://doi.org/10.1016/j.neuropharm.2012.04.032
Asano S, Matsuda T, Nakasu Y, Maeda S, Nogi H, Baba A (1997) Inhibition by nitric oxide of the uptake of [3H]serotonin into rat brain synaptosomes. Jpn J Pharmacol 75: 123–128. https://doi.org/10.1016/S0021-5198(19)31323-X
Chanrion B, Mannoury la Cour C, Bertaso F, Lerner-Natoli M, Freissmuth M, Millan MJ, Bockaert J, Marin P (2007) Physical interaction between the serotonin transporter and neuronal nitric oxide synthase underlies reciprocal modulation of their activity. Proc Natl Acad Sci U S A 104: 8119–8124. https://doi.org/10.1073/pnas.0610964104
Guevara-Guzman R, Emson PC, Kendrick KM (1994) Modulation of in vivo striatal transmitter release by nitric oxide and cyclic GMP. J Neurochem 62: 807–810. https://doi.org/10.1046/j.1471-4159.1994.62020807.x
Wegener G, Volke V, Rosenberg R (2000) Endogenous nitric oxide decreases hippocampal levels of serotonin and dopamine in vivo. Br J Pharmacol 130: 575–580. https://doi.org/10.1038/sj.bjp.0703349
Sayed N, Baskaran P, Ma X, van den Akker F, Beuve A (2007) Desensitization of soluble guanylyl cyclase, the NO receptor, by S-nitrosylation. Proc Natl Acad Sci U S A 104: 12312–12317. https://doi.org/10.1073/pnas.0703944104
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


