Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 4, стр. 455-473
Произвольное внимание и качество жизни у больных сахарным диабетом 1 и 2 типа в зависимости от длительности заболевания
Н. Э. Тадевосян 1, А. С. Хачунц 1, М. Гогаргани 2, А. А. Саакян 1, А. А. Туманян 1, *
1 Институт Физиологии им. Л.А. Орбели НАН РА
Ереван, Республика Армения
2 Университет медицинских наук Ясудж
Ясудж, Исламская республика Иран
* E-mail: tumanyanaa@mail.ru
Поступила в редакцию 22.12.2021
После доработки 09.03.2022
Принята к публикации 10.03.2022
- EDN: QMPZJV
- DOI: 10.31857/S0869813922040082
Аннотация
Статья посвящена изучению когнитивных процессов у больных СД 1-го и 2-го типа с длительностью заболевания менее 6 лет, от 6 до 10 лет и более 10 лет. В исследовании использовались модифицированный аналог d2 теста – тест “Clocks Carrousel” и опросник SF-36 для самооценки качества жизни. У больных СД 1-го и 2-го типа было выявлено умеренное когнитивное нарушение, а именно снижение уровня произвольного внимания, а также снижение качества жизни. Было показано, что продолжительность заболевания влияет на когнитивные процессы у больных СД, однако эти изменения носят различный характер в зависимости от типа заболевания. У пациентов с СД 1-го типа наблюдалась стабильность и некоторое улучшение характеристик внимания с увеличением длительности заболевания. Выявленные изменения характеристик внимания у пациентов с СД 2-го типа свидетельствовали о снижении уровня произвольного внимания с увеличением длительности заболевания. Сравнительный анализ показал, что пациенты с СД 1-го типа имели более низкий уровень внимания по сравнению с пациентами с СД 2-го типа. Эти различия были наиболее выражены у пациентов с длительностью заболевания менее 6 лет. Результаты теста SF-36 выявили схожую тенденцию изменения психологического статуса больных СД в зависимости от типа и длительности заболевания, что и изменения характеристик произвольного внимания.
В последние годы наблюдается стремительный рост заболеваемости сахарным диабетом (СД). По данным Международной диабетической федерации (IDF), число больных СД в 2021 г. составляло 537 млн человек (20–79 лет), а к 2030 г. прогнозируется увеличение этого числа до 643 млн [1]. Диабет представляет собой хроническое метаболическое заболевание, связанное с нарушением секреции инсулина или нарушением его взаимодействия с клеткой-мишенью. В результате развивается гипергликемия, то есть стойкое повышение уровня глюкозы в крови [2]. Это приводит к развитию ретинопатии, нефропатии, периферической невропатии, а также сердечно-сосудистых и других осложнений, снижающих качество жизни больных [3, 4].
Другой мишенью диабета является центральная нервная система (ЦНС). В ряде работ было показано, что состояния гипергликемии и гипогликемии, являющиеся следствием инсулинорезистентности и инсулиновой недостаточности, приводят к развитию когнитивных нарушений при СД [5–7]. Во многих исследованиях выявлены структурные, функциональные и метаболические изменения в головном мозге больных СД, которые обуславливают когнитивные дисфункции. Показано снижение плотности серого вещества во фронтальном, заднем и темпоральном отделах коры у больных СД 1-го типа и уменьшение его объема у больных СД 2-го типа по сравнению со здоровыми лицами [8, 9]. У лиц среднего возраста с СД 1-го типа наблюдается уменьшение объема белого вещества и снижение фракционной анизотропии, отражающей плотность волокон, диаметр аксонов и миелинизацию белого вещества в задних отделах мозга [10]. При МРТ обследовании у больных СД 2-го типа выявляется гиперинтенсивность белого вещества (ГИБВ), т. е. поражение белого вещества возле желудочков головного мозга и в глубоких подкорковых отделах [11]. В популяции больных СД 2-го типа отмечена атрофия медиальных отделов височной доли, особенно гиппокампа и префронтальной коры [12, 13]. Помимо структурной атрофии наблюдаются и функциональные изменения головного мозга, такие как нарушение функциональных связей гиппокампа, сети пассивного режима работы мозга (DMN) и других систем [14, 15]. Исследования больных СД 1-го типа с применением функциональных нейровизуализационных методов показали широко распространенные нарушения сетевой активности в лобно-теменной сети и передней поясной коре (области мозга, связанные с функцией внимания) при выполнении различных когнитивных задач [10]. Отмеченные структурно-функциональные изменения головного мозга приводят к снижению когнитивных функций и скорости обработки информации у больных СД [10–15].
С учетом вышесказанного, СД является существенным и независимым фактором риска развития когнитивных нарушений, которые не являются общепризнанными осложнениями СД. Когнитивные нарушения могут варьировать от минимальной дисфункции до деменции. Для переходного состояния между нормальным когнитивным состоянием и деменцией используется термин “легкие когнитивные нарушения” (MCI, mild cognitive impairment) [16, 17]. Но даже MCI могут оказывать отрицательное влияние на течение СД, вызывая трудности в самообслуживании больных и снижение качества жизни (КЖ). Многочисленные исследования показали ухудшение результатов нейрокогнитивного тестирования у больных СД по сравнению со здоровыми испытуемыми того же возраста [18–20]. Когнитивные нарушения наблюдаются при СД обоих типов, но характер дисфункции у больных СД 1-го и 2-го типа различен. У больных СД 1-го типа когнитивная дисфункция характеризуется снижением скорости обработки информации, психомоторной активности, внимания, ухудшением когнитивного мышления и зрительного восприятия. Помимо этих, наиболее часто встречающихся когнитивных нарушений, у больных СД 1-го типа отмечается нарушение таких когнитивных функций, как соматосенсорное восприятие, обучение, память и исполнительная функция, а также снижение словарного запаса и общего интеллекта [5, 21, 22]. У больных СД 2-го типа наблюдается снижение скорости психомоторных реакций, скорости обработки информации, сосредоточенного внимания, способности к обучению, ухудшение рабочей и вербальной памяти, зрительной ретенции (удерживание), когнитивного мышления и нарушение исполнительной функции. Данные о зрительно-пространственной памяти и концентрации противоречивы [21, 23, 24].
Таким образом, СД наряду с другими системами поражает и ЦНС, что приводит к нарушению когнитивных процессов. Это, в свою очередь, снижает КЖ больных СД. Однако многие вопросы, касающиеся когнитивных процессов у больных СД, остаются невыясненными. В данной работе изучалось произвольное внимание и КЖ у больных СД 1-го и 2-го типа в зависимости от длительности заболевания. Во многих исследованиях для оценки различных когнитивных функций, в том числе внимания, в основном используются тесты Краткая шкала оценки психического статуса (MMSE) и Монреальская шкала когнитивной оценки (MoCA) [25–27]. В отличие от этих тестов, дающих суммарную оценку когнитивного состояния, используемый в нашем исследовании тест внимания позволяет получить такие параметры, как объем обрабатываемой информации и скорость ее обработки, точность выполнения, время дифференциации символов, концентрацию и продуктивность внимания. Сравнение всех этих параметров позволяет получить детальное представление о процессе внимания. В нашем исследовании мы используем одни и те же тесты у больных СД 1-го и 2-го типа, что позволяет получить сопоставимые данные. Это обеспечивает комплексный подход к изучению когнитивных процессов у больных СД. Следует отметить, что научные работы, охватывающие все вышеперечисленные аспекты в рамках одного исследования, немногочисленны и не столь убедительны.
МЕТОДЫ ИССЛЕДОВАНИЯ
Испытуемые
В исследовании приняли участие 29 здоровых испытуемых (от 22 до 54 лет), 42 пациента с СД 1-го типа (от 22 до 34 лет) и 43 пациента с СД 2-го типа (от 22 до 52 лет). Пациенты обоих типов СД были разделены на три группы по длительности заболевания. Первая группа включала пациентов с длительностью заболевания <6 лет (СД1Т-I и СД2Т-I), вторая группа – пациентов с длительностью заболевания от 6 до 10 лет (СД1Т-II и СД2Т-II) и третья группа – пациентов с длительностью заболевания >10 лет (СД1Т- III и СД2Т-III). В контрольные группы (КГ-I и КГ-II) вошли здоровые испытуемые, сопоставимые по возрасту с группами пациентов.
Все участники были правшами и имели нормальное или скорректированное до нормального зрение. Пациенты с СД1Т применяли инъекционную терапию инсулином, а пациенты с СД2Т получали пероральные гипогликемические препараты, то есть не принимали инсулин. Большинство пациентов поддерживали оптимальный уровень глюкозы в крови. Все пациенты, независимо от длительности заболевания, имели легкую степень тяжести заболевания, без выраженных осложнений (нейропатия, нефропатия, ретинопатия, атеросклеротические изменения и др.). Критериями исключения для всех испытуемых были наличие в анамнезе инфаркта, травмы головы и других серьезных неврологических и психических заболеваний, прием нейротропных препаратов, злоупотребление психоактивными веществами (например, алкоголем). Из исследования также исключались пациенты, которым в первые часы после пробуждения был необходим прием инсулина или гипогликемических препаратов. В табл. 1 приводятся некоторые демографические данные и клинические характеристики испытуемых.
Таблица 1.
Демографические данные и клинические характеристики групп
| Характеристика | СД1Т группы | ||||
| КГ-I (n = 15) |
СД1Т-I (n = 15) |
СД1Т-II (n = 13) |
СД1Т-III (n = 14) |
||
| Возраст, лет | 27.7 ± 3.7 | 25.7 ± 3.5 | 25.9 ± 3.6 | 27.6 ± 4.2 | |
| Пол (муж/жен) | 9/6 | 8/7 | 8/5 | 9/5 | |
| Высшее обр., % | 73.7 | 63.0 | 69.2 | 77.5 | |
| ИМТ, кг/м2 | 23.6 ± 0.5 | 22.9 ± 1.2 | 23.2 ± 2.0 | 22.8 ± 1.2 | |
| Длит. забол., лет | – | 4.5 ± 0.7 | 8.6 ± 1.7 | 13.2 ± 1.6 | |
| Ур. глюк. нат., мг/дл | 79.8 ± 13.7 | 217.3 ± 54.7 | 210.2 ± 53.2 | 194.2 ± 49.6 | |
| Доза инсулина, ЕД | – | 38.8 ± 4.4 | 39.4 ± 3.8 | 40.8 ± 1.9 | |
| Характеристика | СД2Т группы | ||||
| КГ-I (n = 15) |
СД2Т-I (n = 18) |
СД2Т-II (n = 12) |
КГ-II (n = 14) |
СД2Т-III (n = 13) |
|
| Возраст, лет | 27.7 ± 3.7 | 27.8 ± 3.5 | 29.3 ± 4.3 | 46.3 ± 4.7 | 48.3 ± 3.6 |
| Пол (муж/жен) | 9/6 | 11/7 | 6/6 | 6/8 | 7/6 |
| Высшее обр., % | 73.7 | 81.9 | 75.0 | 78.6 | 66.7 |
| ИМТ, кг/м2 | 23.6 ± 0.5 | 26.1 ± 1.2 | 25.8 ± 0.9 | 24.7 ± 2.1 | 27.2 ± 2.8 |
| Длит. забол., лет | – | 3.6 ± 1.3 | 7.8 ± 0.7 | – | 12.9 ± 1.8 |
| Ур. глюк. нат., мг/дл | 79.8 ± 13.7 | 131.4 ± 14.6 | 140.0 ± 15.8 | 87.4 ± 10.3 | 163.6 ± 24.4 |
Данные представлены как среднее ± стандартное отклонение. СД1Т: сахарный диабет 1 типа, СД2Т: сахарный диабет 2 типа, КГ: контрольная группа, СД1Т-I/СД2Т-I группы: длительность заболевания <6 лет, СД1Т-II/СД2Т-II группы: длительность заболевания от 6 до 10 лет, СД1Т-III/СД2Т-III группы: длительность заболевания >10 лет, Высшее обр.: высшее образование; ИМТ: индекс массы тела; Длит. забол.: длительность заболевания; Ур. глюк. нат.: уровень глюкозы в крови натощак.
Все процедуры, выполненные в данном исследовании с участием людей, соответствуют этическим стандартам Национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики. От каждого из пациентов было получено информированное добровольное согласие на участие в исследовании.
Краткая форма опросника оценки качества жизни – SF-36
Для оценки качества жизни испытуемых использовался адаптированный компьютеризированный тест SF-36, представляющий собой краткую форму опросника оценки состояния здоровья, состоящий из 36 вопросов, сгруппированных в 8 шкал: физическое функционирование, ролевое функционирование, обусловленное физическим состоянием, интенсивность боли, общее состояние здоровья, жизненная активность, социальное функционирование, ролевое функционирование, обусловленное эмоциональным состоянием и психическое здоровье. На основе этих восьми шкал, с использованием алгоритмов, рекомендованных разработчиками опросника, рассчитываются два суммарных показателя: физический компонент здоровья (ФКЗ) и психический компонент здоровья (ПКЗ) [28]. Стандартная форма опросника предлагает участникам ответить на вопросы в соответствии с тем, как они себя чувствовали в течение предыдущих четырех недель. Для измерения восьми шкал и двух суммарных компонентов здоровья используется шкала Лайкерта. Показатели каждой шкалы варьируют от 0 до 100 баллов. Чем выше балл, тем выше уровень качества жизни. В тесте SF-36 используются алгоритмы оценки на основе нормализации для всех восьми шкал (преобразование в Т-баллы со средним значением 50 ± 10 [SD]). Если балл по шкале ниже 50, состояние здоровья считается ниже среднего, и каждый балл составляет одну десятую стандартного отклонения. Выполнение теста занимает около 10–15 мин [29].
Психофизиологический тест
Для исследования когнитивных функций, в частности произвольного внимания (избирательное внимание), использовался психофизиологический компьютеризированный тест “Карусель часов”. Применяемый тест был разработан по аналогии с d2 тестом [30], с введением ряда модификаций. В тесте “Карусель часов” стимулами являлись циферблаты без чисел, имеющие только часовую стрелку, указывающую “время” – все, кроме 3, 6, 9 и 12 ч. Стимулы располагались по кругу в центре монитора. Размер монитора составлял 48.26 см (ширина x высота: 42.06 см × 23.66 см), диаметр каждого стимула – 2.2 см, а диметр круга – 19.3 см. Когда до завершения круга оставалось 10%, последовательность стимулов менялась автоматически. Стимулы были разделены на две группы – целевые (циферблат со стрелкой, указывающей “время” 5 и 10) и нецелевые (циферблат со стрелкой, указывающей “время” 1, 2, 4, 7, 8 и 11) (рис. 1).
Рис. 1.
а – скриншот рабочего окна психофизиологического теста “Карусель часов”. b – целевые и нецелевые стимулы. Target stimuli – целевые стимулы, non-target stimuli – нецелевые стимулы.
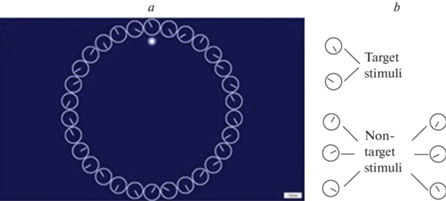
При выполнении теста испытуемые сидели на расстоянии 60–70 см от монитора. До начала теста испытуемым давалась подробная инструкция: для перехода от стимула к стимулу испытуемые должны были нажать на клавишу управления курсором (→), тем самым фиксируя время обработки каждого стимула, а при виде целевых стимулов – сразу же нажать на клавишу пробела, при этом пропуская нецелевые стимулы, без нажатия какой-либо клавиши. Для должного понимания теста было дано достаточное количество попыток. Тренировочная сессия завершалась после того, как испытуемые могли дифференцировать символы. Для дифференциации символов обычно было достаточно 1–2 попыток. Случайный алгоритм предъявления последовательности символов в тесте исключал привыкание у испытуемых. Фиксированная продолжительность теста составляла 10 мин. Все правильно отмеченные (выбор целевых стимулов) и правильно пропущенные символы (пропуск нецелевых стимулов) считались правильными ответами. Неправильно пропущенные (пропуск целевых стимулов) и неправильно отмеченные символы (выбор нецелевых стимулов) считались ошибками.
Нами оценивались количественные, качественные и временные показатели произвольного внимания. Количественные параметры: ОКС – общее количество символов (количество просмотренных символов за 10 мин), КПС/мин – количество просмотренных символов за минуту, КНПС – количество неправильно пропущенных символов, КНОС – количество неправильно отмеченных символов, ОКНО – общее количество неправильных ответов (КНПС + КНОС), ОКПО – общее количество правильных ответов (ОКС-ОКНО). В данной статье рассчитывался процент КНПС, КНОС, ОКНО, ОКПО от ОКС (КНПС%, КНОС%, ОКНО%, ОКПО% соответственно). Качественные параметры: ИК – индекс концентрации (КПОС-КНОС, где КПОС – это количество правильно отмеченных символов), ПВ/мин – продуктивность внимания за минуту (ОКС*(КПОС/(КПОС + КНПС)) [30, 31]. Также изучались временные параметры: НПС_во – время обработки неправильно пропущенных символов (мс), НОС_во – время обработки неправильно отмеченных символов (мс).
Процедура исследования
Исследование проводилось утром в одно и то же время в бесшумной комнате. До начала исследования измерялся уровень глюкозы в крови натощак с помощью глюкометра Contour Plus (в 9.00–9.30 ч). Процедура исследования начиналась с измерения пульса и артериального давления (АД) в положении сидя. Пульс измерялся пальпаторно на A.radialis за одну минуту. АД измерялось трижды с помощью автоматического монитора АД (Omron M6). Прибор также выдавал значение пульса. Рассчитывалось среднее значение трех измерений пульса и АД. Результаты измерения пульса в целом были сопоставимы. Параметры пульса и АД учитывались для оценки общего физиологического состояния испытуемых. Испытуемые с высокими значениями пульса и АД (выше возрастной нормы – ЧСС = 90 уд/мин, АД = 120/80 мм рт. ст. [32] и таргетных клинических значений – АД ≥ 140/90 мм рт. ст. [33, 34]) были исключены из исследования.
Далее испытуемые заполняли опросник SF-36 и выполняли Психофизиологический тест. Продолжительность исследования составляла ~45 мин. После завершения исследования пациенты принимали инсулин или гипогликемические препараты.
Анализ данных
Сравнительный анализ изучаемых показателей проводился: а) между контрольной группой и группой диабетиков, б) между группами одного типа диабета с разной длительностью заболевания, в) между группами двух типов диабета с одинаковой длительностью заболевания.
Группа СД2Т_III имела значимые возрастные различия по сравнению с остальными группами. Для этой группы была создана отдельная, соответствующая по возрасту контрольная группа. Сравнительный анализ изучаемых показателей для группы СД2Т_III проводился только с контрольной группой (КГ-II). Между всеми остальными группами достоверных возрастных различий не было.
Статистический анализ
Данные представлены как среднее ± стандартное отклонение. Проверка данных на нормальность проводили с помощью критерия Шапиро–Уилка, а однородность дисперсии определяли с помощью критерия Левене. При нормальном распределении данных и однородности дисперсии для сравнения групп использовали однофакторный дисперсионный анализ (ANOVA). В случае выявления значимого эффекта длительности заболевания для установления различий между средними значениями проводился апостериорный анализ с помощью критерия Даннетта (между контрольной группой и группой диабетиков) и критерия Бонферрони (между группами диабетиков). При ненормальном распределении данных оценивался H-критерий Краскела–Уоллиса, а для выявления достоверных различий между группами проводился апостериорный анализ с применением критерия Манна–Уитни.
Оценка достоверности различий между КГ-II и СД2Т_III, СД1Т-I и СД2Т-I, СД1Т-II и СД2Т-II группами проводилась с помощью непарного двустороннего t-критерия при нормальном распределении данных и U-критерия Манна–Уитни при ненормальном распределении данных.
Различия считались достоверными при уровне значимости p < 0.05. Статистический анализ проводился с использованием программного обеспечения SPSS (Версия 16.0 для Windows).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Оценка качества жизни (SF-36)
При анализе суммарных показателей теста SF-36 обнаружены межгрупповые различия (Таблица 2). Однофакторный дисперсионный анализ (ANOVA) и критерий Краскела–Уоллиса выявили достоверный эффект длительности заболевания для физического и психического компонентов здоровья (ФКЗ и ПКЗ) у пациентов с СД1Т (F3, 53 = 11.40, p < 0.001 для ФКЗ и χ2 = 17.63, p < 0.001 для ПКЗ). Апостериорный анализ (post-hoc test) показал, что эти параметры были ниже у СД1Т групп по сравнению с контрольной группой. ПКЗ был также значительно ниже у СД1Т-I группы, чем у СД1Т-II и СД1Т-III групп. Достоверных различий по показателю ФКЗ между СД1Т группами не обнаружено.
Таблица 2.
Показатели SF-36, пульса и артериального давления
| Показатель | СД1Т группы | ||||
|---|---|---|---|---|---|
| КГ-I (n = 15) |
СД1Т-I (n = 15) |
СД1Т-II (n = 13) |
СД1Т-III (n = 14) |
||
| ФКЗ, балл | 54.3 ± 3.7 | 45.6 ± 5.3*** | 44.1 ± 5.6*** | 46.6 ± 4.8*** | |
| ПКЗ, балл | 51.6 ± 7.0 | 37.9 ± 8.3*** | 44.2 ± 8.7*# | 44.4 ± 6.0*# | |
| ЧСС, уд./мин | 75.9 ± 4.2 | 73.9 ± 5.3 | 73.5 ± 5.2 | 73.6 ± 3.3 | |
| САД, мм рт. ст. | 116.1 ± 7.9 | 118.9 ± 6.0 | 119.7 ± 6.0 | 119.1 ± 4.1 | |
| ДАД, мм рт. ст. | 76.6 ± 3.9 | 76.7 ± 5.1 | 79.2 ± 5.4 | 77.9 ± 3.8 | |
| Показатель | СД2Т группы | ||||
| КГ-I (n = 15) |
СД2Т-I (n = 18) |
СД2Т2-II (n = 12) |
КГ-II (n = 14) |
СД2Т-III (n = 13) |
|
| ФКЗ, балл | 54.3 ± 3.7 | 53.5 ± 5.9 | 49.0 ± 5.0*# | 53.3 ± 3.1 | 45.4 ± 6.9* |
| ПКЗ, балл | 51.6 ± 7.0 | 50.8 ± 6.4 | 42.8 ± 6.0**# | 51.6 ± 6.0 | 38.0 ± 7.0** |
| ЧСС, уд./мин | 75.9 ± 4.2 | 78.9 ± 6.9 | 80.5 ± 5.8 | 77.9 ± 8.0 | 76.1 ± 7.7 |
| САД, мм рт. ст. | 116.1 ± 7.9 | 119.8 ± 4.4 | 124.4 ± 6.5* | 113.7 ± 11.4 | 126.1 ± 7.4* |
| ДАД, мм рт. ст. | 76.6 ± 3.9 | 78.8 ± 5.3 | 81.5 ± 5.3* | 77.4 ± 8.4 | 83.1 ± 5.8* |
Данные представлены как среднее ± стандартное отклонение. СД1Т: сахарный диабет 1 типа, СД2Т: сахарный диабет 2 типа, КГ: контрольная группа, СД1Т-I/СД2Т-I группы: длительность заболевания <6 лет, СД1Т-II/СД2Т-II группы: длительность заболевания от 6 до 10 лет, СД1Т-III/СД2Т-III группы: длительность заболевания >10 лет, ФКЗ: физический компонент здоровья, ПКЗ: психический компонент здоровья, ЧСС: частота сердечных сокращений, САД: систолическое артериальное давление, ДАД: диастолическое артериальное давление. * Достоверное различие по сравнению с Контрольной группой; # Достоверное различие по сравнению с СД1Т-I или СД2Т-I группой; *p < 0.05, **p < 0.01, ***p < 0.001.
У пациентов с СД2Т наблюдался значительный эффект длительности заболевания для показателей ФКЗ и МКЗ (χ2 = 5.23, p < 0.05 для ФКЗ и F2, 42 = 5.33, p < 0.01 для МКЗ), указывающий на более низкие значения параметров у СД2Т-II группы по сравнению с контрольной и СД2Т-I группами. Достоверных различий по этим параметрам между контрольной и СД2Т-I группами не обнаружено. T-тест показал, что ФКЗ и МКЗ были ниже у СД2Т-III по сравнению с контрольной группой (КГ-II).
Сравнительный анализ параметров выявил достоверно низкие значения ФКЗ и МКЗ у СД1Т-I группы по сравнению с СД2Т-I группой (p < 0.001 для обоих параметров). Между СД1Т-II и СД2Т-II группами достоверных различий по показателям ФКЗ и МКЗ не обнаружено.
Оценка пульса и артериального давления
Результаты статистического анализа пульса и АД представлены в таблице 2. Данные участников с высокими значениями пульса и АД не включены в таблицу. У пациентов с СД1Т межгрупповых различий по показателям ЧСС, САД и ДАД не обнаружено (F3, 53 = 0.86, p > 0.05 для ЧСС, F3, 53 = 0.92, p > 0.05 для САД и F3, 53 = 0.86, p > 0.05 для ДАД).
ANOVA анализ выявил значительный эффект длительности заболевания для САД и ДАД у пациентов с СД2Т (F2, 42 = 2.89, p < 0.05 для САД и F2, 42 = 3.23, p < 0.05 для ДАД). Однако post-hoc анализ показал достоверные различия по этим параметрам только между контрольной и СД2Т-II группами с более высокими значениями у СД2Т-II группы. Из таблицы 2 видно, что СД2Т-III группа также имела более высокие значения САД и ДАД, чем контрольная группа (КГ-II). По показателю ЧСС межгрупповых различий не выявлено.
Из результатов статистического анализ данных видно, что СД2Т-I и СД2Т-II группы имели более высокие значения ЧСС по сравнению с СД1Т-I и СД1Т-II группами (p < 0.05 для обеих групп). СД2Т-II группа также имела более высокое значение САД, чем СД1Т-II группа (p < 0.05). Других различий по показателям САД и ДАД в зависимости от типа диабета не выявлено.
Психофизиологическое исследование
Результаты психофизиологического исследования представлены в табл. 3.
Таблица 3.
Показатели произвольного внимания
| Показатель | СД1Т группы | ||||
|---|---|---|---|---|---|
| КГ-I (n = 15) |
СД1Т-I (n = 15) |
СД1Т-II (n = 13) |
СД1Т-III (n = 14) |
||
| ОКС | 943.0 ± 59.5 | 663.0 ± 75.3*** | 737.0 ± 77.2*** | 773.6 ± 70.5***### | |
| КПС/мин | 94.3 ± 6.0 | 66.3 ± 7.5*** | 73.7 ± 7.7*** | 77.4 ± 7.0***### | |
| ОКПО, % | 92.3 ± 1.6 | 87.5 ± 1.7*** | 88.4 ± 2.1*** | 88.2 ± 2.3*** | |
| ОКНО, % | 7.7 ± 1.6 | 12.5 ± 1.7*** | 11.6 ± 2.1*** | 11.8 ± 2.3*** | |
| КНОС, % | 1.6 ± 0.4 | 1.7 ± 0.4 | 2.9 ± 0.6***### | 1.4 ± 0.4∆∆∆ | |
| КНПС, % | 6.1 ± 1.4 | 10.9 ± 1.6*** | 8.7 ± 2.3*# | 10.4 ± 2.5***∆ | |
| НОС_во, мс | 737.7 ± 95.0 | 1088.5 ± 98.3*** | 975.1 ± 89.8***# | 969.1 ± 104.9***# | |
| НПС_во, мс | 700.9 ± 96.7 | 994.6 ± 102.2*** | 1075.8 ± 95.1*** | 891.8 ± 100.1***#∆∆∆ | |
| ИК, у. е. | 304.5 ± 21.5 | 182.4 ± 25.6*** | 208.5 ± 19.4***# | 218.4 ± 29.4***## | |
| ПВ/мин, у. е. | 79.9 ± 5.4 | 48.3 ± 6.4*** | 55.3 ± 4.7***## | 57.4 ± 7.8***## | |
| Показатель | СД2Т группы | ||||
| КГ-I (n = 15) |
СД2Т-I (n = 18) |
СД2Т-II (n = 12) |
КГ-II (n = 14) |
СД2Т-III (n = 13) |
|
| ОКС | 943.0 ± 59.5 | 822.5 ± 80.8*** | 827.5 ± 52.4*** | 828.5 ± 77.4 | 738.3 ± 72.6** |
| КПС/мин | 94.3 ± 6.0 | 82.3 ± 8.1*** | 82.8 ± 5.2*** | 82.9 ± 7.7 | 73.8 ± 7.3** |
| ОКПО, % | 92.3 ± 1.6 | 91.0 ± 1.4* | 89.0 ± 1.9***# | 94.3 ± 0.9 | 91.2 ± 0.9*** |
| ОКНО, % | 7.7 ± 1.6 | 9.0 ± 1.4* | 11.0 ± 1.9***# | 5.7 ± 0.9 | 8.8 ± 0.9*** |
| КНОС, % | 1.6 ± 0.4 | 1.8 ± 0.4 | 1.4 ± 0.5 | 1.4 ± 0.4 | 1.3 ± 0.2 |
| КНПС, % | 6.1 ± 1.4 | 7.2 ± 1.3* | 9.6 ± 1.9***## | 4.3 ± 0.7 | 7.5 ± 0.9*** |
| НОС_во, мс | 737.7 ± 95.0 | 857.5 ± 90.9*** | 953.9 ± 87.2***# | 826.2 ± 88.7 | 990.4 ± 98.1*** |
| НПС_во, мс | 700.9 ± 96.7 | 917.2 ± 86.2*** | 957.4 ± 60.0*** | 718.5 ± 94.8 | 868.7 ± 97.2** |
| ИК, у. е. | 304.5 ± 21.5 | 255.7 ± 32.0*** | 239.9 ± 21.1*** | 284.0 ± 26.6 | 230.7 ± 26.0*** |
| ПВ/мин, у. е. | 79.9 ± 5.4 | 67.6 ± 8.2*** | 63.0 ± 5.6*** | 73.9 ± 7.0 | 60.1 ± 6.8*** |
Данные представлены как среднее ± стандартное отклонение. СД1Т: сахарный диабет 1 типа, СД2Т: сахарный диабет 2 типа, КГ: контрольная группа, СД1Т-I/СД2Т-I группы: длительность заболевания <6 лет, СД1Т-II/СД2Т-II группы: длительность заболевания от 6 до 10 лет, СД1Т-III/СД2Т-III группы: длительность заболевания >10 лет, ОКС: общее количество символов, КПС/мин: количество просмотренных символов за минуту, ОКПО: общее количество правильных ответов, ОКНО: общее количество неправильных ответов, КНОС: количество неправильно отмеченных символов, КНПС: количество неправильно пропущенных символов, НОС_во: время обработки неправильно отмеченных символов (мсек), НПС_во: время обработки неправильно пропущенных символов, ИК: индекс концентрации, ПВ/мин: продуктивность внимания за минуту. * Достоверное различие по сравнению с Контрольной группой; # Достоверное различие по сравнению с СД1Т-I или СД2Т-I группой; Δ Достоверное различие по сравнению с СД1Т- II; *p < 0.05, **p < 0.01, ***p < 0.001.
У пациентов с СД1Т был обнаружен значительный эффект длительности заболевания для общего количества символов и количества просмотренных символов за минуту (ОКС и КПС/мин) (F3, 53 = 41.95, p < 0.001 для обоих показателей). Результаты post-hoc анализа показали, что у всех СД1Т групп ОКС и КПС/мин были достоверно меньше, чем у контрольной группы. СД1Т-III группа отличалась большими значениями ОКС и КПС/мин по сравнению с СД1Т-I группой. Других значимых различий по этим параметрам между СД1Т группами не обнаружено. Значительный эффект длительности заболевания выявлен также для общего количества правильных и неправильных ответов (ОКПО%, ОКНО%) и количества неправильно отмеченных и неправильно пропущенных символов (КНОС%, КНПС%) (χ2 = 27.86, p < 0.001 для ОКПО% и ОКНО%, χ2 = 22.78, p < 0.001 для КНОС%, χ2 = 27.45, p < 0.001 для КНПС%). У СД1Т групп, по сравнению с контрольной группой, ОКПО% было достоверно ниже, а ОКНО% – выше. Однако между группами СД1Т по показателям ОКПО% и ОКНО% достоверных отличий не отмечалось. Дальнейший анализ ошибок показал, что СД1Т-II группа имела больше КНОС% по сравнению с контрольной и остальными СД1Т группами. Однако КНПС% было достоверно ниже у СД1Т-II группы, чем у СД1Т-I и СД1Т-III групп. Все СД1Т группы имели больше КНПС% по сравнению с контрольной группой. Других межгрупповых различий не наблюдалось.
При исследовании временных параметров был обнаружен значительный эффект длительности заболевания (F3, 53 = 31.90, p < 0.001 для НОС_во и F3, 53 = 35.41, p < 0.001 для НПС_во). Как показано в табл. 3, СД1Т группы потратили больше времени на обработку символов, чем контрольная группа. Статистический анализ выявил, что СД1Т-I группе понадобилось значительно больше времени на обработку НОС, чем СД1Т-II и СД1Т-III группам. СД1Т-III группа потратила больше времени на обработку НПС по сравнению с СД1Т-I и СД1Т-II группами. Других достоверных различий не отмечалось.
Значительный эффект длительности заболевания был обнаружен и для показателей индекса концентрации (ИК) и продуктивности внимания в мин (ПВ/мин) (F3, 53 = 68.17, p < 0.001 для ИК и F3, 53 = 67.84, p < 0.001 для ПВ/мин), указывающий на более низкие ИК и ПВ/мин у СД1Т групп по сравнению с контрольной группой. Post-hoc анализ также показал, что эти параметры были ниже у СД1Т-I группы, чем у СД1Т-II и СД1Т-III групп. Других межгрупповых различий по показателям ИК и ПВ/мин не обнаружено.
ANOVA анализ выявил значительный эффект длительности заболевания для общего количества символов и количества просмотренных символов за минуту (ОКС и КПС/мин) у пациентов с СД2Т (F2, 42 = 14.22, p < 0.001 для обоих показателей). Эти показатели были достоверно ниже у СД2Т групп по сравнению с контрольной группой. Однако между СД2Т группами различий по показателям ОКС и КПС/мин не отмечалось. Значительный эффект длительности заболевания был обнаружен также для общего количества правильных и неправильных ответов (ОКПО%, ОКНО%) и количества неправильно пропущенных символов (КНПС%) (F2, 42 = 11.71, p < 0.001 для ОКПО% и ОКНО%, χ2 = 14.55, p < 0.001 для КНПС%). Статистический анализ показал, что СД2Т группы имели достоверно низкие значения ОКПО% и высокие значения ОКНО% и КНПС%, чем контрольная группа. Нами также обнаружено достоверно низкое значение ОКПО% и высокие значения ОКНО% и КНПС% у СД2Т-II группы по сравнению с СД2Т-I группой. По количеству неправильно отмеченных символов (КНОС%) межгрупповых различий не выявлено (χ2 = 3.27, p > 0.05).
Сравнение временных параметров выявило значительный эффект продолжительности заболевания (F2, 42 = 15.68, p < 0.001 для НОС_во и F2, 42 = 33.24, p < 0.001 для НПС_во). Апостериорный анализ показал, что СД2Т группы потратили больше времени на обработку символов, чем контрольная группа. Различия между двумя группами диабетиков наблюдались только для времени обработки НОС с более высоким значением у СД2Т-II группы.
Значительный эффект длительности заболевания был обнаружен и для показателей индекса концентрации (ИК) и продуктивности внимания в минуту (ПВ/мин) (F2, 42 = 20.26, p < 0.001 для ИК и F2, 42 = 20.55, p < 0.001 для ПВ/мин), указывающий на более низкие ИК и ПВ/мин у СД2Т групп по сравнению с контрольной группой. Между СД2Т группами различий по этим параметрам не отмечалось.
Статистический анализ показал, что различия между контрольной группой (КГ-II) и СД2Т-III группой по всем параметрам произвольного внимания имели аналогичный характер, что и различия между контрольной группой (КГ-I) и СД2Т-I/СД2Т-II группами (табл. 3).
Сравнительный анализ СД1И и СД2Т групп выявил достоверные различия по всем показателям, кроме КНОС % (р > 0.05). Так, СД2Т-I группа имела более высокие значения ОКС, КПС/мин, ОКПО, ИК, ПВ/мин и более низкие значения ОКНО% и КНПС% по сравнению с СД1Т-I группой (p < 0.001 для всех параметров). Достоверные различия между этими группами выявлены и по временным параметрам с более низкими значениями у СД2Т-I группы (p < 0.001 для НОС_во и p < 0.05 для НПС_во).
При сравнении СД1Т-II и СД2Т-II групп было установлено, что СД2Т-II группа имела более высокие значения ОКС, КПС/мин, ИК, ПВ/мин и низкие значения КНОС%, НПС_во, чем СД1Т-II группа (p < 0.01 для ОКС, КПС/мин, ИК, НПС_во, p < 0.001 для КНОС% и p < 0.05 для ПВ/мин). Другие межгрупповые сравнения показателей не достигли значимости.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Статья посвящена изучению процесса произвольного внимания и оценке качества жизни (КЖ) у пациентов с СД 1 и 2 типа. Анализ самооценки КЖ показал, что пациенты с СД 1-го и 2-го типа имели сравнительно низкий физический и психический статус по сравнению со здоровыми испытуемыми. При СД1Т эти различия начали уже проявляться у пациентов с длительностью заболевания <6 лет, а при СД2Т позже, то есть у пациентов с длительностью заболевания от 6 до 10 лет. Снижение КЖ у пациентов с СД2Т также показано в ряде исследований [35, 36]. Согласно некоторым исследованиям, факторы, влияющие на КЖ пациентов с СД2Т, включают ограничение физической активности и выбора продуктов питания, изменение пищевых привычек, частота контроля уровня глюкозы, артериальная гипертензия и депрессия [37, 38]. Плохое КЖ было продемонстрировано и у пациентов с СД1Т, но эти исследования проводились в основном среди пациентов до 18 лет [39, 40]. В нашем исследовании изменения КЖ у пациентов с СД1Т выявлены в возрастной группе 22–34 лет.
Результаты исследования также указывают на изменения КЖ в зависимости от длительности заболевания, которые по-разному проявлялись у пациентов с СД 1-го и 2-го типа. Пациенты с СД1Т с длительностью заболевания от 6 до 10 и >10 лет имели более высокий уровень психического здоровья по сравнению с пациентами с СД1Т с длительностью заболевания <6 лет. В то же время межгрупповых различий физического состояния пациентов с СД1Т в зависимости от длительности заболевания не обнаружено. У пациентов с СД2Т выявлено снижение физического и психического здоровья с увеличением продолжительности заболевания. Связь между длительностью диабета и КЖ до конца не выяснена. В некоторых исследованиях приводятся данные о том, что более длительная продолжительность заболевания была связана с более низким КЖ у пациентов с СД2Т. Это может быть связано с тем, что с увеличением продолжительности заболевания у больных отмечается тенденция к ухудшению гликемического контроля, что может повлиять на КЖ [38, 41]. Однако в других исследованиях показано отсутствие корреляции между длительностью диабета и КЖ у пациентов с СД 1-го и 2-го типа [42, 43].
Полученные в нашем исследовании результаты самооценки КЖ показывают, что у пациентов с СД1Т с длительностью заболевания <6 лет КЖ было хуже, чем у пациентов с СД2Т с той же длительностью заболевания. Однако уровень физического и психического здоровья у пациентов с СД 1-го и 2-го типа с длительностью заболевания от 6 до10 лет не отличался.
Результаты нашего исследования указывают на отсутствие достоверных различий в показателях ЧСС и АД между здоровыми испытуемыми и пациентами с СД1Т, а также между СД1Т группами в зависимости от длительности заболевания. Однако у пациентов с СД2Т с длительностью заболевания от 6 до 10 и >10 лет значение АД было выше, чем у здоровых лиц. Между тем межгрупповых различий по показателям ЧСС и АД у них не выявлено. У пациентов с СД2Т выявлена повышенная ЧСС по сравнению с таковой у пациентов с СД1Т при той же длительности заболевания (длительность заболевания < 6 и 6–10 лет). У пациентов с СД 1-го и 2‑го типа при одинаковой длительности заболевания значения АД не различались.
Наше исследование выявило существенные изменения процесса произвольного внимания у пациентов с СД 1-го и 2-го типа. Так, пациенты с СД обоих типов отличались меньшим объемом обрабатываемой информации и более низкой скоростью ее обработки по сравнению со здоровыми испытуемыми. Снижение ОКПО и увеличение ОКНО за счет увеличения КНПС свидетельствовало о снижении общей эффективности и точности выполнения у пациентов с СД. В то же время пациентам с СД требовалось больше времени для идентификации и дифференциации символов. Они также имели более низкий уровень концентрации внимания и его продуктивности. Таким образом, сравнительный анализ показал, что пациенты с СД 1-го и 2-го типа уступали здоровым испытуемым по всем характеристикам внимания независимо от длительности заболевания. В ряде работ показано снижение когнитивных процессов, в частности внимания, исполнительных функций, концентрации и обработки информации у пациентов с СД 1-го и 2-го типа [25, 44, 45]. Предполагается, что эти когнитивные изменения, по всей вероятности, связаны с гипергликемией, эпизодами гипогликемии, развитием инсулинорезистентности, микрососудистыми заболеваниями [6, 7, 46]. Мы разделяем точку зрения относительно факторов риска когнитивных нарушений у пациентов с СД.
Среди предполагаемых механизмов, лежащих в основе нарушений когнитивных функций, вызванных гипергликемией, можно выделить резистентность ЦНС к инсулину и амилоидогенез. Результаты имеющихся исследований показали, что инсулинорезистентность (ИР) может влиять на нейропластичность гиппокампа, метаболизм белка-предшественника амилоида (АРР) и тау-белка. Известно, что нейровоспаление, окислительный стресс и митохондриальная дисфункция усиливают резистентность ЦНС к инсулину. Это сопровождается накоплением бета-амилоида. Длительное воздействие гипергликемии и гиперинсулинемии, а также высокие уровни бета-амилоида в головном мозге могут привести к повреждению структуры и ухудшению функции нейронов, нарушению их целостности, вызывая снижение когнитивных функций у пациентов с СД [47, 48]. Считается, что гипергликемия также приводит к микрососудистым повреждениям головного мозга, что может нарушить когнитивные функции. Одним из механизмов, посредством которого гипергликемия повреждает ткани микрососудов, является увеличение количества активных форм кислорода, что приводит к окислительному стрессу. Гипергликемическая среда способствует образованию конечных продуктов гликирования (AGE) – механизм, посредством которого гипергликемия содействует развитию атеросклероза [49]. В снижении когнитивных функций при СД свою определенную роль играет и гипогликемия. В качестве потенциального механизма повреждения нейронов, вызванного гипогликемией, был предложен механизм эксайтотоксического действия повышенного уровня нейротрансмиттеров, в частности глутамата, приводящий к чрезмерной стимуляции рецепторов [13].
Эндотелиальная дисфункция сосудов, наблюдаемая при диабете, связана с накоплением в них токсичных липидов и агрегированных белков. Белковые отложения на стенках кровеносных сосудов повреждают эндотелиальные клетки и нарушают выработку сосудорасширяющих веществ, снижая мозговой кровоток, что приводит к нейроваскулярному разобщению и гипоксическому повреждению нейронов. Результаты исследований подтверждают, что снижение мозгового кровотока препятствует способности мозга понимать, обрабатывать, интегрировать информацию [27, 46]. Сосудистая эндотелиальная дисфункция активирует медиаторы воспаления, которые могут нарушать гематоэнцефалический барьер (ГЭБ). Нарушение ГЭБ подвергает паренхиму мозга воздействию потенциально нейротоксичных белков крови, тромбина, фибрина, плазмина и гемоглобина, а также железа из лизированных эритроцитов. Снижение негерметичности ГЭБ вызывает аномальную активность нейронов, приводящую к снижению когнитивной функции [46].
Нами также выявлены различия характеристик внимания в зависимости от длительности заболевания. Сравнительный анализ показателей внимания у пациентов с СД1Т выявил тенденцию увеличения объема обрабатываемой информации и скорости ее обработки с увеличением продолжительности заболевания. Несмотря на то, что межгрупповых различий в общем количестве правильных и неправильных ответов не было, тем не менее, были обнаружены различия в количестве каждого типа ошибок. Межгрупповые различия в количестве каждого типа ошибок рассматривались, сопоставляя со временем их обработки. СД1Т-I группа, имеющая меньшее количество НОС и большее количество НПС, чем СД1Т-II группа, тратила соответственно больше или столько же времени на идентификацию и дифференциацию каждого символа. Несмотря на то, что СД1Т-I группа не отличалась от СД1Т-III группы по количеству ошибок обоих типов, тем не менее, СД1Т-I группе требовалось больше времени для идентификации и дифференциации символов. При сравнении СД1Т-II и СД1Т-III групп видно, что СД1Т-III группа имела меньшее количество НОС и большее количество НПС, при этом затрачивая, соответственно, столько же или меньше времени на их обработку. Итак, сопоставляя количество ошибок обоих типов и время их обработки, можно сказать, что СД1Т-III группа дифференцировала символы легче, чем СД1Т-I и СД1Т-II группы. СД1Т-I группа отличалась от остальных групп наиболее низкой способностью дифференцировать символы. Анализ качественных показателей выявил самый низкий уровень концентрации внимания и его продуктивности у СД1Т-I группы.
Имеющиеся данные относительно влияния продолжительности диабета на когнитивные функции у пациентов с СД1Т противоречивы. Результаты некоторых исследований показали негативное влияние продолжительности заболевания на такие когнитивные функции, как психомоторная скорость, отсроченное припоминание, зрительно-моторная интеграция, в то время как в других исследованиях не отмечалось влияние продолжительности заболевания на отсроченное припоминание, словарный запас, психомоторную скорость, обучение и память [21, 50]. Согласно данным другого исследования, снижение когнитивных функций у взрослых с СД1Т в целом остается достаточно стабильным по мере прогрессирования заболевания [46].
Хорошо известно, что инсулин оказывает нейромодулирующее действие на мозг. Он стимулирует мембраны синаптических ГАМК-А рецепторов и способствует увеличению ГАМК-А-индуцированных тонических токов в пирамидных нейронах гиппокампа и префронтальной коры, модифицируя активность нейронных цепей в этих отделах мозга. Этим можно объяснить влияние изменений в передаче сигналов инсулина на изменения когнитивных процессов [51]. Инсулин оказывает стимулирующее действие на рост нейритов и играет роль в пролиферации, дифференцировке нейронов, т.е. имеет нейротрофическое действие. Среди нейропротекторных эффектов инсулина можно выделить защитные эффекты против пагубного воздействия окислительного стресса на ЦНС, при котором захват ГАМК и глутамата снижается, и эти нейромедиаторы накапливаются в экстрасинаптосомальном пространстве [52, 53]. Показано, что у пациентов с СД при изменении содержания Aβ и тау-белка в спинномозговой жидкости снижается уровень когнитивных функций, в то время как применение инсулина и агентов, которые стимулируют передачу его сигналов, может уменьшить невропатологию и улучшить когнитивные функции при диабете [54].
Таким образом, инсулин можно использовать для предотвращения патологических эффектов, вызванных развитием инсулинорезистентности и дефицитом инсулина в ЦНС [50]. Многие исследования указывают на улучшающее действие интраназального инсулина на когнитивные процессы у здоровых людей и лиц с нарушением когнитивных функций [55–57]. Нейровизуализационные исследования показали, что интраназальный инсулин изменяет активацию когнитивных областей мозга и связь между областью гиппокампа и сетью пассивного режима работы мозга (DMN) [53]. Если данные о положительном эффекте однократного введения интраназального инсулина противоречивы, то данные относительно эффекта длительного применения интраназального инсулина более убедительны. При длительном интраназальном применении инсулина наблюдалось его положительное влияние на когнитивные процессы (4 × 40 ЕД/сут в течение 8 нед., 40 ЕД/сут в течение 3 нед., 20 ЕД/сут в течение 3 нед.) [52, 55, 58]. Мы полагаем, что стабильность и некоторое улучшение характеристик внимания у пациентов с СД1Т в нашем исследовании также могут быть обусловлены длительным введением инсулина (~40 ЕД/сут).
У пациентов с СД2Т сравнительный анализ параметров внимания проводился только между 1-ой и 2-ой группами, так как возраст пациентов 3-ей группы достоверно отличался от возраста пациентов остальных двух групп. У пациентов с СД2Т в зависимости от длительности заболевания изменений объема обрабатываемой информации и скорости ее обработки не выявлено. Однако в СД2Т-II группе наблюдалось снижение общей эффективности и точности выполнения. Исследование типов ошибок и времени их обработки показало, что СД2Т-II группа не отличалась от СД2Т-I группы по количеству НОС и имела большее количество НПС. В то же время СД2Т-II группе требовалось соответственно больше или столько же времени на их обработку. Итак, у пациентов с СД2Т с увеличением длительности заболевания отмечалось снижение способности дифференцировать символы. У них также выявлена тенденция к снижению показателей концентрации внимания и его продуктивности в зависимости от длительности заболевания.
В ряде работ продемонстрировано отрицательное влияние продолжительности заболевания на некоторые когнитивные функции, включая внимание, исполнительные функции, обработку информации, память, психомоторную эффективность, беглость речи и обучение у пациентов с СД2Т [26, 59]. Показано, что риск когнитивных нарушений значительно повышен у пациентов с СД2Т с длительностью заболевания более 15 лет. По мере увеличения продолжительности заболевания, по всей вероятности, имеет место усиление повреждающего действия на нейроны макро- и микрососудистых дисфункций, окислительного стресса и инсулинорезистентности [27]. В нашем исследовании не столь выраженные различия в характеристиках внимания между СД2Т-I и СД2Т-II группами, скорее всего, связаны с меньшей (менее 10 лет) длительностью заболевания.
Известно, что когнитивные функции тесно связаны с психическим здоровьем [60]. Не случайно, что у пациентов с СД 1-го и 2-го типа наблюдались те же изменения психического компонента здоровья, что и характеристик внимания в зависимости от длительности заболевания.
Анализ различий характеристик внимания у пациентов с СД 1-го и 2-го типа при длительности заболевания <6 лет показал, что у пациентов с СД1Т значения показателей внимания были ниже, чем у пациентов с СД2Т. Несмотря на то, что пациенты с СД 1-го и 2-го типа имели одинаковое количество НОС, пациентам с СД1Т требовалось значительно больше времени на их обработку. В то же время пациенты с СД1Т, имеющие значительно большее количество НПС, тратили больше времени на их обработку.
При сравнении характеристик произвольного внимания у пациентов с СД 1-го и 2-го типа с длительностью заболевания от 6 до10 лет, межгрупповые различия наблюдались в следующих характеристиках. Так, СД1Т-II группа имела меньший объем обрабатываемой информации и низкую скорость ее обработки, низкую концентрацию и продуктивность внимания по сравнению с СД2Т-II группой. Вместе с тем СД1Т-II группа отличалась большим количеством НОС по сравнению с СД2-II группой, при этом затрачивая столько же времени на их обработку. Хотя количество НПС у этих групп не отличалось, однако СД1Т-II группе понадобилось значительно больше времени для идентификации и дифференциации символов. Сравнение количества ошибок обоих типов и времени их обработки свидетельствует о сравнительно низкой способности к дифференциации символов у пациентов с СД1Т.
Мы предполагаем, что выявленные различия в характеристиках произвольного внимания и качества жизни между пациентами с СД 1-го и 2-го типа, скорее всего, обусловлены характерным для каждого типа течением заболевания. У пациентов с СД1Т в первые годы (< 6 лет) скорость прогрессирования заболевания высока и снижается в последующие годы (6–10 лет). У пациентов с СД2Т заболевание прогрессирует медленно и в первые годы (<6 лет) скорость прогрессирования отстает от скорости развития заболевания у пациентов с СД1Т. В последующие годы (6–10 лет) у пациентов с СД2Т заболевание продолжает прогрессировать, что приводит к уменьшению различий между группами двух типов СД.
Данное исследование имеет некоторые ограничения. Размер выборки был относительно небольшим, но, несмотря на это, были получены статистически значимые различия в параметрах. Уровень HbA1c, который является более информативным тестом, чем уровень сахара в крови натощак для оценки состояния гликемического контроля у пациентов с диабетом, не определялся, поэтому связь между уровнем сахара в крови и когнитивной дисфункцией не обсуждалась. В этом исследовании учитывались факторы возраста и продолжительности заболевания, хотя было несколько других сопутствующих факторов, которые не были скорректированы. Другие факторы, такие как режим терапевтического лечения, пол, ИМТ, привычки в еде и курении, социально-экономические факторы, могут играть важную роль и должны учитываться в дальнейших исследованиях.
ЗАКЛЮЧЕНИЕ
Развитие когнитивных нарушений у пациентов с СД 1-го и 2-го типа имеет много общего, но есть также существенные различия. В нашем исследовании выявлено снижение уровня произвольного внимания и качества жизни у пациентов с СД 1-го и 2-го типа по сравнению со здоровыми испытуемыми. Нами также обнаружены изменения уровня произвольного внимания у пациентов с СД в зависимости от длительности заболевания. У пациентов с СД2Т с увеличением продолжительности заболевания наблюдалось снижение показателей произвольного внимания. Однако у пациентов с СД1Т с увеличением длительности заболевания выявлена стабильность и некоторое улучшение характеристик произвольного внимания. Показан более низкий уровень внимания у пациентов с СД1Т по сравнению с пациентами с СД2Т. В то же время эта разница была более выражена у пациентов с длительностью заболевания < 6 лет. Изменения КЖ (психического статуса) пациентов с СД в зависимости от типа и длительности заболевания имели ту же тенденцию, что и изменения характеристик произвольного внимания.
Список литературы
International Diabetes Federation (2021) IDF Diabetes Atlas, 10th edn. Brussels, Belgium. Available at: https://www.diabetesatlas.org
American Diabetes Association (2014) Diagnosis and classification of diabetes mellitus. Diabetes Care. 37 Suppl 1: S81–90. https://doi.org/10.2337/dc14-S081
Leung WK, Gao L, Siu PM, Lai CW (2016) Diabetic nephropathy and endothelial dysfunction: Current and future therapies, and emerging of vascular imaging for preclinical renal-kinetic study. Life Sci 166: 121–130. https://doi.org/10.1016/j.lfs.2016.10.015
Cole JB, Florez JC (2020) Genetics of diabetes mellitus and diabetes complications. Nat Rev Nephrol 16(7): 377–390. https://doi.org/10.1038/s41581-020-0278-5
Kawamura T, Umemura T, Hotta N (2012) Cognitive impairment in diabetic patients: Can diabetic control prevent cognitive decline? J Diabetes Investig 3(5): 413–423. https://doi.org/10.1111/j.2040-1124.2012.00234.x
Hamed SA (2017) Brain injury with diabetes mellitus: evidence, mechanisms and treatment implications. Expert Rev Clin Pharmacol 10(4): 409–428. https://doi.org/10.1080/17512433.2017.1293521
Zhou J, Zhang Z, Zhou H, Qian G (2020) Diabetic Cognitive Dysfunction: From Bench to Clinic. Curr Med Chem 27(19): 3151–3167. https://doi.org/10.2174/1871530319666190206225635
Moran C, Münch G, Forbes JM, Beare R, Blizzard L, Venn AJ, Phan TG, Chen J, Srikanth V (2015) Type 2 diabetes, skin autofluorescence, and brain atrophy. Diabetes 64(1): 279–283. https://doi.org/10.2337/db14-0506
Saedi E, Gheini MR, Faiz F, Arami MA. (2016) Diabetes mellitus and cognitive impairments. World J Diabetes (17): 412–422. https://doi.org/10.4239/wjd.v7.i17.412
Shalimova A, Graff B, Gąsecki D, Wolf J, Sabisz A, Szurowska E, Jodzio K, Narkiewicz K (2019) Cognitive Dysfunction in Type 1 Diabetes Mellitus. J Clin Endocrinol Metab 104(6): 2239–2249. https://doi.org/10.1210/jc.2018-01315
Tamura Y, Araki A (2015) Diabetes mellitus and white matter hyperintensity. Geriatr Gerontol Int 15 Suppl 1: 34–42. https://doi.org/10.1111/ggi.12666
Musen G, Jacobson AM, Bolo NR, Simonson DC, Shenton ME, McCartney RL, Flores VL, Hoogenboom WS (2012) Resting-state brain functional connectivity is altered in type 2 diabetes. Diabetes 61(9): 2375–2379. https://doi.org/10.2337/db11-1669
Lee JH, Choi Y, Jun C, Hong YS, Cho HB, Kim JE, Lyoo IK (2014) Neurocognitive changes and their neural correlates in patients with type 2 diabetes mellitus. Endocrinol Metab (Seoul) 29(2): 112–121. https://doi.org/10.3803/EnM.2014.29.2.112
Zhang H, Hao Y, Manor B, Novak P, Milberg W, Zhang J, Fang J, Novak V (2015) Intranasal insulin enhanced resting-state functional connectivity of hippocampal regions in type 2 diabetes. Diabetes 64(3): 1025–1034. https://doi.org/10.2337/db14-1000
Yang SQ, Xu ZP, Xiong Y, Zhan YF, Guo LY, Zhang S, Jiang RF, Yao YH, Qin YY, Wang JZ, Liu Y, Zhu WZ (2016) Altered Intranetwork and Internetwork Functional Connectivity in Type 2 Diabetes Mellitus With and Without Cognitive Impairment. Sci Rep 6: 32980. https://doi.org/10.1038/srep32980
Luchsinger JA, Reitz C, Patel B, Tang MX, Manly JJ, Mayeux R (2007) Relation of diabetes to mild cognitive impairment. Arch Neurol 64(4): 570–575. https://doi.org/10.1001/archneur.64.4.570
Roberts RO, Geda YE, Knopman DS, Christianson TJ, Pankratz VS, Boeve BF, Vella A, Rocca WA, Petersen RC (2008) Association of duration and severity of diabetes mellitus with mild cognitive impairment. Arch Neurol 65(8): 1066–1073. https://doi.org/10.1001/archneur.65.8.1066
Musen G, Tinsley LJ, Marcinkowski KA, Pober D, Sun JK, Khatri M, Huynh R, Lu A, King GL, Keenan HA (2018) Cognitive Function Deficits Associated With Long-Duration Type 1 Diabetes and Vascular Complications. Diabetes Care 41(8): 1749–1756. https://doi.org/10.2337/dc17-1955
Pelimanni E, Jehkonen M (2019) Type 2 Diabetes and Cognitive Functions in Middle Age: A Meta-Analysis. J Int Neuropsychol Soc 25(2): 215–229. https://doi.org/10.1017/S1355617718001042
Самойлова ЮГ, Ротканк МА, Жукова НГ, Матвеева МВ, Толмачев ИВ, Кудлай ДА (2018) Маркеры когнитивных нарушений и вариабельности гликемии у пациентов с сахарным диабетом 1-го типа. Журнал неврологии и психиатрии им СС Корсакова 118(4): 48–51. [Samoilova YG, Rotkank MA, Zhukova NG, Matveeva MV, Tolmachev IV, Kudlay DA (2018) Markers for cognitive impairments and variability of glycaemia in patients with type 1 diabetes mellitus. Zh Nevrol Psikhiatr Im S S Korsakova 118(4): 48–51. (In Russ)]. https://doi.org/10.17116/jnevro20181184148-51
Moheet A, Mangia S, Seaquist ER (2015) Impact of diabetes on cognitive function and brain structure. Ann N Y Acad Sci 1353: 60–71. https://doi.org/10.1111/nyas.12807
Embury CM, Wiesman AI, McDermott TJ, Proskovec AL, Heinrichs-Graham E, Lord GH, Brau KL, Drincic AT, Desouza CV, Wilson TW (2019) The impact of type 1 diabetes on neural activity serving attention. Hum Brain Mapp 40(4): 1093–1100. https://doi.org/10.1002/hbm.24431
Zhang YW, Zhang JQ, Liu C, Wei P, Zhang X, Yuan QY, Yin XT, Wei LQ, Cui JG, Wang J (2015) Memory dysfunction in type 2 diabetes mellitus correlates with reduced hippocampal CA1 and subiculum volumes. Chin Med J (Engl) 128(4): 465–471. https://doi.org/10.4103/0366-6999.151082
Zilliox LA, Chadrasekaran K, Kwan JY, Russell JW (2016) Diabetes and Cognitive Impairment. Curr Diab Rep 16(9): 87. https://doi.org/10.1007/s11892-016-0775-x
Ding X, Fang C, Li X, Cao YJ, Zhang QL, Huang Y, Pan J, Zhang X (2019) Type 1 diabetes-associated cognitive impairment and diabetic peripheral neuropathy in Chinese adults: results from a prospective cross-sectional study. BMC Endocr Disord 19(1): 34. https://doi.org/10.1186/s12902-019-0359-2
Roy S, Kim N, Desai A, Komaragiri M, Baxi N, Jassil N, Blessinger M, Khan M, Cole R, Desai N, Terrigno R, Hunter K (2015) Cognitive Function and Control of Type 2 Diabetes Mellitus in Young Adults. N Am J Med Sci 7(5): 220–226. https://doi.org/10.4103/1947-2714.157627
Sun L, Diao X, Gang X, Lv Y, Zhao X, Yang S, Gao Y, Wang G (2020) Risk Factors for Cognitive Impairment in Patients with Type 2 Diabetes. J Diabetes Res 2020: 4591938. https://doi.org/10.1155/2020/4591938
Gandek B, Sinclair SJ, Kosinski M, Ware JE Jr (2004) Psychometric evaluation of the SF-36 health survey in Medicare managed care. Health Care Financ Rev 25(4): 5–25.
Ware JE Jr. (2000) SF-36 health survey update. Spine (Phila Pa 1976) 25(24): 3130–3139. https://doi.org/10.1097/00007632-200012150-00008
Brickenkamp R (2012) d2, Test de Atención: Manual. Adaptación española: Nicolas Seisdedos Cubero. 4ed. Madrid: TEA Ediciones, S.A.U.
Сидоров КР (2012) Количественная оценка продуктивности внимания в методике “Корректурная проба” Б. Бурдона. Вестн Удмуртск универ Вып 4 50–57. [Sidorov KR (2012) Qualitative Assessment of the Efficiency of Attention in the Methodology of “Cancellation Test” by B. Bourdon. Bull Udmurt State University 4: 50–57. (In Russ)].
Lin J-D, Chen Y-L, Wu C-Z, Hsieh C-H, Pei D, Liang Y-J, Chang J-B (2016) Identification of Normal Blood Pressure in Different Age Group. Medicine (Baltimore) 95(14): e3188. https://doi.org/10.1097/MD.0000000000003188
Eguchi K. (2015) Blood Pressure Management in Patients with Type 2 Diabetes. Intern Med 54(18): 2285–2289. https://doi.org/10.2169/internalmedicine.54.5617
Dederer J, Bewarder Y, Mahfoud F, Böhm M (2019) Blutdruckziele bei Patienten mit Diabetes mellitus : Was sind optimale Werte? [Blood pressure targets in patients with diabetes mellitus : What are optimum values?]. Herz 44(3): 231–237. German. https://doi.org/10.1007/s00059-019-4796-5
Mokhtari Z, Gheshlagh RG, Kurdi A (2019) Health-related quality of life in Iranian patients with type 2 diabetes: An updated meta-analysis. Diabetes Metab Syndr 13(1): 402–407. https://doi.org/10.1016/j.dsx.2018.10.007
Krzemińska S, Bąk E, Šáteková L, Polanská A, Hašová K, Laurinc M (2020) Comparison of Diabetes-Dependent Quality of Life (ADDQoL) in Patients with T2DM in Poland, The Czech Republic, and Slovakia. Diabetes Metab Syndr Obes 13: 3773–3786. https://doi.org/10.2147/DMSO.S273339
Zurita-Cruz JN, Manuel-Apolinar L, Arellano-Flores ML, Gutierrez-Gonzalez A, Najera-Ahumada AG, Cisneros-González N (2018) Health and quality of life outcomes impairment of quality of life in type 2 diabetes mellitus: a cross-sectional study. Health Qual Life Outcomes 16(1): 94. https://doi.org/10.1186/s12955-018-0906-y
Jing X, Chen J, Dong Y, Han D, Zhao H, Wang X, Gao F, Li C, Cui Z, Liu Y, Ma J (2018) Related factors of quality of life of type 2 diabetes patients: a systematic review and meta-analysis. Health Qual Life Outcomes 16(1): 189. https://doi.org/10.1186/s12955-018-1021-9
Abdul-Rasoul M, AlOtaibi F, Abdulla A, Rahme Z, AlShawaf F (2013) Quality of life of children and adolescents with type 1 diabetes in Kuwait. Med Princ Pract 22(4): 379–384. https://doi.org/10.1159/000347052
Bhavani N, Prince S, Menon AS, Abraham N, Pavithran PV, Menon UV, Nair V, Kumar H (2021) Health related quality of life in pediatric onset Type 1 diabetes mellitus in Kerala, India. Pediatr Diabetes 22(2): 369–373. https://doi.org/10.1111/pedi.13151
Spasić A, Radovanović R, Đorđević A, Stefanović N, Cvetković T (2014) Quality of Life in Type 2 Diabetic Patients. Acta Facultatis Medicae Naissensis 31(3):193-200. https://doi.org/10.2478/afmnai-2014-0024
PrasannaKumar HR, Mahesh MG, Menon VB, Srinath KM, Shashidhara KC, Ashok P (2018) Patient Self-reported quality of life assessment in Type 2 diabetes mellitus: A pilot study. Niger J Clin Pract 21(3): 343–349. https://doi.org/10.4103/njcp.njcp_433_16
Bąk E, Nowak-Kapusta Z, Dobrzyn-Matusiak D, Marcisz-Dyla E, Marcisz C, Krzemińska SA (2019) An assessment of diabetes-dependent quality of life (ADDQoL) in women and men in Poland with type 1 and type 2 diabetes. Ann Agric Environ Med 26(3): 429–438. https://doi.org/10.26444/aaem/99959
McCrimmon RJ, Ryan CM, Frier BM (2012) Diabetes and cognitive dysfunction. Lancet 379(9833): 2291–2299. https://doi.org/10.1016/S0140-6736(12)60360-2
Ryan CM, van Duinkerken E, Rosano C (2016) Neurocognitive consequences of diabetes. Am Psychol 71(7): 563–576. https://doi.org/10.1037/a0040455
Biessels GJ, Despa F (2018) Cognitive decline and dementia in diabetes mellitus: mechanisms and clinical implications. Nat Rev Endocrinol 14(10): 591–604. https://doi.org/10.1038/s41574-018-0048-7
Lee HJ, Seo HI, Cha HY, Yang YJ, Kwon SH, Yang SJ (2018) Diabetes and Alzheimer’s Disease: Mechanisms and Nutritional Aspects. Clin Nutr Res 7(4): 229–240. https://doi.org/10.7762/cnr.2018.7.4.229
Zhao X, Han Q, Lv Y, Sun L, Gang X, Wang G (2017) Biomarkers for cognitive decline in patients with diabetes mellitus: evidence from clinical studies. Oncotarget 9(7): 7710–7726. https://doi.org/10.18632/oncotarget.23284
Mayeda ER, Whitmer RA, Yaffe K (2015) Diabetes and cognition. Clin Geriatr Med 31(1): 101–115, ix. https://doi.org/10.1016/j.cger.2014.08.021
Brismar T, Maurex L, Cooray G, Juntti-Berggren L, Lindström P, Ekberg K, Adner N, Andersson S (2007) Predictors of cognitive impairment in type 1 diabetes. Psychoneuroendocrinology 32(8–10): 1041–1051. https://doi.org/10.1016/j.psyneuen.2007.08.002
Trujeque-Ramos S, Castillo-Rolón D, Galarraga E, Tapia D, Arenas-López G, Mihailescu S, Hernández-López S (2018) Insulin Regulates GABAA Receptor-Mediated Tonic Currents in the Prefrontal Cortex. Front Neurosci 12: 345. https://doi.org/10.3389/fnins.2018.00345
Ghasemi R, Haeri A, Dargahi L, Mohamed Z, Ahmadiani A (2013) Insulin in the brain: sources, localization and functions. Mol Neurobiol 47(1): 145–171. https://doi.org/10.1007/s12035-012-8339-9
Arnold SE, Arvanitakis Z, Macauley-Rambach SL, Koenig AM, Wang HY, Ahima RS, Craft S, Gandy S, Buettner C, Stoeckel LE, Holtzman DM, Nathan DM (2018) Brain insulin resistance in type 2 diabetes and Alzheimer disease: concepts and conundrums. Nat Rev Neurol 14(3): 168–181. https://doi.org/10.1038/nrneurol.2017.185
Arvanitakis Z, Wang HY, Capuano AW, Khan A, Taïb B, Anokye-Danso F, Schneider JA, Bennett DA, Ahima RS, Arnold SE (2020) Brain Insulin Signaling, Alzheimer Disease Pathology, and Cognitive Function. Ann Neurol 88(3): 513–525. https://doi.org/10.1002/ana.25826
Gaddam M, Singh A, Jain N, Avanthika C, Jhaveri S, De la Hoz I, Sanka S, Goli SR (2021) A Comprehensive Review of Intranasal Insulin and Its Effect on the Cognitive Function of Diabetics. Cureus 13(8): e17219. https://doi.org/10.7759/cureus.17219
Benedict C, Hallschmid M, Schmitz K, Schultes B, Ratter F, Fehm HL, Born J, Kern W (2007) Intranasal insulin improves memory in humans: superiority of insulin aspart. Neuropsychopharmacology 32(1): 239–243. https://doi.org/10.1038/sj.npp.1301193
Ritze Y, Kern W, Ebner EM, Jahn S, Benedict C, Hallschmid M (2018) Metabolic and Cognitive Outcomes of Subchronic Once-Daily Intranasal Insulin Administration in Healthy Men. Front Endocrinol (Lausanne) 13 9: 663. https://doi.org/10.3389/fendo.2018.00663
Shemesh E, Rudich A, Harman-Boehm I, Cukierman-Yaffe T (2012) Effect of intranasal insulin on cognitive function: a systematic review. J Clin Endocrinol Metab 97(2): 366–376. https://doi.org/10.1210/jc.2011-1802
Gao Y, Xiao Y, Miao R, Zhao J, Zhang W, Huang G, Ma F (2015) The characteristic of cognitive function in Type 2 diabetes mellitus. Diabetes Res Clin Pract 109(2): 299–305. https://doi.org/10.1016/j.diabres.2015.05.019
Jeste DV (2019) Frailty and mental health: association with cognition, sleep, and well-being in older adults. Int Psychogeriatr 31(6): 755–757. https://doi.org/10.1017/S1041610219000863
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


