Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 5, стр. 636-648
Изменение вклада IKCa-каналов в поддержание тонуса и дилатацию пиальных артериий у стареющих крыс после ишемии/реперфузии
О. П. Горшкова 1, *, И. Б. Соколова 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: o_gorshkova@inbox.ru
Поступила в редакцию 26.01.2022
После доработки 24.02.2022
Принята к публикации 15.03.2022
- EDN: KIIGUN
- DOI: 10.31857/S0869813922050065
Аннотация
В основе нарушения мозгового кровотока после ишемии/реперфузии (И/Р) может лежать эндотелиальная дисфункция, связанная с нарушением функциональной активности кальций-чувствительных калиевых каналов промежуточной проводимости (IКCa). Однако данные об изменениях функциональной активности IКCa-каналов в сосудах головного мозга после И/Р немногочисленны и противоречивы. Старение сопровождается изменением вклада IKCa-каналов в эндотелий-зависимую дилатацию мозговых сосудов, что может нарушать перфузию и ухудшать процессы восстановления мозгового кровотока после перенесенной ишемии. В работе исследовали изменение вклада IКCa-каналов в поддержание тонуса и опосредованную ацетилхолином дилатацию пиальных артерий крыс Спрег–Доули в возрасте 18 месяцев после перенесенной однократной И/Р (пережатие обеих сонных артерий с одновременным снижением и строгим поддержанием среднего АД на уровне 45 ± 2 мм рт. ст. на 12 мин). Исследование сосудов проводили через 7, 14 и 21 день после И/Р. С использованием метода прижизненной микрофотосъемки оценивали реакции артерий у крыс, перенесших ишемию, и ложнооперированных животных. Об изменении вклада IКCa-каналов в поддержание тонуса судили по изменению числа сосудов, сузившихся в ответ на воздействие блокатора IКCa-каналов (клотримазола, 10–7 М, 5 мин). Изменение вклада каналов в дилатацию сосудов оценивали путем сравнения числа и степени дилатации артерий в ответ на действие ацетилхолин хлорида (АХ, 10–7 М, 8 мин) до и после применения клотримазола. Установлено, что И/Р коры головного мозга у крыс в возрасте 18 месяцев приводит к уменьшению числа дилатаций пиальных артерий на воздействие АХ, которое сохраняется на протяжении первых 14 дней после ишемии. В этот отрезок постишемического периода вклад IKCa-каналов в поддержание тонуса пиальных артерий и АХ-опосредованную дилатацию также снижается. Снижение вклада IKCa-каналов в осуществление дилататорного ответа наблюдается уже через 7 дней после И/Р, а через 14 дней эти каналы практически не участвуют в АХ-опосредованной дилатации пиальных артерий. К 21-му дню после И/Р все исследованные процессы восстанавливаются.
Ишемическое поражение головного мозга – одно из наиболее распространенных патологических состояний, значительным фактором риска развития которого является возраст. Временное прекращение кровоснабжения мозга вызывает дисбаланс метаболических процессов, приводящий к тканевой гипоксии. Последующая реперфузия не всегда сопровождается восстановлением нормального кровотока и часто приводит к дополнительным повреждениям. Вопросы взаимосвязи между первичным ишемическим поражением и последующими процессами, происходящими в церебральной сосудистой сети, к настоящему времени изучены недостаточно.
В изменениях мозгового кровотока после ишемии/реперфузии (И/Р) большая роль принадлежит развитию эндотелиальной дисфункции в стенке мозговых сосудов, обусловленной нарушениями NO-опосредованных механизмов сосудистой регуляции [1–3]. В качестве параллельного компенсаторного сосудорасширяющего пути в этих условиях может выступать эндотелиальная гиперполяризация (EDH) [1, 4, 5]. Механизм развития EDH в настоящее время до конца не выяснен. Считается, что возникновение EDH связано с действием некоторых веществ, продуцируемых эндотелием (так называемых факторов EDH), которые активируют расположенные в эндотелии сосудов кальций-чувствительные калиевые каналы. Усиление выхода ионов калия из клеток эндотелия через эти каналы приводит к гиперполяризации мембраны гладкомышечных клеток, их расслаблению и вазодилатации [3, 6]. Значительная роль в возникновении EDH отводится кальций-чувствительным калиевым каналам промежуточной проводимости (IKСa) [1, 4, 5]. В то же время многие исследователи утверждают, что источником EDH могут быть процессы, связанные с возникновением электрической связи между эндотелием и мышечной тканью через электрические щелевые каналы без участия генерации химических медиаторов [7]. Старение – это сложный процесс, в частности связанный с клеточными, метаболическими и структурными изменениями в сосудах головного мозга [8, 9], приводящими к развитию дисфункции сосудистых эндотелиальных клеток. Согласно данным, полученным нами в предыдущих экспериментах [10], а также результатам других авторов [6, 11], старение сопровождается изменением вклада IKCa-каналов в эндотелий-зависимую дилатацию сосудов головного мозга, что может приводить к нарушению перфузии мозга и способствовать ухудшению процессов восстановления мозгового кровотока после перенесенной И/Р.
После окклюзии крупных сосудов участок мозга, подвергшийся ишемии, остается жизнеспособным за счет коллатерального кровотока [12]. Церебральные коллатерали являются вспомогательными сосудистыми путями, которые могут частично поддерживать приток крови к ткани, подвергшейся ишемии, при блокировании первичных сосудистых путей [12, 13]. Пиальные коллатерали представляют собой анастамотические соединения на кортикальной поверхности, соединяющие дистальные ветви передней и задней мозговой артерии с дистальными ветвями средней мозговой артерии [12]. Кровоток через пиальные коллатерали определяет степень ишемического поражения коры головного мозга и влияет на процессы восстановления.
Таким образом, нарушение процессов регуляции тонуса пиальных артерий и старение являются критическими факторами в определении исхода и последствий острой ишемии головного мозга. Поэтому целью данной работы было изучение вклада IKCa-каналов в регуляцию тонуса пиальных артерий после перенесенной ишемии/реперфузии у стареющих животных. В задачи исследования входило изучение изменения вклада IKCa-каналов в поддержание тонуса и осуществление опосредованной ацетилхолином (АХ) дилатации пиальных артерий у крыс в возрасте 18 месяцев на разных сроках постишемического периода (через 7, 14 и 21 день после перенесенной ишемии коры головного мозга).
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проведены на 18-месячных самцах крыс Спрег–Доули (n = 41) массой 450–670 г из центра коллективного пользования “Биоколлекция ИФ РАН”. Работа выполнена в соответствии с “Правилами проведения работ с использованием экспериментальных животных”, принятыми Европейской конвенцией 19.07.2014, и требованиями Комиссии по контролю над содержанием и использованием лабораторных животных при Институте физиологии им. И.П. Павлова РАН. Животных содержали в стандартных условиях вивария при свободном доступе к воде и пище по 6 особей в клетках Т4 на стандартной лабораторной диете в условиях искусственного освещения (цикл: 12 ч свет/12 ч темнота).
Ишемия коры головного мозга воспроизводилась с использованием техники окклюзии двух сосудов с управляемой гипотензией, известной в англоязычной литературе как “2-vessel occlusion + hypotention model”, с авторскими модификациями [14]. У наркотизированных хлоралгидратом (внутрибрюшинно, 43 мг/100 г массы тела) крыс проводилась 12-минутная окклюзия обеих сонных артерий с одновременной управляемой гипотензией (снижение и строгое поддержание артериального давления (АД) на уровне 45 ± 2 мм рт. ст. путем забора/реинфузии крови (0.8–1.2 мл/100 г массы тела) в гепаринизированный шприц). Измерение АД осуществлялось прямым способом через катетер в бедренной артерии, соединенным с датчиком DTXPlusTM (Argon Critical Care Systems, Сингапур, https://www. argonmedical.com), подключенным к АЦП, входящему в состав микроконтроллера фирмы STMicroelectronics (США, https://www.st.com), выход которого был подключен к компьютеру через порт USB. Для работы устройства с компьютером в нашей лаборатории была разработана оригинальная программа визуализации значений АД. Расчет среднего АД в реальном времени производился программой по классической формуле:
По окончании периода ишемии производилась полная реинфузия забранной крови и ушивание операционных ран. До выхода из наркоза крысы содержались на электрогрелках (S315, EcoSapiens, Россия) при температуре 38°С. После выхода из наркоза животные возвращались в клетки своего обычного содержания.
Постишемические изменения исследовались в отдельных группах крыс: на 7-, 14- и 21-й день после ишемии. Контролем служили ложнооперированные животные (ЛО). Эти крысы подвергались аналогичному оперативному вмешательству, но без проведения ишемии. Исследования на ЛО крысах проводились в отдельных группах через 7, 14 и 21 день после операции.
Для проведения прижизненного исследования реакций пиальных артерий крыс наркотизировали золетилом (внутрибрюшинно, 20 мг/кг, Virbac, Франция). В теменной области черепа животного высверливали отверстие (S ≈ 1 см2), твердую мозговую оболочку в пределах которого удаляли, тем самым открывая поле для дальнейшего исследования. Поверхность мозга непрерывно орошали раствором Кребса (в мМ: NaCl 120.4; KCl 5.9; NaHCО3 15.5; MgCl2 1.2; CaCl2 2.5; NaH2PO4 1.2; глюкоза 11.5; pH 7.4), аэрированного карбогеном. Раствор для орошения, как и все другие применяемые растворы, в течение всего эксперимента содержали в медицинском водяном термостате (TW-2, SIA “ELMI”, Латвия) при температуре 37°C. На протяжении всего эксперимента контролировали среднее АД, показатели которого оставались примерно на одном уровне и составляли 127 ± 4 мм рт. ст. Температуру тела животного поддерживали на уровне 38°C. Визуализацию пиальных артерий проводили с помощью оригинальной установки, включающей в себя стереоскопический микроскоп MC-2ZOOM (Микромед, Россия), цветную камеру-видеоокуляр для микроскопа Basler acA 4600–10uc (Германия) и персональный компьютер.
При проведении эксперимента крыс разделяли на 6 отдельных групп: крысы через 7 (n = 7), 14 (n = 7) и 21 (n = 8) день после перенесенной ишемии и ЛО крысы через 7 (n = 6), 14 (n = 7) и 21 (n = 6) день после оперативного вмешательства. Исследовали реакции сосудов на орошение поверхности головного мозга раствором ацетилхолин хлорида (Acetylcholine chloride, Sigma-Aldrich, 10–7 М, 8 мин) в отсутствие и на фоне блокады IKCa – каналов раствором клотримазола (Акрихин, Польша) в концентрации 10–5 М (предварительное орошение поверхности головного мозга в течение 5 мин с последующим добавлением АХ в раствор блокатора). Фоновую реакцию на воздействие АХ в каждой группе анализировали по всему массиву сосудов и принимали за 100%. Проверка по критерию Краскела–Уоллеса показала отсутствие значимых различий между отдельными животными в фоновых реакциях на воздействие АХ внутри каждой из исследованных групп. Общая продолжительность эксперимента составляла 60–90 мин, после чего животных усыпляли передозировкой раствора золетила (60 мг/кг).
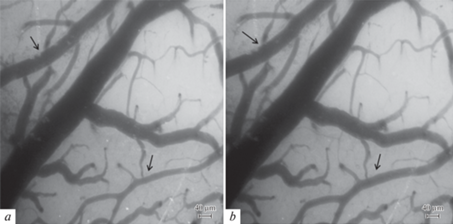
Диаметр сосудов измеряли на статических изображениях (рис. 1) с помощью компьютерной программы для цитофотометрии “Photo M 1.21” (авторская разработка А. Черниговского, http://www.t_lambda.chat.ru). В программе предусмотрен режим увеличения изображения и калибровки для пересчета всех координат в метрические единицы. С использованием программы вручную измеряли ширину потока эритроцитов, соответствующую внутреннему диаметру сосуда. Об изменении вклада IKCa-каналов в поддержание тонуса сосудов судили по изменению числа сосудов, сузившихся в ответ на воздействие блокатора IKCa-каналов клотримазола. Изменение вклада каналов в дилатации сосудов оценивали путем сравнения числа дилатированных сосудов и степени их дилатации в ответ на воздействие АХ до и после применения блокатора.
Рис. 1.
Микрофотографии пиальных сосудов: a – исходное состояние; b – реакция на орошение поверхности головного мозга раствором АХ (10–7 М, 8 мин). Стрелками указаны артериальные участки пиальной сосудистой сети.
Изменение количества расширившихся и сузившихся сосудов на воздействие выражали в процентах относительно общего числа исследованных сосудов в группе. Степень дилатации ΔД %: рассчитывали по формуле:
Изменения диаметра в покое не превышали 5.0 ± 0.5%, поэтому при таких значениях считали, что реакция на воздействие отсутствует.
У каждой крысы было измерено от 40 до 70 участков сосудов. В литературе имеются сведения о том, что вклад EDH в эндотелий-зависимые релаксации неоднороден и варьируется в зависимости от размера сосудов [15–17]. Поэтому для последующего анализа измеренные сосуды были разделены на группы в соответствии с их диаметрами: мелкие сосуды (диаметром от 9 до 20 мкм), сосуды среднего диаметра (от 20 до 40 мкм) и крупные сосуды (более 40 мкм). Данные по отдельной группе сосудов усредняли для каждого животного и использовали для статистических сравнений.
Статистический анализ данных проводили с использованием пакета статистических программ Microsoft Excel 2019 и программы InStat 3.02 (“GraphPad Software Inc.”, США). Данные представлены в виде среднего арифметического значения и его ошибки. При сравнении 2 групп использовали U-критерий Манна–Уитни. Сравнение средних данных независимых выборок при сравнении более 2 групп при нормальном характере распределения вариант в совокупности данных (выборке) проводили при помощи дисперсионного анализа с последующим попарным сравнением групп согласно критерию Тьюки. При распределении вариант в выборке, отличном от нормального, при сравнении групп применяли критерий Краскела–Уоллиса с последующим попарным сравнением групп согласно критерию Данна.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
И/Р изменяла выраженность АХ-опосредованной дилатации пиальных артериальных сосудов только в первые 14 дней после перенесенного воздействия. Через 7 дней у крыс, перенесших ишемию, по сравнению с ЛО животными, в группе артерий диаметром более 40 мкм отмечалось снижение числа дилататорных реакций на воздействие АХ (на 33.9 ± 2.4%; p = 0.02, U = 54, критерий Манна–Уитни), без изменения амплитуды дилатации. В остальных группах исследованных артерий число АХ-опосредованных дилатаций и амплитуда дилатации не отличались от аналогичных показателей в соответствующих группах сосудов ЛО животных (рис. 2). На 14-й день число и амплитуда дилататорных реакций на воздействие АХ сосудов крупных диаметров у крыс, перенесших ишемию, и ЛО животных достоверно не отличались. Число дилатаций мелких и средних артерий было достоверно ниже (в среднем на 25%; рис. 2). Через 21 день число и амплитуда вызванных АХ дилатаций у животных, перенесших ишемию, и ЛО крыс во всех группах исследованных сосудов достоверно не отличались.
Рис. 2.
Дилататорная реакция пиальных артерий различных диаметров на воздействие АХ. Косая штриховка – ЛО крысы; темная заливка – крысы после И/Р (а – 7 дней; b – 14 дней; с – 21 день). * – различия статистически значимы при p < 0.05 (U-критерий Манна–Уитни).

Аппликация клотримазола у ЛО крыс через 7 дней после оперативного вмешательства вызывала констрикцию сосудов всех исследованных диаметров (рис. 3a). Наибольшее число констрикций отмечено в группе артерий диаметром менее 20 мкм (65.1 ± 2%). С увеличением диаметра сосудов число констрикций на воздействие клотримазола достоверно снижалось (р < 0.0001, критерий Краскела–Уоллиса). Блокада IKCa-каналов уменьшала число АХ-опосредованных дилатаций пиальных артерий всех диаметров в среднем на 80–85% (рис. 4a). Амплитуда дилатации во всех группах исследованных сосудов также достоверно уменьшалась (рис. 4b). У крыс, перенесших ишемию, через 7 дней после И/Р, по сравнению с ЛО животными, аппликация клотримазола вызывала достоверно меньшее число констрикций. Во всех исследованных группах артерий в ответ на воздействие клотримазола сужалось в среднем от 30 до 45% сосудов (рис. 3a). Число АХ-опосредованных дилатаций на фоне введения клотримазола во всех группах сосудов снижалось в среднем на 60–70%. В группе артерий мелких диаметров также уменьшалась амплитуда дилатаций (рис. 4).
Рис. 3.
Констрикторная реакция пиальных артерий различных диаметров на воздействие блокатора IKCa-каналов (клотримазола). Косая штриховка — ЛО крысы; темная заливка – крысы после И/Р (а – 7 дней; b – 14 дней; с – 21 день). *– различия статистически значимы при p < 0.05 (U-критерий Манна–Уитни).
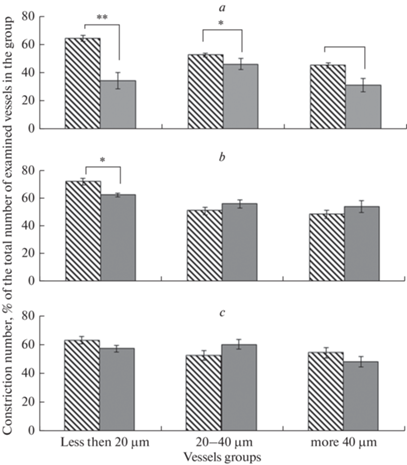
Рис. 4.
Изменение дилататорной реакции пиальных артериальных сосудов различных диаметров на воздействие АХ на фоне блокады IKCa-каналов: a – число дилатаций (% от общего числа исследованных сосудов); b – диаметр артерий после воздействия АХ (% относительно их диаметра до воздействия АХ). Линия – дилататорная реакция сосудов в группе на введение АХ без применения блокатора, принятая за 100%. Косая штриховка – ЛО крысы; черная заливка – крысы через 7 дней после И/Р; серая заливка – крысы через 14 дней после И/Р; белая заливка – крысы через 21 день после И/Р. Различия статистически значимы: *p < 0.05; ** p < 0.01 (U-критерий Манна–Уитни).
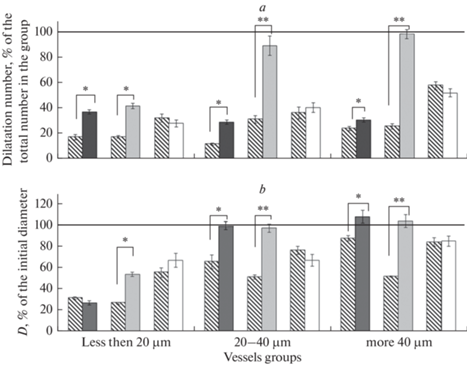
Аппликация клотримазола у ЛО крыс через 14 дней после операции вызывала констрикцию 71.3 ± 4.4% мелких сосудов и около 50% артерий средних и крупных диаметров (рис. 3b). На фоне введения клотримазола во всех группах исследованных сосудов уменьшалось число дилатаций на воздействие АХ (в среднем на 70–80%). Также снижалась и амплитуда АХ-опосредованной дилататорной реакции (рис. 4). У крыс, перенесших ишемию, через 14 дней после И/Р орошение поверхности головного мозга раствором клотримазола приводило к констрикции около 60% сосудов всех исследованных групп (рис. 3b). Число дилатаций на воздействие АХ на фоне применения клотримазола в группах сосудов мелких сосудов уменьшалось на 58.3 ± 2.1% (p = 0.01, U = 11, критерий Манна–Уитни). В этой группе также уменьшалась и амплитуда дилататорной реакции (рис. 4). В группах артерий крупных и средних диаметров число и амплитуда АХ-опосредованных дилатаций на фоне применения клотримазола соответствовали значениям, полученным без применения блокатора (рис. 4).
Через 21 день применение клотримазола у ЛО крыс приводило к констрикции 55–60% сосудов всех исследованных диаметров (рис. 3c). Число дилататорных реакций на воздействие АХ на фоне применения клотримазола у сосудов мелких и средних диаметров уменьшалось в среднем на 65%. В этих группах сосудов также уменьшалась и амплитуда дилатации (рис. 4). Число АХ-опосредованных дилатаций в группе крупных сосудов на фоне блокады IKCa-каналов уменьшалось на 42.2 ± 3.2% (p = 0.004, U = 9, критерий Манна–Уитни). У животных, перенесших ишемию, во всех группах артерий в ответ на воздействие клотримазола сужалось в среднем около 55% сосудов, что достоверно не отличалось от соответствующих реакций сосудов ЛО крыс (рис. 3c). Число и амплитуда АХ-опосредованных дилататорных реакций артерий всех исследованных диаметров на фоне предварительного введения клотримазола у крыс, перенесших ишемию, снижались, но эти изменения у животных после И/Р и у ЛО крыс были выражены в равной степени (рис. 4).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В ходе исследования было установлено, что И/Р коры головного мозга крыс, вызванная окклюзией обеих сонных артерий с управляемой гипотензией, у крыс в возрасте 18 месяцев приводит к угнетению АХ-опосредованной дилатации пиальных артериальных сосудов, которое сохраняется на протяжении первых 14 дней после восстановления кровотока. Нами [18], а также другими исследователями [1–3], ранее было показано, что развитие сосудистой дисфункции после ишемии и последующей реперфузии может быть связано с возникновением эндотелиальной дисфункции, в основе которой лежит нарушение NO-опосредованных механизмов сосудистой регуляции, развивающееся вследствие снижения биодоступности и синтеза NO. Уменьшение секреции и/или продукции NO может усиливать роль фактора эндотелиальной гиперполяризации (EDHF) в регуляции сосудистого тонуса [1, 3]. Структура EDHF к настоящему времени не установлена. Но известно, что важным начальным шагом в развитии эндотелий–зависимой гиперполяризации является активация расположенных в эндотелии сосудов IKСa-каналов (1, 4, 5). Во многих сигнальных событиях, развивающихся после И/Р, центральное место играет увеличение уровня внутриклеточного кальция в эндотелиальных клетках [19–22]. Высокие уровни кальция могут нарушать функцию эндотелия и изменять активность процессов, участвующих в регуляции сосудистого тонуса, в частности, влиять на активность IKCa-каналов [5, 20, 22].
В наших экспериментах у ЛО животных через 7 дней после операции клотримазол, являющийся ингибитором IKCa-каналов [23], вызывал сужение в среднем 45–65% пиальных артерий. Эти данные свидетельствуют о том, что у крыс в возрасте 18 мес. в физиологических условиях IKCa-каналы участвуют в поддержании тонуса пиальных артерий. У крыс, перенесших ишемию, через 7 дней после И/Р во всех группах исследованных сосудов отмечалось уменьшение числа констрикторных реакций на аппликацию клотримазола, по сравнению с реакциями сосудов в соответствующих группах у ЛО животных. Следовательно, можно утверждать, что И/Р вызывает снижение вклада IKCa-каналов в поддержание тонуса пиальных артерий. Но эти данные противоречат результатам, полученным другими исследователями и свидетельствующим об отсутствии [22, 24] изменения или усилении [21] роли IKCa-каналов в поддержании тонуса мозговых сосудов после перенесенной И/Р. Различия в результатах могут быть обусловлены региональной и видовой изменчивостью в экспрессии IKCa-каналов [3]. Также причина появления противоречивых выводов может быть связана с методологическими подходами, приводящими к достижению различной степени ишемии и времени реперфузии [24, 25]. Немаловажным фактором, влияющим на результаты исследования, могут быть и отличия в строении исследованных сосудов. В сосудах, имеющих менее выраженный слой гладкомышечных клеток, в базальных условиях эндотелий может оказывать большее влияние на гладкую мускулатуру, так как такое структурное расположение допускает более полный перенос гиперполяризации, что невозможно в сосудах с более выраженным гладкомышечным слоем [16].
На протяжении последующего постишемического периода в наших экспериментах различия в реакциях артерий на воздействие клотримазола у крыс, перенесших И/Р, и ЛО животных уменьшались. Через 14 дней достоверные отличия наблюдались только в группе мелких сосудов. К 21-му дню реакции артерий всех исследованных диаметров на аппликацию клотримазола у животных, перенесших И/Р, не отличались от реакций артерий у ЛО крыс, что указывает на восстановление вклада IKCa-каналов в поддержании тонуса пиальных артерий в этот отрезок постишемического периода.
Число и амплитуда дилататорных реакций на воздействие АХ у артерий всех исследованных диаметров, предварительно подвергнутых воздействию клотримазола, у ЛО крыс во все временные отрезки послеоперацинного периода достоверно уменьшались. Это свидетельствует о том, что у ЛО животных IKCa-каналы играют значительную роль в осуществлении АХ-опосредованных дилататорных реакций пиальных артериальных сосудов. Согласно современным представлениям в основе механизма АХ-опосредованной активации IKCa-каналов лежит увеличение уровня внутриклеточного кальция посредством активации ваниллоидных каналов (TRPV4) в плазматической мембране и рецепторов инозитолтрисфосфата (IP3Rs) в эндоплазматическом ретикулуме [26]. У крыс, перенесших ишемию, характер АХ-опосредованных дилататорных реакций пиальных артерий на фоне предварительной блокады IKCa-каналов также менялся. Через 7 дней после И/Р на фоне введения клотримазола число дилатаций пиальных артерий всех диаметров достоверно снижалось. Но это снижение было выражено в меньшей степени, чем у ЛО крыс. Наши данные отличаются от результатов, полученных другими исследователями, свидетельствующих об усилении EDHF-опосредованных ответов после перенесенной ишемии [1, 3, 21, 22, 24]. Мы полагаем, что различия могут быть обусловлены возрастными особенностями экспериментальных животных. В большинстве исследований, описанных в литературе, использовались молодые животные в возрасте 3–4 месяцев. В наших же экспериментах возраст крыс составлял 18 месяцев. Основной механизм, приводящий к изменениям EDHF-опосредованных вазодилататорных ответов, связывают с увеличением внутриклеточного кальция в эндотелиальных клетках, что может повышать активность IKCa-каналов, вызывая отток К+ и гиперполяризацию мембраны [22, 27, 28]. В литературе имеются сведения о том, что в условиях покоя у старых животных по сравнению с молодыми особями открыто больше IKCa-каналов [29], что способствует гиперполяризации эндотелия. Связанное с перенесенной И/Р увеличение внутриклеточного кальция в эндотелиальных клетках может способствовать дополнительной активации IKCa-каналов. Известно, что гиперактивация IKCa-каналов уменьшает сопротивление клеточных мембран и снижает способность эндотелия артерий проводить электрические сигналы [15]. Вероятно, именно эти процессы и являются одной из причин снижения вклада IKCa-опосредованных дилататорных ответов пиальных артерий на воздействие АХ у стареющих крыс после перенесенной И/Р.
Через 14 дней после И/Р снижение вклада IKCa-каналов промежуточной проводимости в АХ-опосредованную дилатацию отмечалось только на сосудах диаметром менее 20 мкм. В остальных группах артерий клотримазол не изменял характер дилататорных ответов на АХ. Следовательно, в этот отрезок постишемического периода IKCa-каналы практически не участвовали в АХ-опосредованной дилатации пиальных артерий средних и крупных диаметров. Через 21 день после И/Р снижение числа и амплитуды дилататорных реакций на воздействие АХ на фоне блокады IKCa-каналов у ЛО крыс и крыс, перенесших ишемию, достоверно не отличались.
Таким образом, нами было установлено, что И/Р коры головного мозга у крыс в возрасте 18 месяцев приводит к снижению вклада IKCa-каналов в поддержание тонуса пиальных артериальных сосудов, которое сохраняется на протяжении первых 14 дней после ишемического воздействия. Также снижается вклад IKCa-каналов в осуществление АХ-опосредованных дилататорных реакций. Это явление наблюдается уже через 7 дней после И/Р, а через 14 дней IKCa-каналы практически не участвуют в дилататорном ответе пиальных артерий на АХ. Обнаруженные нами постишемические изменения IKCa-сигнализации у стареющих животных могут являться причиной нарушения эндотелий-зависимой вазодилатации и возникновения вазоспастических реакций, а также фактором риска развития повторных ишемических повреждений головного мозга.
Список литературы
Davis CM, Siler DA, Alkayed NJ (2011) Endothelium-derived hyperpolarizing factor in the brain: influence of sex, vessel size and disease state. Womens Health (Lond) 7(3): 293–303. https://doi.org/10.2217/whe.11.26
Ma J, Ma Y, Shuaib A, Winship IR (2020) Impaired collateral flow in pial arterioles of aged rats during ischemic stroke. Transl Stroke Res 11(2): 243–253. https://doi.org/10.1007/s12975-019-00710-1
Yang Q, He GW, Underwood MJ, Yu CM (2016) Cellular and molecular mechanisms of endothelial ischemia/reperfusion injury: perspectives and implications for postischemic myocardial protection. Am J Transl Res 8(2): 765–777.
Goto K, Ohtsubo T, Kitazono T (2018) Endothelium-dependent hyperpolarization (EDH) in hypertension: The role of endothelial ion channels. Int J Mol Sci 19(1): 315. https://doi.org/10.3390/ijms19010315
Tano JY, Gollasch M (2014) Calcium-activated potassium channels in ischemia reperfusion: a brief update. Front Physiol 5: 381. https://doi.org/10.3389/fphys.2014.00381
Hakim MA, Chum PP, Buchholz JN, Behringer EJ (2020) Aging alters cerebrovascular endothelial GPCR and K+ channel function: divergent role of biological sex. J Gerontol A Biol Sci Med Sci 75(11): 2064–2073. https://doi.org/10.1093/gerona/glz275
Garland CJ, Bagher P, Powell C, Ye X, Lemmey HAL, Borysova L, Dora KA (2017) Voltage-dependent Ca2+ entry into smooth muscle during contraction promotes endothelium-mediated feedback vasodilationin arterioles. Sci Signal 10: eall3806.https://doi.org/10.1126/scisignal.aal3806
Dong P, Zhao J, Zhang Y, Dong J, Zhang L, Li D, Li L, Zhang X, Yang B, Lei W (2014) Aging causes exacerbated ischemic brain injury and failure of sevoflurane post-conditioning: role of B-cell lymphoma-2. Neuroscience 275: 2–11. https://doi.org/10.1016/j.neuroscience.2014.05.064
Tang Y, Wang L, Wang J, Lin X, Wang Y, Jin K, Yang GY (2016) Ischemia-induced angiogenesis is attenuated in aged rats. Aging Dis 7: 326–335. https://doi.org/10.14336/AD.2015.1125
Gorshkova OP, Shuvaeva VN (2020) Age1related changes in the role of calcium1activated potassium channels in acetylcholine mediated dilatation of pial arterial vessels in rats. J Evol Biochem Physiol 56(2): 145–152. https://doi.org/10.1134/S0022093020020064
Izzo C, Carrizzo A, Alfano A, Virtuoso N, Capunzo M, Calabrese M, De Simone E, Sciarretta S, Frati G, Oliveti M, Damato A, Ambrosio M, De Caro F, Remondelli P, Vecchione C (2018) The impact of aging on cardio and cerebrovascular diseases. Int J Mol Sci 19(2): 481. https://doi.org/10.3390/ijms19020481
Winship IR (2015) Cerebral collaterals and collateral therapeutics for acute ischemic stroke. Microcirculation 22(3): 228–236. https://doi.org/10.1111/micc.12177
Van der Worp HB, Van Gijn J (2007) Acute ischemic stroke. New England J Med 357(6): 572–579. https://doi.org/10.1056/NEJMcp072057
Lensman M, Korzhevskii D, Mourovets VO, Kostkin V, Izvarina N, Perasso L, Gandolfo C, Otellin V, Polenov S, Balestrino M (2006) Intracerebroventricular administration of creatine protects against damage by global cerebral ischemia in rat. Brain Res 1114 (1): 187–194. https://doi.org/10.1016/j.brainres.2006.06.103
Behringer EJ, Hakim MA (2019) Functional interaction among KCa and TRP channels for cardiovascular physiology: modern perspectives on aging and chronic disease. Int J Mol Sci 20(6): 1380. https://doi.org/10.3390/ijms20061380
Cipolla MJ, Smith J, Kohlmeyer MM, Godfrey JA (2009) SKCa and IKCa channels, myogenic tone, and vasodilator responses in middle cerebral arteries and parenchymal arterioles: effect of ischemia and reperfusion. Stroke 40(4): 1451–1457. https://doi.org/10.1161/STROKEAHA.108.535435
Shimokawa H, Yasutake H, Fujii K, Owada MK, Nakaike R, Fukumoto Y, Takayanagi T, Nagao T, Egashira K, Fujishima M, Takeshita A (1996) The importance of the hyperpolarizing mechanism increases as the vessel size decreases in endothelium-dependent relaxations in rat mesenteric circulation. J Cardiovasc Pharmacol 28(5): 703–711.https://doi.org/10.1097/00005344-199611000-00014
Горшкова ОП, Шуваева ВН, Ленцман МВ, Артемьева АИ (2016) Постишемические изменения вазомоторной функции эндотелия. Совр пробл науки и образов 5. URL: http://science-education.ru/ru/article/view?id=25270 (дата обращения: 09.01.2022). [Gorshkova OP, Shuvaeva VN, Lentsman MV, Artemyeva AI (2016) Postischemic changes in the vasomotor function of the endothelium. Modern Probl Sci and Educat 5. URL: http://science-education.ru/ru/article/view?id=25270 (accessed: 09.01.2022). (In Russ)].
Dabertrand F, Nelson MT, Brayden JE (2012) Acidosis dilates brain parenchymal arterioles by conversion of calcium waves to sparks to activate BK channels. Circ Res 110(2): 285–294 https://doi.org/10.1161/CIRCRESAHA.111.258145
Li Y, Lapina N, Weinzierl N, Schilling L (2018) Enhancement of bradykinin-induced relaxation by focal brain ischemia in the rat middle cerebral artery: receptor expression upregulation and activation of multiple pathways. PLoS One 13(6): e0198553. https://doi.org/10.1371/journal.pone.0198553
Marrelli SP (2002) Altered endothelial Ca2+ regulation after ischemia/reperfusion produces potentiated endothelium-derived hyperpolarizing factor-mediated dilations. Stroke 33(9): 2285–2291. https://doi.org/10.1161/01.str.0000027439.61501.39
Palomares SM, Cipolla MJ (2011) Vascular protection following cerebral ischemia and reperfusion. J Neurol Neurophysiol 2011: S1-004. https://doi.org/10.4172/2155-9562.s1-004
Wulff H, Gutman GA, Cahalan MD, Chandy KG (2001) Delineation of the clotrimazole/TRAM-34 binding site on the intermediate conductance calcium-activated potassium channel, IKCa1. J Biol Chem 276: 32040-5. https://doi.org/10.1074/jbc.M105231200
Cipolla MJ, Bullinger LV (2008) Reactivity of brain parenchymal arterioles after ischemia and reperfusion. Microcirculation 15(6): 495–501. https://doi.org/10.1080/10739680801986742
Kalogeris T, Baines CP, Krenz M, Korthuis RJ (2016) Ischemia/reperfusion. Compr Physiol 7(1): 113–170. https://doi.org/10.1002/cphy.c160006
Sonkusare SK, Dalsgaard T, Bonev AD, Nelson MT (2016) Inward rectifier potassium (Kir2.1) channels as end-stage boosters of endothelium-dependent vasodilators. J Physiol 594(12): 3271–3285. https://doi.org/10.1113/JP271652
Dora KA, Gallagher NT, McNeish A, Garland CJ (2008) Modulation of endothelial cell KCa3.1 channels during endothelium-derived hyperpolarizing factor signaling in mesenteric resistance arteries. Circ Res 102: 1247–1255. https://doi.org/10.1161/CIRCRESAHA.108.172379
Mozaffari MS, Liu JY, Abebe W, Baban B (2013) Mechanisms of load dependency of myocardial ischemia reperfusion injury. Am J Cardiovasc Dis 3(4): 180–196.
Behringer EJ, Shaw R.L, Westcott EB, Socha MJ, Segal SS (2013) Aging impairs electrical conduction along endothelium of resistance arteries through enhanced Ca2+-activated K+ channel activation. Arterioscler Thromb Vasc Biol 33(8): 1892–1901. https:|//doi.org/ https://doi.org/10.1161/ATVBAHA.113.301514
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


