Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 5, стр. 686-696
Влияние индуктора нейровоспаления на компоненты нейроваскулярной единицы головного мозга in vitro
Е. В. Стельмашук 1, М. Р. Капкаева 1, Н. А. Розанова 1, О. П. Александрова 1, Е. Е. Генрихс 1, В. В. Обмолов 1, 2, С. В. Новикова 1, Н. К. Исаев 1, 2, *
1 Научный центр неврологии
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: nisaev61@mail.ru
Поступила в редакцию 15.02.2022
После доработки 05.04.2022
Принята к публикации 06.04.2022
- EDN: MVDJJT
- DOI: 10.31857/S0869813922050107
Аннотация
Существует тесная связь капилляров мозга с функциональной нагрузкой нейронов и глиальных клеток, что позволяет рассматривать их как единый структурно-функциональный комплекс – нейроваскулярную единицу. Изучено влияние липополисахарида (ЛПС, 5–30 мкг/мл, 24 ч) на продукцию оксида азота и действие менадиона (5–50 мкМ, 24 ч) на жизнеспособность клеток в культурах зернистых нейронов, клеток эндотелия коры головного мозга и астроцитов, оценен митохондрион в разных типах клеток. Найдено, что применение 5 мкг/мл ЛПС вызывало интенсивную продукцию оксида азота в клеточных культурах. Наибольший эффект был показан для астроцитов, в которых ЛПС вызывал достоверное увеличение продукции оксида азота более, чем в 8 раз. В культурах зернистых нейронов данное воздействие вызывало увеличение продукции оксида азота почти в 5 раз. Самый слабый ответ на стимуляцию продукции оксида азота был показан для клеток эндотелия – в 1.7 раза. Для индукции окислительного повреждения в среду культивирования вносили менадион. 10 мкМ менадиона было достаточно для полной гибели зернистых нейронов. Повреждение клеток эндотелия и астроцитов наблюдалось только при повышении концентрации менадиона до 50 мкМ. Так как окислительный стресс при действии менадиона опосредован митохондриями, была выполнена оценка митохондриона в интактных клетках. Показано, что в астроцитах и эндотелии митохондрии многочисленны и представляют собой длинные изогнутые тяжи, тогда как в зернистых нейронах эти органеллы гораздо мельче по размеру, округлой формы. Таким образом, в нейроваскулярной единице головного мозга при развитии нейровоспаления главными продуцентами оксида азота являются астроциты, а наиболее чувствительными к окислительному стрессу, несмотря на относительно слабое развитие митохондриона, являются нейроны, при этом клетки церебрального эндотелия демонстрируют минимальный вклад в продукцию оксида азота.
Головной мозг обладает высокой интенсивностью потребления кислорода и глюкозы по сравнению с другими органами, и его функционирование очень зависимо от притока глюкозы из крови. Это связано прежде всего с тем, что собственные запасы данного углевода в ткани мозга незначительны. Следовательно, нормальная деятельность головного мозга невозможна без эффективной работы систем, обеспечивающих этот орган кислородом и глюкозой, что выполняется капиллярным звеном сосудистой системы, находящейся в тесном взаимодействии с различными клетками нервной системы. То есть существует тесная связь капилляров мозга с функциональной нагрузкой нейронов и глиальных клеток, что позволяет рассматривать их как единый структурно-функциональный комплекс – нейроваскулярную единицу [1]. Современные фактические данные подтверждают концепцию “сосудисто-нервного комплекса”, состоящего из сегментарно разнообразных функциональных модулей, которые реализуют скоординированные сосудистые реакции в ответ на центральные и периферические сигналы для поддержания гомеостаза мозга [2]. Сложная связь между нервными и сосудистыми структурами необходима для быстрого и точного соответствия кровотока метаболизму нейронов в центральной нервной системе.
Поддержание сохранности нейроваскулярной единицы и корректное взаимодействие ее составляющих является основой функционирования головного мозга. Исключительность нейроваскулярной единицы в поддержании метаболизма всех церебральных процессов обосновывает облигатность ее участия в патофизиологии обширной группы неврологических заболеваний и патологических состояний головного мозга. В настоящее время показано сходство структурных изменений в нейроваскулярной единице на ранних стадиях старения и гипертензивной церебральной микроангиопатии, что позволяет предполагать единство патогенетических механизмов повреждения нейроваскулярной единицы при разных типах патологических процессов [3]. Поэтому изучение структуры, клеточных и молекулярных механизмов физиологического и патофизиологического функционирования нейроваскулярной единицы является крайне важным и необходимым для понимания возможностей здорового, стареющего и измененного при заболеваниях головного мозга.
Нарушение сосудисто-нервной координации наблюдается при различных заболеваниях головного мозга, связанных с воспалением и окислительным стрессом, таких как инфекционные заболевания, инсульт, сосудистая деменция и рассеянный склероз. Воспалительные реакции, возникающие в результате инфекций или повреждений головного мозга, а также при нейродегенерации, активируют эндотелий и глиальные клетки в различной степени в зависимости от типа, титра или силы и продолжительности воздействия агентов [4]. В физиологических и патологических условиях один из газовых трансмиттеров – оксид азота – выступает в качестве медиатора межклеточных взаимодействий в нейроваскулярной единице головного мозга. Известно, что различные клетки, входящие в состав нейроваскулярной единицы, способны продуцировать оксид азота, что показано для нейронов [5], астроцитов [6], клеток церебрального эндотелия [7]. Продукция оксида азота существенно меняется при нейродегенерации и нейровоспалении, что определяет не только изменения микроциркуляции, но и вносит вклад в развитие нитрозативного и окислительного стресса и образование нитрозилированных по тирозину белков, запускающих механизмы аберрантной сигнальной трансдукции и мисфолдинга [8, 9]. Однако остается неясным, какой вклад клетки нейроваскулярной единицы вносят в такие эффекты, что не позволяет идентифицировать потенциальные клетки-мишени для фармакологической коррекции. Для исследования этого вопроса были использованы первичные культуры, так как исследование NO-сигналинга в нейроваскулярной единице на отдельных культурах изолированных клеток является необходимым этапом изучения этого процесса в нейроваскулярной единице.
Задачей настоящей работы было исследование уровня продукции оксида азота основными клеточными компонентами нейроваскулярной единицы при моделировании воспаления с помощью липополисахарида in vitro, а также определение и сравнение их чувствительности к окислительному стрессу.
МЕТОДЫ ИССЛЕДОВАНИЯ
Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям локального этического комитета ФГБНУ НЦН (протокол № 12-16/19 от 25.12.2019 г.).
В работе использованы монослойные диссоциированные культуры эндотелия, астроцитов и зернистых нейронов головного мозга крыс линии Wistar.
Эндотелиальные культуры получали по описанному ранее методу [10]. У анестезированных и стерилизованных 14-дневных крыс извлекали головной мозг и перекатывали по стерильной фильтровальной бумаге для удаления оболочек. После удаления крупных кровеносных сосудов и белого вещества кору больших полушарий промывали несколько раз холодным раствором Хенкса (HBSS, Gibco Life Technologies, Великобритания), измельчали и центрифугировали 5 мин при 1000 об./мин. К осадку доливали 25%-ный бычий сывороточный альбумин (BSA, Sigma, США) в объеме, в 2 раза превышающим объем осадка, и пипетировали 25–30 раз движениями вверх и вниз с помощью пастеровской пипетки. Гомогенат центрифугировали 10 мин при 2000 об./мин. Надосадок пипетировали повторно 25–30 раз и центрифугировали. К осадку добавляли 0.1%-ный раствор коллагеназы (Sigma-Aldrich, США) на фосфатном буфере (Gibco Life Technologies, США) на 40 мин при 37°С. Ферментированные микрососуды центрифугировали 5 мин при 1000 об./мин. Осадок ресуспендировали в среде культивирования, содержащей 80% модифицированной среды Игла (DMEM-F12, GIBCO Invitrogen Corporation, США), 20% эмбриональной телячьей сыворотки (HyClone, Австрия), 2 мМ глутамина (glutaMAX, Gibco, Великобритания), 16.6 мМ глюкозы, и высаживали на пластиковую чашку Петри диаметром 40 мм (Медполимер, Россия). Дважды в неделю производили смену среды культивирования. В методе применяется длительное пипетирование и центрифугирование, что приводит к гибели большей части клеток глии, поэтому нет необходимости в химическом подавлении роста астроцитов.
Диссоциированную культуру астроцитов получали из 1-дневных, а нейронов мозжечка – из 7-дневных крыс, методом ферментно-механической диссоциации по ранее описанной методике [11, 12]. Выделенные структуры промывали фосфатным буфером (Gibco Life Technologies, США), лишенным ионов кальция и магния, измельчали скальпелем и инкубировали 15 мин при 37°C в 0.05%-ном растворе трипсина и 0.02%-ном растворе ЭДТА (Gibco Life Technologies, США), промывали в двух сменах фосфатного буфера и один раз средой и диссоциировали механически ступенчатым пипетированием в среде культивирования. Суспензию клеток центрифугировали 3 мин при 1000 об./мин, осадок ресуспендировали в питательной среде и высаживали на культуральный пластик, покрытый полилизином (Sigma, США). Питательная среда содержала 90% минимальной среды Игла на солях Эрла (МЕМ Gibco, Великобритания), 10% эмбриональной телячьей сыворотки (Hy Clone, Великобритания), 2 мМ глутамакса (Gibco, Великобритания), 10 мМ буфера НЕРЕS (Sigma, США). После образования монослоя эндотелиальные и астроцитарные культуры пересаживали в 96-луночные пластиковые планшеты (Eppendorf, Германия) и работали на 1 пассаже после образования монослоя. Культивированные нейроны мозжечка высаживали сразу в 96-луночные пластиковые планшеты (Eppendorf, Германия): в каждую лунку добавляли по 0.1 мл суспензии клеток, создавая конечную плотность 3–5 × 103 клеток на мм2. На 2-е сутки in vitro концентрацию KCl в среде доводили до 25 мМ, что является трофическим фактором для данного вида культур [13]. Для предотвращения пролиферации клеток глии в среду добавляли 0.001 мМ цитозин-арабинозида.
Временной паттерн экспериментов в работе обусловлен временем развития культур – достижения монослоя астроцитами или эндотелиальными клетками, созревания рецепторов нейронов. Эксперименты на культивированных нейронах проводили на 7-й день. Культуры развивались в СО2-инкубаторе (“Nuaire”, 5% СО2, 95% воздуха), при температуре 35.5°С и относительной влажности 98%.
Культуры подвергали окислительному стрессу, который индуцировали добавлением в питательную среду менадиона (витамин К3, 2.5–50 мкМ, 24 ч, Sigma, США), а воспаление вызывали липополисахаридом (5–30 мкМ, 24 ч, ЛПС, Sigma, США). Прижизненные наблюдения за состоянием культур проводили с помощью фазово-контрастной микроскопии, используя инвертированный микроскоп “Olympus CKX41” (Япония) или систему визуализации изображения “EVOS M7000” (Termo Fisher Scientific, США). Уровень оксида азота определяли методом Грисса (Sigma-Aldrich, США), основанном на получении диазосоединений, которые в результате реакции с альфа-нафтиламином окрашивают раствор в красный цвет. Фотометрию выполняли с помощью микропланшетного сканера (SpectraMax M2, Molecular Devices, США) при 540 нм. Выявление морфологии митохондрий проводили при окраске эфиром тетраметилродамина (ТМРЭ, 250 нМ, 15 мин, Sigma, США) с помощью конфокального микроскопа Olympus IX71 (Япония) со встроенными спиннинг-диском, объективом ×100 и лазером OBIS (США), управляемого программой Coherent Connection 3. Флуоресцентные изображения клеток были сделаны с излучением при 590 нм и возбуждением при 560 нм. Для этих экспериментов клетки культивировались на чашках Петри со стеклянным дном диаметром 35 × 10 мм (Eppendorf, Германия).
Для статистической обработки данных использовали программу Statistiсa 13.3 (StatSoft, Inc), однофакторный дисперсионный анализ ANOVA с посттестом Dunnett при сравнении с контролем или Bonferroni при попарном сравнении. Отличия между группами считали статистически значимыми при p < 0.05. Результаты выражали как среднее с ошибкой среднего (M ± SEM).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
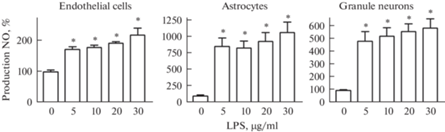
Для моделирования процесса воспаления в среду культивирования астроцитов, клеток эндотелия и зернистых нейронов мозжечка на 24 ч вносили ЛПС. Результаты экспериментов показали, что по сравнению с контролем во всех культурах данное воздействие вызывало достоверное повышение продукции оксида азота при всех использованных концентрациях (рис. 1). Наибольший эффект был показан для культивированных астроцитов, в которых ЛПС в концентрации 5 мкг/мл вызывал увеличение продукции оксида азота более чем в 8 раз (рис. 1). В культурах зернистых нейронов данное воздействие вызывало увеличение продукции оксида азота почти в 5 раз (рис. 1) при такой же концентрации ЛПС. Самый слабый ответ на стимуляцию продукции клетками оксида азота был показан для клеток эндотелия. Продукция оксида азота в этом случае возрастала только в 1.7 раза (рис. 1). Следовательно, для стимуляции выраженного роста оксида азота во всех типах культур достаточно использовать ЛПС в концентрации 5 мкг/мл.
Рис. 1.
Интенсивность выработки оксида азота в культивированных эндотелиальных клетках (Endothelial cells), астроцитах (Astrocytes) и зернистых нейронах (Granule neurons) при стимуляции воспаления липополисахаридом (LPS). По оси абсцисс отложена концентрация липополисахарида в мкг в мл среды культивирования. По оси ординат – продукция оксида азота (Production NO) в процентах относительно контроля. * p < 0.01 по сравнению с контролем (0).
Известно, что воспалительный процесс сопровождается повышением уровня лактата. В последующих экспериментах вместе с ЛПС (5 мкг/мл, 24 ч) в среду культивирования астроцитов, нейронов и эндотелиальных клеток вносили 5 мМ лактата натрия. Однако достоверного влияния лактата на продукцию оксида азота во всех типах культур не было обнаружено, как в контроле, так и во время действия ЛПС (рис. 2).
Рис. 2.
Интенсивность выработки оксида азота в культивированных эндотелиальных клетках (Endothelial cells), астроцитах (Astrocytes) и зернистых нейронах (Granule neurons). По оси ординат отложена продукция оксида азота (Production NO) в процентах относительно исходного уровня. На оси абсцисс отмечено наличие добавок в среде культивирования: отсутствие (–), при добавлении лактата (5 мМ, Lactate, +) или липополисахарида (LPS, 5 мкг/мл, +).

Для индукции окислительного повреждения в среду культивирования вносили менадион (VK3) на 24 ч. Результаты экспериментов показали, что 10 мкМ менадиона было уже достаточно для полной гибели всех зернистых нейронов в культурах (рис. 3). В норме (Control) зернистые нейроны легко идентифицировать прижизненно как небольшие, 7–10 мкм в диаметре, округлые или овальные клетки, большую часть тел которых занимает ядро, окруженное тонким ободком цитоплазмы. При токсическом воздействии первоначально происходит отек цитоплазмы, в дальнейшем – конденсация хроматина ядра и лизис клетки, которая погибает с образованием пикнотического ядра (3–4 мкм). Пикнотические ядра погибших нейронов видны при фазовом контрасте на правой части рис. 3 как яркие точки.
Рис. 3.
Влияние менадиона (VK3, 24 ч) на жизнеспособность культивированных эндотелиальных клеток (Endothelial cells), астроцитов (Astrocytes) и зернистых нейронов (Granule neurons). Фазовый контраст. Живые культуры. Масштабный отрезок 70 мкм.
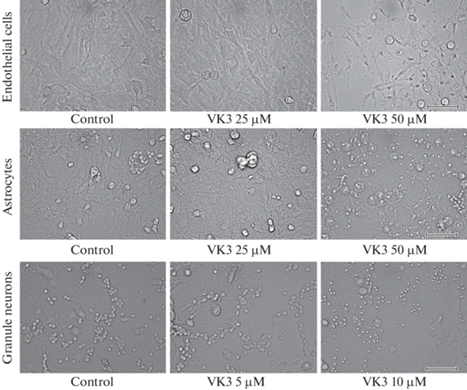
Клетки эндотелия и астроциты оказались значительно более устойчивы к окислительному стрессу. Это довольно крупные распластанные по субстрату клетки, образующие монослой. Повреждение клеток в этих культурах наблюдалось только при повышении концентрации менадиона до 50 мкМ. В таких условиях снижается распластанность клеток, и они сжимаются, некоторые клетки ошариваются и, в конечном итоге, их ядра становятся пикнотическими (правые микрофотографии на рис. 3).
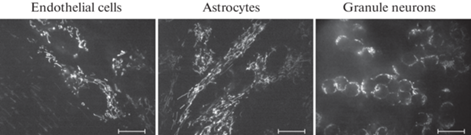
Оценка митохондриона в интактных клетках контрольных культур показала, что в астроцитах и эндотелии митохондрии многочисленны и представляют собой длинные изогнутые тяжи, тогда как в зернистых нейронах эти органеллы гораздо мельче по размеру, вблизи ядра округлые, палочковидные в отростках, и не обладают нитевидной морфологией, как в астроцитах и эндотелии (рис. 4).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В головном мозге существует тесная функциональная связь капилляров с функциональной нагрузкой нейронов и глиальных клеток, что позволяет рассматривать их как единый структурно-функциональный комплекс – нейроваскулярную единицу [1]. Даже незначительные нарушения в нейроваскулярной единице могут в некоторых случаях необратимо повлиять на гомеостаз головного мозга. В настоящее время показано, что астроциты являются ключевыми посредниками в системе модуляции сосудистого тонуса головного мозга. Одним из механизмов этого сигналинга при стимуляции нейронов является высвобождение астроцитами АТФ и ее метаболитов, способствующих выработке эндотелиального оксида азота и расширению сосудов [14]. Кинетика и эффективность этих сигналов, в свою очередь, определяются метаболическим состоянием ткани, уровнем тонуса базальных артериол и/или величиной и типом вызванного стимула [15]. Возможно и самостоятельное участие нейронов в гиперемии. Например, внутри нейрона, активированного глутаматом, усиливаются синтез и выделение во внеклеточную среду оксида азота, а также АТФ и аденозина, которые могут прямо воздействовать на гладкомышечные клетки [16]. Таким образом, в нейроваскулярной единице при стимуляции нейронов главными продуцентами оксида азота являются клетки эндотелия и нейроны, но не астроциты. Однако известно, что астроциты и клетки эндотелия при стимуляции ЛПС могут продуцировать оксид азота [17–19]. Полисахаридная модель является наиболее характеризованной моделью воспаления in vitro, в которой в ряде первичных культур медиатором воспаления является оксид азота. В нашей работе мы показали, что при стимуляции ЛПС именно астроциты гораздо более интенсивно продуцируют оксид азота по сравнению с клетками эндотелия и нейронами. Полученные нами результаты подтверждаются данными Wong с соавт. [17], которые демонстрируют, что первичные культуры клеток эндотелия мозга при стимуляции ЛПС продуцируют низкий уровень оксид азота.
Таким образом, наше исследование указывает, что при патологических воспалительных процессах в нейроваскулярной единице одним из главных продуцентов оксида азота являются астроциты, но не клетки эндотелия и нейроны. Это заключение подтверждается тем, что астроциты считаются одними из ключевых фигур в инициировании воспалительной реакции в головном мозге. Эти клетки ЦНС могут повлиять на локальную микросреду и, таким образом, определить степень повреждения и последующего восстановления [20].
Кроме того, известно, что воспалительный процесс сопровождается повышением уровня лактата [21]. Лактат, будучи продуктом гликолиза, выполняет свои функции не только в качестве энергетического субстрата для нейронов, но может осуществлять и некоторые другие функции. Так, лактат, посредством взаимодействия с рецептором HCAR1 на клетках церебрального эндотелия, способен вызывать ингибирование процессов воспаления [22 ] . Снижение экспрессии рецепторов и транспорта лактата на церебральных эндотелиоцитах и сопутствующее повышение концентрации внеклеточного лактата регистрируются в первичной культуре клеток эндотелия микрососудов головного мозга под воздействием ЛПС и PolyI:C [23]. Однако в нашей модельной системе мы не обнаружили влияния лактата на продукцию оксида азота клеточными культурами астроцитов, эндотелия и нейронов.
Еще одним патогенетически значимым фактором, способным нарушать функционирование нейроваскулярной единицы, является окислительный стресс. Поэтому в ряде экспериментов мы оценивали устойчивость к этому повреждению элементов нейроваскулярной единицы. Одним из главных источников свободных радикалов в клетке являются митохондрии. Комплексы I и III дыхательной цепи митохондрий продуцируют радикалы в виде супероксид-аниона и перекиси водорода, которые играют роль сигнальных молекул, необходимых для дифференцировки клеток, пролиферации, их выживания и адаптивных иммунных реакций. Почти все образующиеся анионы супероксида эффективно нейтрализуются супероксиддисмутазой с образованием перекиси водорода, которая служит важным предшественником для других свободных радикалов и действует как вторичный посредник со способностью диффундировать через митохондриальную мембрану, взаимодействуя со специализированным белком из семейства аквапоринов [24]. Однако в поврежденных митохондриях продукция свободных радикалов может многократно возрастать, вызывая повреждение клетки. Моделировать этот процесс можно с помощью менадиона. Внутри клетки менадион вызывает окислительный стресс за счет способности принимать электроны от DT-диафоразы, минуя комплекс I, что перенаправляет поток электронов от NADH непосредственно в Q-цикл [25], тем самым повышая утечку электронов с цепи переноса, и как следствие, наблюдается возрастание продукции супероксид-аниона. По данным Bayol-Denizot с соавт. [26], нейроны продуцируют достоверно меньше супероксида при действии менадиона по сравнению с эндотелиальными клетками, тогда как астроциты и эндотелий продуцируют приблизительно одинаковое количество супероксида. Так как продукция супероксида при метаболизме менадиона осуществляется митохондриями, уровень генерации этих активных молекул коррелируют с величиной митохондриона в клетках и уровнем мембранного потенциала митохондрий. По приведенным нами в этой работе данным митохондрион имеет наименьшую величину в нейронах и гораздо большие размеры в астроцитах и эндотелиальных клетках (рис. 4). По сравнению с периферическими сосудами для клеток эндотелия головного мозга характерно большое количество и высокая активность митохондрий. Видимо, это необходимо, чтобы функционировали многочисленные системы активного транспорта, такие как GLUT1, P-гликопротеин и т.д. [27]. Однако наиболее чувствительными к окислительному стрессу, вызванному менадионом, оказались нейроны. Результаты экспериментов показали, что 10 мкМ менадиона было уже достаточно для гибели всех зернистых нейронов в культурах, тогда как повреждение клеток эндотелия и астроцитов наблюдалось при повышении концентрации менадиона до 50 мкМ.
Повышенная чувствительность к окислительному стрессу, вызванному менадионом, зернистых нейронов объясняется тем, что они являются глутаматергическими и глутаматчувствительными нейронами (имеют рецепторы к этому нейромедиатору). Окислительный стресс, в свою очередь, приводит к высвобождению эндогенного глутамата, чрезмерной стимуляции рецепторов глутамата и гибели нейронов [28]. Более того, окислительный стресс, вызванный паракватом, является сильным фактором, модулирующим повреждение незрелых нейронов глутаматом [29].
В целом, в нейроваскулярной единице головного мозга при развитии нейровоспаления главными продуцентами оксида азота являются астроциты, а наиболее чувствительными к окислительному стрессу, несмотря на относительно слабое развитие митохондриона, являются нейроны, при этом клетки церебрального эндотелия демонстрируют минимальный вклад в продукцию оксида азота.
Список литературы
Peters APS, Webster HD (1991) The Fine Structure of the Nervous System. New York: Oxford Univer Press 1991.
Schaeffer S, Iadecola C (2021) Revisiting the neurovascular unit. Nat Neurosci 24(9): 1198–1209. https://doi.org/10.1038/s41593-021-00904-7
Dobrynina LA (2018) Neurovascular coupling and cerebral perfusion in aging, cerebral microangiopathy and Alzheimer’s diseases. Ann Clin Exp Neurol 12(5): 87–94. https://doi.org/10.25692/ACEN.2018.5.11
Han HS, Suk K (2005) The function and integrity of the neurovascular unit rests upon the integration of the vascular and inflammatory cell systems. Curr Neurovasc Res 2(5): 409–423. https://doi.org/10.2174/156720205774962647
Tricoire L, Vitalis T (2012) Neuronal nitric oxide synthase expressing neurons: a journey from birth to neuronal circuits. Front Neural Circuits 6: 82. https://doi.org/10.3389/fncir.2012.00082
Buskila Y, Farkash S, Hershfinkel M, Amitai Y (2005) Rapid and reactive nitric oxide production by astrocytes in mouse neocortical slices. Glia 52(3): 169–176. https://doi.org/10.1002/glia.20217
Ko AR, Kim JY, Hyun HW, Kim JE (2015) Endothelial NOS activation induces the blood-brain barrier disruption via ER stress following status epilepticus. Brain Res 1622: 163–173. https://doi.org/10.1016/j.brainres.2015.06.020
Salmina AB, Komleva YK, Szijártó IA, Gorina YV, Lopatina OL, Gertsog GE, Filipovic MR, Gollasch M (2015) H2S- and NO-Signaling Pathways in Alzheimer’s Amyloid Vasculopathy: Synergism or Antagonism? Front Physiol 6: 361. https://doi.org/10.3389/fphys.2015.00361
Picón-Pagès P, Garcia-Buendia J, Muñoz FJ (2019) Functions and dysfunctions of nitric oxide in brain. Biochim Biophys Acta Mol Basis Dis 1865(8): 1949–1967. https://doi.org/10.1016/j.bbadis.2018.11.007
Liu Y, Xue Q, Tang Q, Hou M, Qi H, Chen G, Chen W, Zhang J, Chen Y, Xu X (2013) A simple method for isolating and culturing the rat brain microvascular endothelial cells. Microvasc Res 90: 199–205. https://doi.org/10.1016/j.mvr.2013.08.004
Weikert S, Freyer D, Weih M, Isaev N, Busch C, Schultze J, Megow D, Dirnagl U (1997) Rapid Ca2+-dependent NO-production from central nervous system cells in culture measured by NO-nitrite/ozone chemoluminescence. Brain Res 748(1–2): 1–11. https://doi.org/10.1016/s0006-8993(96)01241-3
Stelmashook EV, Novikova SV, Isaev NK (2010) Glutamine effect on cultured granule neuron death induced by glucose deprivation and chemical hypoxia. Biochemistry (Mosc) 75(8): 1039–1044. https://doi.org/10.1134/s0006297910080134
Favaron M, Manev RM, Rimland JM, Candeo P, Beccaro M, Manev H (1993) NMDA-stimulated expression of BDNF mRNA in cultured cerebellar granule neurones. Neuroreport 4(10): 1171–1174. PMID: 8106000
Toth P, Tarantini S, Davila A, Valcarcel-Ares MN, Tucsek Z, Varamini B, Ballabh P, Sonntag WE, Baur JA, Csiszar A, Ungvari Z (2015) Purinergic glio-endothelial coupling during neuronal activity: role of P2Y1 receptors and eNOS in functional hyperemia in the mouse somatosensory cortex. Am J Physiol Heart Circ Physiol 309(11): H1837–H1845. https://doi.org/10.1152/ajpheart.00463.2015
McConnell HL, Li Z, Woltjer RL, Mishra A (2019) Astrocyte dysfunction and neurovascular impairment in neurological disorders: Correlation or causation? Neurochem Int 128: 70–84. https://doi.org/10.1016/j.neuint.2019.04.005
Kisler K, Nelson AR, Montagne A, Zlokovic BV (2017) Cerebral blood flow regulation and neurovascular dysfunction in Alzheimer disease. Nat Rev Neurosci 18(7): 419–434. https://doi.org/10.1038/nrn.2017.48
Wong D, Dorovini-Zis K, Vincent SR (2004) Cytokines, nitric oxide, and cGMP modulate the permeability of an in vitro model of the human blood-brain barrier. Exp Neurol 190(2): 446–455. https://doi.org/10.1016/j.expneurol.2004.08.008
Cantarella G, Lempereur L, D’Alcamo MA, Risuglia N, Cardile V, Pennisi G, Scoto GM, Bernardini R (2007) Trail interacts redundantly with nitric oxide in rat astrocytes: potential contribution to neurodegenerative processes. J Neuroimmunol 182(1–2): 41–47. https://doi.org/10.1016/j.jneuroim.2006.09.007
Arias-Salvatierra D, Silbergeld EK, Acosta-Saavedra LC, Calderon-Aranda ES (2011) Role of nitric oxide produced by iNOS through NF-κB pathway in migration of cerebellar granule neurons induced by Lipopolysaccharide. Cell Signal 23(2): 425–435. https://doi.org/10.1016/j.cellsig.2010.10.017
Karve IP, Taylor JM, Crack PJ (2016) The contribution of astrocytes and microglia to traumatic brain injury. Br J Pharmacol 173(4): 692–702. https://doi.org/10.1111/bph.13125
Shih MT, Singh AK, Wang AM, Patel S (2004) Brain lesions with elevated lactic acid peaks on magnetic resonance spectroscopy. Curr Probl Diagn Radiol 33(2): 85–95. https://doi.org/10.1016/j.cpradiol.2003.11.002
Boitsova EB, Morgun AV, Osipova ED, Pozhilenkova EA, Martinova GP, Frolova OV, Olovannikova RY, Tohidpour A, Gorina YV, Panina YA, Salmina AB (2018) The inhibitory effect of LPS on the expression of GPR81 lactate receptor in blood-brain barrier model in vitro. J Neuroinflammat 15(1): 196. https://doi.org/10.1186/s12974-018-1233-2
Бойцова ЕБ, Моргун АВ, Осипова ЕД, Мартынова ГП, Салмина АБ (2020) Изменение рецепции и транспорта лактата церебральным эндотелием под воздействием индуктора вирусного и бактериального воспаления in vitro. Фундамент клин мед 5(1): 8–14. [Boytsova EB, Morgun AV, Osipova ED, Martinova GP, Salmina AB (2020) Change of reception and lactate transport by cerebral endothelium under the influence of viral and bacterial inflammation in vitro. Fundament Clin Med 5(1): 8–14. (In Russ)]. https://doi.org/10.23946/2500-0764-2020-5-1-8-14
Rinaldi C, Donato L, Alibrandi S, Scimone C, D’Angelo R, Sidoti A (2021) Oxidative Stress and the Neurovascular Unit. Life (Basel) 11(8): 767. https://doi.org/10.3390/life11080767
Isaev NK, Stelmashook EV, Ruscher K, Andreeva NA, Zorov DB (2004) Menadione reduces rotenone-induced cell death in cerebellar granule neurons. Neuroreport 15(14): 2227–2231. https://doi.org/10.1097/00001756-200410050-00017
Bayol-Denizot C, Daval JL, Netter P, Minn A (2000) Xenobiotic-mediated production of superoxide by primary cultures of rat cerebral endothelial cells, astrocytes, and neurones. Biochim Biophys Acta 1497(1): 115–126. https://doi.org/10.1016/s0167-4889(00)00047-1
Huang X, Hussain B, Chang J (2021) Peripheral inflammation and blood-brain barrier disruption: effects and mechanisms. CNS Neurosci Ther 27(1): 36–47. https://doi.org/10.1111/cns.13569
Stelmashook EV, Genrikhs EE, Aleksandrova OP, Amelkina GA, Zelenova EA, Isaev NK (2016) NMDA-Receptors Are Involved in Cu2+/Paraquat-Induced Death of Cultured Cerebellar Granule Neurons. Biochemistry (Mosc) 81(8): 899–905. https://doi.org/10.1134/S0006297916080113
Stelmashook EV, Isaev NK, Zorov DB (2007) Paraquat potentiates glutamate toxicity in immature cultures of cerebellar granule neurons. Toxicol Lett 174(1–3): 82–88. https://doi.org/10.1016/j.toxlet.2007.08.012
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова