Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 5, стр. 677-685
Метил-бета-циклодекстрин изменяет уровень белков плотных контактов в эндотелии сосудов головного мозга
А. Г. Марков 1, *, А. Е. Бикмурзина 1, А. А. Федорова 1, И. И. Кривой 1
1 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: a.markov@spbu.ru
Поступила в редакцию 08.02.2022
После доработки 05.04.2022
Принята к публикации 07.04.2022
- EDN: MNKABP
- DOI: 10.31857/S0869813922050089
Аннотация
Гематоэнцефалический барьер обеспечивает оптимальные условия для функционирования нейронов головного мозга. Барьерные свойства эндотелия кровеносных сосудов мозга определяются белками семейства клаудина и окклюдином, которые являются ключевыми молекулярными детерминантами избирательного межклеточного транспорта. В формировании структуры плотных контактов важная роль принадлежит липидам плазматической мембраны, объединенные в липидный рафт вместе с белками плотных контактов. Развитие нейродегенеративных заболеваний и психиатрических расстройств коррелирует с изменением клаудинов в эндотелии сосудов головного мозга. Исследовали влияние метил-бета-циклодекстрина (МбЦД), который вызывает дестабилизацию липид-упорядоченной фазы плазматической мембраны, на уровень клаудина-1, -5 и окклюдина в ткани мозга крысы. Самцам крыс внутривенно вводился МбЦД в дозе 5 мг/кг массы тела животного, через 30 мин ткань мозга бралась для проведения Вестерн-блота и иммуногистохимии. МбЦД вызывал значительное снижение уровня клаудина-5 в ткани лобных долей мозга крысы. Уровень клаудина-1 и окклюдина оставался без изменений. Иммуногистохимия и анализ изображений на конфокальном лазерном микроскопе подтверждают, что изменение уровня клаудина-5 локализовано в эндотелии кровеносных сосудов. Клаудин-5 вносит основной вклад в непроницаемость эндотелия кровеносных сосудов, поэтому можно предположить, что изменение упорядоченности липидной фазы рафтов может привести к увеличению межклеточной проницаемости. Полученные результаты свидетельствуют о том, что липидное окружение является важным молекулярным компонентом плотных контактов эндотелия кровеносных сосудов головного мозга крысы и может принимать участие в поддержании и регуляции барьерных свойств гематоэнцефалического барьера.
Эндотелий кровеносных сосудов головного мозга является одной из ключевых структур гематоэнцефалического барьера (ГЭБ), который обеспечивает регулируемый транспорт ионов, воды и различных веществ между плазмой крови и паренхимой головного мозга [1, 2]. Функционирование эндотелия сосудов приводит к стабилизации и поддержанию функций нейронов [3, 4], а нарушение целостности ГЭБ вовлечено в патогенез различных нейродегенеративных заболеваний [5, 6]. Плотные контакты представляют собой апикальный комплекс белков, расположенных в плазматических мембранах соседних эндотелиоцитов и взаимодействующих между собой в межклеточном пространстве. Разнообразие белков, составляющих этот комплекс, в первую очередь белков семейства клаудина, обеспечивает селективную парацеллюлярную проницаемость [7, 8]. Молекулярная архитектоника плотных контактов представляется в виде кластеров взаимосвязанных белков [9], образующих с помощью адаптерных белков и протеинкиназ сигнальную платформу [10]. В кластеризации белков плотных контактов плазматической мембраны клеток важную роль играют липиды, объединенные в липидный рафт вместе с клаудинами [11]. Изучение роли липидного окружения в регуляции функций кластеров белков плазматической мембраны проводят с помощью производных циклического олигосахарида – циклодекстрина. Эти соединения вызывают дестабилизацию липид-упорядоченной фазы плазматической мембраны, что приводит к увеличению текучести и проницаемости этих мембран клеток в модельных условиях [12, 13]. В исследованиях in vivo на животных моделях нейродегенеративных заболеваний преимущественно используют 2-гидроксипропил-бета-циклодекстрин [14]. Для анализа роли липидного окружения в плотных контактах используют метил-бета-циклодекстрин (МбЦД) [15, 16].
Данные о роли липидного окружения в формировании эндотелиального барьера кровеносных сосудов мозга на животных ограничены. Известно, что основной вклад в непроницаемость эндотелия сосудов головного мозга вносит клаудин-5 [17]. Развитие психиатрических расстройств коррелирует с изменением клаудина-5 в эндотелии сосудов головного мозга [18, 19]. Данные о влиянии МбЦД на эндотелий сосудов головного мозга ограничиваются единичной статьей, в которой иммуногистохимическим методом показано уменьшение сигнала клаудина-5 в эндотелиоцитах при действии этого соединения [15]. Эти данные требуют подтверждения с помощью других методов, оценивающих уровень белка в эндотелиоцитах. Стоит отметить, что в плотных контактах эндотелия кровеносных сосудов головного мозга представлены различные клаудины. В первичных культурах эндотелиоцитов сосудов мозга мышей и крыс продемонстрировано наличие клаудина-1 [20, 21]. Удаление холестерина с помощью МбЦД из липидных рафтов в линии клеток Сасо-2 свидетельствует о том, что этот белок, в отличие от других клаудинов, не реагирует на дестабилизацию липидного окружения [16]. Этот факт позволяет предположить дифференцированную реакцию белков плотных контактов в эндотелии сосудов головного мозга на МбЦД, что может быть принципиально важно при прогнозировании изменения проницаемости эндотелиального барьера кровеносных сосудов. В то время как клаудины влияют на проницаемость эпителия для ионов, окклюдин востребован для ограничения парацеллюлярного транспорта органических молекул [22]. Окклюдин представлен в плотных контактах эндотелиальных клеток сосудов мозга человека и включен в регуляцию проницаемости этих клеток при действии различных факторов [23, 24]. Цель данного исследования состояла в изучении уровня клаудина-1, -5 и окклюдина в эндотелии сосудов головного мозга крыс при внутривенном введении метил-бета-циклодекстрина.
МЕТОДЫ ИССЛЕДОВАНИЯ
Экспериментальные животные и схема эксперимента. В экспериментах использовали самцов крыс Вистар (масса тела 180–200 г, n = 5). Животных содержали в клетках по пять особей при стабилизированной температуре и фиксированном стандартном освещении (12 ч свет/12 ч темнота). Животных содержали на стандартном рационе питания при свободном доступе к пище и воде. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям Этического комитета по работе с животными Санкт-Петербургского государственного университета.
Для исследования влияния действия МбЦД крысам его вводили внутривенно в дозе 5 мг/кг массы тела животного. Ранее было установлено, что эта доза при внутривенном введении оказывает влияние на структуру плотных контактов кровеносных сосудов мозга [15]. Через 30 мин проводили декапитацию животных на гильотине (OpenScience, Россия). Животным из группы контроля внутривенно вводили такой же объем физиологического раствора. Ткань лобных долей головного мозга замораживали при –80°С для последующего проведения Вестерн-блот анализа, а также фиксировали в 10%-ном забуференном формалине для иммуногистохимии. Пробы для Вестерн-блота и иммуногистохимии брали у всех животных из одной и той же области мозга. Иссекали участок головного мозга перед центральной извилиной, который соответствует моторной зоне коры крысы.
Вестерн-блот. Для проведения Вестерн-блот анализа ткань мозга была гомогенизирована при помощи механического гомогенизатора Retsch MM 400 (Retsch, Германия) с добавлением лизирующего буфера RIPA (25 мМ HEPES (pH 7.6); 2 мМ EDTA; 25 мМ NaF; 1% SDS), содержавшего ингибиторы протеаз cOmplete mini EDTA tablets (Roche, Германия). Вестерн-блот проводили, как описано нами ранее [25]. Применяли первичные антитела против: клаудина-1 (1 : 1000, Invitrogen, США), клаудина-5 (1 : 500, Invitrogen, США), окклюдина (1 : 1000, Invitrogen, США), вторичные антитела goat-anti-rabbit и goat-anti-mouse (1 : 1000, Abcam, США). Содержание клаудинов было нормализовано на общий белок того же образца. Уровень белков в контрольных группах был принят за 100%.
Иммуногистохимия. После предварительной фиксации в 10%-ном забуференном формалине перед нарезкой ткань мозга помещали в 15%-ный раствор сахарозы на 24 ч. Затем ткань отмывали в растворе PBS и погружали в криопротектор (Frozen Section Compound, Leica Biosystems, США) на 30 мин. Получение серийных срезов замороженной ткани мозга (15 мкм) осуществляли на криостат-микротоме CM1850UV (Leica Microsystems, Австрия). Срезы в течение 45 мин подвергали тепловой демаскировке в цитратном буфере (T 80°C, 0.01 М, pH 6.0). После серии промывок в PBS срезы инкубировали в блокирующем растворе (0.2%-ный Triton, 10%‑ный BSA, PBS pH 7.4) в течение 2 ч при 37°C, а затем с первичными крысиными поликлональными антителами к клаудину-1 и окклюдину (1 : 100, Thermo Fisher Scientific, США, # 71-7800, 71-1500), а также с первичными мышиными моноклональными антителами к клаудину-5 (1 : 100, Thermo Fisher Scientific, США, # 32-2500) в течение суток при 4°C. После промывания в растворе PBS использовали соответствующие вторичные антитела, конъюгированные с Alexa Fluor-488 (1 : 800, Invitrogen, США), в течение 120 мин при 37°C. Протокол завершали промыванием срезов в PBS и нанесением заливочной среды с ядерным красителем 4',6-диамидино-2-фенилиндола (DAPI, 0.1 мкг/мл). Визуализация полученных срезов проводилась с использованием микроскопа Leica TCS SP5 (Leica Microsystems GmbH, Германия). Для дополнительного подтверждения локализации белков плотных контактов именно в кровеносных сосудах мозга использовали метод двойного иммуномечения с применением первичных мышиных моноклональных антител к PECAM-1 (M-20, 1 : 200, SantaCruz, США) и клаудину-5 (1 : 200, Thermo Fisher Scientific, США), а также вторичных антител, конъюгированных с Alexa Fluor-488 (1 : 800, Invitrogen, США) и CF-633 (1 : 800, Sigma Aldrich, США). Для исключения неспецифического свечения вторичных антител был проведен негативный контроль, который показал отсутствие фоновой флуоресценции.
Состав растворов и концентрации физиологически активных веществ. Использовали МбЦД и реактивы для приготовления растворов фирмы Sigma Aldrich (США).
Статистическая обработка результатов исследований. Статистическая обработка результатов проводилась общепринятыми методами с использованием компьютерной статистической программы GraphPad Prism 8 (GraphPad; San Diego, CA, США). Для обработки данных использовали тест OneWay ANOVA с поправкой Даннета. Нормальность распределения проверяли с помощью критерия Шапиро–Уилка. Уровень достоверности р < 0.05 был принят как статистически значимый. Данные представлены в виде средней арифметической ± стандартная ошибка среднего (М ± m).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Воздействие МбЦД в течение 30 мин в дозе 5 мг/кг массы тела (в/в введение) привело к изменению уровня клаудинов и окклюдина в ткани лобных долей головного мозга крысы. Установлено достоверное снижение уровня клаудина-5 на 75% по сравнению с контрольной группой. Уровень клаудина-1 и окклюдина остался без изменений (рис. 1a).
Рис. 1.
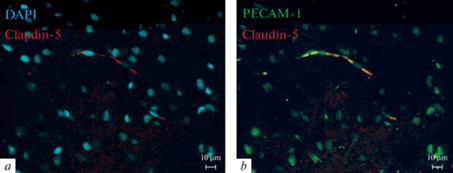
Содержание и локализация белков плотных контактов в ткани лобных долей головного мозга крысы в контроле и после внутривенного введения метил-бета-циклодекстрина (MbCD) в дозе 5 мг/кг на 30 мин. a – примеры иммуноблотов (верхняя панель) и денситометрия (нижняя панель) блотов белков плотных контактов (n = 4 в обеих группах), **p < 0.01 по сравнению с контролем, односторонний дисперсионный анализ с поправкой Даннета. b – локализация белков плотных контактов в области кровеносных сосудов лобных долей головного мозга крысы. Распределение клаудинов (зеленый канал) и овальная форма ядер эндотелиальных клеток (DAPI, синий канал) совпадает с характерным расположением кровеносных сосудов в ткани мозга (шкала – 50 мкм).
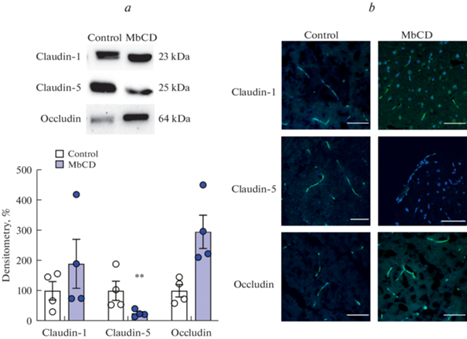
Молекула PECAM-1 является одним из основных белков межклеточных контактов эндотелиальных клеток, поэтому данный белок относят к маркерам этих клеток с самых ранних исследований [26]. Другим маркером эндотелия кровеносных сосудов различных областей головного мозга является клаудин-5 [27]. Использование метода двойной иммуногистохимической метки на контрольных образцах продемонстрировало идентичный характер распределения сигналов в ткани мозга от PECAM-1 и клаудина-5, что указывает на их локализацию в кровеносном сосуде (рис. 2). Кроме этого, протяженный характер распределения сигнала и овальная форма ядер свидетельствуют, что иммуноокрашивание дает свечение в области эндотелиальных клеток кровеносных сосудов. Сигналы от клаудина-1, -5 и окклюдина были выявлены на всех образцах. Анализ изображений показывает, что воздействие МбЦД не привело к распределению этих молекул в ткани мозга. Уменьшение и увеличение их уровня было специфичным для эндотелия, так как локализовано в пределах кровеносных сосудов (рис. 1b).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты проведенного исследования показывают, что дестабилизация липидного состава плазматической мембраны эндотелия кровеносных сосудов лобных долей головного мозга крысы оказывает влияние на структуру плотных контактов этих клеток. Внутривенное введение МбЦД в дозе 5 мг/кг через 30 мин приводит к изменению уровня белков плотных контактов. МбЦД снижает экспрессию основного белка плотных контактов эндотелия кровеносных сосудов клаудина-5 оставляя без изменения уровень клаудина-1 и окклюдина. Поскольку известно, что клаудин-5 является основным барьерообразующим белком плотных контактов в эндотелиоцитах головного мозга [17], можно предположить, что изменение упорядоченности липидной фазы рафтов может привести к увеличению проницаемости ГЭБ.
МбЦД является для организма млекопитающих ксенобиотиком. Однако в плазме крови существуют метаболиты, которые также могут влиять на липиды мембран. Снижение барьерных свойств эпителия при действии капрата натрия (жирная кислота, С10) может происходить за счет разрушения липидного рафта [28], что свидетельствует о возможном изменении состояния ГЭБ при метаболических изменениях биохимического профиля плазмы крови.
Иммуногистохимическим методом ранее было показано снижение клаудина-5 при действии МбЦД в эндотелии сосудов мозга [15]. В наших опытах методом Вестерн-блота было подтверждено снижение клаудина-5 при применении той же дозы МбЦД и отсутствие изменений в уровне клаудина-1 и окклюдина. Стоит отметить согласование результатов экспериментов на животных с опытами по распределению клаудинов в липидных рафтах при инкубации клеток линии MDCK с капратом натрия. Применение капрата натрия приводит к вытеснению клаудина-5 из липидных рафтов, но не влияет на распределение клаудина-1 [28]. Возможно, это связано с тем, что рафты имеют различный липидный состав [5]. Циклодекстрины обладают селективной избирательной активностью относительно экстракции липидов. МбЦД удаляет из плазматической мембраны клеток преимущественно фосфолипиды и холестерин [29]. Эти наблюдения могут свидетельствовать об избирательности взаимодействия отдельных клаудинов, которые имеют различный аминокислотный состав, с липидами рафтов и об их гетерогенном распределении в структуре плотных контактов.
Отсутствие изменения содержания окклюдина, который важен для стабилизации плотных контактов в эпителиальных тканях [30], также подтверждает разнообразие эффектов МбЦД на структуру плотных контактов эндотелия сосудов.
Изменение уровня различных белков плотных контактов при действии МбЦД может происходить при активации различных сигнальных систем клетки. Интегральные белки плазматической мембраны, к которым относятся клаудины и окклюдин, взаимодействуют через адаптерные белки с апикальным актомиозиновым комплексом и различными сигнальными белками [10]. Воздействие МбЦД приводит к дестабилизации холестерина в плазматической мембране, изменению ее механических свойств и, как следствие, происходит перестройка цитоскелета и полимеризация актина, что вызывает запуск внутриклеточного сигналинга [31]. Ремоделирование апикального актомиозинового кольца приводит к молекулярной реорганизации состава и структуры плотных контактов, изменению проницаемости эпителия, в том числе для ионов натрия [32]. В опытах на клеточных линиях было показано, что уменьшение холестерина в плазматической мембране ведет к уменьшению экспрессии альфа-1 субъединицы Na,K-АТФазы при включении Src-зависимого сигнального пути [33]. Использование специфического лиганда Na,K-АТФазы уабаина подтверждает функциональное взаимодействие через Src-сигналинг между Na,K-АТФазой и модуляцией экспрессии клаудинов в плотных контактах [25]. Таким образом, полученные результаты свидетельствуют о том, что липидное окружение является важным молекулярным компонентом плотных контактов эндотелия кровеносных сосудов головного мозга крысы и может принимать участие в поддержании и регуляции барьерных свойств ГЭБ.
Список литературы
Sheikov N, McDannold N, Sharma S, Hynynen K (2008) Effect of focused ultrasound applied with an ultrasound contrast agent on the tight junctional integrity of the brain microvascular endothelium. Ultrasound Med Biol 34: 1093–1104. https://doi.org/https://doi.org/10.1016/j. ultrasmedbio.2007.12.015
Ahishali B, Kaya M (2021) Evaluation of Blood-Brain Barrier Integrity Using Vascular Permeability Markers: Evans Blue, Sodium Fluorescein, Albumin-Alexa Fluor Conjugates, and Horseradish Peroxidase. Methods Mol Biol 2367: 87−103. https://doi.org/10.1007/7651_2020_316
Abbott NJ, Patabendige AA, Dolman DE, Yusof SR, Begley DJ (2010) Structure and function of the blood-brain barrier. Neurobiol Dis 37: 13−25. https://doi.org/10.1016/j.nbd.2009.07.030
Nico B, Ribatti D (2012) Morphofunctional aspects of the blood-brain barrier. Curr Drug Metab 13: 50–60. https://doi.org/10.2174/138920012798356970
Petrov AM, Kasimov MR, Zefirov AL (2016) Brain Cholesterol Metabolism and Its Defects: Linkage to Neurodegenerative Diseases and Synaptic Dysfunction. Acta Naturae 8(1): 58–73.https://doi.org/10.32607/20758251-2016-8-1-58-73
Anchisi L, Dessì S, Pani A, Mandas A (2013) Cholesterol homeostasis: A key to prevent or slow down neurodegeneration. Front Physiol 3: 486. https://doi.org/10.3389/fphys.2012.00486
Günzel D, Yu AS (2013) Claudins and the modulation of tight junction permeability. Physiol Rev 93: 525−569. https://doi.org/10.1152/physrev.00019.2012
Tsukita S, Tanaka H, Tamura A (2019) The Claudins: From Tight Junctions to Biological Systems. Trends Biochem Sci 44: 141–152. https://doi.org/10.1016/j.tibs.2018.09.008
Markov AG, Aschenbach JR, Amasheh S (2015) Claudin clusters as determinants of epithelial barrier function. IUBMB Life 67: 29−35. https://doi.org/10.1002/iub.1347
Zahraoui A, Louvard D, Galli T (2000) Tight junction, a platform for trafficking and signaling protein complexes. J Cell Biol 151: F31–F36. https://doi.org/10.1083/jcb.151.5.F31
Lee DB, Jamgotchian N, Allen SG, Abeles MB, Ward HJ (2008) A lipid-protein hybrid model for tight junction. Am J Physiol Renal Physiol 295: F1601–F1612. https://doi.org/10.1152/ajprenal.00097.2008
Martín Del Valle EM (2004) Cyclodextrins and their uses: A review. Process Biochem 39: 1033–1046. https://doi.org/10.1016/S0032-9592(03)00258-9
Dos Santos AG, Bayiha JC, Dufour G, Cataldo D, Evrard B, Silva LC, Deleu M, Mingeot-Leclercq MP (2017) Changes in membrane biophysical properties induced by the Budesonide/Hydroxypropyl-β-cyclodextrin complex. Biochim Biophys Acta Biomembr 1859: 1930–1940. https://doi.org/10.1016/j.bbamem.2017.06.010
Du J, Liu X, Zhang Y, Han X, Ma C, Liu Y, Guan L, Qiao L, Lin J (2022) The Effects of Combined Therapy With Metformin and Hydroxypropyl-beta-Cyclodextrin in a Mouse Model of Niemann-Pick Disease Type C1. Front Pharmacol 12: 825425.https://doi.org/10.3389/fphar.2021.825425
Atışa M, Akcana U, Yılmazb CU, Orhanc N, Düzgüna P, Ceylana UD, Arıcand N, Karahüseyinoğlue S, Şahine GN, Ahıshalıf B, Kaya M (2019) Effects of methyl-beta-cyclodextrin on blood-brain barrier permeability in angiotensin II-induced hypertensive rats. Brain Res 1715: 148–155.https://doi.org/10.1016/j.brainres.2019.03.024
Lambert D, O’Neill CA, Padfield PJ (2007) Methyl-beta-cyclodextrin increases permeability of Caco-2 cell monolayers by displacing specific claudins from cholesterol rich domains associated with tight junctions. Cell Physiol Biochem 20: 495–506. https://doi.org/10.1159/000107533
Nitta T, Hata M, Gotoh S, Seo Y, Sasaki H, Hashimoto N, Furuse M, Tsukita S (2003) Size-selective loosening of the blood-brain barrier in claudin-5-deficient mice. J Cell Biol 161: 653–660. https://doi.org/10.1083/jcb.200302070
Greene C, Hanley N, Campbell M (2020) Blood-brain barrier associated tight junction disruption is a hallmark feature of major psychiatric disorders. Transl Psychiatry 10: 373. https://doi.org/10.1038/s41398-020-01054-3
Dudek KA, Dion-Albert L, Lebel M, LeClair K, Labrecque S, Tuck E, Ferrer Perez C, Golden SA, Tamminga C, Turecki G, Mechawar N (2020) Molecular adaptations of the blood–brain barrier promote stress resilience vs. depression. Proc Natl Acad Sci U S A 117: 3326–3336. https://doi.org/10.1073/pnas.1914655117
Díaz-Coránguez M, Segovia J, López-Ornelas A, Puerta-Guardo H, Ludert J, Chávez B, Meraz-Cruz N, González-Mariscal L (2013) Transmigration of neural stem cells across the blood brain barrier induced by glioma cells. PLoS One 8: e60655. https://doi.org/10.1371/journal.pone.0060655
Velandia-Romero ML, Calderón-Peláez MA, Castellanos JE (2016) In Vitro Infection with Dengue Virus Induces Changes in the Structure and Function of the Mouse Brain Endothelium. PLoS One 11: e0157786. https://doi.org/10.1371/journal.pone.0157786
Buschmann MM, Shen L, Rajapakse H, Raleigh DR, Wang Y, Wang Y, Lingaraju A, Zha J, Abbott E, McAuley EM, Breskin LA, Wu L, Anderson K, Turner JR, Weber CR (2013) Occludin OCEL-domain interactions are required for maintenance and regulation of the tight junction barrier to macromolecular flux. Mol Biol Cell 24: 3056–3068. https://doi.org/10.1091/mbc.e12-09-0688
Zhang Y, Ding X, Miao C, Chen J (2019). Propofol attenuated TNF-α-modulated occludin expression by inhibiting Hif-1α/VEGF/VEGFR-2/ ERK signaling pathway in hCMEC/D3 cells. BMC Anesthesiol 19: 127. https://doi.org/10.1186/s12871-019-0788-5
Tian J, Shi R, Liu T, She R, Wu Q, An J, Hao W, Soomro MH (2019) Brain Infection by Hepatitis E Virus Probably via Damage of the Blood-Brain Barrier Due to Alterations of Tight Junction Proteins. Front Cell Infect Microbiol 9: 52. https://doi.org/10.3389/fcimb.2019.00052
Markov AG, Fedorova AA, Kravtsova VV, Bikmurzina AE, Okorokova LS, Matchkov VV, Cornelius V, Amasheh S, Krivoi II (2020) Circulating Ouabain Modulates Expression of Claudins in Rat Intestine and Cerebral Blood Vessels. Int J Mol Sci 21: 5067. https://doi.org/10.3390/ijms21145067
Albelda SM, Muller WA, Buck CA, Newmanll PJ (1991) Molecular and cellular properties of PECA-M-1 (endoCAM/CD31): a novel vascular cell-cell adhesion molecule. J Cell Biol 114(5): 1059–1068. https://doi.org/10.1083/jcb.114.5.1059
Morita K, Sasaki H, Furuse M, Tsukita S (1999) Endothelial claudin: claudin-5/TMVCF constitutes tight junction strands in endothelial cells. J Cell Biol 147: 185–194. https://doi.org/10.1083/jcb.147.1.185
Sugibayashi K, Onuki Y, Takayama K (2009) Displacement of tight junction proteins from detergent-resistant membrane domains by treatment with sodium caprate. Eur J Pharm Sci 36: 246–253. https://doi.org/10.1016/j.ejps.2008.09.011
Monnaert V, Tilloy S, Bricout H, Fenart L, Cecchelli R, Monflier E (2004) Behavior of α-, β-, and γ-Cyclodextrins and Their Derivatives on an in Vitro Model of Blood-Brain Barrier. J Pharm Exp Ther 310: 745–751. https://doi.org/10.1124/jpet.104.067512
Saito AC, Higashi T, Fukazawa Y, Otani T, Tauchi M, Higashi AY, Furuse M, Chiba H (2021) Occludin and tricellulin facilitate formation of anastomosing tight-junction strand network to improve barrier function. Mol Biol Cell 32(8): 722–738. https://doi.org/10.1091/mbc.E20-07-0464
Hissa B, Pontes B, Roma PM, Alves AP, Rocha CD, Valverde TM, Aguiar PH, Almeida FP, Guimarães AJ, Guatimosim C, Silva AM, Fernandes MC, Andrews NW, Viana NB, Mesquita ON, Agero U, Andrade LO (2013) Membrane Cholesterol Removal Changes Mechanical Properties of Cells and Induces Secretion of a Specific Pool of Lysosomes. PLoS One 8: e82988. https://doi.org/10.1371/journal.pone.0082988
He WQ, Wang J, Sheng JY, Zha JM, Graham WV, Turner JR (2020) Contributions of Myosin Light Chain Kinase to Regulation of Epithelial Paracellular Permeability and Mucosal Homeostasis. Int J Mol Sci 21: 993. https://doi.org/10.3390/ijms21030993
Zhang J, Li X, Yu H, Larre I, Dube PR, Kennedy DJ, Tang WHW, Westfall K, Pierre SV, Xie Z, Chen Y (2020) Regulation of Na/K-ATPase expression by cholesterol: isoform specificity and the molecular mechanism. Am J Physiol Cell Physiol 319: C1107–C1119. https://doi.org/10.1152/ajpcell.00083.2020
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова