Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 5, стр. 530-546
Клетки церебрального эндотелия и периваскулярной астроглии в регуляции нейрогенеза
Е. А. Тепляшина 1, *, Я. В. Горина 1, Е. Д. Хилажева 1, Е. Б. Бойцова 1, А. И. Мосягина 1, Н. А. Малиновская 1, Ю. К. Комлева 1, А. В. Моргун 1, Ю. А. Успенская 1, 2, А. Н. Шуваев 1, А. Б. Салмина 1, 3
1 Красноярский государственный медицинский университет им. проф. Войно-Ясенецкого
Красноярск, Россия
2 Красноярский государственный аграрный университет
Красноярск, Россия
3 Научный центр неврологии
Москва, Россия
* E-mail: elenateplyashina@mail.ru
Поступила в редакцию 16.02.2022
После доработки 08.04.2022
Принята к публикации 10.04.2022
- EDN: JZMBXV
- DOI: 10.31857/S0869813922050119
Аннотация
Гематоэнцефалический барьер представляет собой совокупность клеток в составе нейроваскулярной единицы головного мозга, выполняющих собственно барьерную функцию, а также участвующих в механизмах пластичности. Проницаемость гематоэнцефалического барьера определяется эффективностью формирования контактов между клетками церебрального эндотелия, механизмами трансцеллюлярной проницаемости, характером взаимодействия клеток эндотелия с периваскулярными клетками, в частности перицитами и астроцитами. Кроме того, проницаемость барьера является производной от активности всей нейроваскулярной единицы и влияет на процессы нейропластичности, в частности нейрогенез, который во взрослом головном мозге осуществляется в специализированных нейрогенных нишах, где поддержание пула стволовых и прогениторных клеток, их обновление, пролиферация, дифференцировка контролируются локальным микроокружением. Формирование этого микроокружения во многом определяется проницаемостью гематоэнцефалического барьера в микрососудах, составляющих сосудистую основу нейрогенных ниш. Поэтому функциональное сопряжение процессов нейрогенеза и неоангиогенеза является важным компонентом механизмов пластичности головного мозга. Процессы неоангиогенеза и нейрогенеза связаны между собой посредством эффектов широкого спектра регуляторных молекул: факторов роста, цитокинов, нейро- и глиотрансмиттеров и метаболитов. Современные технологии дают возможность разрабатывать новые протоколы управления активностью клеток, формирующих пронейрогенное и/или проангиогенное микроокружение. В обзоре обобщены современные представления о механизмах пластичности с участием клеток церебрального эндотелия и о возможностях управления или за счет адресного (оптогенетического) воздействия на периваскулярную астроглию.
СПИСОК ИСПОЛЬЗУЕМЫХ СОКРАЩЕНИЙ
| Aβ | Амилоид бета |
| Angiopoetin (Ang) | Ангиопоэтин |
| AVV | Аденовирусный вектор |
| BDNF | Мозговой нейротрофический фактор |
| CA | Регион гиппокампа |
| CD | Кластер дифференцировки (трансмембранный гликопротеин) |
| ChR2 | Фоточувствительный белок каналородопсин 2 |
| CXCL | Хемокин |
| Cx43 | Белок щелевых контактов |
| Delta-like ligand-4 (DLL4) | Лиганд Notch |
| EGF | Эпидермальный фактор роста |
| FOX | Фактор транскрипции |
| FGF2 | Основный фактор роста фибробластов |
| GFAP | Глиальный кислый фибриллярный белок |
| GPR81 | Рецептор лактата |
| GSK-3 | Киназа гликогенсинтазы 3 |
| HIF-1 | Гипоксия-индуцибельный фактор транскрипции |
| HMGB1 (амфотерин) | Белок из группы ядерных негистоновых белков HMG |
| IGF | Инсулиноподобный фактор роста |
| JAM | Белок адгезионных контактов |
| LIF | Лейкемия-ингибирующий фактор |
| MCT1 | Монокарбоксилатный транспортер |
| Nestin | Маркер стволовых клеток |
| NeuroD1 | Фактор нейрогенной дифференцировки 1 |
| NT3 | Нейротрофин |
| Notch | Трансмембранный рецептор |
| NO | Монооксид азота |
| PCNA | Маркер пролиферирующих клеток |
| PEDF | Пигментный эпителиальный фактор |
| PIGF-2 | Плацентарный фактор роста 2 |
| SGZ | Субгранулярная зона |
| SCF | Фактор роста стволовых клеток |
| SVZ | Субвентрикулярная зона |
| Shh | Sonic hedgehog |
| Stalk-cells | Пролиферирующие клетки эндотелия |
| Tip-cells | Мигрирующие клетки эндотелия |
| TGF | Трансформирующий фактор роста-β |
| VEGF | Сосудисто-эндотелиальный фактор роста |
| Wnt | Сигнальный белок |
| ГАМК | Гамма-аминомасляная кислота |
| ГЭБ | Гематоэнцефалический барьер |
| ИЛ1бета (IL1β) | Интерлейкин 1 бета |
| НВЕ | Нейроваскулярная единица |
| НПК | Нейрональные прогениторные клетки |
| НСК | Нейральные стволовые клетки |
Развитие и функционирование головного мозга включает в себя значительное разнообразие клеточных и молекулярных событий, отражающих явление нейропластичности (формирование новых клеток, их миграция и интеграция в межклеточные ансамбли, межклеточная сигнализация, метаболические преобразования, элиминация отдельных клеточных структур, гибель клеток) [1]. В процессе жизнедеятельности в организме наблюдаются сложные регулируемые изменения стволовых клеток и появление новых клеточных структур головного мозга – нейронов, астроцитов, олигодендроцитов. Нейрогенез рассматривается как один из наиболее важных процессов взрослого мозга, реализующий адаптивный и репаративный потенциал, а также включающий несколько этапов развития: трансформацию нейральных стволовых клеток (НСК), пролиферацию нейрональных прогениторных клеток (НПК), селекцию, миграцию, дифференцировку, вовлечение сформированного зрелого нейрона в нейрональную сеть [2]. Ключевая роль в пластичности клеточных структур мозга отводится стволовым и прогениторным клеткам, дающим начало разным видам клеток – нейрональной, астроглиальной и олигодендроглиальной природы – в зависимости от состояния локального микроокружения нейрогенных ниш, активности отдельных регионов мозга, “запроса” на увеличение генерации того или иного вида клеток. При этом стволовым клеткам свойственны самообновление (сохранение когорты стволовых клеток) и мультипотентность (формирование различных типов клеток из прогениторных клеток) [3].
Открытие феномена нейрогенеза взрослого мозга обладает фундаментальной и универсальной значимостью. Нейрогенез является процессом, объединяющим клеточную пролиферацию, миграцию и дифференцировку нейронов и астроглии. В настоящее время в качестве ключевого молекулярного механизма контроля нейрогенеза выступает локальное микроокружение [3].
В центральной нервной системе процессы нейрогенеза максимально выражены в периоде эмбриогенеза, однако и после рождения, в раннем постнатальном периоде развития и на протяжении всей жизни нейрогенез присутствует в специализированных зонах – нейрогенных нишах, в которых благодаря соответствующему микроокружению формируются условия для сохранения пула стволовых клеток, их рекрутинга, пролиферации, дифференцировки и миграции [4, 5]. Данные области обеспечивают регуляцию нейрогенеза и его стабилизацию за счет сложных механизмов, опосредованных продукцией широкого спектра гуморальных регуляторов, взаимодействием клеток друг с другом и с внеклеточным матриксом [6–8]. Известно, что нейрогенные ниши формируются за счет интеграции нескольких типов клеточных структур нейрональной и глиальной природы, и обязательным их компонентом является т.н. каффолд, представленный микрососудами [9, 10]. Общепризнанными стимулами к образованию клеток нейрональной природы во взрослом мозге выступают физическая активность, гипоксия, стрессовые ситуации, когнитивные нагрузки и обучение [11], а также патологические состояния – ишемия мозга, травма, нейродегенеративные изменения [12]. При действии этих стимулов в нейрогенных нишах меняется локальное гуморальное микроокружение, в том числе за счет изменения проницаемости сосудистой стенки, что имеет своим результатом активацию программы пролиферации и дифференцировки НСК и НПК.
В 2016 г. Dennis с соавт. детально изучили возрастные особенности процесса нейрогенеза в двух нейрогенных нишах головного мозга – субвентрикулярной (SVZ) и субгранулярной (SGZ) зонах. Было отмечено, что в первые годы жизни в этих областях наблюдается снижение клеток, обладающих пролиферативной активностью [13], но во взрослом мозге именно эти регионы вносят основной вклад в нейрогенез. Примечательно, что SGZ гиппокампа насыщена нервными окончаниями и интенсивность нейрогенеза здесь зависит от активности гиппокампальных нейронов и изменения локальной концентрации ключевых нейромедиаторов. SVZ располагается рядом с пространством желудочка мозга и контактирует с компонентами ликвора, продуцируемого клетками сосудистого сплетения, которые формируют гематоликворный барьер [14]. Таким образом, SGZ отводится важная роль в образовании новых клеток, мигрирующих в гранулярный отдел зубчатой извилины гиппокампа для обеспечения механизмов запоминания и/или забывания [11]. Активность SVZ во взрослом мозге в большей степени актуальна в контексте образования новых нейронов, участвующих в восстановлении поврежденных структур, а также мигрирующих в состав обонятельных луковиц [12]. Важно отметить, что эти события, как в SGZ, так и в SVZ, сопровождаются интенсификацией процессов неоангиогенеза, что позволяет считать последний важным компонентом механизмов пластичности головного мозга. Очевидно, что существенную роль в сопряжении нейрогенеза и ангиогенеза в центральной нервной системе играют церебральные эндотелиоциты. Несмотря на значительный прогресс, достигнутый в расшифровке механизмов нейрогенеза и ангиогенеза в последние две декады, по-прежнему малоизученными остаются вопросы вклада клеток-компонентов гематоэнцефалического барьера (ГЭБ) в процессы пластичности. Целью настоящего обзора является обобщение современных данных о таких механизмах и о возможностях управления ими для восстановления пластичности головного мозга при нейродегенерации.
РОЛЬ ЦЕРЕБРАЛЬНОГО ЭНДОТЕЛИЯ В ФОРМИРОВАНИИ ЛОКАЛЬНОГО МИКРООКРУЖЕНИЯ В НЕЙРОГЕННОЙ НИШЕ
Ключевую роль в формировании микроокружения в нейрогенных нишах играют следующие факторы: 1) нейротрансмиттеры, пептидные факторы роста и нейропептиды (например, глутамат, ГАМК, BDNF, окситоцин и пр.), продуцируемые нейронами и нейросекреторными клетками и оказывающими влияние на судьбу и развитие НСК и НПК, нейробластов (незрелые клетки, образующиеся из НСК/НПК SVZ, мигрирующие вдоль рострального миграционного пути в обонятельную луковицу или в зону повреждения, а также клетки, образующиеся из НСК/НПК SGZ, мигрирующие в зубчатую извилину гиппокампа); 2) глиотрансмиттеры (например, серин, АТФ и пр.), продуцируемые активированными глиальными клетками, в частности астроцитами нейрогенных ниш, и влияющими на функциональную активность НСК/НПК; 3) метаболиты, синтезируемые клетками различной природы (например, лактат, пируват, жирные кислоты и пр.), обладающие регуляторной активностью не только за счет их утилизации окружающими клетками, но и за счет влияния на них через соответствующие рецепторы по механизмам паракринной регуляции; 4) активные формы кислорода и азота, газообразные трансмиттеры, например, монооксид азота, сероводород, которые продуцируется клетками нейрогенных ниш и существенным образом влияют на судьбу НСК/НПК [14–16].
Эндотелиоциты являются важной структурой нейроваскулярной единицы (НВЕ) головного мозга и составляют основу ГЭБ. В микрососудах головного мозга клетки эндотелия находятся под контролем периваскулярной астроглии, обеспечивают избирательный транспорт веществ, секвестрируют протромбогенные факторы и контролируют реологические свойства крови, реализуют механизмы контроля микроциркуляции, участвуют в регуляции нейрогенеза, взаимодействуют с лейкоцитами и микроглией, тем самым участвуя в локальном иммунном ответе и воспалении, что дополняется их способностью продуцировать цитокины, метаболиты, факторы роста [17, 18]. Эндотелиоциты, входящие в состав ГЭБ, участвуют в барьерогенезе в раннем периоде развития и в восстановлении барьера после повреждения [16].
Проницаемость ГЭБ, в том числе в микрососудах нейрогенных ниш, определяется следующими факторами: 1) экспрессия белков межклеточных контактов; 2) экспрессия белков-транспортеров и каналов; 3) метаболизм церебральных эндотелиоцитов и других клеток НВЕ; 4) сигнальная трансдукция и межклеточная коммуникация; 5) состояние базальной мембраны; 6) степень зрелости ГЭБ [17–19].
Физиология, структура и метаболизм клеток эндотелия церебральных микрососудов имеют существенные отличия от клеток эндотелия, локализованных в других тканях, в частности, для церебрального эндотелия характерны: 1) низкий уровень фенестрации и сниженный пиноцитоз; 2) высокая экспрессия белков межклеточных контактов (tight junctions, adherence junctions); 3) относительно высокое содержание митохондрий в клетках; 4) тесное взаимодействие с перицитами и периваскулярной астроглией; 5) экспрессия рецепторов трансферрина, инсулина, большого спектра белков-транспортеров [17, 19]. Все эти свойства обеспечивают высокую селективность ГЭБ, что важно для химического гомеостаза в ткани центральной нервной системы: поддержания уровня глюкозы и иных энергетических субстратов, выведения продуктов метаболизма, регуляции концентрации цитокинов, факторов роста и пр. [20]. Синаптическая активность напрямую влияет на процессы, происходящие с участием клеток церебрального эндотелия: например, функциональная гиперемия, возникающая в активных регионах мозга, опосредуется влиянием активированной астроглии (в составе трехчастных синапсов) на клетки эндотелия за счет продукции лактата и метаболитов арахидоновой кислоты [21].
У грызунов развитие ГЭБ начинается к E10–17, контролируемая проницаемость формируется к E21, но и в постнатальном периоде продолжается развитие плотных контактов. У человека маркеры ГЭБ появляются на 8-й неделе эмбриогенеза, интенсивный ангиогенез в ткани головного мозга продолжается до 2–3 нед. постнатального развития [22]. Примечательно, что барьерогенез начинается только после формирования пула НСК/НПК и всегда соответствует синаптогенезу и индукции синаптической активности в ткани головного мозга [23, 24]. Барьерогенез происходит и во взрослом мозге, в том числе при реализации феномена изменения пластичности, индуцированного новым опытным исследованием (изменение синаптической трансмиссии, нейритогенеза, формирования и элиминации синапсов, нейрогенеза и гибели клеток при действии стимулов, инициирующих обучение и запоминание) [25]. Неотъемлемой составной частью этого процесса выступает образование новых микрососудов с активно пролиферирующими и дифференцирующимися эндотелиальными прогениторными клетками, реализация эффектов разнообразных регуляторных молекул и компонентов клеточных сигнальных путей (Notch, FOX, HIF-1, GSK-3) [26]. В целом ассоциация нейрогенеза и ангиогенеза достаточно полно охарактеризована, а ее нарушения признаются в качестве вероятной причины подавления нейрогенеза в стареющем головном мозге [27].
Менее изучен вклад контролируемой и селективной проницаемости ГЭБ в поддержание локального микроокружения в нейрогенных нишах, однако известно, что в SGZ гиппокампа астроциты достаточно плотно окружают эндотелиальный слой клеток, поэтому локальное микроокружение формируется преимущественно за счет локальной секреции нейро- и глиотрансмиттеров, факторов роста, тогда как в SVZ астроциты неплотно примыкают к слою эндотелия и перицитов, что обеспечивает поступление в нишу регуляторных молекул из крови [28, 29].
Таким образом, большинство факторов роста, регулирующих нейрогенез, продуцируются неспециализированными клетками и оказывают эндокринное, паракринное и аутокринное действие [30, 31]. Иными словами, именно локальное микроокружение определяет путь, который выберут клетки для развития и дифференцировки – нейрональный и (или) глиальный – посредством ауто-, эндо- и паракринной регуляции, координации межклеточных связей и внутриклеточной сигнализации, а также за счет динамично изменяющейся структуры внеклеточного матрикса [32]. В настоящее время доказано действие паракринных эффекторных молекул, продуцируемых клетками ГЭБ, на НСК/НПК. К таким факторам относятся сосудистый эндотелиальный фактор роста (VEGF) [33], эпидермальный фактор роста (EGF) [34], основной фактор роста фибробластов (FGF2) [35], мозговой нейротрофический фактор (BDNF) [36], пигментный эпителиальный фактор (PEDF) [37] (табл. 1).
Таблица 1.
Основные регуляторные и сигнальные молекулы нейрогенеза, синтезируемые клетками церебрального эндотелия
| Регуляторные и сигнальные молекулы нейрогенеза |
Оказываемый эффект | Ссылка |
|---|---|---|
| BDNF (Мозговой нейротрофический фактор) |
Нейротрофический фактор мозга отвечает за рост и выживание нервных клеток в процессе нейрогенеза, участвует в селекции и миграции нейробластов в процессе трансформации. Стимулирует нейрогенез в SGZ зоне как in vivo, так и in vitro. | [36] |
| VEGF (Сосудистый эндотелиальный фактор роста) |
Сосудистый эндотелиальный фактор роста отвечает за рост аксонов в направлении клеток-мишеней, обусловливает пластичность нейрональной ткани, участвует в механизмах восстановления нарушенных неврологических функций. Стимулирует нейрогенез в SGZ зоне как in vivo, так и in vitro. | [32] |
| LIF (Лейкемия-ингибирующий фактор) |
Цитокин, участвует в межклеточной сигнализации, выступает как регулятор нейрональной дифференцировки опосредованно через активацию ERK-зависимого пути. | [38] |
| PEDF (Пигментный эпителиальный фактор) |
Фактор пигментного эпителия стимулирует самообновление нейрональных стволовых клеток. Избирательно увеличивает самообновление В-клеток в субвентрикулярной зоне и впоследствии усиливает нейрогенез посредством потенцирования Notch-зависимой транскрипции. | [37–39] |
| IGF (Инсулиноподобный фактор роста 1) |
Плейотропный пептид, отвечает за реализацию механизмов сигнальных путей. Является ключевым регулятором клеточной пролиферации, ингибитором клеточного апоптоза и некроза. | [40] |
| NT3 (Нейротрофин) | Нейротрофин-3 регулирует нейрогенез в SVZ зоне, поддерживает популяцию покоящихся нейрональных клеток. | [41] |
| Бетацеллюлин | Проявляет свое действие как лиганд рецептора эпидермального фактора роста. Способствует пролиферации нейрональных клеток-предшественников и нейробластов. | [42] |
| CXCL12 | Хемокин, способствует регуляции дифференцировки нейрональных клеток-предшественников. | [40] |
| PlGF-2 (Плацентарный фактор роста-2) | Плацентарный фактор роста 2 (PlGF-2) может способствовать пролиферации стволовых клеток в SVZ. | [43] |
| NO (Монооксид азота) |
Его эффекты, по-видимому, зависят от задействованного сигнального пути. Потенциально посредством NO-индуцированного S-нитрозилирования EGF рецепторов NO ингибирует передачу сигналов PI3K/Akt для подавления пролиферации НСК как в культуре, так и in vivo. Однако обход EGF рецепторов индуцирует пролиферацию за счет активации p21Ras, что приводит к увеличению уровней активации c-Myc, p90RSK и Elk-1 и последующему снижению уровня p27Kip1. NO-синтаза (NOS) является основным ферментом, катализирующим образование NO в головном мозге. Три изоформы NOS участвуют в контроле пролиферации НСК и в нейрогенезе: eNOS (эндотелиальная синтаза оксида азота), nNOS (нейрональная синтаза оксида азота) и iNOS (индуцибельная синтаза оксида азота). | [44, 45] |
| FGF2 (Основный фактор роста фибробластов) |
FGF2 влияет на нейрогенез и пролиферацию корковых предшественников. FGF2 служит для поддержания самообновления клеток SVZ. | [46, 47] |
| EGF (Эпидермальный фактор роста) | Супрафизиологические концентрации могут способствовать нейрогенезу, вероятно, за счет прямого митогенного эффекта. Внутрижелудочковая инфузия EGF увеличивает количество НСК типа В, контактирующих с желудочком, и приводит к пролиферации транзитных амплифицирующих клеток при остановке продукции нейробластов. In vitro EGF стимулирует генерацию нейросфер из транзитных амплифицирующих клеток и вызывает реверсию к более “стволовому” фенотипу. | [45, 48] |
| Sonic hedgehog (Shh) | Способствует самообновлению и/или пролиферации НСК, а также прямому нейрогенезу или глиогенезу. | [49] |
| TGF-β (Трансформирующий фактор роста-β) | TGF-β способствует поддержанию состояния покоя стволовых клеток и может ингибировать нейрогенез. TGF-β1 служит важным нейрогенным фактором роста. Влияет на пролиферативный потенциал, о чем свидетельствует остановка в фазе G0/G1 клеточного цикла. В клеточной культуре НСК и клетки-предшественники экспрессируют TGFβRI, II и III, а TGF-β1 дозозависимо снижает размножение этих клеток. | [50, 51] |
| Angiopoietin (Ang) (Ангиопоэтин) | Ангиопоэтин-1 способствует пролиферации и выживанию нейробластов, а при экспрессии эндотелиальными клетками служит скаффолдом. Роль скаффолда заключается в развитии, ремоделировании и созревании кровеносных сосудов. Ангиопоэтин-4 усиливает ангиогенез и нейрогенез после инсульта путем усиления фосфорилирования AKT, снижает гибель нейронов и ингибирует воспалительную реакцию, что является результатом ингибирования экспрессии FasL/FasR пути. | [45, 53] |
| SCF (Фактор роста стволовых клеток) |
SCF действует как хемоаттрактант и фактор выживания для НСК на ранних стадиях дифференцировки, не влияя на пролиферацию или дифференцировку. | [44] |
| Notch1 | Трансмембранный рецептор, способствует увеличению популяции, миграции и дифференцировки нейрональных предшественников. | [53] |
| Wnt | Сигнальный белок способствует увеличению пролиферации нейрональных предшественников. | [54] |
Помимо клеток эндотелия, периваскулярные астроциты в составе ГЭБ/НВЕ могут регулировать нейрогенез [55]. Вероятно, образование астроглиальной сети, связанной посредством коннексиновых каналов, формирует локальное микроокружение, благоприятно для пролиферативных процессов в нейрогенных нишах [56]. Вместе с тем, астроциты влияют и на клетки микрососудов головного мозга, например, вызывая вазодилятацию и стимулируя ангиогенез за счет кальций-индуцируемого гликолиза и продукции лактата, либо генерации метаболитов арахидоновой кислоты [57–59], а экспрессируемый астроцитами тромбоспондин-1 понижает ангиогенный потенциал эндотелиальных прогениторных клеток.
Сопряжение механизмов нейрогенеза и ангиогенеза подтверждается и другими экспериментальными данными: эндотелиальные клетки индуцируют дифференцировку астроцитов за счет секреции LIF [38], астроциты секретируют сосудисто-эндотелиальный фактор роста (VEGF) в ответ на локальное изменение уровня кислорода [32], а дифференцировка астроцитов может, в свою очередь, запускать формирование ГЭБ и развитие перицитов [21]. В нейрогенных нишах радиальная глия (собственно НСК) является продуцентом ретиноевой кислоты как одного из наиболее эффективных регуляторов барьерогенеза [60, 61]. Особое значение в индукции ангиогенеза отводится сосудисто-эндотелиальному фактору роста VEGF [62]. Астроциты продуцируют VEGF в HIF-1-контролируемом режиме, поэтому очевидно, что это наиболее выражено в условиях гипоксии или нейровоспаления [62–64]. Результатом увеличения продукции VEGF является формирование микрососудов с повышенной проницаемостью сосудистой стенки вследствие несовершенного барьерогенеза [65]. Однако есть данные и о позитивном эффекте астроцитарного VEGF в отношении структурно-функциональной целостности ГЭБ [66] или об отсутствии вовлеченности HIF-1-контролируемых механизмов в астроглии в патогенез повреждения ГЭБ при гипоксии [67]. VEGF выступает ключевым регулятором нейрогенеза, а также пролиферации, миграции эндотелиальных клеток и взаимодействия этих клеток с НСК [32]. VEGF-опосредованное восстановление поврежденной ткани во многом определяется его способностью индуцировать процессы неоангиогенеза и стимулировать образование новых нейронов [62, 68, 69]. Например, Palmer с соавт. установили, что в SGZ взрослых крыс процесс нейрогенеза проходит в непосредственной близости от кровеносных сосудов, где отмечается высокая концентрация VEGF и регистрируется интенсивный ангиогенез [26].
АБЕРРАНТНЫЙ НЕЙРОГЕНЕЗ И ЦЕРЕБРАЛЬНЫЙ АНГИОГЕНЕЗ ПРИ ЭКСПЕРИМЕНТАЛЬНОЙ БОЛЕЗНИ АЛЬЦГЕЙМЕРА
Доказательствами тесного сопряжения механизмов нейрогенеза и церебрального ангиогенеза являются следующие данные: 1) стимуляция нейрогенеза, как правило, сопровождается неоангиогенезом, что актуально как для репаративных событий (например, при повреждении головного мозга или при нейродегенерации), так и для феномена пластичности головного мозга [70]; 2) образование новых микрососудов при этом носит обратимый характер (в последующем они могут подвергаться регрессии), но, вероятно, важно для поддержания механизмов структурной и функциональной пластичности [71]; 3) как правило, вновь образованные микрососуды имеют избыточно высокую проницаемость, что может быть фактором, способствующим формированию новых участков нейрогенеза [72] (как это было ранее показано, например, в перивентрикулярных отделах головного мозга при ишемии [73]) за счет облегченного транспорта регуляторных молекул в нишу, но одновременно может стать причиной развития нейровоспаления (в частности, на фоне прогрессирующей нейродегенерации) [74]; 4) активация нейрогенеза и ангиогенеза сопровождается существенными метаболическими изменениями в клетках эндотелия, а также НСК/НПК, сопровождающимися перераспределением вклада в продукцию энергии механизмов гликолиза и окислительного фосфорилирования [20].
При гибели клеток головного мозга индуцируется репаративный нейрогенез, преимущественно в SVZ, для последующей миграции нейробластов в зону повреждения [75–77]. Эти же события сопровождаются активацией церебрального ангиогенеза, вероятно, в качестве компенсаторного механизма в ответ на повреждение ткани и сокращение перфузии, например, после перенесенного ишемического повреждения головного мозга или при медленно прогрессирующих дегенеративных заболеваниях нервной системы [78]. Проницаемость новых сосудов в таких ситуациях повышена и это, вероятно, связано не только с нейровоспалением [79], но и с необходимостью создания новых областей нейрогенеза в поврежденном мозге, как это было показано при формировании новых нейрогенных зон в перивентрикулярной области после ишемии [80]. Одним из механизмов является конверсия сигнального Notch-пути, при которой эндотелий и перициты церебральных микрососудов способны экспрессировать лиганд Notch-рецептора – Delta-like ligand-4 (DLL4) в ответ на высокую локальную продукцию VEGF. Данный механизм стимулирует пролиферацию НСК и инициирует формирование дополнительных нейрогенных ниш в стенках желудочков головного мозга [81].
Для хронической нейродегенерации альцгеймеровского типа характерны неэффективный репаративный нейрогенез [82, 83] и усиленный неоангиогенез с формированием феномена гиперваскуляризации и повышением проницаемости ГЭБ [74]. Однако следует отметить, что клетки эндотелия, экспрессирующие рецепторы инсулина, реагируют на активацию и индукцию ангиогенеза изменением своего метаболизма: инсулин-стимулированный гликолиз необходим для миграции лидирующих при росте сосуда tip-cells, а сочетание интенсивного гликолиза и митохондриального окислительного фосфорилирования – для пролиферации следующих далее stalk-cells [84, 85]. Аналогичным образом гликолитическая продукция лактата в астроцитах, по крайней мере в некоторых регионах головного мозга, контролируется инсулином [86]. Логично предположить, что состояния, сопровождающиеся формированием локальной (церебральной) инсулинорезистентности, в частности болезнь Альцгеймера [87–89], будут сопровождаться аберрантной ангиогенной активностью клеток церебрального эндотелия, в результате чего формирующиеся микрососуды будут фуционально некомпетентны. Действительно, как мы показали, при экспериментальной болезни Альцгеймера наблюдается формирование аберрантных межклеточных контактов в эндотелии церебральных микрососудов, в частности в CA1 субрегионе гиппокампа [90], ответственном за непространственную память [91]. Мы установили, что это проявляется стимуляцией ангиогенеза и присутствием эндотелиальных клеток с низкой экспрессией JAM белков плотных контактов на фоне увеличения общего количества CD31-иммунопозитивных клеток эндотелия, повышением проницаемости ГЭБ in vivo [92]. Дополнительными признаками несовершенного ангиогенеза при этом являются увеличение числа сосудов на фоне снижения ветвления сосудов. Другим регионом гиппокампа, непосредственно связанным с формированием аберрантной сосудистой сети, является зубчатая извилина, в которой максимально выражены процессы неоангиогенеза и в наибольшей степени регистрируются признаки повреждения клеток и аккумуляции алармина HMGB1 во внеклеточном пространстве, что является причиной развития локального воспаления [90]. В целом, неоангиогенез характерен для CA1 зоны гиппокампа и зубчатой извилины, локальные нарушения микроциркуляции вследствие сокращения диаметра и разветвленности сосудов – для CA2 и CA3 субрегионов. Повышение проницаемости ГЭБ в гиппокампе животных с экспериментальной болезнью Альцгеймера наиболее характерно для CA2 субрегиона, что сопровождает развитие нарушений непространственной гиппокамп-зависимой памяти. Интересно, что экспрессия белка CD147, являющегося регулятором активности транспортеров лактата, матриксных металлопротеиназ и протеолиза АРР, его лиганда циклофилина А, а также высокая экспрессия алармина HMGB1 и RAGE в зубчатой извилине гиппокампа маркируют собой нейродегенеративные изменения, интенсивность воспаления [93]. Кроме того, экспрессия данного белка приводит к ремоделированию микрососудов, метаболизму амилоида и повреждению эндотелия, что отражает нарушение когнитивных функций у экспериментальных животных [90].
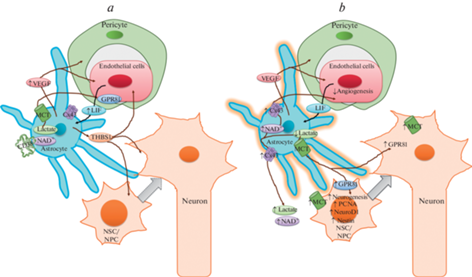
Исследования, выполненные с использованием созданной нами многокомпонентной модели нейрогенной ниши in vitro, включающая нейросферы, астроциты и церебральные эндотелиоциты, показала, что адресная активация астроцитов усиливает нейрогенез и изменяет направление развития НСК/НПК с глиального на нейрональный путь. При экспрессии в астроцитах фоточувствительного белка – каналородопсина (ChR2) нам удалось доказать возможность регуляции процессов нейрогенеза за счет фотоактивации астроцитов [94, 95]. Это сопровождается значимыми изменениями метаболизма клеток церебрального эндотелия и проницаемости ГЭБ (неопубликованные данные), например, вследствие реализации эффектов высвобождаемого астроглией лактата на митохондриальный биогенез в клетках эндотелия. Действительно, высокая экспрессия MCT1 и GPR81 в клетках нейрогенной ниши после фотостимуляции ChR2+-астроцитов может быть расценена как маркер эффективности метаболического сопряжения клеток НВЕ при активации нейрогенеза [96 ] . Мы полагаем, что адресная активация астроцитов позволяет управлять биодоступностью лактата и, вероятно, иных глиотрансмиттеров и факторов роста в клетках ГЭБ/НВЕ (рис. 1).
Рис. 1.
Схема нейрон-глиального сопряжения и взаимодействия астроцитов с другими клетками гематоэнцефалического барьера в обычных условиях (a) и при активации астроцитов (b). Коричневые стрелки отображают влияние астроцитов на другие виды клеток, черная стрелка показывает влияние эндотелиоцитов на астроциты.
ЗАКЛЮЧЕНИЕ
Экспериментальные данные свидетельствуют о том, что существенный вклад в пластичность головного мозга вносит сопряжение процессов нейрогенеза и церебрального ангиогенеза. Это сопряжение важно для формирования локального микроокружения, оптимального для контроля функциональной активности стволовых и прогениторных клеток нейрогенных ниш. Функциональное состояние клеток эндотелия микрососудов головного мозга, целостность и избирательная проницаемость гематоэнцефалического барьера находятся под контролем периваскулярных астроцитов, которые могут являться мишенью для управления процессами нейрогенеза и церебрального ангиогенеза. Разработка новых технологий адресной (оптогенетической) модуляции активности клеток эндотелия и периваскулярной астроглии перспективна для создания протоколов восстановления нейрогенеза при нейродегенерации.
Список литературы
Nikitin VP, Sherstnev VV (2009) The Concept of the Integrative Activities of Neurons and Mechanisms of Neuroplasticity. Neurochem J 3: 29–34. https://doi.org/10.1134/S1819712409010048
Riguelme PA, Drapeau E, Doetsch F (2008) Brain micro-ecologies: neural stem cell niches in the adult mammalian brain. Philos Trans R Soc Lond B Biol Sci 363: 123–137. https://doi.org/10.1098/rstb.2006.2016
Trentesaux C, Striediner K, Pomerants J, Klein OD (2020) From gut to glutes: The critical role of niche signals in the maintenance and renewal of adult stem cells. Curr Opin Cell Biol 63: 88–101. https://doi.org/10.1016/j.ceb.2020.01.004
Abrous DN, Koehl M, Le Moal M (2005) Adult neurogenesis: From precursors to network and physiology. Physiol Rev 85: 523–569. https://doi.org/10.1152/physrev.00055.2003
Altman J, Das GD (1965) Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. J Comp Neurol 124: 319–335. https://doi.org/10.1002/cne.901240303
Altman J, Das GD (1966) Autoradiographic and histological studies of postnatal neurogenesis. I. A longitudinal investigation of the kinetics, migration and transformation of cells incorporating tritiated thymidine in neonate rats, with special reference to postnatal neurogenesis in some brain regions. J Comp Neurol 126: 337–389. https://doi.org/10.1002/cne.901260302
Butti E, Cusimano M, Bacigaluppi M, Martino G (2014) Neurogenic and non-neurogenic functions of endogenous neural stem cells. Front Neurosci 8: 92. https://doi.org/10.3389/fnins.2014.00092
Avarez-Buylla A, Lim DA (2004) For the long run: maintaining germinal niches in the adult brain. Neuron 41: 683–686. https://doi.org/10.1016/s0896-6273(04)00111-4
Mind GL, Song H (2005) Adult neurogenesis in the mammalian central nervous system. Annu Rev Neurosci 28: 223–250. https://doi.org/10.1146/annurev.neuro.28.051804.101459
Mandairon N, Sacquet J, Garcia S, Ravel N, Jourdan F, Didier A (2006) Neurogenic correlates of an olfactory discrimination task in the adult olfactory bulb. Eur J Neurosci 24: 3578–3588. https://doi.org/10.1111/j.1460-9568.2006.05235.x
Shors TJ, Townsend DA, Zhao M, Kozorovitskiy Y, Gould E (2002) Neurogenesis may relate to some but not all types of hippocampal-dependent learning. Hippocampus 12: 578–584. https://doi.org/10.1002/hipo.10103
Wiltrout C, Lang B, Yan Y, Dempsey RJ, Vemuganti R (2007) Repairing brain after stroke: A review on post-ischemic neurogenesis. Neurochem Int 50: 1028–1041. https://pubmed.ncbi.nlm.nih.gov/17531349
Dennis CV, Suh LS, Rodriguez ML, Kril JJ, Sutherland GT (2016) Human adult neurogenesis across the ages: An immunohistochemical study. Neuropathol Appl Neurobiol 42: 621–638. https://doi.org/10.1111/nan.12337
Young SZ, Taylor MM, Bordey A (2011) Neurotransmitters couple brain activity to subventricular zone neurogenesis. Eur J Neurosci 33: 1123–1132. https://doi.org/10.1111/j.1460-9568.2011.07611.x
Lee JC (1971) Evolutyion in the concept of the blood-brain barrier phenomen. Prog Neuropathol 1: 84–145.
Joó F (1996) Endothelial cells of the brain and other organ systems: some similarities and difference. Progress Neurobiol 48: 255–273. https://doi.org/10.1016/0301-0082(95)00046-1
Bradbury MW (1985) The blood-brain barrier. Transport across the cerebral endothelium. Circ Res 57: 213–222. https://doi.org/10.1161/01.res.57.2.213
Begley DJ, Brightman MW (2003) Structural and functional aspects of the blood-brain barrier. Prog Drug Res 61: 39–78. https://doi.org/10.1007/978-3-0348-8049-7_2
Pardridge WM (1999) Blood-brain barrier biology and methodology. J Neurovirol 5: 556–569. https://doi.org/10.3109/13550289909021285
Roh E, Song DK, Kim MS (2016) Emerging role of the brain in the homeostatic regulation of energy and glucose metabolism. Exp Mol Med 48: e216. https://doi.org/10.1038/emm.2016.4
Hawkins BT, Davis TP (2005) The blood-brain barrier/neurovascular unit in health disease. Pharmacol Rev 57: 173–185. https://doi.org/10.1124/pr.57.2.4
Rubin LL, Staddon JM (1999) The cell biology of the blood-brain barrier. Annu Rev Neurosci 22: 11–28. https://doi.org/10.1146/annurev.neuro.22.1.11
Abbott NJ, Patabendige AA, Dolman DE, Yusof SR, Begley DJ (2010) Structure and function of the blood-brain barrier. Neurobiol Dis 37(1): 13–25. https://doi.org/10.1016/j.nbd.2009.07.030
Ballabh P, Braun A, Nedergaard M (2004) The blood–brain barrier: an overview: structure, regulation, and clinical implications. Neurobiol Dis 16(1): 1–13. https://pubmed.ncbi.nlm.nih.gov/15207256/
Салмина АБ, Моргун АВ, Кувачева НВ, Комлева ЮК, Пожиленкова ЕА, Кутищева ИА, Труфанова ЛВ, Таранушенко ТЕ, Мартынова ГП (2013) Межклеточные взаимодействия в развивающемся гематоэнцефалическом барьере. Педиатрия Журн им ГН Сперанского 92:155–159. [Salmina AB, Morgun AV, Kuvacheva NV, Komleva YuK, Pojilenkova EA, Kutischeva IA, Trufanova LV, Taranushenko TE, Martyinova GP (2013) Mezhkletochnyye vzaimodeystviya v razvivayushchemsya gematoentsefalicheskom bar’yere. Pediatriya Zhurn Im GN Speranskogo 92: 155–159. (In Russ)]. https://www.elibrary.ru/item.asp?id=19394048
Palmer TD, Willhoite AR, Gage FH (2000) Vascular niche for adult hippocampal neurogenesis. J Comp Neurol 425: 479–494. https://doi.org/10.1002/1096-9861(20001002)425:4<479::aid-cne2>3.0.co;2-3
Apple DM, Kokovay E (2017) Vascular niche contribution to age-associate neural stem cell dysfunction. Am J Physiol August 11: 896–902. https://journals.physiology.org/doi/pdf/10.1152/ajpheart.00154.2017
Alvarez-Buylla A, Garcia-Verdugo JM (2002) Neurogenesis in adult subventricular zone. J Neurosci 22: 629–634. https://doi.org/10.1523/JNEUROSCI.22-03-00629.2002
Doetsch F (2003) A niche for adult neural stem cell niche. Curr Opin Genetic Develop 13: 543–550. https://doi.org/10.1016/j.gde.2003.08.012
Salmina AB, Morgun AV, Kuvacheva NV, Lopatina OL, Komleva YK, Malinovskaya NA, Pozhilenkova EA (2014) Establishment of neurogenic microenvironment in the neurovascular unit: the connexin 43 story. Rev Neurosci 25: 97–111. https://doi.org/10.1515/revneuro-2013-0044
Pozhilenkova EA, Lopatina OL, Komleva YK, Salmin VV, Salmina AB (2017) Blood-brain barrier-supported neurogenesis in healthy and diseased brain. Rev Neurosci 28: 397–415. https://doi.org/10.1515/revneuro-2016-0071
Conover JC, Notti RQ (2008) The neural stem cell niche. Cell Tissue Res 331: 211–224. https://doi.org/10.1007/s00441-007-0503-6
Jin K, Zhu Y, Sun Y, Mao XO, Xie L, Greenberg DA (2002) Vascular endothelial growth factor (VEGF) stimulates neurogenesis in vitro and in vivo. Proc Natl Acad Sci U S A 99: 11946–11950. https://doi.org/10.1073/pnas.182296499
Doetsch F, Petreanu L, Caille I, Garcia-Verdugo JM, Alvarez-Buylla A (2002) EGF converts transit-amplifying neurogenic precursors in the adult brain into multipotent stem cells. Neuron 36: 1021–1034. https://doi.org/10.1016/s0896-6273(02)01133-9
Kilpatrick TJ, Barlett PF (1995) Cloned multipotential precursors from the mouse cerebrum require FGF-2, whereas glial restricted precursors are stimulated with either FGF-2 or EGF. J Neurosci 15: 3653–3661. https://doi.org/10.1523/JNEUROSCI.15-05-03653.1995
Cheng A, Wang S, Cai J, Rao MS, Mattson MP (2003) Nitric oxide act in a positive feedback loop with BDNF to regulate neural progenitor cell proliferation and differentiation in the mammalian brain. Dev Biol 258: 319–333. https://doi.org/10.1016/s0012-1606(03)00120-9
Andreu-Agulló C, Morante-Redolat JM, Delgado AC, Fariñas I (2009) Vascular niche factor PEDF modulates Notch-dependent stemness in the adult subependymal zone. Nat Neurosci 12: 1514–1523. https://doi.org/10.1038/nn.2437
Ramírez-Castillejo C, Sánchez-Sánchez F, Andreu-Agulló C, Ferrón SR, Aroca-Aguilar JD, Sánchez P, Mira H, Escribano J, Fariñas I (2006) Pigment epithelium-derived factor is a niche signal for neural stem cell renewal. Nat Neurosci 9: 331–339. https://doi.org/10.1038/nn1657
Zhang J, Jiao J (2015) Molecular Biomarkers for Embryonic and Adult Neural Stem Cell and Neurogenesis. Biomed Res Int 2015: 727542. https://doi.org/10.1155/2015/727542
Bátiz LF, Castro MA, Burgos PV, Velásquez ZD, Muñoz RI, Lafourcade CA, Troncoso-Escudero P, Wyneken U (2016) Exosomes as Novel Regulators of Adult Neurogenic Niches. Front Cell Neurosci 9: 501. https://doi.org/10.3389/fncel.2015.00501
Delgado AC, Ferrón SR, Vicente D, Porlan E, Perez-Villalba A, Trujillo CM, D'Ocón P, Fariñas I (2014) Endothelial NT-3 Delivered by Vasculature and CSF Promotes Quiescence of Subependymal Neural Stem Cells through Nitric Oxide Induction. Neuron 83: 572–585. https://doi.org/10.1016/j.neuron.2014.06.015
Gómez-Gaviro MV, Scott CE, Sesay AK, Matheu A, Booth S, Galichet C, Lovell-Badge R (2012) Betacellulin promotes cell proliferation in the neural stem cell niche and stimulates neurogenesis. Proc Natl Acad Sci U S A 109: 1317–1322. https://doi.org/10.1073/pnas.1016199109
Crouch EE, Liu C, Silva-Vargas V, Doetsch F (2015) Regional and stage-specific effects of prospectively purified vascular cells on the adult V-SVZ neural stem cell lineage. J Neurosci 35: 4528–4539. https://doi.org/10.1523/JNEUROSCI.1188-14.2015
Chong CM, Ai N, Ke M, Tan Y, Huang Z, Li Y, Lu JH, Ge W, Su H (2018) Roles of Nitric Oxide Synthase Isoforms in Neurogenesis. Mol Neurobiol 55: 2645–2652. https://doi.org/10.1007/s12035-017-0513-7
Goldberg JS, Hirschi KK (2012) A Vascular perspective on neurogenesis. In: Bonfanti L (ed.) Neural Stem Cells – New Perspectives. https://www.intechopen.com/chapters/44266
Lamus F, Martín C, Carnicero E, Moro JA, Fernández JMF, Mano A, Gato Á, Alonso MI (2020) FGF2/EGF contributes to brain neuroepithelial precursor proliferation and neurogenesis in rat embryos: the involvement of embryonic cerebrospinal fluid. Dev Dyn 249: 141–153. https://doi.org/10.1002/dvdy.135
Zheng W, Nowakowski RS, Vaccarino FM (2004) Fibroblast growth factor 2 is required for maintaining the neural stem cell pool in the mouse brain subventricular zone. Dev Neurosci 26: 181–196. https://doi.org/10.1159/000082136
Killer K, Le O, Beauséjour C (2021) The Intracerebroventricular Injection of Murine Mesenchymal Stromal Cells Engineered to Secrete Epidermal Growth Factor Does Not Prevent Loss of Neurogenesis in Irradiated Mice. Radiat Res 196: 315–322. https://doi.org/10.1667/RADE-21-00017.1
Yang C, Qi Y, Sun Z (2021) The Role of Sonic Hedgehog Pathway in the Development of the Central Nervous System and Aging-Related Neurodegenerative Diseases. Front Mol Biosci 8: 711710. https://doi.org/10.3389/fmolb.2021.711710
Kandasamy M, Lehner B, Kraus S, Sander PR, Marschallinger J, Rivera FJ, Trümbach D, Ueberham U, Reitsamer HA, Strauss O, Bogdahn U, Couillard-Despres S, Aigner L (2014) TGF-beta signalling in the adult neurogenic niche promotes stem cell quiescence as well as generation of new neurons. J Cell Mol Med 18: 1444–1459. https://doi.org/10.1111/jcmm.12298
Dumont CM, Piselli JM, Kazi N, Bowman E, Li G, Linhardt RJ, Temple S, Dai G, Thompson DM (2017) Factors Released from Endothelial Cells Exposed to Flow Impact Adhesion, Proliferation, and Fate Choice in the Adult Neural Stem Cell Lineage. Stem Cells Dev 26: 1199–1213. https://doi.org/10.1089/scd.2016.0350
Qiu Z, Yang J, Deng G, Li D, Zhang S (2021) Angiopoietin-like 4 promotes angiogenesis and neurogenesis in a mouse model of acute ischemic stroke. Brain Res Bull 168: 156–164. https://doi.org/10.1016/j.brainresbull.2020.12.023
Obernier K, Alvarez-Buylla A (2019) Neural stem cells: origin, heterogeneity and regulation in the adult mammalian brain. Development 146: dev156059. https://doi.org/10.1242/dev.156059
Li F, Chong ZZ, Maiese K (2006) Winding through the WNT pathway during cellular development and demise. Histol Histopathol 21: 103–124. https://doi.org/10.14670/HH-21.103
Young JK, Heinbockel T, Gondré-Lewis MC (2013) Astrocyte fatty acid binding protein-7 is a marker for neurogenic niches in the rat hippocampus. Hippocampus 23: 1476–1483. https://doi.org/10.1002/hipo.22200
Салмина АБ, Малиновская НА, Кувачева НВ, Моргун АВ, Хилажева ЕД, Горина ЯВ, Пожиленкова ЕА, Фролова ОВ (2014) Коннексиновые и паннексиновые транспортные системы в клетках нейроваскулярной единицы головного мозга. Нейрохимия 31:122–133. [Salmina AB, Malinovskaya NA, Kuvacheva NV, Morgun AV, Khilazheva ED, Gorina YaV, Pozhilenkova EA, Frolova OV (2014) Connexin and Pannexin Transport Systems in Cells of Neurovascular Unit of the Brain. Neurochem J 31: 122–133. (In Russ)]. https://doi.org/10.7868/s1027813314020095
Heneka MT, Rodríguez JJ, Verkhratsky A (2010) Neuroglia in neurodegeneration. Brain Res Rev 63: 189–211. https://doi.org/10.1016/j.brainresrev.2009.11.004
Caesar K, Hashemi P, Douhou A, Bonvento G, Boutelle M, Walls, Lauritzen M (2008) Glutamate receptor-dependent increments in lactate, glucose and oxygen metabolism evoked in rat cerebellum in vivo. J Physiol 586(5): 1337–1349. https://pubmed.ncbi.nlm.nih.gov/18187464/
Horvat A, Muhic M, Smolic T, Begic E, Zorec R, Kreft M, Vardjan N (2021) Ca2+ as the prime trigger of aerobic glycolysis in astrocytes. Cell Calcium 95: 102368. https://www.sciencedirect.com/science/article/pii/S0143416021000221
Siegenthaler JA, Sohet F, Daneman R (2013) 'Sealing off the CNS’: cellular and molecular regulation of blood-brain barriergenesis. Curr Opin Neurobiol 23: 1057–1064. https://doi.org/10.1016/j.conb.2013.06.006
Mizee MR, Wooldrik D, Lakeman KA, van het Hof B, Drexhage JA, Geerts D, Bugiani M, Aronica E, Mebius RE, Prat A, de Vries HE, Reijerkerk A (2013) Retinoic acid induces blood-brain barrier development. J Neurosci 33: 1660–1671. https://doi.org/10.1523/JNEUROSCI.1338-12.2013
Ferrara N, Gerber HP, LeCouter J (2003) The biology of VEGF and its receptors. Nat Med 9: 669–676. https://doi.org/10.1038/nm0603-669
You T, Bi Y, J Li, Zhang M, Chen X, Zhang K, Li J (2017) IL-17 induces reactive astrocytes and up-regulation of vascular endothelial growth factor (VEGF) through JAK/STAT signaling. Scient Rep7: 41779. https://www.nature.com/articles/srep41779
Choi SH, Kim HJ, Cho HJ, Park SD, Lee NE, Hwang SH, Rhim H, Kim HC, Cho IH, Nah SY (2019) Gintonin-mediated release of astrocytic vascular endothelial growth factor protect cortical astrocytes from hypoxia-induced cell damages. J Ginseng Res 43(2): 305–311. https://khu.elsevierpure.com/en/publications/gintonin-mediated-release-of-astrocytic-vascular-endothelial-grow
Shen Y, Gu J, Liu Z, Xu C, Qian S, Zhang X, Zhou B, Guan Q, Sun, Y, Wang Y, Jin X (2018) Inhibition of HIF-1α Reduced Blood Brain Barrier Damage by Regulating MMP-2 and VEGF During Acute Cerebral Ischemia. Front Cell Neurosci 4. https://www.frontiersin.org/articles/10.3389/fncel.2018.00288/full
Liu J, Li J (2022) Astrocytes Protect Human Brain Microvascular Endothelial Cells from Hypoxia Injury by Regulating VEGF Expression. J Healthcare Engineer ID 1884959. https://www.hindawi.com/journals/jhe/2022/1884959/
Baumann J, Tsao CC, Huang SF, Gassmann M, Ogunshola OO (2021) Astrocyte-specific hypoxia-inducible factor 1 (HIF-1) does not disrupt the endothelial barrier during hypoxia in vitro. Fluids and Barriers of the CNS 18(13). https://fluidsbarrierscns.biomedcentral.com/articles/10.1186/s12987-021-00247-2
Jin K, Zhu Y, Sun Y, Mao, X., Xie, L., Greenberg DA (2002) Vascular endothelial growth factor (VEGF) stimulates neurogenesis in vitro and in vivo. Biol Sci 99(18): 11946–11950. https://www.pnas.org/doi/10.1073/pnas.182296499
Udo H, Yoshida Y, Kino T, Ohnuki K, Mizunoya W, Mukuda T, Sugiyama H (2008) Enhanced Adult Neurogenesis and Angiogenesis and Altered Affective Behaviors in Mice Overexpressing Vascular Endothelial Growth Factor 120. J Neurosci 28(53): 14522–14536. https://sci-hub.wf/10.1523/JNEUROSCI.3673-08.2008
Комлева ЮК, Салмина АБ, Прокопенко СВ, Шестакова ЛА, Петрова ММ, Малиновская ММ, Лопатина ОЛ (2013) Изменения структурно-функциональной пластичности головного мозга, индуцированные обогащенной средой. Вестник акад мед наук 6:39–48. [Komleva Yu, Salmina AB, Prokopenko CV, Shestakova LA, Petrova MM, Malinovskaya NA, Lopatina OL (2013) Changes in structural and functional plasticity of the brain induced by environmental enrichment. Ann Rus Acad Med Sci 6: 39–48. (In Russ)]. https://www.elibrary.ru/item.asp?id=19139669
Hummel FC, Cohen LG (2005) Drivers of brain plasticipy. Curr Opin Neurol 18: 667– 674. https://doi.org/10.1097/01.wco.0000189876.37475.42
Lin R, Cai J, Nathan C, Wei X, Schleidt S, Rosenwasser R, Iacovitti L (2015) Neurogenesis is enchanced by stroke in multiple new stem cell niches along the ventricular system at sites of high BBB permeability. Neurobiol Dis 74: 229–239. https://doi.org/10.1016/j.nbd.2014.11.016
Font MA, Arboix A, Krupinski J (2010) Angiogenesis, neurogenesis and neuroplasticity in ischemic stroke. Curr Cardiol Rev 6: 238–244. https://doi.org/10.2174/157340310791658802
Biron KE, Dickstein DL, Gopaul R, Jefferies WA (2011) Amyloid triggers extensive cerebral angiogenesis causing blood brain barrier permeability and hypervascularity in Alzheimer’s disease. PLoS One 6: e23789. https://doi.org/10.1371/journal.pone.0023789
Palma-Tortosa S, García-Culebras A, Moraga A, Hurtado O, Ruiz-Peres A, Duran-Laforet V, Parra J, Cuartero MI, Pradillo JM, Moro MA, Lizasoain I (2017) Specific Features of SVZ Neurogenesis After Cortical Ischemia: a Longitudinal Study. Sci Rep 7: 16343. https://doi.org/10.1038/s41598-017-16109-7
Deshapande SS, Malik S, Conforti P, Lin J-di, Chu Yu-H, Nath S, Greulich F, Dumbach M-A, Uhlenhaut NH, Shachtrup C (2021) P75 neurotrophin receptor controls subventricular zone neural stem cell after stroke. Cell and Tissue Res 926. https://link.springer.com/article/10.1007/s00441-021-03539-z
Liang H, Zhao H, Gleichman A, Carmichael ST (2019) Region-specific and activity-dependent regulation of SVZ neurogenesis and recovery after stroke. Biol Sci 116(27): 13621–13630. https://doi.org/10.1073/pnas.1811825116
Mahoney ER, Dumitrescu L, Moore AM, Cambronero FE, De Jager PL, Koran MEI, Petyuk VA, Robinson RAS, Goyal S, Schneider JA, Bennett DA, Jefferson AL, Hohman TJ (2021) Brain expression of the vascular endothelial growth factor gene family in cognitive aging and alzheimer’s disease. Mol Psychiatry 26: 888–896. https://doi.org/10.1038/s41380-019-0458-5
Zhu H, Zhang Y, Zhong Yi, Ye Y, Hu X, Gu L, Xiong X (2021) Inflammation-Mediated Angiogenesis in Ischemic Stroke. Front Cell Neurosci. https://www.frontiersin.org/articles/10.3389/fncel.2021.652647/full
Lin R, Cai J, Nathan C, Wei X, Schleidt S, Rosenwasser R, Iacovitti L (2015) Neurogenesis is enhanced by stroke in multiple new stem cell niches along the ventricular system at sites of high BBB permeability. Neurobiol Disease 74: 229–239. https://doi.org/10.1016/j.nbd.2014.11.016
Lin R, Cai J, Kenyon L, Iozzo R, Rosenwasser R, Iacovitti L (2019) Systemic Factors Trigger Vasculature Cells to Drive Notch Signaling and Neurogenesis in Neural Stem Cells in the Adult Brain. Stem Cells 37: 395–406. https://doi.org/10.1002/stem.2947
Rodrigues JJ, Jones VC, Verkhratsky A (2009) Impaired cell proliferation in the subventricular zone in an Alzheimer’s disease model. Neuroreport 20(10): 907–912. https://pubmed.ncbi.nlm.nih.gov/19494789/
Demars M, Hu Y-S, Gadadhar A, Lazarov O (2010) Impaired neurogenesis is an early event in the etiology of familial Alzheimer’s disease in transgenic mice. J Neurosci Res 88(10): 2103–2117. https://pubmed.ncbi.nlm.nih.gov/20209626/
Gerozissis K (2008) Brain insulin, energy and glucose homeostasis; genes, environment and metabolic pathologies. Eur J Pharmacol 585: 38–49. https://doi.org/10.1016/j.ejphar.2008.01.050
Lin R, Cal J, Kenyon L, Iozzo R, Rosenwasser R, Iacovitti L (2019) Systemic Factors Trigger Vasculature Cells to Drive Notch Signaling and Neurogenesis in Neural Stem Cells in the Adult Brain. Stem Cells 37: 395–406. https://doi.org/10.1002/stem.2947
Garcia-Caceres C, Quarta C, Varela L, Gao Y, Gruber T, Legutko B, Jastroch M, Johansson P, Ninkovic J, Yi C-X, Le Thuc O, Szigeti-Buck K, Cai W, Meyer CW, Pfluger PT, Fernandez A, Luquet S, Woods SC, Torres-Aleman I, Kahn CR, Gotz M, Horvanth TL, Tschop MH (2016) Astrocytic Insulin Signaling Couples Brain Glucose Uptake with Nutrient Availability. Cell 166(4): 867–880. https://pubmed.ncbi.nlm.nih.gov/27518562/
Салмина АБ, Яузина НА, Кувачева НВ, Петрова ММ, Таранушенко ТЕ, Малиновская НА, Лопатина ОЛ, Моргун АВ, Пожиленкова ЕА, Окунева ОС, Морозова ГА, Прокопенко СВ (2013) Инсулин и инсулинорезистентность: новые молекулы-маркеры и молекулы-мишени для диагностики и терапии заболеваний центральной нервной системы. Бюл сибирск мед 12: 104–118. [Salmina AB, Yauzina NA, Kuvacheva NV, Petrova MM, Taranushenko TY, Malinovskaya NA, Lopatina OL, Morgun AV, Pozhilenkova YA, Okuneva OS, Morozova GA, Prokopenko SV (2013) Insulin and insulin resistance: new molecule markers and target molecule for the diagnosis and therapy of disease of central nervous system. Bull Siber Med 12: 104–118. (In Russ)]. https://doi.org/10.20538/1682-0363-2013-5-104-118
Горина ЯВ, Салмина АБ, Кувачева НВ, Комлева ЮК, Федюкович ЛВ, Успенская ЮА, Морозова ГА, Демко ИВ, Петрова ММ (2014) Нейровоспаление и инсулинорезистентность при болезни Альцгеймера. Сибирск мед обозр 4: 11–19. [Gorina YaV, Salmina AB, Kuvacheva NV, Komleva YuK, Fedyukovich LV, Uspenskaya YuA, Morozova GA, Demko IV, Petrova MM (2014) Neuroinflammation and insulin resistance in Alzheimer’s disease. Siber Med Rev 4: 11–19. (In Russ)]. https://www.elibrary.ru/query_results.asp
Горина ЯВ, Лопатина ОЛ, Комлева ЮК, Черных АИ, Салмина АБ (2018) Роль нейровоспаления в реализации когнитивных функций и социального взаимодействия у мышей с возрастзависимой нейродегенерацией. Анналы клин экспер неврол 12: 27–32. [Gorina YaV, Lopatina OL, Komleva YuK, Chernikh AI, Salmina AB (2018) The role neuroinflammation in cognitive functions and social interaction in mice with age-dependent neurodegeneration. Ann Clin Exp Neurol 12: 27–32. (In Russ)]. https://www.elibrary.ru/item.asp?id=42236418&
Горина ЯВ, Осипова ЕД, Моргун АВ, Малиновская НА, Комлева ЮК, Салмина АБ (2020) Абберантный ангиогенез в ткани головного мозга при экспериментальной болезни Альцгеймера. Бюлл сибирск мед 19: 46–52. [Gorina YaV, Osipova ED, Morgun AV, Malinovskaya NA, Komleva YuK, Lopatina OL, Salmina AB (2020) Aberrant angiogenesis in brain tissue in experimental Alzheimer’s disease. Bull Siber Med 19: 46–52. (In Russ)]. https://doi.org/10.20538/1682-0363-2020-4-46-52
Hockeimer W (2021) Non-spatial Information Encoding in Hippocampal CA1. Theses and Dissertation, Electronic (ETDs). https://jscholarship.library.jhu.edu/handle/1774.2/63959
Моргун АВ, Осипова ЕД, Бойцова ЕБ, Лопатина ОЛ, Горина ЯВ, Пожиленкова ЕА, Салмина АБ (2020) Васкулярный компонент нейровоспаления при экспериментальной болезни Альцгеймера у мышей. Цитология 62:16–23. [Morgun AV, Osipova ED, Boytsova EB, Lopatina OL, Gorina YaV, Pozhilenkova EA, Salmina AB (2020) Vascular component of neuroinflammation in experimental Alzheimer′s disease in mice. Tsitologiya 62: 16–23. (In Russ)]. https://doi.org/10.31857/s0041377120010058
Горина ЯВ, Осипова ЕД, Моргун АВ, Бойцова ЕБ, Лопатина ОЛ, Салмина АБ (2021) Оценка уровня RAGE в клетках гематоэнцефалического барьера при экспериментальной болезни Альцгеймера. Цитология 63: 176–183. [Gorina YaV, Osipova ED, Morgun AV, Boytsova EB, Lopatina OL, Salmina AB (2021) Assessment of the RAGE in cells blood-brain barrier in experiment Alzheimer′s disease. Tsitologiya 63:176–183. (In Russ)]. https://doi.org/10.1134/S1990519X21030032
Моргун АВ, Осипова ЕД, Бойцова ЕБ, Шуваев АН, Комлева ЮК, Труфанова ЛВ, Вайс ЕФ, Салмина АБ (2019) Астроцит-опосредованные механизмы регуляции нейрогенеза в модели нейрогенной ниши in vitro при действии Aβ1-42. Биомед химия 65: 366–373. [Morgun AV, Osipova ED, Boytsova EB, Shuvaev YuN, Komleva YuK, Trufanova LV, Vais EF, Salmina AB (2019) Astroglia-mediated regulation of cell development in the model of neurogenic niche in vitro treated with Aβ1-42. Biomed khim 65: 366–373. (In Russ)]. https://doi.org/10.18097/pbmc20196505366
Хилажева ЕД, Моргун АВ, Бойцова ЕБ, Мосягина АИ, Шуваев АН, Малиновская НА, Успенская ЮА, Пожиленкова ЕА, Салмина АБ (2021) Особенности экспрессионного профиля клеток в модели нейрогенной ниши гиппокампа in vitro при оптогенетической стимуляции. Биомед химия 67: 34–41. [Khilazheva ED, Morgun AV, Boytsova EB, Mosiagina AI, Shuvaev AN, Malinovskaya NA, Uspenskaya YuA, Pozhilenkova EA, Salmina AB (2021) Features of the in vitro expression profile of hippocampal neurogenic niche cells during optogenetic stimulation. Biomed khim 67: 34–41. (In Russ)]. https://doi.org/10.18097/pbmc20216701034
Хилажева ЕД, Писарева НВ, Моргун АВ, Бойцова ЕБ, Таранушенко ТЕ, Фролова ОВ, Салмина АБ (2017) Активация лактатных рецепторов GPR81 стимулирует митохондриальный биогенез в клетках эндотелия церебральных микрососудов. Анналы клин экспер неврол 11: 34–39. [Khilazheva ED, Pisareva NB, Morgun AV, Boytsova EB, Taranushenko TE, Frolova OV, Salmina AB (2017) Activation of lactate receptors GPR81 stimulates mitochondrial biogenesis in celebral microvessel endothelial cell. Ann Clin Exp Neurol 11: 34–39. (In Russ)]. https://doi.org/10.18454/ACEN.2017.1.6155
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


