Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 5, стр. 547-561
Роль эндотелиального транспортера лизофосфатидилхолина Mfsd2a в поддержании целостности гематоэнцефалического барьера и поступления в мозг омега-3 полиненасыщенных жирных кислот
Р. Г. Парнова *
Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: rimma_parnova@mail.ru
Поступила в редакцию 13.01.2022
После доработки 02.02.2022
Принята к публикации 02.02.2022
- EDN: NQNDFN
- DOI: 10.31857/S0869813922050090
Аннотация
Белок Mfsd2a (Major Facilitator Superfamily Domain Containing 2a) селективно экспрессируется в эндотелии капилляров мозга и является мембранным Na+-зависимым специфическим транспортером лизофосфатидилхолина (лизоФХ), этерифицированного полиненасыщенными жирными кислотами омега-3 ряда. В настоящем обзоре обобщены современные представления о молекулярных механизмах функционирования Mfsd2a в клетках эндотелия и роли транспортируемых им липидов в торможении кавеолин-зависимого трансцитоза и поддержании низкой проницаемости гематоэнцефалического барьера. Рассмотрена роль Mfsd2a-опосредованного переноса лизоФХ как важнейшего пути поступления в мозг и сетчатку глаза докозагексаеновой кислоты и других жирных кислот омега-3 ряда, необходимых для нормального развития и функционирования ЦНС и зрительной системы. Обсуждается защитная роль Mfsd2a в различных нейропатологиях ЦНС, а также анализируются перспективы разработки Mfsd2a-опосредованных терапевтических стратегий для увеличения биодоступности эссенциальных полиненасыщенных жирных кислот и доставки в ткани мозга лекарственных препаратов, не проникающих через гематоэнцефалический барьер.
Гематоэнцефалический барьер (ГЭБ), изолирующий паренхиму мозга от кровотока, является ключевым структурно-функциональным компонентом так называемой нейроваскулярной единицы, которая включает в себя функционально-связанные эндотелиальные клетки капилляров мозга, астроциты, нейроны, перициты и внеклеточный матрикс [1–3]. Нейроваскулярная единица обеспечивает сложнейшие процессы регуляции гомеостаза мозга, гемодинамику, нейропластичность, поступление кислорода и питательных веществ в паренхиму мозга, удаление продуктов метаболизма. Ключевую роль в организации прохождения веществ через ГЭБ играет эндотелий капилляров, который содержит в плазматической мембране огромное разнообразие транспортеров, обеспечивающих контролируемое поступление в мозг жизненно необходимых веществ. В отличие от капилляров периферических тканей, эндотелий капилляров мозга обладает низкой проницаемостью, обеспечивая защиту нервной ткани от патогенов, токсинов, клеток крови и нежелательных потенциально опасных макромолекулярных соединений. Еще в конце 60-х годов прошлого века методами электронной микроскопии были установлены важные структурно-функциональные особенности эндотелия ЦНС, которые обеспечивают его барьерную функцию. Во-первых, наличие плотных межклеточных контактов (tight junction) с высоким электрическим сопротивлением, ограничивающих парацеллюлярный транспорт, во-вторых, крайне низкий, в отличие от клеток эндотелия периферических органов, уровень трансцеллюлярного транспорта – трансцитоза [3–6].
Среди огромного числа транспортеров, обеспечивающих поступление в мозг необходимых веществ и поддержание его химического постоянства, особая роль принадлежит натрий-зависимому транспортеру Mfsd2a (Major Facilitator Superfamily Domain containing 2a), селективно транспортирующего лизофосфатидилхолин (лизоФХ), содержащий докозагексаеновую (С22:6 ω 3, ДГК) жирную кислоту омега-3 ряда, необходимую для нормального развития и функционирования мозга. ЛизоФХ – 1(2)-ацил-sn-глицеро-3-фосфохолин – продукт метаболизма фосфатидилхолина (ФХ), содержащий в отличие от большинства других фосфолипидов не две, а одну жирную кислоту – в первом или во втором положении глицериновой молекулы. ЛизоФХ образуется при действии на ФХ фосфолипазы А2 или лецитин-холестерин-ацилтрансферазы, которая переносит ацильный остаток с ФХ на холестерин. В клетках концентрация лизоФХ крайне низка, поскольку он быстро метаболизируется обратно в ФХ.
Транспортер Mfsd2a относится к суперсемейству белков MFS (Major Facilitator Superfamily), насчитывающему в настоящее время около 70 подсемейств и включающего в себя огромное количество транспортеров, переносящих через клеточную мембрану многочисленные вещества и субстраты – от простых неорганических и органических ионов до пептидов, углеводов и сложных липидов [7, 8]. Как показали данные последних лет, транспортер Mfsd2a экспрессируется в клетках эндотелия сосудов мозга и играет чрезвычайно важную роль как в снабжении мозга полиненасыщенными жирными кислотами омега-3 ряда, так и в торможении кавеолин-зависимого трансцитоза и поддержании низкой проницаемости гематоэнцефалического барьера. Настоящий обзор посвящен анализу этих данных.
СТРУКТУРА И ТРАНСПОРТИРУЮЩИЕ СВОЙСТВА Mfsd2a
Белок Mfsd2a был впервые идентифицирован в 2008 г. как мембранно-связанный белок с неизвестной функцией [9]. По аминокислотной последовательности и доменной организации он был наиболее схож с бактериальным Na+-зависимым транспортером дисахарида мелибиозы MelB, что позволило отнести его к транспортным белкам суперсемейства MFS. У мыши ген Mfsd2a имеет размер 14.3 кб, содержит 14 экзонов и 3 интрона и кодирует последовательность в 543 аминокислоты. Аминокислотная последовательность белка демонстрирует высокую степень гомологии у различных позвоночных от рыб до человека, причем у мыши и человека белки идентичны на 85% [9]. Как большинство белков семейства MFS, Mfsd2a имеет 12 трансмембранных доменов, собранных перпендикулярно плоскости бислоя в два пучка, которые связаны внутриклеточной петлей [10].
Максимальный уровень экспрессии мРНК Mfsd2a в тканях мышей был обнаружен в мозгу, кишечнике, почках, печени, легких [9]. В тканях бурого и белого жира уровень его экспрессии был невысок, однако он резко увеличивался при голодании и холодовой адаптации, а также демонстрировал зависимость от циркадианных ритмов, что позволило предположить участие Mfsd2a в регуляции энергетического обмена [9]. В более поздних работах было показано, что уровень его экспрессии в печени регулируется голоданием, у нокаутных по данному гену мышей обнаруживались нарушения энергетического баланса, что позволило отнести его к нутриционально-регулируемым генам с широким набором функций [11]. Эти исследования продолжаются до сих пор, однако главный фокус интереса был смещен на роль Mfsd2a в структурах ЦНС.
Исследование экспрессии белка в различных структурах мозга показало, что он активно экспрессируется в эндотелиальных клетках ГЭБ, но отсутствует в перицитах, окружающих сосуд, а также в астроцитах и нейронах [12]. Его экспрессия в клетках эндотелия ГЭБ выявляется на 15-й день эмбрионального развития мыши [9, 13]. Функциональная роль этого транспортера в эндотелии ГЭБ была выяснена в 2014 г. [13]. Липидомный и радиоизотопный анализ у мышей, нокаутных по гену Mfsd2a, выявил двукратное снижение уровня ДГК в фосфолипидах мозга (при этом в печени и сердце ее уровень не изменялся) и торможение переноса меченого лизоФХ, эстерифицированного ДГК или другими жирными кислотами, из крови в мозг. На клетках HEK-293, экспрессирующих Mfsd2a, авторы показали, что данный белок транспортирует длинноцепочечные жирные кислоты, но не свободные или связанные с альбумином, а входящие в состав лизоФХ. Наиболее активно транспортировался лизоФХ, содержащий в своей структуре ДГК. Перенос не осуществлялся, если в составе лизоФХ присутствовали жирные кислоты с длиной цепи менее 14 атомов углерода. Критичной для осуществления переноса являлось наличие фосфохолиновой биполярной группы в молекуле лизоФХ. В последующих работах было установлено, что перенос лизофосфолипидов, амфипатических по своей структуре, осуществляется через полость, образуемую двумя пучками трансмембранных доменов, в которой присутствуют гидрофильные и гидрофобные остатки аминокислот, там же находится Na-связывающий сайт и гидрофобный карман, связывающий лизоФХ. Связывание натрия с аминокислотными остатками D88 и D92 приводит к изменению конформации канала, что смещает пространственное расположение R85, который, действуя кооперативно с Е312, координирует перемещение полярной головки лизоФХ и делает возможным его перенос через бислой мембраны [10].
Обнаружено несколько летальных (p.Thr159Met, p.Ser166Leu) и нелетальных (p.Pro402His, p.Ser339Leu) мутаций в гене этого белка у человека, которые вызывают синдром микроцефалии. Мутированные участки белка располагаются в трансмембранных доменах. Вызываемая мутацией замена серина на лейцин в 339-ом положении приводит к снижению транспорта ДГК в мозг, значительному когнитивному дефициту, отсутствию речи и двигательным расстройствам [14]. Эта мутация не приводит к снижению экспрессии транспортера в эндотелии, однако нарушает его транспортные функции в отношении переноса ДГК. У больных в плазме крови значительно повышен уровень лизоФХ, содержащего моно- и полиненасыщенные жирные кислоты, что свидетельствует о снижении транспорта этих липидов в мозг [14]. Летальные мутации человека в гене Mfsd2a (p.Thr159Met, p.Ser166Leu) приводят к микроцефалии, судорогам и смерти в течение первых лет жизни [15]. Белки с данными аминокислотными заменами нормально экспрессируются в эндотелии ГЭБ, однако, как было показано в экспериментах на трансфицированных Mfsd2а клетках HEK293 с использованием меченых субстратов, они полностью теряют способность транспортировать лизоФХ через плазматическую мембрану. Помимо этого, в клетках, трансфицированных мутантными генами, заторможен обеспечиваемый действием лизоФХ-ацилтрансферазы процесс превращения лизоФХ в мембранный ФХ [15], что является необходимым условием для включения ДГК в мембранные липиды.
Mfsd2a-ОПОСРЕДОВАННЫЙ ТРАНСПОРТ лизоФХ В ЭНДОТЕЛИИ ГЭБ – ВАЖНЕЙШИЙ ПУТЬ ПОСТУПЛЕНИЯ ПОЛИНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ В МОЗГ
Хорошо известно, что мозг всех животных чрезвычайно богат липидами. У млекопитающих они составляют половину сухого веса ткани, уступая в этом отношении только жировой ткани. Огромное количество данных свидетельствует о важнейшей роли ДГК и других омега-3 полиненасыщенных жирных кислот в функционировании мозга. В процессе пренатального развития млекопитающих происходит динамичное накопление ДГК в структурах мозга, где она активирует процессы нейрогенеза, разветвление и рост отростков нервных клеток, стимулирует образование дендритных шипиков, синаптических контактов, обеспечивая процессы нейрональной и синаптической пластичности [16, 17]. Дефицит омега-3 полиненасыщенных жирных кислот в рационе животных приводит к снижению нейрогенеза, ухудшению пространственной памяти и способности к обучению, нарушению зрения, психомоторных функций и поведения, активации воспалительных и нейродегенеративных процессов [16, 18]. Поскольку мозг не синтезирует эти жирные кислоты de novo, они должные поступать извне – с пищей или из печени, где ДГК в ограниченном количестве синтезируется из альфа-линоленовой кислоты. В плазме крови ДГК в свободном виде или в составе фосфолипидов переносится в комплексе с альбуминами или липопротеинами, при этом, как оказалось, более половины всей ДГК плазмы крови этерифицировано в составе лизоФХ [19].
Связь поступления ДГК в развивающийся мозг с циркулирующим в плазме крови лизоФХ была установлена еще в начале 90-х годов. Было показано, что преимущественной формой поступления ДГК в мозг является лизоФХ, а в неэтерифицированном виде ее поступление было незначительным [20, 21]. Интересно, что этот феномен был обнаружен только в мозгу – в печени, сердце и почках оба пути поступления ДГК были равнозначны [21, 22], что еще в 90-е годы позволило предположить наличие специфического для сосудов мозга механизмов транспорта ДГК. На in vitro модели ГЭБ, сконструированной при сокультивировании эндотелиальных клеток сосудов мозга и астроцитов, было показано, что лизоФХ является основной формой переноса ДГК через ГЭБ. Интересно, что в отсутствие астроцитов способность к переносу лизоФХ утрачивалась [19]. В экспериментах на мышах с 30-дневным употреблением корма, содержащего лизоФХ-ДГК, было показано увеличение концентрации ДГК в мозгу в 2 раза и улучшение способности к обучению. Замена лизоФХ-ДГК на свободную ДГК не приводила к подобным эффектам [23].
Нокаутные по гену Mfsd2a мыши были не способны транспортировать в мозг меченую ДГК в составе лизоФХ, демонстрировали резкое снижение уровня ДГК в мозгу, микроцефалию, снижение числа клеток Пуркинье в мозжечке, снижение плотности нейронов в гиппокампе в областях CA1 и CA3, а также повышенную тревожность и когнитивный дефицит. Транспорт ДГК в составе лизоФХ в печень и сердце этих мышей был не изменен [13]. Таким образом было установлено, что (а) Mfsd2a в эндотелии ГЭБ является натрий-зависимым специфическим симпортером лизоФХ-ДГК, и (б) обеспечиваемый этим белком транспорт ДГК является одним из важнейших путей поступления этой жирной кислоты в мозг. В других работах было уточнено, что в количественном отношении Mfsd2a эндотелия мозга переносит меньше ДГК, чем совокупное действие FATP1 (fatty acid transport protein 1) и FABP5 (fatty acid-binding protein 5) – классических систем транспорта свободных жирных кислот в клетку, однако осуществляемый им транспорт более эффективен, а время полужизни лизоФХ-ДГК, как показали эксперименты с внутривенным введением липидов, дольше, чем свободной ДГК [24].
Интересно, что этим же механизмом, по всей вероятности, доставляется в мозг не только ДГК, но и другая полиненасыщенная жирная кислота омега-3 ряда – эйкозапентаеновая (ЭПК) – С20:5 ω 3. Несмотря на крайне низкое содержание этой жирной кислоты в фосфолипидах мозга млекопитающих, она обладает собственным функциональным потенциалом. Клинические и преклинические испытания свидетельствуют о том, что ЭПК более эффективна в лечении депрессивных расстройств, чем ДГК [25]. В связи с этим увеличение ее содержания в мозгу – актуальная клиническая задача, поскольку повысить ее содержание при использовании ЭПК в свободном виде в качестве пищевой добавки не удается. Оказалось, что можно достичь 100-кратного увеличения включения ЭПК в ФЛ мозга, если с диетой давать не свободную ЭПК, а лизоФХ-ЭПК [26]. При этом в фосфолипидах мозга увеличивается и уровень ДГК. Только при условии введения в организм лизоФХ-ЭПК, но не свободной ЭПК, наблюдается изменение экспрессии генов-мишеней в мозгу, таких как нейротрофический фактор мозга BDNF, рецептор серотонина 1A и др. Интересно, что такой механизм работает только в отношении мозга и сетчатки, поскольку добавка свободной ЭПК увеличивает ее уровень в жировой ткани, печени и сердце. Хотя участие Mfsd2a в транспорте лизоФХ-ЭПК в мозг не доказано, известно, что данный транспортер переносит лизоФХ с различными жирными кислотами с длиной цепи 14 и более атомов углерода, но не транспортирует свободные жирные кислоты [13]. В связи с этим авторы работы считают, что увеличение содержания ЭПК в фосфолипидах мозга обеспечивается функционированием Mfsd2a, а использование в терапевтических целях лизоФХ-ЭПК в форме пищевой добавки может быть эффективной стратегией коррекции депрессии, профилактике ретинопатии и макулодистрофии [26].
РОЛЬ Mfsd2a ТРАНСПОРТЕРА В СНИЖЕНИИ КАВЕОЛИН-ЗАВИСИМОГО ТРАНСЦЕЛЛЮЛЯРНОГО ТРАНСПОРТА В ЭНДОТЕЛИИ КАПИЛЛЯРОВ МОЗГА
Важной структурной особенностью клеток эндотелия ГЭБ, необходимой для поддержания его целостности, является низкий кавеолин-зависимый везикулярный транспорт [3, 6], один из важнейших механизмов обеспечения транспортных процессов в любых клетках. Оказалось, что в сдерживании активности данных транспортных процессов в клетках эндотелия капилляров мозга ведущая роль принадлежит белку Mfsd2а [12, 27]. У мышей, нокаутных по гену Mfsd2а, сохраняется целостность плотных контактов, однако обнаруживается высокая проницаемость ГЭБ, а в цитоплазме клеток эндотелия мозговых сосудов фиксируется интенсивный везикулярный транспорт [12].
Как оказалось, обнаруженный эффект Mfsd2а не связан с прямым действием белковой молекулы на процесс образования кавеол, а опосредуется способностью белка транспортировать в клетки эндотелия фосфолипиды, обогащенные ДГК, регулируя таким образом жирнокислотный состав плазматической мембраны. Была создана линия мышей, у которых белок Mfsd2а нормально экспрессировался в ткани мозга, но был лишен способности транспортировать липиды за счет замены аспарагина в 96-ом положении на аланин [27]. Такие мыши демонстрировали сходство с нокаутными по данному гену: у них наблюдалась микроцефалия, повышение проницаемости ГЭБ, резкое увеличение числа внутриклеточных везикул в клетках эндотелия мозга. Полученные данные свидетельствовали о том, что решающую роль в торможении трансцеллюлярного транспорта в клетках эндотелия мозга играет Mfsd2а-опосредуемый транспорт лизоФХ.
Сравнение методами липидомики состава жирных кислот эндотелия капилляров с низким (мозг) и высоким (легкие) трансцеллюлярным транспортом показало, что содержание ДГК в мембранах эндотелия мозга в 2–5 раз выше (в зависимости от класса фосфолипидов), чем в легких [27]. Уровень экспрессии мРНК Mfsd2а в эндотелии мозга почти в 80 раз выше, чем в эндотелии легких [12]. Каким же образом высокий уровень ДГК, обеспечиваемый Mfsd2а-опосредуемым транспортом лизоФХ, тормозит кавеолин-зависимый эндоцитоз?
С использованием генетических моделей, электронной микроскопии и методов липидомики было установлено, что липиды, транспортируемые переносчиком Mfsd2а, создают уникальную структуру микродоменов липидного бислоя мембран клеток эндотелия мозга [27]. Кавеолы, участки инвагинации плазматической мембраны, представляют из себя разновидность липидных рафтов с характерным для них составом липидов (высокое содержание холестерина, сфинголипидов и фосфолипидов с насыщенными жирными кислотами). В формировании кавеол ключевую роль играют белки кавеолины-1, которые, связываясь с холестерином липидных рафтов, вызывают инвагинацию плазматической мембраны [28]. Включение в состав фосфолипидов бислоя гибкого ацильного хвоста ДГК с 6 двойными связями вызывает значительную модификацию физических свойств мембраны и изменяет соотношение “неупорядоченных” доменов к “упорядоченным” (липидным рафтам) в пользу первых [29], что приводит к вытеснению кавеолина-1 из кавеол и торможению кластеризации ансамбля белков, необходимых для формирования кавеол (рис. 1). Нарушение структуры липидных рафтов при добавлении длинноцепочечных омега-3 жирных кислот, которое приводит к торможению рафт-зависимых сигнальных процессов, показано во многих типах клеток как в экспериментах in vitro, так и in vivo [30–34]. Принцип действия этих жирных кислот на нарушение молекулярной организации липидных рафтов демонстрирует рис. 2.
Рис. 1.
Регуляция проницаемости ГЭБ Mfsd2a-опосредованным торможением кавеолин-зависимого трансцитоза в эндотелиальных клетках. ДГК, переносимая Mfsd2a, препятствует образованию кавеолин-позитивных везикул. В отсутствие или при ингибировании Mfsd2a повышается их образование и усиливается трансцитоз через эндотелиальные клетки. Cav-1: кавеолин-1, DHA: докозагексаеновая кислота, LPC: лизоФХ, TJ: плотные контакты. Из работы [35], воспроизведено с разрешения издателя.
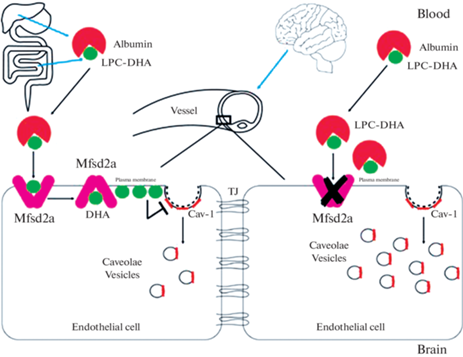
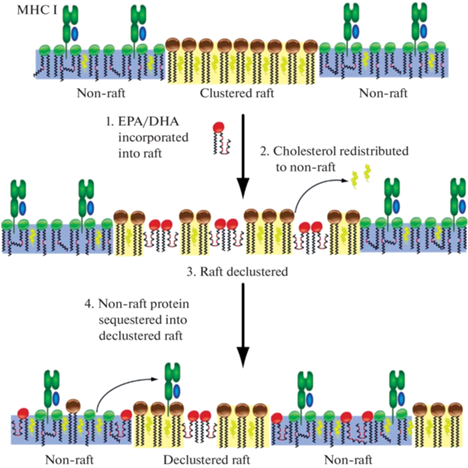
Рис. 2.
Гипотетическая модель действия ДГК (DHA) и ЭПК (EPA) на нарушение молекулярной организации липидных рафтов. Включение жирных кислот в рафты вызывает вытеснение холестерина, что приводит к декластеризации рафтов, изменению локализации белков и нарушению рафт-зависимого сигналинга. Из работы [34], воспроизведено с разрешения издателя.
С помощью молекулярно-генетических методов было выяснено, что одним из механизмов регуляции экспрессии Mfsd2а в эндотелии капилляров мозга и, соответственно, контроля проницаемости ГЭБ является сигнальный путь PTEN/AKT/NEDD4-2. Количество белка Mfsd2а в эндотелиальной клетке находится под прямым контролем E3 убиквитинлигазы NEDD4-2, которая инициирует его протеасомную деградацию. В свою очередь активность E3 убиквитинлигазы NEDD4-2 регулируется ее фосфорилированием АКТ-киназой, уровень функциональной активности которой определяется фосфатазой Pten, тормозящей активацию АКТ-киназы. Оверэкспрессия убиквитинлигазы или выключение гена Pten в эндотелии капилляров мозга приводит к снижению уровня Mfsd2а, увеличению трансцитоза и росту проницаемости ГЭБ [36].
РОЛЬ БЕЛКОВОГО КОМПЛЕКСА Mfsd2a–Spns В СФИНГОЗИН-1-ФОСФАТ-ЗАВИСИМОМ ПОДДЕРЖАНИИ ЦЕЛОСТНОСТИ ГЭБ
Сфингозин-1-фосфат (S1P) является важнейшим липидным медиатором, который играет ключевую роль в регуляции выживания клеток, пролиферации, миграции, адгезии и других клеточных процессах [37]. В основе его действия лежит связывание S1P со специфическими рецепторами на поверхности клетки. Оказалось, что S1P сигналинг, опосредованный S1P1 рецепторами, является одним из регуляторов проницаемости ГЭБ за счет создания S1P-обогащенного микроокружения во внеклеточном матриксе эндотелия сосудов мозга [38, 39]. Точная роль S1P в этом механизме остается невыясненной, однако при введении мышам финголимода (FTY720), блокатора S1P1 рецепторов, или при нокдауне гена этих рецепторов обнаруживалось увеличение проницаемости ГЭБ за счет частичного нарушения плотных контактов [39, 40], при этом инъекция в мозг S1P восстанавливала нарушение проницаемости ГЭБ у мышей, нокаутных по этому белку.
Оказалось, что транспортер Mfsd2a усиливает доставку S1P в паренхиму мозга – у мышей нокаутных по Mfsd2a было значительно снижено количество S1P во внеклеточном матриксе эндотелия, что приводило к увеличению проницаемости ГЭБ. Однако Mfsd2a не является транспортером S1P. Транспорт этого липида в мозг осуществляется другим белком – так называемым Spinster homolog 2 (Spns2), экспрессирующимся в эндотелиальных клетках [41]. Mfsd2a является своеобразной мембранной ловушкой для молекулы S1P, связывая отрицательно заряженную фосфатную группу, однако из-за отсутствия в молекуле S1P холина не может осуществить непосредственно перенос, передавая эту функцию белку Spns2. Таким образом, Mfsd2a и Spns2 действуют кооперативно, образуя особый белковый комплекс в эндотелиальных клетках мозга для осуществления транспорта S1P в мозг. Обеспечиваемое этим механизмом накопление S1P во внеклеточном матриксе эндотелия необходимо для градуального поддержания целостности ГЭБ: высокий уровень S1P поддерживает целостность ГЭБ, средний (при дефиците Mfsd2a) – увеличивает трансцеллюлярный транспорт, очень низкий (при дефиците Spns2) приводит к открытию плотных контактов в эндотелии [39].
РОЛЬ Mfsd2a ТРАНСПОРТЕРА В ФУНКЦИОНИРОВАНИИ ГЕМАТОРЕТИНАЛЬНОГО БАРЬЕРА И ПОСТУПЛЕНИИ ДГК В СЕТЧАТКУ
Гематоретинальный барьер регулирует проникновение в ткани и клетки глаза необходимых веществ, в том числе жирных кислот, и удаление метаболитов. Основой организации внутреннего гематоретинального барьера являются плотные контакты эндотелиальных клеток сосудов, поддерживаемыми астроцитами, перицитами и клетками Мюллера. Внешний гематоретинальный барьер создается плотными контактами клеток пигментного эпителия сетчатки [42]. Хорошо известно, что сетчатка млекопитающих чрезвычайно богата ДГК – в наружных сегментах палочек она колокализована с родопсином в мембранах дисков и составляет свыше 60% всех жирных кислот [43, 44]. В сетчатке идентифицированы молекулярные типы фосфолипидов, содержащие 2 молекулы ДГК, эстерифицированной в 1-ом и 2-ом положениях глицеринового скелета фосфолипида, а также фосфолипиды, имеющие в своем составе помимо ДГК полиненасыщенные жирные кислоты омега-3 ряда с длиной цепи до 36 атомов углерода [45]. Дефицит ДГК приводит к различным проявлениям ретинопатии, связанной в том числе с увеличением проницаемости гематоретинального барьера. При многих заболеваниях зрительной системы, таких как пигментный ретинит, диабетическая ретинопатия, возрастная макулодистрофия, количество ДГК в сетчатке значительно снижено [46].
Как показали недавние исследования, важнейшую роль в поддержании высокого уровня ДГК в зрительной системе играет Mfsd2a-опосредованный транспорт лизоФХ через гематоретинальный барьер [47–49]. Mfsd2a экспрессируется в клетках пигментного эпителия и сосудах сетчатки [48]. У мышей, нокаутных по гену Mfsd2a, в постнатальном периоде значительно снижен транспорт лизоФХ-ДГК, уменьшена длина наружных сегментов палочек сетчатки, выявляются нарушения в организации дисков, уменьшено количество родопсина, наблюдается снижение числа фоторецепторных клеток [48, 49]. Содержание ДГК в ткани глаза нокаутов уменьшено на 40%, а падение ее уровня скомпенсировано ростом количества арахидоновой кислоты и моноеновых жирных кислот [47, 48]. Предполагается, что в отсутствиe транспорта лизоФХ-ДГК у Mfsd2a−/− мышей фоторецепторы подвергаются прогрессирующей дегенерации. Интересно, что увеличение уровня ДГК в сетчатке, так же, как в мозге, достигается при использовании в качестве пищевой добавки лизоФХ-ДГК, но не триацилглицеринов, основных компонентов рыбьего жира, или ДГК в свободном виде, что подчеркивает важнейшую роль Mfsd2а в снабжении сетчатки омега-3 полиненасыщенными жирными кислотами [46].
РОЛЬ Mfsd2a В НЕЙРОПАТОЛОГИЧЕСКИХ ПРОЦЕССАХ
Нарушение проницаемости ГЭБ и снижение экспрессии Mfsd2a в эндотелии капилляров мозга может являться как причиной, так и следствием острых и хронических патологических процессов, протекающих в ЦНС [2, 50]. Многочисленные примеры демонстрируют защитную функцию Mfsd2a, направленную на сохранение низкой проницаемости эндотелия ГЭБ. Показано, что при геморрагическом инсульте под действием клеток крови и содержащихся в ней биологически активных веществ, а также в результате активации микроглии, нарушается целостность ГЭБ, одной из причин которой является снижение экспрессии Mfsd2а в перигематомной области [51]. Рост проницаемости ГЭБ при этой патологии опосредован не только парацеллюлярным транспортом вследствие нарушения плотных контактов клеток эндотелия [52], но и увеличением трансцеллюлярного переноса [53], который регулируется белком Mfsd2а. Нокдаун и нокаут Mfsd2a у мышей с гемморрагическим инсультом значительно увеличивает проницаемость ГЭБ и содержание воды в мозгу. В эндотелиальных клетках значительно возрастает число пиноцитозных везикул и наблюдается рост экспрессии белков, обеспечивающих внутриклеточный трафик везикул (Srgap2, Stx7, and Sec22b). Эти симптомы устраняются при оверэкспрессии Mfsd2a. Полученные данные свидетельствуют о важной защитной роли Mfsd2a при повреждении проницаемости ГЭБ механизмом ингибирования везикулярного транспорта [51].
Субарахноидальное кровоизлияние вызывает повреждение ГЭБ, что приводит к увеличению его проницаемости, и, как следствие, к усилению развивающейся патологии мозга. Как было показано, в увеличении проницаемости, которая вызывается активацией кавеолин-зависимого трансцеллюлярного транспорта, решающая роль принадлежит снижению экспрессии Mfsd2a в эндотелии ГЭБ, что приводит к снижению содержания ДГК в липидном бислое и изменению его биофизических свойств [54]. Помимо этого, недостаток ДГК, вызываемый снижением экспрессии Mfsd2a, может приводить к снижению продукции противовоспалительных медиаторов, субстратом синтеза которых она является. Эти данные позволяют рассматривать Mfsd2a как терапевтическую мишень для защиты целостности ГЭБ и улучшения прогноза течения патологического процесса при субарахноидальном кровоизлиянии.
Нарушение ГЭБ и связанный с этим отек мозга является частым побочным эффектом при хирургических повреждениях мозга. В экспериментах на мышах, у которых молекулярно-генетическими методами были осуществлены нокаут гена Mfsd2a или его оверэкспрессия было показано, что оверэкспрессия транспортера приводит к ослаблению отека и снижению нейрологических повреждений, вызванных операцией, тогда как снижение его экспрессии еще более усиливает повреждение ГЭБ. Как показали полученные данные, положительный эффект оверэкспресии Mfsd2a на функции ГЭБ был связан со снижением экспрессии кавеолина-1, увеличением диссоциации транскрипционного фактора Nrf-2 со связывающим его белком Keap-1/Nrf-2 и увеличением в области хирургического вмешательства Nrf-2-зависимой экспрессии цитопротективных белков, таких как гем-оксигеназа-1, что приводило к росту экспрессии белков плотных контактов и поддержанию барьерных функций ГЭБ [55].
Хроническая ишемия головного мозга, как показали эксперименты на крысах, также приводит к снижению экспрессии Mfsd2a, увеличению проницаемости ГЭБ, росту трансцитоза в клетках эндотелия и когнитивным нарушениям [56]. Оверэкспрессия транспортера устраняет эти патологические проявления, не влияя при этом на ультраструктуру плотных контактов и экспрессию содержащихся в них белков. Эти данные позволяют заключить, что Mfsd2a необходим для поддержания низкой проницаемости ГЭБ при хронической ишемии мозга, и его защитный эффект связан с ингибированием трансцитоза [56].
ПРАКТИЧЕСКИЕ ПЕРСПЕКТИВЫ
Полученные данные о специфических механизмах поступления ДГК в мозг, обеспечиваемыми эндотелиальным транспортером Mfsd2a, позволяют сделать переоценку существующих способов применения ДГК в качестве пищевой добавки для профилактики нейродегенеративных заболеваний. Оказалось, что введение ДГК в виде триацилглицеринов, основных компонентов рыбьего жира, или свободной (неэтерифицированной) ДГК приводит к повышению уровня этой жирной кислоты в жировой ткани и сердце, но не в мозгу. В противоположность этому добавление ДГК в виде лизоФХ или ФХ, содержащего ДГК в обоих положениях, не влияя на включение этой жирной кислоты в жировую ткань, приводит к 2-кратному повышению содержания ДГК в мозгу и значительной стимуляции продукции BDNF, что свидетельствует о ее функциональной активности [22]. Подобные результаты были получены и на сетчатке [46].
По всей вероятности, этими фактами объясняется низкая биодоступность для мозга применяемых омега-3 пищевых добавок, содержащих главным образом триацилглицерины, и недостаточная успешность их терапевтических эффектов в клинических испытаниях. Например, положительный эффект применения омега-3 пищевых добавок не был выявлен у пациентов с болезнью Альцгеймера [57], хотя при этой патологии снижено количество ДГК в мозгу больных, количество циркулирующего лизоФХ и уровень белка Mfsd2a в плазме крови, причем величина снижения коррелирует со степенью тяжести заболевания [58, 59]. В связи с этим эффективная доставка жизненно необходимых ДГК или ЭПК в мозг и сетчатку в виде лизоФХ может рассматриваться как многообещающий нутрицевтический потенциал в профилактике и лечении нейродегенеративных состояний, психических расстройств и ретинопатий. Недавно французскими учеными был запантенован препарат AceDoPC®, представляющий из себя лизоФХ-ДГК, в котором ДГК находится во втором положении, а в первом – ацетильная группа [60]. Такая структура лизоФХ препятствует его изомеризации при попадании в организм и позволяет сохранить ДГК во втором положении. В экспериментах на мышах in vivo, а также in vitro на моделях ГЭБ было доказано что применение AceDoPC® является наиболее эффективным способом доставки ДГК в мозг [61].
Другой важный практический аспект успехов в изучении Mfsd2a связан с потенциальной возможностью управления барьерными свойствами ГЭБ. Низкая проницаемость ГЭБ для многих лекарственных препаратов и вследствие этого невозможность достижения их необходимой терапевтической концентрации в паренхиме мозга является серьезной проблемой при лечении многих заболеваний ЦНС. Одна из активно разрабатываемых Mfsd2a-опосредованных стратегий предполагает транспорт лекарственных препаратов в мозг активацией трансцитоза. Китайскими исследователями была сконструирована пара вводимых поочередно наночастиц, первая из которых содержала так называемый transcytosis-targeting-peptide и туникамицин, тормозящий активность Mfsd2a, а вторая собственно противоопухолевые препараты, которые могли проникать в паренхиму мозга путем кавеолин-зависимого везикулярного транспорта, который повышается при ингибировании Mfsd2a [62]. Хотя применение данных наночастиц на моделях мышей с метастазами рака груди в мозг показало возможность эффективной доставки препарата в ткани мозга и высокую противоопухолевую активность, тщательные исследования необходимы для оценки потенциальных преимуществ данной терапевтической стратегии. Даже кратковременное “открытие” ГЭБ чревато серьезными последствиями для ЦНС и может быть использовано только в тяжелых патологиях, когда потенциальный риск оправдан.
В основе другой стратегии Mfsd2a-опосредованной доставки лекарственных препаратов в мозг лежит возможность синтеза соединений, в которых действующий агент химически связан с лизоФХ, что делает возможным его перенос транспортером [63]. Такая стратегия сопряжена с меньшим риском побочных эффектов, однако конъюгированный лекарственный препарат должен быть в определенной степени липофильным и иметь ограничения по размерам молекулы.
Тем не менее, несмотря на отсутствие на сегодняшний день убедительных успехов в применении Mfsd2a-опосредованных стратегий в лечении заболеваний ЦНС, эти подходы, учитывая огромную востребованность коррекций разнообразных нейропатологий, имеют несомненные перспективы как для потенциального усиления поступления в мозг жизненно необходимых жирных кислот, так и для доставки лекарственных препаратов, основанной на модуляции проницаемости ГЭБ.
Список литературы
Hawkins BT, Davis TP (2005) The blood-brain barrier/neurovascular unit in health and disease. Pharmacol Rev 57(2): 173–185. https://doi.org/10.1124/pr.57.2.4
Salmina AB, Komleva YK, Malinovskaya NA, Morgun AV, Teplyashina EA, Lopatina OL, Gorina YV, Kharitonova EV, Khilazheva ED, Shuvaev AN (2021) Blood-Brain Barrier Breakdown in Stress and Neurodegeneration: Biochemical Mechanisms and New Models for Translational Research. Biochemistry (Mosc) 86(6): 746–760. https://doi.org/10.1134/S0006297921060122
Kaya M, Ahishali B (2021) Basic physiology of the blood-brain barrier in health and disease: a brief overview. Tissue Barriers 9(1): 1840913. https://doi.org/10.1080/21688370.2020.1840913
Brightman MW, Reese TS (1969) Junctions between intimately apposed cell membranes in the vertebrate brain. J Cell Biol 40(3): 648–677. https://doi.org/10.1083/jcb.40.3.648
Reese TS, Karnovsky MJ (1967) Fine structural localization of a blood-brain barrier to exogenous peroxidase. J Cell Biol 34(1): 207–217. https://doi.org/10.1083/jcb.34.1.207
Ayloo S, Gu C (2019) Transcytosis at the blood-brain barrier. Curr Opin Neurobiol 57: 32-38. https://doi.org/10.1016/j.conb.2018.12.014
Yan N (2015) Structural Biology of the Major Facilitator Superfamily Transporters. Annu Rev Biophys 44: 257–283. https://doi.org/10.1146/annurev-biophys-060414-033901
Reddy VS, Shlykov MA, Castillo R, Sun EI, Saier MH, Jr (2012) The major facilitator superfamily (MFS) revisited. FEBS J 279(11): 2022–2035. https://doi.org/10.1111/j.1742-4658.2012.08588.x
Angers M, Uldry M, Kong D, Gimble JM, Jetten AM (2008) Mfsd2a encodes a novel major facilitator superfamily domain-containing protein highly induced in brown adipose tissue during fasting and adaptive thermogenesis. Biochem J 416(3): 347–355. https://doi.org/10.1042/BJ20080165
Cater RJ, Chua GL, Erramilli SK, Keener JE, Choy BC, Tokarz P, Chin CF, Quek DQY, Kloss B, Pepe JG, Parisi G, Wong BH, Clarke OB, Marty MT, Kossiakoff AA, Khelashvili G, Silver DL, Mancia F (2021) Structural basis of omega-3 fatty acid transport across the blood-brain barrier. Nature 595(7866): 315–319. https://doi.org/10.1038/s41586-021-03650-9
Berger JH, Charron MJ, Silver DL (2012) Major facilitator superfamily domain-containing protein 2a (MFSD2A) has roles in body growth, motor function, and lipid metabolism. PLoS One 7(11): e50629. https://doi.org/10.1371/journal.pone.0050629
Ben-Zvi A, Lacoste B, Kur E, Andreone BJ, Mayshar Y, Yan H, Gu C (2014) Mfsd2a is critical for the formation and function of the blood-brain barrier. Nature 509(7501): 507–511. https://doi.org/10.1038/nature13324
Nguyen LN, Ma D, Shui G, Wong P, Cazenave-Gassiot A, Zhang X, Wenk MR, Goh EL, Silver DL (2014) Mfsd2a is a transporter for the essential omega-3 fatty acid docosahexaenoic acid. Nature 509(7501): 503–506. https://doi.org/10.1038/nature13241
Alakbarzade V, Hameed A, Quek DQ, Chioza BA, Baple EL, Cazenave-Gassiot A, Nguyen LN, Wenk MR, Ahmad AQ, Sreekantan-Nair A, Weedon MN, Rich P, Patton MA, Warner TT, Silver DL, Crosby AH (2015) A partially inactivating mutation in the sodium-dependent lysophosphatidylcholine transporter MFSD2A causes a non-lethal microcephaly syndrome. Nat Genet 47(7): 814–817. https://doi.org/10.1038/ng.3313
Guemez-Gamboa A, Nguyen LN, Yang H, Zaki MS, Kara M, Ben-Omran T, Akizu N, Rosti RO, Rosti B, Scott E, Schroth J, Copeland B, Vaux KK, Cazenave-Gassiot A, Quek DQ, Wong BH, Tan BC, Wenk MR, Gunel M, Gabriel S, Chi NC, Silver DL, Gleeson JG (2015) Inactivating mutations in MFSD2A, required for omega-3 fatty acid transport in brain, cause a lethal microcephaly syndrome. Nat Genet 47(7): 809–813. https://doi.org/10.1038/ng.3311
Bazinet RP, Laye S (2014) Polyunsaturated fatty acids and their metabolites in brain function and disease. Nat Rev Neurosci 15(12): 771–785. https://doi.org/10.1038/nrn3820
Parnova R (2021) GPR40/FFA1 Free Fatty Acid Receptors and Their Functional Role. Neuroscien Behav Physiol 51(2): 256–264. https://doi.org/10.1007/s11055-021-01064-8
Crupi R, Marino A, Cuzzocrea S (2013) n-3 fatty acids: role in neurogenesis and neuroplasticity. Curr Med Chem 20(24): 2953–2963. https://doi.org/10.2174/09298673113209990140
Lagarde M, Bernoud N, Brossard N, Lemaitre-Delaunay D, Thies F, Croset M, Lecerf J (2001) Lysophosphatidylcholine as a preferred carrier form of docosahexaenoic acid to the brain. J Mol Neurosci 16(2-3): 201–204; discussion 215–221. https://doi.org/10.1385/JMN:16:2-3:201
Thies F, Delachambre MC, Bentejac M, Lagarde M, Lecerf J (1992) Unsaturated fatty acids esterified in 2-acyl-l-lysophosphatidylcholine bound to albumin are more efficiently taken up by the young rat brain than the unesterified form. J Neurochem 59(3): 1110–1116. https://doi.org/10.1111/j.1471-4159.1992.tb08353.x
Thies F, Pillon C, Moliere P, Lagarde M, Lecerf J (1994) Preferential incorporation of sn-2 lysoPC DHA over unesterified DHA in the young rat brain. Am J Physiol 267(5 Pt 2): R1273–R1279. https://doi.org/10.1152/ajpregu.1994.267.5.R1273
Sugasini D, Yalagala PCR, Goggin A, Tai LM, Subbaiah PV (2019) Enrichment of brain docosahexaenoic acid (DHA) is highly dependent upon the molecular carrier of dietary DHA: lysophosphatidylcholine is more efficient than either phosphatidylcholine or triacylglycerol. J Nutr Biochem 74: 108231. https://doi.org/10.1016/j.jnutbio.2019.108231
Sugasini D, Thomas R, Yalagala PCR, Tai LM, Subbaiah PV (2017) Dietary docosahexaenoic acid (DHA) as lysophosphatidylcholine, but not as free acid, enriches brain DHA and improves memory in adult mice. Sci Rep 7(1): 11263. https://doi.org/10.1038/s41598-017-11766-0
Chouinard-Watkins R, Lacombe RJS, Bazinet RP (2018) Mechanisms regulating brain docosahexaenoic acid uptake: what is the recent evidence? Curr Opin Clin Nutr Metab Care 21(2): 71–77. https://doi.org/10.1097/MCO.0000000000000440
Martins JG (2009) EPA but not DHA appears to be responsible for the efficacy of omega-3 long chain polyunsaturated fatty acid supplementation in depression: evidence from a meta-analysis of randomized controlled trials. J Am Coll Nutr 28(5): 525–542. https://doi.org/10.1080/07315724.2009.10719785
Yalagala PCR, Sugasini D, Dasarathi S, Pahan K, Subbaiah PV (2019) Dietary lysophosphatidylcholine-EPA enriches both EPA and DHA in the brain: potential treatment for depression. J Lipid Res 60(3): 566–578. https://doi.org/10.1194/jlr.M090464
Andreone BJ, Chow BW, Tata A, Lacoste B, Ben-Zvi A, Bullock K, Deik AA, Ginty DD, Clish CB, Gu C (2017) Blood-Brain Barrier Permeability Is Regulated by Lipid Transport-Dependent Suppression of Caveolae-Mediated Transcytosis. Neuron 94(3): 581–594 e5. https://doi.org/10.1016/j.neuron.2017.03.043
Parton RG, Tillu VA, Collins BM (2018) Caveolae. Curr Biol 28(8): R402–R405. https://doi.org/10.1016/j.cub.2017.11.075
Wassall SR, Stillwell W (2008) Docosahexaenoic acid domains: the ultimate non-raft membrane domain. Chem Phys Lipids 153(1): 57–63. https://doi.org/10.1016/j.chemphyslip.2008.02.010
Li Q, Zhang Q, Wang M, Liu F, Zhao S, Ma J, Luo N, Li N, Li Y, Xu G, Li J (2007) Docosahexaenoic acid affects endothelial nitric oxide synthase in caveolae. Arch Biochem Biophys 466(2): 250–259. https://doi.org/10.1016/j.abb.2007.06.023
Ma DW, Seo J, Davidson LA, Callaway ES, Fan YY, Lupton JR, Chapkin RS (2004) n-3 PUFA alter caveolae lipid composition and resident protein localization in mouse colon. FASEB J 18(9): 1040–1052. https://doi.org/10.1096/fj.03-1430fje
Li Q, Zhang Q, Wang M, Zhao S, Ma J, Luo N, Li N, Li Y, Xu G, Li J (2007) Eicosapentaenoic acid modifies lipid composition in caveolae and induces translocation of endothelial nitric oxide synthase. Biochimie 89(1): 169–177. https://doi.org/10.1016/j.biochi.2006.10.009
Turk HF, Chapkin RS (2013) Membrane lipid raft organization is uniquely modified by n-3 polyunsaturated fatty acids. Prostaglandins Leukot Essent Fatty Acids 88(1): 43–47. https://doi.org/10.1016/j.plefa.2012.03.008
Shaikh SR (2012) Biophysical and biochemical mechanisms by which dietary N-3 polyunsaturated fatty acids from fish oil disrupt membrane lipid rafts. J Nutr Biochem 23(2): 101–105. https://doi.org/10.1016/j.jnutbio.2011.07.001
Eser Ocak P, Ocak U, Sherchan P, Zhang JH, Tang J (2020) Insights into major facilitator superfamily domain-containing protein-2a (Mfsd2a) in physiology and pathophysiology. What do we know so far? J Neurosci Res 98(1): 29–41. https://doi.org/10.1002/jnr.24327
Cui Y, Wang Y, Song X, Ning H, Zhang Y, Teng Y, Wang J, Yang X (2021) Brain endothelial PTEN/AKT/NEDD4-2/MFSD2A axis regulates blood-brain barrier permeability. Cell Rep 36(1): 109327. https://doi.org/10.1016/j.celrep.2021.109327
Cui M, Gobel V, Zhang H (2022) Uncovering the 'sphinx' of sphingosine 1-phosphate signalling: from cellular events to organ morphogenesis. Biol Rev Camb Philos Soc 97(1): 251–272. https://doi.org/10.1111/brv.12798
Zhu D, Wang Y, Singh I, Bell RD, Deane R, Zhong Z, Sagare A, Winkler EA, Zlokovic BV (2010) Protein S controls hypoxic/ischemic blood-brain barrier disruption through the TAM receptor Tyro3 and sphingosine 1-phosphate receptor. Blood 115(23): 4963–4972. https://doi.org/10.1182/blood-2010-01-262386
Wang Z, Zheng Y, Wang F, Zhong J, Zhao T, Xie Q, Zhu T, Ma F, Tang Q, Zhou B, Zhu J (2020) Mfsd2a and Spns2 are essential for sphingosine-1-phosphate transport in the formation and maintenance of the blood-brain barrier. Sci Adv 6(22): eaay8627. https://doi.org/10.1126/sciadv.aay8627
Huwiler A, Zangemeister-Wittke U (2018) The sphingosine 1-phosphate receptor modulator fingolimod as a therapeutic agent: Recent findings and new perspectives. Pharmacol Ther 185: 34–49. https://doi.org/10.1016/j.pharmthera.2017.11.001
Fukuhara S, Simmons S, Kawamura S, Inoue A, Orba Y, Tokudome T, Sunden Y, Arai Y, Moriwaki K, Ishida J, Uemura A, Kiyonari H, Abe T, Fukamizu A, Hirashima M, Sawa H, Aoki J, Ishii M, Mochizuki N (2012) The sphingosine-1-phosphate transporter Spns2 expressed on endothelial cells regulates lymphocyte trafficking in mice. J Clin Invest 122(4): 1416–1426. https://doi.org/10.1172/JCI60746
Cunha-Vaz JG, Shakib M, Ashton N (1966) Studies on the permeability of the blood-retinal barrier. I. On the existence, development, and site of a blood-retinal barrier. Br J Ophthalmol 50(8): 441–453. https://doi.org/10.1136/bjo.50.8.441
SanGiovanni JP, Chew EY (2005) The role of omega-3 long-chain polyunsaturated fatty acids in health and disease of the retina. Prog Retin Eye Res 24(1): 87–138. https://doi.org/10.1016/j.preteyeres.2004.06.002
Fliesler SJ, Anderson RE (1983) Chemistry and metabolism of lipids in the vertebrate retina. Prog Lipid Res 22(2): 79–131. https://doi.org/10.1016/0163-7827(83)90004-8
Aveldano MI, Sprecher H (1987) Very long chain (C24 to C36) polyenoic fatty acids of the n-3 and n-6 series in dipolyunsaturated phosphatidylcholines from bovine retina. J Biol Chem 262(3): 1180–1186.
Sugasini D, Yalagala PCR, Subbaiah PV (2020) Efficient Enrichment of Retinal DHA with Dietary Lysophosphatidylcholine-DHA: Potential Application for Retinopathies. Nutrients 12(10). https://doi.org/10.3390/nu12103114
Lobanova ES, Schuhmann K, Finkelstein S, Lewis TR, Cady MA, Hao Y, Keuthan C, Ash JD, Burns ME, Shevchenko A, Arshavsky VY (2019) Disrupted Blood-Retina Lysophosphatidylcholine Transport Impairs Photoreceptor Health But Not Visual Signal Transduction. J Neurosci 39(49): 9689–9701. https://doi.org/10.1523/jneurosci.1142-19.2019
Wong BH, Chan JP, Cazenave-Gassiot A, Poh RW, Foo JC, Galam DL, Ghosh S, Nguyen LN, Barathi VA, Yeo SW, Luu CD, Wenk MR, Silver DL (2016) Mfsd2a Is a Transporter for the Essential omega-3 Fatty Acid Docosahexaenoic Acid (DHA) in Eye and Is Important for Photoreceptor Cell Development. J Biol Chem 291(20): 10501–10514. https://doi.org/10.1074/jbc.M116.721340
Wong BH, Silver DL (2020) Mfsd2a: A Physiologically Important Lysolipid Transporter in the Brain and Eye. Adv Exp Med Biol 1276: 223–234. https://doi.org/10.1007/978-981-15-6082-8_14
Huang B, Li X (2021) The Role of Mfsd2a in Nervous System Diseases. Front Neurosci 15: 730534. https://doi.org/10.3389/fnins.2021.730534
Yang YR, Xiong XY, Liu J, Wu LR, Zhong Q, Zhou K, Meng ZY, Liu L, Wang FX, Gong QW, Liao MF, Duan CM, Li J, Yang MH, Zhang Q, Gong CX, Yang QW (2017) Mfsd2a (Major Facilitator Superfamily Domain Containing 2a) Attenuates Intracerebral Hemorrhage-Induced Blood-Brain Barrier Disruption by Inhibiting Vesicular Transcytosis. J Am Heart Assoc 6(7). https://doi.org/10.1161/JAHA.117.005811
Jiao X, He P, Li Y, Fan Z, Si M, Xie Q, Chang X, Huang D (2015) The Role of Circulating Tight Junction Proteins in Evaluating Blood Brain Barrier Disruption following Intracranial Hemorrhage. Dis Markers 2015: 860120. https://doi.org/10.1155/2015/860120
De Bock M, Van Haver V, Vandenbroucke RE, Decrock E, Wang N, Leybaert L (2016) Into rather unexplored terrain-transcellular transport across the blood-brain barrier. Glia 64(7): 1097–1123. https://doi.org/10.1002/glia.22960
Zhao C, Ma J, Wang Z, Li H, Shen H, Li X, Chen G (2020) Mfsd2a Attenuates Blood-Brain Barrier Disruption After Sub-arachnoid Hemorrhage by Inhibiting Caveolae-Mediated Transcellular Transport in Rats. Transl Stroke Res 11(5): 1012–1027. https://doi.org/10.1007/s12975-019-00775-y
Eser Ocak P, Ocak U, Sherchan P, Gamdzyk M, Tang J, Zhang JH (2020) Overexpression of Mfsd2a attenuates blood brain barrier dysfunction via Cav-1/Keap-1/Nrf-2/HO-1 pathway in a rat model of surgical brain injury. Exp Neurol 326: 113203. https://doi.org/10.1016/j.expneurol.2020.113203
Qu C, Song H, Shen J, Xu L, Li Y, Qu C, Li T, Zhang J (2020) Mfsd2a Reverses Spatial Learning and Memory Impairment Caused by Chronic Cerebral Hypoperfusion via Protection of the Blood-Brain Barrier. Front Neurosci 14: 461. https://doi.org/10.3389/fnins.2020.00461
Freund-Levi Y, Eriksdotter-Jonhagen M, Cederholm T, Basun H, Faxen-Irving G, Garlind A, Vedin I, Vessby B, Wahlund LO, Palmblad J (2006) Omega-3 fatty acid treatment in 174 patients with mild to moderate Alzheimer disease: OmegAD study: a randomized double-blind trial. Arch Neurol 63(10): 1402–1408. https://doi.org/10.1001/archneur.63.10.1402
Sanchez-Campillo M, Ruiz-Pastor MJ, Gazquez A, Marin-Munoz J, Noguera-Perea F, Ruiz-Alcaraz AJ, Manzanares-Sanchez S, Antunez C, Larque E (2019) Decreased Blood Level of MFSD2a as a Potential Biomarker of Alzheimer’s Disease. Int J Mol Sci 21(1). https://doi.org/10.3390/ijms21010070
Semba RD (2020) Perspective: The Potential Role of Circulating Lysophosphatidylcholine in Neuroprotection against Alzheimer Disease. Adv Nutr 11(4): 760–772. https://doi.org/10.1093/advances/nmaa024
Hachem M, Nacir H, Picq M, Belkouch M, Bernoud-Hubac N, Windust A, Meiller L, Sauvinet V, Feugier N, Lambert-Porcheron S, Laville M, Lagarde M (2020) Docosahexaenoic Acid (DHA) Bioavailability in Humans after Oral Intake of DHA-Containing Triacylglycerol or the Structured Phospholipid AceDoPC((R)). Nutrients 12(1). https://doi.org/10.3390/nu12010251
Hachem M, Geloen A, Van AL, Foumaux B, Fenart L, Gosselet F, Da Silva P, Breton G, Lagarde M, Picq M, Bernoud-Hubac N (2016) Efficient Docosahexaenoic Acid Uptake by the Brain from a Structured Phospholipid. Mol Neurobiol 53(5): 3205–3215. https://doi.org/10.1007/s12035-015-9228-9
Ju X, Miao T, Chen H, Ni J, Han L (2021) Overcoming Mfsd2a-Mediated Low Transcytosis to Boost Nanoparticle Delivery to Brain for Chemotherapy of Brain Metastases. Adv Health Mater 10(9): e2001997. https://doi.org/10.1002/adhm.202001997
Wang JZ, Xiao N, Zhang YZ, Zhao CX, Guo XH, Lu LM (2016) Mfsd2a-based pharmacological strategies for drug delivery across the blood-brain barrier. Pharmacol Res 104: 124–131. https://doi.org/10.1016/j.phrs.2015.12.024
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


