Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 6, стр. 781-792
Оценка стабильности референсных генов в мозге крыс при проведении антиоксидантной и противовоспалительной терапии в литий-пилокарпиновой модели височной эпилепсии
А. П. Шварц 1, *, А. Д. Дёмина 1, М. В. Захарова 1, А. А. Коваленко 1, М. О. Грязнова 1, А. М. Ищенко 2, А. В. Зайцев 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
2 НИИ эпидемиологии и микробиологии им. Пастера Роспотребнадзора
Санкт-Петербург, Россия
* E-mail: aleksandr.pavlovich.schwarz@gmail.com
Поступила в редакцию 20.04.2022
После доработки 11.05.2022
Принята к публикации 12.05.2022
- EDN: COILUF
- DOI: 10.31857/S0869813922060073
Аннотация
Обратная транскрипция в сочетании с количественной (в реальном времени) полимеразной цепной реакцией (ОТ-кПЦР) является золотым стандартом для оценки экспрессии генов на уровне РНК, однако требует тщательного выбора валидных референсных генов для нормализации результатов. Целью данной работы было определение оптимальных референсных генов для ОТ-кПЦР экспериментов в височной коре и дорзальном гиппокампе мозга крыс в латентную фазу (период эпилептогенеза до появления спонтанных рецидивирующих судорог) литий-пилокарпиновой модели височной эпилепсии на фоне раздельного или сочетанного применения рекомбинантного провоспалительного цитокина – рецепторного антагониста интерлейкина-1 (100 мг/кг в сутки) и комбинации антиоксидантов (100 мг/кг витамина С, 200 мг/кг витамина Е, 25 мкг/кг S-аденозилметионина). Была проанализирована экспрессия 9 референсных генов (Actb, B2m, Gapdh, Rpl13a, Sdha, Ppia, Hprt1, Pgk1, Ywhaz). С помощью сервиса RefFinder® мы определили оптимальные референсные гены для оценки уровня содержания целевых мРНК в дорзальном гиппокампе (Gapdh, Pgk1, Hprt1) и височной коре (Pgk1, Sdha, Ppia) головного мозга. При этом было выявлено значимое усиление экспрессии генов Actb и B2m в дорзальном гиппокампе, которое не подавлялось ни применением IL-1ra, ни смесью антиоксидантов, ни их сочетанием. Мы также оценили уровень экспрессии гена провоспалительного цитокина интерлейкина-1 бета (Il1b) в дорзальном гиппокампе, нормируя его относительно трех оптимальных (Gapdh, Pgk1, Hprt1) референсных генов либо относительно нестабильных Actb и B2m. В случае использования оптимальных референсных генов было обнаружено, что экспрессия гена Il1b увеличивается в латентную фазу литий-пилокарпиновой модели эпилепсии, и ни один из видов терапии не изменяет этой реакции. При нормировке относительно уровня мРНК Actb и B2m, изменения экспрессии гена Il1b в дорзальном гиппокампе в латентную фазу литий-пилокарпиновой модели не выявляются. Исходя из этого, гены Actb и B2m могут быть вовлечены в процесс эпилептогенеза и не могут использоваться в качестве референсных в эпилептических моделях. Таким образом, результаты нашей работы демонстрируют важность аккуратного выбора референсных генов.
Обратная транскрипция в сочетании с количественной (в реальном времени) полимеразной цепной реакцией (ОТ-кПЦР) является золотым стандартом для оценки экспрессии генов на уровне РНК. Этот метод обладает рядом важных преимуществ, включая высокий уровень стандартизации, широкий динамический диапазон измерений, возможность оценки большого количества мишеней. Тем не менее, получение качественных данных требует соблюдения ряда условий при планировании, проведении, обработке и публикации результатов ОТ-кПЦР, которые легли в основу руководства MIQE (Minimum Information for Publication of Quantitative Real-Time PCR Experiments – минимальная информация для публикации экспериментов с применением количественной ПЦР) [1]. Кроме соблюдения всех требований к пробоподготовке и проведению реакции для количественной оценки экспрессии генов крайне важно затем правильно нормировать полученные данные.
На сегодняшний день стандартным подходом к нормированию данных ОТ-кПЦР является расчет содержания целевых мРНК относительно мРНК референсных генов [2]. Традиционно для таких целей использовались гены домашнего хозяйства, однако в последние десятилетия накапливаются свидетельства того, что их экспрессия может тоже изменяться в некоторых моделях, и поэтому разрабатываются подходы для поиска наиболее надежных референсных генов среди экспериментальных образцов [3–5]. Неудачный выбор референсных генов может привести к потере значимых различий или даже обнаружению противоположных реальным по знаку изменений экспрессии целевых РНК [6].
Ранее нами были определены оптимальные референсные гены для ОТ-кПЦР в пентилентетразоловой модели острых судорог, не приводящих к индукции эпилептогенеза [7]. Настоящая работа направлена на оценку стабильности наиболее часто используемых референсных генов в мозге крыс в латентную фазу литий-пилокарпиновой модели височной эпилепсии при применении экспериментальной терапии, направленной на подавление процессов нейровоспаления и окислительного стресса. Литий-пилокарпиновая модель считается одной из лучших моделей для изучения патогенеза приобретенной эпилепсии [8]. Процессы нейровоспаления и окислительного стресса, сопутствующие нейродегенеративным изменениям при эпилептогенезе, способны взаимно усиливать друг друга, и считаются перспективными мишенями для превентивной терапии приобретенных форм эпилепсии [9].
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на самцах крыс Вистар, выращенных в экспериментально-биологической клинике Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН (ИЭФБ РАН). Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям Биоэтического комитета ИЭФБ РАН.
На начало эксперимента возраст животных составлял 6–8 нед. Индукцию пилокарпин-индуцированного эпилептического статуса проводили, как подробно описано ранее [10]. За сутки до введения пилокарпина всем крысам, включая контрольных, внутрибрюшинно (в/б) вводили раствор хлорида лития в дозе 127 мг/кг (LiCl; Sigma-Aldrich, Сент-Луис, Миссури, США). Для блокады периферических мускариновых рецепторов вводили бромид N-метилскополамина (1 мг/кг, в/б; Sigma-Aldrich) за час до введения пилокарпина. Пилокарпин (Sigma-Aldrich) вводили дробно в дозе 10–40 мг/кг (по 10 мг/кг с интервалом 30 мин, в/б) до развития судорог силой 4 балла по шкале Racine [11]. По истечении 75 мин после начала 4-й стадии судорог их блокировали введением диазепама (в/б, 10 мг/кг, Sigma-Aldrich). Животным контрольной группы вместо пилокарпина вводили физиологический раствор.
Экспериментальную терапию начинали через час после остановки эпилептического статуса и проводили в течение 7 дней. Части животных вводили человеческий рекомбинантный противовоспалительный цитокин – рекомбинантный рецепторный антагонист интерелейкина-1 (в/б, IL-1ra, препарат анакинра, Государственный НИИ особо чистых биопрепаратов, Санкт-Петербург, Россия) в дозе 100 мг/кг (группа Li-PC + IL-1ra), другим – смесь антиоксидантов [12]: витамин С (ОАО “Дальхимфарм”, Хабаровск, Россия) в дозе 100 мг/кг, витамин E (АО “Мосагроген”, Москва, Россия) в дозе 200 мг/кг, S-аденозилметионин (адеметионина бутандисульфонат, препарат “Гептор”, АО “Верофарм”, Россия) в дозе 25 мг/кг (в/б); третьим вариантом терапии было комбинированное введение IL-1ra и смеси антиоксидантов (в/б).
Нелеченым животным после эпилептического статуса и контрольной группе (введение LiCl без пилокарпина) вводили физраствор и стерильное подсолнечное масло (растворитель для инъекционной формы витамина Е). Выбор терапии обусловлен показанным ранее нейропротекторным эффектом выбранной дозы IL-1ra в исследуемой модели эпилепсии [13], а также эффективным подавлением окислительного стресса при применении указанного сочетания низкомолекулярных антиоксидантов [12].
Через 7 дней после эпилептического статуса (одни сутки после последней инъекции препаратов) животных декапитировали, быстро извлекали мозг, замораживали и хранили мозг при –80°С до дальнейшей обработки. Дорзальную область гиппокампа и височную область коры больших полушарий выделяли с использованием микротома-криостата, как было подробно описано ранее [7]. Границы начала и окончания извлечения областей мозга указаны на рис. 1.
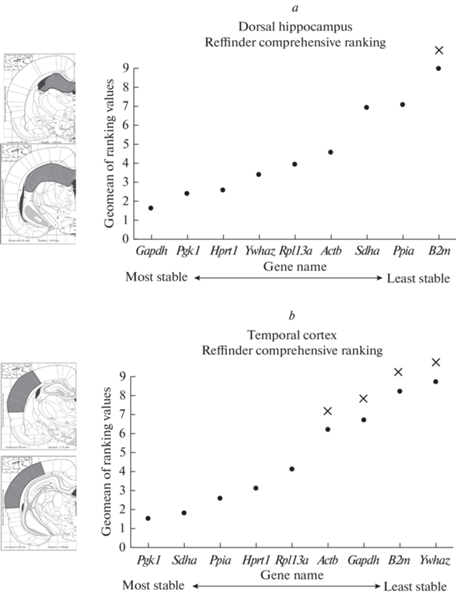
Рис. 1.
Стабильность экспрессии референсных генов в дорзальном гиппокампе (а) и височной коре (b) головного мозга крыс в латентную фазу литий-пилокарпиновой модели височной эпилепсии на фоне раздельной и комбинированной терапии рецепторным антагонистом IL-1ra (анакинра, 100 мг/кг) и смесью антиоксидантов (100 мг/кг витамина С, 200 мг/кг витамина Е, 25 мг/кг S-аденозилметионина). Материал для анализа забирали через 7 дней после индукции эпилептического статуса, терапию начинали через час после остановки судорог. × – гены непригодные для использования в качестве референсных согласно алгоритму geNorm (M > 0.5), по оси ординат указан объединенный ранг стабильности гена, рассчитанный на основании геометрического усреднения рангов, рассчитанных 4 алгоритмами. Слева от графиков приведены условные границы начала (верхний рисунок) и окончания (нижний рисунок) забора материала для анализа согласно атласу крысиного мозга в стереотактических координатах [26] (дорзальный гиппокамп: Interaural 6.60…4.56 Bregma –2.40…–4.44; височная кора: Interaural 6.24…4.32 Bregma –2.76…–4.68).
РНК выделяли методом кислой гуанидин-изотиоцианат-хлороформной экстракции с использованием реагента ExractRNA (Евроген, Москва, Россия). Образцы РНК подвергали обработке RQ1 ДНКазой, свободной от РНКаз, (Promega, США) в течение 15 мин с последующей преципитацией РНК в растворе хлорида лития (конечная концентрация около 6 M) и промывкой в 75%-ном этаноле. Концентрацию РНК определяли по поглощению раствора при длине волны 260 нм, а чистоту препарата – по соотношению оптической плотности при длинах волн 260/280 нм на спектрофотометре NanoDropLite (ThermoFisherScientific, США). Обратную транскрипцию проводили с использованием 1 мкг выделенной РНК, 0.5 мкг oligodT- и 0.25 мкг случайных 9-мерных праймеров (ДНК-Синтез, Москва, Россия), 15 е. а. РНАзина (Силекс, Москва, Россия) и 100 е. а. MMLV-ревертазы (Евроген, Москва, Россия) при 42°С в течение часа с предварительным отжигом праймеров при 70°С в течение 10 мин (до добавления фермента). Реакцию останавливали прогреванием в течение 10 мин при 65°С, полученную кДНК разводили в 10 раз и хранили при –20°С перед ПЦР.
ПЦР в реальном времени для анализа экспрессии 9 референсных генов (Actb, B2m, Gapdh, Rpl13a, Sdha, Ppia, Hprt1, Pgk1, Ywhaz) проводили с применением оригинальных мультиплексных тест-систем нашей разработки, как подробно описано ранее [14], c использованием TaqM-полимеразы (Алкор-био, Санкт-Петербург, Россия) на приборе CFX384 (Bio-Rad Laboratories, США) в конечном объеме реакции 5 мкл, внося по 0.7 мкл образцов кДНК в четырех повторностях, с использованием отрицательного контроля ПЦР (вода вместо кДНК) и отрицательного контроля обратной транскрипции (пробы, в которые во время проведения обратной транскрипции не добавляли ревертазы). Также дополнительно оценивали экспрессию гена провоспалительного цитокина интерлейкина-1 β (Il1b). Последовательности праймеров приведены в табл. 1. Праймеры были синтезированы компанией “ДНК-синтез” (Москва, Россия).
Таблица 1.
Праймеры и зонды для количественной ПЦР
| Название гена Номер в базе данных RefSeq |
Последовательность 5′-3′ (прямой, обратный, зонд) |
Ссылка на источник |
|---|---|---|
| Gapdh1 NM_017008 |
TGCACCACCAACTGCTTAG GGATGCAGGGATGATGTTC ATCACGCCACAGCTTTCCAGAGGG* |
[17] |
| Ppia2 NM_017101 |
AGGATTCATGTGCCAGGGTG CTCAGTCTTGGCAGTGCAGA CACGCCATAATGGCACTGGTGGCA& |
[18] |
| B2m1 NM_012512 |
TGCCATTCAGAAAACTCCCC GAGGAAGTTGGGCTTCCCATT ATTCAAGTGTACTCTCGCCATCCACCG& |
[19] |
| Actb1 NM_031144 |
TGTCACCAACTGGGACGATA GGGGTGTTGAAGGTCTCAAA CGTGTGGCCCCTGAGGAGCAC# |
Прямой и обратный праймер – [20] зонд – [14] |
| Ywhaz3 NM_013011 |
GATGAAGCCATTGCTGAACTTG GTCTCCTTGGGTATCCGATGTC TGAAGAGTCGTACAAAGACAGCACGC& |
Прямой и обратный праймер – [21] зонд – [14] |
| Rpl13a2 NM_173340 |
GGATCCCTCCACCCTATGACA CTGGTACTTCCACCCGACCTC CTGCCCTCAAGGTTGTGCGGCT# |
Прямой и обратный праймер – [22] зонд – [14] |
| Pgk13 NM_053291 |
ATGCAAAGACTGGCCAAGCTAC AGCCACAGCCTCAGCATATTTC TGCTGGCTGGATGGGCTTGGA* |
Прямой и обратный праймер – [21] зонд [14] |
| Hprt13 NM_012583 |
TCCTCAGACCGCTTTTCCCGC TCATCATCACTAATCACGACGCTGG CCGACCGGTTCTGTCATGTCGACCCT# |
Прямой и обратный праймер – [23] зонд – [14] |
| Sdha2 NM_130428 |
AGACGTTTGACAGGGGAATG TCATCAATCCGCACCTTGTA ACCTGGTGGAGACGCTGGAGCT* |
Прямой и обратный праймер – [24] зонд – [14] |
| Il1b NM_031512 |
CACCTCTCAAGCAGAGCACAG GGGTTCCATGGTGAAGTCAAC TGTCCCGACCATTGCTGTTTCCTAG # |
[25] |
Стабильность референсных генов оценивали с помощью онлайн-сервиса RefFinder® [15], объединяющего в себе 4 популярных алгоритма оценки стабильности: geNorm [3], Normfinder [15], BestKeeper [5], comparative Delta-Ct [4] и формирующего объединенный рейтинг стабильности на основании геометрического усреднения рангов каждого гена, полученного каждым из этих методов.
Экспрессию изучаемых генов рассчитывали относительно трех оптимальных референсных для конкретной области с помощью 2–∆∆Сt метода [16]. Данные нормировали по среднему значению контрольной группы (инъекции LiCl) и логарифмировали по основанию 2, чтобы привести к нормальному распределению. Статистическую обработку проводили в программе GraphPad Prism 7.00 c применением однофакторного дисперсионного анализа и апостериорного попарного сравнения с применением критерия Даннета (в качестве группы сравнения использовались нелеченые животные после эпилептического статуса). Для поиска выпадающих значений применяли метод Грабба.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Мы оценили стабильность экспрессии 9 референсных генов, традиционно используемых для нормализации данных ОТ-кПЦР, в гиппокампе и височной коре головного мозга крыс в латентную фазу литий-пилокарпиновой модели височной эпилепсии на фоне раздельной или совместной терапии противовоспалительными (рецепторный антагонист IL-1) и антиоксидантными (витамин С, витамин Е, S-аденозилметионин) препаратами.
Согласно алгоритму geNorm, ориентируясь на критерий M > 0.5, в дорзальном гиппокампе 8 из 9 проанализированных генов, исключая только ген B2m, могут использоваться в качестве референсных (рис. 1a). Используя объединенный рейтинг стабильности на основании геометрического усреднения рангов каждого гена, полученного с помощью четырех методов, мы выявили, что наиболее стабильно экспрессируются гены Gapdh, Pgk1 и Hprt1.
В височной коре экспрессия изученных генов в целом была менее стабильной (рис. 1b). Согласно алгоритму geNorm, четыре гена (Actb, Gapdh, B2m, Ywhaz) экспрессировались нестабильно и были непригодны для нормализации данных ОТ-кПЦР. По объединенному рейтингу наиболее стабильными референсными генами оказались Pgk1, Sdha, Ppia.
Мы рассчитали уровень экспрессии 6 изученных генов относительно трех оптимальных референсных генов для каждой изученной области (рис. 2 и 3).
Рис. 2.
Экспрессия референсных генов в дорзальном гиппокампе крыс в латентную фазу (7 дней после индукции) литий-пилокарпиновой модели височной эпилепсии на фоне раздельной и комбинированной терапией противовоспалительным цитокином IL-1ra и смесью антиоксидантов). Li – контрольные животные без индукции судорог (только введение хлорида лития), Li-PC – животные, у которых вызывали эпилептический статус путем введения пилокарпина; IL-1ra – лечение рецепторным антагонистом интерлейкина-1 (анакинра, 100 мг/кг в сут), AOx – лечение смесью антиоксидантов (100 мг/кг витамина С, 200 мг/кг витамина Е, 25 мг/кг S-аденозилметионина в сутки). ** – p < 0.01 (однофакторный дисперсионный анализ с последующим попарным сравнением критерием Даннета – в качестве группы сравнения использованы нелеченные животные после эпилептического статуса; группа “Li” использована для демонстрации эффектов пилокарпиновых судорог на изучаемые показатели, напрямую не сравнивалась с животными после судорог, получавшими терапию)
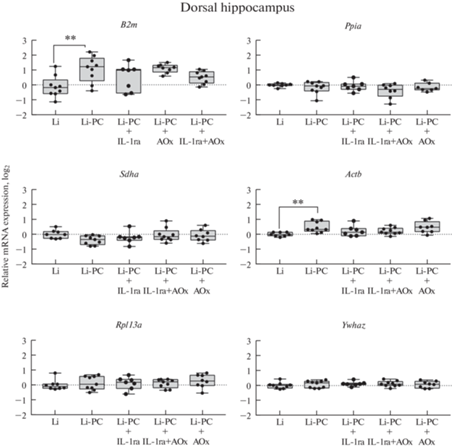
Рис. 3.
Экспрессия референсных генов в височной области коры головного мозга крыс в латентную фазу литий-пилокарпиновой модели височной эпилепсии на фоне раздельной и комбинированной терапией противовоспалительным цитокином IL-1ra. Li – контрольные животные без индукции судорог (только введение хлорида лития), Li-PC – животные, у которых вызывали эпилептический статус путем введения пилокарпина; IL-1ra – лечение рецепторным антагонистом интерлейкина-1 (анакинра, 100 мг/кг в сутки), AOx – лечение смесью антиоксидантов (100 мг/кг витамина С, 200 мг/кг витамина Е, 25 мг/кг S-аденозилметионина в сутки).
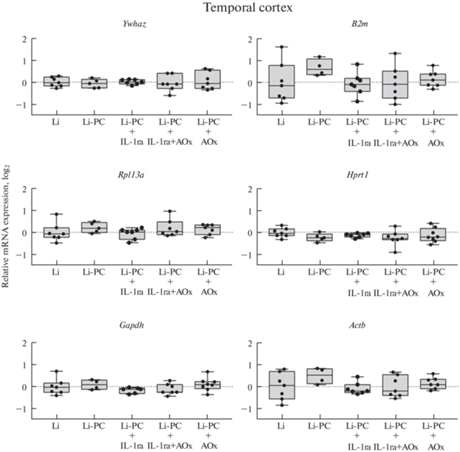
В дорзальном гиппокампе обнаружено увеличение экспрессии генов B2m и Actb после эпилептического статуса, при этом ни один из исследованных видов терапии не подавлял этих изменений (рис. 2; B2m: F (4.37) = 4.777; p < 0.01 и Actb: F (4.36) = 3.674; p = 0.01). В височной области коры значимых изменений экспрессии генов обнаружено не было (рис. 3).
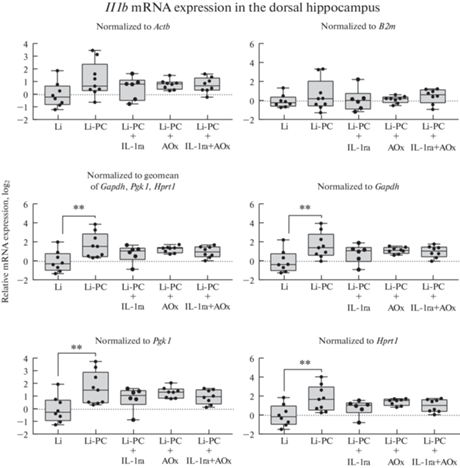
Чтобы оценить, как может повлиять на оценку экспрессии генов интересов выбор референсных генов, мы оценили экспрессию гена провоспалительного цитокина интерлейкина-1 бета (Il1b) в гиппокампе крыс, нормируя относительно уровня экспрессии каждого из трех наиболее стабильных референсных генов (Gapdh, Pgk1, Hprt1), их геометрического среднего, или относительно двух самых нестабильных (B2m и Actb) (рис. 4). При использовании наиболее стабильных референсных генов было выявлено значимое повышение уровня экспрессии гена Il1b после эпилептического статуса (геометрическое среднее: F (4.35) = 3.8, p = 0.01; Hprt1: F (4.35) = 4.3, p < 0.01; Pgk1: F (4.35) = 3.9, p = 0.01; Gapdh: F (4.35) = 3.3, p = 0.02). В то же время при нормализации относительно экспрессии гена B2m или Actb изменений экспрессии не выявлялось (B2m: F (4.34) = 0.52, p = 0.72; Actb: F (4.34) = 1.9, p = 0.13).
Рис. 4.
Стратегия нормирования данных ОТ-кПЦР влияет на обнаружение изменений экспрессии гена Il1b в дорзальной области гиппокампа крыс в латентную фазу литий-пилокарпиновой модели височной эпилепсии. Li – контрольные животные без индукции судорог (только введение хлорида лития), Li-PC – животные, у которых вызывали эпилептический статус путем введения пилокарпина; IL-1ra – лечение рецепторным антагонистом интерлейкина-1 (анакинра, 100 мг/кг в сут), AOx – лечение смесью антиоксидантов (100 мг/кг витамина С, 200 мг/кг витамина Е, 25 мг/кг S-аденозилметионина в сутки). Уровень экспрессии гена Il1b был нормирован относительно уровня экспрессии каждого из трех наиболее стабильных референсных генов (Gapdh, Pgk1, Hprt1), их геометрического среднего, или относительно двух самых нестабильных (B2m и Actb); **p < 0.01 (однофакторный дисперсионный анализ с апостериорным критерием Даннета – попарное сравнение всех групп с нелечеными животными после эпилептического статуса).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Мы изучили стабильность экспрессии 9 референсных генов в височной коре и гиппокампе крыс при экспериментальном эпилептогенезе – в латентную фазу литий-пилокарпиновой модели височной эпилепсии – на фоне применения экспериментальной противовоспалительной (рецепторный антагонист IL-1), антиоксидантной (витамин С, витамин Е, S-аденозилметионин) терапии и их сочетания. Ранее подобных исследований с литий-пилокарпиновой моделью не проводилось, однако были работы с моделями электрической стимуляции перфорантного пути и каинатной моделью, а также с пилокарпиновой моделью без использования хлорида лития [27, 28]. В нашей недавней работе на пентилентетразоловой модели острых судорог мы показали, что выбор устойчивых референсных генов для гиппокампа и разных областей коры сильно различается, что воспроизвелось и в настоящем исследовании. Так, экспрессия гена Gapdh была наиболее стабильной в гиппокампе, в то время как в височной коре она не была стабильной (рис. 1). С другой стороны, стабильность экспрессии генов Ppia и Sdha была высокой в височной коре, но не в гиппокампе (рис. 1, 2).
В период эпилептогенеза в каинатной модели гены Ppia и Actb были описаны как оптимальные референсные гены в гиппокампе [27]. Мы же выявили, что в литий-пилокарпиновой модели, по крайней мере на фоне экспериментальной терапии, их экспрессия мало стабильна (рис. 1). Стоит также отметить, что в модели пентилентетразоловых судорог экспрессия гена Ppia была стабильна в дорзальном гиппокампе [29]. Интересно, что ранее Actb называли одним из наиболее стабильных референсных генов в гиппокампе крыс при эпилептогенезе, индуцированном системным введением пилокарпина (хлоридом лития) [28], однако наше исследование не подтверждает данные Marques с коллегами. Наблюдаемые расхождения могут объяснены иным выбором сроков: в процитированной работе стабильность экспрессии оценивали сразу после и через сутки после инъекции хемоконвульсанта, когда эффекты эпилептогенеза еще не выражены. Кроме того, в нашем случае эффекты вводимых препаратов могли дополнительно сказаться на стабильности экспрессии изучаемых генов. Данное противоречие подчеркивает важность экспериментального подбора оптимальных референсных генов с учетом исследуемой области мозга и экспериментальных условий, так как даже в близких моделях стабильность одних и тех же референсных генов может кардинально различаться.
В настоящей работе продемонстрировано усиление экспрессии генов Actb и B2m в гиппокампе крыс при экспериментальной индукции эпилептогенеза в литий-пилокарпиновой модели, при этом данные эффекты были устойчивы к проведенной антиоксидантной и противовоспалительной терапии (рис. 2). Данный феномен требует дальнейшего изучения, так как, по-видимому, связан c патогенетическими перестройками – либо изменениями транскрипции, либо соотношением клеточных элементов нервной ткани. С учетом того, что Actb является одним из популярнейших референсных генов, часто используемых как единичный без дополнительной проверки [30], следует с осторожностью относиться к интерпретации данных ОТ-кПЦР в случае, если не проводится проверка стабильности референсных генов.
В нашем исследовании продемонстрировано, что выбор референсных генов может существенно повлиять на результаты исследования. Например, при нормализации результатов относительно генов B2m или Actb, которые в данной модели нежелательно использовать в качестве референсных, мы не наблюдали значимого увеличения экспрессии гена Il1b, которое обнаруживается при нормализации относительно любого из трех оптимальных референсных генов (рис. 4). Схожие эффекты были ранее продемонстрированы при анализе экспрессии гена белка програнулина (Pgrn) в гиппокампе крыс в вальпроатной модели расстройств аутистического спектра: неоптимальный выбор стратегии нормализации приводил не только к исчезновению статистически выявляемых эффектов, но даже к ложному выявлению противоположных реальным изменений содержания целевой мРНК [6]. Стоит также отметить, что в упомянутой работе Gapdh оказывался наименее стабильным и невалидным референсным геном в гиппокампе, в то время как в настоящей работе (рис. 1), так и в наших предыдущих исследованиях на модели пентилентетразоловых судорог [31] он оказывается наиболее стабильным в дорзальном гиппокампе.
Таким образом, мы определили регионоспецифичные оптимальные референсные гены для оценки уровня содержания целевых мРНК в дорзальном гиппокампе (Gapdh, Pgk1, Hprt1) и височной коре (Pgk1, Sdha, Ppia) головного мозга крыс в латентную фазу литий-пилокарпиновой модели височной эпилепсии на фоне сочетанной или раздельной экспериментальной противовоспалительной и антиоксидантной терапии. При этом было выявлено значимое усиление экспрессии генов Actb и B2m в дорзальном гиппокампе, которое не подавлялось ни применением IL-1ra, ни смеси антиоксидантов (витамин С, витамин Е, аденозилметионин), ни их сочетанием.
Список литературы
Bustin SA, Benes V, Garson JA, Hellemans J, Huggett J, Kubista M, Mueller R, Nolan T, Pfaffl MW, Shipley GL, Vandesompele J, Wittwer CT (2009) The MIQE guidelines: Minimum information for publication of quantitative real-time PCR experiments. Clin Chem 55: 611–622. https://doi.org/10.1373/clinchem.2008.112797
Derveaux S, Vandesompele J, Hellemans J (2010) How to do successful gene expression analysis using real-time PCR. Methods 50: 227–230. https://doi.org/10.1016/j.ymeth.2009.11.001
Vandesompele J, De Preter K, Pattyn F, Poppe B, Van Roy N, De Paepe A, Speleman F (2002) Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes. Genome Biol 3: RESEARCH0034. https://doi.org/10.1186/gb-2002-3-7-research0034
Silver N, Best S, Jiang J, Thein SL (2006) Selection of housekeeping genes for gene expression studies in human reticulocytes using real-time PCR. BMC Mol Biol 7: 33. https://doi.org/10.1186/1471-2199-7-33
Pfaffl MW, Tichopad A, Prgomet C, Neuvians TP (2004) Determination of stable housekeeping genes, differentially regulated target genes and sample integrity: BestKeeper – Excel-based tool using pair-wise correlations. Biotechnol Lett 26: 509–515.
Zhou J, Zhang X, Ren J, Wang P, Zhang J, Wei Z, Tian Y (2016) Validation of reference genes for quantitative real-time PCR in valproic acid rat models of autism. Mol Biol Rep 43: 837–847. https://doi.org/10.1007/s11033-016-4015-x
Schwarz AP, Kovalenko AA, Malygina DA, Postnikova TY, Zubareva OE, Zaitsev AV (2020) Reference Gene Validation in the Brain Regions of Young Rats after Pentylenetetrazole-Induced Seizures. Biomedicines 8: 239. https://doi.org/10.3390/biomedicines8080239
Löscher W (2017) Animal Models of Seizures and Epilepsy: Past, Present, and Future Role for the Discovery of Antiseizure Drugs. Neurochem Res 42: 1873–1888. https://doi.org/10.1007/s11064-017-2222-z
Terrone G, Balosso S, Pauletti A, Ravizza T, Vezzani A (2020) Inflammation and reactive oxygen species as disease modifiers in epilepsy. Neuropharmacology 167: 107742. https://doi.org/10.1016/j.neuropharm.2019.107742
Dyomina AV., Kovalenko AA, Zakharova MV, Postnikova TY, Griflyuk AV, Smolensky IV, Antonova IV, Zaitsev AV (2022) MTEP, a Selective mGluR5 Antagonist, Had a Neuroprotective Effect but Did Not Prevent the Development of Spontaneous Recurrent Seizures and Behavioral Comorbidities in the Rat Lithium-Pilocarpine Model of Epilepsy. Int J Mol Sci 23: 497. https://doi.org/10.3390/ijms23010497
Racine RJ (1972) Modification of seizure activity by electrical stimulation. II. Motor seizure. Electroencephalogr Clin Neurophysiol 32: 281–294. https://doi.org/10.1016/0013-4694(72)90177-0
Ming Z, Fan Y, Yang X, Lautt WW (2006) Synergistic protection by S-adenosylmethionine with vitamins C and E on liver injury induced by thioacetamide in rats. Free Radic Biol Med 40: 617–624. https://doi.org/10.1016/j.freeradbiomed.2005.09.034
Dyomina AV, Zubareva OE, Smolensky IV, Vasilev DS, Zakharova MV, Kovalenko AA, Schwarz AP, Ischenko AM, Zaitsev AV (2020) Anakinra Reduces Epileptogenesis, Provides Neuroprotection, and Attenuates Behavioral Impairments in Rats in the Lithium-Pilocarpine Model of Epilepsy. Pharmaceuticals (Basel) 13: 340. https://doi.org/10.3390/ph13110340
Schwarz AP, Malygina DA, Kovalenko AA, Trofimov AN, Zaitsev AV (2020) Multiplex qPCR assay for assessment of reference gene expression stability in rat tissues/samples. Mol Cell Probes 53: 101611. https://doi.org/10.1016/j.mcp.2020.101611
Andersen CL, Jensen JL, Ørntoft TF (2004) Normalization of real-time quantitative reverse transcription-PCR data: a model-based variance estimation approach to identify genes suited for normalization, applied to bladder and colon cancer data sets. Cancer Res 64: 5245–5250. https://doi.org/10.1158/0008-5472.CAN-04-0496
Livak KJ, Schmittgen TD (2001) Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCT method. Methods 25: 402–408. https://doi.org/10.1006/meth.2001.1262
Lin W, Burks CA, Hansen DR, Kinnamon SC, Gilbertson TA (2004) Taste receptor cells express pH-sensitive leak K+ channels. J Neurophysiol 92: 2909–2919. https://doi.org/10.1152/jn.01198.2003
Malkin SL, Amakhin DV., Veniaminova EA, Kim KK, Zubareva OE, Magazanik LG, Zaitsev AV (2016) Changes of ampa receptor properties in the neocortex and hippocampus following pilocarpine-induced status epilepticus in rats. Neuroscience 327: 146–155. https://doi.org/10.1016/j.neuroscience.2016.04.024
Yamaguchi M, Yamauchi A, Nishimura M, Ueda N, Naito S (2005) Soybean Oil Fat Emulsion Prevents Cytochrome P450 mRNA Down-Regulation Induced by Fat-Free Overdose Total Parenteral Nutrition in Infant Rats. Biol Pharm Bull 28: 143–147. https://doi.org/10.1248/bpb.28.143
Bonefeld BE, Elfving B, Wegener G (2008) Reference genes for normalization: A study of rat brain tissue. Synapse 62: 302–309. https://doi.org/10.1002/syn.20496
Langnaese K, John R, Schweizer H, Ebmeyer U, Keilhoff G (2008) Selection of reference genes for quantitative real-time PCR in a rat asphyxial cardiac arrest model. BMC Mol Biol 9: 53. https://doi.org/10.1186/1471-2199-9-53
Swijsen A, Nelissen K, Janssen D, Rigo J-M, Hoogland G (2012) Validation of reference genes for quantitative real-time PCR studies in the dentate gyrus after experimental febrile seizures. BMC Res Notes 5: 685. https://doi.org/10.1186/1756-0500-5-685
Kyzar EJ, Zhang H, Sakharkar AJ, Pandey SC (2017) Adolescent alcohol exposure alters lysine demethylase 1 (LSD1) expression and histone methylation in the amygdala during adulthood. Addict Biol 22: 1191–1204. https://doi.org/10.1111/adb.12404
Pohjanvirta R, Niittynen M, Lindén J, Boutros PC, Moffat ID, Okey AB (2006) Evaluation of various housekeeping genes for their applicability for normalization of mRNA expression in dioxin-treated rats. Chem Biol Interact 160: 134–149. https://doi.org/10.1016/j.cbi.2006.01.001
Rioja I, Bush KA, Buckton JB, Dickson MC, Life PF (2004) Joint cytokine quantification in two rodent arthritis models: kinetics of expression, correlation of mRNA and protein levels and response to prednisolone treatment. Clin Exp Immunol 137: 65–73. https://doi.org/10.1111/j.1365-2249.2004.02499.x
Paxinos G, Watson C (2005) The Rat Brain in Stereotaxic Coordinates – The New Coronal Set, 5th ed. Elsevier Acad Press. San Diego, CA.
Sadangi C, Rosenow F, Norwood BA (2017) Validation of reference genes for quantitative gene expression analysis in experimental epilepsy. J Neurosci Res 95: 2357–2366. https://doi.org/10.1002/jnr.24089
Marques TEBS, de Mendonça LR, Pereira MG, de Andrade TG, Garcia-Cairasco N, Paçó-Larson ML, Gitaí DLG (2013) Validation of Suitable Reference Genes for Expression Studies in Different Pilocarpine-Induced Models of Mesial Temporal Lobe Epilepsy. PLoS One 8: e71892. https://doi.org/10.1371/journal.pone.0071892
Schwarz AP, Kovalenko AA, Malygina DA, Postnikova TY, Zubareva OE, Zaitsev AV (2020) Reference Gene Validation in the Brain Regions of Young Rats after Pentylenetetrazole-Induced Seizures. Biomedicines 8: 239. https://doi.org/10.3390/biomedicines8080239
Chapman JR, Waldenström J (2015) With Reference to Reference Genes: A Systematic Review of Endogenous Controls in Gene Expression Studies. PLoS One 10: e0141853. https://doi.org/10.1371/journal.pone.0141853
Schwarz AP, Kovalenko AA, Malygina DA, Postnikova TY, Zubareva OE, Zaitsev AV (2020) Reference Gene Validation in the Brain Regions of Young Rats after Pentylenetetrazole-Induced Seizures. Biomedicines 8: 239. https://doi.org/10.3390/biomedicines8080239
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


