Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 6, стр. 771-780
Анализ роли D1- и D2-рецепторов дофамина в модуляции функции осмотического концентрирования у крыс с различным уровнем вазопрессина в крови
П. Д. Правикова 1, *, Л. Н. Иванова 1
1 Институт цитологии и генетики СО РАН
Новосибирск, Россия
* E-mail: PollyPravi@yandex.ru
Поступила в редакцию 21.03.2022
После доработки 28.04.2022
Принята к публикации 15.05.2022
- EDN: DPTBEA
- DOI: 10.31857/S0869813922060061
Аннотация
Исследована роль D1- и D2-подобных рецепторов дофамина в модуляции концентрирующей функции почек на крысах линии WAG и вазопрессин-дефицитных особях линии Brattleboro. Установлено, что блокада D1-рецепторов (D1R) при введении селективного антагониста SCH-23390 гидрохлорида не вызывает существенных изменений параметров гидруреза у крыс линии WAG, в то время как у крыс Brattleboro приводит к развитию антидиуретической реакции. Блокада D2-рецепторов (D2R) сульпиридом у крыс WAG сопровождается антидиуретическим ответом вследствие снижения скорости клубочковой фильтрации, тогда как у крыс Brattleboro снижение скорости мочеотделения происходило в связи с увеличением реабсорбции воды. Введение селективного антагониста D1R, устраняющего активирующее влияние D1R на цАМФ-систему, приводит к изменениям параметров натрийуретической функции, направленность которых зависит от уровня эндогенного вазопрессина в крови. У крыс WAG при блокаде D1R установлено снижение скорости экскреции натрия, тогда как у вазопрессин-дефицитных крыс Brattleboro, напротив, выявлена натрийуретическая реакция вследствие торможения реабсорбции натрия. В то же время при введении сульпирида, стимулирующего активность аденилатциклазной системы вследствие подавления ингибирующего влияния D2R на цАМФ, фиксируется антинатрийуретическая реакция у крыс обеих линий вне зависимости от уровня эндогенного вазопрессина в крови. Результаты исследований обсуждаются в контексте литературных данных и позволяют прийти к выводу о прямом вазопрессин-независимом эффекте подавления реабсорбции воды как D1, так и D2 подтипами рецепторов дофамина. Вместе с тем в условиях врожденной неспособности к синтезу эндогенного вазопрессина установлено активирующее влияние D1R на транспорт натрия, тогда как тормозящий эффект D2R на натрийуретическую функцию проявляется независимо от уровня гормона в крови и базальной активности цАМФ-системы.
В системе осморегуляции у млекопитающих основным фактором, определяющим интенсивность реабсорбции воды в почке, является нейрогипофизарный гормон вазопрессин (ВП), классический сигнальный путь действия которого в эпителии собирательных трубок представлен цАМФ-сигнальным внутриклеточным каскадом [1]. Известно, что ВП способен оказывать стимулирующий или ингибирующий эффект на транспорт воды и натрия в эпителии почечных канальцев в зависимости от вовлечения рецепторов V2- или V1a-типа, активация которых определяется концентрацией гормона в крови [2].
В последние годы при изучении механизмов модуляции осморегулирующего эффекта ВП значительное внимание уделяется роли местных, аутакоидных факторов, выделение которых стимулирует сам гормон, формируя отрицательную обратную связь [3]. Поскольку система локальных факторов в почке является по сути механизмом саморегуляции и защиты эпителия, исследование механизмов аутокринно-паракринных взаимодействий имеет значительные научно-практические перспективы. К числу аутокринных факторов почки относится дофамин (DA), играющий значительную роль в регуляции как водно-электролитного баланса, так и кровяного давления [4, 5]. Рецепторы DA распределены гетерогенно вдоль нефрона [6] и подразделяются на два класса – D1-подобные рецепторы (подтипы D1R и D5R) и D2-подобные рецепторы (подтипы D2R, D3R и D4R) [7, 8]. Аналогично трансдукции сигнала при действии ВП [9] ключевым посредником стимуляции DA является цАМФ-сигнальный путь: D1-подобные рецепторы сопряжены с Gs белком, активирующим аденилатциклазу [10], тогда как в условиях действия D2-подобных рецепторов, стимулирующих Gi/o белок, активность цАМФ-сигнального каскада подавляется [8, 11]. Учитывая, что ключевым вторичным посредником трансдукции сигналов как ВП, так и DA является цАМФ, следует ожидать влияние DA, модулятора осморегулирующего эффекта ВП, на параметры почечной функции, реализующиеся посредством изменения активности цАМФ-системы. Кроме того, принимая во внимание особенности трансдукции сигнала различными подтипами рецепторов DA, можно предположить, что его действие на функцию осмотического концентрирования должно быть различным в зависимости от типа стимулируемого рецептора. Настоящее исследование было предпринято с целью выявления роли рецепторов DA, относящихся к разным классам, в модуляции параметров концентрирующей функции почек у крыс с различным уровнем ВП в крови.
МЕТОДЫ ИССЛЕДОВАНИЯ
В опытах использованы крысы в возрасте 60 дней и массой тела 150–200 г из вивария конвенциональных животных Института цитологии и генетики СО РАН, содержавшиеся в условиях стандартного рациона со свободным доступом к питьевой воде и сухому корму. Эксперименты проведены на крысах инбредной линии WAG (Wistar Albino Glaxo) с высоким уровнем ВП в крови и на гомозиготных крысах линии Brattleboro, лишенных ВП вследствие мутации гена, кодирующего предшественник гормона [12]. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ (Приложение к Приказу Министерства здравоохранения РФ № 267 от 19.06.2003), а также с учетом международных рекомендаций по работе с экспериментальными животными.
Животные каждой линии были разделены на 3 экспериментальные группы (по 9 особей в каждой): 1) контрольная группа; 2) крысы в условиях селективной блокады D1-рецепторов; 3) крысы в условиях блокады D2-рецепторов. Для блокады D1-рецепторов использован селективный антагонист R(+)-SCH-23390 гидрохлорид (R(+)-7-хлоро-8-гидрокси-3-метил-1-фенил-2,3,4,5-тетрагидро-1H-3-бензазепин гидрохлорид, Sigma, США) в дозе 0.1 мг/0.1 мл/100 г вводился внутрибрюшинно дважды в течение суток (утро/вечер) [13]. Блокада D2-рецепторов осуществлялась в условиях внутрибрюшинного введения селективного антагониста D2R сульпирида (Sulpiride, (±)-N-(1-этил-2-пирролидинилметил)-2-метокси-5-сульфамоилбензамид, Sigma, США), в дозе 0.6 мг/0.1 мл/100 г дважды в течение 3.5 ч [14]. Контрольным особям двух линий вводился физиологический раствор в объеме 0.1 мл/ 100 г массы тела.
Через 60 мин после последней инъекции животных высаживали на 1 ч в индивидуальные клетки с проволочным дном для сбора спонтанно экскретируемой мочи. По окончании эксперимента животных анестезировали тиопенталом натрия (10 мг/100 г массы тела, внутрибрюшинно) и забирали пробы крови.
Осмоляльность мочи и сыворотки крови измеряли криоскопическим методом (миллиосмометр ОСКР-1М КИВИ, Россия). Концентрацию креатинина в моче и сыворотке крови определяли методом Яффе на спектрофотометре (BioPhotometr plus, Eppendorf, Германия, 490 нм), скорость клубочковой фильтрации рассчитывали по клиренсу эндогенного креатинина. Содержание катионов натрия в пробах мочи и сыворотке крови измеряли методом пламенной фотометрии (Flame photometer 410 Sherwood, Великобритания). По стандартным формулам рассчитывали клиренс осмотически активных веществ (Сосм), максимальную реабсорбцию осмотически свободной воды $\left( {T_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{C}} \right),$ экскрецию натрия (ЕNa) и экскретируемую фракцию натрия (FENa). Все параметры рассчитывали по стандартным формулам на 100 г массы тела.
Данные представлены в виде среднего значения ± ошибка среднего (M ± SEM). Достоверность различий оценивали в программе Statistica 8.0 с помощью апостериорного LSD критерия Фишера для множественных сравнений. Для парного сравнения средних между линиями применялся критерий Стьюдента для независимых выборок. Различия считались статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В настоящем исследовании в соответствии с поставленной целью были оценены параметры, характеризующие гидруретическую и натрийуретическую функции у крыс, обладающих разной способностью к синтезу эндогенного ВП, в условиях блокады как D1-, так и D2-рецепторов DA.
У контрольных крыс линии WAG зарегистрирована низкая скорость мочеотделения и положительные значения показателей реабсорбции осмотически свободной воды, отражающие нормальный уровень эндогенного ВП. В то же время для выявления ВП-независимой роли D1R и D2R в регуляции осмотического концентрирования была предпринята серия экспериментов на крысах линии Brattleboro с наследственным дефицитом эндогенного ВП. Гидруретическая функция у контрольных крыс линий WAG и крыс Brattleboro, содержавшихся на стандартном водно-пищевом рационе, существенно различалась. У ВП-дефицитных крыс Brattleboro фиксировалась высокая скорость диуреза и отрицательные показатели реабсорбции воды (рис. 1).
Рис. 1.
Параметры гидруретической функции почек в условиях блокады как D1R SCH23390 гидрохлоридом, так и D2R сульпиридом у крыс линий WAG и Brattleboro (M ± SEM). a – скорость мочеотделения (V); b – реабсорбция осмотически свободной воды $\left( {T_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{C}} \right).$ Достоверность различий: ***p < 0.001 – сравнение с контрольными показателями крыс линии WAG; #p < 0.05; ##p < 0.01; ###p < 0.001 – сравнение с контрольными показателями крыс линии Brattleboro.
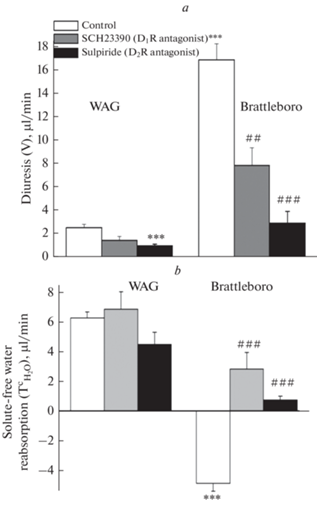
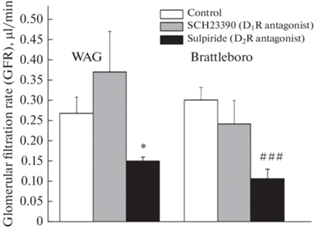
У крыс линии WAG в условиях блокады D1R при введении SCH-23390 гидрохлорида не было выявлено существенных изменений параметров гидруреза (рис. 1), тогда как при введении антагониста D2R сульпирида установлено снижение скорости мочеотделения на фоне уменьшения скорости клубочковой фильтрации (рис. 2) при сохранении базального уровня реабсорбции осмотически свободной воды (рис. 1). Между тем, независимо от степени сродства к D1R или к D2R антагонистов, у ВП-дефицитных крыс Brattleboro развивалась антидиуретическая реакция, при этом снижение скорости мочеотделения вследствие активации реабсорбции осмотически свободной воды и снижения скорости клубочковой фильтрации (рис. 2) было более выраженным при блокаде D2R (рис. 1). Введение сульпирида способствовало снижению скорости клубочковой фильтрации как у крыс WAG, так и Brattleboro, тогда как при блокаде D1R SCH23390 гидрохлоридом не было выявлено достоверных изменений скорости клубочковой фильтрации у крыс обеих линий (рис. 2).
Рис. 2.
Скорость клубочковой фильтрации (GFR) в условиях блокады как D1R SCH23390 гидрохлоридом, так и D2R сульпиридом у крыс линий WAG и Brattleboro (M ± SEM). Достоверность различий: *p < 0.05 – сравнение с контрольными показателями крыс линии WAG; ###p < 0.001 – сравнение с контрольными показателями крыс линии Brattleboro.
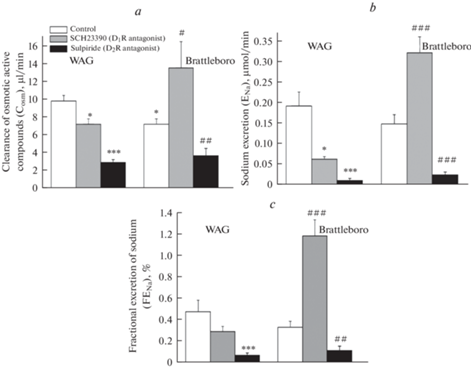
Контрольные показатели натрийуретической функции не имели существенных межлинейных различий (рис. 3). У крыс WAG с высоким уровнем эндогенного ВП в крови блокада подтипов рецепторов как D1R, так и D2R приводила к развитию антинатрийуретической реакции. Введение SCH23390 гидрохлорида, блокирующего действие D1R, способствовало снижению скорости экскреции натрия на фоне отсутствия достоверных изменений уровня экскретируемой фракции (рис. 3). В то же время при введении антагониста D2R сульпирида крысам WAG антинатрийуретический ответ был более выражен: наблюдалось существенное снижение клиренса осмотически активных веществ вследствие снижения скорости экскреции и экскретируемой фракции натрия (рис. 3). Между тем, у ВП-дефицитных крыс Brattleboro направленность изменений натрийуретической функции зависела от селективности антагониста рецепторов DA: при устранении действия D1R был зафиксирован рост осмотического очищения при усилении экскреции натрия вследствие торможения его реабсорбции, в то время как при введении сульпирида, блокирующего D2R, напротив, был установлен антинатрийурез (рис. 3). Таким образом, селективная блокада D1R приводила к изменению параметров натрийуретической функции, направленность которой определялась уровнем эндогенного ВП в крови, поскольку у ВП-дефицитных крыс Brattleboro, в отличие от особей WAG, была выявлена натрийуретическая реакция – увеличение экскретируемой фракции и скорости экскреции натрия.
Рис. 3.
Параметры натрийуретической функции в условиях блокады как D1R SCH23390 гидрохлоридом, так и D2R сульпиридом у крыс линий WAG и Brattleboro (M ± SEM). a – осмоляльное очищение (Сосм); b – скорость экскреции натрия (ENa); c – экскретируемая фракция натрия (FENa). Достоверность различий: *p < 0.05; ***p < 0.001 – сравнение с контрольными показателями крыс WAG; #p < 0.05; ##p < 0.01; ###p < 0.001 – сравнение с контрольными показателями крыс линии Brattleboro.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Поскольку паракринная система почки активируется при повышенной нагрузке, почечные аутакоиды нередко рассматриваются в качестве протективных факторов, предотвращающих повреждения путем подавления транспортных процессов в эпителиоцитах почки [3]. Ранее дофаминергическая система почки характеризовалась диуретическим и натрийуретическим эффектом, а также в качестве сосудорасширяющего фактора [4, 5]. Вместе с тем, учитывая особенности трансдукции сигнала DA-рецепторов [8, 10], а также их распределение в почечной ткани [6], представляло интерес оценить роль рецепторов DA, относящихся к разным классам, как в ВП-независимой регуляции концентрирующей функции почки, так и в модуляции осморегулирующего эффекта ВП.
Независимо от врожденной способности к синтезу эндогенного ВП, у крыс при блокаде D1R SCH23390 гидрохлоридом, снижающего активность цАМФ-сигнального каскада [10, 13], не было выявлено достоверных изменений скорости клубочковой фильтрации, поскольку, как известно, в клубочке почек D1R не локализованы [7]. Кроме того, согласно ранее полученным данным, блокада D1R приводила к снижению скорости клубочковой фильтрации только на фоне высокосолевой диеты, в то время как при нормальном потреблении натрия скорость клубочковой фильтрации оставалась неизмененной [15]. В то же время блокада D2-рецепторов сульпиридом способствовала выраженному снижению скорости клубочковой фильтрации у крыс обеих линий, что является следствием устранения сосудорасширяющего эффекта D2-рецепторов [16] и способствует снижению скорости мочеотделения. Предполагается, что применение сульпирида, устраняющее блокирующего влияния D2R на аденилатциклазу [14], может явиться новым терапевтическим подходом при лечении клубочковой гиперфильтрации [17]. Сохранение уровня скорости клубочковой фильтрации на прежнем уровне у крыс WAG при блокаде D1R сопровождалось отсутствием достоверных изменений показателей гидруретической функции, в то время как введение антагониста D2R способствовало развитию антидиуреза вследствие снижения скорости фильтрации без существенных изменений реабсорбции воды. Отсутствие изменений показателя реабсорбции осмотически свободной воды у крыс WAG при блокаде как D1R, так и D2R объясняется, по всей видимости, преобладающим влиянием высокого уровня эндогенного ВП на факультативную реабсорбцию воды. На сегодняшний день не выявлено межлинейных различий дофаминергической системы почки у крыс линий WAG и Brattleboro, несмотря на зафиксированное ранее снижение уровня DA в лобной коре на фоне гиперфункции DA в полосатом теле у ВП-дефицитных особей Brattleboro [18, 19]. В то же время у ВП-дефицитных крыс Brattleboro при введении блокатора D1R SCH-23390 гидрохлорида, а также в условиях применения антагониста D2R сульпирида было зафиксировано снижение скорости мочеотделения, обусловленное ВП-независимыми механизмами. Более выраженный антидиуретический ответ у крыс Brattleboro был выявлен в условиях введения сульпирида, который обусловлен увеличением реабсорбции осмотически свободной воды, а также снижением скорости клубочковой фильтрации. Кроме того, увеличение эффективности осмотического концентрирования у особей Brattleboro на фоне блокады D2R, по-видимому, было в связи с увеличением внутрипочечного концентрационного градиента, поскольку при введении сульпирида был установлен антинатрийурез вследствие устранения ингибирующего влияния D2R на реабсорбцию натрия в почечных канальцах. Между тем, у крыс Brattleboro в условиях блокады D1R SCH-23390 на фоне отсутствия достоверных изменений скорости фильтрации при действии гидрохлорида было зафиксировано снижение скорости мочеотделения, обусловленное, в первую очередь, увеличением реабсорбции осмотически свободной воды. Блокада D1R приводит к устранению стимулирующего влияния на цАМФ-систему, поскольку, известно, что D1R сопряжены с Gs-белком, активирующим аденилатциклазу [10]. Между тем ранее предполагалось, что DA-индуцированный диурез и натрийурез опосредован стимуляцией D1R, приводящей к стимуляции фосфолипазного сигнального каскада [20], способствующей, как известно, снижению водопроницаемости эпителия собирательных трубок [21]. Позднее было выявлено, что стимуляция альтернативного Са-зависимого фосфолипазного сигнального пути является следствием синергизма D1/D2-рецепторов [22], обусловленного коэкспрессией D1R и D2R в собирательных трубках [16, 23]. Вместе с тем, принимая во внимание, что ВП-дефицитные крысы Brattleboro характеризуются сниженной активностью всех изоформ аденилатциклазы [24], можно предположить, что трансдукция сигнала D1R идет по альтернативному фосфолипазному пути, блокада которого приводит к устранению его тормозящего влияния на реабсорбцию воды.
Как известно, основной физиологический эффект DA при модуляции функции осмотического концентрирования – увеличение натрийуреза вследствие подавления реабсорбции натрия в эпителии почечных канальцев [4]. Независимо от степени сродства антагонистов к D1R или к D2R у крыс WAG был зафиксирована антинатрийуретическая реакция, которая была более выражена при блокаде D2R. Известно, что стимуляция D1R подавляет экспрессию Na+/H+-обменника (NHE3), а также активность Na+,K+-АТФазы в эпителиоцитах как проксимального канальца, так и толстого восходящего колена петли Генле [25–27]. В то же время зафиксированное у крыс WAG сохранение начального уровня экскретируемой фракции натрия несмотря на снижение скорости его экскреции при введении антагониста D1R, очевидно, явилось следствием сохранения преобладающего эффекта ВП на натрийуретическую функцию почек в собирательных трубках и дистальных сегментах нефрона [2]. Вместе с тем при введении крысам обеих линий сульпирида, приводящего, напротив, к прекращению подавляющего действия D2R на цАМФ-сигнальный путь, антинатрийуретический ответ был обусловлен активацией реабсорбции натрия, по-видимому, в проксимальных частях нефрона, что подтверждается ранее полученными данными [28]. Установленное влияние блокады D2R на реабсорбцию натрия не зависит от уровня эндогенного ВП и обусловлено устранением D2R-опосредованного натрийуретического эффекта в проксимальных канальцах нефрона [29]. Кроме того, предполагается, что установленный антинатрийурез у крыс WAG при введении сульпирида является, в том числе, следствием нивелирования блокирующего влияния DA на ВП-зависимую реабсорбцию натрия в кортикальной части собирательных трубок [30]. Между тем, в отличие от однонаправленной межлинейной реакции при устранении D2R, эффект блокады D1R зависел от уровня ВП в крови. У ВП-дефицитных крыс Brattleboro, в противоположность особям WAG, была зафиксирована натрийуретическая реакция в ответ на введение антагониста D1R SCH-23390. У крыс Brattleboro зафиксированное торможение транспорта натрия при введении блокатора D1R SCH23390 гидрохлорида является по сути прямым компенсаторным эффектом устранения стимулирующего действия D1R на цАМФ-систему при сниженной базальной активности аденилатциклазы [24]. Кроме того, обсуждая особенности почечной дофаминергической системы и связанных с ней факторов, важно упомянуть о семействе ферментов циклооксигеназ (ЦОГ). Известно, что натрийуретическая дофаминергическая система по механизму обратной связи подавляет синтез ЦОГ-1,2, которые, в свою очередь, приводят к стимуляции реабсорбции натрия посредством активации ренин-ангиотензиновой системы [31]. В то же время ранее было установлено, что у крыс Brattleboro обнаруживается снижение уровня экспрессии ЦОГ-1,2 во всех зонах почки [32], что, вероятно, является причиной развития натрийуретической реакции на фоне блокады D1R при отсутствии стимулирующего влияния ЦОГ-системы на транспорт натрия.
Таким образом, вне зависимости от типа блокируемого рецептора DA был выявлен ВП-независимый антидиуретический ответ вследствие устранения прямого ингибирующего влияния как D1R, так и D2R на реабсорбцию воды. Кроме того, результаты исследования позволяют прийти к выводу о стимулирующем эффекте D1R на транспорт натрия на фоне врожденного дефицита эндогенного ВП, тогда как влияние D2R, подавляющего уровень цАМФ, направлено на торможение реабсорбции натрия и не зависит от уровня ВП в крови и базальной активности цАМФ-системы.
Список литературы
Tamma G, Robben JH, Trimpert C, Boone M, Deen PM (2011) Regulation of AQP2 localization by S256 and S261 phosphorylation and ubiquitination. Am J Physiol Cell Physiol 300: 636–646. https://doi.org/10.1152/ajpcell.00433.2009. Epub 2010 Dec 9. PMID: 21148409
Bankir L, Bichet DG, Bouby N (2010) Vasopressin V2 receptors, ENaC, and sodium reabsorption: a risk factor for hypertension? Am J Physiol Renal Physiol 299(5): F917–F928. https://doi.org/10.1152/ajprenal.00413.2010
Leipziger J, Praetorius H (2020) Renal Autocrine and Paracrine Signaling: A Story of Self-protection. Physiol Rev 100(3): 1229–1289. https://doi.org/10.1152/physrev.00014.2019
Armando I, Villar VAM, Jose PA (2011) Dopamine and renal function and blood pressure regulation. Compr Physiol 1: 1075–1117. https://doi.org/10.1002/cphy.c100032
Cuevas S, Villar VA, Jose PA, Armando I (2013) Renal dopamine receptors, oxidative stres and hypertension. Int J Mol Sci 14: 17553–17572. https://doi.org/10.1089/ars.2020.8106
Olivares-Hernández A, Figuero-Pérez L, Cruz-Hernandez JJ, González Sarmiento R, Usategui-Martin R, Miramontes-González JP (2021) Dopamine Receptors and the Kidney: An Overview of Health- and Pharmacological-Targeted Implications. Biomolecules. 11(2): 254. https://doi.org/10.3390/biom11020254
Hussain T, Lokhandwala MF (2003) Renal dopamine receptors and hypertension. Exp Biol Med (Maywood) 228: 134–142. https://doi.org/10.1161/01.HYP.32.2.187
Zeng C, Armando I, Luo Y, Eisner GM, Felder RA, Jose PA (2008) Dysregulation of dopamine-dependent mechanisms as a determinant of hypertension: studies in dopamine receptor knockout mice. Am J Physiol Heart Circ Physiol 294: H551–H569.https://doi.org/10.1152/ajpheart.01036.2007
Agre P, King LS, Yasui M, Guggino WB, Ottersen OP, Fujiyoshi Y, Engel A, Nielsen S (2002) Aquaporin water channels – from atomic structure to clinical medicine. J Physiol 542: 3–16. https://doi.org/10.1113/jphysiol.2002.020818
Shonesy BC, Stepheson JR, Marks CR, Colbran RJ (2020) Cyclic AMP-dependent protein kinase and D1 dopamine receptors regulate diacylglycerol lipase- and synaptic 2-arachidonoyl glycerol signaling. J Neurochem 153: 334–345. https://doi.org/10.1111/jnc.14972
Holmes A, Lachowicz JE, Sibley DR (2004) Phenotypic analysis of dopamine receptor knockout mice; recent insights into the functional specificity of dopamine receptor subtypes. Neuropharmacology 47: 1117–1134. https://doi.org/10.1016/j.neuropharm.2004.07.034
Valtin H, Schroeder HA (1997) Familial hypothalamic diabetes insipidus in rats (Brattleboro rata). 1964 [classical article]. J Am Soc Nephrol 8: 1333–1341. https://doi.org/10.1681/ASN.V881333
Di Ciano LA, Azurmendi PJ, Colombero C, Levin G, Oddo EM, Arrizurieta EE, Nowicki S, Ibarra FR (2015) Defective renal dopamine function and sodium-sensitive hypertension in adult ovariectomized Wistar rats: role of the cytochrome P-450 pathway. Am J Physiol Renal Physiol 308(12): F1358-F1368. https://doi.org/10.1152/ajprenal.00450.2014
Del Compare JA, Aguirre JA, Ibarra FR, Barontini M, Armando I (2001) Effects of thyroid hormone on the renal dopaminergic system. Endocrine 15(3): 297–303. https://doi.org/10.1385/ENDO:15:3:297
Ibarra ME, Albertoni Borghese MF, Majowicz MP, Ortiz MC, Loidl F, Rey-Funes M, Di Ciano LA, Ibarra FR (2017) Concerted regulation of renal plasma flow and glomerular filtration rate by renal dopamine and NOS I in rats on high salt intake. Physiol Rep 5(6): e13202. https://doi.org/10.14814/phy2.13202
Gao DQ, Canessa LM, Mouradian MM, Jose PA (1994) Expression of the D2 subfamily of dopamine receptor genes in kidney. Am J Physiol Renal Physiol 266: 646–650. https://doi.org/10.1152/ajprenal.1994.266.4.F646
Luippold G, Schneider S, Stefanescu A, Benöhr P, Mühlbauer B (2001) Dopamine D2-like receptors and amino acid-induced glomerular hyperfiltration in humans. Br J Clin Pharmacol 51(5): 415–421. https://doi.org/10.1046/j.1365-2125.2001.01373.x
Shilling PD, Kinkead B, Murray T, Melendez G, Nemeroff CB, Feifel D (2006) Upregulation of striatal dopamine-2 receptors in Brattleboro rats with prepulse inhibition deficits. Biol Psychiatry 60(11): 1278–1281. https://doi.org/10.1016/j.biopsych.2006.03.045
Cilia J, Gartlon JE, Shilliam C, Dawson LA, Moore SH, Jones DN (2010) Further neurochemical and behavioural investigation of Brattleboro rats as a putative model of schizophrenia. J Psychopharmacol 24(3): 407–419. https://doi.org/10.1177/0269881108098787
Lokhandwala MF, Amenta F (1991) Anatomical distribution and function of dopamine receptors in the kidney. FASEB J 5(15): 3023-3030. https://doi.org/10.1096/fasebj.5.15.1683844
Ma F, Chen G, Rodriguez EL, Klein JD, Sands JM, Wang Y (2020) Adrenomedullin Inhibits Osmotic Water Permeability in Rat Inner Medullary Collecting Ducts. Cells 9(12): 2533. https://doi.org/10.3390/cells9122533
Lee SP, So CH, Rashid AJ, Varghese G, Cheng R, Lanca AJ, O’Dowd BF, George SR (2004) Dopamine D1 and D2 receptor Co-activation generates a novel phospholipase C-mediated calcium signal. J Biol Chem 279: 35671–35678. https://doi.org/10.1074/jbc.M401923200
Ohbu K, Felder RA (1991) DA1 dopamine receptors in renal cortical collecting duct. Am J Physiol 261: 890–895. https://doi.org/10.1152/ajprenal.1991.261.5.F890
Schen T, Suzuki Y, Poyard M, Miyamoto N., Defer N, Hanoune J. (1997) Expression of adenylyl cyclase mRNAs in the adult, in developing, and in the Brattleboro rat kidney. Am J Physiol Cell Physiol 273: 323–330. https://doi.org/10.1152/ajpcell.1997.273.1.C323
Beaulieu JM, Gainetdinov RR (2011) The physiology, signaling, and pharmacology of dopamine receptors. Pharmacol Rev 63: 182–217. https://doi.org/10.1124/pr.110.002642
Zeng C, Felder RA, Jose PA (2006) A new approach for treatment of hypertension: modifying D1 dopamine receptor function. Cardiovasc Hematol Agents Med Chem 4: 369–377. https://doi.org/10.2174/187152506778520727
Wang T, Weinbaum S, Weinstein AM (2017) Regulation of glomerulotubular balance: flow-activated proximal tubule function. Pflugers Arch 469(5–6): 643–654. https://doi.org/10.1007/s00424-017-1960-8
Smit AJ, Meijer S, Wesseling H, Donker AJ, Reitsma WD (1990) Dissociation of renal vasodilator and natriuretic effects of dopamine during sulpiride infusion in normal man. Eur J Clin Pharmacol 39(3): 221–226. https://doi.org/10.1007/BF00315100
Ozono R, Ueda A, Oishi Y, Yano A, Kambe M, Katsuki M, Oshima T (2003) Dopamine D2 receptor modulates sodium handling via local production of dopamine in the Kidney. J Cardiovasc Pharmacol 42: S75–S79. https://doi.org/10.1097/00005344-200312001-00017
Edwards RM, Brooks DP (2001) Dopamine inhibits vasopressin action in the rat inner medullary collecting duct via a2-adrenoceptors. J Pharmacol Exp Ther 298: 1001–1006.
Zhang MZ, Yao B, McKanna JA, Harris RC (2004) Cross talk between the intrarenal dopaminergic and cyclooxygenase-2 systems. Am J Physiol Renal Physiol 288(4): F840–F845. https://doi.org/10.1152/ajprenal.00240.2004
Kotnik P, Nielsen J, Kwon TH, Krzisnik C, Frøkiaer J, Nielsen S (2005) Altered expression of COX-1, COX-2, and mPGES in rats with nephrogenic and central diabetes insipidus. Am J Physiol Renal Physiol 288(5): F1053–F1068. https://doi.org/10.1152/ajprenal.00114.2004
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


