Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 7, стр. 917-930
Влияние плазменной кислоты на пролиферацию эндотелиальных клеток головного мозга крыс in vitro
Е. Д. Хилажева 1, Е. В. Лычковская 1, В. А. Кутяков 1, А. В. Моргун 1, В. В. Салмин 1, *
1 Красноярский государственный медицинский университет им. профессора В.Ф. Войно-Ясенецкого
Красноярск, Россия
* E-mail: vsalmin@gmail.com
Поступила в редакцию 07.02.2022
После доработки 14.06.2022
Принята к публикации 24.06.2022
- EDN: SXCQZA
- DOI: 10.31857/S0869813922070032
Аннотация
Пролиферативная активность клеток эндотелия церебральных микрососудов является объектом регуляции широкого спектра факторов: регуляторных молекул, токсических соединений, межклеточных взаимодействий. Гиперваскуляризация и развитие окислительного и нитрозативного стресса являются важными компонентами патогенеза хронической нейродегенерации. Активные формы кислорода и азота, помимо прямого повреждающего действия на клетки головного мозга, существенным образом влияют на пролиферативную активность и ангиогенный потенциал клеток церебрального эндотелия. В экспериментах in vitro, выполненных с использованием первичной культуры клеток церебрального эндотелия крыс, мы оценили пролиферативную активность эндотелиоцитов с помощью технологии “xCelligence”, предназначенной для анализа пролиферации клеток в режиме реального времени, в течение 24–72 ч. Источником активных форм кислорода и азота выступали водные растворы аммиака и тиоцианата, обработанные неравновесной плазмой. Указанные растворы добавлялись в питательную среду клеток в различных концентрациях. Нами впервые установлено, что присутствие активных форм кислорода и азота в составе плазменной кислоты подавляет пролиферацию клеток, вероятно, вследствие доминирования эффектов цитотоксического пероксинитрита и продуктов его взаимодействия с клеточными белками, а присутствие в растворе аммиака стимулирует пролиферацию клеток в дозозависимой манере. Присутствующий в свежеприготовленном растворе тиоцианат анион снижает ингибирующее действие плазменной кислоты на пролиферацию клеток эндотелия, однако при длительной инкубации плазменная кислота с роданидом натрия проявляет существенный цитотоксический потенциал. Суммируя наблюдения о модуляции цитотоксических эффектов плазменной кислоты в отношении клеток церебрального эндотелия в случае обработки воды неравновесной плазмой в присутствии аммиака и тиоцианата, можно предположить участие окислительного и нитрозативного стресса в изученных нами процессах.
Окислительный и нитрозативный стрессы играют существенную роль в патогенезе нейродегенерации [1, 2]. Основными процессами, приводящими к развитию окислительного и нитрозативного стресса, выступают дисфункция митохондрий, активация НАДФН-оксидаз, генерация продуктов каталитической конверсии жирных кислот вследствие повреждения клеток и развития нейровоспаления [3, 4]. Менее изучена роль окислительного и нитрозативного стресса в нарушении целостности гематоэнцефалического барьера (ГЭБ) и повреждении клеток эндотелия церебральных микрососудов, однако известно, что эти события вносят вклад в развитие патологической проницаемости ГЭБ, что может быть сопряжено с развитием феномена гиперваскуляризации (избыточного неоангиогенеза) в ткани головного мозга [2, 5–7]. В связи с этим эндотелиоциты церебральных микрососудов, характеризующиеся специфическими свойствами, отличающими их от клеток эндотелия других тканей (в частности присутствием в церебральном эндотелии большего количества митохондрий), являются интересным объектом для изучения механизмов нейродегенерации и повреждения ГЭБ, ассоциированных с действием широкого спектра соединений, образующихся в клетках при окислительном и нитрозативном стрессе [8]. Примечательно, что окислительный стресс чаще рассматривается в качестве индуктора пролиферативной активности клеток эндотелия [9], а молекулы с проангиогенной активностью, в частности сосудисто-эндотелиальный фактор роста VEGF, индуцируют гиперактивацию НАДФН-оксидазы и генерацию активных форм кислорода (АФК) [9]. В то же время, накопление в клетках нитротирозина как продукта нитрозативного повреждения белков подавляет ангиогенез [10]. Кроме того, церебральный эндотелий является мишенью действия для другого соединения – аммиака, который в условиях in vivo образуется в процессе химических превращений свободных аминокислот [11], причем действие аммиака может сопровождаться увеличением продукции моноксида азота, коль скоро аммиак способен индуцировать экспрессию NO-синтазы и развитие нитрозативного стресса, например, в астроцитах [12]. Однако информация о механизмах действия аммиака в условиях окислительного и нитрозативного стресса в литературе отсутствует.
Изучение механизмов окислительного и нитрозативного повреждения клеток, как правило, базируется на применении химических соединений, обладающих способностью генерировать АФК или азота, либо индуцировать их образование в клетках-мишенях [7]. Не менее интересным может быть подход, основанный на использовании in vitro соединений, формирующихся при действии неравновесной плазмы на водные растворы, значительная часть которых представлена АФК и азота [13]. К низкомолекулярным активным формам азота (АФА) можно отнести оксид азота (NO), диоксид азота (NO2), оксидонитрит (ONOO–), нитроксил-анион (NO–) и протонированную форму оксидо-нитрита – пероксиазотистую кислоту (HOONO) [14]. Перечисленные АФА могут быть получены в физиологически значимых концентрациях в результате облучения газоразрядной плазмой в атмосферном воздухе воды и водных растворов [15]. Наряду с перечисленными АФА в результате химических преобразований с формирующимися АФК – (HO2/${\text{O}}_{2}^{ - }$), (OH), (H2O2) – происходит постепенное накопление стабильных нитрит- и нитрат-анионов и, как следствие, снижение pH раствора. Поэтому вода, обработанная таким образом, получила название “плазменная кислота” [16, 17]. Состав плазменной кислоты изучен в ряде работ [18–21].
В настоящее время ведутся интенсивные исследования соединений, восстанавливающих функцию эндотелия. В этом контексте перспективными следует считать неорганические тиоцианаты Me(SCN)x [22], функционирующие в качестве антиоксидантов и ингибиторов апоптоза [23]. Однако информации о механизмах действия тиоцианат-аниона на клетки церебрального эндотелия в условиях окислительного и нитрозативного стресса фактически нет.
Целью работы явилось изучение влияния плазменной кислоты на пролиферативную активность церебральных эндотелиоцитов in vitro в присутствии аммиака и тиоцианат-аниона.
МЕТОДЫ ИССЛЕДОВАНИЯ
Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, проводились с соблюдением принципов гуманности, изложенных в Директиве Европейского сообщества (2010/63/ЕС) и в приказе Минздрава России № 267 от 19.06.2003 г. “Об утверждении правил лабораторной практики в Российской Федерации”, рекомендациях биоэтической комиссии по работе с лабораторными животными при локальном этическом комитете и локальным этическим комитетом Красноярского государственного медицинского университета.
Обработка водных растворов объемом 5 мл производилась плазмой искрового разряда в негерметично закрытом стеклянном стаканчике емкостью 50 мл и диаметром 30 мм. Расстояние от искрового канала до поверхности раствора составляло 20 мм. Электроды были выполнены из нержавеющей стали. Межэлектродное расстояние составляло 15 мм. Частота следования импульсов составляла 10 Гц. Для обработки растворов использовалась экспозиция 105 импульсов. Для формирования искрового разряда мы применяли униполярный наносекундный высоковольтный генератор импульсов с напряжением 40 кВ, длительностью импульса 50 нс и энергией 0.2 Дж, описанный нами ранее [24]. Обработка производилась в атмосферном воздухе при комнатной температуре, термостабилизация не производилась. Во всех экспериментах использовался режим обработки 200 000 импульсами искрового разряда. Для обработки плазмой искрового разряда мы использовали следующие растворы:
1. Вода для инъекций. До обработки pH 6.9, после обработки 200 000 импульсами искрового разряда pH 1.3.
2. Раствор аммиака 0.11 М (вода для инъекций 5 мл + 100 мкл раствора NH3 с массовой долей 10%). До обработки pH 11.0, после обработки 200 000 импульсами искрового разряда pH 4.6.
3. Раствор роданида натрия (1 мМ раствор NaSCN). До обработки pH 6.8, после обработки 200 000 импульсами искрового разряда pH 1.2.
Для приготовления растворов использовали следующие компоненты: вода для инъекций буфус 5 мл, Реневал ПФК (Россия), аммиак 10%-ный раствор для наружного применения и ингаляций, Ивановская фармацевтическая фабрика (Россия), натрия тиоцианат, 99% химически чистый (х. ч.) ГОСТ 10643-75, (Россия).
После обработки искровым разрядом производились определение pH раствора с помощью pH-метра “Анион 4100” (Инфраспа-Аналит, Россия) и запись спектра поглощения в области 200–450 нм с помощью спектрометра СМ2203 (Солар, Беларусь). Полученные при действии искрового разряда растворы использовались для обработки культуральных сред в различных концентрациях. Методом спектрофотометрии обработанного плазмой искрового разряда воды для инъекций определено присутствие, нитрит- и нитрат-анионов по характерным пикам поглощения на 350 и 300 нм соответственно и близко расположенных пиков поглощения на 210 и 205 нм [25]. Наличие указанных анионов обеспечивало приобретение водой низких значений рН. Наличие указанных анионов в растворе также проверялось с использованием системы капиллярного электрофореза Капель-105 (ЛЮМЭКС, Санкт-Петербург). Поскольку при увеличении времени обработки искровым разрядом происходит постепенное накопление указанных анионов [19–21], то контроль качества плазменной кислоты проводился по уровню достигнутого pH.
Источником эндотелиоцитов служили крысы 10-дневного возраста линии Вистар. Выделение и культивирование клеток производили по модифицированному протоколу [26]. Модификация заключалась в замене бычьего сывороточного альбумина (BSA) на фетальную бычью сыворотку (FBS) в равных по белку концентрациях. После декапитации животных у них извлекали головной мозг, удаляли оболочки и крупные поверхностные сосуды. Отделяли кору головного мозга и нарезали на кусочки 1 мм3, после чего центрифугировали в течение 3 мин при 150 g. После удаления супернатанта к осадку добавляли 25%-ный FBS, проводили тритурацию и центрифугировали 10 мин при 600 g. Удаляли супернатант и повторяли процедуру с добавлением 25%-ного FBS, тритурированием и центрифугированием. Осадок собирали и добавляли 1 мл 0.1%-ного раствора коллагеназы II. Ферментативная обработка длилась 35 мин при 37°С в условиях СО2-инкубатора (5% СО2) с периодическим перемешиванием. После обработки ферментами к суспензии добавляли двойной объем питательной среды, ресуспензировали и центрифугировали осадок при 150 g в течение 5 мин. Культивирование полученных отдельных эндотелиоцитов и фрагментов сосудов осуществлялось в условиях CO2-инкубатора (Binder, Германия) при 37оС, 5% CO2 в культуральных флаконах, предварительно покрытых желатином (Gelatin Solution 0.1%. Biological Industries, США) в среде DMEM (ПанЭко, Россия) с добавлением 20% эмбриональной телячьей сыворотки (HyClone, США), 2 мМ глутамина (ПанЭко, Россия), 100 Ед/мл пенициллина и 100 мг/мл стрептомицина (ПанЭко, Россия). Смену среды осуществляли каждые три дня. При достижении 90%-ной конфлюентности среду удаляли, клетки во флаконе промывали дважды раствором Хенкса (ПанЭко, Россия) и обрабатывали раствором 0.25%-ного раствора трипсина и ЭДТА (ПанЭко, Россия).
Для непрерывного мониторинга пролиферации in vitro эндотелиоциты переносились в 16-луночные планшеты клеточного анализатора “xCelligence” (Roche, Швейцария). В лунки планшета сначала вносилась культуральная среда в обьеме 50 мкл и регистрировался нулевой (базальный) уровень. Затем в лунки планшета добавляли по 50 мкл суспензии клеток с количеством 30 000 клеток в каждой лунке. В лунки также добавлялось 100 мкл культуральной среды с внесенным в различных концентрациях обработанного плазмой раствором. В контрольную лунку добавлялась культуральная среда (общий объем в лунке составлял 200 мкл). Для каждого варианта “плазменной кислоты” засевали по три одинаковых лунки с клетками.
В качестве контроля также использовалась культуральная среда без клеток. Инкубация проводилась в условиях CO2-инкубатора при 5% CO2 и температуре 37°C. Регистрация осуществлялась с использованием анализатора “xCelligence” , предназначенного для анализа пролиферации клеток в режиме реального времени [27], в течение 24–72 ч. Электроды в лунках планшетов xCelligence регистрируют изменения сопротивления, вызванные присутствием клеток, а специализированное программное обеспечение рассчитывает показатель клеточного индекса (С). Клеточный индекс является импеданс-зависимым и определяется количеством и размерами клеток.
Для статистической обработки использовались методы описательной статистики и метод непараметрической корреляции Спирмена в пакете Statsoft Statistica.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
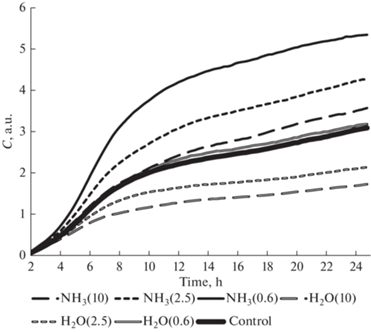
Усредненные кривые клеточного индекса для различных составов и объемов добавок к питательным средам представлены на диаграмме (рис. 1). Как видно из представленных графиков, динамика экспоненциального роста клеток церебрального эндотелия сменяется линейным ростом после 8–10 ч. Клеточный индекс существенно зависит не только от состава “плазменного раствора”, но и от его конечной концентрации.
Рис. 1.
Усредненные кривые зависимости клеточного индекса от времени для церебральных эндотелиоцитов, инкубируемых в средах, содержащих обработанные плазмой искрового разряда растворы. Здесь и далее указаны значения объема плазменной кислоты, внесенного в лунку планшета в мкл.
Для сравнительной оценки ингибирования/стимулирования пролиферативной активности мы использовали нормированный разностный клеточный индекс dСi, который вычислялся по следующей формуле
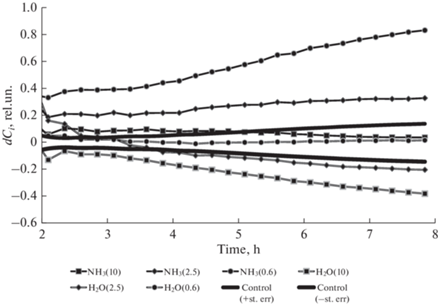
где ci – средний клеточный индекс i-того раствора, c0 – средний клеточный индекс контрольной группы.Как видно из представленных диаграмм (рис. 2), на стадии линейного роста клеточного индекса (T > 10 ч) достигается стационарная фаза для нормированного разностного клеточного индекса dСi, что позволяет оценивать ингибирование/стимулирование пролиферативной активности путем сравнения их линейных фаз сравнением средних.
Рис. 2.
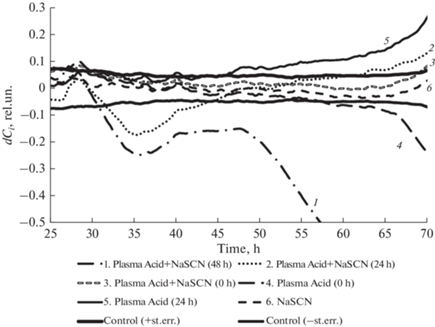
Нормированный разностный клеточный индекс для различных условий инкубации клеток церебрального эндотелия. Значимые изменения достигаются при превышении амплитуды отклонения коридора ошибки среднего для контрольного раствора.
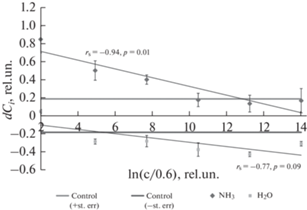
Как видно из представленных диаграмм (рис. 3), при использовании растворов на основе аммиака при низких концентрациях имеет место существенная стимуляция пролиферативной активности, в то время как использование дистиллированной воды, обработанной искровым разрядом, однозначно ингибирует пролиферативную активность эндотелиоцитов. С ростом концентрации пролиферативная активность снижается дозозависимым образом. Высокая значимая отрицательная корреляция Спирмена rs = –0.94, p = 0.01 имеет место для плазменной кислоты, содержащей аммиак. Для имеющегося набора данных для чистой плазменной кислоты корреляция Спирмена не достигла уровня значимой rs = –0.77, p = 0.09. Необходимо отметить, что несмотря на изменение pH “плазменных растворов”, вызванного образованием азотной кислоты за счет искрового разряда, добавление ее в питательную среду в невысоких концентрациях не приводило к значимому изменению рН конечного раствора за счет буферных свойств (согласно технической информации производителя, буферная емкость культуральной среды DMEM составляет не менее 10.5 мл) Δ pH < 0.01, и не обнаруживалось в наших экспериментах.
Рис. 3.
Зависимость нормированного разностного клеточного индекса церебральных эндотелиоцитов линейной фазы от логарифма объема плазменной кислоты, внесенного в лунку, нормированного на минимальное значение (0.6 мкл) и состава раствора.
Второй параметр, оцениваемый в наших экспериментах – это время достижения максимальной скорости роста клеточного индекса. Для этого мы проанализировали экспоненциальную фазу. В указанной фазе строились диаграммы скорости роста клеточного индекса dC/dT – производная от клеточного индекса (рис. 4).
Рис. 4.
Скорость роста клеточного индекса церебральных эндотелиоцитов для различных составов плазменной кислоты.
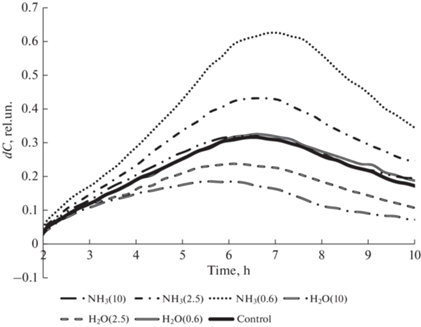
Диаграмма зависимостей времени наступления максимальной скорости роста от логарифма концентрации демонстрирует дозозависимый характер только для плазменной кислоты без аммиака (рис. 5).
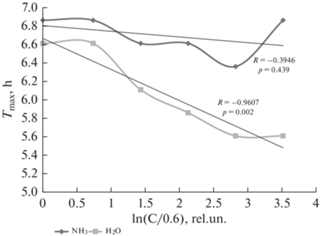
Рис. 5.
Зависимость времени достижения максимума скорости роста клеточного индекса церебральных эндотелиоцитов от состава и концентрации раствора плазменной кислоты.
Далее мы оценивали влияние плазменной кислоты на основе растворов роданида натрия. Усредненные кривые клеточного индекса по группам клеток, культивируемых в одинаковых по составу питательных средах, представлены на диаграмме (рис. 6).
Рис. 6.
Усредненные кривые динамики клеточного индекса для эндотелиоцитов, инкубируемых в средах, содержащих обработанные плазмой искрового разряда растворы.
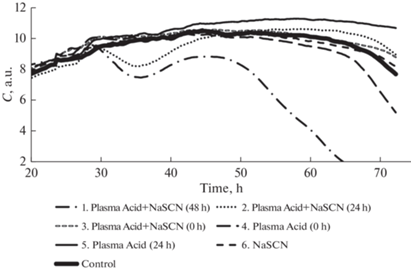
На стадии стационарной фазы (T = 24 ч) мы добавляли в питательную среду плазменную кислоту в одинаковом объеме каждого раствора 10 мкл и оценивали в дальнейшем нормированный разностный клеточный индекс dСi (рис. 7). Были использованы растворы плазменной кислоты с различным временем после ее приготовления, давая возможность протеканию в ней окислительно-восстановительных реакций. На рис. 6 и 7 время после обработки указано в часах.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что в составе плазменной кислоты, полученной при обработке растворов неравновесной плазмой, регистрируется присутствие ряда соединений: нитриты, нитраты, пероксинитрит, пероксид водорода и др. [18–21]. Мы обнаружили, что в зависимости от состава активированной плазмой воды могут быть получены эффекты стимуляции и подавления пролиферативной активности клеток церебрального эндотелия in vitro, которые носят дозозависимый характер и проявляются как в экспоненциальной (начальной стадии деления), так и линейной фазе. Преобладание азотосодержащих соединений при добавлении аммиака приводит к эффектам стимуляции пролиферации, выражающимся в увеличении амплитуды линейной фазы. Преобладание АФК и АФА в плазменной кислоте, полученной на основе дистиллированной воды, демонстрирует ингибирование пролиферации клеток как по амплитуде линейной фазы, так и по более раннему достижению максимальной скорости роста в экспоненциальной фазе (увеличивается отрицательное ускорение – торможение).
Двунаправленый характер действия неравновесной плазмы скользящего разряда на эндотелиоциты был продемонстрирован нами ранее методом иммуногистохимии с регистрацией экспрессии Ki67 как маркера пролиферации [24]: при действии малых концентраций регистрировалась стимуляция, при действии больших – ингибирование пролиферации клеток церебрального эндотелия. Возможным ключевым медиатором этих эффектов является образующийся оксид азота NO, известный как модулятор пролиферации, ареста клеточного цикла и апоптоза [28]. При использовании неравновесной плазмы в парах аммиака для предварительной обработки поверхности культуральных ячеек наблюдали стимуляцию пролиферации эндотелиоцитов [29]. Сигнальная роль аммиака сопряжена с продукцией монооксида азота [12], а введение аммиака позволяет улучшить выживаемость эндотелиоцитов за счет увеличения экспрессии гемоксигеназы HO1 с последующим ростом продукции моноксида углерода CO [30]. Повышенная экспрессия нейрональной синтазы оксида азота (nNOS) и индуцибельной фракции фермента iNOS наблюдалась в стриатуме портокавальных шунтированных крыс с моделью хронической гипераммониемии [11]. Повышалась экспрессия индуцибельной синтазы оксида азота (iNOS) в культивируемых астроцитах под действием аммиака в патофизиологически релевантных концентрациях [31]. Мы предполагаем, что несмотря на разные механизмы регуляции активности индуцибельной и конститутивной изоформ синтазы оксида азота [32], интересным было бы в дальнейшем протестировать гипотезу об аммиак-индуцируемой гиперпродукции оксида азота клетками церебрального эндотелия и вызванной этими событиями стимуляции пролиферации. Примечательно, что eNOS играет доминирующую роль в индуцированном сосудисто-эндотелиальным фактором роста VEGF ангиогенезе и повышении проницаемости сосудов [33], поэтому механизмы участия этого фермента в регуляции пролиферативного статуса клеток церебрального эндотелия при гипераммониемии заслуживают внимания. Кроме того, возможную роль аммиака в развитии хронической нейродегенерации в последние годы стали все более связывать с его повреждающим действием на ГЭБ [34] и цитотоксическим эффектом, ассоциированным с развитием митохондриальной дисфункции [35]. Клетки церебрального эндотелия, имеющие много митохондрий, являются в этой связи очевидной мишенью для токсического действия аккумулирующегося при нейродегенерации в ткани головного мозга аммиака, который, как показали наши результаты, способен индуцировать пролиферативную активность эндотелиоцитов. Коль скоро характерный для хронической нейродегенерации избыточный церебральный неоангиогенез сопряжен с образованием сосудов с высокой проницаемостью эндотелиального слоя [36, 37], вклад аммиака в прогрессирование нейровоспаления при нейродегенерации является весьма вероятным.
Обращает на себя внимание высокая цитотоксичность плазменной кислоты с роданидом натрия после его длительного отстаивания перед внесением в питательную среду, увеличивающаяся со временем. Вероятной причиной такого поведения может быть образование цианидов в результате окисления тиоцианат-аниона активными формами кислорода и азота плазменной кислоты [38]. Как и в предыдущем цикле экспериментов, внесение свежей плазменной кислоты без добавок приводило к ингибирующему пролиферацию эффекту.
Наиболее вероятным кандидатом из соединений в составе плазменной кислоты на проявление окислительных свойств, необходимых для подавления пролиферативной активности, выступает пероксинитрит ONOO– [15], тогда как формирующиеся через 24 ч стабильные нитриты и нитраты, наоборот, стимулируют пролиферацию. Вместе с тем, нитротирозин, образующийся в результате действия пероксинитрита на клеточные белки, подавляет ангиогенную активность [10], поэтому логично предположить, что наблюдаемое нами антипролиферативное действие плазменной кислоты является следствием аккумуляции в клетках нитротирозина. В то же время следует отметить, что пероксинитрит обладает проангиогенной активностью в отношении клеток церебрального эндотелия и антиангиогенной активностью в отношении эндотелиоцитов периферических тканей [39], поэтому механизмы про- и антиангиогенной активности плазменной кислоты в отношении клеток церебрального эндотелия могут носить более комплексный характер и определяться присутствием в ее составе широкого спектра соединений.
Интересно, что внесение необработанного плазмой раствора роданида не влияло на рост популяции эндотелиоцитов и, более того, свежий раствор плазменной кислоты с роданидом натрия также не влиял на пролиферацию клеток. Можно предположить, что раствор роданида выступает тушителем АФК и АФА [40, 41], а не только проявляет антиоксидантные свойства, как это было показано ранее в присутствии миелопероксидазы, конкурентно ингибируя образование опасного гипохлорита [42, 43]. Такой механизм позволяет предполагать наличие противовоспалительного эффекта тиоцианата, реализуемого в системе с участием клеток эндотелия и лейкоцитов, но это требует дополнительных экспериментальных исследований.
Суммируя наблюдения о модуляции цитотоксических эффектов плазменной кислоты в отношении клеток церебрального эндотелия в случае обработки воды неравновесной плазмой в присутствии аммиака и тиоцианата, можно предположить участие окислительного и нитрозативного стресса в изученных нами процессах.
Список литературы
Barnham KJ, Masters CL, Bush AI (2004) Neurodegenerative diseases and oxidative stress. Nat Rev Drug Discov 3: 205–214. https://doi.org/10.1038/nrd1330
Enciu A-M, Gherghiceanu M, Popescu BO (2013) Triggers and effectors of oxidative stress at blood-brain barrier level: relevance for brain ageing and neurodegeneration. Oxidat MedCell Longev 2013: 1–12. https://doi.org/10.1155/2013/297512
Kim GH, Kim JE, Rhie SJ, Yoon S (2015) The role of oxidative stress in neurodegenerative diseases. Exp Neurobiol 24: 325. https://dx.doi.org/10.5607%2Fen.2015.24.4.325
Cobb CA, Cole MP (2015) Oxidative and nitrative stress in neurodegeneration. Neurobiol Disease 84: 4–21. https://dx.doi.org/10.1016%2Fj.nbd.2015.04.020
Zlokovic BV (2008) The blood-brain barrier in health and chronic neurodegenerative disorders. Neuron 57: 178–201. https://doi.org/10.1016/j.neuron.2008.01.003
Song K, Li Y, Zhang H, An N, Wei Y, Wang L, Tian C, Yuan M, Sun Y, Xing Y (2020) Oxidative stress-mediated blood-brain barrier (BBB) disruption in neurological diseases. Oxidat Med Cell Longev 2020: 1–27. https://doi.org/10.1155/2020/4356386
Nazari QA, Mizuno K, Kume T, Takada-Takatori Y, Izumi Y, Akaike A (2012) In vivo brain oxidative stress model induced by microinjection of sodium nitroprusside in mice. J Pharmacol Sci 120: 105–111. https://doi.org/10.1254/jphs.12143fp
Salmina AB, Kharitonova EV, Gorina YV, Teplyashina EA, Malinovskaya NA, Khilazheva ED, Mosyagina AI, Morgun AV, Shuvaev AN, Salmin VV (2021) Blood–brain barrier and neurovascular unit in vitro models for studying mitochondria-driven molecular mechanisms of neurodegeneration. Int J Mol Sci 22: 4661. https://doi.org/10.3390/ijms22094661
Kim Y-W, Byzova TV (2014) Oxidative stress in angiogenesis and vascular disease. Blood, J Am Soc Hematol 123: 625–631. https://doi.org/10.1182/blood-2013-09-512749
Teng R-J, Wu T-J, Bisig CG, Eis A, Pritchard KA, Konduri GG (2011) Nitrotyrosine impairs angiogenesis and uncouples eNOS activity of pulmonary artery endothelial cells isolated from developing sheep lungs. Pediatr Res 69: 112–117. https://doi.org/10.1203/PDR.0b013e318204dcb8
Suárez I, Bodega G, Rubio M, Fernández B (2009) Induction of NOS and nitrotyrosine expression in the rat striatum following experimental hepatic encephalopathy. Metabol Brain Disease 24: 395–408. https://doi.org/10.1007/s11011-009-9154-5
Wang R (2014) Gasotransmitters: growing pains and joys. Trends Biochem Sci 39: 227–232. https://doi.org/10.1016/j.tibs.2014.03.003
Thi M-HN, Shao P-L, Liao J-D, Lin C-CK, Yip H-K (2014) Enhancement of Angiogenesis and Epithelialization Processes in Mice with Burn Wounds through ROS/RNS Signals Generated by NonThermal N2/Ar Micro-Plasma. Plasma Processes and Polymers 11: 1076–1088. https://doi.org/10.1002/ppap.201400072
Владимиров ЮА, Проскурнина ЕВ (2015) Свободные радикалы как участники регуляторных и патологических процессов. Фундаментальные науки–медицине. Биофиз. мед. технол. М. МАКС Пресс. [Vladimirov YuA, Proskurnina YeV (2015) Svobodnyye radikaly kak uchastniki regulyatornykh i patologicheskikh protsessov. Fundamental’nyye nauki–meditsine. Biofiz Med Tekhnol. M. MAKS Press. (In Russ)].
Пискарев ИМ (2016) Образование долгоживущих активных продуктов под действием излучения плазмы искрового разряда. Химия высоких энергий 50: 449–450. [Piskarev I (2016) Obrazovaniye dolgozhivushchikh aktivnykh produktov pod deystviyem izlucheniya plazmy iskrovogo razryada. Khimiya vysokikh energiy 50: 449–450. (In Russ)].
Иванова ИП, Трофимова СВ, Аристова НА, Архипова ЕВ, Бурхина ОЕ, Сысоева ВА, Пискарев ИМ (2012) Анализ активных продуктов излучения плазмы искрового разряда, определяющих биологические эффекты в клетках. Соврем технол в мед 2012: 20–30. [Ivanova IP, Trofimova SV, Aristova NA, Arkhipova EV, Burkhina OE, Sysoeva VA, Piskarev IM (2012) Analysis of active products of spark discharge plasma radiation that determine biological effects in cells. Modern Technol Med 2012: 20–30. (In Russ)].
Иванова ИП, Трофимова СВ, Пискарев ИМ, Ичеткина АА, Бурхина ОЕ, Сысоева ВА (2013) Влияние излучения плазмы искрового разряда на модификацию белков и липидов. Фундамент исследов 3: 572–575. [Ivanova IP, Trofimova SV, Piskarev IM, Ichetkina AA, Burkhina OE, Sysoeva VA (2013) Effect of spark discharge plasma radiation on the modification of proteins and lipids. Basic Res 3: 572–575. (In Russ)].
Ivanova IP, Trofimova SV, Burkhina OE, Piskarev IM (2015) Peroxynitrite complex production under pulsed spark gas-discharge plasma radiation in air. Res J Pharmac Biol Chem Sci 6: 1205–1219.
Piskarev I, Ivanova I, Trofimova S (2013) Chemical effects of self-sustained spark discharge: Simulation of processes in a liquid. High Energy Chem 47: 62–66. https://doi.org/10.1134/S0018143913020082
Piskarev I, Ivanova I, Trofimova S (2013) Comparison of chemical effects of UV radiation from spark discharge in air and a low-pressure mercury lamp. High Energy Chem 47: 247–250. https://doi.org/10.1134/S0018143913050093
Piskarev I, Ivanova I, Trofimova S, Aristova N (2012) Formation of active species in spark discharge and their possible use. High Energy Chem 46: 343–348. https://doi.org/10.1134/S0018143912050050
Zietzer A, Niepmann ST, Camara B, Lenart MA, Jansen F, Becher MU, Andrié R, Nickenig G, T-iyerili V (2019) Sodium thiocyanate treatment attenuates atherosclerotic plaque formation and improves endothelial regeneration in mice. PloS one 14: e0214476. https://doi.org/10.1371/journal.pone.0214476
Bozonet SM, Scott-Thomas AP, Nagy P, Vissers MC (2010) Hypothiocyanous acid is a potent inhibitor of apoptosis and caspase 3 activation in endothelial cells. Free Radic Biol Med 49: 1054–1063. https://doi.org/10.1016/j.freeradbiomed.2010.06.028
Muradyan G, Gudkova E, Khilazheva E, Morgun A, Malinovskaya N, Salmina A, Salmin V (2021) Effect of sliding discharge on proliferation and death of brain microvessel endothelial cells in vitro. Biomed Chem 67: 150–157. https://doi.org/10.18097/pbmc20216702150
Mack J, Bolton JR (1999) Photochemistry of nitrite and nitrate in aqueous solution: a review. J Photochem Photobiol A: Chemistry 128: 1–13. https://doi.org/10.1016/S1010-6030(99)00155-0
Liu Y, Xue Q, Tang Q, Hou M, Qi H, Chen G, Chen W, Zhang J, Chen Y, Xu X (2013) A simple method for isolating and culturing the rat brain microvascular endothelial cells. Microvasc Res 90: 199–205. https://doi.org/10.1016/j.mvr.2013.08.004
Guan N, Deng J, Li T, Xu X, Irelan JT, Wang M-W (2013) Label-free monitoring of T cell activation by the impedance-based xCELLigence system. Mol Biosystems 9: 1035–1043. https://doi.org/10.1039/c3mb25421f
Napoli C, Paolisso G, Casamassimi A, Al-Omran M, Barbieri M, Sommese L, Infante T, Ignarro LJ (2013) Effects of nitric oxide on cell proliferation: novel insights. J Am College Cardiol 62: 89–95. https://doi.org/10.1016/j.jacc.2013.03.070
Kleinhans C, Barz J, Wurster S, Willig M, Oehr C, Müller M, Walles H, Hirth T, Kluger PJ (2013) Ammonia plasma treatment of polystyrene surfaces enhances proliferation of primary human mesenchymal stem cells and human endothelial cells. Biotechnol J 8: 327–337. https://doi.org/10.1002/biot.201200210
Durante W, Liu Xm, Peyton KJ (2017) Ammonia Promotes Endothelial Cell Survival via the Heme Oxygenase-1-mediated Release of Carbon Monoxide. The FASEB J 31: 689.2. https://doi.org/10.1016/j.freeradbiomed.2016.11.029
Häussinger D, Görg B, Reinehr R, Schliess F (2005) Protein tyrosine nitration in hyperammonemia and hepatic encephalopathy. Metabol Brain Disease 20: 285–294. https://doi.org/10.1007/s11011-005-7908-2
Forstermann U, Münzel T (2006) Endothelial nitric oxide synthase in vascular disease: from marvel to menace. Circulation 113: 1708–1714. https://doi.org/10.1161/circulationaha.105.602532
Fukumura D, Gohongi T, Kadambi A, Izumi Y, Ang J, Yun C-O, Buerk DG, Huang PL, Jain RK (2001) Predominant role of endothelial nitric oxide synthase in vascular endothelial growth factor-induced angiogenesis and vascular permeability. Proc Natl Acad Sci U S A 98: 2604–2609. https://doi.org/10.1073/pnas.041359198
Jo D, Kim BC, Cho KA, Song J (2021) The Cerebral Effect of Ammonia in Brain Aging: Blood–Brain Barrier Breakdown, Mitochondrial Dysfunction, and Neuroinflammation. J Clin Med 10: 2773. https://doi.org/10.3390/jcm10132773
Adlimoghaddam A, Sabbir MG, Albensi BC (2016) Ammonia as a potential neurotoxic factor in Alzheimer’s disease. Front Mol Neurosci 9: 57. https://doi.org/10.3389/fnmol.2016.00057
Rigau V, Morin M, Rousset M-C, De Bock F, Lebrun A, Coubes P, Picot M-C, Baldy-Moulinier M, Bockaert J, Crespel A (2007) Angiogenesis is associated with blood–brain barrier permeability in temporal lobe epilepsy. Brain 130: 1942–1956. https://doi.org/10.1093/brain/awm118
Biron KE, Dickstein DL, Gopaul R, Jefferies WA (2011) Amyloid triggers extensive cerebral angiogenesis causing blood brain barrier permeability and hypervascularity in Alzheimer’s disease. PloS One 6: e23789. https://doi.org/10.1371/journal.pone.0023789
Jones E, Munkley CG, Phillips ED, Stedman G (1996) Kinetics and equilibria in the nitric acid–nitrous acid–sodium thiocyanate system. J Chem Soc, Dalton Transact 1915–1920. https://doi.org/10.1039/DT9960001915
Prakash R, Somanath PR, El-Remessy AB, Kelly-Cobbs A, Stern JE, Dore-Duffy P, Johnson M, Fagan SC, Ergul A (2012) Enhanced cerebral but not peripheral angiogenesis in the Goto-Kakizaki model of type 2 diabetes involves VEGF and peroxynitrite signaling. Diabetes 61: 1533–1542. https://doi.org/10.2337/db11-1528
Buxton GV, Stuart CR (1995) Re-evaluation of the thiocyanate dosimeter for pulse radiolysis. J Chem Soc, Faraday Transact 91: 279–281. https://doi.org/10.1039/FT9959100279
Aune TM, Thomas EL (1977) Accumulation of hypothiocyanite ion during peroxidase-catalyzed oxidation of thiocyanate ion. Eur J Biochem 80: 209–214. https://doi.org/10.1111/j.1432-1033.1977.tb11873.x
Chandler JD, Day BJ (2012) Thiocyanate: a potentially useful therapeutic agent with host defense and antioxidant properties. Biochem Pharmacol 84: 1381–1387. https://doi.org/10.1016/j.bcp.2012.07.029
Xu Y, Szép S, Lu Z (2009) The antioxidant role of thiocyanate in the pathogenesis of cystic fibrosis and other inflammation-related diseases. Proc Natl AcadSci U S A 106: 20515–20519. https://doi.org/10.1073/pnas.0911412106
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова