Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 7, стр. 903-916
ЛПС стимулирует аккумуляцию триацилглицеринов и формирование липидных телец в клетках нейрональной линии РС12: роль даун-регуляции карнитин-пальмитоилтрансферазы-1 и снижения окисления жирных кислот
С. Д. Николаева 1, Е. М. Фок 1, Р. Г. Парнова 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: rimma_parnova@mail.ru
Поступила в редакцию 24.05.2022
После доработки 15.06.2022
Принята к публикации 15.06.2022
- EDN: FYSCYW
- DOI: 10.31857/S086981392207007X
Аннотация
Хорошо известно, что воспаление и окислительный стресс в различных типах клеток вызывают образование липидных телец (ЛТ), в которых депонируются жирные кислоты в составе триацилглицеринов (ТАГ) и/или эфиров холестерина. Этот метаболический сдвиг имеет значение для защиты клеток от токсикации избытком липидов или их окисленных производных, образующихся при различных типах стрессорных воздействий, включая окислительный стресс. Эффект бактериального ЛПС на формирование ЛТ в структурах ЦНС был исследован, главным образом, на клетках микроглии, однако его влияние на липидный метаболизм нейрональных клеток, потенциально ассоциированный с формированием ЛТ, не исследовано ни на клеточных линиях, ни на первичной культуре нейронов. Задачей данной работы, объектом которой служила нейрональная линия клеток РС12, широко используемая в исследованиях механизмов нейровоспаления и нейродегенерации, послужило изучение влияния ЛПС на формирование ЛТ, аккумуляцию нейтральных липидов, метаболизм основных липидных классов и выяснение возможного механизма, опосредующего данные эффекты. Инкубация клеток РС12 с ЛПС в течение 24 ч приводила к значительному накоплению ЛТ и увеличению содержания ТАГ. Этомоксир, ингибитор карнитин-пальмитоилтрансферазы 1 (СРТ1), также приводил к увеличению абсолютного количества ТАГ. Для выяснения метаболических путей накопления TAГ, клетки PC12 прединкубировали с [3H]-олеиновой кислотой, а затем исследовали включение радиоактивной метки в основные классы липидов. ЛПС вызывал повышение радиоактивности ТАГ и свободной олеиновой кислоты, сопровождающееся значительным торможением ее окисления и снижением радиоактивности в фосфолипидах. Инкубация клеток с ЛПС приводила к снижению экспрессии СРТ1. Полученные данные свидетельствуют о том, что в клетках РС12 ЛПС вызывает снижение окисления жирных кислот, уменьшение экспрессии СРТ1, ключевого фермента переноса жирных кислот в митохондрии, что приводит к секвестрации избыточных жирных кислот в TAГ и формированию ЛТ. Подобный механизм в условиях действия бактериального патогена является, по всей вероятности, стратегией выживания клетки, защищающий ее от липотоксичности.
За последнее время наши представления о действии бактериального липополисахарида (ЛПС) на нервную систему претерпели значительные изменения. Еще недавно считалось, что патологические эффекты ЛПС на клетки нервной системы могут осуществляться только при наличии в организме специфических инфекций. Однако появились данные о том, что нарушение проницаемости кишечного эпителия, связанное с различными патологиями и старением, может приводить к попаданию в системный кровоток ЛПС и других нейротоксичных соединений. Они проникают через гематоэнцефалический барьер в паренхиму мозга и приводят к развитию хронического воспаления ЦНС и нейродегенерации, в том числе к болезни Альцгеймера [1]. Количество ЛПС в структурах гиппокампа и неокортексе оказалось на порядки выше у больных болезнью Альцгеймера по сравнению со здоровыми людьми [2]. В связи с этим исследования механизмов развития нейродегенерации, стимулируемого бактериальными воспалительными агентами, приобрело в настоящее время особую актуальность.
Клетки нейрональной линии РС12 широко используются как клеточные модели в исследованиях механизмов нейровоспалительного действия ЛПС. Этот тип клеток экспрессирует TLR4, рецепторы ЛПС [3–5], и как нами было показано ранее, запуск сигнального каскада обеспечивается передислокацией TLR4 в область липидных рафтов [3]. Многочисленными работами установлено, что в основе повреждающего действия ЛПС на клетки РС12, независимо от степени их дифференцировки, является усиление генерации активных форм кислорода (АФК), снижение активности ферментов антиоксидантной системы, развивающаяся дисфункция митохондрий, образование провоспалительных цитокинов (IL-1β, IL-6 и TNF-α), стресс эндоплазматического ретикулума, что в конечном итоге приводит к снижению жизнеспособности клеток и апоптозу [4, 6–8]. На дифференцированных клетках РС12, помимо вышеперечисленных эффектов, ЛПС вызывает также снижение роста нейритов [9, 10].
Одним из проявлений воспалительного действия ЛПС, обнаруженного в разных типах клеток, является изменение метаболизма нейтральных липидов, приводящее к усилению депонирования жирных кислот в составе триацилглицеринов (ТАГ) и/или эфиров холестерина в липидных тельцах (ЛТ) [11–13] – особых органеллах, структурно-функционально связанных с эндоплазматическим ретикулумом и митохондриями. ЛТ играют не только важнейшую роль в регуляции липидного и энергетического метаболизма клетки, продукции эйкозаноидов, но и являются структурами, защищающими клетку от токсикации избытком липидов или их производных (жирных кислот, церамида и других липофильных веществ), образующихся при различных типах стрессорных воздействий, включая окислительный стресс [14–16]. С нарушением биогенеза ЛТ связаны многочисленные патологии – ожирение, атеросклероз, стеатоз печени и нейродегенеративные заболевания, такие как болезни Паркинсона, Альцгеймера и Хантигтона, а также боковой амиотрофический склероз [17].
В недавних исследованиях установлено, что ЛТ могут формироваться в различных типах клеток нервной системы – микроглии, астроцитах, эпендимных клетках [14, 18, 19], а в патологических ситуациях и в нейронах [20]. Для нормально функционирующих нейронов в отличие от других типов клеток не характерно формирование ЛТ, и их аккумуляция является маркером патологического процесса [21]. Так, на моделях болезни Паркинсона показано, что с усилением биогенеза ЛТ связано накопление альфа-синуклеина в дофаминергических нейронах [20]. ЛТ присутствуют в глиальных клетках, где выполняют роль особых антиокислительных органелл, аккумулирующих чувствительные к окислению полиненасыщенные жирные кислоты или уже окисленные производные, защищая нейроны от повреждающего действия АФК и препятствуя развитию нейродегенерации [21]. Показано, что при гиперактивации нейронов, которая сопровождается окислительным стрессом, происходит накопление ЛТ в астроцитах за счет экспорта окисленных липидов из нейронов в виде ApoE-позитивных липидных частиц, что обеспечивает нейропротекцию [22, 23]. Стимулом для переноса липидов из нейронов в ЛТ глии является продукция АФК в нейронах [24].
Эффект бактериального ЛПС на изменение липидного метаболизма в структурах ЦНС был исследован, главным образом, на клетках микроглии. В экспериментах in vivo и in vitro показано, что ЛПС вызывает увеличение числа и размеров ЛТ, а также усиление экспрессии белков, локализованных на их поверхности, которые регулируют формирование ЛТ и липолиз аккумулированных липидов [25, 26]. В клетках микроглии ЛПС инициирует высвобождение арахидоновой кислоты из липидов ЛТ для последующего синтеза провоспалительных липидных медиаторов [26]. Однако влияние ЛПС на липидный метаболизм нейрональных клеток, потенциально ассоциированный с формированием ЛТ, не исследовано ни на клеточных линиях, ни на первичной культуре нейронов. В связи с этим задачей настоящей работы, объектом которой служила нейрональная линия клеток РС12, послужило изучение влияния ЛПС на формирование ЛТ, аккумуляцию нейтральных липидов, метаболизм основных липидных классов и выяснение возможного механизма, опосредующего данные эффекты.
МЕТОДЫ ИССЛЕДОВАНИЯ
Реактивы: липополисахарид E. coli (серотип 0111: B4), этомоксир, олеиновая кислота, стандарты липидов (триолеилглицерин, холестерин, эфиры холестерина) – Sigma Chemicals (США); нильский красный – Invitrogen (США); пенициллин и стрептомицин – Serva (Германия); инкубационная среда DMEM c L-глутамином, сыворотки крови лошади и плодов коровы – фирма Биолот (Россия); [9,10-3Н(N)] олеиновая кислота – Perkin Elmer (США).
Культивирование клеток и определение их жизнеспособности
Опыты проводили на нейрональной клеточной линии РС12. Клетки выращивали при 37°C и 5% CO2 в среде DMEM с L-глутамином, содержащей 10% сыворотки крови плодов коровы, 5% сыворотки крови лошади, 50 мкг/мл стрептомицина и 50 ед/мл пенициллина G. Ростовую среду меняли каждые 2–3 дня. Для оценки действия ЛПС на метаболизм липидов посев клеток осуществляли в 24-луночные планшеты в количестве 2 × 105 клеток/лунку. Через сутки в опытные лунки добавляли ЛПС в количестве 0.5 мг/мл и инкубировали клетки в течение 24 ч. Оценку жизнеспособности клеток проводили МТТ-тестом. Для этого клетки рассаживали в 96-луночные планшеты с плотностью 5 × 104 клеток на лунку с ЛПС или без него и за 2 ч до окончания 24-часовой инкубации добавляли МТТ-реагент в конечной концентрации 0.5 мг/мл. Клетки лизировали в 50%-ном растворе диметилформамида в 0.05 N HCl. Оптическую плотность раствора измеряли на планшетном ридере при 570 нм, результаты выражали как процент к контролю после вычитания фоновой оптической плотности.
Конфокальная микроскопия
Клетки в количестве 105/500 мкл среды переносили в камеру для конфокального микроскопа. Концентрированный раствор нильского красного в ДМСО в концентрации 1 мг/мл разбавляли в 1000 раз культуральной средой, 100 мкл этого раствора добавляли в камеру микроскопа за 5–10 мин до визуализации. Микрофотографии получали на конфокальном микроскопе Leica TCS SP-II (Leica-Microsystems, Германия). Флуоресценцию возбуждали при λ 488 нм, регистрируя испускаемый свет при λ 500–570 нм, объектив ×20 с масляной иммерсией. Обсчет флуоресценции осуществляли с помощью программы ImageJ.
Экстракция липидов и определение абсолютного количества ТАГ
Клетки инкубировали с этомоксиром в концентрациях 5, 20 или 100 мкМ, с 25 мкМ олеиновой кислоты или с 0.5 мкг/мл ЛПС в течение суток. В контрольные лунки добавляли соответствующий объем этилового спирта, в котором были растворены этомоксир и олеиновая кислота. По окончании инкубации клетки промывали раствором Хенкса и подвергали экстракции смесью хлороформ–метанол в соотношении 2 : 1. Полученные липидные экстракты промывали 1/5 объема 0.75%-ного раствора KCl, центрифугировали 5 мин при 250 g, нижнюю фазу упаривали досуха, осадок липидов растворяли в 20 мкл смеси хлороформ–метанол (2 : 1) и затем наносили на хроматографическую пластинку DC-Alufolien (Merck, Германия). Хроматографию проводили в системе гексан–диэтиловый эфир–уксусная кислота (33 : 11.3 : 1, v/v). Пластинку проявляли в 20%-ном водном растворе H2SO4, затем нагревали до 150°С до проявления зон липидных классов, после чего фотографировали в стандартных условиях освещенности с помощью фотоаппарата Sony Cyber-Shot DSC-F828 (параметры съемки: F 2.5, S 60). Липиды идентифицировали с помощью соответствующих стандартов. Денситометрический анализ проводили с помощью программ ImageJ и Microsoft Office Excel. Абсолютные количества ТАГ рассчитывали, исходя из количества нанесенного на пластинку стандартного раствора ТАГ.
Включение в липиды [3H]-олеиновой кислоты и оценка окисления жирных кислот
Клетки инкубировали в течение 1 ч с 26 пмолями [9,10-3Н(N)] олеиновой кислоты с удельной активностью 45.5 Ки/ммоль, затем отбирали среду, промывали раствором Хенкса, добавляли чистую инкубационную среду и ЛПС в количестве 0.5 мкг/мл. Через сутки клетки вместе со средой переносили в пробирки, центрифугировали 10 мин при 200 g, надосадочную жидкость отбирали, осадок клеток промывали раствором Хенкса, центрифугировали еще раз при тех же условиях. Из осадка клеток и супернатанта экстрагировали липиды по методу Фолча, липидный экстракт промывали 1/5 объема 0.75%-ного раствора KCl. Полученный клеточный экстракт наносили на хроматографическую пластинку DC-Alufolien, разделение липидов на классы проводили так, как описано выше. Пластинку проявляли в парах йода, после его испарения зоны, соответствующие классам липидов, вырезали и помещали в виалы со сцинтилляционной жидкостью. Уровень радиоактивности измеряли на сцинтилляционном счетчике (LKB 1209/1215 Rack-Beta). В экстрактах супернатанта в полученной после расслоения фаз водной фазе измеряли уровень радиоактивности, оценивая по нему процесс окисления олеиновой кислоты.
Иммуноблоттинг
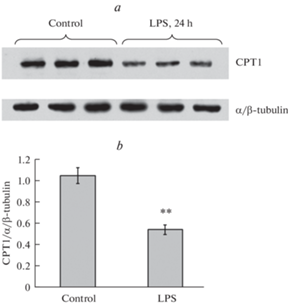
После окончания инкубации с ЛПС и удаления среды клетки лизировали горячим буфером для нанесения проб, содержащим 50 мМ Tris-HCl (pH 6.8), 100 мМ β-меркаптоэтанола, 1% SDS, 10% глицерина, 0.01% красителя бромфеноловый синий, и подвергали нагреванию при 100°C в течение 3 мин. Пробы разделяли в 10%-ном полиакриламидном геле и переносили на нитроцеллюлозную мембрану (Whatman, Германия). Мембраны обрабатывали 5%-ным раствором обезжиренного молока на TBS-Tween 20 в течение 1 ч и инкубировали в течение ночи при 4°C с соответствующими антителами против CPT1 (Santa Cruz Biotechnology, США) (1 : 1000) и против тубулина (Cell Signalling, США) (1 : 1000). В качестве вторичных антител использовали goat anti-rabbit IgG, конъюгированные с пероксидазой хрена (Vector, США) (1 : 3000). Для визуализации сигналов использовали ECL detection system (Thermo Scientific, США), содержание белка оценивали с помощью денситометрии и программы ImageJ. В качестве внутреннего стандарта использовали α/β-тубулин.
Статистическая обработка результатов
Статистическую обработку данных, представленных в виде среднего арифметического ± стандартная ошибка среднего значения, проводили, используя программу Microsoft Office Excel. Для определения достоверности различий применяли t-критерий Стъюдента для попарно-связанных величин. Там, где это было необходимо, достоверность различий между контролем и опытом определяли с помощью метода однофакторного дисперсионного анализа (one-way ANOVA). Достоверными считались отличия при уровне значимости p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Многочисленные литературные данные о применении ЛПС на клетках линии РС12 показывают чрезвычайно широкий диапазон используемых концентраций ЛПС – от 5 до 400 мкг/мл, при этом могут отличаться как условия инкубации клеток (с сывороткой или без нее), так и используемые серотипы ЛПС или время его воздействия [4, 9]. Так же, как и наша работа, большинство исследований на РС12 с применением ЛПС в качестве триггера воспалительных реакций выполнено на недифференцированных клетках. Клетки, использованные в нашей работе, демонстрировали высокую устойчивость к ЛПС серотипа 0111: B4, оцениваемую по МТТ-тесту: массовая гибель (98%) наблюдалась при использовании дозы 1000 мкг/мл. В дозе ЛПС 500 мкг/мл жизнеспособность клеток снижалась на 25.5% ± 2.9 (р < 0.01, n = 6), в связи с чем данная доза была выбрана для проведения последующих экспериментов с исследованием влияния ЛПС на липидный метаболизм.
Как в контроле, так и при действии ЛПС липидные гранулы, оцениваемые по окраске нильским красным, визуализируются в различных количествах практически во всех клетках и локализуются, главным образом, на периферии. Инкубация клеток в течение 24 ч с ЛПС приводила к значительному увеличению в цитоплазме количества и размеров липидных гранул, как одиночных, так и сгруппированных в крупные кластеры (рис. 1а, b). Учитывая свойства нильского красного, увеличение его флуоресценции при действии ЛПС в выбранном диапазоне длин волн могло вызываться накоплением как ТАГ, так и эфиров холестерина. В связи с этим необходимо было оценить роль конкретных липидных классов в накоплении липидных гранул. Для решения этой задачи из контрольных и ЛПС-стимулированных клеток были экстрагированы липиды с последующим разделением липидного экстракта на классы с помощью тонкослойной хроматографии и их количественной оценкой методом денситометрии. Результаты показали, что при действии ЛПС происходит значительное увеличение содержания ТАГ (рис. 2), но не эфиров холестерина (данные не показаны). Аналогичными эффектами обладала олеиновая кислота, использованная в качестве позитивного контроля.
Рис. 1.
Микрофотография клеток РС12 в контроле (а) и при действии ЛПС (b) в концентрации 0.5 мг/мл через 24 ч инкубации. Окраска нильским красным. Конфокальный микроскоп Leica TCS SP-II. Флуоресценцию возбуждали при λ 488 нм, регистрируя испускаемый свет при λ 500–570 нм, объектив ×20 с масляной иммерсией. с – Обсчет уровня флуоресценции нильского красного, n = 5, * p < 0.05, парный тест Вилкоксона. AU – условные единицы.
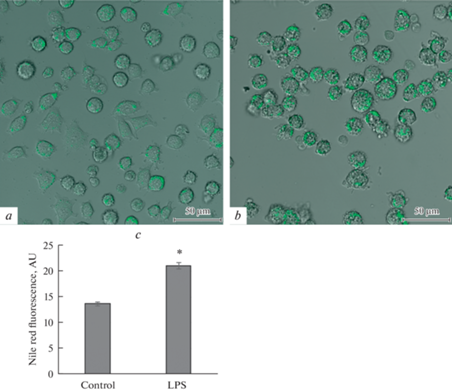
Рис. 2.
Внутриклеточное содержание ТАГ при действии разных концентраций этомоксира (5, 20 и 100 мкМ), 25 мкМ олеиновой кислоты или 0.5 мг/мл ЛПС. Клетки инкубировали в течение 24 ч, затем экстрагировали липиды и разделяли их на классы тонкослойной хроматографией. Количество ТАГ оценивали денситометрически, абсолютные количества рассчитывали, исходя из количества нанесенного на пластинку стандартного раствора ТАГ. OA – олеиновая кислота. Данные представлены в виде среднего значения 4–6 независимых экспериментов ± m. * p < 0.05, ** p < 0.01, *** p < 0.001 по сравнению с контролем.
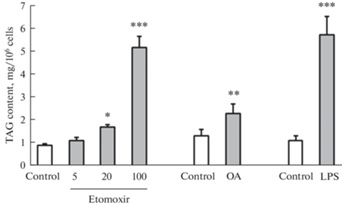
Для того, чтобы понять усиливает ли аккумуляцию ТАГ снижение окисления жирных кислот, как это имеет место в некоторых типах клеток [27], клетки РС12 инкубировали с различными концентрациями этомоксира, ингибитора карнитин-пальмитоилтрансферазы 1 (CPT1), ключевого фермента окисления жирных кислот, обеспечивающего перенос ацил-КоА через наружную мембрану митохондрий. Результаты показали, что этомоксир дозозависимо увеличивал содержание ТАГ (рис. 2).
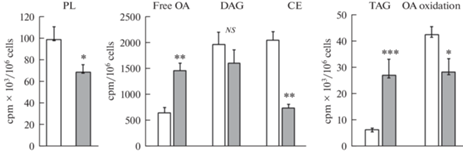
Для исследования влияния ЛПС на метаболизм липидов и окисление жирных кислот, клетки РС12 прединкубировали с [3H]-олеиновой кислотой, затем воздействовали ЛПС в течение 24 ч, экстрагировали липиды и измеряли уровень радиоактивности в отдельных липидных классах. Также оценивали уровень окисления олеиновой кислоты по оценке радиоактивности инкубационной среды после экстракции из нее липофильных компонентов. Результаты показали, что в клетках РС12 ЛПС приводил к увеличению радиоактивности в ТАГ и во фракции свободных жирных кислот, при этом снижал уровень радиоактивности в фосфолипидах и эфирах холестерина (рис. 3). Изменения в уровне радиоактивности диацилглицерина было статистически недостоверным. Оценка радиоактивности водной фазы внеклеточной жидкости, подвергнутой предварительной липидной экстракции, выявила достоверное снижение окисления олеиновой кислоты при действии ЛПС (рис. 3).
Рис. 3.
Уровень радиоактивности в отдельных классах липидов и продуктах окисления олеиновой кислоты в контрольных и ЛПС-стимулированных клетках РС12. Прозрачные столбики – контроль, серые – ЛПС. Клетки инкубировали 1 ч в присутствии [3H]-C18: 1, отмывали и инкубировали 24 ч с 0.5 мг/мл ЛПС. PL – фосфолипиды, TAG – триацилглицерины, DAG – диацилглицерины, CE – эфиры холестерина. Данные представлены в виде среднего значения ± m 4–6 независимых экспериментов. * p < 0.05, ** p < 0.01, *** p < 0.001 по сравнению с контролем.
Поскольку CPT1 является ферментом, лимитирующим окисление жирных кислот в митохондриях, было исследовано влияние 24-часовой инкубации с ЛПС на его экспрессию методом иммуноблотинга. Результаты выявили значительное снижение экспрессии CPT1 при действии ЛПС (рис. 4).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные данные свидетельствуют о том, что ЛПС в клетках нейрональной линии РС12 вызывает внутриклеточную аккумуляцию ТАГ и стимулирует формирование ЛТ. Таким образом, в отношении изменения метаболизма нейтральных липидов клетки РС12 демонстрируют “классическую” реакцию на ЛПС, свойственную различным типам клеток [11–13].
Известно, что механизмы, заставляющие клетки депонировать липиды в условиях действия бактериального патогена, могут быть многообразны: уменьшение липолиза ТАГ [28], изменение экспрессии сопряженных с липазами перилипинов – белков, локализованных на поверхности ЛТ и регулирующих их формирование [26], усиление CD36-опосредованного трансмембранного переноса жирных кислот и синтеза жирных кислот с последующим включением в синтез ТАГ [11], снижение окисления жирных кислот за счет даун-регуляции транскрипционного фактора PPARα и торможения экспрессии генов, обеспечивающих окисление жирных кислот в митохондриях [29], и другие. На клетках РС12 нами обнаружено, что при действии ЛПС происходит снижение окисления жирных кислот, увеличение уровня свободных жирных кислот, даун-регуляция экспрессии СРТ1, а также выявлена способность этомоксира, ингибитора СРТ1, увеличивать внутриклеточное накопление ТАГ. Совокупность этих данных указывает на то, что торможение окисления жирных кислот и их перенаправление на синтез ТАГ является причиной аккумуляции ТАГ и формирования ЛТ в данном типе клеток, что однако не исключает вовлечение и других, перечисленных выше, механизмов. Усиление формирования ЛТ, основанное на снижении окисления жирных кислот, было показано на клетках РС12 при токсическом воздействии квантовых точек (quantum dots), полупроводниковых коллоидных наночастиц [30].
Наиболее вероятной причиной снижения экспрессии СРТ1 и β-окисления жирных кислот в митохондриях является окислительный стресс. Торможение этих процессов в условиях окислительного стресса может являться компенсаторным механизмом, облегчающим выживание клетки, поскольку β-окисление жирных кислот, как известно, является одним из источников АФК. Генерируемый в ходе этого процесса ФАДН2 увеличивает продукцию АФК за счет обратного потока электронов в электрон-транспортной цепи митохондрий от комплекса II к комплексу I [15]. Нами и другими авторами было показано, что ЛПС в клетках РС12 усиливает образование АФК, снижает активность ферментов антиоксидантной системы и вызывает дисфункцию митохондрий [3, 4, 7, 31]. Известно, что в механизме действия ЛПС на клетки РС12 задействованы многочисленные молекулярные каскады, типичные для провоспалительного внутриклеточного сценария, вызванного окислительным стрессом – активация PI3K/AKT сигнального пути [32], МАР-киназ [4], JNK [33], приводящих к активации транскрипционного фактора NF-κB [34], увеличению продукции провоспалительных цитокинов, усилению экспрессии циклооксигеназы-2 [4] и индуцибельной NO-синтазы [35]. Какие сигнальные пути задействованы в снижении экспрессии СРТ1 в клетках РС12 при действии ЛПС остается, однако, неизвестным. Помимо прямой регуляции экспрессии СРТ1 с участием транскрипционных факторов, снижение содержания этого фермента может быть связано с изменением митохондриальной динамики, усилением фрагментации митохондрий и митофагии, что, как известно, сопровождает ЛПС-индуцированный окислительный стресс [36, 37]. Кроме изменения уровня экспрессии, СРТ1 при действии ЛПС может подвергаться и посттрансляционным модификациям продуктами окисления полиненасыщенных жирных кислот, что, как было показано, приводит к резкому снижению ее активности [38].
Еще одним механизмом внутриклеточного накопления ТАГ в клетках РС12 при действии ЛПС может быть индукция аутофагии, которая, как известно, стимулируется при действии окислительного стресса и является основным катаболическим процессом удаления из клеток поврежденных органелл, в том числе митохондрий (митофагия) [39]. Аутофагия обеспечивает передислокацию фосфолипидов из внутриклеточных органелл в аутофагосомы, где фосфолипиды подвергаются гидролизу, а высвободившиеся жирные кислоты идут на синтез ТАГ, осуществляемый ферментами, локализованными на поверхности ЛТ. ЛТ в таких процессах играют роль буферных систем, защищающих клетку от липотоксичности. На возможность участия подобного механизма в клетках РС12 указывают полученные в наших экспериментах данные о достоверном снижении уровня фосфолипидов, меченных олеиновой кислотой, при действии ЛПС, а также увеличении уровня свободных жирных кислот.
Необходимо заметить, что хотя нейрональная линия РС12, в том числе и недифференцированные клетки, широко используется как модель в исследованиях механизмов нейродегенерации, наши данные показывают, что по своему метаболическому фенотипу в отношении нейтральных липидов они похожи не на нейроны, а на нейрональные стволовые клетки. Об этом свидетельствуют следующие факты. Во-первых, в зрелых нейронах в отличие от клеток РС12 практически отсутствует окисление жирных кислот и функционирование СРТ1 системы [40]. В структурах мозга эти процессы локализованы исключительно в астроцитах и нейрональных стволовых клетках [41–43]. Показано, что для нейрональных стволовых клеток субвентрикулярной зоны мозга мышей окисление жирных кислот является не только основным источником энергии, но и определяет возможность клеточной пролиферации [43]. Во-вторых, нормально функционирующие нейроны не аккумулируют нейтральные липиды, тогда как по нашим и литературным данным контрольные клетки РС12 содержат хорошо визуализируемые ЛТ [44]. В-третьих, нейроны и клетки РС12 экспрессируют различные изоформы СРТ1. Идентифицированы три изоформы СРТ1 – СРТ1а, СРТ1с и СРТ1b. СРТ1а и b выполняют классическую функцию этого фермента – перенос жирных кислот в виде ацилкарнитинов через наружную мембрану митохондрий. Изоформа СРТ1с экспрессируется исключительно в нейронах, локализуется не в митохондриях, а в эндоплазматическом ретикулуме и не катализирует образование ацилкарнитина [45]. Функция ее в нейронах до сих пор малопонятна, хотя показано, что в нейронах гиппокампа СРТ1с играет защитную роль, предотвращая развитие окислительного стресса и апоптоза при воздействии β-амилоидного пептида [46]. Использованные в нашей работе антитела не позволяют идентифицировать изоформу СРТ1, которая экспрессируется в РС12 и чувствительна к действию ЛПС, однако по другим данным известно, что в недифференцированных клетках РС12 экспрессируется СРТ1а, локализованная в митохондриях [47]. Это согласуется с нашими данными о способности клеток РС12 окислять жирные кислоты и реагировать на ингибирование СРТ1 аккумуляцией ТАГ. Та же изоформа, СРТ1а, экспрессируется в нейрональных стволовых клетках различных зон мозга [41, 48].
ЗАКЛЮЧЕНИЕ
Полученные нами данные свидетельствуют о том, что в клетках РС12 ЛПС вызывает снижение окисления жирных кислот, уменьшение экспрессии СРТ1, ключевого фермента переноса жирных кислот в митохондрии, что приводит к аккумуляции ТАГ и формированию ЛТ. Подобный механизм в условиях действия бактериального патогена является, по всей вероятности, стратегией выживания клетки, защищающий ее от липотоксичности. Сходство липидного метаболического фенотипа клеток РС12 и нейрональных стволовых клеток позволяет предположить, что нейрогенез может являться важной мишенью действия бактериальных патогенов в структурах ЦНС.
Список литературы
Lukiw WJ (2020) Gastrointestinal (GI) Tract Microbiome-Derived Neurotoxins-Potent Neuro-Inflammatory Signals From the GI Tract via the Systemic Circulation Into the Brain. Front Cell Infect Microbiol 10: 22.https://doi.org/10.3389/fcimb.2020.00022
Zhao Y, Jaber V, Lukiw WJ (2017) Secretory Products of the Human GI Tract Microbiome and Their Potential Impact on Alzheimer’s Disease (AD): Detection of Lipopolysaccharide (LPS) in AD Hippocampus. Front Cell Infect Microbiol 7: 318.https://doi.org/10.3389/fcimb.2017.00318
Nikolaeva S, Bayunova L, Sokolova T, Vlasova Y, Bachteeva V, Avrova N, Parnova R (2015) GM1 and GD1a gangliosides modulate toxic and inflammatory effects of E. coli lipopolysaccharide by preventing TLR4 translocation into lipid rafts. Biochim Biophys Acta 1851(3): 239–247. https://doi.org/10.1016/j.bbalip.2014.12.004
Wang H, Xu YS, Wang ML, Cheng C, Bian R, Yuan H, Wang Y, Guo T, Zhu LL, Zhou H (2017) Protective effect of naringin against the LPS-induced apoptosis of PC12 cells: Implications for the treatment of neurodegenerative disorders. Int J Mol Med 39(4): 819–830.https://doi.org/10.3892/ijmm.2017.2904
Liu X, Xiao Q, Zhao K, Gao Y (2013) Ghrelin inhibits high glucose-induced PC12 cell apoptosis by regulating TLR4/NF-kappaB pathway. Inflammation 36(6): 1286–1294.https://doi.org/10.1007/s10753-013-9667-2
Yang Q, Kang ZH, Zhang J, Qu F, Song B (2021) Neuroprotective Effects of Isoquercetin: An In Vitro and In Vivo Study. Cell J 23(3): 355–365.https://doi.org/10.22074/cellj.2021.7116
Wu Z, Lu Z, Ou J, Su X, Liu J (2020) Inflammatory response and oxidative stress attenuated by sulfiredoxin1 in neuronlike cells depends on nuclear factor erythroid2related factor 2. Mol Med Rep 22(6): 4734–4742.https://doi.org/10.3892/mmr.2020.11545
Bayunova LV, Parnova RG, Avrova NF (2015) Antiapoptotic effect of gangliosides on PC12 cells exposed to bacterial lipopolysaccharide. Zh Evol Biokhim Fiziol 51(2): 88–94.
Wakulik K, Wiatrak B, Szczukowski L, Bodetko D, Szandruk-Bender M, Dobosz A, Swiatek P, Gasiorowski K (2020) Effect of Novel Pyrrolo[3,4-d]pyridazinone Derivatives on Lipopolysaccharide-Induced Neuroinflammation. Int J Mol Sci 21(7).https://doi.org/10.3390/ijms21072575
Wiatrak B, Balon K (2021) Protective Activity of Abeta on Cell Cultures (PC12 and THP-1 after Differentiation) Preincubated with Lipopolysaccharide (LPS). Mol Neurobiol 58(4): 1453–1464.https://doi.org/10.1007/s12035-020-02204-w
Feingold KR, Shigenaga JK, Kazemi MR, McDonald CM, Patzek SM, Cross AS, Moser A, Grunfeld C (2012) Mechanisms of triglyceride accumulation in activated macrophages. J Leukoc Biol 92(4): 829–839.https://doi.org/10.1189/jlb.1111537
Fock E, Bachteeva V, Lavrova E, Parnova R (2018) Mitochondrial-Targeted Antioxidant MitoQ Prevents E. coli Lipopolysaccharide-Induced Accumulation of Triacylglycerol and Lipid Droplets Biogenesis in Epithelial Cells. J Lipids 2018: 5745790.https://doi.org/10.1155/2018/5745790
Wang J, Si Y, Wu C, Sun L, Ma Y, Ge A, Li B (2012) Lipopolysaccharide promotes lipid accumulation in human adventitial fibroblasts via TLR4-NF-kappaB pathway. Lipids Health Dis 11: 139.https://doi.org/10.1186/1476-511X-11-139
Bailey AP, Koster G, Guillermier C, Hirst EM, MacRae JI, Lechene CP, Postle AD, Gould AP (2015) Antioxidant Role for Lipid Droplets in a Stem Cell Niche of Drosophila. Cell 163(2): 340–353.https://doi.org/10.1016/j.cell.2015.09.020
Lee SJ, Zhang J, Choi AM, Kim HP (2013) Mitochondrial dysfunction induces formation of lipid droplets as a generalized response to stress. Oxid Med Cell Longev 2013: 327167.https://doi.org/10.1155/2013/327167
Schonfeld P,Reiser G (2021) How the brain fights fatty acids' toxicity. Neurochem Int 148: 105050.https://doi.org/10.1016/j.neuint.2021.105050
Krahmer N, Farese RV, Jr., Walther TC (2013) Balancing the fat: lipid droplets and human disease. EMBO Mol Med 5(7): 973–983.https://doi.org/10.1002/emmm.201100671
Shimabukuro MK, Langhi LG, Cordeiro I, Brito JM, Batista CM, Mattson MP, Mello Coelho V (2016) Lipid-laden cells differentially distributed in the aging brain are functionally active and correspond to distinct phenotypes. Sci Rep 6: 23795.https://doi.org/10.1038/srep23795
Yang DS, Stavrides P, Saito M, Kumar A, Rodriguez-Navarro JA, Pawlik M, Huo C, Walkley SU, Saito M, Cuervo AM, Nixon RA (2014) Defective macroautophagic turnover of brain lipids in the TgCRND8 Alzheimer mouse model: prevention by correcting lysosomal proteolytic deficits. Brain 137(Pt 12): 3300–3318.https://doi.org/10.1093/brain/awu278
Girard V, Jollivet F, Knittelfelder O, Celle M, Arsac JN, Chatelain G, Van den Brink DM, Baron T, Shevchenko A, Kuhnlein RP, Davoust N, Mollereau B (2021) Abnormal accumulation of lipid droplets in neurons induces the conversion of alpha-Synuclein to proteolytic resistant forms in a Drosophila model of Parkinson’s disease. PLoS Genet 17(11): e1009921.https://doi.org/10.1371/journal.pgen.1009921
Farmer BC, Walsh AE, Kluemper JC, Johnson LA (2020) Lipid Droplets in Neurodegenerative Disorders. Front Neurosci 14: 742.https://doi.org/10.3389/fnins.2020.00742
Ioannou MS, Jackson J, Sheu SH, Chang CL, Weigel AV, Liu H, Pasolli HA, Xu CS, Pang S, Matthies D, Hess HF, Lippincott-Schwartz J, Liu Z (2019) Neuron-Astrocyte Metabolic Coupling Protects against Activity-Induced Fatty Acid Toxicity. Cell 177(6): 1522–1535 e14.https://doi.org/10.1016/j.cell.2019.04.001
Lee LL, Aung HH, Wilson DW, Anderson SE, Rutledge JC, Rutkowsky JM (2017) Triglyceride-rich lipoprotein lipolysis products increase blood-brain barrier transfer coefficient and induce astrocyte lipid droplets and cell stress. Am J Physiol Cell Physiol 312(4): C500–C516.https://doi.org/10.1152/ajpcell.00120.2016
Liu L, MacKenzie KR, Putluri N, Maletic-Savatic M, Bellen HJ (2017) The Glia-Neuron Lactate Shuttle and Elevated ROS Promote Lipid Synthesis in Neurons and Lipid Droplet Accumulation in Glia via APOE/D. Cell Metab 26(5): 719–737 e6.https://doi.org/10.1016/j.cmet.2017.08.024
Marschallinger J, Iram T, Zardeneta M, Lee SE, Lehallier B, Haney MS, Pluvinage JV, Mathur V, Hahn O, Morgens DW, Kim J, Tevini J, Felder TK, Wolinski H, Bertozzi CR, Bassik MC, Aigner L, Wyss-Coray T (2020) Lipid-droplet-accumulating microglia represent a dysfunctional and proinflammatory state in the aging brain. Nat Neurosci 23(2): 194–208.https://doi.org/10.1038/s41593-019-0566-1
Khatchadourian A, Bourque SD, Richard VR, Titorenko VI, Maysinger D (2012) Dynamics and regulation of lipid droplet formation in lipopolysaccharide (LPS)-stimulated microglia. Biochim Biophys Acta 1821(4): 607–617.https://doi.org/10.1016/j.bbalip.2012.01.007
Fock E, Lavrova E, Bachteeva V, Nikolaeva S, Parnova R (2019) Suppression of fatty acid beta-oxidation and energy deficiency as a cause of inhibitory effect of E. coli lipopolysaccharide on osmotic water transport in the frog urinary bladder. Comp Biochem Physiol C Toxicol Pharmacol 218: 81–87.https://doi.org/10.1016/j.cbpc.2019.01.001
Huang YL, Morales-Rosado J, Ray J, Myers TG, Kho T, Lu M, Munford RS (2014) Toll-like receptor agonists promote prolonged triglyceride storage in macrophages. J Biol Chem 289(5): 3001–3012.https://doi.org/10.1074/jbc.M113.524587
Feingold KR, Wang Y, Moser A, Shigenaga JK, Grunfeld C (2008) LPS decreases fatty acid oxidation and nuclear hormone receptors in the kidney. J Lipid Res 49(10): 2179–2187.https://doi.org/10.1194/jlr.M800233-JLR200
Przybytkowski E, Behrendt M, Dubois D, Maysinger D (2009) Nanoparticles can induce changes in the intracellular metabolism of lipids without compromising cellular viability. FEBS J 276(21): 6204–6217. https://doi.org/10.1111/j.1742-4658.2009.07324.x
Wang F, Wang L, Sui G, Yang C, Guo M, Xiong X, Chen Z, Lei P (2021) IGF-1 Alleviates Mitochondrial Apoptosis through the GSK3beta/NF-kappaB/NLRP3 Signaling Pathway in LPS-Treated PC-12 Cells. J Mol Neurosci 71(6): 1320–1328.https://doi.org/10.1007/s12031-020-01759-6
Xie Y, Zhang H, Zhang Y, Wang C, Duan D, Wang Z (2018) Chinese Angelica Polysaccharide (CAP) Alleviates LPS-Induced Inflammation and Apoptosis by Down-Regulating COX-1 in PC12 Cells. Cell Physiol Biochem 49(4): 1380–1388.https://doi.org/10.1159/000493415
Ma S, Zhang C, Zhang Z, Dai Y, Gu R, Jiang R (2019) Geniposide protects PC12 cells from lipopolysaccharide-evoked inflammatory injury via up-regulation of miR-145-5p. Artif Cells Nanomed Biotechnol 47(1): 2875–2881.https://doi.org/10.1080/21691401.2019.1626406
Huang H, Hong Q, Tan HL, Xiao CR, Gao Y (2016) Ferulic acid prevents LPS-induced up-regulation of PDE4B and stimulates the cAMP/CREB signaling pathway in PC12 cells. Acta Pharmacol Sin 37(12): 1543–1554.https://doi.org/10.1038/aps.2016.88
Nikolaeva S, Sokolova T, Bayunova L, Parnova R (2013) Protective effect of GD1a and GM1 gangliosides against the toxic action of bacterial lipopolysaccharide on neuronal and epithelial cells. FEBS J 280(Suppl.1): 433–433.
Kapetanovic R, Afroz SF, Ramnath D, Lawrence GM, Okada T, Curson JE, de Bruin J, Fairlie DP, Schroder K, St John JC, Blumenthal A, Sweet MJ (2020) Lipopolysaccharide promotes Drp1-dependent mitochondrial fission and associated inflammatory responses in macrophages. Immunol Cell Biol 98(7): 528–539.https://doi.org/10.1111/imcb.12363
Harland M, Torres S, Liu J, Wang X (2020) Neuronal Mitochondria Modulation of LPS-Induced Neuroinflammation. J Neurosci 40(8): 1756–1765.https://doi.org/10.1523/JNEUROSCI.2324-19.2020
Serviddio G, Giudetti AM, Bellanti F, Priore P, Rollo T, Tamborra R, Siculella L, Vendemiale G, Altomare E, Gnoni GV (2011) Oxidation of hepatic carnitine palmitoyl transferase-I (CPT-I) impairs fatty acid beta-oxidation in rats fed a methionine-choline deficient diet. PLoS One 6(9): e24084.https://doi.org/10.1371/journal.pone.0024084
Filomeni G, De Zio D, Cecconi F (2015) Oxidative stress and autophagy: the clash between damage and metabolic needs. Cell Death Differ 22(3): 377–388.https://doi.org/10.1038/cdd.2014.150
Schonfeld P, Reiser G (2013) Why does brain metabolism not favor burning of fatty acids to provide energy? Reflections on disadvantages of the use of free fatty acids as fuel for brain. J Cereb Blood Flow Metab 33(10): 1493–1499.https://doi.org/10.1038/jcbfm.2013.128
Jernberg JN, Bowman CE, Wolfgang MJ, Scafidi S (2017) Developmental regulation and localization of carnitine palmitoyltransferases (CPTs) in rat brain. J Neurochem 142(3): 407–419. https://doi.org/10.1111/jnc.14072
Edmond J, Robbins RA, Bergstrom JD, Cole RA, de Vellis J (1987) Capacity for substrate utilization in oxidative metabolism by neurons, astrocytes, and oligodendrocytes from developing brain in primary culture. J Neurosci Res 18(4): 551–561. https://doi.org/10.1002/jnr.490180407
Stoll EA, Makin R, Sweet IR, Trevelyan AJ, Miwa S, Horner PJ, Turnbull DM (2015) Neural Stem Cells in the Adult Subventricular Zone Oxidize Fatty Acids to Produce Energy and Support Neurogenic Activity. Stem Cells 33(7): 2306–2319.https://doi.org/10.1002/stem.2042
Bianchetti G, Di Giacinto F, De Spirito M, Maulucci G (2020) Machine-learning assisted confocal imaging of intracellular sites of triglycerides and cholesteryl esters formation and storage. Anal Chim Acta 1121: 57–66.https://doi.org/10.1016/j.aca.2020.04.076
Wolfgang MJ, Cha SH, Millington DS, Cline G, Shulman GI, Suwa A, Asaumi M, Kurama T, Shimokawa T, Lane MD (2008) Brain-specific carnitine palmitoyl-transferase-1c: role in CNS fatty acid metabolism, food intake, and body weight. J Neurochem 105(4): 1550–1559.https://doi.org/10.1111/j.1471-4159.2008.05255.x
Ding Y, Zhang H, Liu Z, Li Q, Guo Y, Chen Y, Chang Y, Cui H (2021) Carnitine palmitoyltransferase 1 (CPT1) alleviates oxidative stress and apoptosis of hippocampal neuron in response to beta-Amyloid peptide fragment Abeta25-35. Bioengineered 12(1): 5440–5449.https://doi.org/10.1080/21655979.2021.1967032
Sierra AY, Gratacos E, Carrasco P, Clotet J, Urena J, Serra D, Asins G, Hegardt FG, Casals N (2008) CPT1c is localized in endoplasmic reticulum of neurons and has carnitine palmitoyltransferase activity. J Biol Chem 283(11): 6878–6885.https://doi.org/10.1074/jbc.M707965200
Knobloch M, Pilz GA, Ghesquiere B, Kovacs WJ, Wegleiter T, Moore DL, Hruzova M, Zamboni N, Carmeliet P, Jessberger S (2017) A Fatty Acid Oxidation-Dependent Metabolic Shift Regulates Adult Neural Stem Cell Activity. Cell Rep 20(9): 2144–2155.https://doi.org/10.1016/j.celrep.2017.08.029
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова