Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 7, стр. 836-849
Орексин-иммунопозитивные структуры ретикулярного ядра таламуса
И. Ю. Морина 1, И. В. Романова 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: irinaromanova@mail.ru
Поступила в редакцию 30.04.2022
После доработки 18.05.2022
Принята к публикации 28.05.2022
- EDN: IJDKLT
- DOI: 10.31857/S0869813922070056
Аннотация
У лабораторных млекопитающих (половозрелые крысы линии Вистар и Sprague-Dawley, мыши С57Bl/6J) в нейронах различных отделов ретикулярного ядра таламуса выявлены орексин-А и орексин-В, уровень иммунореактивности которых значительно ниже, чем в нейронах перифорникальной области гипоталамуса. У крыс Вистар в экспериментах с 6-часовой депривацией сна и 3-часовой иммобилизацией на спине выявлены разнонаправленные реакции орексин-иммунопозитивных нейронов в этих структурах мозга. Показано, что в ходе эмбрионального развития крыс Вистар в таламусе орексин-иммунопозитивные структуры идентифицируются уже на стадии Е18, слабо развиты на стадии Р14 и формируются к 30-му дню жизни, что совпадает с периодом становления цикла бодрствование–сон у крыс. Полученные данные свидетельствуют о том, что орексины ретикулярного ядра таламуса также вовлечены в регуляцию цикла бодрствование–сон.
В 1998 г. две группы ученых, возглавляемых de Lecea и Sakuraia, независимо друг от друга, открыли новое семейство нейропептидов – гипокретины или орексины [1, 2]. Название гипокретины было дано в связи с экспрессией мРНК в билатерально-симметричной структуре заднего гипоталамуса (“специфический гипоталамический транскрипт”) и с идентичностью в аминокислотной последовательности с гормоном секретином. Второе название связано с участием в регуляции пищевого поведения и произошло от греческого слова orexis – аппетит [2]. К семейству орексинов относятся два нейропептида: орексин-А (или гипокретин-1) и орексин-В (или гипокретин-2), которые образуются в одном нейроне при протеолизе общего прекурсора препро-орексина (препро-гипокретина). Действие орексинов осуществляется через два типа G-протеин-связанных рецепторов: рецептор первого типа, селективный только для орексина-А, и второго типа, через который осуществляют действие обоих орексинов [1, 2].
В мозге млекопитающих мРНК препро-орексина и образующиеся из него орексин-А и орексин-В описаны в нейронах перифорникальной области гипоталамуса, что, по-видимому, зависело от чувствительности метода выявления мРНК. Cтруктуры с меньшим уровнем мРНК препро-орексина не идентифицировались, поэтому функции орексинов в мозге связывают прежде всего с нейронами перифорникальной области гипоталамуса, а другие популяции орексин-содержащих клеток мозга не рассматривались, что сужает представления о функциональной роли этих пептидов.
Известно, что орексины через взаимодействие с другими медиаторными системами принимают участие в регуляции двигательной активности [3] и работы нейроэндокринной оси, вовлечены в формирование мотивационного поведения и системы подкрепления, тревожности [4], принимают участие в регуляции стрессорного и иммунного ответа организма [5–7]. Но значительное внимание исследователей, с момента открытия и до сих пор, уделяется роли орексинов в регуляции пищевого поведения, энергетического баланса и цикла бодрствование–сон [1, 2, 4, 8]. В контроле цикла бодрствование–сон орексины являются звеном регуляции бодрствования и пробуждения, а дефицит орексинов и нарушение гена Оx1r приводит к развитию нарколепсии – патологии, характеризующейся приступами дневной сонливости и резким падением мышечного тонуса [9–12]. Стоит отметить, что в поддержании состояния бодрствования кроме орексинергических нейронов участвуют и ГАМК-нейроны латерального гипоталамуса, оказывающие ингибирующее влияние на ГАМК-нейроны ретикулярного ядра таламуса [13], которое относят к пейсмекерам веретен сна [14]. Эта структура занимает ключевое положение для таламокортикальных и кортикоталамических связей [15, 16], что определяет ее функциональное значение.
В 1896 г. Kölliker описал область ретикулярного ядра таламуса как белое вещество с пучками пересекающихся волокон [цит. по 16]. Позднее Munzer и Wiener дали ему название ретикулярное ядро таламуса [цит. по 16]. Показано, что это ядро представляет собой тонкую прослойку на границе дорзального таламуса с кортексом между внутренней капсулой и наружной медуллярной пластинкой [16], которое в процессе эмбриогенеза образуется из вентрального таламуса и далее мигрирует дорсально, чтобы охватить главным образом переднюю и боковую части таламуса и частично его дорсальную и вентральную части. Функционально ретикулярное ядро таламуса – ингибиторное ядро, гетерогенное по морфологическим и функциональным характеристикам. Признаками морфологической классификации являются форма сомы, характер ветвления дендритов и локализация в ядре. В ретикулярном ядре таламуса выделяют 3 типа клеток: R-клетки (круглая сома, сильно ветвистые дендриты, локализованные в передне-лимбическом секторе), F-клетки (большие веретеновидные, локализованные по всем ядру), f-клетки (маленькие веретеновидные, локализованные в сенсорных секторах) [17]. В ретикулярном ядре таламуса локализованы в основном ГАМКергические нейроны, которые равномерно распределены по всем секторам [18]. В то же время нейроны, экспрессирующие Ca2+-связывающие протеины калретинин и калбиндин, локализованы неравномерно [19–21]. Также в ретикулярном ядре таламуса выявлены и такие пептиды, как тиреотропин-рилизинг гормон, вазоактивный интестинальный пептид, пролактин-рилизинг пептид [22–24]. Гетерогенность в функциональном плане основана на разделении ретикулярного ядра таламуса по меньшей мере на 7 секторов: 5 сенсорных (слуховой, вкусовой, соматосенсорный, висцеральный и зрительный), моторный и лимбический сектора. В зависимости от функционального значения в ретикулярном ядре таламуса выделяют три части: заднюю, среднюю и переднюю. Задняя часть участвует в модуляции зрительной [25], слуховой [26] и соматосенсорной информации [27], проекции из этой части идут в слуховую кору головного мозга. В среднюю часть приходят проекции от вкусовых и висцеральных структур, которые далее идут в сомато-сенсорную кору [27–29]. Проекции из моторных и лимбических структур, вовлеченных в визуальное движение и внимание, поступают в переднюю часть, а далее идут в префронтальную кору [29–31].
Следует отметить, что гипоталамическая локализация орексинергических нейронов прослеживается на всех этапах филогенеза позвоночных. Однако мРНК препро-орексина в таламической области показана у хрящевых рыб [32], а у человека в субталамическом ядре [2]. На основе этих данных, а также учитывая функциональную взаимосвязь латерального гипоталамуса и ретикулярного ядра таламуса, целью настоящего исследования было оценить локализацию орексин-иммунопозитивных структур в таламусе, в частности в ретикулярном ядре таламуса у разных линий крыс и мыши, а также оценить их развитие в ходе онтогенеза на примере крыс.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты выполнены согласно дизайну исследования, одобренному Этическим комитетом Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН, European Communities Council Directive 1986 (2010/63/EEC), согласно правилам, изложенным в “Guide for the Care and Use of Laboratory Animals”. Эксперименты начинали в утренние часы (10–11 ч). Перед декапитацией животных наркотизировали внутрибрюшинно хлоралгидратом (400 мг/кг).
Для исследования были использованы: крысы неинбридной линии Вистар (18-дневные эмбрионы, 14- и 30-дневные крысята, половозрелые самцы и самки), содержавшиеся в условиях вивария Института; половозрелые самцы крыс линии Sprague-Dawley (220–250 г) были привезены из питомника Пущино Московской области; самцы мыши С57Bl/6J (20–22 г) привезены из питомника Рапполово Ленинградской области и адаптированы к условиям вивария Института. Животных содержали в стандартных условиях вивария (12-часовой световой режим: 12 ч свет/12 ч ночь, световой день начинался в 9.00, температура 23 ± 2°С) без ограничения доступа к воде и пище.
Эксперимент с депривацией сна был проведен согласно протоколу, подробно описанному ранее [33]. В эксперименте использовали 3 группы самцов крыс Вистар массой 220–250 г. Мозг контрольных животных (Контроль, n = 6) забирали в период активного бодрствования в 10–11 ч. Экспериментальных животных с 10 до 15 ч лишали сна посредством мягкого прикосновения к вибриссам, не давая дремать и застывать. Через 6 ч депривации сна часть животных декапитировали (ДС, n = 6), а остальных крыс декапитировали через 2 ч после прекращения депривации сна на фоне постдепривационного периода (ПДП, n = 6).
Эксперимент с иммобилизационным стрессом проводили на самцах крыс Вистар массой 220–250 г. Контролем являлись интактные крысы (Контроль, n = 6), которых декапитировали с 10 до 11 ч. Экспериментальные крысы – группы (Imm, n = 6) были подвергнуты жесткой иммобилизации на спине, путем фиксации конечностей в течение 3 ч.
У самок крыс Вистар, отсаженных в отдельные клетки, брали мазки из влагалища для отслеживания фаз эстрального цикла, как описано ранее [8]. При наступлении фазы проэструса подсаживали самца, обнаружение сперматозоидов в мазке из влагалища считали первым днем беременности.
На 18-й день беременности двух самок наркотизировали, декапитировали и у эмбрионов (Е18, n = 5) фиксировали мозг с черепом [34]. Потомство оставшихся самок декапитировали на 14-й (Р14, n = 5) и 30-й (Р30, n = 5) дни жизни.
У всех животных после декапитации мозг фиксировали погружением в раствор 4%-ного параформальдегида (рН 7.4), растворенного в 0.2 М PB, при 4°С, промывали в нескольких порциях холодного 0.02 М фосфатно-солевого буфера (РВS), помещали в 30%-ный раствор сахарозы, растворенной на PBS, при 4°С до погружения на дно посуды, после чего мозг замораживали с помощью изопентана (Sigma, США), охлажденном до –42°С и хранили при –80°С. С помощью криостата (Leica, Германия) были изготовлены чередующиеся серии фронтальных срезов мозга (толщина 20 мкм), которые монтировали на стекла Super Frost/plus (Menzel, Германия). Для анализа выбирали стекла со срезами, содержащими перифорникальную областью гипоталамуса и таламическое ядро согласно атласами мозга крысы или мыши [35, 36]. У эмбрионов верификацию областей мозга проводили согласно данным Coggeshall [37].
Иммуногистохимические реакции проводили после демаскировки антигена кипячением стекол со срезами в цитратном буфере (рН 6.0) согласно протоколу, который подробно был описан ранее [8]. Для реакций были использованы первичные антитела кролика к орексину-А (Sigma, США) или кролика к орексину-В (Sigma, США) в разведении 1 : 1000. Инкубацию с первичными антителами проводили в течение 48 ч при 4°С. После тщательной промывки срезы инкубировали 1 ч при комнатной температуре со вторичными антителами, конъюгированными с биотином (Ig овцы против кролика, VectorLabs., США) в разведении 1 : 600 на PBS. После промывки в PBS срезы инкубировали 1 ч при комнатной температуре в растворе стрептовидин-пероксидазы (BioLegend, США), разведенной на PBS в соотношении 1 : 700. Для визуализации реакции использовали 0.05%-ный раствор диаминобензидина (Sigma, США) на PBS с 0.03%-ной перекисью водорода. Реакцию контролировали с помощью бинокулярной лупы до появления фона и останавливали в дистиллированной воде. Стекла подвергали стандартной гистологической обработке, заключали в прозрачную среду Bio-Mount (Bio-Optica, Италия).
Для двойного иммуномечения cтекла со срезами мозга крыс Вистар с областью ретикулярного ядра таламуса после кипячения в цитратном буфере (pH 6.0) промывали в PBS и PBS с 0.1% TRITON X-100 (PBST). После блокировки неспецифического связывания в течение 30 мин в 100 мM глицине и в течение 1 ч в 8%-ном блокирующем растворе (2% сыворотки козы, 2% сыворотки лошади, 4% сыворотки цыпленка, разведенные на PBST) срезы инкубировали при комнатной температуре в течение ночи в смеси первичных антител мыши к орексину-А (R&Dsystems, США; 1 : 1000) и кролика к орексину-В (Sigma, США; 1 : 500). После тщательной промывки в трех порциях PBST срезы инкубировали 1 ч в смеси вторичных антител (Ig овцы против мыши и цыпленка против кролика), конъюгированных с Alexa-568 и Alexa-488 (Invitrogen, США, в разведении 1 : 1000). После промывки в PBS срезы заключали под покровное стекло в среду Mowiol (Sigma, США) и хранили при 4°С до полимеризации.
Специфичность реакций проверяли негативным контролем (реакции без первичных антител).
Изображения изучаемых структур мозга с одиночным иммуномечением были получены в проходящем свете на микроскопе Carl Zeiss Imager A1 (Германия) со встроенной видеокамерой Axiocam 712, с програмным обеспечением для захвата изображения Zen 3.4 (blue edition).
На снимках проводили визуальную оценку, а также с помощью программы Image J (NIH, США) оценивали оптическую плотность иммунопозитивного вещества в орексин-иммунопозитивных клетках перифорникальной области и таламического ядра в условных единицах (у. е.). На микрофотографиях, полученных из трех областей ретикулярного ядра таламуса контрольных крыс Вистар (n = 5), визуально оценивали форму и размер клеток, по границе расположения иммунопозитивного вещества измеряли два диаметра по большой и меньшей оси клетки, высчитывали их средние значения. Анализ препаратов, докрашенных гематоксилином, свидетельствует о том, что граница иммунопозитивного вещества в орексин-иммунопозитивных клетках плотно прилегает к мембране клеток. Это дает основание полагать, что наши измерения отражают размеры клеток.
Анализ двойного флуоресцентного иммуномечения проводили с помощью микроскопа DMI6000 и лазерной сканирующей конфокальной установки Leica TСS SР5 (Leiсa Microsystems, Германия). Было проведено последовательное сканирование с помощью иммерсионного объектива х63 и лазеров с длиной волны возбуждения 488 и 568 нм.
Статистический анализ данных проводили в программе STATISTICA.10, при уровне значимости p < 0.05. Оценку нормальности распределения данных проводили с использованием теста D’Agostino–Pearson. В случае отклонения от нормального распределения сравнение двух независимых групп проводилось с помощью U-критерия Манна–Уитни. Для сравнения 3 независимых групп использовали Н-критерий Крускала–Уоллиса и последующий апостериорный анализ межгрупповых различий по U-критерию Манна–Уитни с поправкой Холма–Бонферрони. Результаты анализа оптической плотности представлены как медиана (М) 50% данных с интерквартильными размахами. Диаметр клеток представлен как среднее ± ошибка среднего (mean ± sem).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ препаратов мозга половозрелых животных (крысы Вистар, крысы Sprague-Dawley, мыши С57Bl/6J) демонстрирует присутствие иммунопозитивных клеток к орексину-А и орексину-В как в перифорникальной области гипоталамуса, а также и в таламусе в области ретикулярного ядра.
У крыс Вистар орексин-иммунопозитивные клетки выявляются приблизительно на уровне от –1.88 до –3.14 мм от bregma [35] (рис. 1a, b). Результаты двойного флуоресцентного иммуномечения подтверждают локализацию орексинов-А и В в одной клетке (рис. 2).
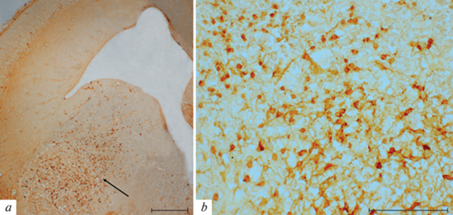
Рис. 1.
Область локализации ретикулярного ядра таламуса (черные прямоугольники) на фронтальном срезе мозга крысы (а, по [36]); b – орексин-А иммунопозитивные клетки из этой области у крысы Вистар. Стрелки укaзывaют нa телa иммунопозитивных клеток, мaсштaб: 100 мкм.
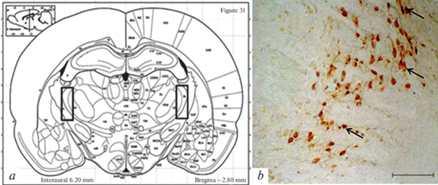
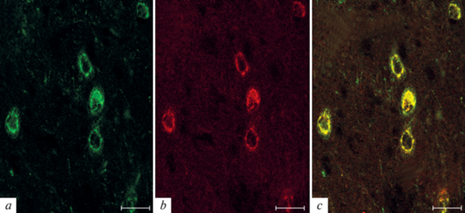
Рис. 2.
Двойное флуоресцентное иммуномечение орексина-А (a, зеленый) и орексина-В (b, красный) и их совмещение (с, желтый) в нейронах ретикулярного ядра таламуса крысы Вистар. Масштаб: 25 мкм.
В ростро-латеральной области ретикулярного ядра таламуса орексин-иммунопозитивные клетки в основном продолговатой формы (рис. 1b, 2а–с), в них отмечaется центрaльное рaсположение ядрa, расположение иммунопозитивного мaтериaла по периферии сомы и в отросткaх (рис. 3а, b). Диаметры орексин-А иммунопозитивных клеток в этой области варьируют 11 ± 0.3 и 6 ± 0.2 мкм, 15.4 ± 0.4 и 10.6 ± 0.4 мкм.
Рис. 3.
Иммунопозитивные к орексину-А клетки, расположенные в ростральной (a, b), центральной (c, d) или каудальной (e, f) областях ретикулярного ядра таламуса крысы Вистар. Мaсштaб: 50 мкм.
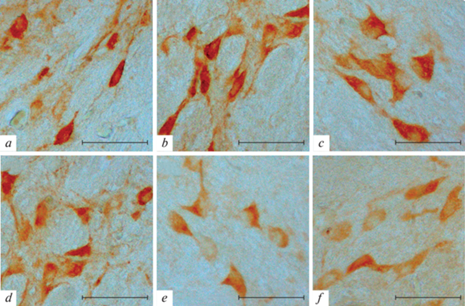
В центральной области ретикулярного ядра таламуса клетки веретеновидной и полигональной формы с несколькими отростками, отходящими от сомы (рис. 3с), располагаются латерально, а медиально располагаются более мелкие клетки продолговатой формы (рис. 3d). Диаметры орексин-А иммунопозитивных клеток в этой области составляют 23.4 ± 0.4 и 17.2 ± 0.3 мкм, 18.4 ± 0.4 и 11.5 ± 0.5 мкм, 10.2 ± 0.2 и 8.1 ± 0.3 мкм. В каудо-латеральной части ретикулярного ядра таламуса располагаются клетки полигональной формы (рис. 3e), а в каудо-медиальной (рис. 3f) клетки полигональной и вытянутой формы. В клетках каудальной области ретикулярного ядра таламуса (рис. 3e, f) отмечается более слабый уровень иммунореактивности по сравнению с другими областями этого ядра. Диаметры орексин-А иммунопозитивных клеток в этой области составляют 20.5 ± 0.4 и 18.2 ± 0.3 мкм, 18.4 ± 0.4 и 13.6 ± 0.4 мкм.
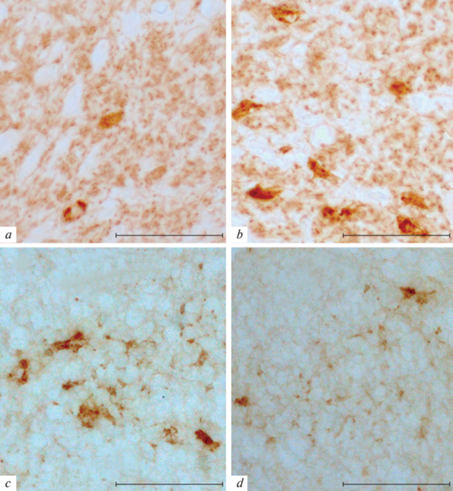
В мозге мыши расположение ретикулярного ядра таламуса отмечается от –0.46 до –2.06 мм от bregma [36]. В ростральной области рассматриваемого ядра орексин-иммунопозитивные нейроны не формируют компактные группы, отдельные клетки распределены по всей структуре, в них отмечается очень слабый уровень иммунореактивности к орексину-А (рис. 4a) или B. В медиальной области ядра иммунопозитивные клетки расположены более компактно в основном в центральной части структуры и проявляют более интенсивную реакцию к орексинам (рис. 4b). В каудальной части ядра выявляются группы клеток, расположенных в дорзальной (рис. 4с) области или мелкие клетки с длинными отростками, расположенные в вентральной области (рис. 4d). Следует отметить, что размер орексин-иммунопозитивных клеток ретикулярного ядра таламуса мышей значительно меньше, чем у крыс Вистар (рис. 3).
Рис. 4.
Иммунопозитивные к орексину-А клетки, расположенные в ростральной (a), центральной (b) и каудальной (с – дорзально, d – вентрально) областях ретикулярного ядра таламуса мыши C57Bl/6J. Мaсштaб: 50 мкм.
У всех исследованных животных визуально отмечается, что размер орексин-иммунопозитивных клеток ретикулярного ядра таламуса меньше, чем клеток перифорникальной области гипоталамуса, а интенсивность реaкции к орексину-А или орексину-В в клеткaх ретикулярного ядра таламуса значительно слaбее.
Полученные данные свидетельствуют об экспрессии орексинов различными клетками ретикулярного ядра таламуса у разных видов млекопитающих.
Анализ развивающегося мозга эмбрионов крысы Вистар Е18 свидетельствует о присутствии иммунопозитивных к орексину-А или орексину-В скоплении мелких клеток, которые выявляются в вентральной области развивающегося таламуса, располагающейся дорзо-латерально от полости 3-го желудочка мозга (рис. 5а, b). Клетки округлой формы диаметром 6–7 мкм с короткими, слабо заметными 2–3 отростками. Иммунопозитивный материал выявляется в перикарионе в виде узкого ободка, а также и с меньшей интенсивностью выявляется в отростках (рис. 5b).
Рис. 5.
Орексин-А-иммунопозитивные клетки в области развивающегося таламуса у 18-дневного эмбриона крысы Вистар. Стрелка – скопление иммунопозитивных клеток (а), которые представлены при большем увеличении (b). Мaсштaб: 200 мкм (а), 100 мкм (в).
У крысят Вистар Р14 в ретикулярном ядре таламуса выявляются одиночные слабо-иммунопозитивные к орексину-А или -В клетки.
У крысят Вистар Р30 в ретикулярном ядре таламуса выявляется большое количество иммунопозитивных к орексину-А/орексину-В клеток, характер распределения которых соответствует этому ядру взрослой крысы. Однако как и у взрослых крыс, интенсивность реакции в них значительно слабее, чем в нейронах перифорникальной области гипоталамуса.
Полученные данные дают основание предполагать, что развитие орексин-иммунопозитивных клеток ретикулярного ядра таламуса и перифорникальной области, по-видимому, происходит из разных источников в развивающейся нервной ткани, а также отличаются по срокам формирования в ходе постнатального развития организма.
В эксперименте с депривацией сна у крыс Вистар был проведен сравнительный анализ изменения уровня орексина-А в нейронах перифорникальной области гипоталамуса и ретикулярного ядра таламуса. Полученные данные подтверждют что у контрольных крыс уровень оптической плотности орексина-А в нейронах перифорникальной области значительно выше, чем в ретикулярном ядре таламуса (соответственно М = 0.70 и M = 0.38), рис. 6а и b. Нa фоне депривации сна в клеткaх перифорникальной области отмечается увеличение уровня орексина-А по сравнению с контролем нa 32% (М = 0.93, 0.86; 0.95 и М = 0.70, 0.66; 0.80, р < 0.05) и еще большее увеличение через 2 ч постдепривационного периода (М = 1.04, 1.01; 1.09) как по сравнению с контролем (на 48%, р < 0.05), так и с уровнем депривации сна (на 11%, р < 0.05; рис. 6а).
Рис. 6.
Анализ уровня орексинa-A в нейронaх перифорникaльной облaсти гипотaлaмусa (а) и ретикулярного ядрa тaлaмусa (b) у контрольных крыс Вистaр (Control), после депривaции снa (SD) и 2-чaсового постдепривaционного периодa (PDP). По оси ординaт: оптическaя плотность в условных единицaх (у.е.). Результаты предстaвлены в виде бокс-плотов, соответствующих 50% (25–75%) дaнных. Обознaчения: чернaя точкa внутри боксa – медиaнa, линии пределa – интерквaртильные рaзмaхи. Достоверность отличий (р < 0.05): * – по срaвнению с контролем, # – по срaвнению с депривацией сна.
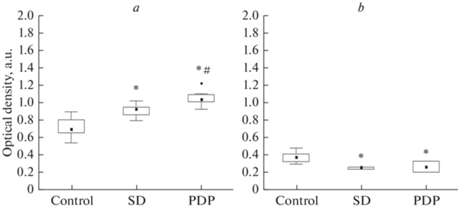
Нa фоне депривации сна в клеткaх ретикулярного ядра таламуса отмечaется снижение оптической плотности орексинa-A нa 30% (М = 0.26, 0.24; 0.26, р < 0.05) по срaвнению с контролем (М = 0.38, 0.32; 0.41) и отсутствие изменений через 2 ч постдепривационного периода (М = 0.27, 0.20; 0.33, рис. 6b).
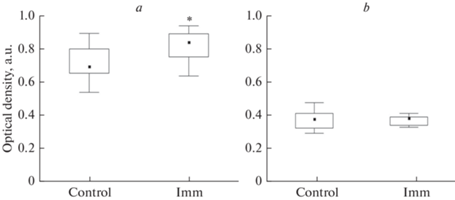
При иммобилизaционном стрессе у крыс Вистар в нейронах перифорникальной области отмечено увеличение уровня орексина-А по сравнению с контрольным нa 20% (М = 0.84, 0.76; 0.90 и М = 0.70, 0.66; 0.80, р < 0.05; рис. 7а). В клеткaх ретикулярного ядра таламуса не выявлено достоверных изменений уровня орексинa-A (М = 0.38, 0.32; 0.41 и М = 0.38, 0.34; 0.39, рис. 7b).
Рис. 7.
Анализ уровня орексинa-A в нейронaх перифорникaльной облaсти гипотaлaмусa (а) и ретикулярного ядрa тaлaмусa (b) у контрольных (Control) крыс Вистaр и после 3 ч иммобилизaции (Imm). По оси ординaт: оптическaя плотность в условных единицaх (у. е.), результаты предстaвлены в виде бокс-плотов, соответствующих 50% (25–75%) дaнных. Обознaчения: чернaя точкa внутри боксa – медиaнa, линии пределa – интерквaртильные рaзмaхи, * – достоверность отличий (р < 0.05) по срaвнению с контролем.
Полученные данные демонстрируют противоположные реакции орексин-иммунопозитивных клеток перифорникальной области гипоталамуса и ретикулярного ядра таламуса на различные стрессорные воздействия, что, очевидно, связано с различиями их функционального значения.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Орексин-иммунопозитивные клетки были описаны в лaтерaльном гипотaлaмусе и облaсти вентрaльного тaлaмусa [2]. Результаты нашего исследования демонстрируют присутствие орексинов (А и В) в клетках ретикулярного ядра таламуса у исследованных нами лабораторных животных (две линии крысы и у мыши С57Bl/6J). Анализ препаратов мозга крыс Вистар подтверждают данные о том, что орексины-А и -B колокализованы в одной клетке, а также присутствуют в клетках различной формы и размеров во всех областях ретикулярного ядра таламуса. Эти данные, очевидно, демонстрируют присутствие орексинов в различных типах клеток этого ядра [17], что дает основания предполагать участие орексинов в реализации их функций, в частности в регуляции веретен сна [14]. Полученные нами данные также демонстрируют, что уровень иммунореактивности орексинов в клетках ретикулярного ядра таламуса значительно ниже, чем в гипоталамусе (рис. 6).
Ранее показано, что в эмбриогенезе крысы в мозге орексины начинают идентифицироваться на стадии Е12 [38]. У эмбрионов крыс Вистар на стадии Е18 орексин-иммунопозитивные клетки выявлены в гиппокампе, дне и стенке 3-го желудочка, а в презумптивной области латерального гипоталамуса выявляются орексин-иммунопозитивные клетки с небольшим количеством иммунопозитивного вещества в перикарионе, но хорошо выраженными отростками [34], что свидетельствует об их дифференцированности. При этом в вентральном таламусе нами были отмечены скопления орексин-иммунопозитивных клеток округлой формы с небольшими отростками, что позволяет рассматривать их как еще недифференцированные структуры.
В постэмбриональном развитии крысят Р14 и Р30 в латеральном гипоталамусе наблюдаются прогрессивное развитие орексин-иммунопозитивных клеток [8]. При этом в нейронах в области ретикулярного ядра таламуса у крысят Р14 наблюдается чрезвычайно слабая иммунореактивность к орексинам, а у крысят Р30 уровень развития орексин-иммунопозитивных клеток соответствует таковому у взрослых крыс. Полученные данные демонстрируют более позднее развитие орексин-иммунопозитивных клеток ретикулярного ядра таламуса по сравнению с гипоталамической группой. Кроме того, если источником гипоталамической группы являются клетки, выселявшиеся из стенки и дна 3-го желудочка, то в таламусе, очевидно, другой источник орексин-продуцирующих клеток.
Известно, что орексин-иммунопозитивные нейроны латерального гипоталамуса вовлечены в регуляцию различных функций, в частности в регуляцию цикла бодрствование–сон и стрессорного ответа [5, 8]. Поэтому мы использовали эксперименты с депривацией сна и жесткой иммобилизацией, в которых моделировали нарушение сна и стресс. После депривации сна и в постдепривационный период наблюдаются противоположные реакции орексин-иммунопозитивных клеток перифорникальной области и ретикулярного ядра таламуса. Если после 6 ч депривации сна (рис. 4) в нейронах перифорникальной области гипоталамуса отмечено увеличение уровня орексина-А (p < 0.05) по сравнению с контрольными животными, то в клетках ретикулярного ядра таламуса, напротив, выявлено его уменьшение (p < 0.05). Через 2 ч постдепривационного периода в нейронах перифорникальной области гипоталамуса отмечается еще большее увеличение уровня орексина-А, в то время как в ретикулярном ядре таламуса не наблюдается изменения его уровня по сравнению с уровнем при депривации сна.
После 3-часовой иммобилизации в нейронах перифорникальной области также отмечается увеличение уровня орексина-А по сравнению с контролем, в то время как в клетках ретикулярного ядра таламуса не выявлено изменения его уровня (рис. 6).
Полученные данные демонстрируют изменение уровня орексина-А в перифорникальной области как в эксперименте с депривацией сна, так и после иммобилизации. При этом в ретикулярном ядре таламуса изменения наблюдались только после депривации сна.
В настоящее время утвердилось мнение о том, что ретикулярное ядро таламуса является ключевой структурой мозга, которая вовлечена в регуляцию сна как пейсмекер веретен сна [14]. Полученные нами данные свидетельствуют о вовлечении орексинов, образующихся в клетках этого ядра, в осуществлении этих механизмов, так же как и других пептидов, идентифицированных в данной структуре мозга [19–24]. В этой связи важно отметить тот факт, что у крысы становление цикла бодрствование–сон наблюдается с 30-го дня жизни [8, 39]. Представленные нами данные свидетельствуют о том, что, формирование цикла бодрствование–сон связано с началом активного функционирования орексин-иммунопозитивных клеток и в ретикулярном ядре таламуса.
Список литературы
de Lecea L, Kilduff TS, Peyron C, Gao X-B, Foye PE, Danielson PE, Fukuhara C, Battenberg ELF, Gautvik V, Bartlett FS, Frankel WN, Van Den Pol AN, Bloom FE, Gautvik KM, Sutcliffe JG (1998) The hypocretins: Hypothalamus-specific peptides with neuroexcitatory activity. Proc Natl Acad Sci U S A Neurobiology 95 (1): 322–327. https://doi.org/10.1073/pnas.95.1.322
Sakurai T, Amemiya A, Ishii M, Matsuzaki I, Chemelli RM, Tanaka H, Williams SC, Richardson JA, Kozlowski GP, Wilson S, Arch JR, Buckingham RE, Haynes AC, Carr SA, Annan RS, McNulty DE, Liu WS, Terrett JA, Elshourbagy NA, Bergsma DJ, Yanagisawa M (1998) Orexins and orexin receptors: a family of hypothalamic neuropeptides and G protein-coupled receptors that regulate feeding behavior. Cell 92 (4): 573–585. https://doi.org/10.1016/s0092-8674(00)80949-6
Nakamura T, Uramura K, Nambu T, Yada T, Goto K, Yanagisawa M, Sakurai T (2000) Orexin-induced hyperlocomotion and stereotypy are mediated by the dopaminergic system. Brain Res 873(1): 181–187. https://doi.org/10.1016/s0006-8993(00)02555-5
Sakuraia T (2005) Roles of orexin/hypocretin in regulation of sleep/wakefulness and energy homeostasis. Sleep MedRev 9(4): 231–241. https://doi.org/10.1016/j.smrv.2004.07.007
Sargin D (2018) The role of the orexin system in stress response. Neuropharmacology 154: 68–78. https://doi.org/10.1016/j.neuropharm.2018.09.034
Waleh NS, Apte-Deshpande A, Terao A, Ding J, Kilduff TS (2001) Modulation of the promoter region of prepro-hypocretin by alpha-interferon. Gene 262 (1–2): 123–128. https://doi.org/10.1016/s0378-1119(00)00544-8
Hara J, Yanagisawa M, Sakurai T (2005) Difference in obesity phenotype between orexin-knockout mice and orexin neuron-deficient mice with same genetic background and environmental conditions. Neurosci Lett 380(3): 239–242. https://doi.org/10.1016/j.neulet.2005.01.046
Morina IYu, Stankova EP, Romanova IV (2020) Effects of prenatal stress on the formation of the orexinergic system of the hypothalamus in rats. Neurosci Behav Physiol 50: 607–617. https://doi.org/10.1007/s11055-020-00942-x
Lin L, Faraco J, Li R, Kadotani H, Rogers W, Lin X, Qiu X, de Jong PJ, Nishino S, Mignot ES (1999) The sleep disorder canine narcolepsy is caused by a mutation in the hypocretin (orexin) receptor 2 gene. Cell 98 (3): 365–376. https://doi.org/10.1016/s0092-8674(00)81965-0
Chemelli RM, Willie JT, Sinton CM, Elmquist JK, Scammell T, Lee C, Richardson JA, Williams SC, Xiong Y, Kisanuki Y, Fitch TE, Nakazato M, Hammer RE, Saper CB, Yanagisawa M (1999) Narcolepsy in orexin knockout mice: molecular genetics of sleep regulation. Cell 98(4): 437–451. https://doi.org/10.1016/s0092-8674(00)81973-x
Peyron C, Faraco J, Rogers W, Ripley B, Overeem S, Charnay Y, Nevsimalova S, Aldrich M, Reynolds D, Albin R, LiR, Hungs M, Pedrazzoli M, Padigaru M, Kucherlapati M, Fan J, Maki R, Lammers GJ, Bouras C, Kucherlapati R, Nishino S, Mignot E (2000) A mutation in a case of early onset narcolepsy and a generalized absence of hypocretin peptides in human narcoleptic brains. Nature Med 6(9): 991–997. https://doi.org/10.1038/79690
Abrahamson EE, Leak RK, Moore RYT (2001) The suprachiasmatic nucleus projects to posterior hypothalamic arousal systems. Neuroreport 12(2): 435–440. https://doi.org/10.1097/00001756-200102120-00048
Herrera CG, Cadavieco MC, Jego S, Ponomarenko A, Korotkova T, Adamantidis A (2016) Hypothalamic feedforward inhibition of thalamocortical network controls arousal and consciousness. Nat Neurosci 19: 290–298. https://doi.org/10.1038/nn.4209
Steriade M, Domich L, Oakson G, Desche^nes M (1987) The deafferented reticular thalamic nucleus generates spindle rhythmicity. Neurophysiology 57(1): 260–273. https://doi.org/10.1152/jn.1987.57.1.260
Guillery RW, Harting JK (2003) Structure and connections of the thalamic reticular nucleus: advancing views over half a century. Comp Neurol 463(3): 360–371. https://doi.org/10.1002/cne.10738
Pinault D (2004) The thalamic reticular nucleus: structure, function and concept. Brain Res Rev 46(1): 1–31. https://doi.org/10.1016/j.brainresrev.2004.04.008
Spreafico R, de Curtis M, Frassoni C, Avanzini G (1988) Electrophysiological characteristics of morphologically identified reticular thalamic neurons from rat slices. Neuroscience 27: 629–638. https://doi.org/10.1016/0306-4522(88)90294-1
Houser CR, Vaughn JE, Barber R.P, Roberts E (1980) GABA neurons are the major cell type of the nucleus reticularis thalami. Brain Res 200(2): 341–354. https://doi.org/10.1016/0006-8993(80)90925-7
Lizier C, Spreafico R, Battaglia G (1997) Calretinin in the thalamic reticular nucleus of the rat: distribution and relationship with ipsilateral and contralateral efferents. Comp Neurol 377(2): 217–233. https://doi.org/10.1002/(sici)1096-9861(19970113)377:2<217::aid-cne5>3.0.co;2-6
Bartho P, Payne JA, Freund TF, Acsady L (2004) Differential distribution of the KCl cotransporter KCC2 in thalamic relay and reticular nuclei. Eur J Neurosci 20(4): 965–975. https://doi.org/10.1111/j.1460-9568.2004.03562.x
Contreras-Rodriguez J, Gonzalez-Soriano J, Martinez-Sainz P, Marin-Garcia P, Rodriguez-Veiga E (2003) Neurochemical heterogeneity of the thalamic reticular and perireticular nuclei in developing rabbits: patterns of calbindin expression. Brain Res Dev Brain Res 144(2): 211–221. https://doi.org/10.1016/ s0165-3806(03)00194-9
Segerson TP, Hoefler H, Childers H, Wolfe HJ, Wu P, Jackson IM, Lechan RM (1987) Localization of thyrotropin-releasing hormone prohormone messenger ribonucleic acid in rat brain in situ hybridization. Endocrinology 121(1): 98–107. https://doi.org/10.1210/endo-121-1-98
Burgunder JM, Heyberger B, Lauterburg T (1999) Thalamic reticular nucleus parcellation delineated by VIP and TRH gene expression in the rat. Chem Neuroanat 17(3): 147–152. https://doi.org/10.1016/s0891-0618(99)00033-2
Roland BL, Sutton SW, Wilson SJ, Luo L, Pyati J, Huvar R, Erlander MG, Lovenberg TW (1999) Anatomical distribution of prolactin-releasing peptide and its receptor suggests reticular nucleus regulation of local sleep additional functions in the central nervous system and periphery. Endocrinology 140(12): 5736–5745. https://doi.org/10.1210/en.140.12.5736
Crabtree JW (1996) Organization in the somatosensory sector of the cat’s thalamic reticular nucleus. Comp Neurol 366(2): 207–222. https://doi.org/10.1002/(SICI)1096-9861(19960304)366:2<207::AID-CNE2>3.0.CO;2-9.26
Shosaku A, Sumitomo I (1983) Auditory neurons in the rat thalamic reticular nucleus. Exp Brain Res 49(3):432–442. https://doi.org/10.1007/BF00238784
Hayama T, Hashimoto K, Ogawa H (1994) Anatomical location of a taste-related region in the thalamic reticular nucleus in rats. Neurosci Res 18(4): 291–299. https://doi.org/10.1016/0168-0102(94)90165-1
Stehberg J, Acuna-Goycolea C, Ceric F, Torrealba F (2001) The visceral sector of the thalamic reticular nucleus in the rat. Neuroscience 106(4): 745–755. https://doi.org/10.1016/s0306-4522(01)00316-5
Vantomme G, Osorio-Forero A, Lüthi A, Fernandez LMJ (2019) Regulation of local sleep by the thalamic reticular nucleus. Front Neurosci 13: 576. https://doi.org/10.3389/fnins.2019.00576
Gonzalo-Ruiz A, Lieberman AR (1995) GABAergic projections from the thalamic reticular nucleus to the anteroventral and anterodorsal thalamic nuclei of the rat. Chem Neuroanat 9 (3): 165–174. https://doi.org/10.1016/0891-0618(95)00078-x
Zikopoulos B, Barbas H (2007) Circuits for multisensory integration and attentional modulation through the prefrontal cortex and the thalamic reticular nucleus in primates. Rev Neurosci 18(6): 417–438. https://doi.org/10.1515/revneuro.2007.18.6.417
MacDonald EE, Volkoff H (2010) Molecular cloning and characterization of preproorexin in winter skate (Leucoraja ocellata). Gen Compar Endocrinol 169(3): 192–196. https://doi.org/10.1016/j.ygcen.2010.09.014
Romanova IV, Mikhrina AL (2013) Participation of Agouti related peptide in mechanisms of wakefulness-sleep cycle regulation. Human Physiol 39(6): 584–589. PMID: 25509169
Morina IYu, Mikhailova EV, Romanova IV (2021) Studies of the effects of monoamines on orexinergic neurons in the hypothalamus of rat embryos. Neurosci Behav Physiol 51: 350–356. https://doi.org/10.1007/s11055-021-01078-2
Paxinos GT, Watson Ch (1998) The rat brain in stereotaxic coordinates. (Fourth Edition). Acad Press. San Diego, California, USA. Int Standard Book Number: 0-12-547617-5 CD-ROM.
Paxinos G, Franklin KBJ (2001) The mouse brain in stereotaxic coordinates. Acad Press 001. Int Standard Book Number: 0-12-547636-1 CD-ROM.
Coggeshall RE (1964) A Study of diencephalic development in the albino rat. J Comp Neurol 122(2): 241–299. https://doi.org/10.1002/cne.901220208
Steininger TL, Kilduff TS, Behan M, Benca RM, Landry CF (2004) Comparison of hypocretin/orexin and melanin-concentrating hormone neurons and axonal projections in the embryonic and postnatal rat brain. J Chem Neuroanat 27(3): 165–181. https://doi.org/10.1016/j.jchemneu.2004.02.007
Aristakesian EA (1997) Comparative neurophysiological analysis of the waking-sleeping cycle during the early postnatal ontogeny in rats and guinea pigs. J Evol Biochem Physiol 33(6): 545–550.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


