Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 7, стр. 807-835
Вторичная дисфункция энтерогематического барьера в патогенезе осложнений острых экзогенных отравлений
Ю. Ю. Ивницкий 1, Т. В. Шефер 2, *, В. Л. Рейнюк 1, О. А. Вакуненкова 1
1 Научно-клинический центр токсикологии им. академика С.Н. Голикова
Федерального медико-биологического агентства
Санкт-Петербург, Россия
2 Государственный научно-исследовательский испытательный институт военной медицины Министерства обороны Российской Федерации
Санкт-Петербург, Россия
* E-mail: schafer@yandex.ru
Поступила в редакцию 11.04.2022
После доработки 23.05.2022
Принята к публикации 24.05.2022
- EDN: KFPJSM
- DOI: 10.31857/S0869813922070020
Аннотация
Последнее десятилетие ознаменовано экспоненциальным ростом числа публикаций, посвященных физиологической роли нормальной микробиоты желудочно-кишечного тракта человека. Представление о симбиотической связи человека с нормальной микробиотой его желудочно-кишечного тракта утвердилось как неотъемлемая часть медико-биологической парадигмы. Однако тип этого симбиоза варьирует от мутуализма до паразитизма и зависит от функционального состояния организма хозяина. Повреждение последнего внешними агентами может вести к возникновению у нормальной кишечной микробиоты условно патогенных свойств, опосредованных гуморальными факторами и влияющих на исход экзогенного воздействия. Неопределенное число веществ, продуцируемых нормальной кишечной микробиотой человека, обладает системной токсичностью. Некоторые из них кишечный химус содержит в количествах, которые, при быстром поступлении таких веществ в кровь, обеспечивают формирование в ней их потенциально летальных концентраций. Этому препятствует энтерогематический барьер – система структурных элементов, разделяющих кишечный химус и кровь. Его повреждение экзогенными токсикантами, обозначенное в настоящем обзоре как вторичная дисфункция энтерогематического барьера, может спровоцировать системное перераспределение токсичных веществ бактериального происхождения. До недавних пор влияние такого перераспределения на исход острых экзогенных отравлений оставалось вне фокуса внимания токсикологии. В настоящем обзоре исследованы причинно-следственные связи между вторичной дисфункцией энтерогематического барьера и осложнениями острых отравлений. Детализирована острая системная токсичность продуктов жизнедеятельности нормальной кишечной микрофлоры: аммиака и эндотоксина. Показана их вовлеченность в формирование ряда осложнений острых отравлений: шока, сепсиса, церебральной недостаточности и повреждений легких. Кратко изложены принципы оценки функционального состояния энтерогематического барьера и подходы к профилактике осложнений острых отравлений, основанные на роли энтерогематического барьера в их патогенезе.
Юридический анализ причин смерти пациента предполагает выбор из четырех возможностей: несвоевременное, неправильное, недостаточное оказание медицинской помощи или отсутствие ее связи с исходом заболевания [1]. Один из источников ошибок при таком выборе – непредсказуемость осложнений острых заболеваний, ярко проявившаяся во время эпидемии COVID-19 [2]. Непредсказуемость присуща и осложнениям острых отравлений: острые расстройства кровообращения, сепсис, вторичные острые повреждения легких и острая церебральная недостаточность осложняют их не у всех пациентов. Причины этой индивидуальной вариабельности требуют детализации.
Ранее мы показали, что при острых отравлениях вероятность летальных осложнений зависит от функционального состояния сосудистого эндотелия [3]. Некоторые повреждающие его вещества продуцирует нормальная микробиота кишечника [4]. Основываясь на концепции, согласно которой организм человека – экосистема, частью которой является кишечная микробиота [5, 6], эти вещества далее рассматриваются как эндогенные. У здоровых людей способность таких веществ преодолевать энтерогематический барьер – систему структурных элементов, разделяющих кишечный химус и кровь, – незначительна, а их латентная утечка ведет к ряду хронических заболеваний [4, 6]. При легких экзогенных отравлениях эффекты эндогенных веществ кишечного происхождения могут затмеваться прямым токсическим действием ксенобиотика. Однако их массированное поступление в кровь при тяжелых экзогенных отравлениях может отягощать состояние организма и вовлекаться в патогенез осложнений.
Прямое или косвенное повреждение ксенобиотиком энтерогематического барьера, далее именуемое его вторичной дисфункцией, может провоцировать поступление в кровоток метаболитов и клеточных компонентов бактерий в дозах, влияющих на исход острого экзогенного отравления. A priori состав смеси этих веществ зависит от состава кишечной микробиоты, который индивидуально вариабелен [5], а согласно некоторым оценкам [7], даже уникален. Эта вариабельность может лежать в основе стохастичности осложнений острых отравлений.
Накоплен большой массив данных, характеризующих влияние ксенобиотиков на энтерогематический барьер. Имеются и многочисленные данные о вовлеченности токсичных веществ кишечного происхождения в патогенез критических состояний организма. Это позволяет впервые проследить связь между вторичной дисфункцией энтерогематического барьера и некоторыми осложнениями острых отравлений. Такая связь явилась предметом настоящего обзора.
Целью обзора явилось выявление путей профилактики осложнений острых отравлений на основе идентификации роли вторичной дисфункции энтерогематического барьера в их патогенезе.
ОСНОВНЫЕ ТЕРМИНЫ, ОПРЕДЕЛЕНИЯ И АББРЕВИАТУРЫ
Бактериальные метаболиты малой молекулярной массы – вещества с молекулярной массой менее 1500 Да, продуцируемые бактериями.
Бактериальные экзотоксины – токсичные протеины и пептиды, выделяемые живой бактерией во внешнюю среду.
Вторичная дисфункция энтерогематического барьера – нарушение функции энтерогематического барьера, вызванное внешним воздействием.
Гематоэнцефалический барьер (ГЭБ) – система структурных элементов, разделяющих кровь и центральную нервную систему (ЦНС).
Ксенобиотик – чужеродное вещество.
Первичная дисфункция энтерогематического барьера – преформированное хроническое нарушение функции энтерогематического барьера.
Токсикант – любое вещество, при воздействии в данной дозе повреждающее организм немеханическим путем.
Эндогенное вещество – соединение, продуцируемое клетками хозяина или симбионтными микроорганизмами.
Эндотоксемия – накопление в крови токсичных эндогенных веществ, включая вещества малой молекулярной массы тканевого или бактериального происхождения, бактериальные экзотоксины и эндотоксин.
Эндотоксикоз – совокупность клинических проявлений эндотоксемии.
Эндотоксин – сумма липополисахаридов внешней стенки грамотрицательных бактерий.
Эндотоксинемия – накопление в крови эндотоксина.
Энтерогематический барьер (ЭГБ) – система структурных элементов, разделяющих кишечный химус и кровь.
ПОРЯДОК ОТБОРА ИСТОЧНИКОВ ИНФОРМАЦИИ
Поиск данных, характеризующих связь осложнений острых отравлений со вторичной дисфункцией ЭГБ, показал очевидную новизну этой тематики. Поэтому настоящий обзор представляет лишь основную информацию по ней, формулирует концепцию и не является систематическим. В нем цитируются преимущественно публикации за предыдущие 10 лет, либо более ранние работы, имеющие фундаментальное значение. Основным источником информации служила база данных PubMed. Использовали запрос: “acute poisoning AND (gut microbiota OR intestinal microflora OR gut microflora OR metabolome OR human gut microbiome OR gut barrier OR leaky gut syndrome OR intestinal barrier OR gut–brain axis OR gut–liver axis)”. При анализе не использовали тезисы докладов на конференциях.
СТРУКТУРА И ФУНКЦИИ НОРМАЛЬНОГО ЭГБ
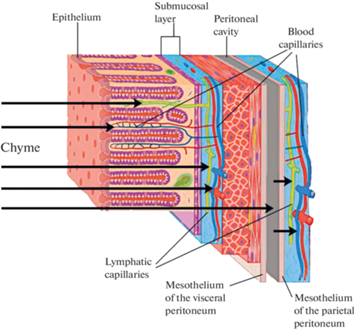
ЭГБ состоит из муцина, эпителия слизистой оболочки кишки [8], ассоциированных с эпителием симбионтных микроорганизмов [9] и эндотелия подслизистых гемо- и лимфокапилляров [10]. Вещества, избегшие абсорбции гемо- и лимфокапиллярными сплетениями кишечной стенки, на своем пути в кровь преодолевают дополнительные структурные элементы ЭГБ: гладкомышечный слой, мезотелий висцерального и париетального листков брюшины, слой смачивающей их жидкости и эндотелий гемо- и лимфокапилляров париетальной брюшины.
Слой муцина толщиной 150 мкм, состоящий из гидратированных гликопротеинов, отделяет эпителиальные клетки от агрессивной среды люминального пространства кишечника. Формирование муцина нарушается при ишемии слизистой оболочки, что наиболее опасно для толстой кишки с ее высокой плотностью бактериальной колонизации. В норме симбионтные аэробные бактерии вытесняют патогенную микрофлору с апикальной поверхности энтеро- и колоноцитов, в то же самое время обеспечивая их эссенциальными веществами [5]. Основная функция монослоя эпителиальных клеток толщиной 20 мкм состоит в селективной абсорбции веществ из химуса.
Благодаря наличию ворсинок в тонкой и крипт в толстой кишке площадь абсорбирующей поверхности слизистой оболочки желудочно-кишечного тракта достигает 200 м2 [8]. В норме вещества абсорбируются из кишечного химуса преимущественно трансцеллюлярно. Доля парацеллюлярного транспорта предположительно пропорциональна доле межклеточных контактов на люминальной поверхности кишечника, оцениваемой в 0.1% [11]. Межклеточные контакты двух типов: плотные и адгезионные – состоят из актина и, соединяя плазматические мембраны соседних клеток с их цитоскелетом, обеспечивают прочность эпителия [8]. Межклеточные контакты служат объектом повреждающего действия ряда ксенобиотиков [12], на фоне которого доля парацеллюлярного транспорта возрастает.
Часть образовавшихся в химусе веществ, преодолевших кишечный эпителий, поступает в сеть гемо- и лимфокапилляров подслизистого слоя и далее в бассейны v. portae и ducti thoracici; в норме этот путь является основным. Другая часть, преодолев висцеральный и париетальный листки брюшины, а также разделяющий их слой жидкости толщиною в 0.25 мм, поступает в лимфатические сосуды бассейна ducti thoracici или в гемокапиллярную сеть бассейна v. cavae inferioris. Этот процесс, трансперитонеальная диффузия, облегчается отсутствием в толстой кишке диффузионного препятствия в виде сплошного продольного мышечного слоя [13]. Экспериментально показана трансперитонеальная диффузия аммиака [14] и эндотоксина [15]. Вещества, вовлеченные в трансперитонеальную диффузию, на своем пути в общий кровоток избегают пресистемного метаболизма в печени. При портальной гипертензии роль трансперитонеальной диффузии может возрастать в связи с замедлением доставки веществ кишечного происхождения в бассейн v. portae [16]. Трансперитонеальная диффузия служит мишенью детоксикационной терапии с использованием перитонеального диализа [17].
В норме ЭГБ непроницаем для бактерий, населяющих кишечник: ДНК Escherichia coli, Bacteroides обнаруживали в плазме крови только на фоне повреждения ЭГБ [18]. Вещества, подлежащие удалению из организма, проникают из химуса в кровь путем пассивной диффузии [19]. Их абсорбция аппроксимируется [20] уравнением первого закона диффузии Фика для мембран: J = D (Ci – Co), где J – плотность потока, моль м−2 с−1; D – коэффициент проницаемости мембраны, м с−1; Ci и Co – концентрация вещества с эпителиальной и эндотелиальной сторон мембраны, моль м−3. Биодоступность токсичных продуктов жизнедеятельности кишечной микробиоты возрастает со значениями множителей (Ci – Co) и D. Первый лимитирован содержанием этих веществ в химусе, второй – состоянием ЭГБ. Предположительно, абсорбция возрастает с увеличением гидравлического давления химуса вследствие гладкомышечного спазма и (или) интенсификации газообразования [21]. Маршруты диффузии веществ из кишечного химуса в лимфу и кровь схематически показаны на рис. 1.
НОРМАЛЬНАЯ МИКРОБИОТА ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Прокариоты более четырехсот видов населяют желудочно-кишечный тракт (ЖКТ) здорового человека. Общее число их клеток превышает число клеток организма хозяина, а масса оценивается в 0.3% массы тела [22]. Плотность бактериальной колонизации дистальных отделов ЖКТ больше, чем проксимальных (табл. 1).
Образцы содержимого желудка, взятые натощак, практически стерильны. При гипохлоргидрии бактерий в просвете желудка больше, и они представлены в основном облигатными анаэробами, стрептококками, лактобациллами, нейссериями и стафилококками. При pH > 5.0 микробный состав содержимого желудка неотличим от микробного состава содержимого тонкой кишки. У ⅔ людей в возрасте 51–60 лет в слое муцина слизистой оболочки желудка выявляется грамотрицательная бактерия Helicobacter pylori, продуцирующая аммиак. У инфицированных ею повышается pH содержимого желудка, что неблагоприятно изменяет состав микрофлоры дистальных отделов ЖКТ [23].
В двенадцатиперстной и тощей кишках вегетация бактерий уравновешена их быстрым удалением в результате секреции, моторики и бактерицидного действия желчи; преобладают грамположительные кокки (Streptococci, Peptococci) и бациллы (Lactobacilli, Bifidobacteria). Микробиота терминального отдела подвздошной кишки за счет рефлюкса из слепой кишки сходна с микробиотой последней [5]. В химусе толстой кишки бактерии составляют в среднем 27% его сухой массы [22]. Анаэробных бактерий (с преобладанием Escherichia coli, Bacterioides fragilis, Lactobacilli и Bifidobacteria) в толстой кишке в 1000 раз больше, чем аэробных [5]. Анаэробы представлены грамположительными (Bifidobacteria, Eubacteria, Propionibacterium) и грамотрицательными (Fusobacterium, Enterobacteriaceae) бактериями. Слизистая оболочка толстой кишки заселена не только симбионтными, но и условно-патогенными бактериями, экспрессирующими уреазу, из семейства Enterobacteriaceae [24].
Состав нормальной микробиоты кишечника зависит от диеты [25], возраста, приема антибактериальных препаратов и ряда неконтролируемых состояний [5]. Образованию токсичных веществ в кишечнике способствует преобладание представителей типов Proteobacteria и Fusobacteria над Bacterioidetes при подавлении Lactobacilli и Bifidobacteria [26]. Количество микроорганизмов в ЖКТ зависит от его моторики. Транзитное время составляет в норме 10–48 мин для желудка, 2.5–4.0 ч для тонкой кишки [27] и 25–40 ч для толстой кишки [22]. Продолжительность прохождения химуса через толстую кишку определяет наибольший вклад ее микробиоты в образование токсичных веществ [5].
ТОКСИЧНЫЕ ПРОДУКТЫ ЖИЗНЕДЕЯТЕЛЬНОСТИ НОРМАЛЬНОЙ КИШЕЧНОЙ МИКРОФЛОРЫ
Нормальная микробиота кишечника продуцирует как необходимые, так и токсичные для хозяина вещества [28]. Справедливость сформулированной И.И. Мечниковым более века назад гипотезы о способности веществ, образованных кишечной микрофлорой из нутриентов, при определенных условиях вызывать системные патологические процессы [29], сегодня полностью доказана. С 2011 по 2021 гг. ежегодное число публикаций, доступных по ключевым словам “gut barrier”, “gut-brain axis”, “gut-liver axis”, “gut microbiota”, “intestinal microflora”, “gut microflora”, “gut microbiota AND metabolome”, “intestinal barrier”, “leaky gut syndrome” и “human gut microbiome”, росло экспоненциально. На веб-сайте PubMed.gov оно увеличилось за это время в 7, 16, 17, 18, 23, 30, 34, 37, 40 и 44 раза соответственно, в то время как в предыдущие годы рост был линейным.
Токсичные вещества бактериального происхождения, обладающие системной токсичностью, включают в себя бактериальные экзотоксины, эндотоксин и продукты бактериального преобразования пищевых белков, аминокислот, аминоспиртов и фосфолипидов (аммиак, амины, фенолы, гетероциклы). Некоторые амины, гетероциклы и фенолы превращаются в печени во вторичные токсиканты (триметиламин-N-оксид, индоксилсульфат, п-крезилсульфат), вовлеченные в патогенез сердечно-сосудистых и других хронических заболеваний. Аммиак и эндотоксин, бессимптомно циркулирующие в крови здорового человека в следовых концентрациях, в более высоких концентрациях способны проявлять острую системную токсичность, рассматриваемую ниже.
Аммиак. Не менее ⅔ аммиака, образующегося в организме, имеет кишечное происхождение. В энтероцитах основной механизм его образования – глутаминазная реакция, а в толстой кишке – метаболическая активность бактерий: дезаминирование аминокислот и азотистых оснований, а также гидролиз мочевины, диффундирующей из крови к люминальной поверхности слизистой оболочки [30]. Уреолитической активностью микроорганизмов, ассоциированных с толстокишечной слизистой оболочкой, обусловлено образование половины аммиака кишечного происхождения [24].
Из кишечного химуса аммиак поступает в общий кровоток как через воротную вену и печень, так и путем трансперитонеальной диффузии [14]. У здорового человека ежедневно в кровь (в основном, портальную) из кишечника доставляется около 4 г аммиака [31]. Его уровень в крови печеночных вен положительно зависит от уровня в портальной крови, а последний – от содержания аммиака в химусе [32]. Благодаря пресистемному метаболизму аммиака, его содержание в крови печеночных вен в 2–3 раза ниже, чем в портальной крови [33] и на порядок ниже, чем в крови брыжеечных вен толстой кишки [5].
В плазме артериальной крови нормальная концентрация аммиака ([NH3] + [${\text{NH}}_{4}^{ + }$]) составляет 30 мкМ [34]. Ее увеличение сопряжено с нейротоксичностью, впервые описанной в лаборатории И.П. Павлова [35]. При значениях ([NH3] + [${\text{NH}}_{4}^{ + }$]) в плазме крови до 100 мкМ гипераммониемия бессимптомна; при 100–200 мкМ отмечаются рвота, атаксия, раздражительность и гиперактивность, а при >200 мкМ – судороги и кома [36]. При среднем значении объема толстокишечного химуса 0.4 л [22] и содержании аммиака в нем 5.7–39.0 ммоль/л [37], толстокишечный пул аммиака составляет 2.3–15.6 ммоль/л. При одномоментном равномерном распределении этого количества в 5 л крови, 2 л лимфы и 0.4 л химуса, концентрация аммиака в плазме крови достигла бы 311–2108 мкМ, т. е. значений, значительно превышающих порог комы.
Аммиак поступает в клетки в неионизированной форме, NH3. Учитывая константу основности аммиака (pKa = 9.15 при t = 37°C), доля аммиака, представленного в форме NH3 в плазме крови, имеющей pH 7.36, составляет 1.6%. В цитоплазме pH ниже, что заставляет NH3 диффундировать в клетки даже при нормальном суммарном содержании обеих форм аммиака в крови [30]. При метаболическом ацидозе или газовом алкалозе возросшая разность значений pH между плазмой крови и цитоплазмой интенсифицирует поток аммиака в клетки по градиенту концентрации NH3 [38]. Это объясняет абсорбцию аммиака из крови головным мозгом, накопление в нем осмотически активного вещества, глутамина, и отек мозга при возрастании содержания аммиака в мозговой ткани [39]. В этом случае нейротоксические эффекты аммиака возможны даже при отсутствии гипераммониемии.
Кроме нейротоксичности, аммиак обладает эндотелиотоксичностью, показанной как in vitro, так и in vivo. В культивируемых клетках эндотелия капилляров головного мозга он вызывает окислительный стресс, накопление монооксида азота (NO) и продуктов пероксидации арахидоновой кислоты [40, 41], разрушает внеклеточный матрикс, повышает проницаемость плазматической мембраны для флуоресцеин-изотиоцианатного производного декстрана, вызывает экспрессию трансмембранного переносчика аргинина, субстрата NO-синтазы [40]. Культивационная среда эндотелиоцитов, обработанных солью аммония, вызывает набухание культивируемых астроцитов, что показывает вовлеченность сосудистого эндотелия в развитие отека мозга при гипераммониемии [42]. В фагоцитах аммиак активирует толл-подобные рецепторы 4-го типа, что усиливает воспалительный ответ на эндотоксин, образование свободных радикалов кислорода и азота, вызывает набухание и повышение проницаемости эндотелия кровеносных сосудов головного мозга [42].
Гипераммониемия вызывает эндотелий-зависимое NO-опосредованное расширение артериол головного мозга, которое вовлечено в развитие отека мозга и повышения внутричерепного давления при острой печеночной недостаточности [38]. Внутривенное введение кроликам ацетата аммония повышало проницаемость их ГЭБ для полиэтиленгликоля-400 [43]. Повышение проницаемости ГЭБ отмечено и у пациентов с хронической печеночной энцефалопатией [44]. Таким образом, интенсификация поступления аммиака в головной мозг вызывает окислительный стресс, воспалительное повреждение, повышение проницаемости ГЭБ, отек мозга, нарушает регуляцию мозгового кровотока и неврологические функции.
Эндотоксин. Содержание в толстокишечном химусе взрослого человека липополисахаридов грамотрицательных бактерий, в сумме известных как “эндотоксин”, близко к 2.5 г/л [45]. В плазме крови оно на девять порядков меньше: 9 нг/л, что является порогом воспалительной активации макрофагов и эндотелиоцитов. Умеренная эндотоксинемия наблюдается при периодонтите, а при сахарном диабете, циррозе печени, болезни Альцгеймера и сепсисе уровень эндотоксина в плазме крови может достигать 500 нг/л [46]. В крови эндотоксин представлен в активной свободной форме или в виде комплексов с белками, обычно не определяемых в лабораторных тестах [17].
Эндотоксин обладает выраженной эндотелиотоксичностью, которая проявляется окислительным стрессом, разрушением гликокаликса, лейкоцитарной адгезией, вазоспазмом, тромбообразованием [47] и повышением проницаемости ГЭБ [48]. При содержании эндотоксина в крови, характерном для сепсиса, возникают “цитокиновый шторм” и септический шок [49]. Липополисахариды Escherichia coli обладают более выраженным провоспалительным действием, чем липополисахариды Bacteroides dorei и Bacteroides vulgatus [50]. Эндотоксинемия ведет к тромбоксан-зависимой легочной вазоконстрикции и легочной гипертензии [51] в сочетании с системной вазодилатацией [52, 53]. Влияние эндотоксина на проницаемость сосудистого эндотелия проявляется повышением проницаемости ГЭБ как для самого эндотоксина, так и для других веществ [4, 54], некардиогенным отеком легких [55], нарушением функций печени [56, 57] и почек [58]. При эндотоксинемии нарушается способность печени вовлекать аммиак в состав мочевины [59]. Профили системной токсичности аммиака и эндотоксина представлены в табл. 2.
Таблица 2.
Публикации, документирующие системную токсичность аммиака и эндотоксина в концентрациях, превышающих физиологическую норму
| Проявление системной токсичности | Аммиак | Эндотоксин |
|---|---|---|
| Системное воспаление | [42] | [47, 49, 52] |
| Расстройства кровообращения | [38] | [47, 52] |
| Коагулопатия | – | [47] |
| Расстройства легочного газообмена | – | [47, 51, 53, 55] |
| Почечная недостаточность | – | [58] |
| Печеночная недостаточность | – | [56, 57] |
| Острая церебральная недостаточность | [38, 42–44, 60] | [4, 48, 54] |
ОЦЕНКА ПРОНИЦАЕМОСТИ ЭНТЕРОГЕМАТИЧЕСКОГО БАРЬЕРА
Для интегральной оценки проницаемости ЭГБ определяют содержание веществ, вводимых в желудок, в крови или моче. Идеальные маркеры проницаемости – это биохимически инертные вещества, которые преодолевают ЭГБ путем пассивной диффузии. Из веществ, определяемых в моче, предпочтение отдается тем, которые не реабсорбируются в почечных канальцах. В случае повышенной экскреции с мочой этих веществ, постулируется повышенная проницаемость ЭГБ и для других, близких к ним по размерам молекулы [11]. Молекулярный вес, липофильно-гидрофильный баланс (logPоктанол/вода), количество водородных связей, образуемых молекулой, являются априорными показателями преобладания парацеллюлярного или трансцеллюлярного транспорта вещества. Последнему способствует умеренная гидрофильность (logPоктанол/вода находится в интервале от 0 до 5) и способность молекулы образовывать не более пяти донорных или акцепторных водородных связей. Молекулярная масса и эффективный молекулярный диаметр вещества используются для оценки размера пор в ЭГБ (табл. 3).
Таблица 3.
Некоторые маркеры проницаемости энтерогематического барьера
| Вещество | Молекулярная масса, Дa | Диаметр молекул, нм | logP** | Число водородных связей | Источник *** | |
|---|---|---|---|---|---|---|
| донорных | акцепторных | |||||
| Преобладает парацеллюлярный тип проницаемости | ||||||
| ПЭГ 400* | 380–420 | 0.53 | –1.43 (0.61) | 2 | 8 | [61] |
| ПЭГ 4000* | 3800–4200 | 1.00 | –0.93 (0.98) | 2 | 80 | [61] |
| Эритритол | 122.1 | 0.86 | –3.16 (0.35) | 4 | 0 | [62] |
| Лактулоза | 322.3 | 1.33 | –3.92 (0.50) | 8 | 3 | [62–64] |
| Сахароза | 342.3 | 1.31 | –3.65 (0.43) | 8 | 3 | [62] |
| ЭДТА (pH 7) | 292.2 | 1.45 | –4.43 (1.30) | 4 | 6 | [62] |
| Декстран | 3000–20 000 | 5.5–10.0 | – | 3n + 2 | 2n + 1 | [64] |
| Преобладает трансцеллюлярный тип проницаемости | ||||||
| Маннитол | 397.6 | 0.89 | –4.96 (0.38) | 6 | 0 | [61, 63, 65] |
| Сукралоза | 397.6 | 1.26 | 0.88 (0.65) | 5 | 5 | 64] |
Оценка проницаемости ЭГБ с помощью указанных маркеров исходит из предположения об их преимущественном всасывании в том или ином сегменте ЖКТ. Сахароза используется для оценки проницаемости стенки желудка, а сукралоза – для оценки проницаемости стенки толстой кишки. Однако не исключено, что при патологических состояниях или под воздействием терапии место всасывания меняется. Например, лактулоза и маннитол абсорбируются в основном в тонкой кишке, поскольку в толстой кишке они быстро расщепляются микроорганизмами [65]. Но на фоне подавления последних антибиотиками эти маркеры могут накапливаться в химусе толстой кишки и абсорбироваться ею.
Для избирательной оценки проницаемости эпителия слизистой оболочки изолированные петли кишечного сегмента заполняют раствором вещества-маркера, лигируют и инкубируют в буферном растворе. Скорость накопления маркера считается показателем проницаемости эпителия, поскольку кровообращение и, следовательно, сосудистый эндотелий, в этих условиях не функционируют [61]. Барьерная функция сосудистого эндотелия ЖКТ может быть избирательно оценена с помощью красителей (Эванс синий, флуоресцеин) или соединений, меченных радиоактивными изотопами [66]. Прижизненная микроскопия [67] и микроскопия тканей ЖКТ ex vivo являются ценным дополнением к прямому изучению транспорта веществ через ЭГБ [68].
ПОВРЕЖДЕНИЕ ЭНТЕРОГЕМАТИЧЕСКОГО БАРЬЕРА ПРИ ОСТРЫХ ОТРАВЛЕНИЯХ
Прямое повреждение ЭГБ ксенобиотиками. Многие ксенобиотики и их метаболиты прямо повреждают ЭГБ. Местное действие раздражающих и прижигающих веществ запускает каскад патологических процессов, включающий денатурацию белка, тканевой некроз, высвобождение медиаторов воспаления и транссудацию плазмы крови [69]. Этанол [70], мышьяк, соли тяжелых металлов [69, 71], опиоиды [72], ряд микотоксинов [73] проявляют прямую энтеротоксичность. Ее выраженность у нестероидных противовоспалительных препаратов сделала их средством экспериментального моделирования острого гастроэнтерита [74]. Декстрансульфат и 2,4,6-тринитробензолсульфонат применяют для экспериментального моделирования острого колита [75]. Некоторые микотоксины вызывают воспалительное повреждение ЭГБ, усиливая действие на него эндотоксина [76]. Микотоксины Т-2 и дезоксиниваленол увеличивают проницаемость ЭГБ для полиэтиленгликоля-4000 [77].
Прямая энтеротоксичность возможна не только при пероральном, но и при других путях поступления в организм токсикантов. Эпителий тонкой кишки и, в меньшей степени, желудка и толстой кишки – типичная система клеточного обновления с высокой пролиферативной активностью. Это делает его чувствительным к веществам, вызывающим интерфазную или репродуктивную гибель энтероцитов. Различия в энтеротоксическом действии таких веществ определяются только уровнем дифференцировки клеток-мишеней. Адриамицин вызывает апоптоз энтероцитов в 4–5 позиции от стволовой клетки, расположенной в нижней точке межворсинчатой крипты, изопропилметансульфонат, азотистый иприт или актиномицин D – в положении 6–7; фторурацил, милеран, циклофосфамид или циклогексимид – в положении 7–9, винкристин или гидроксимочевина – в положении 10–11 [68]. В достаточной дозе все эти токсиканты вызывают денудацию эпителия тонкой кишки. У крыс с острой интоксикацией циклофосфамидом проницаемость ЭГБ для метиленового синего, маннита и лактулозы увеличивается [63]. Энтеротоксичность цитостатических препаратов при трансплантации стволовых кроветворных клеток является одним из факторов, лимитирующих выживаемость пациентов [78].
Экспериментально продемонстрирована повышенная проницаемость ЭГБ на фоне его химического повреждения. У крыс, получавших ацетат аммония через желудочный зонд, внутрибрюшинное введение циклофосфамида ускоряло накопление аммиака и глутамина в крови и головном мозгу [79] и провоцировало острые неврологические расстройства: опистотонус и апноэ, характерные для действия солей аммония в гораздо более высоких дозах [80, 81]. При этом изолированное введение соли аммония существенно не влияло на поведение животных (рис. 2).
Рис. 2.
Симптомы острой интоксикации ацетатом аммония и (или) циклофосфаном у крыс. Животные сфотографированы через 30 мин после внутрижелудочного введения ацетата аммония (AA) в дозе 12 ммоль/кг и (или) внутрибрюшинного введения циклофосфана (CY) в дозе 1000 мг/кг [81].
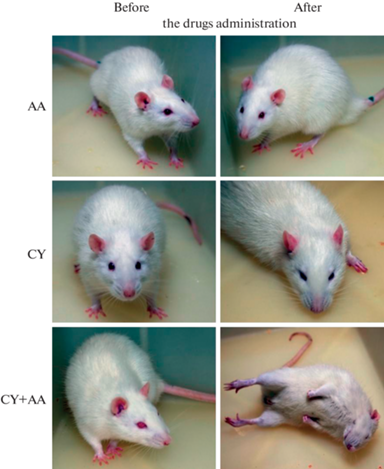
В приведенных примерах прямое повреждение ЭГБ метаболитами циклофосфамида (альдоциклофосфамидом, акролеином, фосфорамидным ипритом и др.) способствовало поступлению аммиака из химуса в кровь со скоростью, при которой гипераммониемия превышала судорожный порог.
Повреждение ЭГБ при острой системной гипоксии. Острая гипоксия кишечника при критических состояниях организма может быть вызвана нарушением внешнего дыхания и кровообращения. При остром тяжелом отравлении такие состояния включают экзотоксический шок, а при отсутствии респираторной поддержки – угнетение дыхательного центра, нервно-мышечную блокаду и бронхообструктивный синдром. В результате “централизации” кровообращения у таких пациентов ЖКТ испытывает более глубокую гипоксию, чем “жизненно важные органы”.
Аэробный тип энергетического метаболизма энтероцитов предрасполагает их к нарушению ресинтеза АТФ при острой гипоксии [82]. Об этом свидетельствует повреждение кишечника во время высотной гипоксии, проявляющееся воспалением, изъязвлением, кровотечением, осложняющими высотную болезнь [83]. Нормобарическая гипоксия провоцировала увеличение проницаемости ЭГБ у крыс при беге на тредмилле [84]. Проницаемость ЭГБ увеличивается при гемолитической анемии [85] и острой кровопотере [86]. Разобщение окислительного фосфорилирования в колоноцитах нарушает их резистентность к Escherichia coli [87]. Мыши с более активным окислительным фосфорилированием в слизистой оболочке толстой кишки более устойчивы к местному токсическому действию декстрансульфата или тринитробензолсульфоната [88]. При гипоксии снижается образование муцина в кишечнике, что приводит к воспалительным изменениям слизистой оболочки. Подслизистое гемокапиллярное сплетение в тонкой кишке более развито, чем в толстой, что объясняет более высокую чувствительность последней к ишемии [89].
Повреждение ЭГБ при гладкомышечном спазме. Спазм гладкой мускулатуры ЖКТ является характерным симптомом отравления ингибиторами холинэстеразы и серотонинергическими препаратами, но также может быть реакцией на “централизацию” кровообращения, или результатом действия на гладкую мускулатуру серотонина, продуцируемого Enterobacteria [90]. Серотонинергическая стимуляция толстой кишки сопровождается, помимо спазма ее собственной гладкой мускулатуры, артериальным спазмом и местной циркуляторной гипоксией [91]. Нарушение микроциркуляции в кишечнике может повредить его так же, как это происходит при системной гипоксии. Выдвинута гипотеза о триаде “мышечный спазм, ишемия и боль” как факторе повышенной проницаемости ЭГБ при синдроме раздраженного кишечника [90]. При остром отравлении реакция ЭГБ на такие изменения может быть аналогичной.
Повреждение ЭГБ при желудочно-кишечном стазе. Желудочно-кишечный стаз является потенциально летальным осложнением у пациентов отделений интенсивной терапии [92]. Это одно из специфичных проявлений токсичности опиоидов, холинергических антагонистов и агонистов серотонина [11]. Он наблюдался у крыс при моделировании барбитуратной комы [93], а также при острых отравлениях алкилирующими токсикантами. На рис. 3 показано расположение рентгенологической тени сульфата бария у крыс, получивших суспензию сульфата бария через зонд тотчас после внутрибрюшинного (i. p.), подкожного (s. c.) или внутрижелудочного (gavage) введения циклофосфамида в дозе 1000 мг/кг [94]. Налицо резкое угнетение пропульсивной активности всех отделов ЖКТ, наиболее выраженное при внутрижелудочном введении токсиканта.
Рис. 3.
Схема расположения рентгенологической тени сульфата бария в ЖКТ крыс после введения циклофосфана и бариевой взвеси. Тон кружков пропорционален доле площади тени рентгеноконтрастного вещества в соответствующем отделе ЖКТ в площади всей наблюдаемой тени сульфата бария. Черные кружки: 75–100%. Белые кружки: отсутствие тени [94].
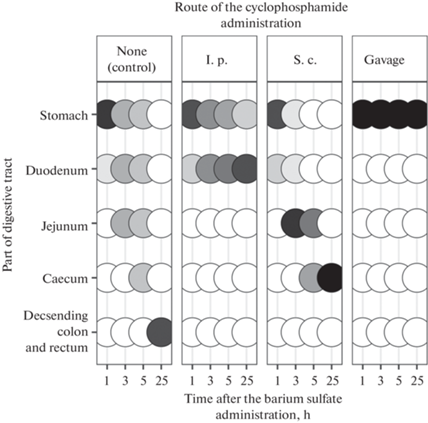
При желудочно-кишечном стазе вегетация бактерий не компенсируется их удалением, в результате чего тип взаимоотношений нормальной кишечной микрофлоры с хозяином перестает быть мутуалистическим и приближается к паразитизму. Увеличивается не только суммарная люминальная концентрация продуцируемого бактериями аммиака ([NH3] + [${\text{NH}}_{4}^{ + }$]), но и pH химуса, а, следовательно, и доля аммиака, представленного в высокопенетрантной форме NH3 [37]. Цитотоксическое действие NH3 сокращает жизненный цикл колоноцитов [95] и продукцию муцина [96], что может повреждать ЭГБ и повышать биодоступность веществ, продуцируемых микрофлорой толстой кишки.
Значительное газообразование, характерное для желудочно-кишечного стаза, может интенсифицировать диффузию веществ через ЭГБ. Оно повышает барометрическое давление в просвете кишечника и согласно первому закону Дальтона – парциальное давление паров летучих веществ. Согласно второму закону Дальтона это увеличивает напряжение соответствующих газов, растворенных в химусе. Повреждение ЭГБ и повышенное напряжение летучих веществ в химусе – потенциальные факторы повышения их биодоступности при желудочно-кишечном стазе.
Воспалительное повреждение ЭГБ. Повреждение ЭГБ экзогенным токсикантом способствует поступлению в кровь эндотоксина. Он стимулирует секрецию фагоцитами провоспалительных цитокинов (ФНО-α, ИФН-γ и ИЛ-6), что ведет как к системному, так и к местному воспалению [97]. Введение циклофосфамида карликовым свиньям в дозе 50 мг/кг увеличивало содержание ФНО-α и ИЛ-6 в сыворотке крови и проницаемость ЭГБ [98]. Кишечный мукозит ведет к бактериемии у реципиентов кроветворных стволовых клеток при цитостатической терапии [99]. Сообщалось о воспалении подслизистой оболочки и лейкоцитокластическом васкулите, сопровождавшемся изъязвлением слизистой оболочки у крыс, которым вводили хлорид ртути [100]. Острое воспаление толстой кишки провоцирует воспаление и в других органах [101], что может способствовать поступлению в них из крови токсичных веществ кишечного происхождения.
Таким образом, при острых тяжелых отравлениях возникают предпосылки к увеличению проницаемости ЭГБ для метаболитов и клеточных компонентов микрофлоры кишечника. Механизмы вторичной дисфункции ЭГБ при острых отравлениях включают прямое повреждающее действие ксенобиотиков или их метаболитов, желудочно-кишечный стаз, гладкомышечный спазм, воспаление и гипоксию ЖКТ. Наряду со вторичной дисфункцией ЭГБ, доставке токсичных веществ из кишечного химуса в общий кровоток при остром отравлении могут способствовать избыточный рост кишечной микробиоты и повышенное газообразование. Перечисленные синергические факторы ведут к эндотоксемии.
ЭНДОТОКСЕМИЯ ПРИ ОСТРЫХ ОТРАВЛЕНИЯХ
Эндотоксемия – повышенное содержание в крови биологически активных веществ, образующихся в организме. Исходя из представлений об организме как об экосистеме, частью которой является кишечная микробиота [5, 6], соединения, продуцируемые последней, классифицируются как эндогенные вещества.
В качестве интегрального показателя эндотоксемии пользуются содержанием в крови веществ средней молекулярной массы [102]. У пациентов с неосложненным отравлением психофармакологическими препаратами среднее содержание в крови таких веществ превышало таковое у здоровых доноров на 32%, а эндотоксина – в 10 раз [103]. После кишечного лаважа уровень веществ средней молекулярной массы в крови снизился на 18%, эндотоксина – вдвое, а без лаважа эти показатели эндотоксемии продолжали расти. Таким образом, при отравлениях психофармакологическими препаратами химус толстой кишки является источником эндотоксемии.
Представляет интерес вопрос о том, какие конкретно вещества вовлечены в формирование эндотоксемии при остром отравлении. Одно из них – эндотоксин, повышенное содержание которого в крови показано при тяжелом остром отравлении колхицином [97], верапамилом [104], этанолом [105]. Выраженная эндотоксинемия сопровождает подготовку пациентов к трансплантации стволовых кроветворных клеток, при которой цитостатические препараты вводят в потенциально летальных дозах. Накопление эндотоксина в крови при таком лечении ведет к системной воспалительной реакции [106, 107].
Одновременно с эндотоксинемией при острых экзогенных отравлениях возникает гипераммониемия [108, 109]. Ниже перечислены ксенобиотики, при острых отравлениях которыми она документирована (для исключения поражения печени из числа причин гипераммониемии не указаны специфические гепатотоксические агенты):
– ацетазоламид [110];
– кальция гопантенат [111];
– клозапин [112];
– кокаин [113];
– циклофосфан [79];
– циклопропан [114];
– цианиды [115];
– этанол [116];
– диэтиловый эфир [117];
– фторацетат [118];
– 5-фторурацил [119];
– гомоцистеина тиолактон [120];
– соли свинца [121];
– метанол [122];
– кислород [123];
– тиопентал натрия [93];
– триметоприм [124];
– вальпроаты [125].
Таким образом, в эндотоксемию при острых отравлениях вовлечены эндотоксин и аммиак, в то время как изменения содержания в крови других компонентов кишечного метаболома требуют изучения. Роль эндотоксина и аммиака в патогенезе острых осложнений характеризуют приведенные ниже сведения об эндотоксемии при соответствующих синдромах различной этиологии.
ЭНДОТОКСЕМИЯ ПРИ КРИТИЧЕСКИХ СОСТОЯНИЯХ ОРГАНИЗМА
Критические состояния организма являются паттернами эндотоксикоза – совокупности клинических проявлений эндотоксемии. Роль эндотоксина и аммиака в патогенезе критических состояний организма рассматривается ниже в зависимости от того, воспроизводятся ли симптомы этих состояний введением в организм эндотоксина или аммиака.
Шок – острое состояние недостаточного кровоснабжения тканей, одним из биохимических маркеров которого является гипераммониемия. Уровень аммиака многократно повышен в плазме крови и ткани головного мозга кроликов и собак при моделировании теплового или инсулинового шока [126]. У пациентов с септическим шоком уровень аммиака в плазме венозной крови был на 80% выше, а у впоследствии погибших от септического шока – в 2.2 раза выше, чем у пациентов с сепсисом, но без шока [127]. У пациентов с геморрагическим шоком уровень аммиака в плазме артериальной крови был вдвое выше, чем у пациентов с кровотечением, но без шока [128]. При тяжелой травме уровень аммиака в плазме венозной крови был вдвое выше, чем в контроле, а у погибших пациентов – на 70% выше, чем у выживших [129]. Концентрация аммиака в плазме крови пациентов, поступивших в отделение интенсивной терапии в связи с остановкой сердца, была в 4.8 раза выше, чем у пациентов со спонтанным кровообращением [130]. Гипераммониемия не только сопровождает шок, но и вовлечена в его патогенез. Введением солей аммония кроликам воспроизводятся основные проявления теплового и инсулинового шока [126].
В эксперименте шок воспроизводится и введением эндотоксина [131]. Накопление эндотоксина в крови характерно для септического [132], травматического и геморрагического [133] шока.
Повреждение ЭГБ является одним из механизмов эндотоксемии при шоке. При моделировании на крысах геморрагического шока животные теряли с мочой клаудин-3, белок плотных контактов кишечного эпителия [134]. При использовании в качестве маркеров эндотоксемии веществ средней молекулярной массы показано, что при геморрагическом шоке они накапливаются вначале в тканях кишечника, затем – в портальной крови и, наконец, в крови из сонной артерии [135].
Таким образом, гипераммониемия и эндотоксинемия характерны для эндотоксемии, сопровождающей шок, и вовлечены в развитие шока различного типа.
Сепсис – системный воспалительный ответ на эндотоксинемию и бактериемию, наиболее часто осложняющий острые отравления у лиц с алкогольной зависимостью [105]. Сепсис развивался у 6.4% пострадавших от отравления метанолом [136]. Эндотоксинемия – постоянная находка при сепсисе [137], в то время как бактериемия наблюдалась лишь у 67% таких пациентов [138]. Накопление в крови эндотоксина возникает при сепсисе, вызванном не только грамотрицательными, но и грамположительными бактериями, а также грибами, что обусловлено повреждением ЭГБ [139].
Клинические проявления сепсиса воспроизводятся введением животным эндотоксина [140]. При эндотоксинемии, характерной для сепсиса, активируется каскад свертывания крови и возникает диссеминированное микрососудистое тромбообразование [141], что ведет к поражению почек [10], сердца и печени [142], мультиорганной недостаточности [132] и отеку легких [143].
Аммиак также вовлечен в патогенез мультиорганной недостаточности при сепсисе. Его концентрация в плазме крови пациентов с этим диагнозом, измеренная при поступлении в приемное отделение, положительно коррелировала с вероятностью развития у них мультиорганной недостаточности в последующее 28 дней [96].
Вторичные острые повреждения легких при острых отравлениях включают в себя некардиогенный отек легких, синдромы шокового и влажного легкого. Вовлеченность эндотоксина в патогенез этих состояний следует из эндотоксинемии при них [144] и повреждения клеток альвеолярно-капиллярного барьера эндотоксином как in vitro [145], так и in vivo [146]. Введение крысам эндотоксина вызывает острое повреждение легких, напоминающее таковое при COVID-19 и проявляющееся кровоизлиянием в полость альвеол, цитокиновым штормом, коагулопатией и легочной гипертензией [147]. Эндотоксин Escherichia coli вызывал гемодинамические нарушения в легких у свиней: его введение в полость правого предсердия повышало давление крови в легочной артерии [53].
При порта-кавальном анастомозе предиктором легочной гипертензии является гипераммониемия [148]. У пациентов с тяжелым острым панкреатитом развитие летального осложнения – отека легких – обусловлено чрезмерной бактериальной колонизацией тонкой кишки [149].
Таким образом, эндотоксинемия сопровождает вторичные острые поражения легких при острых отравлениях и вовлечена в развитие легочной гипертензии. Другим маркером эндотоксемии, перспективным для прогнозирования вторичных острых поражений легких при острых отравлениях, является аммиак.
Острая церебральная недостаточность – синдром, возникающий в результате диффузного поражения головного мозга. Наблюдается при тяжелом отравлении веществами с различным механизмом действия, проявляется нарушением и спутанностью сознания, двигательными расстройствами, ускоренным катаболизмом, острыми нарушениями дыхания и кровообращения [150].
Некоторые проявления острой церебральной недостаточности могут быть связаны с повышенной доставкой аммиака и (или) эндотоксина в головной мозг. Гипераммониемия характерна для острой печеночной недостаточности, осложненной отеком мозга и повышением внутричерепного давлении [151]. Внутричерепное давление, неврологические расстройства и летальность положительно связаны с уровнями аммиака в сыворотке крови у пациентов с внепеченочной гипераммониемией [45]. Содержание аммиака в плазме крови и ткани мозга значительно повышено при моделировании диабетической комы на собаках и крысах [126]. Эндотоксин повышал чувствительность поросят к острой церебральной гипоксии. Введение эндотоксина Escherichia coli поросятам усиливало потерю нейронов, метаболические нарушения и увеличивало вероятность смерти мозга с последующей окклюзией сонной артерии [152]. Введение эндотоксина хорькам усугубило повреждение головного мозга из-за окклюзии сонной артерии [153]. Эндотоксин потенцировал отек мозга во время высотной гипоксии [154].
Таким образом, имеющиеся данные свидетельствуют о том, что эндотоксин и аммиак, продуцируемые нормальной микробиотой кишечника, вовлечены в патогенез патологических состояний, которые могут осложнять острые отравления: шок, сепсис, вторичные острые поражения легких и острую церебральную недостаточность.
ВТОРИЧНАЯ ДИСФУНКЦИЯ ЭНТЕРОГЕМАТИЧЕСКОГО БАРЬЕРА И СТОХАСТИЧНОСТЬ ОСЛОЖНЕНИЙ ОСТРЫХ ОТРАВЛЕНИЙ
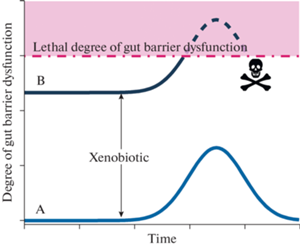
Феномен изменения переносимости острых повреждающих воздействий на фоне преформированной хронической патологии давно используется в функциональной диагностике последней. Этот феномен возможен и при острых отравлениях. Повреждение ЭГБ ксенобиотиком может накладываться на хронические патологические состояния, при которых он поврежден, такие как “кишечный дисбиоз”, “синдром раздраженного кишечника”, болезнь Крона, неспецифический язвенный колит и др. Это может усиливать эндотоксемию при острых экзогенных отравлениях. Такое наложение, схематически показанное на рис. 4, может вносить вклад в индивидуальную вариабельность тяжести их осложнений.
ЗАЩИТА ЭНТЕРОГЕМАТИЧЕСКОГО БАРЬЕРА ПРИ ОСТРЫХ ЭКЗОГЕННЫХ ОТРАВЛЕНИЯХ
Кишечный химус является агрессивной средой для поврежденной слизистой оболочки кишечника. Местное повреждающее действие на нее возрастает при кишечном дисбиозе [95]. Поэтому плановые меры защиты ЭГБ должны быть направлены на оптимизацию состава кишечной микробиоты и повышение местной резистентности слизистой оболочки к токсичным веществам бактериального происхождения. Основными подходами к оптимизации состава кишечной микробиоты являются пребиотико-, метабиотико-, пробиотико- и аутопробиотикотерапия.
Пребиотики – нутриенты, избирательно способствующие вегетации полезных для хозяина представителей микробиоты; примером терапевтического действия таких веществ может служить восстановление кишечной микробиоты у мышей и морских свинок с антибиотико-ассоциированным дисбактериозом [155]. Вариантом пребиотикотерапии является метабиотикотерапия – применение метаболитов функциональных микроорганизмов. Метаболиты Lactobacillus plantarum ускоряли восстановление кишечной микробиоты у мышей с антибиотико-ассоциированным дисбактериозом в 5965 раз и у морских свинок – в 308 раз. Применение на этих же экспериментальных моделях пребиотика Стимбифид (комплекса фруктоолиго- и фруктополисахаридов) ускоряло восстановление кишечной микробиоты в 7118 и 1047 раз соответственно [155].
Пробиотики – препараты функциональных микроорганизмов, относящихся к коллекционным штаммам. Классическим примером пробиотикотерапии может служить использование предложенной И.И. Мечниковым Lactobacillus bulgaricus [29]. Широко применяются с этой целью препараты живых Lactobacilli, Enterococci, Bifidobacteria и E. coli [156]. Анаэробные грамположительные бактерии: Lactobacilli, Bifidobacteria, Propionobacteria – подавляют условно-патогенные микроорганизмы кишечника, выработку аммиака, аминов, субстратов для синтеза триметиламин-N-оксида, индоксилсульфата, п-крезилсульфата, обладающих как системной, так и местной токсичностью [45]. В качестве источника пробиотических микроорганизмов применимы содержащие их официнальные микробиологические препараты. Вместе с тем отмечается неспособность таких микроорганизмов к участию в формировании “микробно-тканевого комплекса” и длительной колонизации кишечника человека [155]. В связи с этим перспективна аутопробиотикотерапия – применение определенных аборигенных бактерий, выделенных из организма и возвращенных в него после культивирования и накопления in vitro. Показана терапевтическая эффективность при экспериментальном дисбиозе используемых таким образом Enterococci [157] и Bifidobacteria [158].
С целью повышения местной устойчивости кишечника к токсичным веществам бактериального происхождения перспективны малотоксичные препараты, пригодные для длительного применения. Перспективен их поиск среди препаратов, обладающих адаптогенными свойствами. Экспериментально показана эффективность сока подорожника как средства коррекции острых гипераммонемического и нейротоксического эффектов циклофосфамида. На фоне всего лишь однократного внутрижелудочного введения крысам официнального препарата сока подорожника в дозе, эквивалентной 47 мл для человека, гипераммониемический эффект циклофосфамида, вводившегося в супралетальной дозе, 2.1 ЛД50, снижался в полтора раза, на 20% возрастала средняя продолжительность виса животных на проволочной решетке, на 30% – средняя продолжительность их жизни [159].
Перспективными средствами экстренной профилактики поражения ЭГБ являются препараты, способные образовывать на слизистой оболочке экранирующую пленку. Такими веществами могут быть пектины, адгезивные свойства которых используются в гидроколлоидных пластырях для ран [160]. При пероральном введении пектина на слизистых оболочках образуется защитная пленка из пектатов кальция [75], препятствующая попаданию в кровь веществ, образованных микрофлорой. Желатина таннат обладает аналогичной способностью [161]. Защитный эффект этих веществ ожидается преимущественно во время транзита препарата в тонкой кишке: с 10 мин до 5 ч после приема внутрь.
Необходимыми условиями поддержания барьерной функции кишечника при тяжелых острых отравлениях являются устранение его гипоксии и воспаления. Это подтверждается противовоспалительным действием гипербарической оксигенации при сепсисе [162]. Перспективны клинические испытания газовых смесей, обогащенных кислородом, содержащих инертные газы, оксид азота или водород в малых концентрациях; свойства этих добавок могут модулировать эффекты кислородной терапии. Ксенон, оксид азота и водород обладают нейропротекторными и кардиотоническими свойствами, аргон и сероводород – только нейрозащитными свойствами [163]. Противовоспалительные препараты могут быть дополнением к оксигенотерапии: при экспериментальном моделировании сепсиса дисфункция ЭГБ и эндотоксемия предотвращались введением гидрокортизона [164].
ЗАКЛЮЧЕНИЕ
1. Химус кишечника здорового человека содержит продукты бактериального происхождения, количество и профиль системной токсичности которых при потере градиентов их концентрации между химусом и кровью обеспечивают формирование критических состояний организма: шока, сепсиса, вторичных острых поражений легких и острой церебральной недостаточности.
2. При тяжелых острых экзогенных отравлениях создаются предпосылки ко вторичной дисфункции энтерогематического барьера и эндотоксемии кишечного происхождения.
3. Эндотоксемия, включающая эндотоксинемию и гипераммониемию, вовлечена в формирование осложнений острого отравления, проявляющихся критическими состояниями организма, перечисленными в пункте 1.
4. Плановые меры защиты энтерогематического барьера от повреждения при последующем остром отравлении должны быть направлены на оптимизацию состава кишечной микробиоты, подавление образования ею цитотоксических веществ и повышение местной кишечной резистентности путем назначения малотоксичных препаратов, рассчитанных на длительное применение.
5. Основными подходами к оптимизации состава кишечной микробиоты являются пребиотико-, метабиотико-, пробиотико- и аутопробиотикотерапия. Для повышения местной устойчивости кишечника к токсичным веществам бактериального происхождения перспективны малотоксичные препараты, обладающие адаптогенными свойствами и пригодные для длительного применения.
6. Экстренная профилактика вторичной дисфункции энтерогематического барьера предусматривает применение препаратов, экранирующих слизистую оболочку от химуса, устраняющих гипоксию и воспаление кишечника.
Список литературы
Grishin SM (2018) Crimes committed by medical workers as a result of improper performance of their professional duties (based on the case-law of the European part of Russia 2015–2017). Medicina (Mex) 6: 1–14. https://doi.org/10.29234/2308-9113-2018-6-1-1-14
Ponti G, Maccaferri M, Ruini C, Tomasi A, Ozben T (2020) Biomarkers associated with COVID-19 disease progression. Crit Rev Clin Lab Sci 57: 389–399. https://doi.org/10.1080/10408363.2020.1770685
Ivnitsky JuJu, Schäfer TV, Rejniuk VL, Golovko AI (2022) Endogenous humoral determinants of vascular endothelial dysfunction as triggers of acute poisoning complications. J Appl Toxicol Online ahead of print. https://doi.org/10.1002/jat.4312
Vutukuri R, Brunkhorst R, Kestner R-I, Hansen L, Bouzas NF, Pfeilschifter J, Devraj K, Pfeilschifter W (2018) Alteration of sphingolipid metabolism as a putative mechanism underlying LPS-induced BBB disruption. J Neurochem 144: 172–185. https://doi.org/10.1111/jnc.14236
Hill MJ (1995) Role of gut bacteria in human toxicology and pharmacology. London Bristol PA. Taylor & Francis.
Tang WHW, Kitai T, Hazen SL (2017) Gut Microbiota in Cardiovascular Health and Disease. Circ Res 120: 1183–1196. https://doi.org/10.1161/CIRCRESAHA.117.309715
Choi T-Y, Choi YP, Koo JW (2020) Mental Disorders Linked to Crosstalk between The Gut Microbiome and The Brain. Exp Neurobiol 29:403–416. https://doi.org/10.5607/en20047
Lopetuso LR, Scaldaferri F, Bruno G, Petito V, Franceschi F, Gasbarrini A (2015) The therapeutic management of gut barrier leaking: the emerging role for mucosal barrier protectors. Eur Rev Med Pharmacol Sci 19: 1068–1076.
Gurwara S, Dai A, Ajami NJ, Graham DY, White DL, Chen L, Jang A, Chen E, El-Serag HB, Petrosino JF, Jiao L (2020) Alcohol use alters the colonic mucosa-associated gut microbiota in humans. Nutr Res 83: 119–128. https://doi.org/10.1016/j.nutres.2020.09.004
Liu Z, Yang D, Gao J, Xiang X, Hu X, Li S, Wu W, Cai J, Tang C, Zhang D, Dong Z (2020) Discovery and validation of miR-452 as an effective biomarker for acute kidney injury in sepsis. Theranostics 10: 11963–11975. https://doi.org/10.7150/thno.50093
Gad SC (2018) Toxicology of the Gastrointestinal Tract. Boca Raton, Florida : CRC Press.
Lechuga S, Naydenov NG, Feygin A, Cruise M, Ervasti JM, Ivanov AI (2020) Loss of β-Cytoplasmic Actin in the Intestinal Epithelium Increases Gut Barrier Permeability in vivo and Exaggerates the Severity of Experimental Colitis. Front Cell Dev Biol 8: 588836. https://doi.org/10.3389/fcell.2020.588836
Magnotti LJ, Upperman JS, Xu DZ, Lu Q, Deitch EA (1998) Gut-derived mesenteric lymph but not portal blood increases endothelial cell permeability and promotes lung injury after hemorrhagic shock. Ann Surg 228: 518–527. https://doi.org/10.1097/00000658-199810000-00008
Schäfer TV, Ivnitsky JuJu, Rejniuk VL (2011) Cyclophosphamide-induced leakage of gastrointestinal ammonia into the common bloodstream in rats. Drug Chem Toxicol 34: 25–31. https://doi.org/10.3109/01480545.2010.483518
Milan Manani S, Virzì GM, Giuliani A, Baretta M, Corradi V, De Cal M, Biasi C, Crepaldi C, Ronco C (2020) Lipopolysaccharide Evaluation in Peritoneal Dialysis Patients with Peritonitis. Blood Purif 49: 434–439. https://doi.org/10.1159/000505388
Møller S, Kimer N, Barløse M, Bendtsen F (2020) Pathophysiological-based treatments of complications of cirrhosis. Scand J Gastroenterol 55: 383–394. https://doi.org/10.1080/00365521.2020.1744709
Комаров БД, Лужников ЕА, Шиманко ИИ (1981) Хирургические методы лечения острых отравлений. М. Медицина. [Komarov BD, Luzhnikov EA, Shimanko II (1981) Surgical treatments for acute poisoning. Moscow. Meditsina. (In Russ)].
Shi K, Wang F, Jiang H, Liu H, Wei M, Wang Z, Xie L (2014) Gut bacterial translocation may aggravate microinflammation in hemodialysis patients. Dig Dis Sci 59: 2109–2117. https://doi.org/10.1007/s10620-014-3202-7
Travis S, Menzies I (1992) Intestinal permeability: functional assessment and significance. Clin Sci 82: 471–488. https://doi.org/10.1042/cs0820471
Самойлов ВО (2013) Медицинская биофизика. Санкт-Петербург. СпецЛит. [Samoilov VO (2013) Medical biophysics. Saint-Petersburg. SpezLit. (In Russ)].
Lin HC, Pimentel M (2005) Bacterial concepts in irritable bowel syndrome. Rev Gastroenterol Disord 5(3): S3–S9.
Sender R, Fuchs S, Milo R (2016) Revised Estimates for the Number of Human and Bacteria Cells in the Body. PloS Biol 14: e1002533. https://doi.org/10.1371/journal.pbio.1002533
Hunt RH, Camilleri M, Crowe SE, El-Omar EM, Fox JG, Kuipers EJ, Malfertheiner P, McColl KEL, Pritchard DM, Rugge M, Sonnenberg A, Sugano K, Tack J (2015) The stomach in health and disease. Gut 64: 1650–1668. https://doi.org/10.1136/gutjnl-2014-307595
Walker V (2012) Severe hyperammonaemia in adults not explained by liver disease. Ann Clin Biochem Int J Lab Med 49: 214–228. https://doi.org/10.1258/acb.2011.011206
Adamberg K, Jaagura M, Aaspõllu A, Nurk E, Adamberg S (2020) The composition of faecal microbiota is related to the amount and variety of dietary fibres. Int J Food Sci Nutr 71: 845–855. https://doi.org/10.1080/09637486.2020.1727864
Rai R, Saraswat VA, Dhiman RK (2015) Gut Microbiota: Its Role in Hepatic Encephalopathy. J Clin Exp Hepatol 5: S29–S36. https://doi.org/10.1016/j.jceh.2014.12.003
O’Grady J, Murphy CL, Barry L, Shanahan F, Buckley M (2020) Defining gastrointestinal transit time using video capsule endoscopy: a study of healthy subjects. Endosc Int Open 8: E396–E400. https://doi.org/10.1055/a-1073-7653
Rodríguez-Hernández P, Cardador MJ, Arce L, Rodríguez-Estévez V (2020) Analytical Tools for Disease Diagnosis in Animals via Fecal Volatilome. Crit Rev Anal Chem 1–16. https://doi.org/10.1080/10408347.2020.1843130
Metchnikoff E (1907) Essais optimistes. Paris. A. Maloine
Ивницкий ЮЮ, Шефер ТВ, Рейнюк ВЛ (2012) Эндогенный аммиак в токсическом процессе. Palmarium Acad Publish. [Ivnitsky JuJu, Schäfer TV, Rejniuk VL (2012) Endogenous ammonia in a toxic process. Palmarium Acad Publish. (In Russ)].
Summerskill WHJ, Wolpert E (1970) Ammonia Metabolism in the Gut. Am J Clin Nutr 23: 633–639. https://doi.org/10.1093/ajcn/23.5.633
Gips CH, Qué GS, Wibbens-Alberts M (1973) The arterial ammonia curve after oral and intraduodenal loading with ammonium acetate. Absorption in the stomach. Neth J Med 16: 14–17.
Dobson GP, Veech RL, Passonneau JV, Huang MT (1990) In vivo portal-hepatic venous gradients of glycogenic precursors and incorporation of D-[3-3H]glucose into liver glycogen in the awake rat. J Biol Chem 265: 16350–16357.
Ali R, Nagalli S (2021) Hyperammonemia. StatPearls Publ.
Hahn M, Massen O, Nencki M, Pawlow J (1893) Die Eck’sche Fistel zwischen der unteren Hohlvene und der Pfortader und ihre Folgen für den Organismus. Arch Für Exp Pathol Pharmakol 32: 161–210. https://doi.org/10.1007/BF01995065
Pagana K, Pagana T, Pagana T (2021) Mosby’s manual of diagnostic and laboratory tests. 7th ed. Philadelphia. Elsevier Inc.
Agostini L, Down PF, Murison J, Wrong OM (1972) Faecal ammonia and pH during lactulose administration in man: comparison with other cathartics. Gut 13: 859–866. https://doi.org/10.1136/gut.13.11.859
Scott TR (2013) Pathophysiology of cerebral oedema in acute liver failure. World J Gastroenterol 19: 9240. https://doi.org/10.3748/wjg.v19.i48.9240
Ott P, Vilstrup H (2014) Cerebral effects of ammonia in liver disease: current hypotheses. Metab Brain Dis 29: 901–911. https://doi.org/10.1007/s11011-014-9494-7
Skowrońska M, Albrecht J (2013) Oxidative and nitrosative stress in ammonia neurotoxicity. Neurochem Int 62: 731–737. https://doi.org/10.1016/j.neuint.2012.10.013
Tranah TH, Vijay GKM, Ryan JM, Shawcross DL (2013) Systemic inflammation and ammonia in hepatic encephalopathy. Metab Brain Dis 28: 1–5. https://doi.org/10.1007/s11011-012-9370-2
Jayakumar AR, Norenberg MD (2018) Hyperammonemia in Hepatic Encephalopathy. J Clin Exp Hepatol 8: 272–280. https://doi.org/10.1016/j.jceh.2018.06.007
McClung HJ, Sloan HR, Powers P, Merola AJ, Murray R, Kerzner B, Pollack JD (1990) Early changes in the permeability of the blood-brain barrier produced by toxins associated with liver failure. Pediatr Res 28: 227–231. https://doi.org/10.1203/00006450-199009000-00014
Ochoa-Sanchez R, Rose CF (2018) Pathogenesis of Hepatic Encephalopathy in Chronic Liver Disease. J Clin Exp Hepatol 8: 262–271. https://doi.org/10.1016/j.jceh.2018.08.001
Bested AC, Logan AC, Selhub EM (2013) Intestinal microbiota, probiotics and mental health: from Metchnikoff to modern advances: Part II – Contemporary contextual research. Gut Pathog 5: 3. https://doi.org/10.1186/1757-4749-5-3
Brown GC (2019) The endotoxin hypothesis of neurodegeneration. J Neuroinflammation 16: 180. https://doi.org/10.1186/s12974-019-1564-7
Iba T, Levy JH, Hirota T, Hiki M, Sato K, Murakami T, Nagaoka I (2018) Protection of the endothelial glycocalyx by antithrombin in an endotoxin-induced rat model of sepsis. Thromb Res 171: 1–6. https://doi.org/10.1016/j.thromres.2018.09.042
Minami T, Oda K, Gima N, Yamazaki H (2007) Effects of lipopolysaccharide and chelator on mercury content in the cerebrum of thimerosal-administered mice. Environ Toxicol Pharmacol 24: 316–320. https://doi.org/10.1016/j.etap.2007.08.004
Pfalzgraff A, Weindl G (2019) Intracellular Lipopolysaccharide Sensing as a Potential Therapeutic Target for Sepsis. Trends Pharmacol Sci 40: 187–197. https://doi.org/10.1016/j.tips.2019.01.001
Yoshida N, Yamashita T, Kishino S, Watanabe H, Sasaki K, Sasaki D, Tabata T, Sugiyama Y, Kitamura N, Saito Y, Emoto T, Hayashi T, Takahashi T, Shinohara M, Osawa R, Kondo A, Yamada T, Ogawa J, Hirata K (2020) A possible beneficial effect of Bacteroides on faecal lipopolysaccharide activity and cardiovascular diseases. Sci Rep 10: 13009. https://doi.org/10.1038/s41598-020-69983-z
Wideman RF, Erf GF, Chapman ME (2001) Intravenous Endotoxin Triggers Pulmonary Vasoconstriction and Pulmonary Hypertension in Broiler Chickens. Poult Sci 80: 647–655. https://doi.org/10.1093/ps/80.5.647
Bermejo-Martin J, Martín-Fernandez M, López-Mestanza C, Duque P, Almansa R (2018) Shared Features of Endothelial Dysfunction between Sepsis and Its Preceding Risk Factors (Aging and Chronic Disease). J Clin Med 7: 400. https://doi.org/10.3390/jcm7110400
Corrêa TD, Pereira AJ, Takala J, Jakob SM (2020) Regional venous-arterial CO2 to arterial-venous O2 content difference ratio in experimental circulatory shock and hypoxia. Intensive Care Med Exp 8: 64. https://doi.org/10.1186/s40635-020-00353-9
Yeo IJ, Yun J, Son DJ, Han S-B, Hong JT (2020) Antifungal drug miconazole ameliorated memory deficits in a mouse model of LPS-induced memory loss through targeting iNOS. Cell Death Dis 11: 623. https://doi.org/10.1038/s41419-020-2619-5
Wang L, Cao Y, Gorshkov B, Zhou Y, Yang Q, Xu J, Ma Q, Zhang X, Wang J, Mao X, Zeng X, Su Y, Verin AD, Hong M, Liu Z, Huo Y (2019) Ablation of endothelial Pfkfb3 protects mice from acute lung injury in LPS-induced endotoxemia. Pharmacol Res 146: 104292. https://doi.org/10.1016/j.phrs.2019.104292
Jadhav K, Cohen TS (2020) Can You Trust Your Gut? Implicating a Disrupted Intestinal Microbiome in the Progression of NAFLD/NASH. Front Endocrinol 11: 592157. https://doi.org/10.3389/fendo.2020.592157
Solé C, Guilly S, Da Silva K, Llopis M, Le-Chatelier E, Huelin P, Carol M, Moreira R, Fabrellas N, De Prada G, Napoleone L, Graupera I, Pose E, Juanola A, Borruel N, Berland M, Toapanta D, Casellas F, Guarner F, Doré J, Solà E, Ehrlich SD, Ginès P (2021) Alterations in Gut Microbiome in Cirrhosis as Assessed by Quantitative Metagenomics: Relationship With Acute-on-Chronic Liver Failure and Prognosis. Gastroenterology 160: 206–218.e13. https://doi.org/10.1053/j.gastro.2020.08.054
Nežić L, Škrbić R, Amidžić L, Gajanin R, Milovanović Z, Nepovimova E, Kuča K, Jaćević V (2020) Protective Effects of Simvastatin on Endotoxin-Induced Acute Kidney Injury through Activation of Tubular Epithelial Cells’ Survival and Hindering Cytochrome C-Mediated Apoptosis. Int J Mol Sci 21: E7236. https://doi.org/10.3390/ijms21197236
Soria LR, Marrone J, Molinas SM, Lehmann GL, Calamita G, Marinelli RA (2014) Lipopolysaccharide impairs hepatocyte ureagenesis from ammonia: Involvement of mitochondrial aquaporin-8. FEBS Lett 588: 1686–1691. https://doi.org/10.1016/j.febslet.2014.03.012
Skowrońska M, Zielińska M, Wójcik-Stanaszek L, Ruszkiewicz J, Milatovic D, Aschner M, Albrecht J (2012) Ammonia increases paracellular permeability of rat brain endothelial cells by a mechanism encompassing oxidative/nitrosative stress and activation of matrix metalloproteinases: Ammonia-induced brain endothelium damage. J Neurochem 121: 125–134. https://doi.org/10.1111/j.1471-4159.2012.07669.x
Zijlstra FJ, van Meeteren ME, Garrelds IM, Meijssen MAC (2003) Effect of pharmacologically induced smooth muscle activation on permeability in murine colitis. Mediators Inflamm 12: 21–27. https://doi.org/10.1080/0962935031000096944
Wilms E, Jonkers DMAE, Savelkoul HFJ, Elizalde M, Tischmann L, de Vos P, Masclee AAM, Troost FJ (2019) The Impact of Pectin Supplementation on Intestinal Barrier Function in Healthy Young Adults and Healthy Elderly. Nutrients 11: 1554. https://doi.org/10.3390/nu11071554
Шефер ТВ, Рейнюк ВЛ, Краснов КА, Ивницкий ЮЮ (2011) Повышение циклофосфаном проницаемости тонкой кишки крыс для содержащихся в ее просвете гидрофильных веществ средней молярной массы. Medline.ru. Рос биомед журн 12: 1437–1449. [Schäfer TV, Rejniuk VL, Krasnov KA, Ivnitsky JuJu (2011) Increased permeability of a small intestine to luminal hydrophylic medium-sized molecules in cyclophosphamide-treated rats. Medline.ru. Russ Biomed J 12: 1437–1449. (In Russ)].
Jiang Y, Bian Y, Lian N, Wang Y, Xie K, Qin C, Yu Y (2020) iTRAQ-Based Quantitative Proteomic Analysis of Intestines in Murine Polymicrobial Sepsis with Hydrogen Gas Treatment. Drug Des Devel Ther 14: 4885–4900. https://doi.org/10.2147/DDDT.S271191
Di Palo DM, Garruti G, Di Ciaula A, Molina-Molina E, Shanmugam H, De Angelis M, Portincasa P (2020) Increased Colonic Permeability and Lifestyles as Contributing Factors to Obesity and Liver Steatosis. Nutrients 12: E564. https://doi.org/10.3390/nu12020564
Wick MJ, Harral JW, Loomis ZL, Dempsey EC (2018) An Optimized Evans Blue Protocol to Assess Vascular Leak in the Mouse. J Vis Exp 57037. https://doi.org/10.3791/57037
Alves NG, Motawe ZY, Yuan SY, Breslin JW (2018) Endothelial Protrusions in Junctional Integrity and Barrier Function. Curr Top Membr 82: 93–140. https://doi.org/10.1016/bs.ctm.2018.08.006
Ijiri K, Potten CS (1983) Response of intestinal cells of differing topographical and hierarchical status to ten cytotoxic drugs and five sources of radiation. Br J Cancer 47: 175–185. https://doi.org/10.1038/bjc.1983.25
Куценко СА (2004) Основы токсикологии. СПб. Фолиант. [Kutsenko SA (2004) Fundamentals of Toxicology. Saint-Petersburg. Foliant Publ House. (In Russ)].
Bishehsari F, Magno E, Swanson G, Desai V, Voigt RM, Forsyth CB, Keshavarzian A (2017) Alcohol and Gut-Derived Inflammation. Alcohol Res Curr Rev 38: 163–171.
Zhao Y, Zhou C, Wu C, Guo X, Hu G, Wu Q, Xu Z, Li G, Cao H, Li L, Latigo V, Liu P, Cheng S, Liu P (2020) Subchronic oral mercury caused intestinal injury and changed gut microbiota in mice. Sci Total Environ 721: 137639. https://doi.org/10.1016/j.scitotenv.2020.137639
Akbarali HI, Dewey WL (2017) The gut-brain interaction in opioid tolerance. Curr Opin Pharmacol 37: 126–130. https://doi.org/10.1016/j.coph.2017.10.012
Puel O, Galtier P, Oswald I (2010) Biosynthesis and Toxicological Effects of Patulin. Toxins 2: 613–631. https://doi.org/10.3390/toxins2040613
Karádi O, Nagy Z, Bódis B, Mózsik G (2001) Atropine-induced gastrointestinal cytoprotection dependences to the intact of vagal nerve against indomethacin-induced gastrointestinal mucosal and microvascular damage in rats. J Physiol (Paris) 95: 29–33. https://doi.org/10.1016/s0928-4257(01)00006-7
Ishisono K, Mano T, Yabe T, Kitaguchi K (2019) Dietary Fiber Pectin Ameliorates Experimental Colitis in a Neutral Sugar Side Chain-Dependent Manner. Front Immunol 10: 2979. https://doi.org/10.3389/fimmu.2019.02979
Ge L, Lin Z, Le G, Hou L, Mao X, Liu S, Liu D, Gan F, Huang K (2020) Nontoxic-dose deoxynivalenol aggravates lipopolysaccharides-induced inflammation and tight junction disorder in IPEC-J2 cells through activation of NF-κB and LC3B. Food Chem Toxicol Int J Publ Br Ind Biol Res Assoc 145: 111712. https://doi.org/10.1016/j.fct.2020.111712
Семенов ЭИ, Мишина НН, Папуниди КХ (2019) Неучтенная анафилактическая реакция на действие микотоксинов. Medline.ru. Рос биомед журн 20: 36–43. [Semenov EI, Mishina NN, Papunidi KKh (2019) Unaccounted anaphylactic reaction to effect of mycotoxins. Medline.ru. Russ Biomed J 20: 36–43. (In Russ)].
McMillen KK, Coghlin-Dickson T, Adintori PA (2021) Optimization of nutrition support practices early after hematopoietic cell transplantation. Bone Marrow Transplant 56: 314–326. https://doi.org/10.1038/s41409-020-01078-9
Ivnitsky JuJu, Schäfer TV, Tyaptin AA, Rejniuk VL (2019) Changes in the chemical composition of blood and brain of rats under the conditions of modeling of the myeloablation regimen of cyclophosphamide administration. Toxicol Rev 13–18. https://doi.org/10.36946/0869-7922-2019-3-13-18
Ivnitsky JuJu, Schäfer TV, Rejniuk VL (2011) Promotion of the Toxic Action of Cyclophosphamide by Digestive Tract Luminal Ammonia in Rats. ISRN Toxicol 2011: 1–4. https://doi.org/10.5402/2011/450875
Rejniuk VL, Schäfer TV, Ivnitsky JuJu (2010) Increase of Ammonia Pool in the Gastrointestinal Tract of Rats Potentiates Acute Toxicity of Cyclophosphamide. Bull Exp Biol Med 149: 718–720. https://doi.org/10.1007/s10517-010-1034-9
Khyzhnyak SV, Bezdrobna LK, Stepanova LI, Morozova VS, Voitsitskiy VM (2014) Oxidative phosphorylation in mitochondria of small-intestinal enterocytes at chronic and single exposure to low power ionizing radiation. Probl Rad Med Radiobiol 19: 482–489.
Khanna K, Mishra KP, Chanda S, Eslavath MR, Ganju L, Kumar B, Singh SB (2019) Effects of Acute Exposure to Hypobaric Hypoxia on Mucosal Barrier Injury and the Gastrointestinal Immune Axis in Rats. High Alt Med Biol 20: 35–44. https://doi.org/10.1089/ham.2018.0031
Hill GW, Gillum TL, Lee BJ, Romano PA, Schall ZJ, Hamilton AM, Kuennen MR (2020) Prolonged treadmill running in normobaric hypoxia causes gastrointestinal barrier permeability and elevates circulating levels of pro- and anti-inflammatory cytokines. Appl Physiol Nutr Metab Physiol Appl Nutr Metab 45: 376–386. https://doi.org/10.1139/apnm-2019-0378
Abuga KM, Muriuki JM, Williams TN, Atkinson SH (2020) How Severe Anaemia Might Influence the Risk of Invasive Bacterial Infections in African Children. Int J Mol Sci 21: E6976. https://doi.org/10.3390/ijms21186976
Khazoom F, L’Écuyer S, Gilbert K, Gagné M-A, Bouchard C, Rose CF, Rousseau G, Charbonney E (2020) Impact of uric acid on liver injury and intestinal permeability following resuscitated hemorrhagic shock in rats. J Trauma Acute Care Surg 89: 1076–1084. https://doi.org/10.1097/TA.0000000000002868
Saxena A, Lopes F, McKay DM (2018) Reduced intestinal epithelial mitochondrial function enhances in vitro interleukin-8 production in response to commensal Escherichia coli. Inflamm Res 67: 829–837. https://doi.org/10.1007/s00011-018-1172-5
Bär F, Bochmann W, Widok A, von Medem K, Pagel R, Hirose M, Yu X, Kalies K, König P, Böhm R, Herdegen T, Reinicke AT, Büning J, Lehnert H, Fellermann K, Ibrahim S, Sina C (2013) Mitochondrial gene polymorphisms that protect mice from colitis. Gastroenterology 145: 1055–1063.e3. https://doi.org/10.1053/j.gastro.2013.07.015
Звенигородская ЛА, Самсонова НГ, Топорков АС (2010) Хроническая ишемическая болезнь органов пищеварения: алгоритм диагностики и лечения. Рус мед журн 9: 544–548. [Zvenigorodskaya LA, Samsonova NG, Toporkov AS (2010) Chronic ischemic disease of the digestive system: an algorithm for diagnosis and treatment. Russ Med Zhurn 9: 544–548. (In Russ)].
Uno Y (2019) Hypothesis: Mechanism of irritable bowel syndrome in inflammatory bowel disease. Med Hypotheses 132: 109324. https://doi.org/10.1016/j.mehy.2019.109324
Lychkova AE (2005) Gradients of serotoninergic innervation of the large intestine. Bull Exp Biol Med 139: 550–553. https://doi.org/10.1007/s10517-005-0342-y
Deane AM, Chapman MJ, Reintam Blaser A, McClave SA, Emmanuel A (2019) Pathophysiology and Treatment of Gastrointestinal Motility Disorders in the Acutely Ill. Nutr Clin Pract Off Publ Am Soc Parenter Enter Nutr 34: 23–36. https://doi.org/10.1002/ncp.10199
Ivnitsky JuJu, Rejniuk VL, Schäfer TV, Malakhovsky VN (2006) Fulminant hyperammonaemia induced by thiopental coma in rats. Toxicology 224: 184–190. https://doi.org/10.1016/j.tox.2006.04.002
Schäfer TV, Ivnitsky JuJu, Rejniuk VL (2022) Modelling myeloablative cytostatic therapy with cyclophosphamide is accompanied by gastrointestinal stasis in rats. Med Extrem Situat 1: 51–55. https://doi.org/10.47183/mes.2022.001
Visek WJ (1972) Effects of urea hydrolysis on cell life-span and metabolism. Fed Proc 31: 1178–1193.
Zhao J, He Y, Xu P, Liu J, Ye S, Cao Y (2020) Serum ammonia levels on admission for predicting sepsis patient mortality at D28 in the emergency department: A 2-center retrospective study. Medicine (Baltimore) 99: e19477. https://doi.org/10.1097/MD.0000000000019477
Horioka K, Tanaka H, Isozaki S, Konishi H, Fujiya M, Okuda K, Asari M, Shiono H, Ogawa K, Shimizu K (2020) Acute Colchicine Poisoning Causes Endotoxemia via the Destruction of Intestinal Barrier Function: The Curative Effect of Endotoxin Prevention in a Murine Model. Dig Dis Sci 65: 132–140. https://doi.org/10.1007/s10620-019-05729-w
Lee SI, Kang KS (2017) Function of capric acid in cyclophosphamide-induced intestinal inflammation, oxidative stress, and barrier function in pigs. Sci Rep 7: 16530. https://doi.org/10.1038/s41598-017-16561-5
Herbers AHE, de Haan AFJ, van der Velden WJFM, Donnelly JP, Blijlevens NMA (2014) Mucositis not neutropenia determines bacteremia among hematopoietic stem cell transplant recipients. Transpl Infect Dis Off J Transplant Soc 16: 279–285. https://doi.org/10.1111/tid.12195
Mathieson PW, Thiru S, Oliveira DB (1992) Mercuric chloride-treated brown Norway rats develop widespread tissue injury including necrotizing vasculitis. Lab Invest J Tech Methods Pathol 67: 121–129.
Winnard KP, Dmitrieva N, Berkley KJ (2006) Cross-organ interactions between reproductive, gastrointestinal, and urinary tracts: modulation by estrous stage and involvement of the hypogastric nerve. Am J Physiol-Regul Integr Comp Physiol 291: R1592–R1601. https://doi.org/10.1152/ajpregu.00455.2006
Matkevich VA, Luzhnikov EA, Belova MV, Yevdokimova NV, Syromyatnikova ED, Kurilkin YA (2015) The role of intestinal translocation in the origin of endotoxemia in acute poisoning and detoxification effect of intestinal lavage. Russ Sklifosovsky J Emerg Med Care 16–21.
Matkevich VA, Potskhveriya MM, Goldfarb YuS, Simonova AYu (2018) Violations of homeostasis parameters in acute poisonings and ways of their correction. Toxicol Rev 18–26. https://doi.org/10.36946/0869-7922-2018-3-18-26
Aburto-Fernández MDC, Araujo-López A, García-Godoy IU, Alvarado-González A, Gutiérrez-Samperio JL, de Orendáin AÁ-M, Ocio MAR, Arteaga-Villalba LR, Herrera-Díaz A, Jiménez-Ríos CO, Lerma-Alvarado RM (2019) Secondary colonic necrosis. Case report. Cir Cir 87: 33–37. https://doi.org/10.24875/CIRU.18000656
Chaung WW, Brenner M, Yen H-T, Ochani ML, Jacob A, Wang P (2019) Recombinant human milk fat globule-EGF factor VIII (rhMFG-E8) as a therapy for sepsis after acute exposure to alcohol. Mol Med Camb Mass 25: 52. https://doi.org/10.1186/s10020-019-0118-x
Johansson J-E, Hasséus B, Johansson P, Eklöf C, Ohman D, Stockelberg D (2009) Gut protection by palifermin during autologous haematopoietic SCT. Bone Marrow Transplant 43: 807–811. https://doi.org/10.1038/bmt.2008.388
Guinan EC, Palmer CD, Mancuso CJ, Brennan L, Stoler-Barak L, Kalish LA, Suter EE, Gallington LC, Huhtelin DP, Mansilla M, Schumann RR, Murray JC, Weiss J, Levy O (2014) Identification of single nucleotide polymorphisms in hematopoietic cell transplant patients affecting early recognition of, and response to, endotoxin. Innate Immun 20: 697–711. https://doi.org/10.1177/1753425913505122
Laemmle A, Hahn D, Hu L, Rüfenacht V, Gautschi M, Leibundgut K, Nuoffer J-M, Häberle J (2015) Fatal hyperammonemia and carbamoyl phosphate synthetase 1 (CPS1) deficiency following high-dose chemotherapy and autologous hematopoietic stem cell transplantation. Mol Genet Metab 114: 438–444. https://doi.org/10.1016/j.ymgme.2015.01.002
Uygun V, Karasu G, Daloğlu H, Hazar V, Yeşilipek A (2015) Idiopathic hyperammonemia after hematopoietic stem cell transplantation: A case report. Pediatr Transplant 19: E104–E105. https://doi.org/10.1111/petr.12467
Webster LT (1965) Hepatic coma – a biochemical disorder of the brain. Gastroenterology 49: 698–702.
Kimura A, Yoshida I, Ono E, Matsuishi T, Yoshino M, Yamashita F, Yamamoto M, Hashimoto T, Shinka T, Kuhara T (1986) Acute encephalopathy with hyperammonemia and dicarboxylic aciduria during calcium hopantenate therapy: a patient report. Brain Dev 8: 601–605. https://doi.org/10.1016/s0387-7604(86)80006-7
Slyundin DG, Aleкhnovich AV, Ivanov VB, Livanov AS, Anuchin VV (2010) The pharmacological correction of hyperammoniemisis conditions at the criminal poisoning clozapine. Medline.ru. Russ Biomed J 11: 518–525.
Kramer L, Bauer E, Schenk P, Steininger R, Vigl M, Mallek R (2003) Successful treatment of refractory cerebral oedema in ecstasy/cocaine-induced fulminant hepatic failure using a new high-efficacy liver detoxification device (FPSA-Prometheus). Wien Klin Wochenschr 115: 599–603. https://doi.org/10.1007/BF03040456
Goldberg JE, Hamilton WK (1959) Blood ammonia levels during ether and cyclopropane anesthesia. Anesthesiology 20: 836–841. https://doi.org/10.1097/00000542-195911000-00015
Yamamoto H (1993) Relationship among cyanide-induced encephalopathy, blood ammonia levels, and brain aromatic amino acid levels in rats. Bull Environ Contam Toxicol 50: 274–281. https://doi.org/10.1007/BF00191733
Ивницкий ЮЮ, Шефер ТВ, Рейнюк ВЛ (2010) Перераспределение аммиака между пищеварительным трактом и кровью при моделировании алкогольной комы: роль в формировании летального исхода. Патол физиол экспер терапия 3:34–37. [Ivnitsky JuJu, Schäfer TV, Rejniuk VL (2010) Redistribution of gastrointestinal ammonia into blood in alcohol coma rat: the role in lethal outcome. Patol fiziol eksperim terapiya 3: 34–37. (In Russ)].
Watanabe A, Kuwabara Y (1994) Hyperammonemia induced in rats by inhalation anesthesia with ether. Res Exp Med (Berl) 194: 157–164. https://doi.org/10.1007/BF02576376
Proudfoot AT, Bradberry SM, Vale JA (2006) Sodium fluoroacetate poisoning. Toxicol Rev 25: 213–219. https://doi.org/10.2165/00139709-200625040-00002
Mitani S, Kadowaki S, Komori A, Sugiyama K, Narita Y, Taniguchi H, Ura T, Ando M, Sato Y, Yamaura H, Inaba Y, Ishihara M, Tanaka T, Tajika M, Muro K (2017) Acute hyperammonemic encephalopathy after fluoropyrimidine-based chemotherapy: A case series and review of the literature. Medicine (Baltimore) 96: e6874. https://doi.org/10.1097/MD.0000000000006874
Blennow G, Folbergrova J, Nilsson B, Siesjö BK (1979) Cerebral metabolic and circulatory changes in the rat during sustained seizures induced by DL-homocysteine. Brain Res 179: 129–146. https://doi.org/10.1016/0006-8993(79)90497-9
Maslinski PG, Loeb JA (2004) Pica-associated cerebral edema in an adult. J Neurol Sci 225: 149–151. https://doi.org/10.1016/j.jns.2004.07.016
Foster WA, Schoenhals JA (1995) Hyperammonemia with severe methanol intoxication. West J Med 163: 377–379.
Singh AK, Banister EW (1983) Tissue ammonia and amino acids in rats at various oxygen pressures. J Appl Physiol 54: 438–444. https://doi.org/10.1152/jappl.1983.54.2.438
Simma B, Meister B, Deutsch J, Sperl W, Fend F, Öfner D, Margreiter R, Vogel W (1995) Fulminant hepatic failure in a child as a potential adverse effect of trimethoprim-sulphamethoxazole. Eur J Pediatr 154: 530–533. https://doi.org/10.1007/BF02074828
Woo PYM, Woo AWY, Lam SW, Ko NMW, Ho JWK, Chu ACH, Kwan MCL, Chan Y, Wong H-T, Chan K-Y (2020) Incidence, Presentation, and Risk Factors for Sodium Valproate–Associated Hyperammonemia in Neurosurgical Patients: A Prospective, Observational Study. World Neurosurg 144: e597–e604. https://doi.org/10.1016/j.wneu.2020.09.027
Козлов НБ (1971) Аммиак, его обмен и роль в патологии. М. Медицина. [Kozlov NB (1971) Ammonia, its exchange and role in pathology. Moscow. Medicina. (In Russ)].
Gao C, Wang D, Li W, Guo X, Ma J, Xie Y (2020) [Value of blood ammonia on predicting the severity and prognosis of patients with sepsis: a prospective observation study]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue 32: 1315–1319. https://doi.org/10.3760/cma.j.cn121430-20200305-00210
Singla A, Kaur S, Kaur N, Gill C (2016) Arterial ammonia levels: Prognostic marker in traumatic hemorrhage. Int J Appl Basic Med Res 6: 255. https://doi.org/10.4103/2229-516X.192601
Hagiwara A, Sakamoto T (2009) Clinical Significance of Plasma Ammonia in Patients With Traumatic Hemorrhage. J Trauma Inj Infect Crit Care 67: 115–120. https://doi.org/10.1097/TA.0b013e3181a5e63e
Lin C-H, Chi C-H, Wu S-Y, Hsu H-C, Chang Y-H, Huang Y-Y, Chang C-J, Hong M-Y, Chan T-Y, Shih H-I (2013) Prognostic values of blood ammonia and partial pressure of ammonia on hospital arrival in out-of-hospital cardiac arrests. Am J Emerg Med 31: 8–15. https://doi.org/10.1016/j.ajem.2012.04.037
Fujiwara Y, Ohnishi K, Horlad H, Saito Y, Shiraishi D, Takeya H, Yoshii D, Kaieda S, Hoshino T, Komohara Y (2020) CD163 deficiency facilitates lipopolysaccharide-induced inflammatory responses and endotoxin shock in mice. Clin Transl Immunol 9: e1162. https://doi.org/10.1002/cti2.1162
Luna M, Kamariski M, Principi I, Bocanegra V, Vallés PG (2021) Severely ill pediatric patients with Shiga toxin-associated hemolytic uremic syndrome (STEC-HUS) who suffered from multiple organ involvement in the early stage. Pediatr Nephrol 36: 1499–1509. https://doi.org/10.1007/s00467-020-04829-4
Hu C, Sun J, Du J, Wen D, Lu H, Zhang H, Xue Y, Zhang A, Yang C, Zeng L, Jiang J (2019) The Hippo-YAP pathway regulates the proliferation of alveolar epithelial progenitors after acute lung injury. Cell Biol Int 43: 1174–1183. https://doi.org/10.1002/cbin.11098
Thuijls G, Derikx JPM, Haan J-J de, Grootjans J, Bruïne A de, Masclee AAM, Heineman E, Buurman WA (2010) Urine-based Detection of Intestinal Tight Junction Loss. J Clin Gastroenterol 44: e14–e19. https://doi.org/10.1097/MCG.0b013e31819f5652
Храмых ТП, Долгих ВТ (2009) К вопросу об эндотоксемии при геморрагической гипотензии. Патол физиол эксперим терапия 1: 28–29. [Khramykh TP, Dolgikh VT (2009) Endotoxemia in hemorrhagic hypotension. Patol fiziol eksperim terapiya 1: 28–30. (In Russ)].
Kumar M, Kaeley N, Nagasubramanyam V, Bhardwaj BB, Kumar S, Kabi A, Arora P, Dhar M (2019) Single center experience of managing methanol poisoning in the hilly state of Uttarakhand: A cross sectional study. Int J Crit Illn Inj Sci 9: 172–176. https://doi.org/10.4103/IJCIIS.IJCIIS_49_19
Chew CH, Cheng L-W, Huang W-T, Wu YM, Lee C-W, Wu M-S, Chen C-C (2020) Ultrahigh packing density next generation microtube array membrane: A novel solution for absorption-based extracorporeal endotoxin removal device. J Biomed Mater Res B Appl Biomater 108: 2903–2911. https://doi.org/10.1002/jbm.b.34621
Novosad SA, Sapiano MRP, Grigg C, Lake J, Robyn M, Dumyati G, Felsen C, Blog D, Dufort E, Zansky S, Wiedeman K, Avery L, Dantes RB, Jernigan JA, Magill SS, Fiore A, Epstein L (2016) Vital Signs: Epidemiology of Sepsis: Prevalence of Health Care Factors and Opportunities for Prevention. MMWR Morb Mortal Wkly Rep 65: 864–869. https://doi.org/10.15585/mmwr.mm6533e1
Śmiechowicz J (2022) The Rationale and Current Status of Endotoxin Adsorption in the Treatment of Septic Shock. J Clin Med 11: 619. https://doi.org/10.3390/jcm11030619
Chen S, Xiu G, Zhou J, Liu P, Chen X, Sun J, Ling B (2020) [Role of high mobility group box 1 in intestinal mucosal barrier injury in rat with sepsis induced by endotoxin]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue 32: 803–807. https://doi.org/10.3760/cma.j.cn121430-20200109-00126
Colbert JF, Schmidt EP (2016) Endothelial and Microcirculatory Function and Dysfunction in Sepsis. Clin Chest Med 37: 263–275. https://doi.org/10.1016/j.ccm.2016.01.009
Soltanian A, Mosallanejad B, Razi Jalali M, Najafzadeh Varzi H, Ghorbanpoor M (2020) Comparative evaluation of the therapeutic effects of silymarin and hydrocortisone on clinical and hematological alterations, and organ injury (liver and heart) in low-dose canine lipopolysaccharide-induced sepsis model. Vet Res Forum 11: 235–241. https://doi.org/10.30466/vrf.2018.83961.2105
Pool R, Gomez H, Kellum JA (2018) Mechanisms of Organ Dysfunction in Sepsis. Crit Care Clin 34: 63–80. https://doi.org/10.1016/j.ccc.2017.08.003
Maniatis NA, Kotanidou A, Catravas JD, Orfanos SE (2008) Endothelial pathomechanisms in acute lung injury. Vascul Pharmacol 49: 119–133. https://doi.org/10.1016/j.vph.2008.06.009
Wang W, Weng J, Yu L, Huang Q, Jiang Y, Guo X (2018) Role of TLR4-p38 MAPK-Hsp27 signal pathway in LPS-induced pulmonary epithelial hyperpermeability. BMC Pulm Med 18: 178. https://doi.org/10.1186/s12890-018-0735-0
Forrester SJ, Xu Q, Kikuchi DS, Okwan-Duodu D, Campos AC, Faidley EA, Zhang G, Lassègue B, Sadikot RT, Griendling KK, Hernandes MS (2019) Poldip2 deficiency protects against lung edema and vascular inflammation in a model of acute respiratory distress syndrome. Clin Sci Lond Engl 133: 321–334. https://doi.org/10.1042/CS20180944
Al-Ani B, ShamsEldeen AM, Kamar SS, Haidara MA, Al-Hashem F, Alshahrani MY, Al-Hakami AM, Kader DHA, Maarouf A (2022) Lipopolysaccharide induces acute lung injury and alveolar haemorrhage in association with the cytokine storm, coagulopathy and AT1R/JAK/STAT augmentation in a rat model that mimics moderate and severe Covid-19 pathology. Clin Exp Pharmacol Physiol 49: 483–491. https://doi.org/10.1111/1440-1681.13620
Bloom PP, Rodriguez-Lopez J, Witkin AS, Al-Samkari H, Kuter DJ, Mojtahed A, Luther J (2020) Ammonia Predicts Hepatic Involvement and Pulmonary Hypertension in Patients With Hereditary Hemorrhagic Telangiectasia. Clin Transl Gastroenterol 11: e00118. https://doi.org/10.14309/ctg.0000000000000118
Liang X-Y, Jia T-X, Zhang M (2021) Intestinal bacterial overgrowth in the early stage of severe acute pancreatitis is associated with acute respiratory distress syndrome. World J Gastroenterol 27: 1643–1654. https://doi.org/10.3748/wjg.v27.i15.1643
Шилов ВВ, Александров МВ, Васильев СА, Александрова ТВ, Черный ВС (2010) Острая церебральная недостаточность при тяжелых отравлениях. Medline.ru. Рос биомед журн 11: 315–321. [Shilov VV, Aleksandrov MV, Vasilev SA, Aleksandrova TV, Chernyi VS (2010) Acute cerebral failure at the serious poisoning. Medline.ru. Russ Biomed J 11(art. 25): 315–321. (In Russ)].
Sheikh MF, Unni N, Agarwal B (2018) Neurological Monitoring in Acute Liver Failure. J Clin Exp Hepatol 8: 441–447. https://doi.org/10.1016/j.jceh.2018.04.013
Pang R, Martinello KA, Meehan C, Avdic-Belltheus A, Lingam I, Sokolska M, Mutshiya T, Bainbridge A, Golay X, Robertson NJ (2020) Proton Magnetic Resonance Spectroscopy Lactate/N-Acetylaspartate Within 48 h Predicts Cell Death Following Varied Neuroprotective Interventions in a Piglet Model of Hypoxia-Ischemia With and Without Inflammation-Sensitization. Front Neurol 11: 883. https://doi.org/10.3389/fneur.2020.00883
Wood T, Moralejo D, Corry K, Fisher C, Snyder JM, Acuna V, Holden-Hunt A, Virk S, White O, Law J, Parikh P, Juul SE (2019) A Ferret Model of Inflammation-sensitized Late Preterm Hypoxic-ischemic Brain Injury. J Vis Exp (153): e60131. https://doi.org/10.3791/60131
Zhou Y, Huang X, Zhao T, Qiao M, Zhao X, Zhao M, Xu L, Zhao Y, Wu L, Wu K, Chen R, Fan M, Zhu L (2017) Hypoxia augments LPS-induced inflammation and triggers high altitude cerebral edema in mice. Brain Behav Immun 64: 266–275. https://doi.org/10.1016/j.bbi.2017.04.013
Chicherin IYu, Pogorelsky IP, Lundovskikh IA, Gavrilov KE, Shabalina MR, Darmov IV (2013) Autoprobiotic therapy. J Infectology 5: 43–54. https://doi.org/10.22625/2072-6732-2013-5-4-43-54
Shenderov BA (2011) Probiotics and Functional Foods. In: Food Engineering. Oxford. UK. EOLSS Publishers. p 36.
Suvorov A (2013) Gut Microbiota, Probiotics, and Human Health. Biosci Microbiota Food Health 32: 81–91. https://doi.org/10.12938/bmfh.32.81
Gromova LV, Ermolenko EI, Sepp AL, Dmitrieva YV, Alekseeva AS, Lavrenova NS, Kotyleva MP, Kramskaya TA, Karaseva AB, Suvorov AN, Gruzdkov AA (2021) Gut Digestive Function and Microbiome after Correction of Experimental Dysbiosis in Rats by Indigenous Bifidobacteria. Microorganisms 9: 522. https://doi.org/10.3390/microorganisms9030522
Шефер ТВ, Ивницкий ЮЮ, Рейнюк ВЛ (2015) Влияние сока подорожника на проявления и исход острой интоксикации циклофосфаном у крыс. Биопрепараты 3: 61–63. [Schäfer TV, Ivnitsky JuJu, Rejniuk VL (2015) The influence of the plantain juice on the manifestations and outcome of acute cyclophosphamide intoxication in rats. Biopreparaty 55(3): 61–64. (In Russ)].
Sabando C, Ide W, Rodríguez-Díaz M, Cabrera-Barjas G, Castaño J, Bouza R, Müller N, Gutiérrez C, Barral L, Rojas J, Martínez F, Rodríguez-Llamazares S (2020) A Novel Hydrocolloid Film Based on Pectin, Starch and Gunnera tinctoria and Ugni molinae Plant Extracts for Wound Dressing Applications. Curr Top Med Chem 20: 280–292. https://doi.org/10.2174/1568026620666200124100631
Çağan E, Ceylan S, Mengi Ş, Çağan HH (2017) Evaluation of Gelatin Tannate Against Symptoms of Acute Diarrhea in Pediatric Patients. Med Sci Monit Int Med J Exp Clin Res 23: 2029–2034. https://doi.org/10.12659/msm.903158
Rinaldi B, Cuzzocrea S, Donniacuo M, Capuano A, Di Palma D, Imperatore F, Mazzon E, Di Paola R, Sodano L, Rossi F (2011) Hyperbaric oxygen therapy reduces the toll-like receptor signaling pathway in multiple organ failures. Intensive Care Med 37: 1110–1119. https://doi.org/10.1007/s00134-011-2241-1
Alshami A, Einav S, Skrifvars MB, Varon J (2020) Administration of inhaled noble and other gases after cardiopulmonary resuscitation: A systematic review. Am J Emerg Med 38: 2179–2184. https://doi.org/10.1016/j.ajem.2020.06.066
Assimakopoulos SF, Papadopoulou I, Bantouna D, de Lastic A-L, Rodi M, Mouzaki A, Gogos CA, Zolota V, Maroulis I (2021) Fecal Microbiota Transplantation and Hydrocortisone Ameliorate Intestinal Barrier Dysfunction and Improve Survival in a Rat Model of Cecal Ligation and Puncture-Induced Sepsis. Shock Augusta Ga 55: 666–675. https://doi.org/10.1097/SHK.0000000000001566
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова