Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 7, стр. 861-873
Анализ нейрогенеза в гиппокампе мышей при краткосрочном антиортостатическом вывешивании
Е. А. Олейник 1, А. А. Наумова 1, Ю. С. Григорьева 1, В. Т. Бахтеева 1, Е. А. Лаврова 1, Е. В. Черниговская 1, М. В. Глазова 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: mglazova@iephb.ru
Поступила в редакцию 16.05.2022
После доработки 24.06.2022
Принята к публикации 24.06.2022
- EDN: IKXLWH
- DOI: 10.31857/S0869813922070081
Аннотация
Длительные космические полеты и симулируемая микрогравитация оказывают негативное влияние на целый ряд когнитивных функций, включая память, обучение, ориентацию в пространстве и принятие решений. В то же время известно, что в регуляции когнитивных процессов важную роль играет гиппокампальный нейрогенез. В настоящей работе было исследовано влияние 3-дневной двигательной разгрузки задних конечностей (антиортостатического вывешивания) на активность нейрогенеза в гиппокампе мышей. В экспериментах были использованы взрослые самцы мышей линии CD1. Наши результаты показали, что 3-дневное вывешивание не оказывает влияния на пролиферацию клеток и численность незрелых doublecortin-позитивных нейронов, однако вызывает снижение числа ранних nestin-позитивных нейрональных предшественников. Анализ сигнальных каскадов, вовлеченных в регуляцию гиппокампального нейрогенеза, не выявил изменений в активности протеинкиназ ERK1/2, однако показал повышение экспрессии и фосфорилирования транскрипционного фактора CREB. Кроме того, после 3-дневного вывешивания у мышей наблюдалось значительное увеличение концентрации кортикостерона в крови, а также экспрессии глюкокортикоидных рецепторов в гранулярных клетках и поле СА3 гиппокампа, что свидетельствует о развитии стрессорного ответа. Таким образом, стресс, отражающий адаптацию организма к двигательной разгрузке, может являться ключевым фактором, опосредующим нарушения гиппокампального нейрогенеза при кратковременном воздействии симулируемой микрогравитации.
Впервые постнатальный нейрогенез у млекопитающих был открыт Altman и Das в 1965 г. [1]. В головном мозге взрослых млекопитающих выявлены две основные нейрогенные ниши: субгранулярная зона зубчатой извилины и субвентрикулярная зона боковых желудочков мозга. Десятилетия исследований показали, что гиппокампальный нейрогенез представляет собой гибкий процесс, который зависит от множества различных факторов [2]. В частности, физически активная жизнь и обогащенная среда стимулируют нейрогенез, что коррелирует с улучшением когнитивных функций [2]. И наоборот, произвольный малоподвижный образ жизни или гипокинезия, вызванная травмами или заболеваниями, могут негативно сказаться как на нейрогенезе, так и на когнитивных функциях [3, 4]. В то же время молекулярные механизмы регуляции нейрогенеза при различных патологических состояниях до сих пор остаются малоизученными.
Было показано, что микрогравитация в условиях длительных космических миссий не только влияет на опорно-двигательный аппарат, сердечно-сосудистую и другие периферические системы, но и приводит к целому ряду нарушений в центральной нервной системе как у человека, так и у животных [5, 6]. МРТ-исследования выявили различные морфологические изменения в головном мозге астронавтов после длительного космического полета, в том числе изменение плотности и объема серого вещества, увеличение объема желудочков и снижение функциональных связей [6–8]. Сходные отклонения наблюдались у добровольцев в аналоговых экспериментах, позволяющих симулировать влияние микрогравитации на Земле, в первую очередь – в модели антиортостатической гипокинезии (АНОГ, или Head-down bed rest, HDBR) [7–10]. Кроме того, длительные космические полеты и АНОГ могут вызвать некоторые когнитивные изменения, такие как нарушения кратковременной памяти, переключения внимания, ориентации в пространстве и т.д. [11]. Очевидно, что выявленные патологии связаны с нарушением нейрохимических и молекулярных механизмов, которые были выявлены в экспериментах на животных. В частности, когнитивные нарушения могут быть связаны с нарушением работы гиппокампа, который участвует в обучении, формировании памяти и эмоций, пространственной ориентации, а также является нейрогенной зоной взрослого мозга. Сдвиг цереброспинальной жидкости и морфологические изменения, выявленные в коре, также указывают на изменения работы нейронов. Показано, что изменения окружающей среды и некоторые патологии, такие как эпилепсия и нейродегенеративные заболевания, могут существенно влиять на микроанатомию и функции гиппокампа [12–14]. В то же время данные о влиянии микрогравитации на гиппокамп пока ограничены. На данный момент опубликована только одна работа, в которой при помощи МРТ продемонстрировано уменьшение объема серого вещества в гиппокампе человека после 30-дневного воздействия АНОГ [15]. При этом полностью отсутствуют данные об уровне активности постнатального нейрогенеза во время или после космического полета. С другой стороны, в нескольких работах продемонстрировано негативное влияние длительной разгрузки задних конечностей на нейрогенез гиппокампа грызунов [16, 17]. Метод антиортостатической разгрузки задних конечностей (метод вывешивания по Новикову–Ильину в модификации Morey–Holton) является широко используемой моделью симулированной микрогравитации, воспроизводящей такие изменения, как снижение двигательной активности, атрофия мышц задних конечностей и сдвиг жидкости к голове [18, 19].
В регуляции постнатального нейрогенеза в гиппокампе взрослых млекопитающих задействован целый ряд сигнальных механизмов. Одним из основных регуляторов нейрональной дифференцировки являются протеинкиназы ERK1/2 (extracellular signal-regulated kinases 1, 2) [20]. Кроме того, было показано, что в регуляции дифференцировки нейронов гиппокампа участвует нейромедиатор глутамат [21, 22]. В наших предыдущих исследованиях мы показали, что 3-дневное антиортостатическое вывешивание приводит к снижению глутаматергической нейротрансмиссии [23] и уменьшению числа незрелых doublecortin (DCX)-позитивных нейронов в гиппокампе крыс [24]. Эти изменения сопровождались значительным снижением активности ERK1/2 киназ. В то же время известно, что скорость нейрогенеза у разных млекопитающих различается [25]. В частности, уровень пролиферации нейрональных стволовых клеток и скорость созревания нейронов в гиппокампе у крыс значительно выше, чем у мышей [26]. В данной работе мы провели исследование влияния 3-суточного вывешивания на уровень нейрогенеза в гипокампе мышей. Полученные данные показали, что в отличие от крыс у мышей кратковременное вывешивание не оказало значительного влияния на пролиферацию клеток и на популяцию DCX-позитивных незрелых нейронов в гиппокампе, но приводило к значительному снижению числа nestin-позитивных нейрональных прогениторных клеток. Эти изменения сопровождались повышением активности транскрипционного фактора CREB (cAMP responsive element binding protein), однако активность ERK1/2-киназ при этом не изменялась. При этом повышенное содержание кортикостерона в крови, а также повышенная экспрессия глюкокортикоидных рецепторов в гиппокампе, наблюдаемые после кратковременной двигательной разгрузки, свидетельствовали о развитии стрессорного ответа, который может являться ключевым фактором снижения нейрогенеза в условиях двигательной разгрузки.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные. В экспериментах были использованы половозрелые самцы мышей линии CD1 в возрасте 4–5 мес. (n = 20). Мышей содержали в стандартных условиях вивария при естественном освещении и свободном доступе к еде и воде. Все процедуры с использованием животных проводились в соответствии с Правилами обращения с лабораторными животными Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН, согласующимися с директивой Европарламента 2010/63/ЕС от 22.09.2010 г.
Животные были разделены на две группы: 1. Контроль (n = 10); 2. Антиортостатическое вывешивание по методу Новикова–Ильина в модификации Morey–Holton (hindlimb unloading, HU; n = 10). Каждое животное из группы HU помещали в индивидуальную клетку. Хвост животного прикрепляли с помощью пластыря к гибкому подвесу, который присоединяли через систему карабинов к горизонтальному металлическому стержню в верхней части клетки. Угол между телом животного и дном клетки составлял 30 градусов. Таким образом, задние конечности мыши не взаимодействовали с опорой и не участвовали в локомоции, однако животное могло свободно перемещаться по клетке с использованием передних конечностей. Животные контрольной группы помещались в такие же индивидуальные клетки, но не испытывали никаких ограничений локомоции. Длительность вывешивания составляла 3 суток. Все животные были выведены из эксперимента на следующий день.
По окончании эксперимента у всех животных брали кровь для дальнейшего иммуноферментного анализа концентрации кортикостерона. 5 животных из каждой экспериментальной группы были декапитированы, гиппокампы иссекали из мозга, гомогенизировали в лизирующем буфере (20 мM Tris, pH 7.5, 1% Triton-X100, 100 мM NaCl, 1 мM EDTA, 1 мM EGTA), содержащем ингибиторы протеаз (Sigma-Aldrich, #P8340) и фосфатаз (Roche, #04906837001), и центрифугировали 15 мин при 12000 g при комнатной температуре. Полученный супернатант разводили в соотношении 1 : 2 трехкратным SDS буфером (0.2 М Tris-HCl, pH 6.7; 6% SDS; 15% глицерин; 0.003% бромфеноловый синий, 10% β-меркаптоэтанол), инкубировали 10 мин при 96°С, замораживали и хранили при –20°С для дальнейшего Вестерн-блот анализа.
Остальных животных наркотизировали внутрибрюшинным введением смеси золетила и ксилазина (60 + 10 мг/кг; Virbac) и перфузировали транскардиально холодным 4%-ным параформальдегидом. Мозг извлекали и постфиксировали в 4%-ном параформальдегиде в течение 3 суток при 4°С, далее инкубировали в 20%-ном растворе сахарозы на фосфатно-солевом буфере, замораживали и хранили при –80°С для дальнейшего иммуногистохимического анализа.
Иммуноферментный анализ. Содержание кортикостерона в сыворотке крови определяли с помощью коммерческого набора реактивов “Кортикостерон крыса/мышь-ИФА” (ООО “ХЕМА”, #K210R) в соответствии с инструкцией производителя.
Иммуногистохимический/иммунофлуоресцентный анализ. Чередующиеся серии срезов мозга толщиной 10 мкм изготовляли на криостате Leica. Анализ каждого белка интереса проводился одновременно в контрольной и экспериментальной группах животных в стандартных условиях. После стандартной предварительной обработки гистологические срезы, содержащие дорсальный гиппокамп, инкубировали с первичными антителами против doublecortin (DCX) (1 : 300; Cell Signaling, #4604), Ki67 (1 : 300; Millipore, #AB9260), nestin (1 : 400; Cell Signaling, #4760), глюкокортикоидного рецептора (glucocorticoid receptor, GR) (1 : 400; Cell Signaling) и phospho-CREB (Ser133; 1 : 1000; Novus Biologicals, NB300-273) в течение ночи при комнатной температуре. Затем для иммунофлуоресцентного анализа экспрессии DCX, Ki67 и nestin препараты инкубировали в растворе вторичных антител, конъюгированных с Alexa488 (1 : 1000; Invitrogen, #913909) или Alexa568 (1 : 1000; Invitrogen, #762708) в течение часа при комнатной температуре. Ядра клеток окрашивали DAPI (1 : 2000; Sigma-Aldrich, #32670). Для иммуногистохимического анализа экспрессии GR и фосфо-CREB препараты инкубировали в растворе биотинилированных вторичных антител против иммуноглобулинов кролика (1 : 300, Vector Laboratories Inc., #BA-1000) в течение часа, а затем – в течение часа в растворе стрептавидин-пероксидазы (1 : 500; Supelco, #S2438). Выявление специфической реакции проводили в буферном растворе, содержащем 0.05% 3,3′-диаминобензидина (DAB; Sigma-Aldrich, #D5637) и 0.3% пероксида водорода. Флуоресцентную реакцию анализировали с помощью микроскопа Leica DMI 6000B fluorescent microscope (Leica Microsystems GmbH), световую – с помощью микроскопа Zeiss Axio Imager A1 fluorescent microscope (Carl Zeiss Microscopy GmbH). Полученные микрофотографии обрабатывали в программе ImageJ. Далее подсчитывали число DCX, Ki67 и nestin-позитивных клеток, а также оценивали оптическую плотность pCREB и GR иммунопозитивного вещества в гиппокампе мышей.
Вестерн-блоттинг. Белки в пробах разделяли в 10%-ном полиакриамидном геле (SDS-PAGE) по Лэммли и переносили на нитроцеллюлозную мембрану (Santa-Cruz, #sc-3718). Мембраны инкубировали в 5%-ном обезжиренном молоке в течение часа, а затем – в растворе первичных антител против phospho-ERK1/2 (Thr202/Tyr204; 1 : 1000; Cell Signaling, #4376), CREB (1 : 1000; Cell Signaling, #9197) и actin (1 : 1000; Abcam, #ab3280) при 4°С в течение ночи. Затем мембраны отмывали в TBST и инкубировали в течение часа в растворе вторичных антител, конъюгированных с пероксидазой хрена, против иммуноглобулинов кролика (1 : 10 000; Sigma-Aldrich, #A0545) или мыши (1 : 40 000; Sigma-Aldrich, #A9044). Результаты визуализировали с помощью SuperSignal™ West Dura Extended Duration Substrate (ThermoFisher Scientific, #34075) с использованием ChemiDoc MP Imaging System (Bio-Rad Laboratories Inc.). Денситометрический анализ проводили с помощью программы ImageJ. Уровень экспрессии специфических белков нормировали с помощью сигнала actin, выявляемого для оценки общего содержания белка в пробах.
Статистический анализ. Полученные результаты статистически обрабатывали при помощи непараметрического U-критерия Манна–Уитни в коммерческой программе GraphPad Prism 7. Данные представлены в виде медианы ± интерквартильное отклонение. Достоверными считали различия при уровне значимости р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
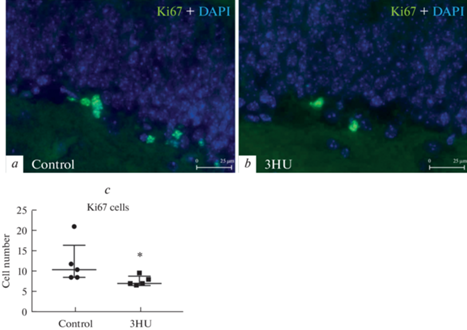
Анализ показателей нейрогенеза. В первую очередь мы оценили уровень пролиферативной активности в зубчатой извилине мышей. Полученные результаты показали, что после 3-суточного вывешивания число Ki67-позитивных клеток достоверно снизилось (рис. 1), что свидетельствует об ингибирующем влиянии краткосрочного вывешивания на активность пролиферации нейрональных стволовых клеток.
Рис. 1.
Анализ уровня пролиферации в зубчатой извилине. a, b – Иммунофлуоресцентное выявление Ki67 у контрольных мышей (a) и после 3-дневного вывешивания (3HU) (b). c – На графике представлено число Ki67 позитивных клеток у контрольных животных (control) и в группе вывешивания (3HU). Данные представлены в виде медианы ± интерквартильное отклонение. * p < 0.05.
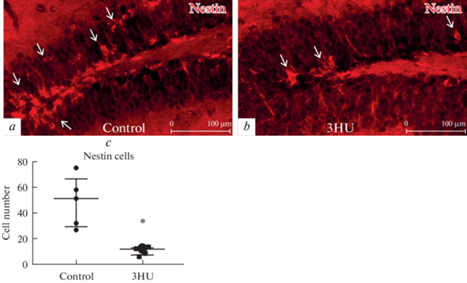
В то же время число nestin-позитивных нейрональных прогениторных клеток в зубчатой извилине у мышей после 3-суточного вывешивания также был значительно снижен по сравнению с контролем (рис. 2).
Рис. 2.
Анализ популяции nestin-позитивных клеток. a, b – Иммунофлуоресцентное выявление nestin у контрольных мышей (a) и после 3-дневного вывешивания (3HU) (b). c – На графике представлено число nestin-позитивных клеток у контрольных животных (control) и в группе вывешивания (3HU). Данные представлены в виде медианы ± интерквартильное отклонение. * – p < 0.05.
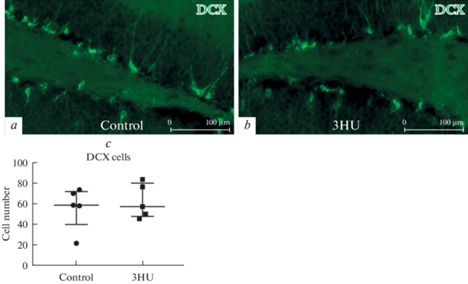
Анализ популяции незрелых DCX-позитивных нейронов также не выявил различий между экспериментальной и контрольной группами (рис. 3).
Рис. 3.
Анализ популяции DCX-позитивных клеток в зубчатой извилине. a, b – Иммунофлуоресцентное выявление DCX у контрольных мышей (a) и после 3-дневного вывешивания (3HU) (b). c – На графике представлено число DCX-позитивных клеток у контрольных животных (control) и в группе вывешивания (3HU). Данные представлены в виде медианы ± интерквартильное отклонение.
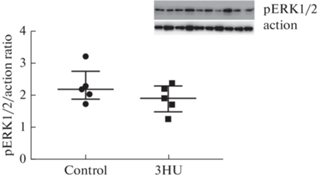
Анализ активности протеинкиназ ERK1/2. ERK1/2 играют важную роль в регуляции нейрональной дифференцировки [20], при этом уровень их фосфорилирования по остаткам Thr202/Tyr204 напрямую свидетельствует об уровне киназной активности. Полученные данные показали, что 3-суточное вывешивание не оказывало влияния на активность ERK1/2 (рис. 4).
Рис. 4.
Анализ уровня активности ERK1/2 в гиппокампе мышей. Уровень активности протеинкиназы ERK1/2 оценивали Вестерн-блоттингом по отношению уровня фосфорилированной формы ERK1/2 (pERK1/2) к уровню actin у контрольных животных (control) и в группе вывешивания (3HU). Данные представлены в виде медианы ± интерквартильное отклонение.
Анализ активности транскрипционного фактора CREB. Транскрипционный фактор CREB контролирует экспрессию множества генов, участвующих в регуляции нейрогенеза [27], нейроадаптивных процессов, таких как обучение и память [28], а также опосредует эффекты стресса [29]. Иммуногистохимическое выявление активной формы CREB, фосфорилированной по Ser133, показал, что в результате вывешивания активность CREB значительно повысилась в гранулярном слое зубчатой извилины и зоне CA3 (рис. 5).
Рис. 5.
Анализ pCREB в зубчатой извилине мышей. a, b – Иммуногистохимическое выявление pCREB у контрольных мышей (a) и после 3-х дневного вывешивания (3HU) (b). c – На графике представлена оптическая плотность pCREB-иммунопозитивного вещества, выраженная в условных единицах (a.u.) у контрольных животных (control) и в группе вывешивания (3HU). Данные представлены в виде медианы ± интерквартильное отклонение. * – p < 0.05.
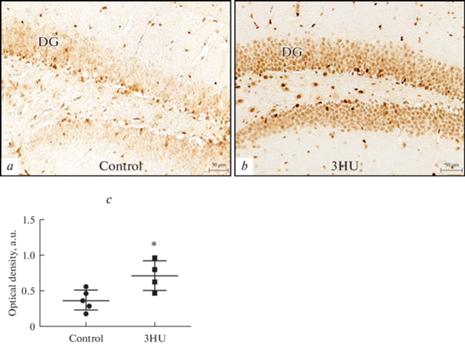
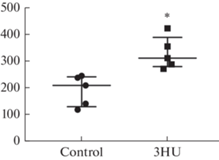
Анализ содержания кортикостерона в крови. Снижение нейрональной дифференцировки и повышение активности CREB в гиппокампе может быть связано не только с антиортостатическим вывешиванием, но и со стрессом, вызванным данным экспериментальным воздействием. Действительно, концентрация кортикостерона в сыворотке крови мышей после 3 суток вывешивания была значительно выше, чем у контрольных животных (рис. 6).
Рис. 6.
Анализ содержания кортикостерона в крови мышей. Концентрация кортикостерона в крови мышей определяли иммуноферментным анализом. На графике представлены данные содержания кортикостерона (нг/мл) у контрольных животных (control) и в группе вывешивания (3HU). Данные представлены в виде медианы ± интерквартильное отклонение. *p < 0.05.
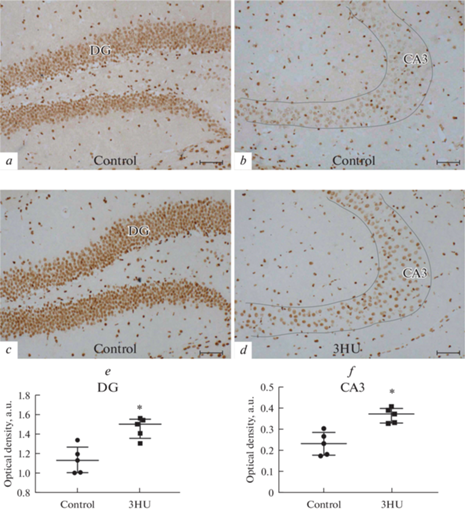
Анализ экспрессии глюкокортикоидных рецепторов (GR). Известно, что при развитии стресса экспрессия GR значительно повышается в гранулярных клетках, а также GR начинает экспрессироваться в пирамидных клетках СА3, где в норме он не экспрессируется [30]. Наши данные показали значительное повышение экспрессии GR у мышей после 3-суточного вывешивания как в гранулярном слое зубчатой извилины (рис. 7a, c, e), так и в зоне СА3 гиппокампа (рис. 7b, d, f).
Рис. 7.
Анализ экспрессии глюкокортикоидых рецепторов (GR) в гиппокампе мышей. a–d – Иммуногистохимическое выявление GR у контрольных мышей в зубчатой извилине (a) и зоне СА3 (b), и у мышей после 3-суточного вывешивания (3HU) в зубчатой извилине (c) и СА3 (d). Шкала – 50 мкм. e, f – На графиках представлена оптическая плотность GR-иммунопозитивного вещества, выраженная в условных единицах (a.u.) у контрольных животных (control) и в группе вывешивания (3HU) в зубчатой извилине (e) и зоне СА3 (f). Данные представлены в виде медианы ± интерквартильное отклонение. * – p < 0.05.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Гиппокампальный нейрогенез у взрослых млекопитающих представляет собой сложный процесс, который начинается с пролиферации стволовых клеток и включает в себя несколько стадий дифференцировки, если выживают ранние постмитотические нейрональные предшественники [2]. Ранее в нескольких работах было показано, что длительная антиортостатическая разгрузка приводит к ингибированию нейрогенеза в гиппокампе [16, 17]. Однако нет каких-либо данных, показывающих, что при вывешивании нарушается в первую очередь: пролиферация, дифференцировка или и то, и другое. Наши данные выявили снижение количества nestin-позитивных клеток в зубчатой извилине без каких-либо изменений количества Ki67-позитивных пролиферирующих клеток и DCX-позитивных незрелых нейронов после 3-дневного вывешивания. Nestin относится к белкам промежуточных филаментов и выявляется в клетках на более ранних этапах нейрональной дифференцировки, чем DCX. Хотя первоначально этот белок был выявлен именно в нейрональных стволовых и прогениторных клетках, на сегодняшний день показано, что nestin экспрессируется также в миоцитах, сателитных клетках скелетных мышц, поджелудочной железе, сердце, волосяных фолликулах и пр. [31]. В условиях in vitro большинство эмбриональных нейрональных стволовых клеток коэкспрессируют nestin и Ki67 [32]. Однако в гиппокампе взрослых мышей только около 20% nestin-позитивных клеток активно пролиферируют, о чем свидетельствует экспрессия в них Ki67 [33]. Наши данные также демонстрируют, что не все nestin-позитивные клетки являются пролиферирующими: в отличие от Ki67-позитивных клеток, которые выявляются только в субгранулярной зоне зубчатой извилины, nestin-позитивные клетки выявлялись также в гранулярном слое.
Ранее нами было показано, что у крыс 3-дневная разгрузка задних конечностей также не приводит к изменению числа пролиферирующих клеток в гиппокампе, однако вызывает снижение популяции DCX-позитивных незрелых нейронов [24]. При этом после более длительного вывешивания (14 дней) у крыс значительно снижается не только численность DCX-позитивных незрелых нейронов, но и уровень пролиферации [16]. Выявленное несовпадение результатов у крыс и у мышей можно объяснить данными о том, что скорость нейрогенеза у крыс значительно выше, и маркеры ранних стадий нейрональной дифференцировки, DCX и PSA-NCAM (polysialylated-neural cell adhesion molecule), в клетках, закончивших цикл деления, начинают экспрессироваться гораздо раньше [26].
Одним из основных регуляторов нейрональной дифференцировки являются протеинкиназы ERK1/2. Интересно, что вызванное двигательной разгрузкой снижение числа DCX-позитивных нейронов у крыс коррелирует со снижением активности протеинкиназ ERK1/2 [24]. В то же время в настоящей работе показано, что у мышей, которые демонстрируют отсутствие изменений в популяции DCX-позитивных клеток, не наблюдается изменений уровня фосфорилирования ERK1/2 по сравнению с контролем. Таким образом, у мышей при кратковременном вывешивании страдают более ранние нейрональные предшественники, а у крыс – более зрелые, однако можно заключить, что ранние этапы нейрональной дифференцировки являются главным уязвимым звеном при нарушениях регуляции нейрогенеза, вызванных кратковременной двигательной разгрузкой.
Наблюдаемые изменения гиппокампального нейрогенеза могут быть обусловлены стрессом, возникающим на коротких сроках вывешивания и отражающим адаптацию организма к гипокинезии, перераспределению мышечного тонуса, сдвигу жидкости и потере опорной афферентации. Ранее было установлено, что стресс может приводить к подавлению постнатального нейрогенеза в гиппокампе [34]. Одним из ключевых показателей стрессорного ответа у мышей и крыс является содержание кортикостерона в крови [35]. Имеющиеся сведения об изменениях уровня кортикостерона при антиортостатическом вывешивании противоречивы: по одним данным, повышение наблюдается в первый день эксперимента, а затем происходит стабилизация, по другим – повышенное содержание кортикостерона нормализуется только к седьмому дню [19]. В данном исследовании мы выявили повышенный уровень кортикостерона в крови мышей после 3-дневного вывешивания. Более того, результаты показали повышение экспрессии GR в гранулярном слое зубчатой извилины и зоне СА3 гиппокампа мышей. Эти данные также свидетельствуют о развитии стрессорного ответа, поскольку ранее было установлено, что при стрессе экспрессия GR появляется в зоне СА3, где он в норме не экспрессируется и значительно повышается в гранулярных клетках [30].
Мы также показали, что 3-дневное вывешивание приводит к значительному увеличению экспрессии и активности транскрипционного фактора CREB в гиппокампе мышей. Ранее сходные изменения были выявлены нами и в гиппокампе крыс [23]. Показано, что активация CREB наблюдается как при остром, так и при хроническом стрессе [30]. Таким образом, выявленное нами повышение активности CREB в гиппокампе может служить еще одним показателем стресса, вызванного двигательной разгрузкой задних конечностей. Известно, что CREB контролирует экспрессию множества генов, в том числе играющих важную роль в регуляции нейрогенеза [36]. Показано, что активация CREB стимулирует пролиферацию и созревание клеток гиппокампа, а также способствует выживанию нейронов [27]. Наши исследования не выявили повышения активности CREB в субгранулярной зоне зубчатой извилины, однако активация CREB в гранулярных клетках и поле СА3 может служить компенсаторным механизмом, повышающим выживаемость новообразованных клеток на фоне нарушений нейрогенеза, вызванных антиортостатическим вывешиванием.
Таким образом, полученные нами данные свидетельствуют о том, что кратковременная двигательная разгрузка задних конечностей вызывает у мышей стрессорный ответ, который, по-видимому, является одной из основных причин снижения гиппокампального нейрогенеза.
Список литературы
Altman J, Das GD (1965) Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. J Comp Neurol 124: 319–335.https://doi.org/10.1002/CNE.901240303
Baptista P, Andrade JP (2018) Adult hippocampal neurogenesis: Regulation and possible functional and clinical correlates. Front Neuroanat 12: 44.
Adami R, Pagano J, Colombo M, Platonova N, Recchia D,Chiaramonte R, Bottinelli R, Cannepari M, Bottai D (2018) Reduction of Movement in Neurological Diseases: Effects on Neural Stem Cells Characteristics. Front Neurosci 12: 336.https://doi.org/10.3389/fnins.2018.00336
Watson N, Ji X, Yasuhara T, Date I, Kaneko Y, Tajiri N, Borlongan C (2015) No pain, No gain: Lack of exercise obstructs neurogenesis. Cell Transplant 24: 591–597.https://doi.org/10.3727/096368915X687723
Popova NK, Kulikov AV, Naumenko VS (2020) Spaceflight and brain plasticity: Spaceflight effects on regional expression of neurotransmitter systems and neurotrophic factors encoding genes. Neurosci Biobehav Rev 119: 396–405.
Roberts DR, Albrecht MH, Collins HR, Asemani D, Spampinato VM, Xun Zhu, Chimowitz MI, Antonucci MU (2017) Effects of Spaceflight on Astronaut Brain Structure as Indicated on MRI. N Engl J Med 377: 1746–1753.https://doi.org/10.1056/NEJMoa1705129
Demertzi A, Van Ombergen A, Tomilovskaya E, Jeurissen B, Pechenkova E, Perri CD, Litvinova L, Amico E, Rumshiskaya A, Rukavishnikov I, Sijbers J, Sinitsyn V, Kozlovskaya I, Sunaert S, Parizel PM, Van de Heyning PH, Laureys S, Wuyts FL (2016) Cortical reorganization in an astronaut’s brain after long-duration spaceflight. Brain Struct Funct 221: 2873–2876.https://doi.org/10.1007/S00429-015-1054-3/FIGURES/1
Van Ombergen A, Demertzi A, Tomilovskaya E, Jeurissen B, Sijbers J, Kozlovskaya I, Parizel PM, Van de Heyning PH, Sunaert S, Laureys S, Wuyts FL (2017) The effect of spaceflight and microgravity on the human brain. J Neurol 264: 18–22.https://doi.org/10.1007/S00415-017-8427-X
Koppelmans V, Bloomberg JJ, De Dios YE, Wood SJ, Reuter-Lorenz PA, Kofman IS, Riascos R, Mulavara AP, Seidler RD (2017) Brain plasticity and sensorimotor deterioration as a function of 70 days head down tilt bed rest. PLoS One 12: e0182236.https://doi.org/10.1371/JOURNAL.PONE.0182236
Roberts DR, Zhu X, Tabesh A, Duffy EW, Ramsey DA, Brown TR (2015) Structural Brain Changes following Long-Term 6° Head-Down Tilt Bed Rest as an Analog for Spaceflight. Am J Neuroradiol 36: 2048–2054.https://doi.org/10.3174/AJNR.A4406
Casler JG, Cook JR (1999) Cognitive performance in space and analogous environments. Int J Cogn Ergon 3: 351–372.
Vecchio LM, Meng Y, Xhima K, Lipsman N, Hamani C, Aubert I (2018) The Neuroprotective Effects of Exercise: Maintaining a Healthy Brain Throughout Aging. Brain Plast 4: 17.https://doi.org/10.3233/BPL-180069
Dekeyzer S, De Kock I, Nikoubashman O, Bossche SV, Eetvelde RV, De Groote J M, Wiesmann M, Deblaere K, Achten E (2017) “Unforgettable” – a pictorial essay on anatomy and pathology of the hippocampus. Insights Imaging 8: 199.https://doi.org/10.1007/S13244-016-0541-2
Anand K, Dhikav V (2012) Hippocampus in health and disease: An overview. Ann Indian Acad Neurol 15: 239–246.
Li K, Guo X, Jin Z, Ouyang X, Zeng Y, Jinsheng F, Wang Y, Yao L, Ma L (2015) Effect of Simulated Microgravity on Human Brain Gray Matter and White Matter – Evidence from MRI. PLoS One 10: e0135835.https://doi.org/10.1371/JOURNAL.PONE.0135835
Yasuhara T, Hara K, Maki M, Matsukawa N, Fujino H, Date I, Borlongan CV (2007) Lack of exercise, via hindlimb suspension, impedes endogenous neurogenesis. Neuroscience 149: 182–191.https://doi.org/10.1016/j.neuroscience.2007.07.045
Nomura S, Kami K, Kawano F, Oke Y, Nakai N, Ohira T, Fujita R, Terada M, Imaizumi K, Ohira Y (2012) Effects of hindlimb unloading on neurogenesis in the hippocampus of newly weaned rats. Neurosci Lett 509: 76–81.https://doi.org/10.1016/j.neulet.2011.12.022
Qaisar R, Karim A, Elmoselhi AB (2020) Muscle unloading: A comparison between spaceflight and ground-based models. Acta Physiol 228: e13431.https://doi.org/10.1111/apha.13431
Morey-Holton ER, Globus RK (2002) Hindlimb unloading rodent model: Technical aspects. J Appl Physiol 92: 1367–1377.
Li Z, Theus MH, Wei L (2006) Role of ERK 1/2 signaling in neuronal differentiation of cultured embryonic stem cells. Dev Growth Differ 48: 513–523.https://doi.org/10.1111/j.1440-169X.2006.00889.x
Jansson LC, Åkerman KE (2014) The role of glutamate and its receptors in the proliferation, migration, differentiation and survival of neural progenitor cells. J Neural Transm 121: 819–836. https://doi.org/10.1007/s00702-014-1174-6
Schlett K (2006) Glutamate as a Modulator of Embryonic and Adult Neurogenesis. Curr Top Med Chem 6: 949–960.https://doi.org/10.2174/156802606777323665
Berezovskaya AS, Tyganov SA, Nikolaeva SD, Naumova AA, Merkulyeva NS, Shenkman BS, Glazova MV (2021) Dynamic Foot Stimulations During Short-Term Hindlimb Unloading Prevent Dysregulation of the Neurotransmission in the Hippocampus of Rats. Cell Mol Neurobiol 41: 1549–1561.https://doi.org/10.1007/s10571-020-00922-2
Berezovskaya AS, Tyganov SA, Nikolaeva SD, Naumova AA, Shenkman BS, Glazova MV (2021) Plantar stimulations during 3-day hindlimb unloading prevent loss of neural progenitors and maintain erk1/2 activity in the rat hippocampus. Life 11(5) : 449.https://doi.org/10.3390/life11050449
Charvet CJ, Finlay BL (2018) Comparing adult hippocampal neurogenesis across species: Translating time to predict the tempo in humans. Front Neurosci 12.https://doi.org/10.3389/FNINS.2018.00706/FULL
Snyder JS, Choe JS, Clifford MA, Jeurling SI, Hurley P, Brown A, Kamhi JF, Heather A, Cameron HA (2009) Adult-Born Hippocampal Neurons Are More Numerous, Faster Maturing, and More Involved in Behavior in Rats than in Mice. J Neurosci 29: 14484–14495.https://doi.org/10.1523/JNEUROSCI.1768-09.2009
Ortega-Martínez S (2015) A new perspective on the role of the CREB family of transcription factors in memory consolidation via adult hippocampal neurogenesis. Front Mol Neurosci 8: 46. https://doi.org/10.3389/FNMOL.2015.00046/BIBTEX
Bourtchuladze R, Frenguelli B, Blendy J, Cioff D, Schutz G, Silva AG (1994) Deficient long-term memory in mice with a targeted mutation of the cAMP-responsive element-binding protein. Cell 79: 59–68.https://doi.org/10.1016/0092-8674(94)90400-6
Böer U, Alejel T, Beimesche S, Cierny I, Krause D, Knepel W, Flügge G (2007) CRE/CREB-Driven Up-Regulation of Gene Expression by Chronic Social Stress in CRE-Luciferase Transgenic Mice: Reversal by Antidepressant Treatment. PLoS One 2: e431.https://doi.org/10.1371/JOURNAL.PONE.0000431
Chen Y, Fenoglio KA, Dubé CM, Chen Y, Fenoglio KA, Dubé CM (2006) Cellular and molecular mechanisms of hippocampal activation by acute stress are age-dependent. Mol Psychiatry 11: 992.https://doi.org/10.1038/SJ.MP.4001863
Bernal A, Arranz L (2018) Nestin-expressing progenitor cells: function, identity and therapeutic implications. Cell Mol Life Sci 75: 2177.https://doi.org/10.1007/S00018-018-2794-Z
Marei HES, Ahmed AE, Michetti F, Pescatori M, Pallini R, Casalbore P, Cenciarelli C, Elhadidy M (2012) Gene Expression Profile of Adult Human Olfactory Bulb and Embryonic Neural Stem Cell Suggests Distinct Signaling Pathways and Epigenetic Control. PLoS One 7: e33542. https://doi.org/10.1371/JOURNAL.PONE.0033542
Pechnick RN, Zonis S, Wawrowsky K, Cosgayon R, Farrokhi C, Lacayo L, Chesnokova V (2011) Antidepressants Stimulate Hippocampal Neurogenesis by Inhibiting p21 Expression in the Subgranular Zone of the Hipppocampus. PLoS One 6: e27290.https://doi.org/10.1371/JOURNAL.PONE.0027290
Warner-Schmidt JL, Duman RS (2006) Hippocampal neurogenesis: opposing effects of stress and antidepressant treatment. Hippocampus 16: 239–249.https://doi.org/10.1002/HIPO.20156
Boucher P, Plusquellec P (2019) Acute Stress Assessment From Excess Cortisol Secretion: Fundamentals and Perspectives. Front Endocrinol (Lausanne) 10: 749.https://doi.org/10.3389/FENDO.2019.00749/BIBTEX
Sakamoto K, Karelina K, Obrietan K (2011) CREB: a multifaceted regulator of neuronal plasticity and protection. J Neurochem 116: 1.https://doi.org/10.1111/J.1471-4159.2010.07080.X
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


