Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 7, стр. 874-889
Применение наивного байесовского классификатора для оценки влияния антипсихотических средств на параметры биоэлектрической активности головного мозга у крыс
Ю. И. Сысоев 1, 2, 3, 4, *, Д. Д. Шиц 1, М. М. Пучик 1, В. А. Приходько 1, 4, Р. Д. Идиятуллин 1, А. А. Котельникова 1, С. В. Оковитый 1, 4
1 Санкт-Петербургский государственный химико-фармацевтический университет
Санкт-Петербург, Россия
2 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
3 Институт трансляционной биомедицины, Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
4 Институт мозга человека им. Н.П. Бехтеревой РАН
Санкт-Петербург, Россия
* E-mail: susoyev92@mail.ru
Поступила в редакцию 23.05.2022
После доработки 16.06.2022
Принята к публикации 20.06.2022
- EDN: HPPTHS
- DOI: 10.31857/S0869813922070093
Аннотация
Поиск и разработка методов выявления эффектов антипсихотических средств является важной задачей медико-биологических исследований. Поведенческие тесты, наиболее часто применяемые для фармакологического скрининга, позволяют эффективно оценивать влияние препаратов на уровень тревожности и двигательной активности животных, однако выявить с их помощью антипсихотическое действие достаточно затруднительно. Перспективным подходом для решения данных задач может быть метод фармакоэлектроэнцефалографии (фармако-ЭЭГ), основанный на концепции специфических изменений биоэлектрической активности головного мозга под влиянием различных психотропных препаратов. С развитием методов машинного обучения возникают новые возможности использования данных фармако-ЭЭГ для решения задач классификации и прогнозирования. В настоящей работе предложен экспериментальный подход для выявления специфической активности и сравнения фармакологического профиля антипсихотических средств с использованием наивного байесовского классификатора – простого вероятностного классификатора, достаточно широко применяемого в биомедицинских исследованиях. Эксперименты были выполнены на белых беспородных крысах-самцах с хронически имплантированными электрокортикографическими электродами. Была сформирована библиотека электрокортикограмм (ЭКоГ) при введении антипсихотических средств: хлорпромазина, галоперидола, дроперидола, тиаприда и сульпирида, которая использовалась как обучающая выборка. Для каждой записи были рассчитаны значения параметров ЭКоГ до и после введения препаратов. Анализ ЭКоГ включал в себя расчет 132 показателей амплитудно-спектральных характеристик сигнала. Уменьшение размерности данных проводили с помощью метода главных компонент. Применение наивного байесовского классификатора позволило выявить специфическое влияние антипсихотических средств на параметры биоэлектрической активности головного мозга крыс, дифференцируя их от бензодиазепинового транквилизатора феназепама, обладающего седативной активностью. Кроме того, данный подход продемонстрировал эффективность сравнительной оценки ЭКоГ-особенностей изучаемых антипсихотических средств между собой, а также с другими средствами, близкими по спектру рецепторного действия (например, трициклическим антидепрессантом амитриптилином). Таким образом, предлагаемый нами метод может быть использован как для отличия антипсихотического действия лекарственных препаратов от седативного, так и для сравнения эффектов антипсихотических средств между собой.
Антипсихотические средства – группа препаратов, широко применяемых в психофармакологии, главным образом для лечения шизофрении и аффективных расстройств. С появлением новых представителей данной группы было показано, что многие из них дополнительно обладают положительными эффектами при биполярной (оланзапин, рисперидон, кветиапин) и униполярной депрессии (арипипразол, оланзапин и др.), а также при тревожных расстройствах (кветиапин) [1]. Принято считать, что основной фармакологической мишенью антипсихотических средств являются дофаминовые D2-рецепторы, однако современный подход к классификации предлагает выделять не менее 5 групп, в зависимости от механизмов действия [2], а фармакологическими мишенями могут быть не только дофаминовые рецепторы, но и другие медиаторные системы, в том числе серотонинергическая, глутаматергическая и система γ-аминомасляной кислоты (ГАМК), а также рецепторы следовых аминов (trace amine associated receptors, TAAR) и нейропептидов [3].
В связи с большим разнообразием молекулярных механизмов действия различных антипсихотических средств возникает необходимость в эффективных методах дифференцировки эффектов представителей данной группы на этапе экспериментальных исследований. Традиционно могут быть использованы батареи поведенческих тестов, позволяющих оценивать уровень тревожности и исследовательской активности мелких лабораторных животных (например, “Открытое поле”, “Приподнятый крестообразный лабиринт” и т.д.). Следующим этапом, как правило, являются эксперименты с использованием моделей психотических расстройств у мышей и крыс (разрушение вентральных областей гиппокампа, фармакологические и генетические модели) [4] и специфических поведенческих тестов (препульсивное ингибирование, трехкамерный социальный тест и др.) [5]. При проведении сразу нескольких поведенческих тестов можно получить комплексные данные об эффектах того или иного препарата на симптомы шизофрении у лабораторных животных. Тем не менее, такой подход может потребовать большого количества времени, материальных затрат и соблюдения достаточно строгих условий тестирования (последовательности тестов, промежутков между ними и т.д.). Кроме того, поведенческие тесты не всегда оказываются достаточно чувствительными для выявления эффектов психоактивных препаратов.
Перспективным подходом для выявления различий в эффектах антипсихотических средств может быть метод фармакоэнцефалографии (фармако-ЭЭГ). Несмотря на то, что первые подобные исследования проводили уже в 60–70-е года прошлого века [6, 7], этот экспериментальный подход так и не стал стандартом фармакологического скрининга новых психоактивных молекул. Во многом это было обусловлено комплексностью получаемых данных (большим количеством показателей, часто трудно интерпретируемых), в связи с чем исследователи не могли их использовать для сравнения профилей фармакологической активности изучаемых препаратов. С появлением современных методов компьютерного анализа данных в настоящее время вновь возрос интерес к использованию фармако-ЭЭГ в биомедицинских исследованиях [8–11].
Особое внимание привлекает возможность использования методов машинного обучения с целью прогнозирования фармакологической активности того или иного препарата на основании данных об его эффектах на параметры биоэлектрической активности у лабораторных животных. В настоящее время такие подходы активно используются для направленного синтеза новых фармакологически активных соединений [12]. Несмотря на большое разнообразие методов машинного обучения, наивный байесовский классификатор (НБК), являясь одним из самых базовых, широко используется в медицинских и биомедицинских исследованиях. НБК – это простой вероятностный классификатор, в котором каждый параметр классифицируемых данных рассматривается независимо от других характеристик. Он находит широкое применение в медицинской практике, например, для предсказания резистентности пациентов с онкологическими заболеваниями к химиотерапии [13], диагностики сахарного диабета [14] или оценки риска лекарственного поражения печени [15]. Безусловно, возможности применения данного алгоритма не ограничиваются вышеуказанными примерами, и с каждым годом появляется все больше и больше работ, где авторы успешно используют данный подход в задачах классификации и прогнозирования [16].
На основании вышесказанного целью данной работы была оценка возможности использования НБК для выявления и различия эффектов антипсихотических лекарственных средств на параметры электрокортикограмм (ЭКоГ) у крыс.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проводили в соответствии с принципами Базельской декларации, Приказом Минздрава РФ от 01.04.16 г. № 199н “Об утверждении правил надлежащей лабораторной практики” и рекомендациями биоэтической комиссии ФГБОУ ВО СПХФУ Минздрава России. Эксперименты были выполнены на 33 крысах-самцах линии Вистар массой 250–300 г, полученных из ФГУП Питомник лабораторных животных “Рапполово” (Ленинградская область, Россия). Крыс содержали в стандартных условиях вивария на обычном пищевом рационе, со свободным доступом к воде. Все опытные и контрольные животные были взяты из одной партии и прошли карантин в течение 14 суток.
Кортикографические электроды изготавливали из нихромовой проволоки диаметром 0.5 мм (для регистрирующих и референтного электродов) и диаметром 0.16 мм – для заземляющего электрода. Изоляцию осуществляли термоусадочной трубкой (1.5/0.5 мм); длина регистрирующей (неизолированной) части составляла ≈1 мм. Все электроды объединяли в гнездо на кабель BLS-8 (Connfly Electronic Co. Ltd., КНР) c шагом 2.54 мм.
Процедуры имплантации электродов и послеоперационного ухода за животными были подробно описаны в ранее опубликованной работе [17]. Для наркотизации животных использовали тилетамин/золазепам 50 (Золетил®, Virbac, Франция; 10 мг/кг, внутримышечно). Электроды FP1 и FP2 располагали в области первичной двигательной коры (AP = 0.0, ML = 2.5, DV = 1.0), С3 и С4 – первичной соматосенсорной коры над гиппокампом (AP = –4.0, ML = 2.5, DV = 1.0), O1 и O2 – вторичной зрительной коры (AP = –7.0, ML = 2.5, DV = 1.0). Референтный электрод устанавливали в носовую кость, заземляющий – под кожу в области шеи.
Запись ЭКоГ у животных осуществляли не ранее чем через 7 дней после операции с помощью 8-канального энцефалографа Нейрон-Спектр-1 (Нейрософт, Россия) c полосой пропускания 0.5–35 Гц и частотой квантования 500 Гц. Регистрацию сигнала проводили одновременно с видеорегистрацией поведения в условиях домашней клетки при искусственном освещении. Длительность записи составляла 2 ч и включала в себя 30 мин фоновой активности (до введения препарата или физиологического раствора) и 1.5 ч после инъекции. Для дальнейшего анализа отбирали два 60-секундных участка записи: непосредственно перед введением и спустя 20 мин после. Во время выбранных фрагментов ЭКоГ животные находились в спокойном бодрствующем состоянии, в отсутствие локомоторной или исследовательской активности, а также груминга или скрэтчинга [18].
В качестве типичных антипсихотических средств нами были выбраны хлорпромазин, галоперидол и дроперидол, атипичных – тиаприд и сульпирид. Дополнительно в качестве референтных препаратов были сделаны записи ЭКоГ-эффектов трициклического антидепрессанта амитриптилина, ингибитора ацетилхолинэстеразы галантамина и бензодиазепинового транквилизатора феназепама. Выбор амитриптилина как препарата сравнения был обусловлен его действием на многие фармакологические мишени (М-холино-, H1-гистаминовые и α1-адренорецепторы), являющиеся точками приложения действия хлорпромазина. Представляло интерес, насколько предлагаемый подход позволит обнаружить данное сходство.
Также известно, что типичные нейролептики могут вызывать экстрапирамидные нарушения за счет повышения тонуса холинергической иннервации в головном мозге [19]. В рамках настоящей работы было предположено, что метод фармако-ЭЭГ может быть чувствительным к ранним проявлениям данного побочного эффекта, и ввиду этого для хлорпромазина, галоперидола и дроперидола была ожидаема высокая вероятность сходства с галантамином как средством, повышающим тонус холинергической иннервации. Феназепам был выбран в качестве средства с выраженным седативным действием, влияние которого на параметры ЭКоГ должно отличаться от действия типичных и атипичных антипсихотических средств.
Испытуемые препараты вводили внутрибрюшинно, при необходимости предварительно растворив в физиологическом растворе до нужной концентрации. Доза галоперидола (ООО “Велфарм”, Россия) и дроперидола (ФГУП “Московский эндокринный завод”, Россия) была 0.3 мг/кг, хлорпромазина (АО “Валента Фарм”, Россия) – 10 мг/кг, амитриптилина (ФГУП “Московский эндокринный завод”, Россия), тиаприда (АО “Органика”, Россия) и сульпирида (АО “Органика”, Россия) – 30 мг/кг, галантамина (АО “Софарма”, Болгария) и феназепама (АО “Валента Фарм”, Россия) – 1 мг/кг [20–22]. В качестве контроля вводили физиологический раствор в объеме 0.5 мл.
Для каждого препарата было сделано не менее 10 записей у разных животных (n = 10 для каждой группы). Введение нового препарата производили не ранее чем через 3 дня после предыдущей записи для исключения взаимодействия и остаточных эффектов. Частота тестирования той или иной крысы определялась сохранностью коннекторов и заземляющего электрода, а также общим состоянием животного. В случае признаков инфекционного заболевания вводили повторно бициллин-3 (ОАО “Синтез”, Россия; 5000 ЕД/кг, внутримышечно) и следующее тестирование проводили не ранее чем через неделю после инъекции.
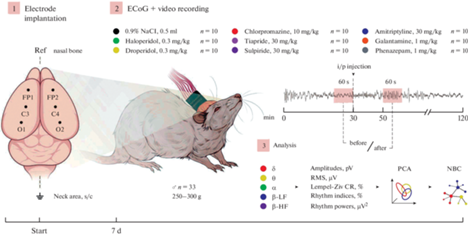
Анализ полученных записей осуществляли с помощью программы Нейрон-Спектр.NETω (ООО “Нейрософт”, Россия). Для всех 6 отведений (FP1, FP2, C3, C4, O1 и O2) проводили амплитудно-спектральный анализ с расчетом в общей сложности 132 параметров, включавших в себя среднюю и максимальную амплитуды сигнала, среднеквадратичное отклонение и степень сжатия по Лемпел–Зив, средние амплитуды ритмов волн, индексы и средние мощности ритмов. Из сигнала выделяли δ- (0.5–4.0 Гц), θ- (4.0–8.0 Гц), α- (8.0–14.0 Гц) и β-ритмы (низкочастотные (НЧ) – 14.0–20.0 Гц – и высокочастотные (ВЧ) – 20.0–35.0 Гц). Данные выражали как соотношения значения параметров до введения препарата к значениям соответствующих параметров после введения (от 0 до 1) (рис. 1).
Рис. 1.
Этапы эксперимента. (1) – Имплантация электрокортикографических электродов в области первичной двигательной коры (FP1 и FP2), первичной соматосенсорной коры над гиппокампом (C3 и C4) и вторичной зрительной коры (O1 и O2). (2) – Регистрация электрокортикограмм в условиях домашней клетки при одновременной видеорегистрации поведения. (3) – Анализ выбранных участков электрокортикограмм. Ref – референтный электрод, s/c – подкожно, i/p – внутрибрюшинно, ECoG – электрокортикограмма, RMS – среднеквадратичное отклонение, CR – степень сжатия, LF – низкочастотные, HF – высокочастотные, PCA – метод главных компонент, NBC – наивный байесовский классификатор.
Обработку и последующий анализ полученных данных осуществляли с помощью надстройки для MS Excel XLSTAT 2016.02.28451. Уменьшение размерности данных проводили с помощью метода главных компонент (МГК) – технологии многомерного статистического анализа, используемой для сокращения размерности пространства признаков с минимальной потерей полезной информации. Суть метода состоит в ортогональном линейном преобразовании, которое отображает данные из исходного пространства признаков в новое пространство меньшей размерности. При этом первая ось новой системы координат строится таким образом, чтобы дисперсия данных вдоль нее была бы максимальна. Вторая ось строится ортогонально первой так, чтобы дисперсия данных вдоль нее была бы максимальной из оставшихся возможных и т.д. Первая ось называется первой главной компонентой, вторая – второй и т.д. [23]. На основании рассчитанных значений главных компонент для каждой записи из групп хлорпромазина, галоперидола, дроперидола, тиаприда и сульпирида с помощью НБК была спрогнозирована фармакологическая активность (рассчитано сходство с той или иной группой обучающей выборки). В качестве обучающей выборки были использованы данные всех полученных записей за исключением группы препарата, для которого осуществлялся прогноз. Числовые данные, приведенные на рисунках, представлены в виде среднее ± стандартная ошибка среднего (SEM).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Введение антипсихотических средств крысам вызывало у них изменение амплитудно-спектральных характеристик ЭКоГ (рис. 2a). Наиболее выраженные эффекты были отмечены для хлорпромазина, галоперидола и дроперидола. При введении хлорпромазина наблюдалось увеличение средней мощности δ-, θ-, α- и β-НЧ-ритмов преимущественно в области фронтальной коры (электроды FP1 и FP2). Галоперидол увеличивал среднюю мощность преимущественно α- и β-НЧ ритмов в отведениях FP1 и FP1, а также α-ритмов в затылочной области. Дроперидол оказывал схожие эффекты, при этом дополнительно активируя θ-активность во фронтальной коре. Тиаприд и сульпирид, как и предыдущие препараты, увеличивали среднюю мощность в δ-, θ-, α- и β-диапазонах, однако их эффекты в отличие от хлорпромазина, галоперидола и дроперидола не были локализованы в какой-либо конкретной области коры и были менее выражены.
Рис. 2.
Результаты анализа параметров электрокортикограмм. (a) – Тепловые карты усредненных (n = 10 для каждой группы) значений средней мощности δ-, θ-, α- и β-ритмов в отведениях FP1, FP2, C3, C4, O1 и O2 при введении хлорпромазина, галоперидола, дроперидола, тиаприда и сульпирида. Данные представлены как отношения значений средней мощности ритмов спустя 20 мин после введения препаратов к значениям соответствующих показателей до введения (30-я минута фоновой записи). (b) – Усредненные значения пяти главных компонент во всех экспериментальных группах. (c) – Лепестковые диаграммы усредненных значений вероятности сходства фармакологической активности хлорпромазина, галоперидола, дроперидола, тиаприда и сульпирида с препаратами из обучающей выборки, полученные с использованием наивного байесовского классификатора.
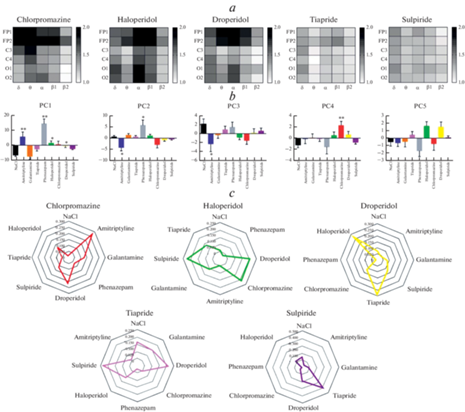
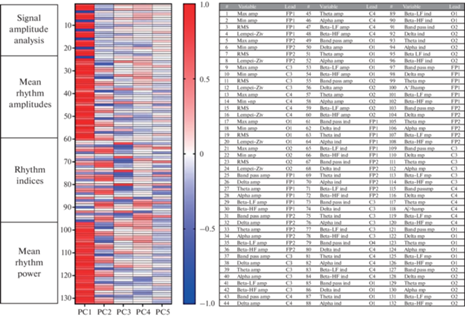
При проведении анализа данных МГК было получено, что 84.8% всей дисперсии описывают первые пять компонент (PC1–PC5), которые были использованы для дальнейших расчетов. Для каждого из анализируемых параметров ЭКоГ были получены соответствующие факторные нагрузки, позволяющие оценить вклад этих параметров в формирование той или иной главной компоненты (рис. 3). Компоненту PC1, описывающую 55.3% дисперсии данных, формировали такие амплитудные характеристики сигнала, как максимальная и средняя амплитуды, среднеквадратичное отклонение, степень сжатия по Лемпел–Зив, а также средние амплитуды и мощности δ-, θ-, α- и β-ритмов. Важно отметить, что все перечисленные параметры ЭКоГ влияли на значение PC1 вне зависимости от регистрирующего отведения. На долю компоненты PC2 приходилось 13.4% дисперсии, и наибольшее влияние на ее значения оказывали индексы и средняя мощность β-НЧ- и ВЧ-ритмов во всех областях регистрации сигнала. Компонента PC3 (8.4% дисперсии) складывалась из соотношения индексов δ-, θ-, α-ритмов вне зависимости от локализации сигнала. PC4 (4.2%) формировалась средней амплитудой θ-ритмов в отведениях C3 и C4 (область первичной сенсомоторной коры над гиппокампом), а также индексом α-ритма во всех отведениях. Компонента PC5 описывала 3.5% дисперсии и определялась значениями индексов β-НЧ-ритмов в областях затылочных электродов O1 и O2.
Рис. 3.
Факторные нагрузки, показывающие степень вовлечения каждого из 132 анализируемых параметров в формирование компонент PC, PC2, PC3, PC4 и PC5, используемых для дальнейших вычислений с использованием наивного байесовского классификатора. Amp – амплитуда (мкВ), RMS – среднеквадратичное отклонение (мкВ), Lempel–Ziv – степень сжатия по Лемпел–Зив (%), ind – индекс ритма (%), mp – средняя мощность ритма (мкВ2).
Таким образом, для каждой записи был осуществлен пересчет значений параметров ЭКоГ (132 показателя) на значения главных компонент PC1–PC5 (табл. 1). Было отмечено, что изучаемые препараты оказывают выраженное влияние на величину показателей PC1–PC5, при этом выявлялась специфичность и разнонаправленность их действия (рис. 2b). Введение амитриптилина, феназепама, галоперидола и дроперидола статистически значимо (p < 0.01 для амитриптилина и феназепама, p < 0.05 для галоперидола и дроперидола) увеличивало значение компоненты PC1 по сравнению с контрольной группой. Величина PC2 уменьшалась при введении амитриптилина (p < 0.05) и, напротив, увеличивалась у животных, получавших феназепам (p < 0.05). У крыс, которым вводили амитриптилин, также было отмечено снижение компоненты PC3 по сравнению с контрольной группой (p < 0.05). Компонента PC4 статистически значимо (p < 0.01) увеличивалась при введении хлорпромазина. Ни один из испытуемых препаратов не оказывал значимого влияния на величину компоненты PC5, однако была отмечена тенденция к ее увеличению у групп галоперидола и дроперидола, а также к снижению – у группы феназепама.
Таблица 1.
Пример рассчитанных значений главных компонент PC1–PC5 для 10 записей, полученных после введения NaCl
| Запись | Компоненты | ||||
|---|---|---|---|---|---|
| PC1 | PC2 | PC3 | PC4 | PC5 | |
| 1 | –7.639 | 0.007 | 3.371 | –2.235 | –0.712 |
| 2 | –4.682 | 0.501 | 4.678 | 0.115 | 1.715 |
| 3 | –5.366 | 1.446 | 1.929 | –0.323 | –0.812 |
| 4 | –10.583 | 1.806 | –2.936 | –1.670 | –4.482 |
| 5 | –10.227 | 3.062 | –0.452 | –1.344 | –2.462 |
| 6 | –3.276 | –0.527 | 2.235 | –0.955 | 0.347 |
| 7 | –7.187 | 2.798 | –4.214 | 1.669 | –0.638 |
| 8 | –2.280 | 1.022 | 5.025 | –0.619 | 0.954 |
| 9 | –5.778 | –1.553 | 4.675 | –2.665 | 0.216 |
| 10 | –7.892 | –3.020 | 6.782 | –3.788 | 1.273 |
Следующим этапом работы была классификация полученных записей на основании их значений главных компонент с использованием НБК. Для каждой анализируемой записи были рассчитаны доли вероятности совпадения эффектов на ЭКоГ с эффектами других групп препаратов, используемых в обучающей выборке (табл. 2). Полученные значения усредняли для каждой группы, на основании чего можно было сделать выводы о сходстве эффектов тех или иных психотропных препаратов (рис. 2c). Например, было показано, что хлорпромазин оказывал наиболее схожие эффекты с амитриптилином и дроперидолом (доли вероятности – 0.281 и 0.216 соответственно). Действие галоперидола напоминало, в большей степени, эффекты дроперидола (0.206), хлорпромазина (0.210) и сульпирида (0.220). Для галоперидола было показано сходство с дроперидолом (0.268) и тиапридом (0.288), а для тиаприда – с сульпиридом (0.231) и дроперидолом (0.214). Наиболее избирательным прогноз был для сульпирида – доля вероятности сходства с тиапридом составила 0.405. Ни для одного из антипсихотических средств не была показана высокая вероятность сходства с NaCl или феназепамом. НБК продемонстрировал умеренное сходство эффектов испытуемых средств с галантамином, причем наибольшее было отмечено у тиаприда (0.147), наименьшее – у дроперидола и сульпирида (0.086 и 0.087).
Таблица 2.
Пример рассчитанных значений вероятности совпадения влияния эффектов сульпирида у 10 животных с эффектами других изучаемых препаратов
| Запись | Препараты | |||||||
|---|---|---|---|---|---|---|---|---|
| NaCl | Амитриптилин | Галантамин | Тиаприд | Дроперидол | Хлорпромазин | Феназепам | Галоперидол | |
| 1 | 0.290 | 0.024 | 0.059 | 0.421 | 0.172 | 0.008 | 0.002 | 0.023 |
| 2 | 0.037 | 0.042 | 0.101 | 0.396 | 0.228 | 0.017 | 0.006 | 0.173 |
| 3 | 0.176 | 0.009 | 0.120 | 0.462 | 0.102 | 0.021 | 0.000 | 0.109 |
| 4 | 0.017 | 0.147 | 0.018 | 0.215 | 0.569 | 0.018 | 0.012 | 0.004 |
| 5 | 0.084 | 0.005 | 0.061 | 0.641 | 0.120 | 0.008 | 0.001 | 0.080 |
| 6 | 0.221 | 0.003 | 0.067 | 0.569 | 0.079 | 0.005 | 0.000 | 0.055 |
| 7 | 0.255 | 0.014 | 0.108 | 0.448 | 0.088 | 0.007 | 0.003 | 0.076 |
| 8 | 0.008 | 0.006 | 0.072 | 0.353 | 0.124 | 0.020 | 0.001 | 0.416 |
| 9 | 0.047 | 0.018 | 0.080 | 0.446 | 0.213 | 0.023 | 0.001 | 0.172 |
| 10 | 0.188 | 0.128 | 0.181 | 0.100 | 0.152 | 0.212 | 0.001 | 0.037 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящей работе показано, что метод фармако-ЭКоГ у крыс в комбинации с МГК и НБК может быть использован для сравнения профилей антипсихотических средств, а также для отличия их эффектов от средств с антидепрессивным и седативным действием (на примере амитриптилина и феназепама). Для всех пяти изучаемых антипсихотиков было показано сходство с наиболее близкими по фармакологическому действию препаратами. Например, эффекты хлорпромазина на амплитудно-спектральные характеристики ЭКоГ были наиболее близкими к таковым дроперидола и галоперидола, что является справедливым, поскольку все препараты оказывают сильное антипсихотическое действие, связанное с выраженной или умеренной блокадой D2-рецепторов [2]. Сходство хлорпромазина с амитриптилином также не является неожиданным, поскольку несмотря на то, что препараты представляют разные фармакологические группы, оба проявляют антагонизм по отношению к М-холино-, α1-адрено- и H1-гистаминовым рецепторам [2, 24].
Аналогичным образом характер действия галоперидола был похож на таковой дроперидола и хлорпромазина. Тем не менее, высокая вероятность совпадения его эффектов с сульпиридом оказалась неожиданной. С одной стороны, оба препарата являются антипсихотическими средствами, однако для галоперидола вероятность совпадения с другим атипичным нейролептиком тиапридом была невысока. Обращает на себя внимание то, что для дроперидола, в отличие от галоперидола, была показана высокая степень сходства с тиапридом. Таким образом, можно провести условную черту между галоперидолом, схожим с хлопромазином и сульпиридом, и дроперидолом, похожим по своим эффектам на тиаприд. На основании данных исследований in vitro можно предположить, что сходство двух последних связано с их наибольшим аффинитетом к D4-рецепторам (табл. 3). Выраженное сходство сульпирида с тиапридом наиболее вероятно отражает то, что оба препарата близки по химической структуре (являются замещенными бензамидами). Следует также учитывать, что на ЭЭГ-картине действия препаратов может сказываться их различная избирательность в отношении рецепторов одного и того же типа, но находящихся в разных областях (нигростриарной, мезокортикальной или мезолимбической).
Таблица 3.
Значения констант ингибирования (Ki, nM), отражающие аффинитет изучаемых антипсихотиков к различным рецепторам [25–27]
| Рецептор | Препараты | ||||
|---|---|---|---|---|---|
| Хлорпромазин | Галоперидол | Дроперидол | Сульпирид | Тиаприд | |
| Дофаминовые рецепторы | |||||
| D1 | 6.3 | 83 | 880 | N/A | N/A |
| D2 | 11 | 2.0 | 0.25 | 8.2 | 226 |
| D3 | 9.7 | 4.0 | N/A | 7.9 | 324 |
| D4 | 56 | 48 | 0.84 | 54 | 14 |
| D5 | N/A | 147 | N/A | N/A | N/A |
| Серотониновые рецепторы | |||||
| 5-HT1A | 840 | 1200 | N/A | N/A | N/A |
| 5-HT2A | N/A | 70 | 4.6 | >10 000 | N/A |
| 5-HT2C | N/A | 5000 | N/A | N/A | N/A |
| Другие | |||||
| α1-АР | 1.4 | 12 | N/A | N/A | N/A |
| H1-ГР | 25 | 3000 | N/A | N/A | N/A |
| M1-ХР | 1.5 | >10000 | N/A | N/A | N/A |
Одна из рабочих гипотез настоящего исследования заключалась в том, что реализуемый подход может быть пригоден для выявления ранних признаков возможных экстрапирамидных нарушений у животных, возникающих в результате введения так называемых типичных антипсихотических средств. Поскольку при применении типичных нейролептиков развитие таких экстрапирамидных нарушений, как брадикинезия, ригидность мышц и тремор во многом связано с гипертонусом холинергической иннервации в головном мозге [19], было выдвинуто предположение, что такие изменения работы нейромедиаторных систем могут быть выявлены при регистрации ЭКоГ уже на раннем этапе. Именно поэтому в качестве одного из референтных средств был выбран ингибитор ацетилхолинэстеразы – галантамин, обладающий ярко выраженным холинергическим действием. Несмотря на то, что в данной работе для всех пяти антипсихотиков было показано некоторое сходство с галантамином (практически всегда выше, чем с NaCl или феназепамом), результат нельзя считать положительным, поскольку наиболее “холинотропным” был тиаприд, в клинической практике нечасто вызывающий экстрапирамидные нарушения [28]. Тем не менее, идея поиска ранних предикторов возможных экстрапирамидных нарушений с помощью фармако-ЭЭГ остается привлекательной и заслуживает внимания в дальнейших исследованиях.
В проведенной работе были использованы дозы препаратов, оказывающие выраженный эффект на поведение или параметры ЭКоГ животных, приведенные в ранее опубликованных работах. Безусловно, для решения задач классификации и прогнозирования вопрос выбранных дозировок является одним из ключевых, поскольку рассчитанные вероятности отнесения препарата к той или иной группе могут кардинально меняться при многократном увеличении или уменьшении дозы. Например, для антипсихотиков с увеличением дозы возникают седативные и антихолинергические эффекты, которые, безусловно, будут сказываться на регистрируемой биоэлектрической активности головного мозга [29]. В связи с этим для дальнейшего развития предлагаемого метода как инструмента фармакологического скрининга необходимо пополнение обучающей выборки записями эффектов известных препаратов в нескольких диапазонах доз.
Идея использования фармако-ЭЭГ у лабораторных животных не является принципиально новым подходом в биомедицинских исследованиях. Данный метод неоднократно использовался разными научными группами для характеристики функциональных эффектов потенциальных или уже известных психоактивных соединений [30–33], выявления возможных побочных эффектов (например, снотворного) [34] или токсического действия (эпилептогенная активность и др.) [35].
Отдельного внимания заслуживают исследования научной группы Dimpfel, первые результаты которых были опубликованы в середине 80-х годов и продолжают выходить в свет по настоящее время. В работе 1984 г. [36] авторами был применен дискриминантный анализ для различия действия сульпирида, клозапина и галоперидола на основании сравнения с эффектами амфетамина, диазепама, имипрамина и хлорпромазина. В качестве входных данных были использованы соотношения до и после введения препарата абсолютных мощностей δ-, θ-, α- и β-ритмов сигналов, записанных билатерально в областях проекций сенсомоторной коры, стриатума и ретикулярной формации. Последующие работы были посвящены записи эффектов различных групп препаратов, что в дальнейшем позволило авторам собрать библиотеку т.н. электрофармакограмм [37], включающую нейролептики, опиоидные и неопиоидные анальгетики, антидепрессанты, психостимуляторы, седативные и противосудорожные средства и даже галлюциногены (LSD, MK 801 и др.). С 2009 г. по настоящее время данная библиотека активно используется для изучения эффектов растительных извлечений. Например, было спрогнозировано антидепрессивное действие флавоноидов рутина и кверцетина [20] и ряда других соединений, а также предложен вариант фармакологической классификации растительных экстрактов на основании их электрофармакограмм [38].
Схожий подход был разработан голландскими исследователями Krijzer и соавт. в 1993 г. [30]. Регистрацию биоэлектрической активности головного мозга осуществляли с фронтальной и париетальной областей коры (получали дифференциальный сигнал), в качестве входных данных для дальнейшего анализа были использованы значения соотношений мощности 256 спектральных диапазонов от 0.36 до 100 Гц до введения препарата и через 20 и 45 мин после. Дисперсионный анализ, t-тест и последующая нормализация по степеням свободы преобразовывали полученные значения первичного анализа в так называемые n-профили. Дальнейший дискриминантный анализ позволял сравнивать между собой n-профили препаратов разных групп и различать между собой эффекты антидепрессантов, нейролептиков, анксиолитиков и психостимуляторов. Предложенный метод позволил спрогнозировать антидепрессивное и анксиолитическое действие E-10-гидроксинортриптилина, активного метаболита нортриптилина, что подтвердило предыдущие клинические наблюдения у пациентов с депрессией [31]. Несмотря на положительные результаты, данный подход не получил развития, и приведенное выше исследование является последней опубликованной работой, где были использованы n-профили для прогнозирования фармакологической активности.
ФГБУН “Научный центр биомедицинских технологий ФМБА России” (Московская область) предложил еще один метод прогнозирования, в котором в качестве модельного объекта была выбрана кошка [39, 40]. Регистрацию биоэлектрической активности мозга осуществляли глубинными электродами, имплантированными в поясную извилину, гипоталамус, хвостатое ядро и другие структуры. Оценка профиля фармакологической активности испытуемых психотропных препаратов была основана на сравнении нормализованных значений спектральной мощности с таковыми для референтных препаратов. С помощью данного метода было показано, что лейцинэнкефалин лейтрагин обладает схожими эффектами с оригинальным синтетическим аналогом фрагмента адренокортикотропного гормона (АКТГ4-10), что, согласно предположению авторов, отражает механизмы ГАМК-ергической модуляции гиппокампа и префронтальной коры [41].
Таким образом, результаты вышеприведенных работ свидетельствуют о том, что метод фармако-ЭЭГ у лабораторных животных может быть использован для выявления и определения эффектов препаратов, оказывающих влияние на функции центральной нервной системы. Пример исследований Dimpfel и соавт. показывает, что этот экспериментальный подход не остался рудиментом нейробиологических исследований, но может быть успешно использован для решения исследовательских задач в настоящее время. На основании результатов данного исследования и сравнения с работами других авторов можно сделать вывод, что для решения задач классификации и прогнозирования могут быть использованы различные математические подходы. Анализ данных биоэлектрической активности головного мозга позволяет рассчитывать десятки и даже сотни амплитудно-спектральных характеристик сигналов, однако для успешного применения различных классификаторов необходимы грамотные подходы уменьшения размерности либо выявления показателей, наиболее чувствительных к фармакологическому воздействию. Особенно важно, что с появлением новых методов машинного обучения полученные данные не теряют свою актуальность и могут представлять плодородную почву для исследовательской работы не только нейрофармакологов, но и специалистов из областей математики и информационных технологий.
Список литературы
Lally J, MacCabe JH (2015) Antipsychotic medication in schizophrenia: a review. Br Med Bull 114(1): 169–179.https://doi.org/10.1093/bmb/ldv017
Дробижев МЮ, Овчинников АА (2010) Антипсихотики: меняем старые поколения на новую классификацию? Социальная и клиническая психиатрия 20(2): 80–87. [Drobizhev MYu, Ovchinnikov AA (2010) Antipsychotics: replacing the old generations with a new classification? Sotsialnaia i klinicheskaia psikhiatriia 20(2): 80–87. (In Russ)].
Калитин КЮ, Спасов АА, Муха ОЮ, Придворов ГВ, Липатов ВА (2021) Фармакологические мишени и механизм действия антипсихотических средств в рамках нейрохимической теории патогенеза шизофрении. Рос физиол журн им ИМ Сеченова 107(8): 927–954. [Kalitin KY, Spasov AA, Mukha OY, Pridvorov GV, Lipatov VA (2021) Pharmacological targets and the mechanism of action of antipsychotic agents in the framework of the neurochemical theory of the pathogenesis of schizophrenia. Russ J Physiol 107(8): 927–954. (In Russ)]. https://doi.org/10.31857/S0869813921080070
Winship IR, Dursun SM, Baker GB, Balista PA, Kandratavicius L, Maia-de-Oliveira JP, Hallak J, Howland JG (2019) An Overview of Animal Models Related to Schizophrenia. Can J Psychiatry 64(1): 5–17.https://doi.org/10.1177/0706743718773728
Ang MJ, Lee S, Kim JC, Kim SH, Moon C (2021) Behavioral Tasks Evaluating Schizophrenia-like Symptoms in Animal Models: A Recent Update. Curr Neuropharmacol 19(5): 641–664. https://doi.org/10.2174/1570159X18666200814175114
Itil T, Shapiro D, Hickman C, Fink M, Kiremitci N (1968) The differentiation of tranquilizers by quantitative EEG. Electroencephalogr Clin Neurophysiol 24(3): 288.
Itil TM, Ulett GA, Fukuda T (1971) Quantitative pharmaco-electroencephalography in early evaluation of psychotropic drugs. Folia Psychiatr Neurol Jpn 25(3): 195–202.https://doi.org/10.1111/j.1440-1819.1971.tb01503.x
Каркищенко НН, Каркищенко ВН, Фокин ЮВ, Табоякова ЛА, Алимкина ОВ, Борисова ММ (2020) Между когнитивностью и нейропатиями: нейровизуализация эффектов ГАМК-ергической модуляции гиппокампа и префронтального неокортекса по нормированным электрограммам мозга. Биомедицина 16(2): 12–38. [Karkischenko NN, Karkischenko VN, Fokin YuV, Taboyakova LA, Alimkina OV, Borisova MM (2020) Between Cognitivity and Neuropathies: Neuroimaging of the Effects of GABAergic Modulation of the Hippocampus and Prefrontal Neocortexis by Normalized Brain Electrograms. J Biomed 16(2): 12–38. (In Russ)]. https://doi.org/10.33647/2074-5982-16-2-12-38
Каркищенко НН, Фокин ЮВ, Табоякова ЛА, Алимкина ОВ, Борисова ММ (2020) Новые биомедицинские подходы в информационно-когнитивных технологиях фармако-ЭЭГ моделирования психопатологий. Биомедицина 16(3): 35–38. [Karkischenko NN, Fokin YuV, Taboyakova LA, Alimkina OV, Borisova MM (2020) New Biomedical Approaches in Information and Cognitive Technologies of Psychopathology Modeling. J Biomed 16(3): 35–38. (In Russ)]. https://doi.org/10.33647/2074-5982-16-3-35-38
Куделина ОМ, Сафроненко АВ, Макляков ЮС, Ганцгорн ЕВ, Морозов НМ, Джабр МА (2020) Аналитическая оценка лечения депрессии в эксперименте на животных посредством количественной фармако-ЭЭГ. Биомедицина 16(3): 43–47. [Kudelina OM, Safronenko AV, Maklyakov YuS, Gantsgorn EV, Morozov NM, Jabr MA (2020) Analytical Evaluation of Treating Depression in Animal Models by Quantitative Pharmaco-EEG. J Biomed 16(3): 43–47. (In Russ)].https://doi.org/10.33647/2074-5982-16-3-43-47
Яковлев ОА, Вахвияйнен МС, Юдин МА (2020) Фармако-ЭЭГ как способ определения пороговой дозы нейротропных веществ. Биомедицина 16(3): 39–42. [Yakovlev OA, Vakhviyaynen MS, Yudin MA (2020) Pharmaco-EEG as a Method for Determining the Threshold Dose of Neurotropic Substances. J Biomed 16(3): 39–42. (In Russ)].https://doi.org/10.33647/2074-5982-16-3-39-42
Patel L, Shukla T, Huang X, Ussery DW, Wang S (2020) Machine Learning Methods in Drug Discovery. Molecules 25(22): 5277. https://doi.org/10.3390/molecules25225277
Guo B, Zheng Q (2015) Using Naïve Bayes Algorithm to Estimate the Response to Drug in Lung Cancer Patients. Comb Chem High Throughput Screen 21(10): 734–748.https://doi.org/10.2174/1386207322666190125151624
Muchira JM, Gona PN, Leveille S, Hayman LL (2019) A Review of Methodological Approaches for Developing Diagnostic Algorithms for Diabetes Screening. J Nurs Meas 27(3): 433–457. https://doi.org/10.1891/1061-3749.27.3.433
Zhang H, Ding L, Zou Y, Hu SQ, Huang HG, Kong WB, Zhang J (2016) Predicting drug-induced liver injury in human with Naïve Bayes classifier approach. J Comput Aided Mol Des 30(10): 889–898.https://doi.org/10.1007/s10822-016-9972-6
Rescorla M (2021) Bayesian modeling of the mind: from norms to neurons. Wiley Interdiscip Rev Cogn Sci 12(1): e1540.https://doi.org/10.1002/wcs.1540
Сысоев ЮИ, Приходько ВА, Идиятуллин РД, Черняков РТ, Карев ВЕ, Оковитый СВ (2022) Метод регистрации биоэлектрической активности коры головного мозга у крыс в условиях хронического эксперимента. Рос физиол журн им ИМ Сеченова 108(2): 279–290. [Sysoev YuI, Prikhodko VA, Idiyatullin RD, Chernyakov RT, Karev VE, Okovityi SV (2022) A Method for Chronic Registration of Brain Cortical Electrical Activity in Rats. Russ J Physiol 108(2): 279–290. (In Russ)].https://doi.org/10.1134/S0869813919060074
Hansen IH, Agerskov C, Arvastson L, Bastlund JF, Sørensen HBD, Herrik KF (2019) Pharmaco-electroencephalographic responses in the rat differ between active and inactive locomotor states. Eur J Neurosci 50(2): 1948–1971.https://doi.org/10.1111/ejn.14373
Liu C (2020) Targeting the cholinergic system in Parkinson’s disease. Acta Pharmacol Sin 41(4): 453–463.https://doi.org/10.1038/s41401-020-0380-z
Dimpfel W (2009) Rat electropharmacograms of the flavonoids rutin and quercetin in comparison to those of moclobemide and clinically used reference drugs suggest antidepressive and/or neuroprotective action. Phytomedicine 16(4): 287–294.https://doi.org/10.1016/j.phymed.2009.02.005
Mar AC, Nilsson SRO, Gamallo-Lana B, Lei M, Dourado T, Alsiö J, Saksida LM, Bussey TJ, Robbins TW (2017) MAM-E17 rat model impairments on a novel continuous performance task: effects of potential cognitive enhancing drugs. Psychopharmacology (Berl) 234(19): 2837–2857.https://doi.org/10.1007/s00213-017-4679-5
Scatton B, Cohen C, Perrault G, Oblin A, Claustre Y, Schoemaker H, Sanger DJ, Rouquier L, Porsolt R (2001) The preclinical pharmacologic profile of tiapride. Eur Psychiatry 16 Suppl 1: 29s–34s.https://doi.org/10.1016/s0924-9338(00)00526-5
Ringnér M (2008) What is principal component analysis? Nat Biotechnol 26(3): 303–304.https://doi.org/10.1038/nbt0308-303
McClure EW, Daniels RN (2021) Classics in Chemical Neuroscience: Amitriptyline. ACS Chem Neurosci 12(3): 354–362.https://doi.org/10.1021/acschemneuro.0c00467
Donahue TJ, Hillhouse TM, Webster KA, Young R, De Oliveira EO, Porter JH (2017) Discriminative stimulus properties of the atypical antipsychotic amisulpride: comparison to its isomers and to other benzamide derivatives, antipsychotic, antidepressant, and antianxiety drugs in C57BL/6 mice. Psychopharmacology (Berl) 234(23–24): 3507–3520.https://doi.org/10.1007/s00213-017-4738-y
Li P, Snyder GL, Vanover KE (2016) Dopamine Targeting Drugs for the Treatment of Schizophrenia: Past, Present and Future. Curr Top Med Chem 16(29): 3385–3403.https://doi.org/10.2174/1568026616666160608084834
Yonemura K, Miyanaga K, Machiyama Y (1998) Profiles of the affinity of antipsychotic drugs for neurotransmitter receptors and their clinical implication. Kitakanto Med J 48(2): 87–102. https://doi.org/10.2974/kmj.48.87
Dose M, Lange HW (2000) The benzamide tiapride: treatment of extrapyramidal motor and other clinical syndromes. Pharmacopsychiatry 33(1): 19–27.https://doi.org/10.1055/s-2000-7964
Haddad PM, Sharma SG (2007) Adverse effects of atypical antipsychotics: differential risk and clinical implications. CNS Drugs 21(11): 911–936.https://doi.org/10.2165/00023210-200721110-00004
Krijzer F, Koopman P, Olivier B (1993) Classification of psychotropic drugs based on pharmaco-electrocorticographic studies in vigilance-controlled rats. Neuropsychobiology 28(3): 122–37. https://doi.org/10.1159/000119015
Nordin C, Krijzer F (1996) Antidepressant and anxiolytic profiles of E-10-hydroxynortriptyline on electrocorticograms of rats. Neuropsychobiology 34(1): 44–48.https://doi.org/10.1159/000119290
Papp N, Vas S, Bogáthy E, Kátai Z, Kostyalik D, Bagdy G (2018) Acute and chronic escitalopram alter EEG gamma oscillations differently: relevance to therapeutic effects. Eur J Pharm Sci 121: 347–355.https://doi.org/10.1016/j.ejps.2018.06.012
Rujiralai T, Puangpairote T, Cheaha D (2021) Characterization of pharmaco-EEG fingerprint and sleep-wake profiles of Lavandula angustifolia Mill. essential oil inhalation and diazepam administration in rats. J Ethnopharmacol 276: 114193.https://doi.org/10.1016/j.jep.2021.114193
Depoortere H, Decobert M, Granger P, Riou-Merle F (1986) Hypnotics: clinical value of pharmaco-EEG methods. Neuropsychobiology 16(2–3): 157–162.https://doi.org/10.1159/000118318
Krijzer F, Snelder M, Bradford D (1984) Comparison of the (pro)convulsive properties of fluvoxamine and clovoxamine with eight other antidepressants in an animal model. Neuropsychobiology 12(4): 249–254.https://doi.org/10.1159/000118147
Dimpfel W, Decker H (1985) Classification of sulpiride, clozapine and haloperidol by toposelective recording from different brain structures in the immobilized rat (stereo-EEG). Neuropsychobiology 14(3): 157–164.https://doi.org/10.1159/000118220
Dimpfel W (2003) Preclinical data base of pharmaco-specific rat EEG fingerprints (tele-stereo-EEG). Eur J Med Res 8(5): 199–207.
Dimpfel W (2013) Pharmacological classification of herbal extracts by means of comparison to spectral EEG signatures induced by synthetic drugs in the freely moving rat. J Ethnopharmacol 149(2): 583–589.https://doi.org/10.1016/j.jep.2013.07.029
Каркищенко НН, Фокин ЮВ, Каркищенко ВН, Табоякова ЛА, Харитонов СЮ, Алимкина ОВ (2018) Новые подходы к оценке интрацентральных отношений по показателям оперантного поведения и электрограмм мозга кошек. Биомедицина (4): 4–17. [Karkischenko NN, Fokin YuV, Karkischenko VN, Taboyakova LA, Kharitonov SYu, Alimkina OV (2020) New approaches to the assessment of intracentral relations in terms of operant behavior and electrograms of the brain of cats. J Biomed (4): 4–17. (In Russ)].
Каркищенко НН, Каркищенко ВН, Фокин ЮВ, Харитонов СЮ (2019) Нейровизуализация эффектов психоактивных средств посредством нормализации электрограмм головного мозга. Биомедицина (1): 12–34. [Karkischenko NN, Karkischenko VN, Fokin YuV, Kharitonov SYu (2019) Neuroimaging of the effects of psychoactive substances by means of normalization of brain electrograms. J Biomed (1): 12–34. (In Russ)].https://doi.org/10.33647/2074-5982-15-1-12-34
Фокин ЮВ, Каркищенко НН, Борисова ММ (2020) Нейровизуализация фармако-ЭЭГ эффектов лейтрагина посредством нормированных электрограмм мозга кошек. Биомедицина 16(4): 71–82. [Fokin YuV, Karkischenko NN, Borisova MM (2020) Neurovisualization of Pharmaco-EEG Effects of Leutragine by Normalized Cat Brain Electrograms. J Biomed 16(4): 71–82. (In Russ)].https://doi.org/10.33647/2074-5982-16-4-71-82
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


