Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 8, стр. 984-996
Исследование эффектов индуктора шаперонов U133 на временные характеристики цикла бодрствование–сон и пространственную память
И. В. Екимова 1, *, Н. С. Курмазов 1, М. Б. Пази 1, М. В. Чернышев 1, С. Г. Полоник 2, Ю. Ф. Пастухов 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
2 Тихоокеанский институт биоорганической химии им. Г.Б. Елякова ДВО РАН
Владивосток, Россия
* E-mail: irina-ekimova@mail.ru
Поступила в редакцию 17.06.2022
После доработки 20.07.2022
Принята к публикации 20.07.2022
- EDN: VAMLIQ
- DOI: 10.31857/S0869813922080027
Аннотация
Индуктор шаперонов соединение U133, созданное на основе эхинохрома A, обладает противоопухолевой, антиоксидантной и нейропротективной активностью. Широта терапевтического действия вызывает большой интерес к этому соединению, поскольку на его основе в дальнейшем могут быть разработаны потенциальные лекарственные средства. Однако на сегодняшний день спектр биологической активности соединения U133 на функциональном уровне до конца не определен. В данном исследовании мы поставили перед собой задачу выяснить, сопряжено ли повышение содержания шаперона Нsp70 в головном мозге, достигаемое с помощью соединения U133, с изменением цикла бодрствование–сон и пространственной рабочей памяти у крыс популяции Вистар в естественных физиологических условиях. Проведенное исследование показало, что внутрибрюшинное введение соединения U133 приводит к возрастанию содержания шаперона Hsp70 (HSPA1) в структурах головного мозга, вовлеченных в механизмы регуляции сна–бодрствования и формирования памяти (голубое пятно, преоптическая область гипоталамуса, черная субстанция, вентральная тегментальная область среднего мозга). Повышение уровня Hsp70 в головном мозге было сопряжено с увеличением в 1.7 раза продолжительности парадоксального сна (ПС) в период с 12-го по 24-й ч после введения индуктора. Эти факты позволяют полагать, что эффект соединения U133 на представленность ПС реализуется с участием шаперона Hsp70. Несмотря на то что ПС может влиять на на различные виды памяти, мы не обнаружили значимого эффекта U133 на пространственную рабочую память. Соединение U133 может быть рекомендовано для дальнейшего исследования спектра биологической активности с целью прогнозирования его терапевтической эффективности при различных патологиях ЦНС и старении, когда нарушается сон и уменьшается экспрессия шаперонов в головном мозге.
ВВЕДЕНИЕ
1,4-Нафтохиноны являются вторичными метаболитами растений и животных и необходимы для протекания многих биологических процессов. Их природные и синтетические производные демонстрируют широкий спектр биологической активности, который включает в себя противомикробное, антиоксидантное, нейропротекторное, кардио- и гепатопротекторное, антиишемическое и другие свойства [1–4]. Такой широкий терапевтический спектр вызывает большой интерес к этим соединениям, поскольку они представляют многообещающую платформу для поиска потенциальных лекарственных средств. Одними из них, синтезированными сотрудниками ТИБОХ ДВО РАН, являются лекарственный препарат “Гистохром®” (2,3,5,6,8-пентагидрокси-7-этил-1,4-нафтохинон) и соединение U133 (ацетилированный трис-О-глюкозид эхинохрома), которые были созданы на основе эхинохрома A – пигмента морских ежей [5]. Гистохром как мощный антиоксидант более 10 лет применяется для лечения инфаркта миокарда и ишемической болезни сердца, а также в офтальмологии для лечения дегенерации роговицы, диабетической ретинопатии, травм и ожогов глаз [6, 7]. Он является скавенджером свободных радикалов, и хелатором катионов металлов, включая катионы кальция [8, 9].
Соединение U133 обладает противоопухолевой [10], антиокидантной активностью [11] и уникальной способностью активировать транскрипционный фактор теплового шока HSF1, что индуцирует усиление экспрессии ко-шаперона Hsp40 и гена индуцибельного белка теплового шока Hsp70 (Hspa1) [12, 13]. Проведенные недавно нами исследования показали, что применение терапии, основанной на системном введении U133, на моделях болезни Паркинсона (БП) у крыс среднего и пожилого возраста приводит к повышению уровня Hsp70 в нигростриатной системе, что сопровождается ослаблением развития α-синуклеиновой патологии, нейровоспаления и процесса нейродегенерации [12, 14]. Hsp70-индуцирующая активность соединения U133 может иметь хорошие перспективы в медицинской стратегии терапии конформационных патологий и других заболеваний, для которых характерна дезорганизация клеточных процессов. Это связано с тем, что шаперон Hsp70 является одним из центральных координаторов протеостазной сети, обеспечивая правильную конформацию белков, и защищает клетки от последствий неправильного фолдинга и агрегации белка [15]. Кроме того, обладая шаперонной активностью, Hsp70 вступает во взаимодействие с функциональными клеточными белками, что приводит к модификации различных регуляторных каскадов и синаптических процессов в ЦНС [16, 17]. Hsp70 участвует в процессах синтеза и доставки белков, необходимых для поддержания существующих синапсов и образования новых.
К настоящему времени растет количество исследований, указывающих на важную роль фактора транскрипции HSF1 и шаперона Hsp70 в молекулярных механизмах модуляции сна и процессах формирования памяти. Например, было продемонстрировано, что введение Hsp70 в преоптическую область гипоталамуса у крыс приводит к возрастанию представленности медленноволнового сна (МВС), а нокдаун Hsp70 к его уменьшению [18, 19]. В модели доклинической стадии БП у пожилых крыс фармакотерапия с индуктором шаперонов U133 препятствовала развитию гиперсомнии, корректировала показатели МВС и оказывало действие, подобное антидепрессантам [20, 21]. Показана взаимосвязь между функцией шаперона Hsp70 и формированием памяти. Об этом свидетельствует HSF1-зависимая индукция Hsp70 при выполнении задач, связанных с обучением и памятью [17, 22, 23]. Куркумин, который действует как активатор HSF1, повышает уровень мозгового нейротрофического фактора (Brain-Derived Neurotrophic Factor – BDNF) в гиппокампе и уменьшает потерю рабочей и пространственной референтной памяти в модели болезни Альцгеймера у грызунов [24, 25]. Однако эффекты индуктора шаперонов соединения U133 на интегративные функции мозга, такие как сон и память, до сих пор не изучены в естественных физиологических условиях. Пока остаются неясными его ситуативные эффекты (“здесь и сейчас”) и насколько они сопряжены с Hsp70-индуцирующей активностью соединения U133. Проведение таких исследований необходимо для дальнейшего выяснения спектра биологической активности соединения U133 на функциональном уровне.
В настоящей работе мы поставили перед собой задачу выяснить, сопряжено ли повышение содержания шаперона Нsp70 в головном мозге, достигаемое с помощью соединения U133, с изменением цикла бодрствование–сон и пространственной рабочей памяти у крыс в естественных физиологических условиях.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проведено на крысах-самцах популяции Wistar в возрасте 7–8 мес., массой тела 370–420 г. До эксперимента животных содержали в стандартных условиях вивария ИЭФБ РАН по 5 особей в клетке при температуре окружающей среды 23 ± 1°С и свободном доступе к воде и пище. Во время проведения экспериментов животных содержали в одиночных клетках в экспериментальной комнате при температуре 23 ± 1°C, фотопериоде 12:12 ч (11:00–23:00 – свет) и свободном доступе к воде и пище. Манипуляции с животными соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям, утвержденным биоэтическим комитетом по охране животных ИЭФБ РАН.
Препараты. В опытах использовали индуктор шаперонов хиноидное соединение U133 (ацетилированный трис-О-глюкозид эхинохрома), которое было синтезировано в Тихоокеанском институте биоорганической химии им. Г.Б. Елякова ДВО РАН [26, 27]. Соединение U133 растворяли в 20 мкл DMSO и доводили до объема 200 мкл с помощью 0.9% раствора NaCl. U133 вводили животным внутрибрюшинно (в/б) в дозе 4 мг/кг в начале светлой фазы суток. Контрольной группе животных вводили растворитель (200 мкл 0.9% NaCl с добавлением 20 мкл DMSO).
Вестерн-блот. Изменение содержания Hsp70 оценивали методом Вестерн-блот в ткани преоптической области гипоталамуса, голубом пятне, компактной части черной субстанции (кчЧС)/вентральной тегментальной области (ВТО) среднего мозга через 12 и 24 ч после введения U133 или его растворителя. В каждой временной точке было не менее 3 животных. Пробы тканей головного мозга гомогенизировали и лизировали с использованием High RIPA буфера. Электрофорез проводился в 11% полиакриламидном геле, затем белки переносили на мембрану из поливинилидендифторида (PVDF-мембрану; Immun-Blot®, BIO RAD, США). Для предотвращения неспецифического связывания антител мембраны инкубировали в течение 1 ч в блокирующем растворе (PBS с добавлением 0.1% Tween-20 и 3% бычьего сывороточного альбумина). Далее мембрану инкубировали с первичными антителами против Hsp70 (1 : 1000; Abcam, Великобритания), против β-актина (1 : 1000; Sana Cruz Biotechnology, США) или GAPDH (Invitrogen, США) в течение ночи при 4°C. Протокол хемилюминесценции с применением реактива Novex ECL HRP Chemiluminescent Substrate Reagent Kit (Invitogen, США) был использован для визуализацим сигнала. Для оценки денситометрии использовали ImageJ (NIH, США). Уровень белка Hsp70 был нормирован на сигнал β-актина или GAPDH.
Полисомнография. Регистрацию полисомнограмм проводили в изолированной от звуковых и световых раздражителей экспериментальной камере в условиях свободного поведения животных с использованием телеметрического оборудования “Dataquest A.R.T. System” (DSI, США). Под общим наркозом (Золетил100, tiletamine hydrochloride and zolazepam, 70 мг/кг внутримышечно; Virbac Sante Animale, France) крысам контрольной (n = 5) и экспериментальной (n = 5) групп вживляли подкожно телеметрический модуль 4EТ (DSI, США) для регистрации электроэнцефалограммы (ЭЭГ), электроокулограммы глазных мышц (ЭОГ), электромиограммы (ЭМГ) шейной мышцы, температуры тела. Период послеоперационной реабилитации составлял не менее 2 нед. Регистрация полисомнограмм проводилась с момента введения соединения U133 или его растворителя в течение 24 ч.
Анализ полисомнограмм выполняли в программе Sleep_Pro, разработанной в лаборатории (М.В. Гузеев). Программа отфильтровывала сигнал ЭЭГ в диапазоне 0.5–100 Гц, а сигнал ЭМГ – в диапазоне 10–100 Гц; частота дискретизации АЦП – 250 Гц. На полисомнограммах выделяли 4 состояния: бодрствование – высокий тонус мышц или двигательная активность на ЭМГ, низкоамплитудная, высокочастотная, десинхронизированная ЭЭГ, включая периоды со смешанной амплитудой и частотой; дремота – на ЭЭГ небольшие периоды умеренной медленноволновой активности, наблюдаются сонные веретена, ЭМГ демонстрирует тонус мышц ниже, чем в бодрствовании; МВС – высокоамплитудная ЭЭГ с преобладанием медленноволновой активности (0.8–4 Гц), низкий тонус мышц на ЭМГ; парадоксальный сон (ПС) – на ЭЭГ коры головного мозга преобладает десинхронизация или тета-ритм (5–8 Гц), на ЭМГ отсутствие мышечного тонуса, прерываемого периодическими мышечными подергиваниями, быстрые движения глаз на ЭОГ. Эпоха анализа бодрствования и МВС составляла 10 с, при идентификации дремоты и ПС использовали эпоху менее 10 с. Для оценки архитектуры сна анализировали общее время, среднею длительность и число эпизодов состояний бодрствования, дремоты, МВС и ПС.
Для оценки интенсивности (качества) МВС определяли медленноволновую активность ЭЭГ в дельта диапазоне в состоянии МВС как отношение спектральной плотности в полосе частот 0.7–4 Гц за каждый час регистрации к среднесуточной спектральной плотности диапазона 0.7–50 Гц. Представленность глубокого МВС рассчитывали как продолжительность сна с преобладанием медленноволновой активности от общего времени МВС.
Тест Y-образный лабиринт использовался для оценки пространственной рабочей памяти крыс [28]. Установка представляла собой лабиринт с тремя равнозначными рукавами 50 × 16 × 31 см. Исследование выполнено на 12 крысах, равномерно разделенных на две независимые группы. Тестирование начинали через 24 ч после введения соединения U133 или растворителя в начале светлой фазы суток. Крыса, помещенная в Y-образный лабиринт, обследовала новое пространство, поочередно посещая различные рукава. Регистрировалось количество и последовательность заходов крысы в рукава лабиринта за 10 мин теста, где выделяли правильные триады, выражающиеся в чередовании трех разных рукавов. В финальном расчете в качестве показателя рабочей памяти высчитывался коэффициент спонтанного чередования по следующей формуле: $\frac{{{\text{число}}\,\,{\text{правильных}}\,\,{\text{триад}}}}{{{\text{общее}}\,\,{\text{число}}\,\,{\text{входов}}\,\,{\text{в}}\,\,{\text{рукава}} - 2}} \times 100{\text{\% }}$. Низкий процент чередования свидетельствовал о нарушении пространственной рабочей памяти, поскольку крыса не может вспомнить, какой рукав она только что посетила, и, таким образом, демонстрирует снижение спонтанного чередования.
Статистика. Статистический анализ результатов выполнен в программе Prism – GraphPad 8. Нормальность распределения проверяли с помощью теста Колмогорова–Смиронова. Статистическую обработку данных по Вестерн-блотам выполняли с помощью однофакторного дисперсионного анализа ANOVA с последующим Sidak’s post-hoc test. Для выявления различий во временных характеристиках цикла бодрствование-сон и показателях пространственной памяти использовали параметрический t-критерий Стьюдента. Полученные различия считали статистически значимыми при p ≤ 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Системное введение U133 приводит к повышению содержания индуцибельного белка Hsp70 в головном мозге
На первом этапе работы необходимо было оценить Hsp-70-индуцирующую активность соединения U133 в структурах головного мозга, вовлеченных в регуляцию сна и когнитивных функций (кчЧС/ВТО, голубое пятно, преоптическая область гипоталамуса) [29–33]. Содержание Hsp70 было изучено через 12 и 24 ч после в/б введения U133. Однофакторный анализ ANOVA показал статистически значимые различия в группе с введением U133 по сравнению с контрольной группой (введение растворителя): кчЧС/ВТО (F (2, 11) = 5.7; p = 0.02), голубое пятно (F (2, 10) = 14.9; p = 0.001), преоптическая область гипоталамуса (F (2, 3) = 13.1; p = 0.03). Используя Sidak’s post-hoc test, мы показали, что системное введение соединения U133 вызывает значимое повышение уровня Hsp70 во всех изучаемых структурах (рис. 1а–c). При этом повышенный уровень Hsp70 сохранялся через 24 ч после введения индуктора, но дальнейшего прироста Hsp70 не отмечалось.
Рис. 1.
Изменение содержания индуцибельного белка теплового шока Hsp70 в ткани компактной части черной субстанции/вентральной тегментальной области среднего мозга/черной субстанции (a), голубом пятне (b), преоптической области гипоталамуса (с) у крыс через 12 и 24 ч после внутрибрюшинного введения соединения U133. В верхней части рисунка представлены репрезентативные иммуноблоты компактной части черной субстанции/вентральной тегментальной области (SN/VTA), голубого пятна (Locus C.), преоптической области гипоталамуса (POA). На графике по вертикали — оптическая плотность Hsp70, % от контроля. Проведен дисперсионный анализ ANOVA с последующим post-hoc анализом с помощью критерия Сидак HSD.Достоверность различий в опыте относительно контроля * – p < 0.05.Данные представлены в виде среднего значения ± ошибка среднего.

Индуктор шаперонов U133 увеличивает представленность парадоксального сна
Повышение уровня Hsp70 в кчЧС/ВТО, голубом пятне, преоптической области гипоталамуса при введении соединения U133 совпадало по срокам с изменениями временных характеристик ПС (REMS). Общее время ПС начинало возрастать через 12 ч после введения U133 и сохранялось на повышенном уровне в течение последующих 12 ч активной (темной) фазы суток. В среднем прирост ПС составил 73% или 31 мин (t тест = 3.243, р = 0.0118; рис. 2a) по сравнению с контролем.
Рис. 2.
Изменение общего времени состояний бодрствования и сна за 12 ч активной фазы суток при системном введении индуктора шаперонов U133 у крыс. По вертикали – процент времени состояния за 12 ч. * – достоверные изменения по сравнению с контролем (p < 0.05, t-критерий Стьюдента). REMS – парадоксальный сон, SWS – медленноволновый сон. Данные представлены в виде среднего значения ± ошибка среднего.

Увеличение представленности ПС было связано с увеличением как числа эпизодов ПС (на 37%), так и их длительности (на 24%) (табл. 1). Проведенный анализ временных характеристик МВС (SWS) не выявил значимых изменений при введении соединения U133 (рис. 2b, табл. 1). Отмечалась лишь тенденция к возрастанию общего времени МВС (31.7 ± 1.9% в экспериментальной группе против 28.7 ± 2.3% в контрольной группе (t тест = 1.0, р = 0.3). Индуктор шаперонов не оказывал влияние на общее время бодрствования (t тест = 1.3, р = 0.2), дремоты (t тест = 0.3, р = 0.8) и представленность глубокого дельта МВС (t тест = 0.3, p = 0.8) (рис. 2с–е); средняя длительность и число эпизодов бодрствования и дремоты также значимо не менялись (табл. 1).
Таблица 1.
Средняя длительность и число эпизодов состояний бодрствования и сна в активную фазу суток при введении соединения U133 у крыс
| Группа | Средняя длительность эпизодов | Число эпизодов | |
|---|---|---|---|
| Бодрствование | Контроль | 267.3 ± 48.6 | 89 ± 11.1 |
| U133 | 253.2 ± 21.6 | 76.6 ± 5.4 | |
| Дремота | Контроль | 36.9 ± 4.2 | 162.2 ± 21.2 |
| U133 | 33.9 ± 1.7 | 165.4 ± 11.1 | |
| ПС | Контроль | 107.8 ± 5.5 | 23.6 ± 3.3 |
| U133 | 134 ± 9.8 * | 32.4 ± 1.2 * | |
| МВС | Контроль | 118.6 ± 19.1 | 113.4 ± 17.3 |
| U133 | 112.6 ± 12.1 | 122 ± 7.5 |
Соединение U133 не влияет на пространственную память
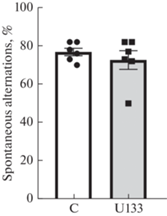
В многочисленных клинических и экспериментальных исследованиях продемонстрирована тесная взаимосвязь между потерей/нарушением сна и когнитивным дефицитом [34, 35]. Среди физических последствий недосыпания, пожалуй, наиболее важными являются дефицит внимания и кратковременной (рабочей) памяти. Считается, что недостаток ПС сказывается на формировании и закреплении долговременной процедурной памяти и эмоционального компонента декларативной памяти. Это позволило нам предположить, что изменение архитектуры сна за счет увеличения представленности ПС после введения U133 могло оказать влияние на когнитивные показатели в естественных физиологических условиях. Однако при оценке пространственной рабочей памяти в тесте Y-образный лабиринт у крыс не было обнаружено достоверных различий в коэффициенте спонтанных чередований между контрольной группой и группой с введением U133 (t-тест, р > 0.05; рис. 3). Не наблюдалось также значимых различий между указанными группами и в показателе двигательной активности, о чем судили по количеству заходов в рукава лабиринта (15.4 ± 1.4 в экспериментальной группе против 13.8 ± 2.0 в контрольной).
Рис. 3.
Оценка пространственной рабочей памяти в тесте Y-образный лабиринт у крыс после введения соединения U133. По вертикали: доля правильных спонтанных чередований (коэффициент). По горизонтали: использованные группы животных. Данные представлены как среднее значение ± стандартная ошибка. С – контроль.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенное исследование показало, что системное введение соединения U133 крысам среднего возраста в естественных физиологических условиях приводит через 12 ч с момента введения к значимому возрастанию уровня Hsp70 в голубом пятне, преоптической области гипоталамуса, кчЧС/ВТО, которые включены в нервные сети регуляции цикла бодрствование–сон и процессы формирования памяти [29–33]. При этом повышенный уровень шаперона Hsp70 сохранялся в течение последующих 12 ч, что указывает на длительный процесс транскрипции и трансляции шаперона Hsp70. Ранее нами показано, что Hsp70-индуцирующая активность соединения U133 связана с его способностью активировать белковый фактор транскрипции HSF1, что приводит к ядерной транслокации HSF1 и связыванию с регуляторным элементом теплового шока (HSE) с последующей активацией промотора hsp70; после этого начинается транскрипция и синтез Hsp70 [12]. Важно отметить, что потенциал U133 для активации HSF1 был сопоставим с тепловым шоком, что свидетельствует о высоком уровне индуцирующего действия хиноидного соединения на транскрипцию генa hsp70.
Повышение уровня Hsp70 в структурах головного мозга при введении соединения U133 было сопряжено с увеличением в 1.7 раза продолжительности ПС вследствие активации как механизмов генерации (увеличение числа эпизодов), так и поддержания этого состояния (возрастание длительности эпизодов ПС). Эти факты позволяют полагать, что механизм действия соединения U133 на ПС связан с повышенной экспрессией шаперона Hsp70 в структурах головного мозга, вовлеченных в регуляцию ПС (преоптическая область гипоталамуса, кчЧС/ВТО). В пользу этого свидетельствуют данные об уменьшении общего времени МВС и ПС в условиях подавления синтеза Hsp70 и снижения его уровня на 60% в вентролатеральной преоптической области гипоталамуса крыс, где локализуется один из основных “центров” регуляции сна [19]. Дополнительным подтверждением вовлечения шаперона Hsp70 в клеточно-молекулярные механизмы модуляции ПС и интеграцию двух состояний сна (МВС и ПС) в суточном цикле явились данные о возрастании уровня экспрессии гена Hspa1 в стволе головного мозга в условиях естественной повышенной представленности ПС [36]. Кроме того, ПС-индуцирующий эффект соединения U133 может быть опосредован модулирующим влиянием шаперона Hsp70 на нейромедиаторные процессы и внутриклеточные сигнальные каскады. Ранее показано, что экзогенный Hsp70 может модулировать МВС через ГАМК- и аденозин-связанные механизмы в преоптической области гипоталамуса [18, 37]. Модулирующая функция Hsp70 может осуществляться посредством взаимодействия шаперона с синаптическими белками и синтезирующими системами нейромедиаторов, в частности с GAD67, ферментом синтеза ГАМК [38]. При обсуждении механизмов действия U133 на ПС нельзя исключить и вклад других генов транскрипционной сети, которую HSF1 координирует. Среди них гены ко-шаперона hsp40 и подмножество генов, кодирующих SNARE и SNARE-ассоциированные белки (Vamp2, Syt1 и Snap25), и ген, кодирующий субъединицу α4 рецептора ГАМКА, что может оказать влияние на высвобождение нейротрансмиттеров и привести к синаптической модификации ГАМК сигнала в структурах головного мозга, вовлеченных в механизмы регуляции ПС [39–42].
Несмотря на выраженное влияние соединения U133 на показатели ПС, явных изменений в архитектуре МВС нами не выявлено, что отличает действие индуктора шаперонов от сомногенных эффектов экзогенного белка Hsp70 (увеличение представленности МВС и уменьшение времени ПС), наблюдаемых при его введении в 3-й желудочек мозга [43]. Расхождение эффектов может быть обусловлено разницей в механизмах действия экзогенного и эндогенного Hsp70 или U133 индуцированной транскрипционной активностью фактора теплового шока HSF1.
Несмотря на то, что ПС влияет на память различной модальности [34, 35], нам не удалось выявить эффекта индуктора шаперонов U133 на пространственную рабочую память крыс в естественных физиологических условиях. В большинстве работ [22, 23, 44] описанные позитивные эффекты Нsp70 затрагивали в большей мере механизмы консолидации памяти, то есть упрочения уже сформированного следа памяти, или процесса перехода кратковременной памяти в долговременную. В тесте спонтанных чередований в Y-образном лабиринте для выполнения задачи животные задействовали в своем поведенческом репертуаре рабочую память, где требовалось на очень короткий период времени (как правило, не более минуты) сформировать энграмму, и при последующей смене события (рукава лабиринта) “стереть” ее и заменить новой. Иными словами, в основе памяти, оцениваемой в нашем тесте, по сравнению с представленными выше работами лежали принципиально другие нейрофизиологические механизмы, в которых не обнаруживается участие исследуемого соединения U133. С другой стороны, отсутствие эффекта на память может еще объяснятся и тем, что в дизайне нашего эксперимента отсутствовали какие-либо патологические нарушения памяти у животных, требующие коррекции или восстановления с помощью U133. Очевидным является то, что обнаружить какие-либо улучшения памяти в нормальных физиологических условиях с помощью фармакологических манипуляций значительно сложнее, чем при патологии. Исходя из этого, можно полагать, что соединение U133 может оказаться эффективным средством для коррекции нарушений памяти при различных видах неврологических патологий (болезнь Альцгеймера, болезнь Паркинсона, инсульт и др.), что по своей природе является оптимальным условием для проявления защитных свойств Hsp70-индуцирующей активности соединения U133. В качестве примера стоит привести данные о корректирующем влиянии фармакотерапии с индуктором Hsp70 куркумином на показатели рабочей и референтной памяти (в тестах Y-образный лабиринт и лабиринт Моpриса соответственно) в модели болезни Альцгеймера у крыс [25]. При этом авторы не выявили влияние одноразового введения препарата на референтную память в нормальных физиологических условиях. Эти данные сходны с результатом нашего эксперимента, проводимого по протоколу острого опыта, тем самым представляют еще один аргумент для объяснения отсутствия эффекта.
Таким образом, полученные данные демонстрируют, что индуктор шаперонов U133 влияет на архитектуру сна, увеличивая количество ПС, и не оказывает влияния на пространственную рабочую память у крыс в естественных физиологических условиях. При этом ПС-индуцирующий эффект соединения U133 был сопряжен с повышением содержания шаперона Hsp70 в структурах головного мозга, участвующих в регуляции сна. Это свидетельствует о том, что действие соединения U133 на ПС опосредуется через повышение экспрессии шаперонов в головном мозге.
Соединение U133 может быть рекомендовано для дальнейшего исследования спектра биологической активности с целью прогнозирования его терапевтической эффективности при различных патологиях ЦНС и старении, когда нарушается сон и уменьшается экспрессия шаперонов в головном мозге.
Работа выполнена в рамках государственного задания (тема № АААА-А18-118012290427-7).
ВКЛАД АВТОРОВ
Идея и методология работы (И.В.Е.), проведение экспериментов на животных (Н.С.К, М.Б.П., М.В.Ч.), синтез соединения U133 (С.Г.П.), анализ данных (Н.С.К, М.Б.П., М.В.Ч., Ю.Ф.П., И.В.Е.,), подготовка чернового варианта рукописи (Н.С.К, М.Б.П., М.В.Ч.), написание и редактирование рукописи (И.В.Е., Ю.Ф.П.).
Список литературы
Mostert S, Petzer A, Petzer JP (2016) Evaluation of natural and ynthetic 1,4-naphthoquinones as inhibitors of monoamine oxidase. Chem Biol Drug Des 87: 737–746. https://doi.org/10.1111/cbdd.12708
Aminin D, Polonik S (2020) 1,4-Naphthoquinones: some biological properties and application. Chem Pharm Bull 68: 46–57. https://doi.org/10.1248/cpb.c19-00911
Sabutski YE, Menchinskaya ES, Shevchenko LS, Chingizova EA, Chingizov AR, Popov RS, Denisenko VA, Mikhailov V V., Aminin DL, Polonik SG (2020) Synthesis and evaluation of antimicrobial and cytotoxic activity of oxathiine-fused quinone-thioglucoside conjugates of substituted 1,4-Naphthoquinones. Molecules 25: 3577. https://doi.org/10.3390/molecules25163577
Menchinskaya E, Chingizova E, Pislyagin E, Likhatskaya G, Sabutski Y, Pelageev D, Polonik S, Aminin D (2021) Neuroprotective effect of 1,4-Naphthoquinones in an in vitro model of paraquat and 6-OHDA-induced neurotoxicity. Int J Mol Sci 22: 9933. https://doi.org/10.3390/ijms22189933
Мищенко НП, Федореев СА (2003) Новый оригинальный отечественный препарат гистохром®. Хим-фармацевт журн 37: 49–53 [Mishchenko NP, Fedoreev SA (2003) Novyj original’nyj otechestvennyj preparat gistohrom ® . Him-farmacevt zhurn 37: 49–53. (In Russ)].
горов ГБ, Алехина ВА (1999) Новый биоантиоксидант гистохром в клинике глазных болезней. Вестн офтальмологии 115: 34–35 [Egorov GB, Alyokhina (1999) A new bioantioxidant histochrome in the clinic of eye diseases. Bulletin of Ophthalmology 115: 34–35. (In Russ)]
Cакирова АН, Иванова МВ (1997) Фармакокинетика и клиническая эффективность гистохрома у больных острым инфарктом миокарда. Эксперим и клин фармакол 60: 21–24 [Sakirova AN, Ivanova MV (1997) Pharmacokinetics and clinical efficacy of histochrome in patients with acute myocardial infarction. Experim and klin pharmacol 60: 21–24. (In Russ)].
Лебедев АВ, Левицкая ЕЛ (2001) Антиоксидантные свойства, автоокисление и мутагенная активность yхинохрома А в сравнении с его yстерифицированным аналогом. БИОХИМИЯ 66: 1089–1098 [Lebedev AV, Levitskaya EL (2001) Antioxidant properties, autooxidation and mutagenic activity of ukhinochrome A in comparison with its esterified analog. BIOCHEMISTRY 66: 1089–1098. (In Russ)].
Lebedev A V, Ivanova M V, Levitsky DO (2005) Echinochrome, a naturally occurring iron chelator and free radical scavenger in artificial and natural membrane systems. Life Sci 76: 863–875. https://doi.org/10.1016/j.lfs.2004.10.007
Yurchenko AE (2015) Hsp70 induction and anticancer activity of U-133, the acetylated trisglucosydic derivative of echinochrome. Med Chem (Los Angeles) 5: 263–271. https://doi.org/10.4172/2161-0444.1000274
Lazarev VF, Nikotina AD, Mikhaylova ER, Nudler E, Polonik SG, Guzhova I V, Margulis BA (2016) Hsp70 chaperone rescues C6 rat glioblastoma cells from oxidative stress by sequestration of aggregating GAPDH. Biochem Biophys Res Commun 470: 766–771. https://doi.org/10.1016/j.bbrc.2015.12.076
Ekimova IV, Plaksina DV., Pastukhov YF, Lapshina KV, Lazarev VF, Mikhaylova ER, Polonik SG, Pani B, Margulis BA, Guzhova IV., Nudler E (2018) New HSF1 inducer as a therapeutic agent in a rodent model of Parkinson’s disease. Exp Neurol 306: 199–208. https://doi.org/10.1016/j.expneurol.2018.04.012
Guzhova IV, Lazarev VF, Kaznacheeva AV, Ippolitova MV, Muronetz VI, Kinev AV, Margulis BA (2011) Novel mechanism of Hsp70 chaperone-mediated prevention of polyglutamine aggregates in a cellular model of huntington disease. Hum Mol Genet 20: 3953–3963. https://doi.org/10.1093/hmg/ddr314
Belan DV, Polonik SG, Ekimova IV (2021) Assessment of the efficacy of preventive therapy with chaperone inducer U133 in a model of the preclinical stage of Parkinson’s disease in elderly rats. Neurosci Behav Physiol 51: 673–680. https://doi.org/10.1007/s11055-021-01120-3
Klaips CL, Jayaraj GG, Hartl FU (2018) Pathways of cellular proteostasis in aging and disease. J Cell Biol 217: 51–63. https://doi.org/10.1083/jcb.201709072
Пастухов ЮФ, Худик КА, Екимова ИВ (2010) Шапероны в регуляции и восстановлении физиологических функций. Рос физиол журн им ИМ Сеченова 96(7): 708-25 [Pastukhov IuF, Khudik KA, Ekimova IV (2010) Chaperones in regulation and restoration of physiological functions. Ross Fiziol Zh Im I M Sechenova. 96(7): 708–725. (In Russ)].
Zatsepina OG, Evgen’ev MB, Garbuz DG (2021) Role of a heat shock transcription factor and the major heat shock protein Hsp70 in memory formation and neuroprotection. Cells 10: 1638. https://doi.org/10.3390/cells10071638
Ekimova IV (2013) Somnogenic effect of exogenous heat shock protein 70 kDa is mediated by GABA(A) receptors in the preoptic area of the hypothalamus. Dokl Biol Sci 449: 89–92. https://doi.org/10.1134/S0012496613020130
Pastukhov IF, Simonova VV, Guzeev MA, Meshalkina DA, Guzhova IV, Ekimova IV (2015) Chaperone Hsp70 is involved in the molecular mechanisms of slow wave sleep regulation. Dokl Biochem Biophys 461: 76–79. https://doi.org/10.1134/S1607672915020040
Pastukhov YF, Simonova VV, Shemyakova TS, Guzeev MA, Polonik SG, Ekimova IV (2020) U-133, a chaperone inducer, eliminates sleep disturbances in a model of the preclinical stage of Parkinson’s disease in aged rats. Adv Gerontol 10: 254–259. https://doi.org/10.1134/S2079057020030133
Ekimova IV, Pazi MB, Belan DV, Polonik SG, Pastukhov YF (2021) The chaperone inducer U133 eliminates anhedonia and prevents neurodegeneration in monoaminergic emotiogenic brain structures in a preclinical model of Parkinson’s disease in aged rats. J Evol Biochem Physiol 57: 1130–1141. https://doi.org/10.1134/S0022093021050148
Porto RR, Dutra FD, Crestani AP, Holsinger RMD, Quillfeldt JA, Homem de Bittencourt PI, de Oliveira Alvares L (2018) HSP70 facilitates memory consolidation of fear conditioning through MAPK pathway in the hippocampus. Neuroscience 375: 108–118. https://doi.org/10.1016/j.neuroscience.2018.01.028
Hooper PL, Durham HD, Török Z, Hooper PL, Crul T, Vígh L (2016) The central role of heat shock factor 1 in synaptic fidelity and memory consolidation. Cell Stress Chaperones 21: 745–753. https://doi.org/10.1007/s12192-016-0709-1
Teiten M-H, Reuter S, Schmucker S, Dicato M, Diederich M (2009) Induction of heat shock response by curcumin in human leukemia cells. Cancer Lett 279: 145–154. https://doi.org/10.1016/j.canlet.2009.01.031
Zhang L, Fang Y, Xu Y, Lian Y, Xie N, Wu T, Zhang H, Sun L, Zhang R, Wang Z (2015) Curcumin improves amyloid β-peptide (1–42) Induced spatial memory deficits through BDNF-ERK signaling pathway. PLoS One 10: e0131525. https://doi.org/10.1371/journal.pone.0131525
Полоник С, Толкач А, Уварова Н (1994) Гликозилирование эхинохрома и родственных гидроксинафтазаринов ортоэфирным методом. Журн. орган. химии. 30(2): 248–253. [Polonik S, Tolkach A, Uvarova N (2004) Glycosylation of echinochrome and related hydroxynaphthazarines by the orthoester method. Zhurn. organ. himii. 30(2): 248–253. (In Russ)].
Mishchenko NP, Fedoreev SA, Bagirova VL (2003) Histochrome: a new original domestic drug. Pharm Chem J 37: 48–52. https://doi.org/https://doi.org/10.1023/A:1023659331010
Hidaka N, Suemaru K, Takechi K, Li B, Araki H (2011) Inhibitory effects of valproate on impairment of Y-maze alternation behavior induced by repeated electroconvulsive seizures and c-Fos protein levels in rat brains. Acta Med Okayama 65: 269–277. https://doi.org/10.18926/AMO/46853
Rothhaas R, Chung S (2021) Role of the preoptic area in sleep and thermoregulation. Front Neurosci 15: 664781. https://doi.org/10.3389/fnins.2021.664781
Van Egroo M, Koshmanova E, Vandewalle G, Jacobs HIL (2022) Importance of the locus coeruleus-norepinephrine system in sleep-wake regulation: Implications for aging and Alzheimer’s disease. Sleep Med Rev 62: 101592. https://doi.org/10.1016/j.smrv.2022.101592
Oishi Y, Lazarus M (2017) The control of sleep and wakefulness by mesolimbic dopamine systems. Neurosci Res 118: 66–73. https://doi.org/10.1016/j.neures.2017.04.008
Mather M, Harley CW (2016) The locus coeruleus: essential for maintaining cognitive function and the aging brain. Trends Cogn Sci 20: 214–226. https://doi.org/10.1016/j.tics.2016.01.001
D’Ardenne K, Eshel N, Luka J, Lenartowicz A, Nystrom LE, Cohen JD (2012) Role of prefrontal cortex and the midbrain dopamine system in working memory updating. Proc Natl Acad Sci 109: 19900–19909. https://doi.org/10.1073/pnas.1116727109
McCoy JG, Strecker RE (2011). The cognitive cost of sleep lost. Neurobiology of learning and memory 6(4): 564–582. https://doi.org/10.1016/j.nlm.2011.07.004
Krause AJ, Simon EB, Mander BA, Greer SM, Saletin JM, Goldstein-Piekarski AN, Walker MP (2017) The sleep-deprived human brain. Nat Rev Neurosci. 18(7): 404–418. https://doi.org/10.1038/nrn.2017.55
Simonova VV, Guzeev MA, Ekimova IV, Pastukhov YF (2022) Chaperone Hsp70 (HSPA1) is involved in the molecular mechanisms of sleep cycle integration. Int J Mol Sci 23: 4464. https://doi.org/10.3390/ijms23084464
Ekimova IV, Pastukhov YF (2014) The role of adenosine A2A receptors of the preoptic area in somnogenic activity of 70 kDa protein in pigeons. J Evol Biochem Physiol 50: 492–499. https://doi.org/10.1134/S0022093014060039
Ekimova IV, Nitsinskaya LE, Romanova IV, Pastukhov YF, Margulis BA, Guzhova IV (2010) Exogenous protein Hsp70/Hsc70 can penetrate into brain structures and attenuate the severity of chemically-induced seizures. J Neurochem 115: 1035–1044. https://doi.org/10.1111/j.1471-4159.2010.06989.x
Mendillo ML, Santagata S, Koeva M, Bell GW, Hu R, Tamimi RM, Fraenkel E, Ince TA, Whitesell L, Lindquist S (2012) HSF1 drives a transcriptional program distinct from heat shock to support highly malignant human cancers. Cell 150: 549–562. https://doi.org/10.1016/j.cell.2012.06.031
Varodayan FP, Pignataro L, Harrison NL (2011) Alcohol induces synaptotagmin 1 expression in neurons via activation of heat shock factor 1. Neuroscience 193: 63–71. https://doi.org/10.1016/j.neuroscience.2011.07.035
Varodayan F (2013) HSF1 transcriptional activity mediates alcohol induction of Vamp2 expression and GABA release. Front Integr Neurosci 7: 89. https://doi.org/10.3389/fnint.2013.00089
Pignataro L, Miller AN, Ma L, Midha S, Protiva P, Herrera DG, Harrison NL (2007) Alcohol regulates gene expression in neurons via activation of heat shock factor 1. J Neurosci 27: 12957–12966. https://doi.org/10.1523/JNEUROSCI.4142-07.2007
Pastukhov YF, Ekimova IV, Khudik KA, Guzhova IV (2008) Protein 70 kDa in the control of sleep and thermoregulation. J Evol Biochem Physiol 44: 74–81. https://doi.org/10.1134/S002209300801009X
Beck CD, Rankin CH (1995) Heat shock disrupts long-term memory consolidation in Caenorhabditis elegans. Learn Mem 2: 161–177. https://doi.org/10.1101/lm.2.3-4.161
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


