Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 8, стр. 997-1014
Исследование нейродегенеративных изменений в структурной и ультраструктурной организации пириформной коры у трансгенных мышей линии 5XFAD
Н. Л. Туманова 1, Д. С. Васильев 1, *, Н. М. Дубровская 1, Н. Н. Наливаева 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: dvasilyev@bk.ru
Поступила в редакцию 17.06.2022
После доработки 20.07.2022
Принята к публикации 20.07.2022
- EDN: CFHFSE
- DOI: 10.31857/S086981392208009X
Аннотация
Анализ патологических изменений структурно-функциональной организации пириформной коры у мышей линии 5xFAD, моделирующих патогенез болезни Альцгеймера, показал, что в возрасте 7 мес. в ней имеет место повышенная агрегация β-амилоидного пептида, гибель нейронов, распад миелиновых оболочек нервных волокон, агглютинация синаптических пузырьков в синаптических окончаниях и появление большого количества аутофаголизосом в телах и отростках нейронов. Также в пириформной коре таких животных обнаружены очаги глиоза и почти трехкратное повышение содержания глиального маркерного белка GFAP по сравнению с животными дикого типа. Все эти нарушения имели более выраженный характер по сравнению с исследованной нами ранее энторинальной корой 5xFAD мышей. Между пириформной и энторинальной областями также выявлено различие в распределении амилоид-деградирующей металлопептидазы неприлизина (НЕП). В пириформной коре этот фермент содержится, в основном, в межклеточном пространстве, а в энторинальной коре – в телах клеток, при этом у 5xFAD мышей число НЕП-позитивных клеток на 60% ниже, чем у мышей дикого типа. У 5xFAD мышей также наблюдалось значительное ухудшение обонятельной функции, которое выражалось почти в двукратном снижении результативности поиска пищи по запаху по сравнению с мышами дикого типа. Полученные данные свидетельствуют о существенных патологических изменениях в пириформной и энторинальной коре у 5xFAD мышей, вызванных накоплением амилоида, что может являться причиной ухудшения их обоняния и сходным образом обуславливать нарушение обонятельной функции при развитии болезни Альцгеймера.
Трансгенные мыши линии 5xFAD являются одной из широко используемых моделей для получения информации о структурных и молекулярных изменениях в нервной ткани, а также поведенческих нарушениях, вызванных накоплением амилоидного Аβ пептида, характерным для патогенеза болезни Альцгеймера (БА) [1]. Нарушения метаболизма Аβ, вызванные его ускоренной продукцией и образованием амилоидных агрегатов, приводят к дегенерации и гибели нейронов, синаптопатии и нейровоспалительным процессам. От степени накопления в нервной ткани мозга мышей амилоидных агрегатов зависит уровень нарушений нейрональных функций и пластичности мозга, а также активации микроглии [2]. По литературным данным у 5xFAD мышей уже на 3-м месяце жизни одновременно с образованием амилоидных бляшек начинает развиваться астроглиоз и микроглиоз [1]. При развитии амилоидогенеза гибель нейронов у мышей линии 5xFAD наблюдается во многих отделах мозга. Так, в субикулуме и в V кортикальном слое новой коры гибель нейронов начинается примерно в 6-месячном возрасте [3]. В этом же возрасте наблюдается уменьшение количества холинэргических нейронов в базальной части переднего мозга [4]. Синаптическая дегенерация начинается в мозге в 4-месячном возрасте [5], а к 12 месяцам в гиппокампе исчезает около 50% аксошипиковых синапсов [6]. При этом наблюдаемые когнитивные нарушения коррелируют с нарушением кратковременной и долговременной памяти [7], а изменения на молекулярном уровне начинаются задолго до формирования функциональных нарушений [8].
Поскольку деструктивные изменения ткани мозга при БА связаны с ранним нарушением обоняния [9], изучение обонятельной функции при развитии амилоидоза у 5xFAD мышей представляет особый интерес. Имеющиеся литературные данные свидетельствуют о том, что в процессе развития патологии у этих мышей происходит дегенерация терминальных окончаний волокон обонятельного нерва, связанных с накоплением в них Аβ [10]. Имеются также данные о нарушении у 5xFAD мышей экспрессии генов обонятельных рецепторов Olfr110/111 и Olfr544 в коре и гиппокампе [11]. Все это свидетельствует о необходимости сопоставления патологических изменений в периферической и центральной частях обонятельного анализатора при развитии амилоидогенеза у трансгенных мышей. Ранее у 5xFAD мышей нами проводилось исследование энторинальной коры и гиппокампа, входящих в состав центрального обонятельного анализатора, которое показало существенные нарушения структурной организации этих структур мозга [12]. Пириформная область коры головного мозга также является одним из центров обработки информации обонятельного анализатора млекопитающих и получает прямые проекции из обонятельных луковиц, однако данные об изменении ее структуры при развитии патогенеза у 5xFAD мышей отсутствуют, что и послужило целью данного исследования.
Накопление Аβ в ткани мозга тесно связано со снижением в нем содержания и активности амилоид-деградирующего фермента неприлизина (НЕП) [13, 14]. Как было показано в наших исследованиях, снижение экспрессии НЕП в энторинальной коре и гиппокампе, как на уровне РНК, так и на уровне белка, коррелирует с нарушением обоняния и когнитивных функций у крыс и мышей [15–17]. В нашем предыдущем исследовании было показано, что снижение экспрессии НЕП также коррелирует с накоплением амилоидных отложений и когнитивным дефицитом у 5xFAD мышей [18].
Целью данного исследования являлся сравнительный анализ структурных и ультраструктурных изменений в пириформной коре (центральный отдел) и обонятельных луковицах (периферический отдел обонятельного анализатора), содержания глиального фибриллярного кислого белка (GFAP), распределения нейропептидазы НЕП, а также обонятельного поведения у трансгенных мышей линии 5xFAD и мышей дикого типа.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные. В работе использовали самцов мышей линий С57BL (С57BL/6 – дикий тип) и 5xFAD (линия трансгенных мышей Tg(APPSwFlLon, PSEN1 × × M146L × L286V)6799Vas/J, поддерживаемая на генетическом фоне C57BL/6 в гемизиготном по трансгенной кассете состоянии) – модель патологии болезни Альцгеймера) в возрасте 7 месяцев из питомника “Черноголовка”, Россия. Животных содержали в стандартных условиях вивария Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН при световом режиме (12 ч день/12 ч ночь) по 4–5 особей в клетке, со свободным доступом к воде и пище. Эксперименты осуществляли согласно протоколу использования лабораторных животных Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН, основанному на директиве Европейского Сообщества по гуманному обращению с экспериментальными животными (European Communities Council Directive #86⁄609 for the Care of Laboratory Animals).
Световая микроскопия. Светооптическое исследование ткани мозга проводили на мышах дикого типа (n = 8) и линии 5хFAD (n = 8). Ткань мозга фиксировали методом транскардиальной перфузии 10%-ным нейтральным формалином на фосфатном буфере (PBS, 4°C, pH 7.4). Замороженные фронтальные срезы мозга толщиной 20 мкм изготавливали на криостате Leica CM 1510S (Leica Microsystems, Германия). Для исследования отбирали срезы обонятельной луковицы (4.0–2.5 мм от bregma) и пириформной коры мозга (2.0–3.0 мм от bregma в каудальном направлении) [19] (рис. 1a, b) и проводили комбинированное окрашивание по методу Ниссля и красителем Конго красным (4%-ный водный раствор). С использованием микроскопа ImagerA (Zeiss, Германия) оценивали состояние нервной ткани мозга. Количественное сравнение клеток пириформной коры проводили на серии срезов толщиной 20 мкм; первый срез серии выбирался случайно, расстояние между последующими срезами в серии составляло 40 мкм. При проведении анализа использовали программу Video Test Master-Morphology (Video Test, Санкт-Петербург, Россия). По срезам (6 на каждое животное), содержащим пириформную кору, вычисляли средние величины общего количества клеток и количества нейронов (на участке ткани площадью 10 000 мкм2) для каждого животного (С57Bl, n = 8; 5хFAD, n = 8).
Рис. 1.
(a) – cхема основных путей передачи сигнала в отделах обонятельного анализатора мыши. Контуром показана вентральная поверхность головного мозга. Обозначения: ОЕ – обонятельный эпителий в носовой полости, ОВ – обонятельная луковица, РС – пириформная кора, ЕС – энторинальная кора, Hippocampus – гиппокамп, Thalamus – таламические ядра, А – миндалина. Бирюзовым цветом выделены отделы мозга, изученные нами ранее [12], желтым – отделы мозга, описываемые в настоящей работе. (b–c) – схемы расположения исследуемых областей пириформной коры (b) и обонятельной луковицы (c). Области интереса выделены желтым цветом.

Электронная микроскопия. Для анализа мозг мышей (дикий тип n = 5, 5хFAD n = 4) фиксировали методом транскардиальной перфузии смесью 1%-ного глутарового альдегида и 1%-ного формальдегида на 0.1 M PBS, рН 7.4. Блоки, содержащие обонятельную луковицу и пириформную кору, дополнительно фиксировали 1%-ным OsO4, контрастировали уранилацетатом, обезвоживали и заливали в аралдит по стандартному протоколу [20]. На ультратоме Leica (Leica Microsystems, Германия) изготавливали срезы исследуемых структур толщиной 500Å, которые затем исследовали на электронном микроскопе FEI Tecnai V2 (FEI, США).
Иммуноблотинг. Ткань пириформной коры мышей дикого типа (n = 4) и линии 5хFAD (n = 4) гомогенизировали в 50 мM Tris-HCl буфере (pH 7.4), центрифугировали (5 мин при 2500 g и 4°C) и отбирали супернатант. Осадок ресуспендировали и контролировали отсутствие в нем белка интереса. Анализ содержания глиального фибриллярного кислого белка (GFAP) проводили методом иммуноблотинга. Содержание белка в пробах определяли методом Брэдфорда. Анализируемые образцы загружали в лунки SDS-полиакриламидного геля (8%) из расчета 25 мкг белка на лунку, проводили электрофорез белков, после чего переносили их на PVDF мембрану. Мембраны блокировали 5%-ным раствором сухого молока в 0.1% Tween2/PBS и инкубировали с антителами: к GFAP (антитела ab7260 производства Abcam, разведение 1 : 1000), или к β-актину (А5060 производства Sigma, 1 : 10 000). Визуализацию осуществляли с помощью HRP-конъюгированных вторичных антител против IgG кролика (Abcam, разведение 1 : 4000), используя Optiblot ECL Ultra Detect Kit (1.2pg–2ng) (Abcam, ab133409). Рассчитывали соотношение оптический плотности полосы GFAP к плотности полосы β-актина.
Иммуногистохимия. Для исследования отбирали срезы пириформной и энторинальной областей коры (рис. 1a, b) на уровне 2.0–3.3 мм от bregma [19] у животных дикого типа (n = 8) и линии 5хFAD (n = 8). Обработка материала осуществлялась как описано ранее [12]. Мозг фиксировали методом транскардиальной перфузии раствором 10%-ного нейтрального формалина на 0.1 М фосфатном буфере (рН 7.4). На криостате Leica CM 1510S (Leica Microsystems, Германия) изготавливали фронтальные срезы мозга толщиной 15 мкм. Для снижения автофлуоресценции срезы инкубировали в 0.1 М растворе глицина (SIGMA, Германия) на 0.1 М фосфатном буфере (рН 7.4). Проводили визуальный контроль до максимального ослабления свечения в диапазоне длин волн 490–550 нм. Блокировку неспецифического связывания антител осуществляли путем инкубации в 2%-ном растворе бычьего сывороточного альбумина (Sigma, Германия) на 0.1 М фосфатном буфере (рН 7.4). В блокировочный раствор добавляли 0.01% Triton X-100 для пермеабилизации клеточных мембран. Иммунохимическое мечение НЕП проводили с помощью поликлональных антител кролика Anti-CD10 (EPR5904, ab126593, Abcam, Великобритания, разведение 1 : 100), визуализацию которых осуществляли с помощью FITC-конъюгированных вторичных антител (ab96902, Abcam, Великобритания, разведение 1 : 500). В качестве негативного контроля неспецифического связывания ставили иммунохимическую реакцию в отсутствие первичных антител для каждого животного. В качестве позитивного контроля использовали ткань печени, характеризующейся высоким содержанием НЕП, взятой у мыши дикого типа. Исследование выполняли на микроскопе Leica DMR, оборудованном конфокальным сканером Leica TCS SL (Leica Microsystems, Германия). Возбуждение флуорохрома FITC осуществляли светом He/Ar лазера при длине волны 488 нм, свечение регистрировали в диапазоне 496–537 нм. Яркость свечения FITC на поле нервной ткани площадью 10 000 мкм2 оценивали при помощи программы Video Test Master-Morphology (Video Test, Санкт-Петербург, Россия). Для каждого животного вычисляли среднее значение по 5 срезам. Нормировку полученных значений для каждого животного осуществляли путем деления свечения каждой исследуемой области пириформной или энторинальной коры на среднее значение для негативного контроля (иммунохимическая реакция в отсутствие первичных антител, среднее по 4 срезам). Сравнивали средние нормированные значения уровня сигнала FITC для мышей дикого типа и линии 5хFAD, выраженные в % от уровня негативного контроля. В качестве дополнительного параметра для каждого среза вычисляли среднее количество НЕП-позитивных клеток (яркость свечения тел которых более чем в 3 раза превосходило яркость свечения окружающего межклеточного пространства) в случайно выбранном поле пириформной или энторинальной коры площадью 10 000 мкм2.
Тест результативности поиска пищи. В парадигме “поиск пищи” использовали модифицированную нами методику поиска корма [21]. Тестирование мышей (С57Bl, n = 10 и 5хFAD, n = 7) проводили в специальной камере площадью 100 × 100 см и непрозрачными стенками высотой 30 см. Камера обладала 16 отверстиями, равномерно распределенными в непрозрачном дне камеры. Отверстия диаметром 2 см и глубиной 4 см и нижняя поверхность камеры были заполнены деревянными опилками. Во время эксперимента в два отверстия закладывали по одному пищевому объекту с выраженным запахом (кусочки овсяного печенья диаметром 0.3 см). Кусочки корма находились под слоем опилок, ниже поверхности камеры на 0.5 см, и их расположение меняли при каждом новом тестировании животного. Перед тестированием мыши проходили 2-суточную 50%-ную пищевую депривацию. В ходе однократного ежедневного 15-минутного тестирования в течение 5 суток оценивали в баллах количество добытых кусочков корма (0, 1 или 2) и регистрировали время, затраченное на их нахождение. После нахождения второго кусочка корма тестирование прекращалось. Кроме того, за цикл тестирования подсчитывали общее число обнюхиваний всех отверстий в полу экспериментальной камеры и вычисляли индекс поисковой активности, как отношение суммарного числа обнюхиваний всех отверстий ко времени тестирования, выраженному в секундах. Полученное значение умножали на 100 и рассматривали его в качестве индекса, отражающего мотивацию поиска пищи у животных. Каждое животное в начале тестирования помещали в центр экспериментальной камеры. Перед каждым циклом тестирования поверхности камеры протирали 50%-ным раствором этилового спирта и меняли верхний слой опилок.
Статистическая обработка данных. Статистическую обработку полученных данных проводили с помощью пакета программ SPSS SigmaStat 3.0 или GraphPad Prism 9, используя однофакторную ANOVA (one-way ANOVA) или тест Крускала–Уолиса с последующим post hoc тестом Стьюдента–Ньюмана–Кеулса для поведенческих экспериментов. При проведении морфологических экспериментов парные сравнения групп проводили с помощью t-теста Стьюдента или U-теста Манна–Уитни. Для анализа значений с нормальным распределением использовались методы параметрической статистики. Значимыми считались различия при p ≤ 0.05. Все данные представлены как среднее ± ошибка среднего, кроме случаев, специально упомянутых в тесте.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Морфологическое исследование структур мозга мышей дикого типа и мышей линии 5xFAD
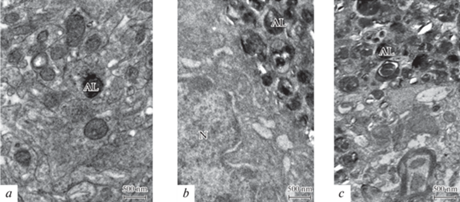
Обонятельные луковицы. С помощью электронномикроскопического исследования обонятельных луковиц у трансгенных мышей линии 5xFAD в отличие от мышей дикого типа отмечены существенные изменения в строении миелинизированных волокон разных диаметров, направляющихся в пириформную кору. На рис. 2d, e видны деструктивные изменения таких волокон: сужение осевого цилиндра, расслоение миелина, образование миелиновых карманов с выпяченными ламелями. Такие признаки разрушенных миелиновых волокон не обнаружены у мышей дикого типа (рис. 2c). Деструктивным изменениям подвержены и нейроны обонятельных луковиц у трансгенных мышей, особенно в очагах поражения, где отмечены скопления амилоидных образований (бляшек) как в слое митральных клеток, так и в волокнистых слоях (рис. 2a, b). На электроннограммах обонятельных луковиц трансгенных мышей, по сравнению с мышами дикого типа, обнаружены нейроны с признаками клеточной гибели: лизисом органелл в цитоплазме и признаками дегенерации по типу хроматолиза (рис. 2f–g). В обонятельных луковицах 5xFAD мышей часто встречаются нейроны с деструкцией ядерной и цитоплазматической мембран, с разрушением митохондрий и расширенными каналами эндоплазматического ретикулума, а также появляется большое количество глиальных клеток. В нейропиле обонятельных луковиц трансгенных мышей часто встречаются аутофаголизосомы различных форм и размеров (рис. 2a).
Рис. 2.
Структурная организация обонятельных луковиц у мышей дикого типа (a, c, f) и трансгенных мышей линии 5xFAD (b, d, e, g) в возрасте 7 мес. (a) – окраска по Нисслю, b – двойное окрашивание по Нисслю и Конго красным. (а–b) – масштаб 60 мкм. (c–g) – электроннограммы участков нейропиля с нейронами в обонятельной луковице. Обозначение: A – амилоидные образования (бляшки), D – дендриты, N – нейроны, M – митохондрии, ER – ЭПР, ML – миелиновые волокна.
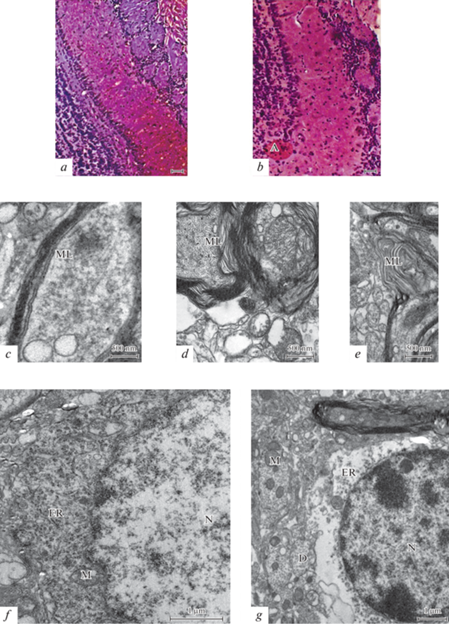
Пириформная кора. На препаратах с двойным окрашиванием (по Нисслю и Конго красным) в пириформной коре мышей линии 5xFAD, в отличие от мышей дикого типа, обнаружено большое количество амилоидных образований (бляшек) (рис. 3a, b). У трансгенных мышей количество амилоидных образований в пириформной коре, куда поступают афферентные волокна из обонятельных луковиц, намного больше, чем в гиппокампе и энторинальной коре [12]. Причем в волокнистых областях они наблюдаются чаще, чем в клеточных. На полученных электроннограммах пириформной коры трансгенных мышей линии 5xFAD, в отличие от мышей дикого типа того же возраста, ультраструктурная организация нервных волокон, направленных из обонятельных луковиц, резко отличается, заметен распад миелиновой оболочки с разрушением ламелей, их выпячиванием, образованием миелиновых карманов и сужением осевого цилиндра (рис. 3c, e). На этой стадии развития в пириформной коре трансгенных мышей отмечаются ультраструктурные изменения нейронов и их гибель. На рис. 3f, g показаны изменения ядерной оболочки нейронов. Она становится извитой, отходит от цитоплазмы нейрона и углубляется в ядро. В цитоплазме таких нейронов происходит расширение эндоплазматического ретикулума, появление крупных вакуолей. На рис. 3g изображен нейрон с нейрофиламентозной дегенерацией. В цитоплазме нейронов пириформной коры трансгенных мышей заметны многочисленные нейрофиламенты, которые занимают большой объем клетки. В цитоплазме таких нейронов увеличено число лизосом. В нейропиле пириформной коры трансгенных мышей обнаружено большое количество синаптических терминалей с агглютинацией синаптических пузырьков, хотя синаптические контакты сохранены (рис. 3h). Такие изменения могут приводить к нарушению выделения медиатора в синаптическом контакте окончания афферентов на нейронах пириформной коры.
Рис. 3.
Структура пириформной коры у мышей дикого типа (a, c, d) и трансгенных мышей линии 5xFAD (b, e, f, g, h) в возрасте 7 мес. (a) – окраска по Нисслю, (b) – двойное окрашивание по Нисслю и Конго красным. (a–b) – масштаб 50 мкм. (c–h) – электроннограммы участков нейропиля с нейронами в пириформной коре мышей. Обозначение: A – амилоидные образования (бляшки), N – нейроны, S – синаптические контакты, M – митохондрии, ER – ЭПР, ML – миелиновые волокна, NF – нейрофиламенты, L – лизосомы, SV – синаптические пузырьки.

В пириформной коре трансгенных мышей в отличие от мышей дикого типа обнаружены аутофаголизосомы. Часто они располагаются около нейронов и глиальных клеток (рис. 4b), либо в нейропиле пириформной коры (рис. 4c).
Содержание маркера астроглии GFAP
В ткани пириформной коры трансгенных животных выявлено значительно более высокое содержание GFAP, превышающее таковое у мышей дикого типа почти в три раза (283 ± 22% от показаний у мышей дикого типа, U = 17.1, p = 0.02) (рис. 5). Повышенное содержание глиального маркера GFAP может указывать на активацию астроглии в ткани пириформной коры мышей линии 5xFAD.
Рис. 5.
Исследование содержания астроцитарного маркера глиального фибриллярного кислого белка (GFAP) в ткани пириформной коры у мышей дикого типа (WT) и трансгенных мышей линии 5xFAD). (a) – пример иммунохимического окрашивания белка после электрофореза; (b) – количественный анализ содержания GFAP. * Статистически значимое различие между 5xFAD и мышами дикого типа (U-тест Манна–Уитни; p < 0.05; n = 4 в каждой группе). Данные представлены как среднее ± ошибка среднего и выражены в % от уровня контроля (принятого за 100%).

Иммуногистохимическое исследование распределения НЕП
Статистически значимых различий в интенсивности иммуногистохимического окрашивания НЕП в пириформной коре между мышами дикого типа и трансгенными животными линии 5хFAD выявлено не было (t-test, t = 1.25, p = 0.23, рис. 6g). Ранее нами также было показано отсутствие различий в содержании НЕП в обонятельных луковицах, а также снижение его содержания и экспрессии в энторинальной коре [12, 18]. В данном исследовании мы также наблюдали, что в энторинальной коре уровень иммунохимического окрашивания НЕП у мышей линии 5хFAD был выражен слабее, чем у мышей дикого типа (t-test, t = 3.53, p = 0.03, рис. 6h). Более того, сравнительный анализ распределения НЕП у мышей обеих линий в ткани пириформной и соседней энторинальной области коры выявил существенные различия. Так, в пириформной коре иммунопозтивный сигнал НЕП локализовался преимущественно в нейропиле, а тела клеток с повышенным свечением были единичны, при этом их количество не отличалось у мышей дикого типа и линии 5хFAD (Mann–Whitney U-test, U = 27.5, p = 0.66, рис. 6i). В то же время в соседней энторинальной области коры мышей дикого типа, помимо относительно равномерного окрашивания нейропиля, наблюдались многочисленные НЕП-позитивные тела пирамидных нейронов, а у мышей линии 5хFAD таких нейронов было заметно меньше, и их количество составляло 38.6 ± 5.9% от уровня контроля (U-тест Манна–Уитни U = 3.5, p = 0.001). Таким образом, нами выявлено различие в характере распределения НЕП в пириформной и энторинальной областях коры, а также снижение количества НЕП-позитивных нейронов в энторинальной коре у 5хFAD мышей.
Рис. 6.
Распределение металлопептидазы неприлизин (НЕП) (FITC-позитивный сигнал зеленого цвета) в пириформной (Pyr. cx., a–c) и энторинальной коре (Ent. cx., d–f) у 7-месячных мышей дикого типа (b, e) и мышей линии 5хFAD (c, f). (a, d) – негативный контроль иммуногистохимического окрашивания ткани мозга мыши дикого типа (в отсутствие первичных антител к НЕП иммунохимическая реакция не наблюдается). Масштабные отрезки: 60 мкм. (g, h) – результаты денситометрического анализа яркости свечения FITC-позитивных структур в ткани пириформной (Pyr. cx. g) и энторинальной коры (Ent. cx. h) мышей дикого типа (синие точки, n = 8) и мышей линии 5XFAD (красные точки, n = 8); данные представлены в виде среднего значения и его ошибки в % от уровня среднего значения свечения FITC в ткани негативного контроля; различия между группами животных достоверны при * p < 0.05 (t-test). (i, j) – результаты морфометрического анализа количества НЕП-позитивных клеток (тела клеток с яркостью свечения более 300% от яркости окружающего межклеточного пространства) в ткани пириформной (Pyr. cx. i) и энторинальной коры (Ent. cx. j) мышей дикого типа (синие точки, n = 8) и мышей линии 5XFAD (красные точки, n = 8); данные представлены в виде среднего количества клеток на поле площадью 10 000 мкм2. Различия между группами животных достоверны при **p < 0.01 (U-тест Манна–Уитни).

Анализ обонятельного поведения
Сравнительный анализ результативности поиска пищи у мышей линии 5xFAD и дикого типа показал, что трансгенные мыши были менее успешны в поиске пищи и в среднем набирали в два раза меньше баллов, чем их сверстники дикого типа (t = 41.5, р = 0.04, рис. 7a). Более детальный анализ полученных данных показал, что соотношение трансгенных мышей, выполнявших безуспешный, 50%- или 100%-ный поиск, было равномерным (рис. 7b). Мыши дикого типа чаще (H = 17.762, р = 0.003, тест Крускала–Уолиса с пост-хок анализом Стьюдента–Ньюмана–Кеулса р < 0.05) демонстрировали 100%-ный поиск, в то время как безуспешный поиск у них наблюдался достаточно редко (H = 17.762, р = 0.003, тест Крускала–Уолиса с пост-хок анализом Стьюдента–Ньюмана–Кеулса р < 0.05). При сопоставлении (H = 17.762, р = 0.003, тест Крускала–Уолиса) со сверстниками дикого типа трансгенные мыши в 7.6 раз чаще (р < 0.05, пост-хок анализ Стьюдента–Ньюмана–Кеулса) демонстрировали безуспешный поиск с нулевым результатом и в 2 раза реже (р < 0.05, пост-хок анализ Стьюдента–Ньюмана–Кеулса) находили оба куска пищи (рис. 7b).
Рис. 7.
Сравнительный анализ эффективности поиска пищи у мышей С57Bl и 5хFAD. (a) – ось ординат: усредненная по группам результативность поиска пищи в баллах. * р <0.05 – различия между С57Bl и 5хFAD группами мышей, t-тест. (b) – ось ординат: доля мышей (%), достигших определенного результата (0, 1 или 2) в поиске пищи от общего количества мышей в каждой группе, принятого за 100%. Ось абсцисс: результат поиска пищи в баллах. # р < 0.05 – внутригрупповые различия и * р < 0.05 – межгрупповые различия, тест Крускала–Уолиса Н = 17.8, р = 0.03 с пост-хок анализом Стьюдента–Ньюмана–Келюса. (c) – ось ординат: индекс поисковой активности. Ось абсцисс: номер цикла тестирования. * р = 0.01 – межгрупповые различия, t-тест. (d) – ось ординат: число обнюхиваний отверстий за цикл тестирования. Ось абсцисс: номер цикла тестирования. # р < 0.05 – внутригрупповые различия, One Way ANOVA F4.47 = 6.97, р < 0.001 с пост-хок анализом Стьюдента–Ньюмана–Кеулса. (e) – ось ординат: продолжительность поиска корма за цикл тестирования в секундах. Ось абсцисс: номер цикла тестирования. * р = 0.036 – межгрупповые различия, тест Манна–Уитни; # р < 0.05 – внутригрупповые различия между первым и пятым циклами тестирования, t-тест. Все данные представлены в виде среднего ± ошибка среднего.

По индексу поисковой активности трансгенные мыши не отличались от мышей дикого типа (Н = 15.40, р = 0.082, ANOVA on Ranks), за исключением первого дня тестирования, когда мотивация поиска у мышей дикого типа была существенно выше (t = 2.90, р = 0.010, рис. 7c).
В процессе тестирования с 1-х по 5-е сутки было обнаружено, что у мышей дикого типа наблюдается позитивная динамика выполнения поиска пищи: сокращалось число обнюхиваний отверстий до первого обнаружения корма (F4,47 = 6.97, р < 0.001, ANOVA) – начиная со второго дня тестирования этот параметр существенно снижался (р < 0.01, пост-хок анализ Стьюдента–Ньюмана–Кеулса, рис. 7e), а к пятому дню тестирования существенно сокращалась и продолжительность поиска корма (t = 3.34, р = 0.010, рис. 7e). В отличие от мышей дикого типа у трансгенных 5xFAD мышей позитивная динамика выполнения поиска пищи (по продолжительности поиска корма) не наблюдалась. К пятому дню тестирования продолжительность поиска у трансгенных мышей была в 1.8 раз больше, чем у мышей дикого типа (U = 85, р = 0.036, рис. 7e).
Сниженную результативность поиска пищи у мышей линии 5xFAD по сравнению с мышами дикого типа (линия C57Bl) можно интерпретировать как свидетельство нарушения обонятельной функции у этих животных.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Основной путь передачи сигнала в обонятельной системе млекопитающих (рис. 1a) начинается с сенсорных нейронов обонятельного эпителия, развивающегося из обонятельной плакоды во время эмбриогенеза. Аксоны первично-чувствующих нейронов формируют обонятельный нерв, который проецируется в обонятельную луковицу (OB; выпячивание из конечного мозга) и образует синапсы с апикальными дендритами митральных/пучковых клеток, давая начало гломерулам обонятельных луковиц. Первичные аксоны проекционных нейронов обонятельных луковиц (митральные и пучковые клетки), преимущественно иннервируют узкую область вентро-латеральной части конечного мозга, образуя латеральный обонятельный тракт (LOT), прилегающий к пиальной поверхности мозга [22]. Аксоны LOT дают коллатеральные ответвления в обонятельных областях коры, в том числе в пириформной и энторинальной областях (рис. 1a), имеющих тесные функциональные связи с таламическими ядрами (пириформная кора), гиппокампальной формацией и миндалиной (энторинальная кора).
При морфофункциональном исследовании разных отделов обонятельного анализатора периферического отдела (обонятельных луковиц) и центральных отделов – гиппокампа, энторинальной и пириформной областей коры у 7-месячных трансгенных мышей линии 5xFAD обнаружены амилоидоз и аутофаголизосомы в нервной ткани. При электронномикроскопическом исследовании пириформной коры, получающей прямые обонятельные проекции волокон от обонятельных луковиц, выявлено, что наблюдаемые изменения более выражены по сравнению с энторинальной корой. Это проявляется в виде амилоидоза с интенсивным накоплением Аβ и гибелью нейронов, нейрофиламентозной дегенерации, деструкции миелиновой оболочки волокон, поражении синаптических окончаний, связанным с аггллютинацией синаптических пузырьков. Последнее может приводить к нарушению выделения нейромедиаторов в области синаптических контактов афферентных волокон на нейронах пириформной коры.
Обнаруженное нами повышение содержания маркерного белка астроглии GFAP в пириформной коре мышей линии 5xFAD указывает на активацию астроцитов, инициированную нейровоспалительными и нейродегенеративными процессами, вызванными амилоидогенезом, что согласуется с результатами, полученными ранее на этой линии животных [1]. Повышение содержания астроцитов при развитии генетически-обусловленных форм БА выявляется и при позитронно-эмиссионной томографии мозга пациентов, причем развитие астроглиоза предшествует накоплению амилоидных бляшек [23]. Схожие данные получены и у трансгенных мышей линии APPswe, у которых увеличение числа астроцитов наблюдается по мере развития патогенетических изменений в коре и гиппокампе, начиная с 6-месячного возраста [24].
Ранее мы проводили исследования распределения амилоид-деградирующей металлопептидазы неприлизина (НЕП) в ткани обонятельной луковицы, гиппокампа и энторинальной области коры как у крыс, перенесших пренатальную гипоксию [17], так и у трансгенных мышей линии 5xFAD [12]. Поскольку в настоящей работе мы использовали тот же протокол иммунофлуоресцентного исследования, это дало нам возможность впервые провести сравнение распределения НЕП в ткани различных отделов мозга трансгенных мышей и животных дикого типа. Результаты исследования распределения металлопептидазы НЕП в обонятельной луковице и энторинальной области коры в рамках данной работы согласуются с данными, полученными нами ранее на этой же модели [12], однако данные о распределении НЕП в пириформной коре получены нами впервые. В пириформной коре НЕП локализуется преимущественно в межклеточном пространстве, тогда как в энторинальной присутствуют НЕП-позитивные клеточные тела. Можно предположить, что различия в общем уровне иммунохимического окрашивания в пириформной и энторинальной областях коры во многом определяются наличием в энторинальной коре большего числа клеток с повышенным уровнем содержания НЕП. Более того, в энторинальной коре 5xFAD мышей количество таких клеток существенно ниже, чем у мышей дикого типа, тогда как в пириформной коре, где эти клетки единичны в обеих группах, такие различия между линиями животных ярко не выражены. Интересно отметить, что в гиппокампе клетки с повышенным содержанием НЕП в телах также встречаются редко, как и в пириформной коре [12]. В ткани обонятельных луковиц мышей и крыс НЕП локализован как в телах клеток, так и в нейропиле и его содержание намного выше, чем в корковых структурах как на уровне мРНК, так и белка [15, 17, 18]. Наибольшее его количество отмечено в центральный области, в проводящих пучках белого вещества и паттерн распределения НЕП стабильно воспроизводится у крыс [17] и мышей – как дикого типа, так и линии 5xFAD [18].
Снижение экспрессии НЕП на уровне мРНК и белкового продукта у мышей линии 5xFAD относительно мышей дикого типа коррелирует с накоплением и агрегацией амилоидного пептида, приводящее к образованию амилоидных бляшек в межклеточном пространстве [18] и в зонах расположения волокон белого вещества. Также нами ранее было показано различие в общем уровне экспрессии НЕП в различных отделах головного мозга крыс [15], что в совокупности с данными иммуногистохимии свидетельствует о наличии специфических особенностей экспрессии данного гена в отделах мозга, характеризующихся различным временным диапазоном появления амилоидных депозитов при развитии БА (сначала в корковых структурах и позже в стриатуме) [25]. Закономерности, стоящие за наблюдающимися отличиями в распределении НЕП в различных отделах головного мозга у животных, нуждаются в дальнейшем изучении.
Наблюдаемые нами патологические изменения в обонятельных луковицах и пириформной коре могут быть причиной ослабления обонятельной функции у трансгенных мышей, которое выражается в снижении результативности поиска пищи по запаху на фоне одинаковой поисковой активности по сравнению с мышами дикого типа. Это согласуется с данными, полученными на другой линии трансгенных мышей 3xTg-AD, у которых также наблюдался более длительный период поиска пищи и нарушение обонятельной функции, по сравнению с мышами дикого типа, по мере накопления амилоидных отложений [26]. Нарушение обонятельной функции у мышей линии 5xFAD было также показано в нашем предыдущем исследовании [18], когда помимо когнитивного дефицита у этих животных, наблюдаемого при обучении в водном лабиринте Морриса, мы обнаружили потерю предпочтения к запаху масла валерианы, компоненты которого имеют феромональную значимость для грызунов [27]. В литературе также есть данные, свидетельствующие о существенных нарушениях в функционировании сенсорных нейронов в обонятельных луковицах 5xFAD мышей, выражающиеся в изменении пространственного распределения кальциевой сигнализации в ответ на стимуляцию одорантами [28], что согласуется с нашими данными о нарушении предпочтения к запаху валерианы. Нарушение обонятельной функции также наблюдается и у человека на ранних стадиях развития болезней Альцгеймера и Паркинсона [9, 29, 30], что делает изучение механизмов нарушения обонятельной функции с использованием трансгенных животных важным и актуальным.
Поскольку НЕП расщепляет основной нейромедиатор обонятельной сигнализации соматостатин [31], уровень которого очень высок в обонятельных луковицах [32], повышенная экспрессия НЕП на уровне мРНК и белка в этом отделе обонятельного анализатора свидетельствует о важной роли этого фермента в проведении обонятельного сигнала. Это, вероятно, объясняет и тот факт, что экспрессия НЕП в обонятельных луковицах остается высокой в течение всей продолжительности жизни и снижается только к старости, чему соответствует снижение обонятельной функции у экспериментальных животных [33]. В более раннем возрасте нарушение обонятельной функции, коррелирующее с пониженной экспрессией НЕП в корковых структурах обонятельного анализатора, наблюдается у крыс, перенесших пренатальную гипоксию [15]. Аналогичным образом снижение уровня экспрессии НЕП в теменной и энторинальной коре, а также гиппокампе у 5xFAD мышей [16] может быть причиной нарушения у них проведения обонятельного стимула, наблюдаемого нами как в тесте поиска пищи, так и распознавания запахов. Интересно, что повышение экспрессии НЕП у перенесших пренатальную гипоксию крыс, после введения им ингибитора деацетилаз гистонов вальпроата натрия или ингибитора каспаз Ac-DEVD-CHO, приводило к восстановлению у них нарушений в обонянии, вызванных пренатальной патологией [15, 16]. Введение вальпроата натрия трансгенным мышам, моделирующим БА, также приводило у них к снижению числа амилоидных бляшек и улучшению когнитивных функций [34]. Принимая во внимание, что НЕП является основным амилоид-деградирующим ферментом в ткани мозга [13], а его экспрессия в нервных клетках регулируется на эпигенетическом уровне посредством деацетилаз гистонов [35], в настоящее время нами проводится исследование влияния инъекций вальпроата натрия на уровень экспрессии и обонятельного поведения мышей линии 5xFAD и предварительные данные позволяют предположить, что повышение экспрессии НЕП в структурах мозга, отвечающих за проведение обонятельного стимула, будет позитивно коррелировать с уровнем их обонятельной функции.
ЗАКЛЮЧЕНИЕ
Таким образом, исследование у трансгенных мышей линии 5xFAD нейродегенеративных изменений в ткани пириформной коры, получающей прямые входы из обонятельной луковицы, свидетельствует о наличии в пириформной коре большого количества амилоидных образований, распаде миелиновых волокон, дегенеративных изменениях синаптических окончаний, образовании обширных областей с аутофаголизосомами, усилении глиальной реакции (GFAP) и изменении уровня экспрессии и распределения НЕП. У этих животных также отмечается нарушение обонятельной функции. Многие из описанных признаков наблюдаются и в ткани мозга человека при развитии БА. Нарушение обоняния, наблюдаемое на самых ранних стадиях БА, может свидетельствовать о повреждении системы проведения обонятельных стимулов при развитии амилоидоза, что делает анализ обонятельной функции важным критерием для ранней диагностики этого заболевания. В связи с этим исследования молекулярно-клеточных механизмов, лежащих в основе изменений обонятельной функции экспериментальных животных, вызванных повышенным образованием амилоидного пептида или нарушением его клиренса, являются исключительно важными и перспективными как для понимания основных молекулярных механизмов патогенеза БА, так и для создания направленной терапии этого и других заболеваний, сопровождающихся нарушением обоняния.
Список литературы
Oakley HO, Cole SL, Logan S, Maus E, Shao P, Craft J, Guillozet-Bongaarts A, Ohno M, Disterhoft J, Van Eldik L, Berry R, Vassar R (2006) Intraneuronal β-amyloid aggregates, neurodegeneration, and neuron loss in transgenic mice with five familial Alzheimer’s disease mutations: Potential factors in amyloid plaque formation. J Neurosci 26: 10129–10140. https://doi.org/10.1523/JNEUROSCI.1202-06.2006
Mirzaei N, Tang SP, Ashworth S, Coello C, Plisson C, Passchier J, Selvaraj V, Tyacke RJ, Nutt DJ, Sastre M (2016) In vivo imaging of microglial activation by positron emission tomography with [(11)C]PBR28 in the 5XFAD model of Alzheimer’s disease. Glia 64: 993–1006. https://doi.org/10.1002/glia.22978
Eimer WA, Vassar R (2013) Neuron loss in the 5XFAD mouse model of Alzheimer’s disease correlates with intraneuronal Abeta42 accumulation and Caspase-3 activation. Mol Neurodegener 8: 2. https://doi.org/10.1186/1750-1326-8-2
Devi L, Ohno M (2010b) Phospho-eIF2α level is important for determining abilities of BACE1 reduction to rescue cholinergic neurodegeneration and memory defects in 5XFAD mice. PLoS One 5: e12974. https://doi.org/10.1371/journal.pone.0012974
Shao CY, Mirra SS, Sait HB, Sacktor TC, Sigurdsson EM (2011) Postsynaptic degeneration as revealed by PSD-95 reduction occurs after advanced Aβ and tau pathology in transgenic mouse models of Alzheimer’s disease. Acta Neuropathol 122: 285–292. https://doi.org/10.1007/s00401-011-0843-x
Neuman KM, Molina-Campos E, Musial TF, Price AL, Oh KJ, Wolke ML, Buss EW, Scheff SW, Mufson EJ, Nicholson DA (2015) Evidence for Alzheimer’s disease-linked synapse loss and compensation in mouse and human hippocampal CA1 pyramidal neurons. Brain Struct Funct 220: 3143–3165. https://doi.org/10.1007/s00429-014-0848-z
Kimura R, Ohno M (2009) Impairments in remote memory stabilization precede hippocampal synaptic and cognitive failures in 5XFAD Alzheimer mouse model. Neurobiol Dis 33: 229–235. https://doi.org/10.1016/j.nbd.2008.10.006
Kanno T, Tsuchiya A, Nishizaki T (2014) Hyperphosphorylation of Tau at Ser396 occurs in the much earlier stage than appearance of learning and memory disorders in 5XFAD mice. Behav Brain Res 274: 302–306. https://doi.org/10.1016/j.bbr.2014.08.034
Murphy C (2019) Olfactory and other sensory impairments in Alzheimer disease. Nat Rev Neurol 15: 11–24. https://doi.org/10.1038/s41582-018-0097-5
Cai Y, Xue ZQ, Zhang XM, Li MB, Wang H, Luo XG, Cai H, Yan XX (2012) An age-related axon terminal pathology around the first olfactory relay that involves amyloidogenic protein overexpression without plaque formation. Neurosci 215: 160–173. https://doi.org/10.1016/j.neuroscience.2012.04.043
Gaudel F, Stephan D, Landel V, Sicard G, Féron F, Guiraudie-Capraz G (2018) Expression of the Cerebral Olfactory Receptors Olfr110/111 and Olfr544 Is Altered During Aging and in Alzheimer’s Disease-Like Mice. Mol Neurobiol 56: 2057–2072. https://doi.org/10.1007/s12035-018-1196-4
Туманова НЛ, Васильев ДС, Дубровская НМ, Наливаева НН (2022) Морфофункциональные изменения нервной ткани мозга трансгенных мышей линии 5xFAD. Цитология 64: 159–171. [Tumanova NL, Vasilev DS, Dubrovskaya NM, Nalivaeva NN (2022) Morphofunctional changes in the brain tissue of 5xFAD transgenic mice. Cell Tiss Biol 64: 159–171. (In Russ)]. https://doi.org/10.31857/S0041377122020080
Nalivaeva NN, Turner AJ (2019) Targeting amyloid clearance in Alzheimer’s disease as a therapeutic strategy. Br J Pharmacol 176: 3447–3463. https://doi.org/10.1111/bph.14593
Nalivaeva NN, Zhuravin IA, Turner AJ (2020) Neprilysin expression and functions in development, ageing and disease. Mech Ageing Dev 192: 111363. https://doi.org/10.1016/j.mad.2020.111363
Vasilev DS, Dubrovskaya NM, Zhuravin IA, Nalivaeva NN (2021) Developmental Profile of Brain Neprilysin Expression Correlates with Olfactory Behaviour of Rats. J Mol Neurosci 71: 1772–1785. https://doi.org/10.1007/s12031-020-01786-3
Vasilev D, Dubrovskaya NM, Nalivaeva, NN (2022) Caspase Inhibition Restores NEP Expression and Rescues Olfactory Deficit in Rats Caused by Prenatal Hypoxia. J Mol Neurosci 72: 1516–1526. https://doi.org/10.1007/s12031-022-01986-z
Tumanova NL, Vasilev DS, Dubrovskaya NM, Nalivaeva NN, Zhuravin IA (2021) Effect of Prenatal Hypoxia on Cytoarchitectonics and Ultrustructural Organisation of Brain Regions Related to Olfaction in Rats. Cell Tiss Biol 15: 482–492. https://doi.org/10.1134/S1990519X21050114
Vasilev DS, Dubrovskayaa NM, Tumanova NL, Nalivaeva NN (2022) Analysis of Expression of the Amyloid-Degrading Enzyme Neprilysin in Brain Structures of 5xFAD Transgenic Mice. J Evol Biochem Physiol 58: 193–203. https://doi.org/10.1134/S0022093022010173
Paxinos G, Franklin KBJ (2001) The mouse brain in stereotaxic coordinates. 2nd Edition. Acad. Press. San Diego. https://doi.org/10.1084/jem.20081588
Tumanova NL, Vasil’ev DS, Dubrovskaya NM, Zhuravin IA (2018) Ultrastructural alterations in the sensorimotor cortex upon delayed development of motor behavior in early ontogenesis of rats exposed to prenatal hypoxia. Cell Tiss Biol 12: 419–425. https://doi.org/10.1134/S1990519X18050097
Sun S, Li T, Davies H, Li W, Yang J, Li S, Ling S (2016) Altered Morphologies and Functions of the Olfactory Bulb and Hippocampus Induced by miR-30c. Front Neurosci 10: 207. https://doi.org/10.3389/fnins.2016.00207
De Castro F (2009) Wiring olfaction: The cellular and molecular mechanisms that uide the development of synaptic connections from the nose to the cortex. Front Neurosci 3: 52. https://doi.org/10.3389/neuro.22.004.2009
Schöll M, Carter SF, Westman E, Rodriguez-Vieitez E, Almkvist O, Thordardottir S, Wall A, Graff C, Långström B, Nordberg A (2015) Early astrocytosis in autosomal dominant Alzheimer’s disease measured in vivo by multi-tracer positron emission tomography. Sci Rep 5: 16404. https://doi.org/10.1038/srep16404
Rodriguez-Vieitez E, Ni R, Gulyás B, Tóth M, Häggkvist J, Halldin C, Voytenko L, Marutle A, Nordberg A (2015) Astrocytosis precedes amyloid plaque deposition in Alzheimer APPswe transgenic mouse brain: a correlative positron emission tomography and in vitro imaging study. Eur J Nucl Med Mol Imaging 42: 1119–1132. https://doi.org/10.1007/s00259-015-3047-0
Thal DR, Rub U, Orantes M, Braak H (2002) Phases of A β-deposition in the human brain and its relevance for the development of AD. Neurology 58: 1791–1800. https://doi.org/10.1212/WNL.58.12.1791
Mitrano DA, Houle SE, Pearce P, Quintanilla RM, Lockhart BK, Genovese BC, Schendzielos RA, Croushore EE, Dymond EM, Bogenpohl JW, Grau HJ, Smith Webb L (2021) Olfactory dysfunction in the 3xTg-AD model of Alzheimer’s disease. IBRO Neurosci Rep 10: 51–61. https://doi.org/10.1016/j.ibneur.2020.12.004
Мельник СА, Гладышева ОС, Крылов ВН (2009) Возрастные изменения обонятельной чувствительности самцов мышей к запаху изовалериановой кислоты. Сенсорные системы 23: 151–155. [Melnik SA, Gladysheva OS, Krylov VN (2009) Age-related changes in the olfactory sensitivity of male mice to the smell of isovaleric acid. Sensory Systems 23: 151–155. (In Russ)].
Son G, Yoo S-J, Kang S, Rasheed A, Jung DH, Park H, Cho B, Steinbusch HWM, Chang K-A, Suh Y-H, Moon C (2021) Region-specific amyloid-β accumulation in the olfactory system influences olfactory sensory neuronal dysfunction in 5xFAD mice. Alzheimers Res Ther 13: 4. https://doi.org/10.1186/s13195-020-00730-2
Djordjevic J, Jones-Gotman M, De Sousa K, Chertkow H (2008) Olfaction in patients with mild cognitive impairment and Alzheimer’s disease. Neurobiol Aging 29: 693–706. https://doi.org/10.1016/j.neurobiolaging.2006.11.014
Doty RL (2012) Olfactory dysfunction in Parkinson disease. Nat Rev Neurol 8: 329–339. https://doi.org/10.1038/nrneurol.2012.80
Lepousez G, Mouret A, Loudes C, Epelbaum J, Viollet C (2010) Somatostatin contributes to in vivo gamma oscillation modulation and odor discrimination in the olfactory bulb. J Neurosci 30: 870–875. https://doi.org/10.1523/JNEUROSCI.4958-09.2010
Nocera S, Simon A, Fiquet O, Chen Y, Gascuel J, Datiche F, Schneider N, Epelbaum J, Viollet C (2019) Somatostatin serves a modulatory role in the mouse olfactory bulb: Neuroanatomical and behavioral evidence. Front Behav Neurosci 13: 61. https://doi.org/10.3389/fnbeh.2019.00061
Dubrovskaya NM, Vasilev DS, Tumanova NL, Alekseeva OS, Nalivaeva NN (2022) Prenatal Hypoxia Impairs Olfactory Function in Postnatal Ontogeny in Rats. Neurosci Behav Physiol 52: 262–270. https://doi.org/10.1007/s11055-022-01233-3
Qing H, He G, Ly PTT, Fox CJ, Staufenbiel M, Cai F, Zhang Z, Wei S, Sun X, Chen C-H, Zhou W, Wang K, Song W (2008) Valproic acid inhibits Aβ production, neuritic plaque formation, and behavioral deficits in Alzheimer’s disease mouse models. J Exp Med 205: 2781–2789. https://doi.org/0.1084/jem.20081588
Belyaev ND, Nalivaeva NN, Makova NZ, Turner AJ (2009) Neprilysin gene expression requires binding of the amyloid precursor protein intracellular domain to its promoter: implications for Alzheimer disease. EMBO Rep 10: 94–100. https://doi.org/10.1038/embor.2008.222
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова