Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 8, стр. 940-956
Оценка паракринных эффектов кондиционированной среды в ходе ее перекрестного добавления при моделировании взаимодействий в морфофункциональной системе “кондуит–артерия”
А. В. Фролов 1, Д. К. Шишкова 1, В. Е. Маркова 1, *, М. Ю. Синицкий 1, А. В. Синицкая 1, А. О. Поддубняк 1, А. Ю. Каноныкина 1, Н. И. Загородников 1, Е. В. Григорьев 1, А. Г. Кутихин 1
1 Научно-исследовательский институт комплексных проблем сердечно-сосудистых заболеваний
Кемерово, Россия
* E-mail: markve97@gmail.com
Поступила в редакцию 19.05.2022
После доработки 15.07.2022
Принята к публикации 22.07.2022
- EDN: DRWEUQ
- DOI: 10.31857/S0869813922080039
Аннотация
Дисфункция эндотелия является одним из ключевых триггеров для развития болезней системы кровообращения, в том числе способствуя развитию тромбоза, рестеноза и неоатеросклероза в системе “кондуит–артерия”, возникающей при соединении венозного или артериального кондуита с коронарной артерией при коронарном шунтировании. Цель исследования – провести in vitro моделирование взаимодействий артериальных и венозных эндотелиальных клеток системы “кондуит–артерия”. Кондиционированная в течение 24 ч бессывороточная культуральная среда от монослоя первичных эндотелиальных клеток коронарной артерии человека (HCAEC), первичных эндотелиальных клеток внутренней грудной артерии человека (HITAEC) и первичных эндотелиальных клеток большой подкожной вены человека (HSaVEC) была перекрестно добавлена к интактному монослою тех же линий клеток на 24 ч. Далее был проведен анализ генной и белковой экспрессии в культурах эндотелиальных клеток, а также анализ профиля секретируемых ими в культуральную среду цитокинов, про- и антиангиогенных факторов. Анализ генной экспрессии показал, что добавление культуральной среды от HITAEC снижало выраженность стимулирующего клеточную адгезию провоспалительного ответа в HCAEC, в то время как добавление культуральной среды от HSaVEC, напротив, активировало транскрипцию в HCAEC генов провоспалительных цитокинов. В свою очередь, добавление культуральной среды от HCAEC способствовало поддержанию эндотелиального фенотипа HITAEC. Кондиционированная среда от артериальных эндотелиальных клеток стимулировала выделение про-ангиогенных молекул при воздействии на HCAEC и HSaVEC, но не HITAEC. Добавление кондиционированной среды от HSaVEC приводило к значимому снижению концентрации провоспалительного цитокина интерлейкина-6 во всех трех сценариях. Взаимодействия артериальных эндотелиальных клеток в модели HITAEC–HCAEC препятствуют их провоспалительной активации и увеличивают ангиогенный потенциал HCAEC, что частично объясняет повышенную проходимость артериальных кондуитов и устойчивость связанной с ними коронарной артерии к тромбозу, рестенозу и неоатеросклерозу в отдаленном послеоперационном периоде после коронарного шунтирования.
Сосудистые эндотелиальные клетки образуют внутреннюю выстилку всех кровеносных сосудов, как крупных – вен и артерий, так и мелких – артериол, венул и капилляров. Поскольку сосуды артериального и венозного русла имеют совершенно различное функциональное значение, фенотип и физиологический профиль экспрессии их клеточных популяций, в том числе эндотелиальные клетки, также существенно отличается [1, 2]. Эндотелиальные клетки артериальных и венозных сосудов выделяют большое количество различных регуляторных молекул, позволяющих регулировать проницаемость эндотелиального монослоя, транспорт макромолекул (в том числе атерогенных липопротеинов) и гемостаз, а также участвующих в модулировании клеточной адгезии и в процессах воспаления [3]. Различие в разнообразии выделяемых в микроокружение и в системный кровоток биоактивных факторов наблюдается не только между венами и артериями, но и между разными гистологическими типами артерий и даже между разными сегментами одной и той же артерии в зависимости от их геометрии [2, 4].
На сегодняшний день лучшим кондуитом для коронарного шунтирования – хирургического вмешательства с целью создания обходного пути (шунта) для восстановления коронарного кровотока – считается внутренняя грудная артерия (ВГА), поскольку она относительно устойчива к развитию атеросклероза, что обеспечивает ее проходимость даже в отдаленном послеоперационном периоде [5, 6]. Вместе с тем, хотя артериальные кондуиты демонстрируют более высокие показатели проходимости, чем венозные (в частности большая подкожная вена, БПВ), именно последние используются наиболее часто, поскольку их легче извлекать и проводить с ними хирургические манипуляции, а их длина позволяет осуществлять анатомическое соединение с любой коронарной артерией и производить сегментирование на несколько графтов. Несмотря на совершенствование хирургической техники и последующего медикаментозного лечения, а также технологий реабилитации и преабилитации, долгосрочная эффективность шунтов из подкожных вен остается ограниченной вследствие полной или гемодинамически значимой окклюзии (рестеноза) кондуитов или продолжающегося прогрессирования атеросклероза коронарных артерий (КА) [7–9]. Таким образом, оптимальная стратегия реваскуляризации сердечной ткани при помощи коронарного шунтирования все еще остается предметом активных дискуссий кардиохирургов и физиологов.
Для оценки особенности взаимодействий между артериальными и венозными эндотелиальными клетками в формирующейся при коронарном шунтировании морфофункциональной системе “кондуит–артерия” ранее нами была осуществлена работа по сокультивированию трех клеточных линий – эндотелиальных клеток КА (в англоязычной терминологии – HCAEC, от human coronary artery endothelial cells), эндотелиальных клеток ВГА (в англоязычной терминологии – HITAEC, от human internal thoracic artery endothelial cells) и эндотелиальных клеток БПВ (в англоязычной терминологии – HSaVEC, от human saphenous vein endothelial cells). Сокультивирование HCAEC и HITAEC взаимно способствовало экспрессии эндотелиальной синтазы монооксида азота (eNOS) и поддержанию эндотелиального фенотипа, снижая экспрессию транскрипционных факторов эндотелиально-мезенхимального перехода и повышая экспрессию транскрипционных факторов артериальной дифференцировки. Сокультивирование HCAEC и HSaVEC также индуцировало артериальное репрограммирование HSaVEC. Кроме того, сокультивирование HCAEC и HITAEC приводило к повышенному выделению про-ангиогенных молекул в микроокружение, вероятно, способствуя сосудистой регенерации. На основании этих результатов было предположено, что паракринные взаимодействия HCAEC и эндотелиальных клеток кондуита (HITAEC или HSaVEC) могут влиять на сосудистый гомеостаз после коронарного шунтирования и, при их благотворном влиянии, могут лежать в основе повышенной проходимости артериальных кондуитов в отдаленном периоде [10].
Несмотря на определенные преимущества модели сокультивирования артериальных и венозных эндотелиальных клеток (в частности прямое воздействие клеточных линий друг на друга), ее недостатком является отсутствие технической возможности отделить культуральную среду, кондиционированную конкретным типом эндотелиальных клеток (то есть среду, в которую выделяет внеклеточные везикулы и растворимые факторы только какой-либо определенный тип эндотелиальных клеток), поскольку в культуральной посуде с вставками для сокультивирования культуральная среда неизбежно перемешивается. Поэтому данную модель также было решено дополнить моделью перекрестного добавления кондиционированной среды с целью оценки изолированного влияния артериальных и венозных эндотелиальных клеток друг на друга. Впоследствии проводилось измерение уровня молекул, ответственных за эндотелиальный гомеостаз или обусловливающих развитие дисфункции эндотелия во всех указанных клеточных линиях – HCAEC, HITAEC и HSaVEC.
МЕТОДЫ ИССЛЕДОВАНИЯ
Первичные HCAEC (HCAEC, Cell Applications, каталожный номер 300K-05a), первичные HITAEC (HITAEC, Cell Applications, 308K-05a) и первичные HSaVEC (PromoCell, C-12231) были культивированы в среде MesoEndo Growth Medium (Cell Applications, 212-500) во флаконах Т-150 (Techno Plastic Products, 90552) до формирования монослоя, после чего полная культуральная среда (Cell Applications, 212-500) для предотвращения контаминации внеклеточными везикулами из сыворотки после двукратной отмывки фосфатно-солевым буфером была заменена на бессывороточную среду с теми же факторами роста, что и в полной среде (Cell Applications, 212F-500). Через 24 ч (данный срок был обусловлен оптимальной продолжительностью сывороточной депривации, в течение которого монослой остается в неизменном виде без признаков патологического состояния клеток) указанная бессывороточная культуральная среда (кондиционированная среда, 30 мл от каждой клеточной линии) была забрана из данных флаконов и центрифугирована при 3000 g для очистки от крупного дебриса с последующим перекрестным добавлением во флаконы Т-25 (Techno Plastic Products, 90026) с заранее культивированным в среде MesoEndo Growth Medium (Cell Applications, 212-500) монослоем от этих же доноров.
Таким образом, дизайн эксперимента предусматривал девять экспериментальных групп – HCAEC, к которым была добавлена кондиционированная среда от HCAEC (аутоконтроль), HITAEC и HSaVEC; HITAEC, к которым была добавлена кондиционированная среда от HCAEC, HITAEC (аутоконтроль) и HSaVEC; HSaVEC, к которым была добавлена кондиционированная среда от HCAEC, HITAEC и HSaVEC (аутоконтроль). Через 24 ч после перекрестного добавления HCAEC, HITAEC и HSaVEC во флаконах Т-25 клетки были однократно отмыты в охлажденном (4°С) фосфатно-солевом буфере и далее лизированы в тризоле (15596018, Applied Biosystems) для выделения РНК или RIPA-буфере (Thermo Scientific, 89901) с коктейлем ингибиторов протеаз и фосфатаз Halt (Thermo Scientific, 78444) для выделения белка согласно инструкциям производителей. Количественная оценка и контроль качества выделенных нуклеиновых кислот проводились при помощи спектрофотометрии на приборе NanoDrop 2000 (Thermo Scientific), количественная оценка белка выполнялась с использованием набора BCA Protein Assay Kit (Thermo Scientific, 23227) согласно инструкции производителя. Кондиционированная культуральная среда от этих клеток была забрана, центрифугирована при 12 000 g для очистки от крупного дебриса и заморожена при –60°С для измерения уровня выделяемых клетками молекул при помощи дот-блоттинга (скрининг) и иммуноферментного анализа (высокоточное определение).
Для измерения генной экспрессии вначале осуществлялась обратная транскрипция для синтеза кДНК (термоциклер Veriti, Applied Biosystems, набор High-Capacity cDNA Reverse Transcription Kit, 4368814, Applied Biosystems) согласно инструкции производителя. Далее проводилась собственно количественная полимеразная цепная реакция (кПЦР) в соответствии с протоколом производителя мастер-микса (PowerUp SYBR Green Master Mix, A25777, Applied Biosystems) на приборе ViiA 7 (Applied Biosystems) в четырех повторах для каждого образца. Праймеры для кПЦР были разработаны в программе Primer-BLAST (National Institutes of Health) с использованием следующих параметров: длина ПЦР-продукта – от 70 до 150 пар оснований, температура плавления праймеров – от 59 до 65°С с различием между праймерами не более 3°С, включение интрона с длиной не менее 200 пар оснований – обязательно, длина праймера – от 18 до 22 нуклеотидов, содержание гуанина и цитозина в праймерах – от 40 до 60%, максимальная длина повтора одного и того же нуклеотида подряд – 4, максимальное содержание гуанина и цитозина на 3'-конце – не более 3 (60%), максимальная комплементарность праймеров – не более 5 условных единиц. Все остальные параметры программы соответствовали настройкам по умолчанию. Выбирались исключительно пары праймеров, специфичные к гену интереса. После разработки праймеров производился контроль их качества в программах PCR Primer Stats (Sequence Manipulation Suite, www.bioinformatics.org) и Multiple Primer Analyzer (Thermo Scientific Web Tools) на стандартных настройках. В случае обнаружения вероятных димеров разрабатывалась новая пара праймеров (до исключения всех возможных димеров). Синтез разработанных праймеров проводился в компании Евроген (Москва). В качестве референсного гена был выбран ген PECAM1, кодирующий обильно и стабильно экспрессируемый в ЭК рецептор CD31. Уровень экспрессии генов в артериальных и венозных эндотелиальных клетках рассчитывался при помощи 2−ΔΔCt-метода (поправка на экспрессию гена PECAM1 в группе интереса и экспрессию гена интереса в референтной группе аутоконтроля – клеток, к которым была добавлена аутологичная кондиционированная среда). К примеру, в группе сравнений для HCAEC контролем были HCAEC, к которым была добавлена кондиционированная среда от HCAEC (аналогичная схема применялась для HITAEC и HSaVEC).
В качестве скрининговых генов были выбраны VCAM1, ICAM1, SELE и SELP (рецепторы эндотелиальных клеток для лейкоцитов), IL6, CXCL8, CCL2, CXCL1 и MIF (основные эндотелиальные провоспалительные цитокины), NOS3 (ген эндотелиальной NO-синтазы), SNAI1, SNAI2, TWIST1, ZEB1, CDH5 и CDH2 (транскрипционные факторы и маркеры эндотелиально-мезенхимального перехода), HES1, HEY1, HEY2 и NOTCH1 (транскрипционные факторы и рецептор артериальной эндотелиальной дифференцировки) и NR2F2 (транскрипционный фактор венозной эндотелиальной дифференцировки). В таком экспериментальном дизайне повышенная экспрессия генов VCAM1, ICAM1, SELE и SELP в сочетании с повышенной экспрессией генов IL6, CXCL8, CCL2, CXCL1 и MIF свидетельствует о провоспалительной активации эндотелиальных клеток, сниженная экспрессия гена NOS3 указывает на нарушенную способность эндотелиальных клеток выделять основной вазодилататор NO, а повышенная экспрессия генов SNAI1, SNAI2, TWIST1 и ZEB1 в сочетании со сниженной экспрессией гена сосудистого эндотелиального (VE) кадгерина CDH5 и повышенной экспрессией гена мезенхимального кадгерина CDH2 говорит об эндотелиально-мезенхимальном переходе. Сниженная экспрессия генов HES1, HEY1, HEY2 и NOTCH1 в сочетании с повышенной экспрессией гена NR2F2 отражает сдвиг эндотелиальной дифференцировки от артериальной к венозной. Результаты измерения уровня генной экспрессии отображались в виде тепловой карты (белый цвет обозначал отсутствие генной экспрессии, светло-зеленый цвет – кратность изменения (fold change) ≤0.5, светло-серый цвет – от 0.51 до 1.99, светло-фиолетовый цвет – ≥2).
Анализ уровня цитокинов и ангиогенных факторов в культуральной среде с восьми из девяти экспериментальных групп (всех, исключая HSaVEC после добавления кондиционированной среды от HITAEC в силу меньшей релевантности данной экспериментальной группы проверяемой гипотезе) был проведен с использованием соответствующих наборов для дот-блоттинга (ARY005B, R&D Systems; ab193655, Abcam) в соответствии с протоколами производителя. Хемилюминесцентная детекция проводилась посредством цифрового сканера блотов C-DiGit (LI-COR Biosciences) в высокочувствительном режиме (12-минутное сканирование). С целью количественной верификации полуколичественных результатов дот-блоттинга в культуральной среде также была измерена концентрация интерлейкина-6 при помощи соответствующего набора для иммуноферментного анализа (430507, BioLegend) в соответствии с протоколом производителя. Колориметрическая детекция результата была проведена при помощи спектрофотометра Multiskan Sky (Thermo Scientific) при длине волны 450 нм.
Для проведения иммуноблоттинга одинаковые количества белка (15 мкг на образец) были смешаны с буфером на основе додецилсульфата лития NuPAGE (NP0007, Invitrogen) в соотношении 4 : 1 и восстановителем NuPAGE (NP0009, Invitrogen) в соотношении 10 : 1, денатурированы при 99°C в течение 5 мин и далее загружены на гель NuPAGE 4–12% Bis-Tris толщиной 1.5 мм (NP0335BOX, Invitrogen). В качестве маркера молекулярных масс использовалась смесь белковых стандартов Novex Sharp Pre-Stained (LC5800, Invitrogen) и MagicMark XP Western в соотношении 1 : 1 (LC5602, Invitrogen). Белки разделялись путем электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) при напряжении 150 В в течение 2 ч с использованием буфера для разделения белков NuPAGE MES SDS (NP0002, Invitrogen), антиоксиданта NuPAGE (NP0005, Invitrogen) и камеры для вертикального электрофореза XCell SureLock Mini-Cell (EI0001, Invitrogen). Перенос белка выполнялся с помощью мембран из поливинилидендифторида (IB24001, Invitrogen) и прибора для сухого переноса iBlot 2 (Invitrogen) в соответствии с протоколом производителя в стандартном режиме для белков с молекулярной массой 30–150 кДа (P0 – 20 В в течение 1 мин, 23 В в течение 4 мин и 25 В в течение 2 мин). Мембраны далее инкубировались в растворе iBind Flex (SLF2020, Solution Kit Thermo Fisher Scientific, Waltham, MA, США) в течение 1 ч для предотвращения неспецифического связывания.
Для иммуноблоттинга использовались антитела кролика к провоспалительным молекулам клеточной адгезии VCAM1 (ab134047, 1 : 1000, Abcam) и ICAM1 (ab109361, 1 : 1000, Abcam), транскрипционному фактору эндотелиально-мезенхимального перехода ZEB1 (ab203829, 1 : 200, Abcam) и белку CD31 (контроль загрузки, ab9498, 1 : 1000, Abcam), антитела мыши к каспазе-3 (ab208161, 1 : 250, Abcam) и глицеральдегид-3-фосфат-дегидрогеназе (GAPDH, контроль загрузки, ab139416, 1 : 250, Abcam) и антитела козла к бета-тубулину (контроль загрузки, ab21057, 1 : 1000, Abcam). Конъюгированные с пероксидазой хрена вторичные антитела козла против кролика (7074, Cell Signaling Technology), козла против мыши (AP130P, Sigma-Aldrich) и осла против козла (ab205723, Abcam) были использованы в разведении 1 : 200, 1 : 1000 и 1 : 400 соответственно. Инкубирование с антителами выполнялось при помощи реагентов из набора iBind Flex (SLF2020, Invitrogen), карточек iBind Flex (SLF2010, Invitrogen) и прибора iBind Flex Western Device (SLF2000, Invitrogen) в течение 3 ч в соответствии с протоколами производителя. Хемилюминесцентная детекция проводилась с использованием субстрата SuperSignal West Pico PLUS (34580, Thermo Scientific) и цифрового сканера блотов C-DiGit (LI-COR Biosciences) в высокочувствительном режиме (12-минутное сканирование).
Статистический анализ был выполнен в программе GraphPad Prism 8 (GraphPad Software). Данные были представлены в виде медианы, 25-го и 75-го процентилей и минимального и максимального значений. Анализ межгрупповых различий проводился с использованием критерия Краскела–Уоллиса с последующим попарным U-критерием Манна–Уитни, поправка на множественные сравнения выполнялась посредством применения средней доли ложных отклонений гипотез (false discovery rate, FDR по Беньямини, Кригеру и Йекутиели). Статистически значимой считалась вероятность отвергнуть верную нулевую гипотезу q (скорректированные с учетом FDR значения р) ≤ 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ генной экспрессии методом ОТ-кПЦР (рис. 1) продемонстрировал: 1) относительное снижение экспрессии генов провоспалительных молекул клеточной адгезии (VCAM1, ICAM1, SELE, SELP) в сочетании с признаками артериовенозной трансдифференцировки (снижение экспрессии генов артериальной дифференцировки HES1, HEY2 и NOTCH1 и повышение экспрессии гена венозной дифференцировки NR2F2) в HCAEC, к которым добавляли кондиционированную среду от HITAEC; 2) относительное повышение экспрессии практически всех генов провоспалительных молекул клеточной адгезии и цитокинов (VCAM1, ICAM1, SELE, SELP, CXCL8, CCL2, CXCL1, MIF), а также генов транскрипционных факторов и маркеров эндотелиально-мезенхимального перехода (SNAI1, TWIST1, ZEB1, CDH2) в HCAEC, к которым добавляли кондиционированную среду от HSaVEC; 3) относительное снижение экспрессии генов транскрипционных факторов эндотелиально-мезенхимального перехода (SNAI1, SNAI2, TWIST1) и артериальной дифференцировки (HES1, NOTCH1) в HITAEC, к которым добавляли кондиционированную среду от HCAEC; 4) относительное снижение экспрессии генов провоспалительных цитокинов (IL6, CXCL8, CCL2, CXCL1) и артериальной дифференцировки (HES1, NOTCH1) в HITAEC, к которым добавляли кондиционированную среду от HSaVEC; 5) относительное повышение экспрессии генов провоспалительных молекул клеточной адгезии и цитокинов (VCAM1, ICAM1, SELP, IL6, CXCL8, CXCL1, MIF) и генов эндотелиально-мезенхимального перехода (SNAI1, TWIST1, ZEB1, CDH2) в HSaVEC, к которым добавляли кондиционированную среду от HCAEC и особенно HITAEC. Таким образом, на уровне генной экспрессии, по аналогии с моделью сокультивирования клеточных линий, на модели перекрестного добавления кондиционированной среды: 1) культуральная среда от HITAEC в целом оказывала благотворное действие на HCAEC, снижая их потенциальную провоспалительную активность, в то время как культуральная среда от HSaVEC, напротив, провоцировала провоспалительную активацию и эндотелиально-мезенхимальный переход HCAEC; 2) культуральная среда от HCAEC способствовала поддержанию эндотелиального фенотипа HITAEC (при этом культуральная среда от HSaVEC снижала их провоспалительный потенциал): 3) в то же время культуральная среда от артериальных эндотелиальных клеточных линий (HCAEC и особенно HITAEC) индуцировала провоспалительную активацию и эндотелиально-мезенхимальный переход в HSaVEC.
Рис. 1.
Сравнительное измерение генной экспрессии (количественная полимеразная цепная реакция после обратной транскрипции) в культурах HCAEC (слева), HITAEC (в центре) и HSaVEC (справа), к монослою которых на 24 ч перекрестно добавили кондиционированную в течение 24 ч среду от монослоя клеток от тех же самых доноров (после центрифугирования при 3000 g для очистки от грубого клеточного дебриса) и далее выделили РНК (при помощи тризола) с последующей обратной транскрипцией до кДНК. Кондиционированная среда представляла собой культуральную среду, предварительно добавленную к монослою клеток тех же самых доноров (HCAEC, HITAEC и HSaVEC) на 24 ч. В качестве референсного гена был выбран PECAM1 (кодирующий белок CD31), также проводилась нормализация генной экспрессии эндотелиальных клеток на величину экспрессии в аутоконтроле – клеточной линии, к которой была добавлена аутологичная кондиционированная среда (2–ΔΔCt). VCAM1, ICAM1, SELE, SELP – молекулы клеточной адгезии (рецепторы эндотелиальных клеток для лейкоцитов), повышенная экспрессия генов которых в сочетании с повышенной экспрессией генов основных эндотелиальных цитокинов (IL6, CXCL8, CCL2, CXCL1, MIF) свидетельствует о провоспалительной активации эндотелиальных клеток. NOS3 – эндотелиальная NO-синтаза, сниженная экспрессия гена которой может свидетельствовать о нарушенной способности эндотелиальных клеток выделять основную сосудорасширяющую молекулу (монооксид азота NO). SNAI1, SNAI2, TWIST1, ZEB1 – транскрипционные факторы эндотелиально-мезенхимального перехода, повышенная экспрессия генов которых в сочетании со сниженной экспрессией гена сосудистого эндотелиального (VE) кадгерина CDH5 и повышенной экспрессией гена мезенхимального кадгерина CDH2 указывает на эндотелиально-мезенхимальный переход. HES1, HEY1, HEY2 и NOTCH1 – транскрипционные факторы (HES1, HEY1, HEY2) и рецептор (NOTCH1) артериальной эндотелиальной дифференцировки, NR2F2 – транскрипционный фактор венозной эндотелиальной дифференцировки. Белый цвет обозначает отсутствие генной экспрессии, светло-зеленый цвет обозначает кратность изменения (fold change) ≤0.5, светло-серый цвет – от 0.51 до 1.99, светло-фиолетовый цвет – ≥2. Отсутствие экспрессии генов транскрипционных факторов артериальной эндотелиальной дифференцировки HEY1 и HEY2 в венозных эндотелиальных клетках (HSaVEC) указывает на техническую валидность проведенного анализа генной экспрессии (стоит отметить, что HITAEC также не экспрессируют эти гены в отличие от HCAEC).

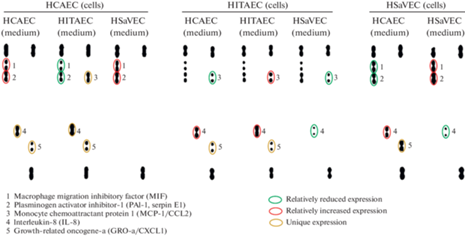
При анализе профиля цитокинов, выделяемых различными артериальными и венозными эндотелиальными клетками после перекрестного добавления к ним кондиционированной культуральной среды (рис. 2) были выявлены: 1) уникальная экспрессия провоспалительного цитокина MCP-1/CCL2 в культуральной среде от HCAEC, к которым добавляли кондиционированную среду от HITAEC (в сравнении с культуральной средой от HCAEC, к которым добавляли аутологичную кондиционированную среду); 2) отсутствие экспрессии провоспалительных цитокинов MCP1/CCL2, интерлейкина-8 и CXCL1 в культуральной среде от HCAEC, к которым добавляли аутологичную кондиционированную среду от HSaVEC; 3) относительное повышение уровня интерлейкина-8 и уникальную экспрессию CXCL1 в культуральной среде от HITAEC, к которым добавляли кондиционированную среду от артериальных эндотелиальных клеток (в сравнении с культуральной средой от HITAEC, к которым добавляли кондиционированную среду от HSaVEC); 4) относительное повышение уровня интерлейкина-8 и уникальная экспрессия CXCL1 в культуральной среде от HSaVEC, к которым добавляли кондиционированную среду от HCAEC (в сравнении с культуральной средой от HSaVEC, к которым добавляли аутологичную кондиционированную среду). Таким образом, кондиционированная среда от артериальных эндотелиальных клеток стимулировала провоспалительный цитокиновый ответ (в частности активное выделение интерлейкина-8 и CXCL1) в сравнении с кондиционированной средой от венозных эндотелиальных клеток, при этом HITAEC также характеризовались повышенным выделением MCP-1/CCL2, а кондиционированная среда от них – способностью индуцировать выделение этого цитокина HCAEC.
Рис. 2.
Сравнительная оценка профиля цитокинов, выделяемых HCAEC (слева), HITAEC (в центре) и HSaVEC (справа), к монослою которых на 24 ч перекрестно добавляли кондиционированную в течение 24 ч среду от монослоя клеток от тех же самых доноров (после центрифугирования при 3000 g для очистки от грубого клеточного дебриса). Культуральная среда из эксперимента по оценке генной экспрессии. Дот-блоттинг (мембраны Proteome Profiler Human Cytokine Array, ARY005B, R&D Systems). Зеленым цветом выделены молекулы с относительно сниженной экспрессией, красным цветом – с относительно повышенной экспрессией, золотым цветом – с уникальной экспрессией.
Аналогичный анализ профиля про- и анти-ангиогенных молекул (рис. 3) показал: 1) относительное повышение уровня провоспалительного цитокина интерлейкина-6, про-ангиогенного плацентарного фактора роста (PlGF) и про-ангиогенной матрикс-ремоделирующей матриксной металлопротеиназы-1 (MMP-1) в культуральной среде от HCAEC, к которым добавляли кондиционированную среду от артериальных эндотелиальных клеток (в сравнении с культуральной средой от HCAEC, к которым добавляли кондиционированную среду от HSaVEC); 2) относительное повышение уровня про-ангиогенной молекулы ангиопоэтина-1 (ANGPT1) в сочетании с уникальной экспрессией анти-ангиогенной молекулы ангиопоэтина-2 (ANGPT2) в культуральной среде от HCAEC, к которым добавляли кондиционированную среду от HSaVEC (в сравнении с культуральной средой от HCAEC, к которым добавляли кондиционированную среду от артериальных эндотелиальных клеток); 3) относительное повышение уровня про-ангиогенных молекул ангиогенина и рецептора к матрикс-ремоделирующей урокиназе (uPAR) в культуральной среде от HITAEC, к которым добавляли кондиционированную среду от HSaVEC (в сравнении с культуральной средой от HITAEC, к которым добавляли кондиционированную среду от артериальных эндотелиальных клеток); 4) относительное повышение уровня анти-ангиогенной молекулы ангиопоэтина-2 (ANGPT2) и уникальную экспрессию про-ангиогенного плацентарного фактора роста (PlGF), про-ангиогенной матрикс-ремоделирующей матриксной металлопротеиназы-1 (MMP-1) и провоспалительной молекулы MCP-1/CCL2 в HSaVEC, к которым добавляли кондиционированную среду от HCAEC (в сравнении с HSaVEC, к которым добавляли аутологичную кондиционированную среду); 5) уникальную экспрессию провоспалительного цитокина интерлейкина-6 в культуральной среде от HCAEC, но не от HITAEC или HSaVEC. Таким образом, кондиционированная среда от артериальных эндотелиальных клеток обладала выраженным про-ангиогенным профилем при воздействии на HCAEC и HSaVEC, но не на HITAEC.
Рис. 3.
Сравнительная оценка профиля про- и анти-ангиогенных молекул, выделяемых HCAEC (слева), HITAEC (в центре) и HSaVEC (справа), к монослою которых на 24 ч перекрестно добавляли кондиционированную в течение 24 ч среду от монослоя клеток от тех же самых доноров (после центрифугирования при 3000 g для очистки от грубого клеточного дебриса). Культуральная среда из эксперимента по оценке генной экспрессии. Дот-блоттинг (мембраны Human Angiogenesis Antibody Array – Membrane, ab193655, Abcam). Зеленым цветом выделены молекулы с относительно сниженной экспрессией, красным цветом – с относительно повышенной экспрессией, золотым цветом – с уникальной экспрессией.

Дальнейший иммуноферментный анализ (рис. 4) обнаружил статистически значимое снижение концентрации провоспалительной молекулы интерлейкина-6 во всех случаях при добавлении кондиционированной среды от HSaVEC, а также в культурах HITAEC и HSaVEC при добавлении кондиционированной среды от HITAEC (однако при этом данная концентрация все равно была выше, чем при добавлении кондиционированной среды от HSaVEC). На основании полученных данных был сделан вывод о том, что HCAEC выделяют в микроокружение больше интерлейкина-6, чем HITAEC и HSaVEC, при этом их культивирование с кондиционированной средой от HSaVEC существенно снижает активность данного процесса.
Рис. 4.
Иммуноферментный анализ концентрации интерлейкина-6, выделяемого HCAEC (слева), HITA-EC (в центре) и HSaVEC (справа), к монослою которых на 24 ч перекрестно добавляли кондиционированную в течение 24 ч среду от монослоя клеток от тех же самых доноров (после центрифугирования при 3000 g для очистки от грубого клеточного дебриса). Культуральная среда из эксперимента по оценке генной экспрессии. Иммуноферментный анализ (набор LEGEND MAX, 430507, BioLegend). n = 6 повторов на группу. Каждая точка на графиках отражает одно измерение. Оранжевый цвет отражает добавление кондиционированной культуральной среды от HCAEC, розовый – добавление кондиционированной культуральной среды от HITAEC, светло-фиолетовый – добавление кондиционированной культуральной среды от HSaVEC. Критерий Краскела–Уоллиса с последующим попарным U-критерием Манна–Уитни, поправка на множественные сравнения посредством применения средней доли ложных отклонений гипотез (false discovery rate, FDR по Беньямини, Кригеру и Йекутиели), значения q (скорректированные с учетом FDR значения P) приведены над графиками.

Помимо анализа провоспалительного и ангиогенного секреторного профиля артериальных и венозных эндотелиальных клеток, также был проведен анализ экспрессии ими провоспалительных молекул клеточной адгезии (рецепторов эндотелиальных клеток для лейкоцитов VCAM1 и ICAM1), транскрипционного фактора эндотелиально-мезенхимального перехода ZEB1 (поскольку более значимые транскрипционные факторы этого процесса Snail и Slug по неясным причинам не были детектированы в лизате эндотелиальных клеток с данного эксперимента) и центрального апоптотического фермента – каспазы-3 (рис. 5):
Рис. 5.
Сравнительный анализ экспрессии провоспалительных молекул клеточной адгезии (рецепторы эндотелиальных клеток для лейкоцитов VCAM1 и ICAM1), транскрипционного фактора эндотелиально-мезенхимального перехода (ZEB1), центрального апоптотического фермента (каспаза-3) и референсных белков (специфическая эндотелиальная молекула клеточной адгезии CD31, цитозольный фермент глицеральдегид-3-фосфат-дегидрогеназа (GAPDH) и белок цитоскелета бета-тубулин) в HCAEC (слева) и HITAEC (справа), к монослою которых на 24 ч перекрестно добавляли кондиционированную в течение 24 ч среду от монослоя клеток от тех же самых доноров (после центрифугирования при 3000 g для очистки от грубого клеточного дебриса). Иммуноблоттинг (антитела кролика к VCAM1 (ab134047, 1 : 1000, Abcam), ICAM1 (ab109361, 1 : 1000, Abcam), ZEB1 (ab203829, 1 : 200, Abcam), CD31 (ab9498, 1 : 1000, Abcam), антитела мыши к каспазе-3 (ab208161, 1 : 250, Abcam) и глицеральдегид-3-фосфат-дегидрогеназе (GAPDH, ab139416, 1 : 250, Abcam), антитела козла к бета-тубулину (ab21057, 1 : 1000, Abcam). Вторичные антитела козла против кролика (7074, Cell Signaling Technology, 1 : 200), козла против мыши (AP130P, Sigma-Aldrich, 1 : 1000) и осла против козла (ab205723, Abcam, 1 : 400), реагент для хемилюминесцентной детекции SuperSignal West Pico PLUS (34580, Thermo Scientific).

Отсутствие видимых различий в экспрессии указанных белков между экспериментальными группами свидетельствовало о том, что кондиционированная среда от артериальных или венозных эндотелиальных клеток при добавлении к артериальным эндотелиальным клеткам не вызывает резких изменений уровня провоспалительных молекул клеточной адгезии или выраженной запрограммированной клеточной гибели.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В клинической практике выбор артериального или венозного кондуита для проведения коронарного шунтирования с учетом их структурных и функциональных особенностей играет определяющую роль для последующего клинического исхода (и качества жизни пациента после оперативного вмешательства) [11]. В сценарии гетеротопического функционирования, который сопровождается кардинальными изменениями гемодинамических условий, артериальные и венозные кондуиты могут оказывать совершенно различное влияние на шунтируемую КА [12] в рамках морфофункциональной системы “кондуит–артерия”. Концепция системы “кондуит–артерия” предлагает рассматривать хирургически соединенные коронарную артерию и артериальные/венозные кондуиты как единую и взаимно регулируемую систему, в основе которой лежат постоянные паракринные взаимодействия между кондуитом (как правило, БПВ или ВГА) и шунтируемой КА, физиологические или патологические эффекты которых определяют риск тромбоза и прогрессирование рестеноза или неоатеросклероза как в пораженной атеросклерозом КА, так и в изначально интактном кондуите [13]. В зависимости от выбора кондуитов формирование системы “кондуит–артерия” может происходить в виде создания артерио-артериального и венозно-артериального континуумов. По ранее полученным нашей группой данным, артерио-артериальный континуум является более благоприятным для поддержания коронарного гомеостаза в лучшей интеграции ВГА и КА на уровне эндотелиальных клеток за счет их взаимно благотворных паракринных взаимодействий, в то время как венозно-артериальный континуум между БПВ и КА может препятствовать развитию устойчивости соответствующих сосудов к атеросклерозу и рестенозу [10]. Концепция морфофункциональной системы “кондуит-артерия” позволяет рассматривать клинические проявления отдаленных послеоперационных осложнений в патофизиологической связи с природой кондуита, учитывая, что длительность его функционирования существенно различается в зависимости от его принадлежности к артериям или венам. Артериальные кондуиты в целом имеют более высокую долговременную проходимость: для ВГА она к 1-му году после коронарного шунтирования составляет 93–96%, через 5–7 лет – 88–98%, через ≥10 лет – 85–95%, для лучевой артерии – 89–92, 90–98, 89–91%, для правой желудочно-сальниковой артерии – 92–97, 80–90 и 62%, в то время как для БПВ – 81–98, 75–86 и 50–60% соответственно [14]. Причиной такого превосходства артерио-артериального континуума над венозно-артериальным может являться повышенное выделение ВГА атеропротективных молекул (NO и простациклина), препятствующих прогрессированию коронарного атеросклероза [15]. Сочетание благоприятных гистологических характеристик и атеропротективного физиологического профиля обеспечивает функциональную состоятельность артерио-артериального континуума даже в отдаленном периоде [13, 16], в то время как до 50% венозных кондуитов в рамках венозно-артериального континуума теряют свою проходимость в первые 5 лет [17]. Тем не менее, несмотря на общую устойчивость к липидной и воспалительной инфильтрации, у определенной доли пациентов артериальные кондуиты (в том числе ВГА) не справляются со своей задачей, вероятно, вследствие нарушенной регуляции функционирования сосудистых гладкомышечных клеток и их гиперпролиферации, возникающей вследствие их перехода с сократительного фенотипа на синтетический и являющейся субстратом для прогрессирования гипертрофии интимы [18]. Следует отметить, что различные патофизиологические сценарии не всегда тождественны неблагоприятным клиническим исходам. К примеру, сохранение нативного кровоснабжения коронарной артерии часто приводит к нарушению функционирования шунта, не приводящему к развитию клинических симптомов, а окклюзия кондуита ассоциирована с нелетальными неблагоприятными исходами, в отличие от повторной окклюзии коронарной артерии, которая достаточно часто заканчивается смертью пациента [19].
Атерогенный и атеропротективный сценарии в морфофункциональной системе “кондуит–артерия” в значительной степени управляются ангиокринными свойствами эндотелиальных клеток коронарной артерии и кондуитов, которые секретируют огромное количество биоактивных факторов и показывают высокую степень гетерогенности как в зависимости от направления дифференцировки кровеносных сосудов (артерии или вены), так и от их локализации внутри артериального русла (к примеру, КА и ВГА) [20]. В частности, HITAEC (эндотелиальные клетки ВГА) характеризуются повышенной экспрессией эндотелиальной синтазы монооксида азота eNOS [21] и самого монооксида азота (NO), являющегося одним из ключевых вазодилататоров, в ответ на воздействие сосудистого эндотелиального фактора роста (VEGF) [22]. Кроме этого, HITAEC также отличаются от HSaVEC (эндотелиальные клетки БПВ) повышенным уровнем циклического гуанозинмонофосфата (цГМФ), опосредующего вазодилатирующий эффект NO, простациклина (простагландина I2) и эндотелий-зависимого гиперполяризирующего фактора (EDHF) [23]. Такое многообразие вазоактивных факторов со стороны эндотелиальных клеток ВГА может приводить к различным паракринным эффектам, сопровождающимися гомеостатическими изменениями баланса про- и анти-ангиогенных молекул и про- и противовоспалительных цитокинов, в конечном счете способствуя физиологическому функционированию морфофункциональной системы “кондуит–артерия” в рамках артерио-артериального континуума. Одно из последних исследований показало, что в сравнении с БПВ, ВГА отличаются менее выраженным сократительным ответом на воздействие различных вазоконстрикторов (простагландинов E2 и F2α, фенилэфрина, лейкотриенов C4 и D, хлорида калия и арахидоновой кислоты), однако при этом характеризуются более выраженной ацетилхолин-индуцированной вазорелаксацией [24]. Следует отметить отсутствие ясного понимания того, какие именно цитокины или метаболиты могут способствовать развитию вышеупомянутых атерогенного и атеропротективного сценариев. Для ответа на этот вопрос следовало бы провести протеомное профилирование совокупности выделяемых эндотелиальных клеток в микроокружение молекул (секретома) при помощи жидкостной хроматографии, совмещенной с тандемной масс-спектрометрией, однако данный подход является достаточно сложным и дорогим. С этой целью предпочтительным подходом для изначального анализа является скрининговое полуколичественное исследование при помощи дот-блоттинга (позволяющее определять содержание определенных функциональных классов молекул, к примеру, про- и противовоспалительных или про- и анти-ангиогенных) с последующей верификацией дифференциально экспрессированных молекул при помощи количественного иммуноферментного анализа.
В данном исследовании было проведено in vitro моделирование взаимодействий между эндотелиальными клетками кондуитов (HITAEC и HSaVEC) и эндотелиальными клетками КА (HCAEC) в контексте имитации артерио-артериального и венозно-артериального континуумов системы “кондуит–артерия”. Для этой цели было произведено перекрестное добавление кондиционированной среды к интактному монослою соответствующих эндотелиальных клеток с последующим измерением экспрессии ключевых эндотелиальных генов и белков, включая некоторые секретируемые ими факторы, с целью определения изолированного (в отличие от ранее примененной модели прямого сокультивирования [10]) влияния артериальных и венозных эндотелиальных клеток друг на друга. Результаты были проанализированы при помощи профилирования генной экспрессии (используя оригинальную панель генов для определения дисфункции эндотелия) методом ОТ-кПЦР, классического иммуноблоттинга, а также дот-блоттинга и иммуноферментного анализа секретируемых эндотелиальных клеток в микроокружение молекул в соответствии с указанным выше методологическим подходом.
Проведенные эксперименты позволили сделать следующие выводы:
Анализ генной экспрессии показал, что добавление культуральной среды от HITAEC снижало выраженность стимулирующего клеточную адгезию провоспалительного ответа в HCAEC, в то время как добавление культуральной среды от HSaVEC, напротив, активировало транскрипцию в HCAEC генов провоспалительных цитокинов. В свою очередь, добавление культуральной среды от HCAEC способствовало поддержанию эндотелиального фенотипа HITAEC. Кондиционированная среда от артериальных эндотелиальных клеток стимулировала выделение про-ангиогенных молекул при воздействии на HCAEC и HSaVEC, но не HITAEC. Добавление кондиционированной среды от HSaVEC приводило к статистически значимому снижению концентрации интерлейкина-6 во всех трех сценариях.
1. Взаимодействие артериальных эндотелиальных клеток в модели HITAEC (среда)–HCAEC (клетки) препятствует их провоспалительной активации на уровне транскрипции рецепторов эндотелиальных клеток к лейкоцитам (VCAM1, ICAM1, SELE, SELP) и генов провоспалительных цитокинов (CXCL8, CCL2, CXCL1) и поддерживает эндотелиальный фенотип HITAEC, снижая транскрипцию генов транскрипционных факторов эндотелиально-мезенхимального перехода (SNAI1, SNAI2, TWIST1);
2. Артериальные эндотелиальные клетки обладают выраженной про-ангиогенной активностью в моделях HITAEC (среда)–HCAEC (клетки) и HCAEC (среда)–HSaVEC (клетки);
3. Венозные эндотелиальные клетки (HSaVEC) могут обладать противовоспалительным потенциалом в отношении подавления транскрипции гена IL6 и снижения выделения кодируемого им провоспалительного цитокина интерлейкина-6 в микроокружение, что может иметь патофизиологическую значимость, учитывая повышенный базовый уровень выделения интерлейкина-6 HCAEC в сравнении с HITAEC и HSaVEC.
Таким образом, проведенные в данной работе эксперименты позволили предоставить патофизиологическое обоснование функциональных последствий взаимодействия эндотелиальных клеток КА (HCAEC), эндотелиальных клеток ВГА (HITAEC) и эндотелиальных клеток БПВ (HSaVEC) в рамках концепции морфофункциональной системы “кондуит–артерия”. Следует отметить, что полученные результаты частично проливают свет на паракринные эффекты эндотелиальных клеток в рамках как артерио-артериального, так и венозно-артериального континуума (в частности, подчеркивая вероятный противовоспалительный потенциал HSaVEC). Клиническая релевантность проведенного исследования заключается в наличии соответствующего хирургического сценария множественного коронарного шунтирования, при котором КА с окклюзионно-стенотическим поражением соединяется c кондуитом (шунтом), в качестве которого выступает ВГА или БПВ, получая таким образом кровь из артериального бассейна (аорта или подключичная артерия). В госпитальном периоде, как правило, венозные кондуиты по эффективности не уступают артериальным (поскольку их забор и манипуляции с ними при выполнении оперативного вмешательства существенно проще и сопряжены с меньшим риском развития инфекционных осложнений), однако в отдаленном периоде артериальное шунтирование имеет свои преимущества вследствие большей устойчивости артериальных кондуитов к атеросклерозу, тромбозу и рестенозу в гетеротопической позиции.
Проведенные в ходе данного проекта патофизиологические изыскания не позволяют сделать однозначного вывода в пользу фундаментального обоснования выбора того или иного шунта, поскольку паракринные взаимодействия между артериальными эндотелиальными клетками более благотворны в отношении регенеративного ангиогенеза и поддержания артериального эндотелиального фенотипа, а венозные эндотелиальные клетки могут паракринно снижать провоспалительную активацию артериального эндотелия за счет меньшего выделения провоспалительных цитокинов. Вероятно, дальнейшая расшифровка патофизиологических сценариев, происходящих внутри артерио-артериального и венозно-артериального континуумов морфофункциональной системы “кондуит–артерия”, требует протеомного профилирования (в первую очередь секретома эндотелиальных клеток, то есть совокупности выделяемых ими в микроокружение молекул) при помощи масс-спектрометрических подходов с последующей верификацией дифференциально экспрессированных молекул посредством иммуноферментного анализа.
Список литературы
dela Paz NG, D’Amore PA (2009) Arterial versus venous endothelial cells. Cell Tissue Res 335(1): 5–16. https://doi.org/10.1007/s00441-008-0706-5
Rafii S, Butler JM, Ding BS (2016) Angiocrine functions of organ-specific endothelial cells. Nature 529(7586): 316–325. https://doi.org/10.1038/nature17040
Verrier ED, Boyle EM Jr (1996) Endothelial cell injury in cardiovascular surgery. The Ann Thorac Surg 62(3): 915–922. https://doi.org/10.1016/s0003-4975(96)00528-0
Augustin HG, Koh GY (2017) Organotypic vasculature: From descriptive heterogeneity to functional pathophysiology. Science (New York) 357(6353): eaal2379. https://doi.org/10.1126/science.aal2379
Zeff RH, Kongtahworn C, Iannone LA, Gordon DF, Brown TM, Phillips SJ, Skinner JR, Spector M (1988) Internal mammary artery versus saphenous vein graft to the left anterior descending coronary artery: prospective randomized study with 10-year follow-up. Ann Thorac Surg 45(5): 533–536. https://doi.org/10.1016/s0003-4975(10)64526-2
Ray FR, Huang W, Slater M, Barden JA (2002) Purinergic receptor distribution in endothelial cells in blood vessels: a basis for selection of coronary artery grafts. Atherosclerosis 162(1): 55–61. https://doi.org/10.1016/S0021-9150(01)00681-5
Wadey K, Lopes J, Bendeck M, George S (2018) Role of smooth muscle cells in coronary artery bypass grafting failure. Cardiovasc Res 114(4): 601–610. https://doi.org/10.1093/cvr/cvy021
Hadinata IE, Hayward PA, Hare DL, Matalanis GS, Seevanayagam S, Rosalion A, Buxton BF (2009) Choice of conduit for the right coronary system: 8-year analysis of Radial Artery Patency and Clinical Outcomes trial. Ann Thorac Surg 88(5): 1404–1409. https://doi.org/10.1016/j.athoracsur.2009.06.010
Lytle BW, Loop FD, Cosgrove DM, Ratliff NB, Easley K, Taylor PC (1985) Long-term (5 to 12 years) serial studies of internal mammary artery and saphenous vein coronary bypass grafts. J Thorac Cardiovasc Surg 89(2): 248–258.
Shishkova D, Markova V, Sinitsky M, Tsepokina A, Frolov A, Zagorodnikov N, Bogdanov L, Kutikhin A (2020) Co-Culture of Primary Human Coronary Artery and Internal Thoracic Artery Endothelial Cells Results in Mutually Beneficial Paracrine Interactions. Int J Mol Sci 21(21): 8032. https://doi.org/10.3390/ijms21218032
Dimeling G, Bakaeen L, Khatri J, Bakaeen FG (2021) CABG: When, why, and how? Cleve Clin J Med 88(5): 295–303. https://doi.org/10.3949/ccjm.88a.20115
Alizadehghobadi S, Biglari H, Niroomand-Oscuii H, Matin MH (2021) Numerical study of hemodynamics in a complete coronary bypass with venous and arterial grafts and different degrees of stenosis. Comput Methods Biomech Biomed Engin 24(8): 883–896. https://doi.org/10.1080/10255842.2020.1857744
Фролов АВ (2019) Морфофункциональная система “кондуит-артерия”. Комплексные проблемы сердечно-сосудистых заболеваний 8(1): 112–122. [Frolov AV (2019) Morphological and functional system of graft-artery junctions. Complex Issues of Cardiovascular Diseases 8(1): 112–122. (In Russ)]. https://doi.org/10.17802/2306-1278-2019-8-1-112-122
Gaudino M, Antoniades C, Benedetto U, Deb S, Di Franco A, Di Giammarco G, Fremes S, Glineur D, Grau J, He GW, Marinelli D, Ohmes LB, Patrono C, Puskas J, Tranbaugh R, Girardi LN, Taggart DP, ATLANTIC (Arterial Grafting International Consortium) Alliance (2017) Mechanisms, Consequences, and Prevention of Coronary Graft Failure. Circulation 136(18): 1749–1764. https://doi.org/10.1161/CIRCULATIONAHA.117.027597
Kitamura S (2011) Physiological and metabolic effects of grafts in coronary artery bypass surgery. Circ J 75(4): 766–772. https://doi.org/10.1253/circj.cj-10-1302
Carrel T, Winkler B (2017) Current trends in selection of conduits for coronary artery bypass grafting. Gen Thorac Cardiovasc Surg 65(10): 549–556. https://doi.org/10.1007/s11748-017-0807-8
Калинин РЕ, Сучков ИА, Пшенников АС, Виноградов СА (2019) Маркеры артериовенозной дифференцировки эндотелиальных клеток и их влияние на адаптацию аутовенозных кондуитов в реконструктивной хирургии магистральных артерий. Новости хирургии 27(1):91–100. [Kalinin RE, Suchkov IA, Pshennikov AS, Vinogradov SA (2019) Markers of arteriovenous differentiation of endothelial cells and their influence on adaptation of autovenous conduits in main arteries reconstructive surgery. Surgery News 27(1): 91–100. (In Russ)]. https://doi.org/10.18484/2305-0047.2019.1.91
Malinska A, Podemska Z, Sujka-Kordowska P, Witkiewicz W, Nowicki M, Perek B, Witt M (2017) Caveolin 2: a facultative marker of unfavourable prognosis in long-term patency rate of internal thoracic artery grafts used in coronary artery bypass grafting. Preliminary report. Interact Cardiovasc Thorac Surg 24(5): 714–720. https://doi.org/10.1093/icvts/ivw411
Gaudino M, Di Franco A, Bhatt DL, Alexander JH, Abbate A, Azzalini L, Sandner S, Sharma G, Rao SV, Crea F, Fremes SE, Bangalore S (2021) The association between coronary graft patency and clinical status in patients with coronary artery disease. Eur Heart J 42(14): 1433–1441. https://doi.org/10.1093/eurheartj/ehab096
Spadaccio C, Antoniades C, Nenna A, Chung C, Will R, Chello M, Gaudino M (2020) Preventing treatment failures in coronary artery disease: what can we learn from the biology of in-stent restenosis, vein graft failure, and internal thoracic arteries? Cardiovasc Res 116(3): 505–519. https://doi.org/10.1093/cvr/cvz214
Gaudino M, Toesca A, Maggiano N, Pragliola C, Possati G (2003) Localization of nitric oxide synthase type III in the internal thoracic and radial arteries and the great saphenous vein: a comparative immunohistochemical study. J Thorac Cardiovasc Surg 125(6): 1510–1515. https://doi.org/10.1016/S0022-5223(03)00029-1
Broeders MA, Doevendans PA, Maessen JG, van Gorsel E, Egbrink MG, Daemen MJ, Tangelder GJ, Reneman RS, van der Zee R (2001) The human internal thoracic artery releases more nitric oxide in response to vascular endothelial growth factor than the human saphenous vein. J Thorac Cardiovasc Surg 122(2): 305–309. https://doi.org/10.1067/mtc.2001.113602
Tadjkarimi S, O’Neil GS, Luu TN, Allen SP, Schyns CJ, Chester AH, Yacoub MH (1992) Comparison of cyclic GMP in human internal mammary artery and saphenous vein: implications for coronary artery bypass graft patency. Cardiovasc Res 26(3): 297–300.
Ozen G, Aljesri K, Turkyilmaz G, Turkyilmaz S, Kavala AA, Topal G, Norel X (2022) Comparative study of coronary artery bypass graft materials: reduced contraction and ADMA levels in internal mammary artery versus saphenous vein. J Cardiovasc Surg (Torino) 63(1): 69–77. https://doi.org/10.23736/S0021-9509.21.11796-3
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


