Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 9, стр. 1222-1238
Экспериментальное исследование нейропротективного эффекта ингибиторов натрий-глюкозного котранспортера 2-го типа
А. В. Симаненкова 1, 2, *, О. С. Фукс 1, Н. В. Тимкина 1, 2, Т. Л. Каронова 1, 2, Д. Л. Цыба 3, О. В. Кирик 3, Д. Э. Коржевский 3, Т. Д. Власов 2
1 Национальный медицинский исследовательский центр им. В.А. Алмазова
Министерства здравоохранения Российской Федерации
Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет
им. акад. И.П. Павлова Министерства здравоохранения Российской Федерации
Санкт-Петербург, Россия
3 Институт экспериментальной медицины
Санкт-Петербург, Россия
* E-mail: annasimanenkova@mail.ru
Поступила в редакцию 23.06.2022
После доработки 01.08.2022
Принята к публикации 10.08.2022
- EDN: GDUCVJ
- DOI: 10.31857/S0869813922090035
Аннотация
Ингибиторы натрий-глюкозного котранспортера 2-го типа (иНГЛТ-2) обладают доказанными кардиопротективными свойствами, что делает этот класс препаратов одним из приоритетных в лечении пациентов с сахарным диабетом (СД) 2-го типа. Ишемический инсульт и хроническое нарушение мозгового кровообращения встречаются при СД с высокой частотой, что обусловливает актуальность изучения нейротропных свойств иНГЛТ-2. Целью нашего исследования явилось изучение и сопоставление нейропротективного действия высокоселективного и-НГЛТ-2 эмпаглифлозина (ЭМПА) и низкоселективного иНГЛТ-2 канаглифлозина (КАНА) на модели острой ишемии головного мозга и изучение вероятного механизма влияния данных препаратов на головной мозг. На первом этапе ЭМПА и КАНА вводились крысам Вистар без СД в течение 7 дней до моделирования транзиторной фокальной 30-минутной ишемии головного мозга. Через 48 ч реперфузии оценивался неврологический дефицит по шкале Garcia, затем срезы мозга инкубировались в растворе трифенилтетразолия хлорида для изучения объема некроза. Объем повреждения ткани мозга в группах “ЭМПА” и “КАНА” не различался и был достоверно меньше, чем в группе контроля – у крыс, не получавших препаратов. При этом ни ЭМПА, ни КАНА не оказывали достоверного влияния на неврологический дефицит. На втором этапе мы моделировали СД 2-го типа (высокожировая диета и никотинамид + стрептозотоцин), через 4 нед. после чего была инициирована 8-недельная терапия ЭМПА и КАНА. По истечении срока терапии производилось иммуногистохимическое исследование ткани мозга. Развитие СД 2-го типа сопровождалось увеличением числа микроглиоцитов в СА1 зоне гиппокампа; терапия ЭМПА, но не КАНА, привела к уменьшению числа активированных микроглиоцитов. Таким образом, высокоселективный иНГЛТ-2 ЭМПА и низкоселективный иНГЛТ-2 КАНА обладают сходным инфаркт-лимитирующим эффектом при применении их в течение 7 дней до моделирования ишемии у крыс Вистар без СД. Эффект ЭМПА в отношении головного мозга при СД может быть частично обусловлен уменьшением активации микроглии.
Сахарный диабет (СД) 2-го типа является независимым фактором риска развития сердечно-сосудистых заболеваний, таких как ишемическая болезнь сердца, в том числе инфаркт миокарда и ишемический инсульт. По данным Атласа Международной диабетической Федерации 2021 г., ишемический инсульт является одной из ведущих причин смерти больных СД 2-го типа [1]. Частота инсульта среди больных СД 2-го типа по разным данным в 2–6 раз выше, чем у лиц без СД [2]. СД 2-го типа приводит к развитию хронического нарушения мозгового кровообращения, которое, не вызывая очаговой неврологической симптоматики, проявляется когнитивными расстройствами той или иной степени выраженности.
Современные российские и зарубежные алгоритмы по лечению пациентов с СД 2-го типа [3, 4] рекомендуют в первую очередь отдавать предпочтение сахароснижающим препаратам с доказанной способностью уменьшать частоту сердечно-сосудистых событий. Так, у пациентов, имеющих сердечно-сосудистые заболевания атеросклеротического генеза, такие как инфаркт миокарда или острое нарушение мозгового кровообращения (ОНМК) в анамнезе, сердечную недостаточность или даже совокупность факторов сердечно-сосудистого риска, препаратами выбора будут ингибиторы натрий-глюкозного котранспортера 2-го типа (иНГЛТ-2) и агонисты рецепторов глюкагоноподобного пептида-1 (аГПП-1).
В настоящее время известно, что среди широкого многообразия имеющихся на фармакологическом рынке сахароснижающих лекарственных средств только дулаглутид и семаглутид, относящиеся к длительно действующим аГПП-1, способны достоверно уменьшать риск развития ишемического инсульта [5, 6].
Препараты из группы иНГЛТ-2, будучи одними из передовых классов сахароснижающих лекарственных средств с точки зрения кардиопротекции, не продемонстрировали достоверного нейропротективного эффекта в плане влияния на частоту инсультов. По данным большинства мета-анализов, эффекты данной группы препаратов можно считать нейтральными одинаково в отношении как фатальных, так и нефатальных инсультов, а также относительно влияния на частоту развития инсультов в целом. В то же время, примечательно, что наблюдаются некоторые различия во влиянии препаратов на частоту различных подтипов инсультов. В мета-анализе 2021 г. производилось сопоставление результатов международных рандомизированных исследований и было показано, что ни один из исследуемых иНГЛТ-2 не привел к уменьшению частоты развития ишемического инсульта и транзиторных ишемических атак. В то же время терапия канаглифлозином (КАНА), по данным исследования CANVAS, привела к снижению риска геморрагического инсульта (RR = 0.434, 95% CI 0.207–0.912, p = 0.027) [7].
Кроме того, в последние годы появляется все больше сведений о положительном влиянии иНГЛТ-2 на риск развития нарушений ритма, в частности фибрилляции предсердий. Результаты мета-анализа 2021 г. показали, что применение иНГЛТ-2 ассоциировано со снижением риска фибрилляции предсердий на 18% (RR 0.82, 95% CI 0.70–0.96) и закономерно сопровождается уменьшением риска кардио-эмболического подтипа ишемического инсульта на 68% (RR 0.32, 95% CI 0.12–0.85), по сравнению с плацебо [8].
Таким образом, сведения о потенциальном нейропротективном эффекте иНГЛТ-2 на данный момент немногочисленны и частично противоречивы. Однако предпосылки к наличию такого эффекта у данного класса сахароснижающих препаратов есть и обусловлены их широким защитным профилем в отношении сердечно-сосудистой системы, а также экспрессией натрий-глюкозного котранспортера как первого, так и второго типа в ткани головного мозга и в эндотелии сосудов [9].
Целью нашей работы стало изучение потенциального нейропротективного эффекта высокоселективного иНГЛТ-2 эмпаглифлозина (ЭМПА) и низкоселективного иНГЛТ-2 канаглифлозина (КАНА) в условиях острой ишемии головного мозга и исследование механизмов положительного влияния данных препаратов на головной мозг при сахарном диабете 2-го типа.
МЕТОДЫ ИССЛЕДОВАНИЯ
Соблюдении биоэтических норм
Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям Комиссии по контролю содержания и использования лабораторных животных (IACUC) Национального медицинского исследовательского цента им. В.А. Алмазова.
Проведенное нами исследование включало два этапа.
На первом этапе мы изучали потенциальные защитные свойства иНГЛТ-2 при введении их в течение 7 дней до моделирования ишемического инсульта животным без нарушений углеводного обмена. Такой дизайн исследования позволяет создать “чистую” модель ОНМК и феноменологически подтвердить наличие у препарата самостоятельного нейропротективного эффекта, не связанного с его положительным влиянием на гликемический профиль.
Задачей второго этапа было изучение возможных механизмов реализации нейротропного эффекта высоко- и низкоселективных иНГЛТ-2. Для этого мы воспроизводили СД 2-го типа, рассматривая его как модель хронического повреждения головного мозга. Мы отказались от попытки исследования нейропротективных свойств препаратов на фоне моделирования острой ишемии, так как механизмы защиты в условиях острого состояния принципиально сходны и сводятся преимущественно к противовоспалительному, антиапоптотическому и другим эффектам. Механизмы же реализации защитного эффекта препаратов именно в условиях хронического повреждения представляют научный и практический интерес.
Первый этап
Исследование проводилось на крысах-самцах стока Вистар (масса 420–470 г), n = 32.
Крысы содержались не более, чем по 5 голов в одной клетке при неограниченном потреблении корма и воды, при фиксированном световом режиме 12.00 : 12.00 ч (свет : темнота). Температура поддерживалась в пределах 22–25°С, относительная влажность – 50–70%.
Длительность карантина (акклиматизационного периода) для всех животных составляла 14 дней. В течение карантина проводился ежедневный осмотр каждого животного. Оценивались окраска кожи и видимых слизистых, поведение, характер двигательной активности, наличие судорог, изменение характера дыхательных движений, положение хвоста. Взвешивание производилось при поступлении животных и в период карантина – не реже 1 раза в неделю. Животные, имевшие отклонения по массе тела, общему состоянию или поведению, не были включены в эксперимент.
Были сформированы следующие группы животных:
• Группа “КОНТРОЛЬ” (n = 12) – введение 0.9%-ного раствора NaCl 1 мл per os, 1 раз в день, 7 дней до ишемии мозга;
• Группа “ЭМПА” (n = 8) – терапия эмпаглифлозином per os 2 мг/кг, 1 раз в день, 7 дней до ишемии мозга;
• Группа “КАНА” (n = 8 ) – терапия канаглифлозином per os 25 мг/кг, 1 раз в день, 7 дней до ишемии мозга.
Ежедневно в одно и то же время производилось измерение массы тела крыс всех групп, а также массы потребляемого корма.
Кроме того, трехкратно (на второй, четвертый и шестой дни эксперимента) производилось определение уровня гликемии. Гликемия оценивалась в одно и то же время, при этом животное находилось на свободном потреблении корма. Производилась пункция хвостовой вены, после чего содержание глюкозы в полученной капле венозной крови определялось при помощи прибора определения гликемии и кетонемии StatStrip (Nova Biomedical, США). Нормальными считались значения гликемии от 3.3 до 7.8 ммоль/л, поскольку измерение производилось в течение дня (не натощак).
Транзиторная фокальная ишемия головного мозга воспроизводилась по достижении хирургической стадии наркоза (Золетил + Ксилазин в/м) с помощью модели транзиторной окклюзии левой средней мозговой артерии по методике Koizumi с соавт. в модификации Longa [10]. Методика заключается во введении окклюдера – нити длиной 20–22 мм (Doccol Corporation, США) во внутреннюю сонную артерию на глубину 20–22 мм до места отхождения средней мозговой артерии, устье которой перекрывается вводимым окклюдером. В результате введения нити происходит ишемизация мозга в бассейне левой средней мозговой артерии. Верификация снижения регионарного кровотока на фоне окклюзии осуществлялась при помощи допплерографии (Минимакс-Допплер-К модель НБ, Россия). Доступ к корковой ветви левой средней мозговой артерии производился через трепанационное окно. Уменьшение линейной скорости кровотока на 70% и более по сравнению с исходной свидетельствовало о наличии ишемии в исследуемом бассейне. Длительность окклюзии составляла 30 мин, после чего нить извлекалась, рана ушивалась.
Во время проведения оперативного вмешательства, а также в послеоперационном периоде до момента прекращения действия наркоза производился динамический контроль гликемии при помощи повторных пункций хвостовой вены, а также контроль ректальной температуры животного, которая поддерживалась на уровне 37.0°C при помощи терморегулирующего столика.
После моделирования ишемии (с момента выхода из наркоза) каждое животное было помещено в отдельную клетку.
В течение последующих двух суток (48 ч) не менее 3 раз в сутки осуществлялось определение гликемии по указанной выше методике.
Животные всех групп в течение реперфузионного периода получали 1 мл 0.9%-ного раствора NaCl per os 1 раз в день. Введение исследуемых препаратов было прекращено, так как целью исследования было изучение их протективных свойств только при применении до инсульта, в качестве агентов прекондиционирования.
Через 48 ч реперфузии во всех группах оценивался неврологический дефицит по шкале Garcia [11]. Данная шкала включает параметры, позволяющие выявлять сенсорные и моторные нарушения у животных, перенесших фокальную ишемию головного мозга в бассейне левой средней мозговой артерии. В соответствии с данной шкалой здоровое животное имеет 18 баллов, в то время как максимально выраженный неврологический дефицит характеризуется 3 баллами (табл. 1).
После оценки неврологического дефицита производилось извлечение материала головного мозга для определения объема повреждения при помощи окраски срезов мозга 1%-ным раствором трифенилтетразолия хлорида. Для этого изготавливались пять срезов головного мозга толщиной 2 мм. Срезы мозга инкубировались в 1%-ном растворе трифенилтетразолия хлорида (MP Biomedicals, США) в течение 15 мин при температуре 37°С и рН 7.4. После инкубации обе поверхности всех срезов фотографировались цифровой камерой Olympus C-4000, сопряженной с помощью микрофотографического устройства с микроскопом МБС10 (ЛОМО, Санкт-Петербург). Цифровые изображения срезов в последующем обрабатывались компьютерным методом с помощью программ ImageJ, Adobe Photoshop 8.0, которые позволяют рассчитать площадь зоны некроза. Затем при помощи суммации результата по всем срезам вычислялся объем повреждения мозга,по отношению к общему объему мозга (в %).
Таблица 1.
Шкала оценки неврологического дефицита J.H. Garcia (адаптировано из [11])
| Параметр | Количество баллов | |||
|---|---|---|---|---|
| 0 | 1 | 2 | 3 | |
| Спонтанная активность (в клетке в течение 5 мин) | Движения отсутствуют | Едва двигается | Двигается, но не приближается по крайней мере к трем сторонам клетки | Двигается и достигает по крайней мере трех сторон клетки |
| Симметричность движений (4 конечности) | Правая сторона: отсутствует движение | Правая сторона: небольшое движение | Правая сторона: двигается медленно | Обе стороны двигаются симметрично |
| Симметричность предплечий (крыса вытягивает конечности, когда ее держат за хвост) | Правая сторона: отсутствует движение, отсутствует вытягивание конечностей | Правая сторона: небольшое движение, чтобы вытянуть конечности | Правая сторона: двигается и пытается вытянуть конечность меньше, чем с левой стороны | Симметричные вытягивания |
| Забирается по стенке проволочной клетки | – | Не удается забраться | Правая сторона слабая | Нормально забирается |
| Реакция на прикосновение к каждой стороне туловища | – | Отсутствует ответ с правой стороны | Слабый ответ с правой стороны | Симметричный ответ |
| Ответ на прикосновение к вибриссам | – | Отсутствует ответ с правой стороны | Слабый ответ с правой стороны | Симметричный ответ |
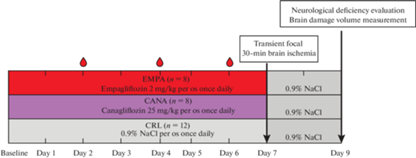
Дизайн первого этапа исследования представлен на рис. 1.
Рис. 1.
Дизайн первого этапа эксперимента.  – взятие крови из хвостовой вены для определения гликемии. Transient focal 30-min
brain ischemia – транзиторная фокальная 30-минутная ишемия мозга. Neurological deficiency
evaluation – оценка неврологического дефицита. Brain damage volume measurement – измерение
объема повреждения мозга.
– взятие крови из хвостовой вены для определения гликемии. Transient focal 30-min
brain ischemia – транзиторная фокальная 30-минутная ишемия мозга. Neurological deficiency
evaluation – оценка неврологического дефицита. Brain damage volume measurement – измерение
объема повреждения мозга.
Второй этап
На втором этапе исследования крысы-самцы стока Вистар, n = 25, (масса 200–255 г) по истечении акклиматизационного периода (14 дней) в течение 28 дней содержались на диете с высоким содержанием насыщенных жиров (22%) – общая экспериментальная группа.
Через 4 недели у всех животных определялась гликемия посредством пункции хвостовой вены, как описано выше, при помощи прибора определения гликемии и кетонемии StatStrip (Nova Biomedical, США), затем вводился раствор никотинамида (Nicotimamide, Sigma-Aldrich, St. Louis, MO, США) 230 мг/кг внутрибрюшинно в качестве панкреатопротектора, через 15 мин – раствор стрептозотоцина (Streptozocin, Sigma-Aldrich, St. Louis, MO, США) 60 мг/кг внутрибрюшинно в качестве панкреатотоксина [12].
В течение всего последующего эксперимента крысы общей экспериментальной группы продолжали находиться на диете с повышенным содержанием насыщенных жиров.
На вторые и третьи сутки после введения стрептозотоцина и никотинамида производилось определение гликемии по описанной методике. При выявлении в 2 измерениях, выполненных в разные дни, гликемии больше 11.1 ммоль/л диагностировался СД [13, 14]. При обнаружении меньших значений гликемии хотя бы в одном из измерений выполнялся пероральный глюкозотолерантный тест (ПГТТ). Измерение гликемии производилось исходно (натощак), а также через 15, 30 и 60 мин после зондового введения 40%-ного раствора глюкозы в расчете 3 г/кг массы тела животного. При определении гликемии натощак нормальными значениями считались до 6.1 ммоль/л, уровень 6.1–7.0 ммоль/л расценивался как “серая” зона, гликемия больше 7.0 ммоль/л натощак соответствовала критериям СД. При выявлении во время ПГТТ, после введения глюкозы, в любой из точек гликемии 11.1 ммоль/л и больше, при наличии или отсутствии гипергликемии натощак, диагностировался СД. При выявлении меньших значений данная патология не подтверждалась, и животные исключались из дальнейшего эксперимента.
Наблюдение за животными продолжалось еще 28 дней с момента индукции СД. При появлении на данном этапе симптомов, характерных для абсолютной инсулиновой недостаточности, то есть клинической картины СД 1-го типа (полидипсия, полиурия, интенсивная потеря массы тела), эти животные исключались из дальнейшего эксперимента.
Через 28 дней животные были разделены на группы (n = 5 в каждой):
• Группа “СД” – СД без лечения (56 дней);
• Группа “СД + ЭМПА” – терапия эмпаглифлозином per os 2 мг/кг 1 раз в день 56 дней;
• Группа терапия “СД + КАНА” – терапия канаглифлозином per os 25 мг/кг 1 раз в день 56 дней.
Также была создана группа здоровых животных “Контроль” (n = 5), которые находились на стандартном корме и не подвергались никаким интервенциям в течение всего эксперимента.
Во всех группах на протяжении всего эксперимента 1 раз в 2 дня измерялись масса животных и масса потребленного корма.
Через 8 недель проведения соответствующей терапии выполнялась эвтаназия, затем головной мозг животных аккуратно извлекали с сохранением мягкой мозговой и паутинной оболочек, фиксировали в цинк-этанол-формальдегиде [15], обезвоживали и заливали в парафин обычным способом. Морфологическому исследованию подвергали фронтальные срезы конечного мозга толщиной 5 мкм на уровне –3.36 мм ± 0.12 мм относительно брегмы согласно анатомического атласу [16].
Выявление микроглиоцитов в структурах переднего мозга осуществляли при помощи иммуноцитохимического маркирования с использованием козьих поликлональных антител к Iba-1 в разведении 1 : 1000 (Abсam, Великобритания). В качестве вторичных реагентов использовали набор VECTASTAIN Universal Quick HRP kit (Vector Labs, США). Пероксидазную метку выявляли с использованием диаминобензидинового хромогена (DAB+; Аgilent, США).
Дизайн второго этапа исследования показан на рис. 2.
Рис. 2.
Дизайн второго этапа исследования. CRL, Контроль – группа “КОНТРОЛЬ”, DM, СД – группа
“СД”, DM + EMPA, СД + ЭМПА – группа “СД + ЭМПА”, DM + CANA, СД + КАНА – группа “СД
+ КАНА”, N/A, Н/А – никотинамид, STR, СТР – стрептозотоцин.  – взятие крови из хвостовой вены для определения гликемии.
– взятие крови из хвостовой вены для определения гликемии. 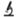 – иммуногистохимическое исследование головного мозга
– иммуногистохимическое исследование головного мозга

Статистический анализ
Статистическая обработка данных производилась при помощи программного пакета IBM SPSS Statistics-22 (IBM, США) и Statistica-10 (Statsoft, США). Статистический анализ производился при помощи непараметрических методов. Значимость различий между группами оценивалась с помощью непараметрического критерия Крускала–Уоллеса и Манна–Уитни для независимых выборок, с применением непараметрического дисперсионного анализа (апостериорное попарное сравнение групп при помощи критерия Данна). Все показатели представлены в виде “медиана (25%; 75%)”. Значения p меньше 0.05 рассматривались как значимые.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Первый этап
Применение как ЭМПА, так и КАНА у здоровых животных привело к замедлению физиологической прибавки массы тела по сравнению с контрольной группой, не получавшей терапии. При этом различий в динамике массы тела между группами “ЭМПА” и “КАНА” не было (рис. 3а).
Рис. 3.
Динамика массы тела и потребления корма у животных в ходе первого этапа исследования. (а) Динамика массы тела. (b) Динамика потребления корма. *– р < 0.05 по сравнению с группой “Контроль”, § – р < 0.05 между группами “ЭМПА” и “КАНА”.
Потребление корма у животных, получавших КАНА, первоначально имело тенденцию к снижению, однако с четвертого дня наблюдения, напротив, стало нарастать и достоверно превысило таковое в контрольной группе. На фоне терапии ЭМПА имела место противоположная тенденция. Так, первоначально потребление корма в этой группе было стабильно высоким, однако в дальнейшем стало снижаться (рис. 3b).
На фоне применения обоих иНГЛТ-2 в течение 7 дней у животных без СД уровень гликемии оставался в пределах нормы, эпизодов гипогликемии зафиксировано не было (табл. 2).
Таблица 2.
Уровень гликемии (ммоль/л) до моделирования ишемии головного мозга
| День 2 | День 4 | День 6 | |
|---|---|---|---|
| Группа “Контроль” | 5.6 (5.3; 7.3) | 5.0 (4.8; 6.8) | 5.2 (4.7; 7.0) |
| Группа “ЭМПА” | 5.3 (5.0; 7.0) | 4.9 (4.5; 6.9) | 5.1 (4.9; 7.1) |
| Группа “КАНА” | 5.1 (4.7; 7.2) | 5.0 (4.4; 6.0) | 5.9 (5.5; 6.3) |
Мониторинг гликемии во время оперативного вмешательства, моделирования транзиторной фокальной ишемии головного мозга, показал, что применение обоих иНГЛТ-2 предотвращает интраоперационную гипергликемию, имевшую место в контрольной группе на фоне применения наркоза. При этом эпизодов гипогликемии также зафиксировано не было (табл. 3).
Таблица 3.
Уровень гликемии (ммоль/л) во время моделирования ишемии головного мозга
| Измерение 1 | Измерение 2 | Измерение 3 | |
|---|---|---|---|
| Группа “Контроль” | 16.7 (14.5; 16.9) | 18.8 (12.8; 18.8) | 15.9 (12.5; 17.8) |
| Группа “ЭМПА” | 9.3 (6.6; 14.3)* | 7.1 (5.9; 11.7)* | 6.2 (4.5; 7.8)* |
| Группа “КАНА” | 11.6 (8.4; 15.1)* | 4.8 (4.5; 7.0)* | 10.4 (9.5; 11.0)* |
В табл. 4 представлены средние значения гликемии в течение первых и вторых суток в исследуемых группах. Необходимо отметить, что в течение первых суток, на фоне продолжавшегося действия наркоза, до восстановления сознания и возможности потреблять пищу, у 2 животных в группе “ЭМПА” и 3 животных в группе “КАНА” наблюдались эпизоды гипогликемии. Так, минимальные зафиксированные значения гликемии составили 2.8 и 3.1 ммоль/л в группах “ЭМПА” и “КАНА” соответственно. Это потребовало неотложных мероприятий по купированию гипогликемии – введения 5%-ного раствора глюкозы подкожно, а после восстановления сознания – 40%-ного раствора глюкозы через желудочный зонд. Эти животные были исключены из дальнейшего анализа. С учетом полученных данных, в последующем мы производили подкожное введение 5%-ного раствора глюкозы по окончании оперативного вмешательства для предотвращения гипогликемии, а также при появлении тенденции к низко-нормальной гликемии повторно в течение первых суток, до выхода из наркоза.
Таблица 4.
Уровень гликемии (ммоль/л) после моделирования ишемии головного мозга
| День 1 | День 2 | |
|---|---|---|
| Группа “Контроль” | 6.7 (5.5; 6.9) | 7.5 (6.8; 8.0) |
| Группа “ЭМПА” | 4.3 (4.3; 5.3) | 5.1 (4.5; 5.3) |
| Группа “КАНА” | 5.0 (4.8; 5.7) | 4.8 (4.5; 6.1) |
В связи с необходимостью исключения указанных пяти животных из эксперимента в дальнейшем группы “ЭМПА” и “КАНА” были дополнены еще двумя и тремя крысами соответственно – с целью сохранения исходно запланированного количества животных в группах.
При оценке выраженности неврологического дефицита при помощи шкалы Garcia мы не выявили достоверных различий между группами “ЭМПА”, “КАНА” и “Контроль” (рис. 4).
Рис. 4.
Неврологический статус, оценка по шкале Garcia [11]. Максимальный неврологический дефицит = 3 балла, здоровое животное = 18 баллов.

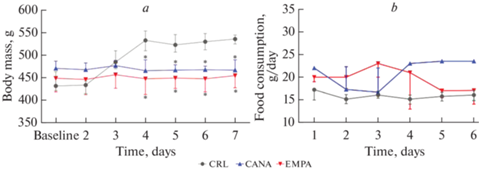
При этом применение как ЭМПА, так и КАНА в течение 7 дней до моделирования транзиторной фокальной ишемии головного мозга привело к достоверному уменьшению объема повреждения ткани мозга по сравнению с группой контроля. Достоверных различий в выраженности инфаркт-лимитирующего эффекта между группами “ЭМПА” и “КАНА” не было (рис. 5).
Рис. 5.
Объем повреждения мозга в результате моделирования транзиторной фокальной ишемии. (а) – размер инфаркта мозга, представленный в виде точечных графиков с медианой, (b) – репрезентативные срезы головного мозга. * – р < 0.05, по сравнению с группой “Контроль”.
Летальности в ходе проведения оперативного вмешательства и в послеоперационном периоде не было, в связи с чем из эксперимента выбыли только животные, у которых была зафиксирована гипогликемия (n = 5).
Второй этап
При моделировании СД в ходе проведения ПГТТ у одного животного не удалось зафиксировать нарушений углеводного обмена (уровень гликемии не выходил за пределы нормы натощак и во всех точках измерения после введения раствора глюкозы), у трех животных значения гликемии находились в “серой” зоне, что соответствовало нарушению толерантности к глюкозе. Эти животные были исключены из дальнейшего эксперимента. У одного животного после моделирования СД развилась симптоматика, характерная для СД 1-го типа (обильное потребление жидкости, полиурия и интенсивная потеря массы тела) – это животное также было исключено. Таким образом, опыт был продолжен на 20 крысах (по 5 крыс в каждой группе).
Развитие СД 2-го типа сопровождалось более интенсивным набором массы тела по сравнению с группой контроля с отсутствием нарушений углеводного обмена. При этом набор массы тела был сопоставим в группах “СД” и “СД + КАНА”, в то время как в группе “СД + ЭМПА” данный параметр был достоверно выше (рис. 6а). В то же время потребление корма было сходным в группах “СД” без лечения, а также на фоне обоих вариантов сахароснижающей терапии (в группах “СД + ЭМПА” и “СД + КАНА”) и превышало таковое в группе “Контроль” (рис. 6b).
Рис. 6.
Динамика массы тела и потребления корма в ходе второго этапа исследования. (а) – динамика массы тела. (b) – динамика потребления корма. * – р < 0.05 по сравнению с группой “Контроль”, § – р < 0.05 по сравнению с группой “СД”, # – р < 0.05 между группами “ЭМПА” и “КАНА”.

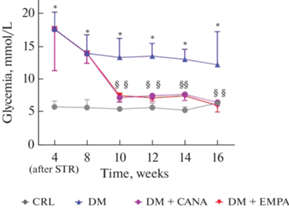
Уровень гликемии в группе “СД” был достоверно выше, чем в группе “Контроль” на протяжении всего эксперимента. Применение как ЭМПА, так и КАНА вызвало стойкую нормализацию гликемического профиля, достоверных различий между сахароснижающей эффективностью данных двух препаратов не было. Эпизодов гипогликемии не наблюдалось (рис. 7).
Рис. 7.
Динамика гликемии в ходе второго этапа исследования. STR – стрептозотоцин. * – р < 0.05 по сравнению с группой “Контроль”, § - р < 0.05 по сравнению с группой “СД”.
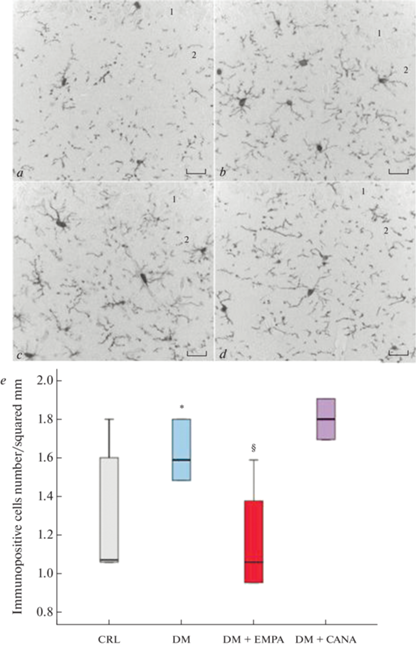
Иммуногистохимическое исследование с использованием специфического маркера микроглии Iba-1 выявило присутствие рамифицированной микроглии во всех областях головного мозга. Проведенный количественный анализ показал, что в зоне stratum radiatum СА1 области гиппокампа у животных группы “СД” количество клеток микроглии достоверно больше, чем у здоровых животных контрольной группы. Данная зона была выбрана для анализа в связи с тем, что нейроны области СА1 гиппокампа высокочувствительны к разного рода воздействиям. В зоне stratum radiatum проходят дендриты этих нейронов, на повреждение которых реагирует микроглия. Кроме того, изучаемая область имеет хорошо определяемые слои, что позволяет проводить сравнения данной области у разных животных.
Применение ЭМПА приводило к уменьшению числа клеток микроглии в исследуемой зоне по сравнению с группой “СД” – количество микроглиоцитов в группе “СД + ЭМПА” не отличалось от такового в контрольной группе. Терапия КАНА достоверно не повлияла на данный показатель (рис. 8).
Рис. 8.
Результаты иммуногистохимической реакции на микроглиальный маркер Iba-1. (a)–(d) – микрофотографии области CA1 гиппокампа (1) и stratum radiatum (2): (a) – “Контроль”, (b) – “СД”, (с) – “СД + КАНА”, (d) – “СД + ЭМПА”. Масштабный отрезок равен 20 мкм. (e) – количество Iba-1-иммунопозитивных клеток на 1 мм2 в зоне stratum radiatum области CA1 гиппокампа. * – р < 0.05 по сравнению с группой “Контроль”, § – р < 0.05 по сравнению с группой “СД”.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенное нами исследование показало, что иНГЛТ-2 при применении у здоровых животных без нарушений углеводного обмена способны нивелировать естественный прирост массы тела. В то же время мы отметили, что у крыс с СД терапия ЭМПА не вызывала снижения массы тела, приводя даже к некоторому ее приросту, чего не наблюдалось при применении КАНА. При этом потребление корма на фоне терапии ЭМПА и КАНА было сходным. Последнее может объясняться тем, что КАНА действует не только на уровне натрий-глюкозного котранспортера (НГЛТ) 2-го типа, но также и на уровне НГЛТ 1-го типа, уменьшая всасывание глюкозы в кишечнике [17]. Таким образом, КАНА, не уменьшая потребления корма, более значимо контролирует массу тела.
Мы не зафиксировали эпизодов гипогликемии при применении как ЭМПА, так и КАНА у крыс без СД на фоне отсутствия каких-либо вмешательств. В то же время в раннем постинсультном периоде у нескольких животных обеих групп были зарегистрированы эпизоды тяжелой гипогликемии, что потребовало их исключения из дальнейшего эксперимента. Данное состояние имело место до выхода животных из наркоза и, следовательно, до начала самостоятельного потребления пищи. Нам не удалось найти подтверждение подобного феномена в работах других авторов. Однако имеются единичные данные о том, что иНГЛТ-2 способны модулировать внутрипеченочные эффекты глюкагона, снижая активность и экспрессию глюкагонового рецептора [18], что может предрасполагать к снижению активности контринсулярного ответа и, тем самым, к развитию гипогликемии.
Наше исследование стало первым в своем роде, позволившим оценить и сопоставить нейропротективный эффект высоко- и низкоселективных иНГЛТ-2 на модели острой транзиторной ишемии головного мозга. Ранее подобные работы не проводились.
Протективное действие высокоселективного иНГЛТ-2 ЭМПА при остром повреждении головного мозга описано в работе 2020 г., в которой ишемия головного мозга у крыс с СД моделировалась при помощи 30-минутной двусторонней окклюзии обеих общих сонных артерий. Авторы сравнивали инфаркт-лимитирующий эффект ЭМПА и производного сульфонилмочевины гликлазида при введении их через 1 и 24 ч после начала реперфузии. Было показано, что применение ЭМПА позволяет достоверно уменьшить объем повреждения мозга и улучшить неврологический статус по сравнению с гликлазидом, что сопровождается уменьшением выраженности оксидативного стресса и воспаления [19]. В другой работе 2021 г. ЭМПА вводился внутрибрюшинно за 1 ч до моделирования ишемии у здоровых крыс без СД. Авторы показали, что применение ЭМПА способно оказывать антиоксидантный и противовоспалительный эффект, тем самым защищая головной мозг в условиях ишемического-реперфузионного повреждения. В то же время в данной работе не осуществлялась оценка потенциального инфаркт-лимитирующего действия препарата [20].
Данные о протективном эффекте КАНА при ишемии головного мозга в эксперименте нами найдены не были.
По результатам проведенного нами исследования ни ЭМПА, ни КАНА не оказали достоверного влияния на выраженность неврологического дефицита при оценке по шкале Garcia. Нельзя исключить, что примененная шкала не обладает достаточной степенью чувствительности при данном дизайне эксперимента, так как отражает только грубые нарушения сенсорной и моторной функции. Кроме того, возможно, определенный вклад в отсутствие полноценного функционального восстановления после инсульта внес низко-нормальный уровень гликемии в раннем постинсультном периоде. Крысы, у которых развилась гипогликемия, были исключены из эксперимента, остальным животным осуществлялась профилактика данного состояния, однако низко-нормальные значения гликемии до выхода животных из наркоза имели место. Вероятно, данный уровень гликемии был недостаточен для поддержания энергетических потребностей в условиях ишемического-реперфузионного повреждения.
В то же время, мы показали, что иНГЛТ-2 способны ограничивать объем повреждения головного мозга при пролонгированном применении до моделирования транзиторной ишемии вне зависимости от степени селективности их влияния на НГЛТ.
Известно, что селективность ЭМПА приблизительно в 10 раз больше селективности КАНА [21], который ингибирует не только НГЛТ 2-го типа, но также и НГЛТ 1‑го типа. НГЛТ 2-го типа экспрессируется преимущественно в проксимальных канальцах почек и ответственен за реабсорбцию около 90% глюкозы, попадающей в первичную мочу. НГЛТ 1-го типа представлен в слизистой оболочке тонкой кишки, в проксимальных канальцах почек, в миокарде, в капиллярах различных органов и тканей [17]. В последние годы появляется все больше данных об экспрессии обоих типов котранспортеров в ткани головного мозга. НГЛТ-1 представлен в пирамидных клетках коры, клетках Пуркинье мозжечка, в пирамидных и зернистых клетках гиппокампа [22]. Они также обнаруживаются в глиальных клетках вентромедиального отдела гипоталамуса [23]. НГЛТ-2 менее широко представлен в головном мозге и экспрессируется преимущественно в микрососудах гематоэнцефалического барьера, а также в области миндалевидного тела, гипоталамуса, ядра солитарного тракта [24, 25]. Кроме того, оба типа транспортеров обнаруживаются в эндотелии капилляров головного мозга [23]. Функция НГЛТ в головном мозге на настоящий момент остается предметом изучения, однако примечательно, что зоны, в которых обнаруживаются НГЛТ, ответственны за процесс обучения, за регуляцию потребления пищи, энергетический обмен, а также центральную регуляцию сердечно-сосудистой деятельности [25, 26]. НГЛТ 2-го типа, действуя в качестве глюкозного сенсора, в гипоталамусе ответственен за регуляцию цикла сна и бодрствования и аппетита [27].
Роль НГЛТ 1-го и 2-го типа в защите головного мозга в условиях повреждения, в том числе, ишемического-реперфузионного повреждения при инсульте или в условиях хронического нарушения мозгового кровообращения при СД 2 типа на настоящий момент изучена слабо.
Мы показали, что одним из механизмов воздействия иНГЛТ-2 на головной мозг при СД может быть уменьшение активации микроглии. Микроглия представляет собой резидентные макрофаги центральной нервной системы, основной регуляторный компонент барьерной системы головного мозга, в которую входят гематоэнцефалический, ликвороэнцефалический и гематоликворный барьеры. Количество наблюдаемых в очаге повреждения микроглиоцитов может отражать тяжесть поражения. Ранее было показано, что при диабетической ретинопатии происходит активация микроглиоцитов, что сопровождается гиперпродукцией провоспалительных факторов, что, в свою очередь, способствует прогрессированию ретинопатии [28]. Jackson и соавт. обнаружили прямую взаимосвязь между гиперактивацией микроглии и когнитивным снижением после перенесенного инсульта у животных с СД. В то же время подавление патологической гиперактивации микроглии способствует уменьшению воспаления, улучшает когнитивные функции после ишемии [29].
Результаты проведенного нами эксперимента показали, что количество микроглиоцитов в зоне stratum radiatum СА1 области гиппокампа при СД больше, чем у здоровых животных, в то время как терапия высокоселективным иНГЛТ-2 ЭМПА приводит к уменьшению количества данных иммунопозитивных клеток. Это позволяет предположить, что одним из механизмов нейропротективного действия ЭМПА при СД может быть противовоспалительный эффект, который, вероятно, преимущественно реализуется посредствам НГЛТ 2-го типа. Низкоселективный КАНА может реализовывать свой защитный эффект в отношении головного мозга другим путем. Так, к примеру, было показано, что КАНА способен ингибировать ацетилхолинэстеразу, что может приводить к улучшению когнитивной функции [30]. Кроме того, иНГЛТ-2 увеличивают концентрацию мозгового нейротрофического фактора (BDNF) в ткани головного мозга. Данный фактор отвечает за рост нейронов, их выживаемость, нейропластичность. Дополнительно, BDNF считается важным фактором, участвующим в процессах обучения и запоминания [31]. Показано, что при СД уровень BDNF снижается, что ассоциировано с развитием когнитивной дисфункции у этих больных [32].
Таким образом, мы впервые показали, что высокоселективные и низкоселективные иНГЛТ-2 обладают сходным инфаркт-лимитирующим эффектом в условиях острого ишемического-реперфузионного повреждения головного мозга. Одним из механизмов реализации нейропротективного эффекта высокоселективных иНГЛТ-2 может являться уменьшение активации микроглии.
Список литературы
IDF Diabetes Atlas 2021. Available at: https://diabetesatlas.org/
Bottle A (2009) Trends in cardiovascular admissions and procedures for people with and without diabetes in England 1996–2005. Diabetologia 52(1): 74–80. https://doi.org/10.1007/s00125-008-1170-1
Дедов ИИ, Шестакова МВ, Майоров АЮ (2021) Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Клин рекоменд 24(S1). [Dedov II, Shestakova MV, Mayorov AYu (2021) Standards of specialized diabetes care. Clin Recomend 22(S1). (In Russ)]. https://doi.org/10.14341/DM12802
Davies M, D’Alessio D, Fradkin J (2018) Management of hyperglycaemia in type 2 diabetes. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 61(12): 2461–2498. https://doi.org/10.2337/dci18-0033
Gerstein HC, Colhoun HM, Dagenais GR, Diaz R, Lakshmanan M, Pais P, Probstfield J, Riesmeyer JS, Riddle MC, Rydén L, Xavier D, Atisso CM, Dyal L, Hall S, Rao-Melacini P, Wong G, Avezum A, Basile J, Chung N, Conget I, REWIND Investigators (2019) Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet 394(10193): 121–130. https://doi.org/10.1016/S0140-6736(19)31149-3
Marso SP, Bain SC, Consoli A, Eliaschewitz FG, Jódar E, Leiter LA, Lingvay I, Rosenstock J, Seufert J, Warren ML, Woo V, Hansen O, Holst AG, Pettersson J, Vilsbøll T, SUSTAIN-6 Investigators (2016) Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. The New England J Med 375(19): 1834–1844. https://doi.org/10.1056/NEJMoa1607141
Tsai WH, Chuang SM, Liu SC, Lee CC, Chien MN, Leung CH, Liu SJ, Shih HM (2021) Effects of SGLT2 inhibitors on stroke and its subtypes in patients with type 2 diabetes: a systematic review and meta-analysis. Scient Rep 11(1): 15364. https://doi.org/10.1038/s41598-021-94945-4
Li HL, Lip G, Feng Q, Fei Y, Tse YK, Wu MZ, Ren QW, Tse HF, Cheung BY, Yiu KH (2021) Sodium-glucose cotransporter 2 inhibitors (SGLT2i) and cardiac arrhythmias: a systematic review and meta-analysis. Cardiovasc Diabetol 20(1): 100. https://doi.org/10.1186/s12933-021-01293-8
Pawlos A, Broncel M, Woźniak E, Gorzelak-Pabiś P (2021) Neuroprotective Effect of SGLT2 Inhibitors. Molecules 26(23): 7213. https://doi.org/10.3390/molecules26237213
Koizumi J, Yoshida Y, Nakazawa T, Ooneda G (1986) Experimental studies of ischemic brain edema: I: A new experimental model of cerebral embolism in which recirculation can introduced into the ischemic area. Jpn J Stroke 8(1): 1–8. https://doi.org/10.3995/jstroke.8.1
Garcia JH, Wagner S, Liu KF, Hu XJ (1995) Neurological deficit and extent of neuronal necrosis attributable to middle cerebral artery occlusion in rats. Statistical validation. Strokepr 26(4): 627–634. https://doi.org/10.1161/01.str.26.4.627
Bayrasheva VK, Babenko AY, Dobronravov VA, Dmitriev YV, Chefu SG, Pchelin IY, Ivanova AN, Bairamov AA., Alexeyeva NP, Shatalov IS, Grineva EN (2016) Uninephrectomized High-Fat-Fed Nicotinamide-Streptozotocin-Induced Diabetic Rats: A Model for the Investigation of Diabetic Nephropathy in Type 2 Diabetes. J Diabetes Res 8317850. https://doi.org/10.1155/2016/8317850
Adeyi AO, Idowu BA, Mafiana CF, Oluwalana SA, Ajayi OL, Akinloye OA (2012) Rat model of food-induced non-obese-type 2 diabetes mellitus: comparative pathophysiology and histopathology. Int J Physiol Pathophysiol Pharmacol 4(1): 51–58.
Zhang M, Lv XY, Li J, Xu ZG, Chen L (2008) The Characterization of High-Fat Diet and Multiple Low-Dose Streptozotocin Induced Type 2 Diabetes Rat Model. Exp Diabet Res 2008:704045. https://doi.org/10.1155/2008/704045
Korzhevskii DE, Sukhorukova EG, Kirik OV, Grigorev IP (2015) Immunohistochemical demonstration of specific antigens in the human brain fixed in zinc-ethanol-formaldehyde. Eur J Histochem 59(3): 2530. https://doi.org/10.4081/ejh.2015.2530
Paxinos G, Watson Ch (1998) The Rat Brain in Stereotaxic Coordinates. Fourth Edition. San Diego. Acad Press.
Yu AS, Hirayama BA, Timbol G, Liu J, Basarah E, Kepe V, Satyamurthy N, Huang S C, Wright EM, Barrio JR (2010) Functional expression of SGLTs in rat brain. Am J Physiol Cell Physiol 299(6): C1277–C1284. https://doi.org/10.1152/ajpcell.00296.2010
Wang MY, Yu X, Lee Y, McCorkle SK, Chen S, Li J, Wang ZV, Davidson JA, Scherer PE, Holland WL, Unger RH, Roth MG (2017) Dapagliflozin suppresses glucagon signaling in rodent models of diabetes. Proc Natl Acad Sci U S A 114(25): 6611–6616. https://doi.org/10.1073/pnas.1705845114
Amin EF, Rifaai RA, Abdel-Latif RG (2020) Empagliflozin attenuates transient cerebral ischemia/reperfusion injury in hyperglycemic rats via repressing oxidative-inflammatory-apoptotic pathway. Fundament Clin Pharmacol 34(5): 548–558. https://doi.org/10.1111/fcp.12548
Abed FN, Abbas EC, Al-Khalidi HA, AlMudhafar AM, Hadi NR (2021) Anti-inflammatory and antioxidant effect of Empagliflozin on cerebral ischemia/reperfusion injury in rat model. Eur J Mol Clin Med 7(1): 4324–4334.
Ndefo UA, Anidiobi NO, Basheer E, Eaton AT (2015) Empagliflozin (Jardiance): A Novel SGLT2 Inhibitor for the Treatment of Type-2 Diabetes. P T 40(6): 364–368.
Poppe R, Karbach U, Gambaryan S, Wiesinger H, Lutzenburg M, Kraemer M, Witte OW, Koepsell H (1997) Expression of the Na+-D-glucose cotransporter SGLT1 in neurons. J Neurochem 69(1): 84–94. https://doi.org/10.1046/j.1471-4159.1997.69010084.x
Koepsell H (2020) Glucose transporters in brain in health and disease. Pflugers Arch 472(9): 1299–1343. https://doi.org/10.1007/s00424-020-02441-x
Enerson BE, Drewes LR (2006) The rat blood-brain barrier transcriptome. J Cereb Blood Flow Metab 26(7): 959–973. https://doi.org/10.1038/sj.jcbfm.9600249
Nguyen T, Wen S, Gong M, Yuan X, Xu D, Wang C, Jin J, Zhou L (2020) Dapagliflozin Activates Neurons in the Central Nervous System and Regulates Cardiovascular Activity by Inhibiting SGLT-2 in Mice. Diabetes Metab Syndr Obes 13: 2781–2799. https://doi.org/10.2147/DMSO.S258593
Gaur A, Pal GK, Ananthanarayanan PH, Pal P (2014) Role of Ventromedial hypothalamus in high fat diet induced obesity in male rats: association with lipid profile, thyroid profile and insulin resistance. Ann Neurosci 21(3): 104–107. https://doi.org/10.5214/ans.0972.7531.210306
Al Hamed FA, Elewa H (2020) Potential Therapeutic Effects of Sodium Glucose-linked Cotransporter 2 Inhibitors in Stroke. Clin Ther 42(11): e242–e249. https://doi.org/10.1016/j.clinthera.2020.09.008
Kinuthia UM, Wolf A, Langmann T (2020) Microglia and Inflammatory Responses in Diabetic Retinopathy. Front Immunol 11: 564077. https://doi.org/10.3389/fimmu.2020.564077
Jackson L, Dumanli S, Johnson MH, Fagan SC, Ergul A (2020) Microglia knockdown reduces inflammation and preserves cognition in diabetic animals after experimental stroke. J Neuroinflammat 17(1): 137. https://doi.org/10.1186/s12974-020-01815-3
Rizvi SM, Shakil S, Biswas D, Shakil S, Shaikh S, Bagga P, Kamal MA (2014) Invokana (Canagliflozin) as a dual inhibitor of acetylcholinesterase and sodium glucose co-transporter 2: advancement in Alzheimer’s disease- diabetes type 2 linkage via an enzoinformatics study. CNS Neurol Disord Drug Targets 13(3): 447–451. https://doi.org/10.2174/18715273113126660160
Bathina S, Das UN (2015) Brain-derived neurotrophic factor and its clinical implications. Arch Med Sci 11(6): 1164–1178. https://doi.org/10.5114/aoms.2015.56342
Zhen YF, Zhang J, Liu XY, Fang H, Tian LB, Zhou DH, Kosten TR, Zhang XY (2013) Low BDNF is associated with cognitive deficits in patients with type 2 diabetes. Psychopharmacology (Berl) 227(1): 93–100. https://doi.org/10.1007/s00213-012-2942-3
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


