Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 9, стр. 1200-1221
Роль метаболического воспаления в развитии секреторного фенотипа клеток и когнитивной дисфункции у мышей при старении
Е. Д. Хилажева 1, О. С. Белозор 1, Ю. А. Панина 1, Я. В. Горина 1, А. И. Мосягина 1, А. В. Васильев 1, Н. А. Малиновская 1, Ю. К. Комлева 1, *
1 Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого Министерства здравоохранения РФ
Красноярск, Россия
* E-mail: yuliakomleva@mail.ru
Поступила в редакцию 05.07.2022
После доработки 17.08.2022
Принята к публикации 19.08.2022
- EDN: HNNEPW
- DOI: 10.31857/S0869813922090072
Аннотация
Старение организма характеризуется запуском многочисленных патофизиологических событий, которые включают воспаление, клеточную сенесценцию и развитие секреторного фенотипа, связанного со старением (SASP), измененную толерантность к глюкозе и инсулинорезистентность (ИР). Значительный вклад в развитие ИР головного мозга вносит нейровоспаление из-за активации мультипротеинового олигомерного комплекса – NLRP3 инфламмасомы. Целью исследования явилось изучение нарушения механизмов инсулиновой сигнализации и метаболического воспаления в головном мозге стареющих мышей линии C57BL/6. Мы обнаружили, что у стареющих мышей происходит повышение количества сенесцентных клеток в срезах головного мозга и сокультуре астроцитов и нейронов, а также увеличение экспрессии фосфорилированных протеинкиназ PKR и IKKβ – компонентов метафламмасом. Другим компонентом метафламмасомы, экспрессия которого усиливалась в гиппокампе при старении, была IKKβ. В нашем исследовании было показано, что конститутивная активация IKKβ связана с клеточной сенесценцией и старением, а также с избыточной активацией NLRP3 инфламмасомы и увеличением продукции лактата у стареющих мышей. Изменения экспрессии инфламмасом в головном мозге находят отражение в изменении сложных форм поведения. В данном исследовании зафиксировано нарушение контекстуальной памяти у стареющих мышей, но не процесса приобретения и сигнальной памяти. Тем не менее, старение у мышей не приводило к изменению в экспрессии инсулиновых рецепторов, субстрата инсулиновых рецепторов 1 (IRS1phospho-S312). Это позволяет предположить, что при физиологическом старении, без признаков нейродегенерации, реактивного астроглиоза, еще не наблюдается нарушений инсулиновой сигнализации, но уже наблюдаются проявления метаболического воспаления. Таким образом, модуляция активности компонентов метафламмасом PKR и IKKβ может быть основой нового подхода управления механизмами метаболического воспаления и развития cвязанного со старением секреторного фенотипа клеток в головном мозге для улучшения когнитивных функций в пожилом и старческом возрасте.
Известно, что за последние десятилетия продолжительность жизни человека значительно увеличилась [1]. Старение – это сложный процесс, который происходит под влиянием генетических, эпигенетических факторов и факторов окружающей среды, а изменения в стареющем организме происходят на молекулярном, клеточном и тканевом уровнях [2]. Некоторые из этих процессов, определяющих старение, включают воспаление, клеточную сенесценцию и развитие секреторного фенотипа, связанного со старением (SASP), измененную толерантность к глюкозе и инсулинорезистентность (ИР) в результате дизрегуляции чувствительности к питательным веществам и нарушениями межклеточной коммуникации [3]. Все эти патофизиологические процессы лежат в основе возрастных нейродегенеративных расстройств [4].
Иммунносенесценция и воспаление, связанное с самим старением, ассоциированы и со старением головного мозга. Эти процессы сопровождаются нарушением памяти и развитием когнитивной дисфункции, характерных для болезни Альцгеймера (БА) и болезни Паркинсона (БП) [1, 2]. В последнее время большое количество исследований было сосредоточено на изучении взаимосвязи ожирения, старения мозга и снижения когнитивных функций. Ранее было показано, что передача сигналов инсулина влияет на молекулярные каскады, которые лежат в основе функций гиппокампа, познания и памяти [5]. Наши предыдущие результаты показали, что значительный вклад в развитие ИР головного мозга вносит нейровоспаление из-за гиперпродукции провоспалительных цитокинов, активации астроглии и микроглии и нарушения процессов репаративного нейрогенеза [4, 6–8].
Воспаление – это иммунный ответ на множество экзогенных патоген-ассоциированных молекулярных паттернов (PAMP) и молекулярных паттернов, ассоциированных с повреждениями (DAMP). Врожденная иммунная система, включая нейтрофилы, моноциты и макрофаги, обеспечивает первую линию защиты организма от патогенов [9]. PAMP и DAMP инициируют развитие воспалительного ответа через взаимодействие с Toll-подобными рецепторами (TLR) и рецепторами, подобными домену связывания и олигомеризации нуклеотидов (NOD) (NLR). Как член семейства NLR, инфламмасомы представляют собой группу больших цитозольных мультимерных белковых комплексов, которые обрабатывают и инициируют созревание IL-1β и IL-18 из молекул-предшественников. После созревания цитокины IL-1β и IL-18 предупреждают иммунную систему о потенциальной опасности и усиливают провоспалительную иммунную реакцию [10].
Из-за разнообразной природы стимулов воспаления NLRP3 многие исследования были направлены на понимание точных механизмов, которые приводят к активации NLRP3 инфламмасомы. Эти исследования показали, что инфламмасома NLRP3 в значительной степени регулируется клеточным метаболизмом [11, 12]. Растущее количество данных свидетельствует о том, что клеточный метаболизм является решающим регулятором клеточных функций, таких как метаболический контроль поляризации макрофагов и формирование иммунного ответа. Несмотря на предполагаемую защитную роль инфламмасомы NLRP3 и воспаления в целом, чрезмерная воспалительная активность была связана с развитием как острых, так и хронических патологий. Хроническим воспалением обычно считается длительное воспаление низкого уровня. Этот тип воспаления, наряду с метаболическим воспалением, называемым метафламмацией, способствует процессу старения [12, 13].
Факторы риска, которые были рассмотрены в связи со старением мозга, включают метаболические нарушения. Процесс старения мозга может сопровождаться нарушением метаболизма глюкозы или снижением поступления глюкозы в мозг. Более того, ИР головного мозга была связана с повышенным риском когнитивного дефицита и деменции [14]. Сборка мультибелковой инфламмасомы происходит не только при нейродегенеративных заболеваниях, но и при нарушениях обмена веществ [15, 16].
Термины “метаболические инфламмасомы” или “метафламмасомы” охватывают метаболические нарушения и вызываемое ими воспаление [17, 18]. Подтверждена экспрессия четырех основных компонентов комплекса метафламмасом в мозге человека. Он включает фосфорилированные формы IKKβ (ингибитор бета-субъединицы киназы ядерного фактора ядра), IRS1 (субстрат 1-го рецептора инсулина), JNK (N-концевые киназы c-Jun) и PKR (двухцепочечная РНК-зависимая протеинкиназа) [19].
В связи с этим весьма актуальным является проведение фундаментальных исследований, направленных на изучение метаболических путей активации инфламмасом для регуляции и восстановления когнитивных функций, а также расширения регенеративного потенциала и пластичности головного мозга. Известно, что активация NLRP3 инфламмасомы может регулировать клеточный метаболизм [20].
Целью данного исследования явилось изучение нарушения механизмов инсулиновой сигнализации и метаболического воспаления (“метафламации”) в головном мозге у стареющих мышей линии C57Bl/6. Дальнейшее исследование этих вопросов поможет углубить наше понимание активации инфламмасом и заболеваний, связанных с нарушением экспрессии инфламмасом, и будет способствовать выявлению потенциальных терапевтических мишеней метаболических путей и метаболитов для предотвращения или лечения воспалительных заболеваний.
МЕТОДЫ ИССЛЕДОВАНИЯ
В исследовании использовались мыши линии C57BL/6, самцы в возрасте 4–5 мес., массой 25–30 г (n = 12); мыши линии C57BL/6, самцы в возрасте 14–15 мес., массой 25–30 г (n = 15). Часть экспериментов выполнена in vitro с получением нейросфер от мышей исследуемых групп.
Грызунов содержали в индивидуально-вентилируемых клетках по 5–6 особей с соблюдением температуры 21–22°C со свободным доступом к воде и гранулярному корму и регулярном световом цикле 12 ч день/12 ч ночь. Все манипуляции выполнялись во время светлой фазы дня. В ходе эксперимента были предприняты все усилия для сведения к минимуму страданий животных и сокращения их числа согласно принципам работы с животными (Принцип 3 “R”). Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и проводились в соответствии с соблюдением принципов гуманности, изложенных в Директиве Европейского Парламента и Совета Европейского союза (2010/63/ЕС). На все эксперименты было получено разрешение биоэтической комиссии Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого.
1. ПОВЕДЕНЧЕСКОЕ ТЕСТИРОВАНИЕ
Тест “Условно-рефлекторного замирания” (Fear conditioning)
Оборудование для проведения тестирования представляло собой акриловую квадратную камеру с электрифицированным решетчатым полом для подачи электрического сигнала (безусловный раздражитель (unconditioned stimulus (US)) во время белого шума – условного раздражителя (conditioned stimulus (CS). Данная камера помещена в большой звуконепроницаемый бокс (Ugo Basil, Италия) [21].
Данный тест проводится согласно описанной методике в течение трех дней [22].
Создание условий для запоминания (conditioning day)
В первый день создаются условия для запоминания и обучения в данном тесте, проявляющиеся возрастающим времени замирания. Для реализации таких условий для замирания в течение первого дня животное помещали в новую камеру. Свободно передвигающаяся мышь исследовала камеру в течение 120 с. После этого в качестве условного раздражителя (CS) подавали звуковой сигнал (белый шум, 55 дБ) в течение 30 с, а в качестве безусловного стимула (US) в течение последних 2 с белого шума подавали ток 0.3 мА. Подачу стимулов CS–US повторяли три раза, чтобы сформировать у животного условный рефлекс страха. Предъявление такой комбинации стимулов происходила на 120-, 240- и 360-й с после начала теста. Анализ полученных результатов проводился за каждый выделенный промежуток времени (с 0-й по 120-ю, со 120-й по 240-ю, с 240-й по 360-ю и с 360-й по 480-ю с) для отслеживания динамики приобретения ассоциации условного раздражителя с безусловным стимулом.
Контекстуальная обусловленность страха (Context day)
Контекстуальный тест (второй день тестирования) проводили через 24 ч после первого теста, когда создавали условия для замирания в той же камере в течение 300 с в отсутствие предоставления каких-либо стимулов (без подачи белого шума (CS) и электрического сигнала 0.3 мА (US)).
Условное (вызванное стимулом) выражение страха (Cued day)
В третий день тестирования (сигнальный тест) испытательная камера отличалась от камеры, использованной в первый и второй дни по цвету стен, структуре пола (без решетки), и освещенностью 30 люкс, обеспечивая новый контекст. Тест состоял из 180-секундного периода исследования мышами новой среды, чтобы оценить неспецифический контекстуальный страх, за которым следовал условный стимул на 180-й с (белый шум (CS) без последующей подачи электрического тока (US)), чтобы оценить приобретенный страх. Процент времени замирания в каждом временном отрезке был определен как показатель памяти страха, поскольку замирание как наиболее распространенный элемент в поведении, вызванный сильной болью или страхом, зачастую используется для количественной характеристики в тесте FC [21–23]. Весь процесс тестирования фиксировался с помощью системы видеоанализа за животными ANY MAZE (Behavior Tracking Software, Stoelting, США).
2. ИССЛЕДОВАНИЕ КЛЕТОЧНЫХ КУЛЬТУР
Выделение и культивирование нейросфер. Животных декапитировали и производили забор головного мозга. Извлеченный мозг помещали в ледяной раствор 2%-ный раствор глюкозы в PBS (ПанЭко, Россия), после чего выделяли гиппокамп и измельчали его скальпелем на кусочки размером около 1 мм3. Полученные кусочки ткани переносили пастеровской пипеткой в центрифужную пробирку, содержащую свежий раствор 2%-ной глюкозы в PBS и оставляли на 1 мин. После осаждения кусочков ткани удаляли супернатант. В пробирку вносили 3 мл среды NeuroCult NS-A Proliferation (StemCell, США) и проводили механическую диссоциацию ткани стерильной серологической пипеткой до получения однородной суспензии клеток, после чего центрифугировали при 150 g в течение 5 мин. После центрифугирования удаляли супернатант и добавляли 3 мл свежей среды NeuroCult NS-A Proliferation. Полученную клеточную суспензию переносили в культуральные флаконы T-75 см2 с 25 мл среды NeuroCult NS-A Proliferation. Культивирование осуществлялось в условиях инкубатора при 5% CO2 и 37°C. Через 48 ч после выделения наблюдали образование нейросфер. Пассаж и смену среды осуществляли каждые 4–5 дней.
Дифференцировка нейросфер. На 3-м пассаже собирали из флакона среду, нейросферы осаждали центрифугированием при 300 g в течение 5 мин. Супернатант сливали, нейросферы ресуспендировали в культуральной среде DMEM (ПанЭко, Россия) с добавлением 20% FBS (HyClone, США), 0.58 мг/мл глутамина (ПанЭко, Россия), 100 ЕД/мл пенициллина и 100 мг/мл стрептомицина (ПанЭко, Россия). Клетки засеивали в культуральные флаконы T-75 см2. Через 5–7 дней наблюдали дифференцировку нейросфер в сокультуру астроцитов и нейронов. Через 10 дней дифференцированную культуру клеток пересаживали в 24-луночные или 96-луночные культуральные планшеты для дальнейшего изучения.
3. ИССЛЕДОВАНИЕ ИММУНОСЕНЕСЦЕНЦИИ
Набор для обнаружения сенесценции предназначен для гистохимического обнаружения специфического маркера старения при различных значениях рН в культивируемых клетках и срезах тканей. Сенесцентные клетки демонстрируют увеличение размера, связанную со старением экспрессию активности β-галактозидазы (SA-β-Gal) и измененные паттерны экспрессии генов. Набор для обнаружения старения предназначен для гистохимического определения активности SA-β-Gal в культивируемых клетках и срезах тканей, что является известной характеристикой стареющих клеток. SA-β-Gal присутствует только в сенесцентных клетках и не обнаруживается в предсенесцентных, клетках в состоянии покоя или некротизированных клетках.
Исследование сенесценции проводили с помощью набора Senescence Detection Kit (K320, BioVision, США) согласно протоколу изготовителя. Клетки фиксировали с помощью Fixative Solution в течение 15 мин, однократно промывали PBS, после чего добавляли к клеткам Staining Solution Mix и инкубировали при 37°C в течение ночи. По завершению инкубации наблюдали появление голубой окраски клеток. Интенсивность изменения окраски определяли спектрофотометрически при длине волны 620 нм с помощью планшетного спектрофотометра Anthos (Biochrom, Великобритания). В случае окрашивания срезов (нефиксированных в PFA) окраску проводили по аналогичному принципу с изучением голубой окраски на микроскопе Olympus BX45. Далее снимки обрабатывали в программе ImageJ и оценивали как минимум 5 рандомно выбранных снимков.
4. ИММУНОЦИТОХИМИЧЕСКОЕ ОКРАШИВАНИЕ
Для регистрации целевых молекул – маркеров использовали метод двойного непрямого иммуноцитохимического окрашивания согласно протоколу фирмы-изготовителя антител. Были использованы первичные антитела к IKK (ab178870, Abcam, Великобритания), PKR (ab32506, Abcam, Великобритания), IR (ab137747, Abcam, Великобритания); IRS1 (ab66154, Abcam, Великобритания). Первичные антитела использовали в рабочем разведении 1 : 300. Время инкубации с первичными антителами составляло 18 ч при 4°С. Вторичные антитела, меченные Alexa 555 (ab150078, Abcam, Великобритания), использовали в разведении 1 : 500, время инкубации составляло 2 ч при 37°С.
Микроскопию клеток осуществляли на флуоресцентном микроскопе ZOE (Bio-Rad, США). Выполняли подсчет относительного количества клеток, экспрессирующих антиген, а также интенсивность флуоресценции исследуемых маркеров с помощью программного обеспечения ImageJ.
5. ИММУНОГИСТОХИМИЯ И КОНФОКАЛЬНАЯ МИКРОСКОПИЯ
После глубокой анестезии проводили транскардиальную перфузию 4%-ным параформальдегидом (PFA) с 0.1 М фосфатно-солевым буфером (Sigma, США). Мозг удаляли и постфиксировали в 4%-ном PFA при 4°C в течение ночи, а затем погружали на 48 ч при 4°C в 20%-ный раствор сахарозы, растворенной в фосфатно-солевом буфере (PBS, pH 7.4), содержащем 0.01% азида натрия (Sigma, США). Срезы толщиной 50 мкм делали с помощью вибротома (Thermo Scientific) в сагиттальном направлении с использованием стереотаксического атласа для определения локализации гиппокампа. Свободно плавающие срезы мозга блокировали в PBS, содержащем 10% нормальной козьей сыворотки (Sigma), 2% альбумина бычьей сыворотки (BSA) (Sigma), 1% Triton X-100 (Sigma) и 0.1% азида натрия (Sigma) в течение 1 ч при комнатной температуре.
Использовали следующие антитела: анти-GFAP (Abcam, ab4674, Великобритания) 1 : 1000, анти-NeuN (Merk, ABN90) 1 : 1000, анти-IRS1 (phosphor S312) (Abcam, ab66154, Великобритания), анти-IL18 (sc6177-4, Santa Cruz Biotechnology), анти-NLRP3 (Abcam, ab23073-96, Великобритания), анти-IKKβ (ab178870, Abcam, Великобритания), PKR (ab32506, Abcam, Великобритания). На следующий день после инкубации с антителами срезы промывали в PBS, а затем инкубировали с Alexa-конъюгированными вторичными антителами 1 : 1000 (Invitrogen) в течение 2 ч при комнатной температуре. После промывания срезы монтировали на предметные стекла, наносили водную монтажную среду Fluoromount (Sigma) и предметные стекла закрывали покровным стеклом. Изображения были получены с 60-кратным объективом на конфокальном флуоресцентном микроскопе Olympus FV 10i и обрабатывались с помощью программного обеспечения Olympus FluoView (Ver.4.0a) и программы ImageJ. Репрезентативные изображения гиппокампа в соответствии со стереотаксическим атласом Paxinos и Franklin [24] были взяты по крайней мере из двух срезов от семи мышей на группу.
6. СТАТИСТИЧЕСКИЙ АНАЛИЗ
Статистический анализ полученных результатов включал методы описательной статистики с использованием программы GraphPad Prism7 (GraphPad Software, La Jolla, CA, США). Критерий Колмогорова–Смирнова использовали для оценки нормальности распределения. При несоблюдении условий нормальности распределения сравнение двух групп осуществляли с помощью непараметрического U критерия Манна–Уитни. Для оценки влияния двух факторов применяли двуфакторный ANOVA (two-way ANOVA): применялся двухфакторный дисперсионный анализ независимых выборок. Последующее попарное сравнение групп проводили с помощью post-hoc Sidak’s теста множественных сравнений.
Уровень значимости при проверке гипотез принимали р ≤ 0.05. Все результаты представлены в виде M ± SE, где М – среднее значение, SE – ошибка среднего, p – уровень значимости.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Старение характеризуется нарушением контекстуальной памяти у мышей
У мышей разного возраста изучали ассоциативную память в тесте “Fear Conditioning” (FC), в котором мыши учат связывать нейтральный стимул (условный раздражитель – белый шум), с аверсивным (электрический ток) и при этом демонстрировать условный ответ (в виде реакции замирания). После повторяющихся в первый день обучения пар стимулов животные начинают ассоциировать неприятный стимул с нейтральным. Для оценки ассоциативной памяти в тесте “Fear Conditioning” в первый день изучали приобретение памяти (кривая обучения) с последующим анализом контекстуальной и сигнальной памяти в ранний период (на первый–второй день после создания условий для замирания). Оценивали процент времени замирания в каждый день тестирования и число эпизодов замирания. В первый день анализ проводили в различные временные интервалы для построения кривой обучения. Во второй день анализ проводили за весь период времени, а в третий – до и после подачи условного стимула [25].
В первый день тестирования была исследована динамика запоминания для построения кривой обучения. Для этого сначала измерили базальный уровень замирания до предъявления мышам пары согласованных стимулов (базальный уровень). Далее предъявляли в равные промежутки времени (120 с) пару стимулов (CS–US) с трехкратным повторением. Процент времени замирания фиксировали в каждый интервал. Также в каждый временной промежуток, включая базальный, оценивали число эпизодов замирания. В день создания условий для замирания не было выявлено статистически значимого влияния взаимодействия двух факторов (F (3.76) = 0.4, p = 0.8) (рис. 1a). При последующем множественном сравнении для анализа динамики кривой обучения не было выявлено различий в проценте замирания на базальном уровне (до стимулов) у мышей исследуемых групп. Также не отмечено статистически достоверной разницы при сравнении групп между собой в разные интервалы времени. При анализе эпизодов замирания также не было найдено статистически значимого влияния двух факторов (F (3.76) = 2.5, p = 0.06) (рис. 1b). Таким образом, не выявлено нарушений на этапе приобретения памяти у группы мышей в возрасте 5 и 14 месяцев.
Рис. 1.
Изучение ассоциативной памяти в тесте “Fear Conditioning”. (a) – процент времени замирания в первый день создания условий для запоминания в тесте “Условно-рефлекторного замирания”. Pre-tone – до подачи белого шума, CS–US1 – первая пара стимулов, CS–US2 – вторая пара стимулов, CS–US3 – третья пара стимулов. (b) – число эпизодов замирания в первый день создания условий для запоминания в тесте “Условно-рефлекторного замирания”. (c) – процент времени замирания в контекстный день. (d) – число эпизодов замирания в контекстный день. (e) - процент времени замирания в сигнальный день. Pre-tone – до подачи белого шума, Tone – подача белого шума. (f) – число эпизодов замирания в сигнальный день. 5 months – мыши C57Bl/6 в возрасте 5 мес.; 14 months – в возрасте 12–14 мес.
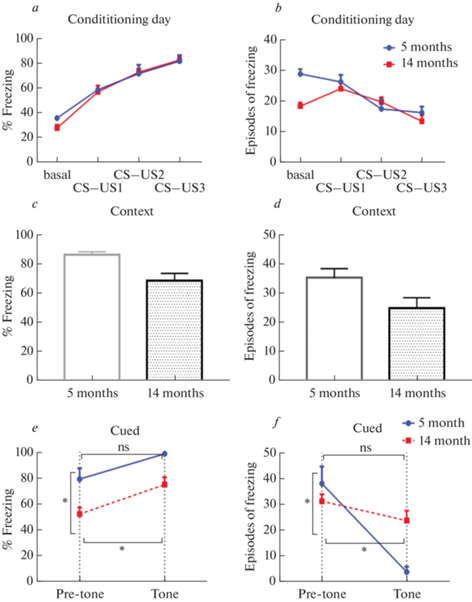
При оценке извлечения памяти в контексте (контекстуальной) оценили процент замирания у двух групп. Отмечено статистически значимое различие между группами зрелых мышей (5 месяцев) и стареющими мышами (14 месяцев). Зрелые мыши замирают дольше (86.4 ± 2.0%) по сравнению с стареющими (68.6 ± 4.9%) (p = 0.02, критерий Манна–Уитни). Аналогичные данные получены при анализе эпизодов замирания: число эпизодов замирания в группе зрелых мышей 35.2 ± 3.2, в группе стареющих статистически значимо меньше – 24.8 ± 3.6 (p < 0.05) (рис. 1c, d).
На третий день тестирования в абсолютно новых для мышей условиях фиксировался процент времени замирания – базальный и после сигнального извлечения памяти посредством подачи белого шума. Отметили статистически значимое влияние фактора возраста мышей (F (1.38) = 14.7, p < 0.001), а также фактора самого белого шума (F (1.38) = 10.2, p < 0.01), (двухфакторный дисперсионный анализ Two-way ANOVA) (рис. 1e, f).
С помощью множественного анализа зафиксировали статистически значимые различия в базальном уровне замирания (при помещении в новую среду): у зрелых мышей (79.1 ± 8.3%) и у стареющей группы (52.2 ± 5.1%) (p = 0.04, Sidak’s критерий). При сравнении процента замирания в динамике (от базального и после предъявления звукового тона) в группе зрелых мышей не наблюдали достоверных отличий (p = 0.4, Sidak’s критерий), что вероятно, вместе с высоким процентом времени замирания до предъявления шума может является показателем избыточной тревожности, нежели отсутствия ассоциативной связи между шумом и потенциальной возможностью воздействия электрического тока. В группе стареющих мышей эти параметры статистически значимо отличаются (p = 0.02, Sidak’s критерий). Подтверждает эти данные и число эпизодов замирания в группе зрелых мышей: до предъявления условного стимула число эпизодов замирания было высоким (38.0 ± 6.6), после предъявления стимула происходило снижение числа эпизодов замирания (3.7 ± 2.1) (p < 0.001, Sidak’s критерий), что соответствует при этом высокому времени замирания (т.е. иными словами, животные проводят все время в неподвижной позиции).
Таким образом, у стареющих мышей зафиксировано нарушение контекстуальной памяти (во второй день тестирования), но не процесса приобретения и сигнальной памяти. Ранее в исследованиях было показано, что синаптическая пластичность миндалевидного тела играет важную роль в приобретении и экспрессии условного замирания, а гиппокамп в свою очередь необходим для контекстуального запоминания [42].
Старение сопровождается увеличением числа сенесцентных клеток и повышением экспрессии маркеров воспаления
Ограниченная способность к репликации является определяющей характеристикой большинства нормальных клеток и достигает кульминации при старении. Известно, что сенесцентные стареющие клетки не стимулируются к делению сывороткой или пассажем в культуре, а сам процесс старения индуцирует специфический профиль клеточного цикла. Старение сопровождается увеличенным размером клеток, экспрессией рН-зависимой активности β-галактозидазы, а также измененным характером экспрессии генов.
Мы изучили активность β-галактозидазы в клетках гиппокампа на срезах и в сокультуре клеток с использованием SA-β-Gal набора. Хромогенное окрашивание клеток подтвердило индукцию SA-β-Gal в гиппокампе. Клетки в гиппокампе стареющих мышей демонстрируют более высокий уровень маркеров старения (3.5 ± 0.8% площади сенесцентных клеток) по сравнению с группой зрелых животных (1 ± 0.2% площади сенесцентных клеток) (р = 0.02, критерий Манна–Уитни) (рис. 2a, b, d).
Рис. 2.
Изучение сенесценции in vivo и in vitro. (a) – репрезентативные снимки окраски SA-β-gal in vivo. Голубое окрашивание идентифицирует сенесцентные клетки. (b) – изображение SA-β-gal + клеток, полученное с помощью программы Image. (c) –репрезентативные снимки окраски SA-β-gal in vitro. (d) – количественный анализ SA-β-gal + клеток, представленный в виде занимаемой площади на срезах. (e) – количественный анализ SA-β-gal + клеток, представленный в виде оптической площади в у.е. в сокультуре клеток. 5 months – C57Bl/6 мыши в возрасте 5 мес., 14 months – C57Bl/6 мыши в возрасте 14 мес.

Подтверждают эти результаты данные, полученные в сокультуре нейронов и астроцитов от животных разных групп. При изучении сенесценции спектрофотометрически было зарегистрировано статистически значимое увеличение β-галактозидазной активности, свойственной стареющим клеткам, в сокультуре клеток, выделенной от 12-месячных животных (0.055 ± 0.002 оптическая плотность), по сравнению с молодыми животными (0.045 ± 0.0013, р = 0.01, критерий Манна–Уитни) (рис. 2c, e).
Таким образом, активность β-галактозидазы в клетках стареющих животных была выше, что связано с увеличением сенесцентных клеток. Известно, что провоспалительный интерлейкин IL-1β, TNFa и IL6 являются основными составляющими SASP [4]. Поэтому далее было проведено исследование изменения экспрессии мультибелкового комплекса инфламмасомы NLRP3, которая участвует в созревании и секреции IL-1β и IL-18. В клетках гиппокампа животных в возрасте 14 мес. площадь экспрессии IL-18 была значимо выше (2038.0 ± 89.2 мкм2) по сравнению с группой мышей в возрасте 5 мес. (283.1 ± 35.5 мкм2) (р < 0.01, критерий Манна–Уитни) (рис. 3a, b). Аналогичные результаты получены при анализе снимков с экспрессией инфламмасомы NLRP3: у стареющих мышей – 2789 ± 531 мкм2 против 1063 ± 19 мкм2 у зрелых (р < 0.05, критерий Манна–Уитни) (рис. 3a, c).
Рис. 3.
Экспрессия маркеров воспаления при старении. (a) – тройное иммунофлуоресцентное окрашивание в группах мышей в возрасте 5 и 14 мес.: в первой колонке ядра клеток прокрашены DAPI (голубой), во второй колонке – экспрессия NLRP3 (красный), в третьей колонке – экспрессия IL1β (зеленый), в четвертой колонке представлено наложение сигналов (Merge). SGZ – субгранулярная зона. Масштабная шкала – 100мкм. (b) – площадь экспрессии IL1β, мкм2. (c) – площадь экспрессии NLRP3, мкм2. 5 months – C57Bl/6 мыши в возрасте 5 мес., 14 months –14 мес.
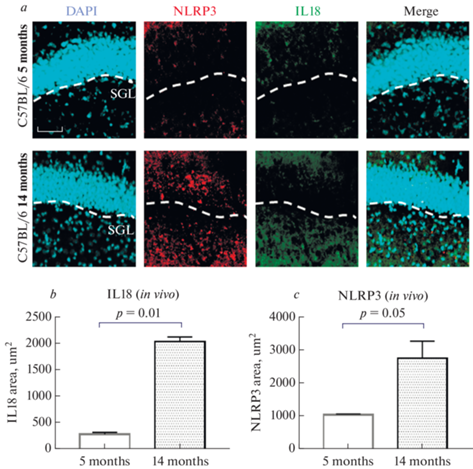
Таким образом, при старении было отмечено увеличение сенесцентных клеток, которые характеризуются секреторным фенотипом, сопровождающимся увеличением экспрессии NLRP3 инфламмасом и IL-18.
Старение приводит к увеличению уровня лактата, но не к изменению экспрессии маркеров инсулинорезистентности
Далее в сокультуре астроцитов и нейронов исследовали экспрессию инсулиновых рецепторов (IR). Также была отмечена тенденция к увеличению экспрессии инсулиновых рецепторов клетками, выделенными от стареющих животных (11.0 ± 1.1 у.е.) по сравнению с 5-месячными мышами (8.6 ± 1.5 у.е.), однако, статистически значимых различий в уровне экспрессии IR в экспериментальных группах выявлено не было (р = 0.2, критерий Манна–Уитни) (рис. 4a, b). Не было выявлено и статистически значимых различий в уровне инсулина в гомогенатах гиппокампа мышей исследуемых групп – в группе стареющих мышей (0.23 ± 0.05 нг/мг белка), в группе зрелых животных (0.2 ± 0.01 нг/мг белка) (р > 0.9, критерий Манна–Уитни) (рис. 4c).
Рис. 4.
Экспрессия маркеров инсулиновой сигнализации. (a) – репрезентативные снимки экспрессии IR (инсулиновых рецепторов) в сокультуре астроцитов и нейронов, выделенных от молодых (5 мес.) и стареющих (14 мес.) мышей. Ядра клеток прокрашены DAPI (голубой), IR (красный). (b) – количественный анализ экспрессии IR в сокультуре клеток. (c) – определение уровня инсулина в гомогенатах гиппокампа. (d) – определение уровня лактата в гомогенатах гиппокампа. (e) – двойное иммунофлуоресцентное окрашивание в группах мышей в возрасте 5 и 14 мес.: в первой колонке ядра клеток прокрашены DAPI (голубой), во второй колонке – экспрессия IRS1phospho-S312 (синий). SGZ – субгранулярная зона. Масштабная шкала – 100 мкм. (f) – площадь экспрессии IRS1phospho-S312, мкм2. 5 months – C57Bl/6 мыши в возрасте 5 мес., 14 months –14 мес.

Далее была определена концентрация продукта метаболизма глюкозы – лактата в гиппокампе методом иммуноферментного анализа. Лактат, входящий в активированные синапсы, играет метаболическую роль, в соответствии с высокими потребностями в энергии мембранных и клеточных процессов, необходимых для долговременной синаптической пластичности и памяти [26]. В исследовании был определен высокий уровень лактата у стареющих животных (13.4 ± 2.6 нмоль/мкг белка) по сравнению с мышами в возрасте 5 месяцев (5.9 ± 0.7) (р = 0 .01, критерий Манна–Уитни) (рис. 4d).
При иммуногистохимическом исследовании площади экспрессии патологически фосфорилированного IRS1 не было выявлено статистически значимых различий в группе стареющих (3118 ± 39 мкм2) и зрелых мышей (2809 ± 37 мкм2) (р = 0.4, критерий Манна–Уитни) (рис. 4e, f). Таким образом, у стареющих мышей не выявлено признаков формирования инсулинорезистентности, но найдено увеличение уровня лактата в гиппокампе.
При старении у мышей наблюдается увеличение экспрессии фосфорилированных протеиназ метафламмасом
Поскольку известно, что процесс старения мозга может сопровождаться нарушением метаболизма глюкозы или снижением поступления глюкозы в мозг, центральная инсулинорезистентность связана с повышенным риском когнитивного дефицита [5]. Как уже было описано, термин “метафламмасома” был введен для описания клеточной сигнальной реакции, вызванной DAMP, за которой следует ответ метаболического пути и выброс цитокинов [18]. Мы исследовали экспрессию основных компонентов комплекса метафламмасом в головном мозге мышей разного возраста.
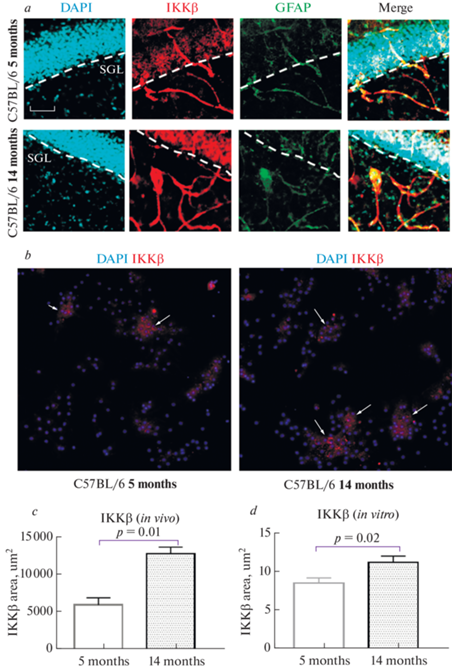
Было выявлено статистически значимое увеличение экспрессии фосфорилированной формы IKKβ in vivo и in vitro. Площадь экспрессии IKKβ в группе стареющих мышей составила 12780 ± 890 мкм2 по сравнению с животными зрелой группы – 5920 ± 943.9 мкм2 (р < 0.01, критерий Манна–Уитни) (рис. 5a, c). Установлено также, что в сокультуре клеток, выделенных от стареющих животных, уровень экспрессии киназы IKKβ выше (11.2 ± 0.8 у.е.), чем в клетках, полученных от молодых животных (8.5 ± 0.7 у.е.) (р = 0.02, критерий Манна–Уитни) (рис. 5b, d).
Рис. 5.
Экспрессия фосфорилированной формы IKKβ in vivo и in vitro. (a) – тройное иммунофлуоресцентное окрашивание в группах мышей в возрасте 5 и 14 мес.: в первой колонке ядра клеток прокрашены DAPI (голубой), во второй колонке – экспрессия IKKβ (красный), в третьей колонке – экспрессия GFAP (зеленый), в четвертой колонке представлено наложение сигналов (Merge). SGZ – субгранулярная зона. Масштабная шкала – 100 мкм. (b) – репрезентативные снимки экспрессии IKKβ в сокультуре астроцитов и нейронов, выделенных от молодых (5 мес.) и стареющих (14 мес.) мышей. Ядра клеток прокрашены DAPI (голубой), IKKβ (красный). (c) – площадь экспрессии IKKβ в срезах головного мозга, мкм2. (d) – количественный анализ экспрессии IKKβ в сокультуре клеток. 5 months – C57Bl/6 мыши в возрасте 5 мес., 14 months –14 мес.
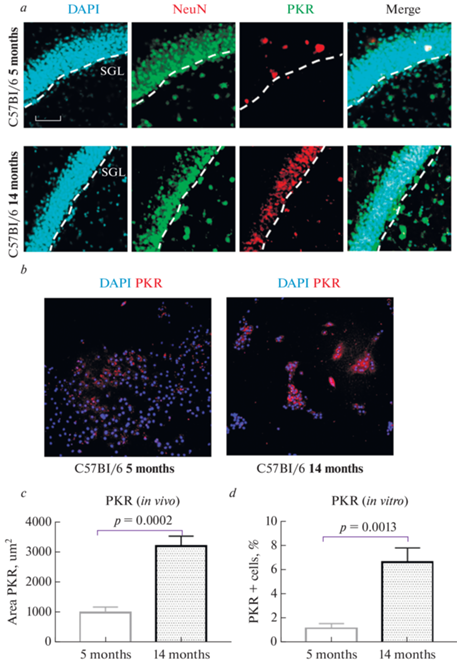
Площадь экспрессии PKR в гиппокампе стареющих животных была выше (3206.9 ± 335.2 мкм2) по сравнению с 5-месячными мышами (984.2 ± 189.2 мкм2) (р < 0.001, критерий Манна–Уитни) (рис. 6a, c). Также было выявлено, что в культуре клеток, выделенных от стареющих животных, количество клеток, экспрессирующих PKR в 5 раз выше (6.6 ± 1.2%), чем в культуре, выделенной от молодых животных (1.1 ± 0.4%) (р = <0.01, критерий Манна–Уитни) (рис. 6b, d). Таким образом, в группе стареющих мышей наблюдали увеличение экспрессии фосфорилированных протеиназ метафламмасом.
Рис. 6.
Экспрессия PKR in vivo и in vitro. (a) – тройное иммунофлуоресцентное окрашивание в группах мышей в возрасте 5 и 14 мес.: в первой колонке ядра клеток прокрашены DAPI (голубой), во второй колонке – экспрессия NeuN (зеленый), в третьей колонке – экспрессия PKR (красный), в четвертой колонке представлено наложение сигналов (Merge). SGZ – субгранулярная зона. Масштабная шкала – 100 мкм. (b) – репрезентативные снимки экспрессии PKR в сокультуре астроцитов и нейронов, выделенных от молодых (5 мес.) и стареющих (14 мес.) мышей. Ядра клеток прокрашены DAPI (голубой), PKR (красный). (c) – площадь экспрессии PKR в срезах головного мозга, мкм2. (d) – количественный анализ экспрессии PKR в сокультуре клеток. 5 months – C57Bl/6 мыши в возрасте 5 мес., 14 months – 14 мес.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Поскольку старение является основным риском развития возрастных заболеваний, в последнее время очень активно развиваются направления в науке, ориентированные на профилактику и терапию ассоциированных с возрастом состояний. Эта тема, безусловно, очень популярна не только в медицинском сообществе, но и в обществе в целом [27].
Воспаление, ассоциированное со старением, сопровождается активацией инфламмасомы и продукцией провоспалительных цитокинов
Клеточное старение характеризуется неспособностью клеток к пролиферации. При этом старение характеризуется тремя основными фазами: фаза индукции (характеризуется укорочением теломер, повреждением ДНК, депривацией факторов роста); вторая фаза – реакция на повреждение ДНК; и фаза 3 – остановка роста (молекулы сигнальной трансдукции р53, р21 запускают остановку роста) [28].
Мы показали, что у стареющих мышей происходит увеличение количества сенесцентных клеток in vivo и сокультуре астроцитов и нейронов. Сенесцентные клетки характеризуются необратимой остановкой роста в ответ на различные стрессы, и одной из отличительных черт сенесцентных клеток является секреция набора факторов, называемого секреторным фенотипом, ассоциированным со старением (SASP), состоящего из провоспалительных медиаторов, факторов роста, металлопротеиназ и других компонентов [29].
Хроническое воспаление, отличительный признак старения, также вызывает клеточную сенесенцию и способствует старению тканей [4, 30]. Процесс старения и патогенез воспалительных состояний, связанных со старением, приводят к увеличению различных провоспалительных цитокинов, метаболитов, агрегатов и химически активных веществ. Было доказано, что все они приводят к активации NLRP3 инфламмасомы с помощью различных механизмов, что способствует дальнейшему развитию воспаления и прогрессированию заболевания [4, 20].
Одним из наиболее важных факторов старения мозга является чрезвычайно высокая потребность нейронов в энергии для поддержания их работы и сохранения умственных способностей [31]. С возрастом наблюдается усиление системного воспаления, метаболических изменений и периферического иммунного старения. Из-за реципрокных взаимодействий между нервной и иммунной системами развивается хроническое асептическое воспаление в центральной нервной системе, называемое “нейровоспалительным” старением [32].
Ранее было показано, что нейровоспаление в гиппокампе играет важную роль в развитии тревожных и когнитивных расстройств, связанных с запоминанием, но лежащий в их основе механизм до сих пор полностью не выяснен. Nod-подобный рецепторный белок (NLRP) 3 инфламмасома, который контролирует выработку провоспалительных цитокинов, широко вовлечен в заболевания, связанные с нейровоспалением [6, 33]. В настоящем исследовании мы показываем, что NLRP3 инфламмасома значительно активируется в гиппокампе при старении.
Процесс старения ассоциирован с усиленной активацией компонентов метафламмасомы
Метаболические нарушения, включая ожирение и диабет 2-го типа, как известно, связаны с хроническим воспалением и являются очевидными факторами риска болезни Альцгеймера – патологического старения [33], но также, возможно, играют роль при физиологическом старении. Недавние данные, касающиеся ожирения и диабета, позволяют предположить, что метаболическая инфламмасома (“метафламмасома”) опосредует хроническое воспаление [34, 35].
Также в своем исследовании мы убедительно продемонстирровали повышение экспрессии фосфорилированных протеинкиназ PKR и IKKβ – компонентов метафламмасом при старении мышей. Двухцепочечная РНК-зависимая протеинкиназа (PKR) является центральным компонентом метафламмасомы [33]. Недавно было показано, что двухцепочечная РНК-зависимая протеинкиназа (PKR) является основным регулятором активации инфламмасомы. У стареющих мышей PKR активировалась в гиппокампе. Эти результаты показывают, что воспалительный путь PKR/NLRP3 гиппокампа играет важную роль в развитии сенесцентного фенотипа клеток. Более того, ранее в исследованиях была продемонстрирована защитная роль нокаута гена PKR. У мышей дикого типа (WT) и PKR–/– после индукции ожирения диетой с высоким содержанием жиров наблюдали значительное повышение уровня активированных белков метафламмасом головного мозга у подвергшихся воздействию мышей WT, но изменения не были значительными у мышей PKR–/– [33]. Также в исследованиях было ранее подтверждено, что РНК-активированная протеинкиназа запускает активацию канонической инфламмасомы NLRP3 и каспазы-1, что приводило к процессингу и секреции про-IL-1β. PKR активировала инфламмасому посредством образования активных форм кислорода и MAP-киназ ERK1/2, JNK и p38 [36].
Другим компонентом метафламмасомы, экспрессия которого усиливалась в гиппокампе при старении, была IKKβ. Активированный комплекс IKK фосфорилирует белки IκB, что приводит к их последующей деградации. В результате димер NF-κB, секвестрированный в цитоплазме, высвобождается и перемещается в ядро, чтобы активировать специфический механизм транскрипции. Нормальная активация NF-kB необходима для поддержания многих физиологических функций, тогда как его аномальная или хроническая активация связана со многими воспалительными и возрастными заболеваниями. NF-kB также играет ключевую роль в клеточной сенесценции и процессе старения. Биоинформатические исследования показали, что NF-κB является фактором транскрипции, наиболее связанным со старением млекопитающих. Кроме того, конститутивная активация NF-κB вызывает сенесценцию и старение млекопитающих, обеспечивая экспрессию факторов SASP, включая провоспалительные цитокины и хемокины (например, p16INK4a, p21CIP1, IL-6, IL-1α и TNFα) [30, 37]. В нашем исследовании было показано, что конститутивная активация IKKβ связана с клеточной сенесценцией и старением, а также избыточной активацией NLRP3 инфламмасомы.
Физиологическое старение сопровождается увеличением продукции лактата
Известно, что активация NLRP3 инфламмасомы важна для активации врожденных иммунных ответов, но неправильная и чрезмерная активация может вызвать воспалительное заболевание [8, 38]. Ранее было показано, что гликолиз – метаболический путь, который превращает глюкозу в пируват, необходим для активации NLRP3 инфламмасомы в макрофагах. Также ранее было показано, что снижение ферментации лактата путем ингибирования лактатдегидрогеназы снижает активацию каспазы-1 и созревание IL-1β в ответ на различные агонисты воспаления NLRP3, такие как нигерицин, АТФ, кристаллы мононатрия урата или квасцы, это указывает на то, что ферментация лактата необходима для активации инфламмасомы NLRP3. Ингибирование лактатдегидрогеназы с помощью GSK2837808A снижало выработку лактата и активность NLRP3 инфламмасомы, фосфорилированной протеинкиназы R (PKR), но не уменьшало общий триггер воспаления NLRP3, отток калия или продукцию активных форм кислорода [39, 40].
Наши результаты показывают, что увеличение содержания лактата у стареющих мышей сопровождается активацией NLRP3 инфламмасом. Некоторые авторы рассматривают перепрограммирование метаболизма пирувата в митохондриях и цитоплазме как новую стратегию лечения NLRP3-инфламмасом-ассоциированных заболеваний [40].
Старение ассоциировано с нарушением контекстуальной памяти
Изменения экспрессии инфламмасом в головном мозге находят отражение в изменении сложных форм поведения. Ранее нами было показано, что блокирование NLRP3 приводит к неожиданным последствиям нарушений эмоциональной сферы и памяти: развитие тревожного поведения, нарушений процессов формирования и извлечения памяти, что, безусловно, находит свое отражение на клеточном и молекулярном уровне: нарушение ранних этапов нейрогенеза, формирования астроцитов и синаптической передачи [6, 7, 38].
Старение связано со снижением эпизодической памяти и изменениями функций мозга, связанных с памятью [41]. В данном исследовании зафиксировано нарушение контекстуальной памяти у стареющих мышей, но не процесса приобретения и сигнальной памяти. Ранее было показано, что фронтотемпоральная миндалина головного мозга имеет важное значение в приобретении и реализации условного замирания, а гиппокамп, в свою очередь, необходим для контекстуального запоминания [42, 43].
Предыдущие результаты показывают, что старение влияет на способность использовать контекст для модулирования усвоенных ответов на угрозу, возможно, из-за изменений в структурах мозга, которые обеспечивают контекстно-зависимое поведение и преимущественно уязвимы во время старения [44]. К таким структурам относится в первую очередь зубчатая извилина гиппокампа [45].
В остальном нарушений памяти не было выявлено. Кроме того, старение у мышей не приводило к изменению в экспрессии инсулиновых рецепторов, субстрата инсулиновых рецепторов 1 (IRS1phospho-S312). Это позволяет предположить, что при физиологическом старении, без признаков нейродегенерации, реактивного астроглиоза, еще не наблюдается нарушений инсулиновой сигнализации, но уже наблюдаются проявления метаболического воспаления.
ЗАКЛЮЧЕНИЕ
Таким образом, модуляция активности компонентов метафламмасом PKR и IKKβ может быть новой патогенетически обоснованной стратегией управления механизмами метаболического воспаления и развития cвязанного со старением секреторного фенотипа клеток в головном мозге. Данная стратегия может быть использована для улучшения когнитивных функций в пожилом и старческом возрасте.
Список литературы
Costantini E, D’Angelo C, Reale M (2018) The Role of Immunosenescence in Neurodegenerative Diseases. Mediat Inflammat 1–12. https://doi.org/10.1155/2018/6039171
Khan SS, Singer BD, Vaughan DE (2017) Molecular and physiological manifestations and measurement of aging in humans. Aging Cell 16(4): 624–633. https://doi.org/10.1111/acel.12601
de Souto Barreto P, Guyonnet S, Ader I, Andrieu S, Casteilla L, Davezac N, Rolland Y (2020). The INSPIRE research initiative: a program for GeroScience and healthy aging research going from animal models to humans and the healthcare system. J Frailty Aging 1–8. https://doi.org/10.14283/jfa.2020.18
Komleva Y, Chernykh A, Lopatina O, Gorina Y, Lokteva I, Salmina A, Gollasch M (2021) Inflamm-Aging and Brain Insulin Resistance: New Insights and Role of Life-style Strategies on Cognitive and Social Determinants in Aging and Neurodegeneration. Front Neurosci 14: 618395. https://doi.org/10.3389/fnins.2020.618395
Spinelli M, Fusco S, Grassi C (2019) Brain Insulin Resistance and Hippocampal Plasticity: Mechanisms and Biomarkers of Cognitive Decline. Front Neurosci 13: 788. https://doi.org/10.3389/fnins.2019.00788
Komleva YK, Lopatina OL, Gorina YV, Shuvaev AN, Chernykh AI, Potapenko IV, Salmina AB (2021) NLRP3 deficiency-induced hippocampal dysfunction and anxiety-like behavior in mice. Brain Res 1752: 147220. https://doi.org/10.1016/j.brainres.2020.147220
Komleva YK, Potapenko IV, Lopatina OL, Gorina YV, Chernykh AI, Khilazheva ED, Shuvaev AN (2021) NLRP3 Inflammasome Blocking as a Potential Treatment of Central Insulin Resistance in Early-Stage Alzheimer’s Disease. Int J Mol Sci 22(21): 11588. https://doi.org/10.3390/ijms222111588
Komleva YK, Lopatina OL, Gorina YV, Chernykh AI, Shuvaev AN, Salmina AB (2018) Early changes in hyppocampal neurogenesis induced by soluble Ab1-42 oligomers. Biomed Chem 64(4): 326–333. https://doi.org/10.18097/PBMC20186404326
Heneka MT, McManus RM, Latz E (2018) Inflammasome signalling in brain function and neurodegenerative disease. Nature Rev Neurosci 19(10): 610–621. https://doi.org/10.1038/s41583-018-0055-7
Rea IM, Gibson DS, McGilligan V, McNerlan SE, Alexander HD, Ross OA (2018) Age and Age-Related Diseases: Role of Inflammation Triggers and Cytokines. Front Immunol 9: 586. https://doi.org/10.3389/fimmu.2018.00586
Barra NG, Henriksbo BD, Anhê FF, Schertzer JD (2020). The NLRP3 inflammasome regulates adipose tissue metabolism. Biochem J 477(6): 1089–1107. https://doi.org/10.1042/BCJ20190472
Meyers AK, Zhu X (2020) The NLRP3 Inflammasome: Metabolic Regulation and Contribution to Inflammaging. Cells 9(8): 1808. https://doi.org/10.3390/cells9081808
Franceschi C, Bonafè M, Valensin S, Olivieri F, De Luca M, Ottaviani E, De Benedictis G (2006) Inflamm-aging: An Evolutionary Perspective on Immunosenescence. Ann NY Acad Sci 908(1): 244–254. https://doi.org/10.1111/j.1749-6632.2000.tb06651.x
Litwiniuk A, Bik W, Kalisz M, Baranowska-Bik A (2021) Inflammasome NLRP3 Potentially Links Obesity-Associated Low-Grade Systemic Inflammation and Insulin Resistance with Alzheimer’s Disease. Int J Mol Sci 22(11): 5603. https://doi.org/10.3390/ijms22115603
Kelley N, Jeltema D, Duan Y, He Y (2019) The NLRP3 Inflammasome: An Overview of Mechanisms of Activation and Regulation. Int J Mol Sci 20(13): 3328. https://doi.org/10.3390/ijms20133328
Zahid A, Li B, Kombe AJK, Jin T, Tao J (2019) Pharmacological Inhibitors of the NLRP3 Inflammasome. Front Immunol 10: 2538. https://doi.org/10.3389/fimmu.2019.02538
Kanbay M, Yerlikaya A, Sag AA, Ortiz A, Kuwabara M, Covic A, Afsar B (2019) A journey from microenvironment to macroenvironment: the role of metaflammation and epigenetic changes in cardiorenal disease. Clin Kidney J 12(6): 861–870. https://doi.org/10.1093/ckj/sfz106
Kuryłowicz A, Koźniewski K (2020) Anti-Inflammatory Strategies Targeting Metaflammation in Type 2 Diabetes. Molecules 25(9): 2224. https://doi.org/10.3390/molecules25092224
Taga M, Minett T, Classey J, Matthews FE, Brayne C, Ince PG, MRC CFAS (2017) Metaflammasome components in the human brain: a role in dementia with Alzheimer’s pathology?: Metaflammasome Proteins in Alzheimer’s Disease. Brain Pathol 27(3): 266–275. https://doi.org/10.1111/bpa.12388
Gritsenko A, Green JP, Brough D, Lopez-Castejon G (2020) Mechanisms of NLRP3 priming in inflammaging and age related diseases. Cytokine Growth Factor Rev 55: 15–25. https://doi.org/10.1016/j.cytogfr.2020.08.003
Горина ЯВ, Комлева ЮК, Лопатина ОЛ, Волкова ВВ, Черных АИ, Шабалова АА, Салмина АБ (2017) Батарея тестов для поведенческого фенотипирования стареющих животных в эксперименте. Успехи геронтол 1: 49–55. [Gorina YV, Komleva YK, Lopatina OL, Volkova VV, Chernykh AI, Shabalova AA, Salmina AB (2017) Battery of tests for behavioral phenotyping of aging animals in experiment. Advances Gerontol 1: 49–55. (In Russ)].
Shoji H, Takao K, Hattori S, Miyakawa T (2014) Contextual and Cued Fear Conditioning Test Using a Video Analyzing System in Mice. J Visual Exp 85.https://doi.org/10.3791/50871
Morimura N, Yasuda H, Yamaguchi K, Katayama K, Hatayama M, Tomioka NH, Aruga J (2017) Autism-like behaviours and enhanced memory formation and synaptic plasticity in Lrfn2/SALM1-deficient mice. Nature Communicat 8: 15800. https://doi.org/10.1038/ncomms15800
Paxinos G, Franklin KBJ (2004) The mouse brain in stereotaxic coordinates (Compact 2nd ed.). Amsterdam. Boston. Elsevier Acad Press.
Pai CS, Sharma PK, Huang HT, Loganathan S, Lin H, Hsu Y-L, Liu IY (2018) The Activating Transcription Factor 3 (Atf3) Homozygous Knockout Mice Exhibit Enhanced Conditioned Fear and Down Regulation of Hippocampal GELSOLIN. Front Mol Neurosci 11: 37. https://doi.org/10.3389/fnmol.2018.00037
Zhang M, Cheng X, Dang R, Zhang W, Zhang J, Yao Z (2018) Lactate Deficit in an Alzheimer Disease Mouse Model: The Relationship With Neuronal Damage. J Neuropathol Exp Neurol 77(12): 1163–1176. https://doi.org/10.1093/jnen/nly102
Scapagnini G, Caruso C, Spera G (2016) Preventive Medicine and Healthy Longevity: Basis for Sustainable Anti-Aging Strategies. In: N Scuderi & BA Toth (Eds), International Textbook of Aesthetic Surgery. Berlin. Heidelberg. Springer. https://doi.org/10.1007/978-3-662-46599-8_82
Martínez-Zamudio RI, Dewald HK, Vasilopoulos T, Gittens-Williams L, Fitzgerald-Bocarsly P, Herbig U (2021) Senescence-associated β-galactosidase reveals the abundance of senescent CD8+ T cells in aging humans. Aging Cell 20(5). https://doi.org/10.1111/acel.13344
Papadopoulos D, Magliozzi R, Mitsikostas DD, Gorgoulis VG, Nicholas RS (2020) Aging, Cellular Senescence, and Progressive Multiple Sclerosis. Front Cell Neurosci 14: 178. https://doi.org/10.3389/fncel.2020.00178
Zhang L, Zhao J, Mu X, McGowan SJ, Angelini L, O’Kelly RD, Robbins PD (2021) Novel small molecule inhibition of IKK/NF-κB activation reduces markers of senescence and improves healthspan in mouse models of aging. Aging Cell 20(12). https://doi.org/10.1111/acel.13486
de Tredern E, Rabah Y, Pasquer L, Minatchy J, Plaçais PY, Preat T (2021) Glial glucose fuels the neuronal pentose phosphate pathway for long-term memory. Cell Reports 36(8): 109620. https://doi.org/10.1016/j.celrep.2021.109620
Diniz BS, Vieira EM, Mendes-Silva AP, Bowie CR, Butters MA, Fischer CE on behalf of the PACt-MD Study Group (2021) Mild cognitive impairment and major depressive disorder are associated with molecular senescence abnormalities in older adults. Alzheimer’s & Dementia: Translational Res Clin Intervent 7(1). https://doi.org/10.1002/trc2.12129
Taga M, Mouton-Liger F, Sadoune M, Gourmaud S, Norman J, Tible M, Hugon J (2018) PKR modulates abnormal brain signaling in experimental obesity. PLOS One 13(5): e0196983. https://doi.org/10.1371/journal.pone.0196983
Arnold SE, Arvanitakis Z, Macauley-Rambach SL, Koenig AM, Wang H-Y, Ahima RS, Nathan DM (2018) Brain insulin resistance in type 2 diabetes and Alzheimer disease: concepts and conundrums. Nature Rev Neurol 14(3): 168–181. https://doi.org/10.1038/nrneurol.2017.185
Hugon J, Mouton-Liger F, Dumurgier J, Paquet C (2017) PKR involvement in Alzheimer’s disease. Alzheimer’s Res & Therapy 9(1): 83. https://doi.org/10.1186/s13195-017-0308-0
Stunnenberg M, Hamme JL, Trimp M, Gringhuis SI, Geijtenbeek TBH (2021) Abortive HIV-1 RNA induces pro-IL-1β maturation via protein kinase PKR and inflammasome activation in humans. Eur J Immunol 51(10): 2464–2477. https://doi.org/10.1002/eji.202149275
Dresselhaus EC, Meffert MK (2019) Cellular Specificity of NF-κB Function in the Nervous System. Front Immunol 10: 1043. https://doi.org/10.3389/fimmu.2019.01043
Komleva YK, Lopatina OL, Gorina YV, Chernykh AI, Trufanova LV, Vais EF, Salmina AB (2022) Expression of NLRP3 Inflammasomes in Neurogenic Niche Contributes to the Effect of Spatial Learning in Physiological Conditions but Not in Alzheimer’s Type Neurodegeneration. Cell Mol Neurobiol 42(5): 1355–1371. https://doi.org/10.1007/s10571-020-01021-y
Li Q, Liu S, Zhu X, Mi W, Maoying Q, Wang J, Wang Y (2019) Hippocampal PKR/NLRP1 Inflammasome Pathway Is Required for the Depression-Like Behaviors in Rats with Neuropathic Pain. Neuroscience 412: 16–28. https://doi.org/10.1016/j.neuroscience.2019.05.025
Lin H-C, Chen Y-J, Wei Y-H, Lin H-A, Chen C-C, Liu T-F, Chen L-C (2021) Lactic Acid Fermentation Is Required for NLRP3 Inflammasome Activation. Front Immunol 12: 630380. https://doi.org/10.3389/fimmu.2021.630380
Subramaniapillai S, Rajagopal S, Elshiekh A, Pasvanis S, Ankudowich E, Rajah MN (2019) Sex Differences in the Neural Correlates of Spatial Context Memory Decline in Healthy Aging. J Cogn Neurosci 31(12): 1895–1916. https://doi.org/10.1162/jocn_a_01455
Bouton ME, Maren S, McNally GP (2021) Behavioral and neurobiological mechanisms of pavlovian and instrumental extinction learning. Physiol Rev 101(2): 611–681. https://doi.org/10.1152/physrev.00016.2020
Tran T, Tobin KE, Block SH, Puliyadi V, Gallagher M, Bakker A (2021) Effect of aging differs for memory of object identity and object position within a spatial context. Learning & Memory 28(7): 239–247. https://doi.org/10.1101/lm.053181.120
Battaglia S, Garofalo S, di Pellegrino G (2018) Context-dependent extinction of threat memories: influences of healthy aging. Sci Rep 8(1): 12592. https://doi.org/10.1038/s41598-018-31000-9
Bernier BE, Lacagnina AF, Ayoub A, Shue F, Zemelman BV, Krasne FB, Drew MR (2017) Dentate Gyrus Contributes to Retrieval as well as Encoding: Evidence from Context Fear Conditioning, Recall, and Extinction. J Neurosci 37(26): 6359–6371. https://doi.org/10.1523/JNEUROSCI.3029-16.2017
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


