Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 1, стр. 119-135
Эффекты семакса в моделях острого стрессогенного воздействия
Н. Ю. Глазова 1, 2, Д. М. Манченко 1, Д. А. Виленский 1, 3, Е. А. Себенцова 1, 2, Л. А. Андреева 2, А. А. Каменский 1, 2, Л. В. Дергунова 2, С. А. Лимборская 2, Н. Ф. Мясоедов 2, Н. Г. Левицкая 1, 2, *
1 Московский государственный университет им. М.В. Ломоносова,
биологический факультет
Москва, Россия
2 Институт молекулярной генетики Национального исследовательского центра
“Курчатовский институт”
Москва, Россия
3 Московский государственный университет им. М.В. Ломоносова,
факультет биоинженерии и биоинформатики
Москва, Россия
* E-mail: nglevitskaya@gmail.com
Поступила в редакцию 13.10.2022
После доработки 10.12.2022
Принята к публикации 11.12.2022
- EDN: IYBRAD
- DOI: 10.31857/S0869813923010053
Аннотация
Острое стрессогенное воздействие вызывает в организме человека и животных каскад нейрохимических реакций, приводящих, в частности, к изменению поведения и повышению толерантности к боли. Важную роль в регуляции реакции организма на стрессорные воздействия играют АКТГ/МСГ-подобные пептиды. Целью представленной работы явилось изучение эффектов аналога АКТГ4–10 гептапептида семакс в различных моделях острого стресса. Было исследовано влияние внутрибрюшинного введения семакса в дозах 0.05 и 0.5 мг/кг на изменения поведения и болевой чувствительности крыс Wistar в моделях прерывистого неизбегаемого электроболевого раздражения и принудительного плавания в холодной воде. Для оценки вовлеченности эндогенной опиоидной системы в эффекты стресса исследовали влияние предварительного введения антагониста опиоидных рецепторов налоксона (1 мг/кг). Использованные стрессогенные воздействия приводили к увеличению болевого порога в тесте “сдавливания задней лапы”, что свидетельствует о развитии стресс-вызванной анальгезии. Кроме того, у крыс, перенесших стресс, наблюдалось снижение исследовательского поведения и возрастание уровня тревожности в тесте “норковая камера”. Как семакс, так и налоксон ослабляли стресс-вызванную анальгезию в модели электроболевого раздражения, но не влияли на величину болевого порога в модели принудительного плавания. Оба исследованных препарата не влияли на поведение крыс в использованных моделях острого стресса. Можно заключить, что семакс ослабляет опиоидную форму стресс-вызванной анальгезии, но не влияет на изменения поведения крыс, перенесших острое стрессогенное воздействие.
Стрессогенные воздействия являются неотъемлемой частью жизни любого организма. Стресс можно определить как сложное динамическое состояние, при котором нарушается или находится под угрозой устойчивая внутренняя среда организма (гомеостаз) [1, 2]. Воздействие стрессора активирует физиологические и психологические реакции организма, направленные на поддержание гомеостаза (стрессорные реакции) [3, 4]. Способность адекватно реагировать на стресс имеет решающее значение для выживания. Нарушение регуляции нейрохимических и нейроэндокринных реакций на стресс играет ключевую роль в возникновении и/или обострении ряда психических и неврологических расстройств, включая тревожность, депрессию и хроническую боль. Исследование реакции на стресс и факторов, которые ее модулируют, необходимо для понимания этиологии связанных со стрессом расстройств и разработки новых подходов к их лечению [2, 5].
Реакция организма на стрессорное воздействие опосредуется координированным действием центральной и периферической нервной системы. В ответ на действие стрессора происходит высвобождение нейромедиаторов, нейропептидов и гормонов, инициирующих системную реакцию организма. Активация симпато-адреналовой системы приводит к выбросу адреналина и норадреналина, которые регулируют периферические реакции на стрессор. Активация гипоталамо-гипофизарно-надпочечниковой оси включает несколько последовательных этапов передачи сигналов: выброс кортикотропин-рилизинг-гормона нейронами гипоталамуса; высвобождение адренокортикотропного гормона (АКТГ) передней долей гипофиза; стимуляция выброса глюкокортикоидов корой надпочечников [4, 6]. Поступившие в кровь глюкокортикоиды взаимодействуют со специфическими рецепторами в мозге, воздействуя на когнитивные функции и адаптивное поведение [7]. Кроме того, в развитие стрессорного ответа вовлечены также опиоидная, серотонинергическая, дофаминергическая, ГАМК-ергическая, глутаматная, эндоканабиноидная и другие нейромедиаторные системы мозга [8, 9].
Острое стрессогенное воздействие вызывает в организме человека и животных каскад нейрохимических реакций, приводящих, в частности, к изменению поведения и повышению толерантности к боли. У животных, перенесших стресс, наблюдается снижение исследовательской активности, увеличение уровня тревожности и страха [10]. В регуляцию поведенческого ответа на действие стрессора вовлечены многочисленные нейрохимические механизмы, которые включают в себя различные нейромедиаторы (катехоламины, ГАМК, возбуждающие аминокислоты), а также гормоны, нейротрофины и регуляторные пептиды [2, 7, 11, 12]. Воздействие острого стресса также приводит к снижению болевой чувствительности, развивается стресс-вызванная анальгезия (СВА) [4, 13]. СВА опосредуется активацией антиноцицептивных нисходящих систем, которые подавляют пути передачи болевых стимулов от ноцицепторов к ЦНС [3]. Известно, что СВА может опосредоваться как опиоидными, так и неопиоидными механизмами, различают опиоидную и неопиоидную формы СВА [2, 4, 13]. В развитии неопиоидной СВА участвуют различные нейромедиаторы, такие как серотонин, дофамин, гистамин, эндоканабиноиды, ГАМК, глютамат и др. В зависимости от природы и длительности стрессорного воздействия, а также от вида болевого стимула может происходить как отдельная, так и совместная активация опиоидных и неопиоидных механизмов СВА [2, 4].
Пептиды, относящиеся к семейству меланокортинов (MC), включают в себя АКТГ, α-, β- и γ-меланоцитстимулирующие гормоны (α-, β- и γ-МСГ), фрагменты этих гормонов и их синтетические аналоги. Все эндогенные MC образуются из общего белка предшественника – проопиомеланокортина (ПОМК) [14, 15]. В настоящее время выделено 5 типов меланокортиновых рецепторов – MC1R–MC5R. Рецепторы MCR3 и MCR4 широко представлены в нервной системе, а MC2R экспрессируется преимущественно в клетках коры надпочечников [15, 16]. Все эндогенные MC способны связываться с различными MC-рецепторами, исключением является MC2R – единственным известным эндогенным лигандом этих рецепторов является молекула АКТГ [15]. В структуре всех природных MC присутствует общая последовательность, соответствующая фрагменту АКТГ4–9 – ME(G)HFRW, эта последовательность необходима для связывания со всеми типами MCR [17]. Для активации MC2R помимо АКТГ4–9 нужна последовательность АКТГ15–18 (KKRR), которая отсутствует в структуре МСГ [18].
MC играют важную роль в регуляции эмоционального состояния и реакции организма на стрессорные воздействия [19, 20]. При остром стрессе увеличивается экспрессия мРНК генов ПОМК и MC4R [19]. Показано, что природные и синтетические агонисты MC4R стимулируют тревожность и анорексию, вызванные острым стрессом, а антагонисты этого рецептора ослабляют стресс-вызванные изменения поведения [21]. Все эти данные указывают на важную роль МС и MC4R в регуляции ответа на острый стресс [20, 22]. Большой интерес исследователей вызывает вопрос о взаимодействии МС с опиоидной системой мозга. Показано, что MC и опиоиды являются функциональными антагонистами в ЦНС – при совместном введении MC ингибируют анальгетические эффекты эндогенных опиоидов и морфина [16].
Гептапептид семакс (MEHFPGP) является аналогом фрагмента АКТГ4–10, полностью лишенным эндокринной активности и обладающим пролонгированным нейротропным действием [23]. Структура пептида включает в себя последовательность АКТГ4–7 и обогащенный пролином трипептид PGP. В настоящее время семакс успешно используется в медицине в качестве ноотропного и нейропротекторного лекарственного средства [24]. Изучение эффектов семакса в норме и на фоне стрессогенных воздействий показало, что хроническое введение пептида приводит к снижению уровня тревожности и депрессивности крыс, а также ослабляет последствия хронического непредсказуемого стресса [25, 26]. При однократном введении семакс не оказывал влияния на уровень тревожности и депрессивности крыс в норме, но ослаблял анксиогенные эффекты холицистокинина-тетрапептида [27]. Введение пептида ослабляло когнитивные нарушения, вызванные острым иммобилизационным стрессом [28]. В модели острого стресса, вызванного принудительным плаванием при температуре 28°С, введение семакса перед стрессогенным воздействием блокировало опиоидную составляющую СВА, но не влияло на стресс-вызванные изменения поведения крыс [29].
Известно, что как природа СВА, так и изменения поведения, вызванные острым стрессом, зависят от вида стрессорного воздействия [2, 4]. Зависимость эффектов семакса от вида стрессирующего фактора ранее не исследовалась. Поэтому целью представленной работы явилось изучение эффектов семакса в различных моделях острого стресса. Задачей работы было исследование влияния семакса на изменения поведения и болевой чувствительности крыс в моделях неизбегаемого прерывистого электроболевого раздражения и принудительного плавания в холодной воде.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на самцах крыс Wistar массой 230–250 г. Животных содержали в стандартных условиях вивария со свободным доступом к пище и воде и соблюдением 12-часового светового режима дня.
Гептапептид семакс (MEHFPGP) синтезирован в Институте молекулярной генетики Национального исследовательского центра “Курчатовский институт”. Пептид вводили в водном растворе в дозе 0.05 или 0.5 мг/кг внутрибрюшинно в объеме 1 мл/кг. Контрольным животным вводили эквивалентный объем стерильной дистиллированной воды в соответствующие сроки. Блокатор опиоидных рецепторов налоксон (Naloxone, Sigma, США) вводили внутрибрюшинно, в водном растворе, в дозе 1 мг/кг (1 мл/кг).
Было проведено 3 независимых серии экспериментов. В первой серии опытов в качестве стрессорного воздействия использовали принудительное плавание в холодной воде. Семакс в дозе 0.05 или 0.5 мг/кг и налоксон вводили за 15 мин до начала воздействия. Было использовано 5 групп крыс (15–16 крыс в группе): группа Контроль (животные получали инъекцию растворителя в соответствующее время и не подвергались стрессорному воздействию, находились в домашней клетке); группа Стресс (крысы получали инъекцию растворителя и подвергались стрессорному воздействию); группы Стресс + налоксон, Стресс + семакс-0.05 и Стресс + семакс-0.5 (крысы получали инъекцию соответствующего препарата в указанной дозе и подвергались принудительному плаванию). Болевую чувствительность крыс в тесте “сдавливания задней лапы” измеряли через 5, 20 и 35 мин после окончания стрессогенного воздействия, поведение в “норковой камере” – через 15 мин после воздействия.
Во второй и третьей сериях экспериментов в качестве стрессора использовали прерывистое неизбегаемое электроболевое раздражение. Во второй серии семакс и налоксон вводили за 15 мин до начала воздействия. Было использовано 5 групп крыс, аналогично серии 1 (15–16 крыс в группе). Болевую чувствительность крыс измеряли через 5, 20 и 35 мин после окончания стрессогенного воздействия, поведение – через 15 мин после воздействия.
В третьей серии семакс вводили через 5 мин после окончания стрессогенного воздействия, а налоксон – за 15 мин до начала воздействия. Было использовано 4 группы животных: Контроль, Стресс, Стресс + налоксон и Стресс + семакс-0.5 (14–15 крыс в группе). Болевую чувствительность крыс измеряли через 10, 25 и 40 мин после окончания стрессогенного воздействия, поведение – через 20 мин после воздействия.
Модели острого стрессогенного воздействия
В модели принудительного плавания крыс помещали в прозрачные пластиковые цилиндры (высота 45, диаметр 20 см) на 2/3 заполненной водой (температура 12°С), длительность плавания составляла 5 мин. После окончания процедуры плавания крыс сушили полотенцем, а затем согревали при помощи фена. К моменту измерения болевой чувствительности (через 5 мин после окончания плавания) животные были согреты и практически высушены, что исключает влияние температуры конечностей на величину болевого порога в тесте “сдавливание задней лапы”.
В модели прерывистого электроболевого раздражения крыс индивидуально помещали в экспериментальную камеру с решетчатым полом, соединенным с электростимулятором ЭСЛ-1. Электрическое раздражение наносили в течение 10 мин (10 с тока с интервалом 20 с) при частоте 200 Гц и длительности 0.5 мс. Напряжение варьировало от 60 до 100 В в зависимости от вокализации животного.
Тест “сдавливание задней лапы”
Величину болевого порога крыс до и после стресса измеряли в тесте “сдавливание задней лапы”, в котором болевым раздражителем служит равномерно нарастающее давление на заднюю конечность. Измерение проводилось с помощью анальгезиметра фирмы “Ugo Basile” (Италия). Уровень болевой чувствительность определяли по величине давления на конечность в момент отдергивания лапы. Давление измерялось в условных единицах (у.е.) прибора, одна у.е. соответствовала увеличению нагрузки на 20 г/см2. Максимальная нагрузка на конечность составляла 25 у.е. До введения препаратов проводили три измерения исходной болевой чувствительности. При анализе результатов для вычисления фоновой болевой чувствительности исходные значения усредняли. После стресса проводили 3 измерения болевой чувствительности с интервалом 15 мин. При статистической обработке данных для каждого животного при каждом измерении вычисляли изменение болевой чувствительности относительно фоновых значений.
Тест “норковая камера”
Для оценки исследовательской активности и уровня тревожности крыс применяли тест “норковая камера”. Экспериментальная камера представляет собой ящик с передней стенкой из органического стекла (40 × 40 × 30 см). Пол камеры имеет 13 круглых отверстий (“норок”) и расчерчен на 9 квадратов. При тестировании животное помещали в угол камеры и в течение 3 мин визуально регистрировали следующие показатели: величина пробега (число пересеченных квадратов), число стоек (подъемов на задние лапы), число обследованных норок (погружений головы в отверстие до уровня ушей).
Статистическая обработка данных
Для статистической обработки использовали пакет программ Statistica 10. Анализ выборок с помощью критерия Шапиро–Уилка показал, что распределение выборок соответствовало критериям нормального (p > 0.05), что позволило нам использовать дисперсионный анализ (ANOVA). Анализ результатов теста “норковая камера” проводили с использованием однофакторного ANOVA (фактор ГРУППА). При анализе изменений болевой чувствительности применяли ANOVA для повторных измерений (repeated ANOVA) для факторов ГРУППА и ВРЕМЯ ИЗМЕРЕНИЯ. В случае достоверного влияния указанных факторов или их взаимодействия, проводили post hoc анализ с использование критерия Фишера (Fisher LSD test). Для оценки зависимости между параметрами использовали коэффициент корреляции Пирсона. Различия считали статистически значимыми при p < 0.05. Данные на графиках представлены как среднее ± стандартная ошибка среднего.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
1. Влияние предварительного введения семакса и налоксона на последствия острого стресса, вызванного принудительным плаванием в холодной воде
Оценка изменений болевой чувствительности с помощью ANOVA для повторных измерений выявила статистически значимое влияние факторов ГРУППА (F4,72 = 17.3, p < 0.001) и ВРЕМЯ ИЗМЕРЕНИЯ (F3,216 = 108.36, p < 0.001), а также взаимодействие данных факторов (F12,216 = 7.5, p < 0.001). Дальнейший анализ показал статистически значимое увеличение болевого порога во всех группах крыс, перенесших стресс, через 5 и 20 мин после окончания действия стрессора как относительно фоновых значений (p < 0.005), так и по сравнению с группой Контроль (p < 0.01) (рис. 1). Значимых отличий между группами стрессированных крыс отмечено не было (p > 0.17). Таким образом, у всех крыс, перенесших плавание в холодной воде, наблюдалась СВА. Введение семакса в использованных дозах и налоксона не влияло на изменение болевой чувствительности, вызванное острым стрессом.
Рис. 1.
Влияние налоксона (a) и семакса (b) на изменения болевого порога крыс, вызванные принудительным плаванием в холодной воде (тест сдавливания задней лапы). Налоксон (1 мг/кг) или семакс (0.05 или 0.5 мг/кг) вводили за 15 мин до начала стрессогенного воздействия. По оси абсцисс – время после окончания воздействия (мин), по оси ординат – изменение болевого порога относительно фоновых значений (условные единицы прибора). В каждой группе по 15–16 крыс. Данные представлены в виде среднего ± стандартная ошибка среднего. Значимые отличия от фоновых значений отмечены закрашенными символами (p < 0.005), значимые отличия от группы Контроль – ** (p < 0.001).

При оценке поведения крыс в тесте “норковая камера” было зарегистрировано статистически значимое влияние фактора ГРУППА на величину пробега, число стоек и обследованных норок в данном тесте (F4,73 > 12.0, p < 0.001). Дальнейший анализ показал статистически значимое снижение регистрируемых показателей во всех группах крыс, перенесших стресс, относительно контрольных значений (p < 0.001) (рис. 2). Отличий между группами животных, подвергавшихся стрессу, отмечено не было (p > 0.15). Следовательно, использованное воздействие вызывало у крыс снижение исследовательского поведения и увеличение тревожности. Введение семакса и налоксона не влияло на стресс-вызванные изменения поведения животных.
Рис. 2.
Влияние налоксона и семакса на изменения поведения крыс в тесте “норковая камера”, вызванные принудительным плаванием в холодной воде (величина пробега, число обследованных норок и стоек). Налоксон (1 мг/кг) или семакс (0.05 или 0.5 мг/кг) вводили за 15 мин до начала стрессогенного воздействия. Через 15 мин после окончания стресса крыс тестировали в “норковой камере”. В каждой группе по 15–16 крыс. Данные представлены в виде среднего ± стандартная ошибка среднего. Значимые отличия от группы Контроль отмечены ** (p < 0.001).

2. Влияние предварительного введения налоксона и семакса на последствия острого стресса, вызванного неизбегаемым электроболевым раздражением
ANOVA для повторных измерений выявил статистически значимое влияние факторов ГРУППА (F4,72 = 10.73, p < 0.001) и ВРЕМЯ ИЗМЕРЕНИЯ (F5,216 = 31.39, p < 0.001), а также взаимодействие данных факторов (F12,216 = 3.94, p < 0.001) для изменений величины болевого порога. Дальнейший анализ показал статистически значимое увеличение болевого порога у крыс группы Стресс через 5 и 20 мин после окончания стрессорного воздействия как относительно фоновых значений (p < 0.001), так и относительно соответствующего контроля (p < 0.001) (рис. 3).
Рис. 3.
Влияние налоксона (a) и семакса (b) на изменения болевого порога крыс, вызванные неизбегаемым электроболевым раздражением (тест сдавливания задней лапы). Налоксон (1 мг/кг) или семакс (0.05 или 0.5 мг/кг) вводили за 15 мин до начала стрессогенного воздействия. По оси абсцисс – время после окончания воздействия (мин), по оси ординат – изменение болевого порога относительно фоновых значений (условные единицы прибора). В каждой группе по 15–16 крыс. Данные представлены в виде среднего ± стандартная ошибка среднего. Значимые отличия от фоновых значений отмечены закрашенными символами (p < 0.01), значимые отличия от группы Контроль –* (p < 0.05) и ** (p < 0.001), от группы Стресс – # (p < 0.05) и ## (p < 0.001), от группы Стресс+семакс-0.05 – & (p < 0.05).
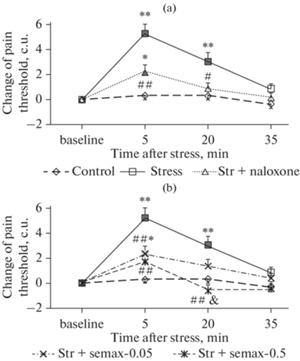
В группах крыс, получавших перед воздействием инъекции налоксона или семакса в дозе 0.05 мг/кг, через 5 мин после окончания действия стрессора величина болевого порога значимо превышала соответствующие фоновые значения (p < 0.01) и контрольные показатели (p < 0.03). Через 20 мин после стресса в этих группах значимых отличий болевого порога от фоновых и контрольных значений зарегистрировано не было (p > 0.30). В группе Стресс + налоксон отмечалось значимое снижение болевого порога относительно группы Стресс через 5 (p < 0.001) и 20 (p < 0.02) мин после воздействия. У крыс группы Стресс + семакс-0.05 величина этого показателя статистически значимо отличалась от группы Стресс через 5 мин после воздействия (p < 0.001), через 20 мин значимых отличий между этими группами отмечено не было (p = 0.11). В группе Стресс + семакс-0.5 не было зарегистрировано значимых отличий болевого порога от фоновых и контрольных значений через 5 и 20 мин после стрессорного воздействия (p > 0.12). При этом наблюдалось статистически значимое снижение этого показателя через 5 и 20 мин после воздействия относительно соответствующих значений в группе Стресс (p < 0.001).
Значимых отличий между группой Стресс + налоксон и группами крыс, получавших семакс перед стрессогенным воздействием, зарегистрировано не было (p > 0.28). В группе Стресс + семакс-0.5 величина болевого порога через 20 мин после воздействия была значимо ниже, чем в группе Стресс + семакс-0.05 (p < 0.03). Таким образом, использованное электроболевое раздражение приводило к развитию СВА. Предварительное введение налоксона или семакса в использованных дозах ослабляло анальгезию, вызванную данным воздействием. Эффекты семакса в дозе 0.5 мг/кг были более выражены.
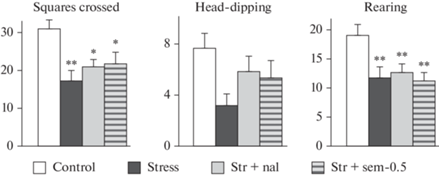
Изучение поведения крыс в тесте “норковая камера” выявило статистически значимое влияние фактора ГРУППА на величину пробега, число обследованных норок и стоек (F4,73 > 3.58, p < 0.01). Дальнейший анализ показал достоверное снижение этих показателей в группах крыс, перенесших электроболевое раздражение, относительно контрольных значений (p < 0.01) (рис. 4). Значимых отличий между группами стрессированных крыс зарегистрировано не было (p > 0.35). Следовательно, введение семакса в использованных дозах или налоксона не влияло на изменения поведения животных, вызванные неизбегаемым электроболевым раздражением.
Рис. 4.
Влияние налоксона и семакса на изменения поведения крыс в тесте “норковая камера”, вызванные неизбегаемым электроболевым раздражением (величина пробега, число обследованных норок и стоек). Налоксон (1 мг/кг) или семакс (0.05 или 0.5 мг/кг) вводили за 15 мин до начала стрессогенного воздействия. Через 15 мин после окончания стресса крыс тестировали в “норковой камере”. В каждой группе по 15–16 крыс. Данные представлены в виде среднего ± стандартная ошибка среднего. Значимые отличия от группы Контроль отмечены * (p < 0.05) и ** (p < 0.001).

3. Влияние семакса на последствия острого стресса, вызванного неизбегаемым электроболевым раздражением, при введении пептида после окончания стрессорного воздействия
В данной серии экспериментов семакс вводили через 5 мин после окончания действия стрессора, поэтому измерения болевой чувствительности проводили через 10, 25 и 40 мин, а тест “норковая камера” – через 20 мин после воздействия.
Оценка изменений болевой чувствительности с помощью ANOVA для повторных измерений выявила статистически значимое влияние факторов ГРУППА (F3,54 = 4.06, p = 0.01) и ВРЕМЯ ИЗМЕРЕНИЯ (F3,162 = 10.77, p < 0.001), а также взаимодействие данных факторов (F9,162 = 2.16, p = 0.027). Дальнейший анализ показал достоверное увеличение болевого порога у крыс группы Стресс через 10 и 25 мин после окончания стрессорного воздействия как относительно фоновых значений (p < 0.001 и p = 0.01 соответственно), так и относительно группы Контроль (p < 0.001 и p = 0.01 соответственно) (рис. 5). В группе Стресс + налоксон через 10 мин после окончания действия стрессора величина болевого порога значимо превышала соответствующие фоновые и контрольные значения (p < 0.04), а через 25 мин после стресса значимых отличий от фона и группы Контроль отмечено не было (p > 0.80). В группе крыс, получавших инъекцию налоксона, регистрируемый показатель через 10 мин после воздействия отличался от соответствующих значений в группе Стресс на уровне тенденции (p = 0.06), а через 25 мин это отличие было статистически значимым (p = 0.02).
Рис. 5.
Влияние налоксона (a) и семакса (b) на изменения болевого порога крыс, вызванные неизбегаемым электроболевым раздражением (тест сдавливания задней лапы). Налоксон (1 мг/кг) вводили за 15 мин до начала стрессогенного воздействия, семакс (0.5 мг/кг) – через 5 мин после окончания воздействия. По оси абсцисс – время после окончания воздействия (мин), по оси ординат – изменение болевого порога относительно фоновых значений (условные единицы прибора). В каждой группе по 14–15 крыс. Данные представлены в виде среднего ± стандартная ошибка среднего. Значимые отличия от фоновых значений отмечены закрашенными символами (p < 0.03), значимые отличия от группы Контроль – *(p < 0.05) и ** (p < 0.001), от группы Стресс – # (p < 0.05) и ## (p < 0.001).
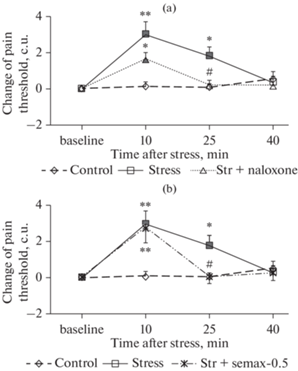
В группе Стресс + семакс-0.5 через 10 мин после стрессогенного воздействия (через 5 мин после инъекции пептида) величина болевого порога статистически значимо превышала фоновые и контрольные значения (p < 0.001), отличий от группы Стресс отмечено не было (p = 0.94). Однако через 25 мин после стресса величина болевого порога в этой группе от фоновых значений и группы Контроль не отличалась (p > 0.92) и была достоверно ниже, чем в группе Стресс (p < 0.01). Значимых отличий между группами Стресс–налоксон и Стресс–семакс-0.5 зарегистрировано не было, но при первом измерении величина болевого порога в группе Стресс–семакс-0.5 превышала соответствующие значения в группе Стресс–налоксон на уровне тенденции (p = 0.07).
Таким образом, как и во второй серии экспериментов, электроболевое раздражение приводило к развитию СВА, которая ослаблялась предварительным введением налоксона. Введение семакса в дозе 0.5 мг/кг через 5 мин после окончания стрессорного воздействия не оказывало влияния на величину болевого порога при первом измерении (через 5 мин после инъекции), но приводило к значимому уменьшению СВА через 20 мин после введения препарата.
Изучение поведения крыс в тесте “норковая камера” выявило статистически значимое влияние фактора ГРУППА на величину пробега и число стоек (F3,55 > 4.7, p < 0.005), а также влияние данного фактора на число обследованных норок на уровне тенденции (F3,55 = 2.46, p = 0.07). В группах крыс, перенесших стресс, отмечалось достоверное снижение величины пробега и числа стоек по сравнению с группой контроль (p < 0.03) (рис. 6).
Рис. 6.
Влияние налоксона и семакса на изменения поведения крыс в тесте “норковая камера”, вызванные неизбегаемым электроболевым раздражением (величина пробега, число обследованных норок и стоек). Налоксон (1 мг/кг) вводили за 15 мин до начала стрессогенного воздействия, семакс (0.5 мг/кг) – через 5 мин после окончания воздействия. Через 20 мин после окончания стресса крыс тестировали в “норковой камере”. В каждой группе по 14–15 крыс. Данные представлены в виде среднего ± стандартная ошибка среднего. Значимые отличия от группы Контроль отмечены *(p < 0.05) и **(p < 0.001).
Значимых отличий между группами стрессированных крыс зарегистрировано не было (p > 0.20). Следовательно, как и во второй серии опытов, электроболевое раздражение вызывало у крыс снижение исследовательского поведения и увеличение тревожности. Ни предварительное введение налоксона, ни введение семакса после стрессогенного воздействия не оказывало значимого влияния на стресс-вызванные изменения поведения животных.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Реакция организма на острое стрессогенное воздействие включает в себя широкий спектр физиологических и поведенческих изменений, в том числе увеличение тревожности и снижение болевой чувствительности [2]. Согласно данным литературы, специфические нейромедиаторные системы, определяющие характер стрессорного ответа, зависят от природы, продолжительности и интенсивности стрессирующего воздействия [30]. Показано, что анальгезия, вызванная принудительным плаванием в теплой воде или прерывистым электрическим раздражением конечности, блокируется предварительным введением антагонистов опиоидных рецепторов, однако при увеличении интенсивности и/или продолжительности стрессорного воздействия включаются неопиоидные механизмы СВА [31–34]. В представленной работе нами были использованы две экспериментальные модели острого стресса – принудительное плавание в холодной воде и неизбегаемое прерывистое электроболевое раздражение. Т.е., были использованы стрессоры, воздействие которых, по данным литературы, должно приводить к развитию неопиоидной и опиоидной формы СВА соответственно [35, 36].
Воздействие использованных стрессоров приводило к увеличению порога реакции на болевое раздражение в тесте “сдавливание задней лапы” через 5 и 20 мин после окончания стресса. У крыс, перенесших плавание в холодной воде, стресс-вызванные изменения болевого порога были более выражены, чем у животных, подвергавшихся электроболевому раздражению. Плавание в холодной воде приводило к снижению температуры тела животного – гипотермии, которая играет важную роль в развитии СВА [37]. В модели принудительного плавания в холодной воде анальгезия развивается в результате взаимодействия двух факторов – эмоционального стресса, вызванного процедурой плавания, и термического стресса, связанного с воздействием низкой температуры [37, 38]. Плавание в холодной воде является стрессором более высокой интенсивности по сравнению с использованным прерывистым электроболевым раздражением, поэтому влияние этого стрессора на величину болевого порога и поведение крыс более выражено.
У крыс, перенесших острый стресс, наблюдалось снижение величины пробега, числа стоек и обследованных норок у крыс в тесте “норковая камера”. Такие изменения параметров поведения животных свидетельствуют об уменьшении исследовательской активности. Показатели исследовательского поведения тесно связаны с изменениями уровня тревожности и эмоциональности. Ранее было показано, что снижение числа стоек и обследованных норок в тесте “норковая камера” отражает возрастание уровня тревожности [39–41]. Полученные нами результаты свидетельствуют о развитии анальгезии, снижении исследовательского поведения и увеличении уровня тревожности в ответ на действие использованных стрессоров, что согласуется с данными литературы [2, 4, 13].
Многочисленные данные свидетельствуют об участии эндогенной опиоидной системы в регуляции стрессорного ответа [13, 42]. Для оценки вовлеченности опиоидной системы в зарегистрированные эффекты использованных стрессогенных воздействий нами исследовалось влияние антагониста опиоидных рецепторов налоксона на эффекты острого стресса. В первой серии экспериментов предварительное введение налоксона не оказывало влияния на изменения поведения и болевой чувствительности, вызванные принудительным плаванием в холодной воде. При этом в группе крыс, перенесших острый стресс, была зарегистрирована статистически значимая отрицательная корреляция между величиной показателей поведения в “норковой камере” и изменениями болевого порога относительно фоновых значений (–0.83 < r < –0.67; p < 0.03). Отсутствие влияния налоксона на эффекты стрессорного воздействия в данной модели свидетельствует о том, что принудительное плавание в холодной воде приводит к развитию неопиоидной формы СВА. Налоксон также не оказывал влияния на поведение крыс, перенесших острый стресс, следовательно, нарушения поведения, отмеченные в этой серии опытов, также не связаны с опиоидной системой организма. Наличие значимой корреляции между изменениями болевой чувствительности и поведения животных, вызванными использованным воздействием, указывает на общие механизмы, лежащие в основе этих эффектов стресса.
Во второй и третьей сериях экспериментов в качестве стрессорного воздействия было использовано неизбегаемое прерывистое электроболевое раздражение. В этом случае предварительное введение налоксона приводило к статистически значимому ослаблению СВА, но не блокировало ее полностью. Влияния на стресс-вызванную тревожность налоксон не оказывал. Оценка зависимости между изменениями болевого порога относительно фоновых значений и параметрами поведения крыс в “норковой камере” не выявила значимой корреляции между этими показателями (0.12 < r < 0.39; p > 0.10). Следовательно, использованное нами стрессогенное воздействие вызывает смешанную форму СВА, содержащую опиоидный компонент. Отсутствие корреляционной зависимости между стресс-вызванными изменениями поведения и болевой чувствительности может указывать на различные механизмы, определяющие данные изменения.
Оценка влияния семакса на уровень болевой чувствительности животных, перенесших стресс, показала, что введение пептида не влияет на величину болевого порога в модели принудительного плавания в холодной воде, но приводит к уменьшению выраженности СВА в модели прерывистого электроболевого раздражения. При введении семакса за 15 мин до начала стрессорного воздействия значимое снижение болевого порога отмечалось через 5 и 20 мин после окончания раздражения (через 30–45 мин после инъекции). При введении пептида после стресса, значимое снижение болевого порога отмечалось только через 25 мин после раздражения (через 20 мин после введения пептида). Таким образом, семакс оказывает влияние на СВА как при введении до, так и после электроболевого раздражения, однако для развития эффекта пептида необходимо не менее 20 мин. Способность налоксона ослаблять СВА в модели электроболевого раздражения указывает на участие эндогенной опиоидной системы в развитии анальгезии. Ранее нами было показано, что предварительное введение семакса уменьшает анальгезию в модели принудительного плавания при температуре 28°С. Введение налоксона также ослабляло СВА, зарегистрированную в этой модели [29]. Способность семакса уменьшать выраженность СВА только в случае анальгезии, чувствительной к налоксону, свидетельствует о влиянии пептида на опиоидную составляющую СВА. Однако поскольку в обеих моделях наблюдалась смешанная форма СВА, нельзя полностью исключить возможность участия других медиаторных систем. На основании полученных данных и проведенных ранее исследований можно предположить, что семакс блокирует опиоидную составляющую анальгезии, вызванной острым стрессогенным воздействием. Влияние семакса на СВА определяется механизмом наблюдаемой анальгезии, а не природой использованного стрессора.
Многочисленные исследования свидетельствуют о функциональном взаимодействии меланокортиновой и опиоидной систем организма при модуляции передачи болевого сигнала [16]. Показано, что введение α-МСГ или АКТГ ослабляет анальгезию, вызванную как эндогенными (β-эндорфин), так и экзогенными (морфин) опиоидами [43, 44]. Меланокортиновые и опиоидные рецепторы демонстрируют сходное распределение в спинном мозге и различных областях головного мозга, что обеспечивает анатомическую основу для взаимодействия этих систем [45, 46]. Так, показано, что в нейронах околоводопроводного серого вещества могут экспрессироваться одновременно μ-опиоидные рецепторы и MC4R. Вероятно, колокализация этих рецепторов обеспечивает антиопиоидные эффекты MC [16]. Можно предположить, что ослабление СВА под действием семакса также может быть связано с его антиопиоидным действием.
Изучение влияния семакса на поведение крыс, перенесших острое стрессорное воздействие, показало, что введение пептида в исследованных дозах перед началом или после завершения действия стрессора не влияет на изменения поведения, зарегистрированные через 15–20 мин после стресса, как в модели принудительного плавания в холодной воде, так и в модели электроболевого раздражения. Ранее нами было показано, что предварительное введение семакса также не влияло на изменения поведения крыс через 20–30 мин после стресса в моделях принудительного плавания при температуре 28°С или однократной иммобилизации [28, 29]. Проведенные исследования позволяют заключить, что семакс в исследованных дозах не влияет на кратковременные изменения поведения крыс, вызванные острыми стрессогенными воздействиями различной природы.
Как уже указывалось, последовательность АКТГ15–18 необходима для связывания молекулы АКТГ с рецептором MC2R и последующей стимуляции выброса кортикостерона корой надпочечников [18]. Тетрапептид KKRR, соответствующий этой последовательности, связывается с рецептором MC2R, не активирует этот рецептор и препятствует связыванию с ним целой молекулы гормона [47]. Ранее нами были изучены эффекты пептида АКТГ15–18 и его аналога АКТГ15–18PGP в модели неизбегаемого электроболевого раздражения. Было показано, что предварительное введение этих пептидов снижает выброс кортикостерона в ответ на стрессирующее воздействие, уменьшает тревожность, вызванную острым стрессом, но не влияет на выраженность СВА [48]. Сопоставление эффектов АКТГ15–18 и семакса в модели острого стресса подтверждает важную роль кортикостерона в регуляции краткосрочных изменений поведения, вызванных прерывистым электроболевым воздействием, и участие эндогенной опиоидной системы в развитии СВА в данной модели.
На основании полученных данных можно заключить, что введение семакса в использованных дозах приводит к ослаблению опиоидной составляющей СВА, но не влияет на краткосрочные изменения поведения, вызванные острым стрессом. Известно, что острый стресс вызывает как кратковременные, так и отдаленные поведенческие, нейрохимические и структурные изменения, в основе которых могут лежать различные механизмы [5, 49]. Продолжительность долговременных изменений, вызванных острым стрессом, составляет от нескольких часов до нескольких суток [9, 50]. Ранее нами было показано, что предварительное введение семакса ослабляет изменения поведения крыс, зарегистрированные через 4 ч после окончания острого иммобилизационного стресса [51]. Можно предположить, что семакс способен ослаблять долговременные последствия острого стрессогенного воздействия, но не влияет на кратковременные изменения поведения, вызванные острым стрессом. Однако для выяснения влияния семакса на долговременные последствия острого стресса необходимы дальнейшие исследования.
Список литературы
Wilder RL (1995) Neuroendocrine–immune system interactions and autoimmunity. Annu Rev Immunol 13: 307–338. https://doi.org/10.1146/annurev.iy.13.040195.001515
Finn DP (2010) Endocannabinoid-mediated modulation of stress responses: physiological and pathophysiological significance. Immunobiology 215(8): 629–646. https://doi.org/10.1016/j.imbio.2009.05.011
Ghasemzadeh Z, Rezayof A (2015) Ventral hippocampal nicotinic acetylcholine receptors mediate stress-induced analgesia in mice. Prog Neuropsychopharmacol Biol Psychiatry 56: 235–242. https://doi.org/10.1016/j.pnpbp.2014.09.008
Cecconello AL, Torres IL, Oliveira C, Zanini P, Niches G, Ribeiro MF (2016) DHEA administration modulates stress-induced analgesia in rats. Physiol Behav 157: 231–236. https://doi.org/10.1016/j.physbeh.2016.02.004
Tillage RP, Foster SL, Lustberg D, Liles LC, McCann KE, Weinshenker D (2021) Co-released norepinephrine and galanin act on different timescales to promote stress-induced anxiety-like behavior. Neuropsychopharmacology 46(8): 1535–1543. https://doi.org/10.1038/s41386-021-01011-8
Floriou-Servou A, von Ziegler L, Waag R, Schläppi C, Germain PL, Bohacek J (2021) The Acute Stress Response in the Multiomic Era. Biol Psychiatry 89(12): 1116–1126. https://doi.org/10.1016/j.biopsych.2020.12.031
Гуляева НВ (2022) Нейроэндокринный контроль гиперглутаматергических состояний при патологиях мозга: влияние глюкокортикоидов. Рос физиол журн им ИМ Сеченова 108 (9): 1077–1093. [Gulyaeva NV (2022) Neuroendocrine control of hyperglutamatergic states in brain pathologies: the effects of glucocorticoids. Russ J Physiol 108(9): 1077–1093. (In Russ)]. https://doi.org/10.31857/S0869813922090102
O’Connor TM, O’Halloran DJ, Shanahan F (2000) The stress response and the hypothalamic-pituitary-adrenal axis: from molecule to melancholia. QJM 93(6): 323–333. https://doi.org/10.1093/qjmed/93.6.323
Busnardo C, Crestani CC, Scopinho AA, Packard BA, Resstel LBM, Correa FMA, Herman JP (2019) Nitrergic neurotransmission in the paraventricular nucleus of the hypothalamus modulates autonomic, neuroendocrine and behavioral responses to acute restraint stress in rats. Prog Neuropsychopharmacol Biol Psychiatry 90: 16–27. https://doi.org/10.1016/j.pnpbp.2018.11.001
Tang W, Zhou D, Wang S, Hao S, Wang X, Helmy M, Zhu J, Wang H (2021) CRH Neurons in the Laterodorsal Tegmentum Mediate Acute Stress-induced Anxiety. Neurosci Bull 37(7): 999–1004. https://doi.org/10.1007/s12264-021-00684-x
Millan MJ, Brocco M (2003) The Vogel conflict test: procedural aspects, gamma-aminobutyric acid, glutamate and monoamines. Eur J Pharmacol 463(1–3): 67–96. https://doi.org/10.1016/s0014-2999(03)01275-5
McCall JG, Al-Hasani R, Siuda ER, Hong DY, Norris AJ, Ford CP, Bruchas MR (2015) CRH Engagement of the Locus Coeruleus Noradrenergic System Mediates Stress-Induced Anxiety. Neuron 87(3): 605–620. https://doi.org/10.1016/j.neuron.2015.07.002
al’Absi M, Nakajima M, Bruehl S (2021) Stress and pain: modality-specific opioid mediation of stress-induced analgesia. J Neural Transm (Vienna) 128(9): 1397–1407. https://doi.org/10.1007/s00702-021-02401-4
Gantz I, Fong TM (2003) The melanocortin system. Am J Physiol Endocrinol Metab 284(3): E468–E474. https://doi.org/10.1152/ajpendo.00434.2002
Yang Y, Harmon CM (2020) Molecular determinants of ACTH receptor for ligand selectivity. Mol Cell Endocrinol 503: 110688. https://doi.org/10.1016/j.mce.2019.110688
Sharfman N, Gilpin NW (2021) The Role of Melanocortin Plasticity in Pain-Related Outcomes After Alcohol Exposure. Front Psychiatry 12: 764720. https://doi.org/10.3389/fpsyt.2021.764720
Fridmanis D, Roga A, Klovins J (2017) ACTH Receptor (MC2R) Specificity: What Do We Know About Underlying Molecular Mechanisms? Front Endocrinol (Lausanne) 8: 13. https://doi.org/10.3389/fendo.2017.00013
Gallo-Payet N, Martinez A, Lacroix A (2017) Editorial: ACTH Action in the Adrenal Cortex: From Molecular Biology to Pathophysiology. Front Endocrinol (Lausanne) 8: 101. https://doi.org/10.3389/fendo.2017.00101
Yamano Y, Yoshioka M, Toda Y, Oshida Y, Chaki S, Hamamoto K, Morishima I (2004) Regulation of CRF, POMC and MC4R gene expression after electrical foot shock stress in the rat amygdala and hypothalamus. J Vet Med Sci 66(11): 1323–1327. https://doi.org/10.1292/jvms.66.1323
Chaki S, Okuyama S (2005) Involvement of melanocortin-4 receptor in anxiety and depression. Peptides 26(10): 1952–1964. https://doi.org/10.1016/j.peptides.2004.11.029
Chaki S, Ogawa S, Toda Y, Funakoshi T, Okuyama S (2003) Involvement of the melanocortin MC4 receptor in stress-related behavior in rodents. Eur J Pharmacol 474(1): 95–101. https://doi.org/10.1016/s0014-2999(03)02033-8
Shimazaki T, Chaki S (2005) Anxiolytic-like effect of a selective and non-peptidergic melanocortin 4 receptor antagonist, MCL0129, in a social interaction test. Pharmacol Biochem Behav 80(3): 395–400. https://doi.org/10.1016/j.pbb.2004.11.014
Ashmarin IP, Nezavibatko VN, Levitskaya NG, Koshelev VB, Kamensky AA (1995) Design and investigation of an ACTH(4-10) analogue lacking D-amino acids and hidrophobic radicals. Neurosci Res Commun 16(2): 105–112.
Ашмарин ИП, Незавибатько ВН, Мясоедов НФ, Каменский АА, Гривенников ИА, Пономарева-Степная МА, Андреева ЛА, Каплан АЯ, Кошелев ВБ, Рясина ТВ (1997) Ноотропный аналог адренокортикотропина 4–10 – семакс (15-летний опыт разработки и изучения). Журн высш нерв деятельн им ИП Павлова 47: 420–430. [Asmarin IP, Nezavibat’ko VN, Miasoedov NF, Kamenski˘ı AA, Grivennikov IA, Ponomareva-Stepnaia MA, Andreeva LA, Kaplan AI, Koshelev VB, Riasina TV (1997) A nootropic adrenocorticotropin analog 4–10 – semax (l5 years experience in its design and study). Zhurn Vyss Nervn Deiatelnosti im IP Pavlova 47: 420–430. (In Russ)].
Виленский ДА, Левицкая НГ, Андреева ЛА, Алфеева ЛЮ, Каменский АА, Мясоедов НФ (2007) Влияние хронического введения семакса на исследовательскую активность и эмоциональное состояние белых крыс. Рос физиол журн им ИМ Сеченова 93(6): 661–669. [Vilenski$\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\smile}$}}{\imath } $ DA, Levitskaia NG, Andreeva LA, Alfeeva LIu, Kamenski$\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\smile}$}}{\imath } $ AA, Miasoedov NF (2007) Effects of chronic Semax administration on exploratory activity and emotional reaction in white rats. Russ J Physiol 93(6): 661–669. (In Russ)].
Yatsenko KA, Glazova NYu, Inozemtseva LS, Andreeva LA, Kamensky AA, Grivennikov IA, Levitskaya NG, Dolotov OV, Myasoedov NF (2013) Heptapeptide Semax Attenuates the Effects of Chronic Unpredictable Stress in Rats. Dokl Biol Sci 453: 353–357. https://doi.org/10.1134/S0012496613060161
Levitskaya NG, Vilenskii DA, Sebentsova EA, Andreeva LA, Kamensky AA, Myasoedov NF (2010) Influence of semax on the emotional state of white rats in the norm and against the background of cholecystokinin-tetrapeptide action. Biol Bull 37(2): 186–192. https://doi.org/10.1134/S1062359010020147
Glazova NYu, Sebentsova EA, Manchenko DM, Andreeva LA, Dergunova LV, Levitskaya NG, Limborska SA, Myasoedov NF (2018) The Protective Effect of Semax in a Model of Stress-induced Impairment of Memory and Behavior in White Rats. Biol Bull 45(4): 394–399. https://doi.org/10.1134/S1062359018040040
Ivanova DM, Vilenski$\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\smile}$}}{\imath } $ DA, Levitskaya NG, Andreeva LA, Alfeeva LY, Kamenski$\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\smile}$}}{\imath } $ AA, Miasoedov NF (2006) Effect of Semax on changes in pain sensitivity and behavior of animals induced by forced swimming. Dokl Biol Sci 407: 123–127. https://doi.org/10.1134/s001249660602003710.1134/s0012496606020037
Atwal N, Winters BL, Vaughan CW (2020) Endogenous cannabinoid modulation of restraint stress-induced analgesia in thermal nociception. J Neurochem 152(1): 92–102. https://doi.org/10.1111/jnc.14884
Lewis JW, Cannon JT, Liebeskind JC (1980) Opioid and nonopioid mechanisms of stress analgesia. Science 208(4444): 623–625. https://doi.org/10.1126/science.7367889
Mogil JS, Sternberg WF, Balian H, Liebeskind JC, Sadowski B (1996) Opioid and nonopioid swim stress-induced analgesia: a parametric analysis in mice. Physiol Behav 59(1): 123–132. https://doi.org/10.1016/0031-9384(95)02073-x
Hohmann AG, Suplita RL, Bolton NM, Neely MH, Fegley D, Mangieri R, Krey JF, Walker JM, Holmes PV, Crystal JD, Duranti A, Tontini A, Mor M, Tarzia G, Piomelli D (2005) An endocannabinoid mechanism for stress-induced analgesia. Nature 435(7045): 1108–1112. https://doi.org/10.1038/nature03658
Lafrance M, Roussy G, Belleville K, Maeno H, Beaudet N, Wada K, Sarret P (2010) Involvement of NTS2 receptors in stress-induced analgesia. Neuroscience 166(2): 639–652. https://doi.org/10.1016/j.neuroscience.2009.12.042
Terman GW, Shavit Y, Lewis JW, Cannon JT, Liebeskind JC (1984) Intrinsic mechanisms of pain inhibition: activation by stress. Science 226(4680): 1270–1277. https://doi.org/10.1126/science.6505691
Terman GW, Morgan MJ, Liebeskind JC (1986) Opioid and non-opioid stress analgesia from cold water swim: importance of stress severity. Brain Res 372(1): 167–171. https://doi.org/10.1016/0006-8993(86)91472-1
Sadowski B, Konarzewski M (1999) Analgesia in selectively bred mice exposed to cold in helium/oxygen atmosphere. Physiol Behav 66(1): 145–151. https://doi.org/10.1016/s0031-9384(98)00282-0
Łapo IB, Konarzewski M, Sadowski B (2003) Analgesia induced by swim stress: interaction between analgesic and thermoregulatory mechanisms. Pflugers Arch 446(4): 463–469. https://doi.org/10.1007/s00424-003-1060-9
Takeda H, Tsuji M, Matsumiya T (1998) Changes in head-dipping behavior in the hole-board test reflect the anxiogenic and/or anxiolytic state in mice. Eur J Pharmacol 350(1): 21–29. https://doi.org/10.1016/s0014-2999(98)00223-4
Abbasi-Habashi S, Ghasemzadeh Z, Rezayof A (2020) Morphine improved stress-induced amnesia and anxiety through interacting with the ventral hippocampal endocannabinoid system in rats. Brain Res Bull 164: 407–414. https://doi.org/10.1016/j.brainresbull.2020.09.002
Farzamfard P, Rezayof A, Alijanpour S (2022) Ventral hippocampal NMDA receptors mediate the effects of nicotine on stress-induced anxiety/exploratory behaviors in rats. Neurosci Lett 780: 136649. https://doi.org/10.1016/j.neulet.2022.136649
Bershad AK, Miller MA, Norman GJ, de Wit H (2018) Effects of opioid- and non-opioid analgesics on responses to psychosocial stress in humans. Horm Behav 102: 41–47. https://doi.org/10.1016/j.yhbeh.2018.04.009
Smock T, Fields HL (1981) ACTH1-24 blocks opiate-induced analgesia in the rat. Brain Res 212(1): 202–206. https://doi.org/10.1016/0006-8993(81)90052-4
Contreras PC, Takemori AE (1984) Antagonism of morphine-induced analgesia, tolerance and dependence by alpha-melanocyte-stimulating hormone. J Pharmacol Exp Ther 229(1): 21–26.
Ercil NE, Galici R, Kesterson RA (2005) HS014, a selective melanocortin-4 (MC4) receptor antagonist, modulates the behavioral effects of morphine in mice. Psychopharmacology (Berl) 180(2): 279–285. https://doi.org/10.1007/s00213-005-2166-x
Han DJ, He ZG, Yang H (2018) Melanocortin-4 receptor in subthalamic nucleus is involved in the modulation of nociception. Am J Clin Exp Immunol 7(4): 76–80.
Kovalitskaya YA, Zolotarev YA, Kolobov AA, Sadovnikov VB, Yurovsky VV, Navolotskaya EV (2007) Interaction of ACTH synthetic fragments with rat adrenal cortex membranes. J Pept Sci 13(8): 513–518. https://doi.org/10.1002/psc.873
Манченко ДМ, Глазова НЮ, Себенцова ЕА, Андреева ЛА, Долотов ОВ, Каменский АА, Мясоедов НФ, Левицкая НГ (2022) Влияние фрагмента АКТГ15-18 и его аналога АКТГ15-18-Pro-Gly-Pro на последствия острого стрессогенного воздействия. Журн высш нерв деятельн им ИП Павлова 72(4): 561–575. [Manchenko DM, Glazova NYu, Sebentsova EA, Andreeva LA, Dolotov OV, Kamensky AA, Myasoedov NF, Levitskaya NG (2022) Effects of fragment ACTH15-18 and its analog ACTH15-18-PGP on the consequences of the acute stress exposure. Zh Vyss Nervn Deiatelnosti im IP Pavlova 72: 561–575. (In Russ)]. https://doi.org/10.31857/S0044467722040074
Musazzi L, Tornese P, Sala N, Popoli M (2018) What Acute Stress Protocols Can Tell Us About PTSD and Stress-Related Neuropsychiatric Disorders. Front Pharmacol 9: 758. https://doi.org/10.3389/fphar.2018.00758
Chakraborty P, Chattarji S (2019) Interventions after acute stress prevent its delayed effects on the amygdala. Neurobiol Stress 10: 100168. https://doi.org/10.1016/j.ynstr.2019.100168
Filippenkov IB, Stavchansky VV, Glazova NY, Sebentsova EA, Remizova JA, Valieva LV, Levitskaya NG, Myasoedov NF, Limborska SA, Dergunova LV (2021) Antistress action of melanocortin derivatives associated with correction of gene expression patterns in the hippocampus of male rats following acute stress. Int J Mol Sci 22(18): 10054. https://doi.org/10.3390/ijms221810054
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


