Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 1, стр. 109-118
Оптимизация структуры α-гарпинина, блокирующего калиевые каналы KV1.3
А. М. Гиголаев 1, В. М. Табакмахер 1, С. Пеньёр 2, Я. Титгат 2, А. А. Василевский 1, 3, *
1 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова
Российской академии наук
Москва, Россия
2 Лёвенский университет
Лёвен, Бельгия
3 Московский физико-технический институт (государственный университет)
Долгопрудный, Московская область, Россия
* E-mail: avas@ibch.ru
Поступила в редакцию 02.12.2022
После доработки 09.12.2022
Принята к публикации 11.12.2022
- EDN: IYEAZZ
- DOI: 10.31857/S0869813923010041
Аннотация
Актуальной задачей современной физиологии и фармакологии является получение соединений, обладающих специфичностью в отношении определенных изоформ ионных каналов. В серии статей мы показали, что α-гарпининовая укладка может служить шаблоном для рационального проектирования пептидных лигандов калиевых каналов. В данной работе было использовано молекулярное моделирование, чтобы оптимизировать структуру ранее полученного пептида Tk-hefu-10, селективного блокатора каналов KV1.3, полумаксимальная концентрация ингибирования (ИК50) для которого составляет ≈150 нМ. Расчеты молекулярной динамики комплекса Tk-hefu-10–KV1.3 предоставили информацию о взаимодействии отдельных аминокислотных остатков пептида и канала, а анализ этих взаимодействий позволил предложить аминокислотные замены в структуре Tk-hefu-10 для увеличения его аффинности. Новый пептид Tk-hefu-12 представляет собой укороченный на один остаток аналог Tk-hefu-10 с пятью заменами; экспериментальная проверка активности показала, что его ИК50 ≈ 70 нМ против KV1.3. Кроме того, в структуре Tk-hefu-12 отсутствуют остатки метионина, что позволяет перейти к получению пептидов линейки Tk-hefu с использованием бромциана.
Потенциал-чувствительные калиевые каналы (KV) формируют нисходящую фазу потенциала действия и потому играют важную роль в физиологии нервной системы и мышц [1]. Интересно, что KV встречаются также в клетках и тканях, не являющихся электровозбудимыми. В частности, изоформа KV1.3 характерна для клеток иммунной системы [2]. Эти каналы необходимы для пролиферации особой субпопуляции T-клеток и секреции ими цитокинов [3–5]. Предполагается, что гомомерные KV1.3 служат фармакологической мишенью в различных аутоиммунных заболеваниях, таких как рассеянный склероз, диабет 1-го типа, ревматоидный артрит и псориаз, а ингибиторы этих каналов будут оказывать терапевтический эффект [3, 5, 6]. Очевидно, что разработка селективных лигандов KV является важной задачей современной фармакологии.
Ранее было показано, что сравнительно простая укладка защитных пептидов растений, называемых α-гарпининами, может быть использована для рационального дизайна блокаторов KV [7]. Эта укладка состоит из двух коротких антипараллельных α-спиралей, стабилизированных двумя дисульфидными связями; общая длина пептидов составляет ~20–50 аминокислотных остатков. Для этого в структуру пептида Tk-AMP-X2 из пшеницы Triticum kiharae мы внесли так называемую “функциональную диаду” блокаторов калиевых каналов и получили пептид Tk-hefu. Затем нам удалось с помощью подходов белковой топографии и молекулярной динамики (МД) создать селективные блокаторы различных изоформ каналов: KV1.3 [8, 9] и KV1.6 [10]. При этом в качестве шаблона был использован тот же пептид Tk-hefu, и в его структуру последовательно вносили точечные замены, руководствуясь соображениями о вкладе конкретных аминокислотных остатков в стабильность комплекса пептида с каналами. В результате, в частности, был получен пептид Tk-hefu-10 (см. аминокислотную последовательность на рис. 1a) с полумаксимальной концентрацией ингибирования ИК50 ≈ 150 нМ в отношении KV1.3 [9].
Рис. 1.
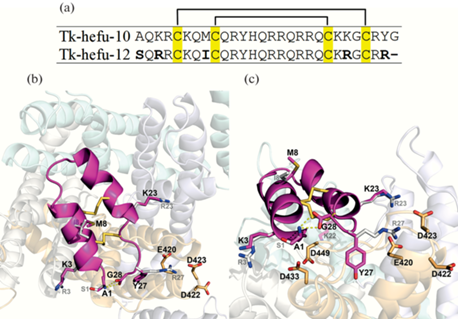
Аминокислотные последовательности исследуемых пептидов и модель комплекса Tk-hefu-10 с каналом KV1.3. (a) – Cравнение аминокислотных последовательностей Tk-hefu-10 и 12. Остатки цистеина выделены желтым, показано расположение дисульфидных связей. (b) – Модель комплекса Tk-hefu-10–KV1.3 после 200 нс МД в гидратированном липидном бислое. Вид внешнего вестибюля поры канала. (c) – Вид со стороны клеточной мембраны. Субъединицы канала (показаны полупрозрачно на заднем плане) и пептид (показан розовым цветом) представлены в виде ленточных моделей. Затыкающий пору канала остаток K22 (полупрозрачный на панели c), некоторые остатки пептида Tk-hefu-10, выбранные для замены/делеции, возможное положение боковой цепи остатков S1, R3, I8, R23 и R27 (показаны белым цветом) и дисульфидные мостики в пептиде Tk-hefu-12, а также некоторые отрицательно заряженные остатки канала показаны стержневыми моделями. Желтыми пунктирными линиями обозначены полярные контакты между N- и C-концевыми остатками пептида. Визуализация выполнена с помощью программы PyMOL.
В данной работе производилась дальнейшая оптимизация производных Tk-hefu. Основное внимание было уделено остаткам, которые образуют слабые взаимодействия с порой KV1.3. Используя модель комплекса Tk-hefu-10 с KV1.3, были предложены новые замены, которые должны привести к его стабилизации. В результате был получен новый пептид Tk-hefu-12, обладающий ИК50 ≈ 70 нМ в отношении KV1.3.
МЕТОДЫ ИССЛЕДОВАНИЯ
Молекулярное моделирование. Структурная модель комплекса Tk-hefu-10 с KV1.3 была построена нами ранее [10]. Процедура in silico мутагенеза с целью визуализации предлагаемых изменений в структуре Tk-hefu-10 была выполнена в программе PyMOL Molecular Graphics System, версия 1.8 (Schrödinger, LLC).
Подготовка комплекса Tk-hefu-10 с KV1.3 к моделированию МД была проведена с использованием оригинального программного пакета IMPULSE (Крылов и др., готовится к печати) аналогично процедуре, описанной ранее [10]. Комплекс помещали внутрь липидного бислоя, имитирующего мембрану нейронов. Был использован предварительно уравновешенный фрагмент бислоя (7.0 × 7.0 × 13.5 нм3; 1-пальмитил-2-олеил-sn-глицеро-3-фосфохолин/1-пальмитил-2-олеил-sn-глицеро-3-фосфоэтаноламин/холестерин, POPC:POPE:Chl; 100:50:50 молекул соответственно, сольватированных 14172 молекулами воды), что подробно описано в предыдущих работах [8, 11, 12]; некоторые молекулы фосфолипидов и Chl были удалены, чтобы освободить место для белка. Для сольватации использовали модель воды TIP3P [13] и ионы Na+/Cl– в количестве, необходимом для поддержания электронейтральности.
Молекулярная система была уравновешена (нагрета до 37°C) в течение 100 пс МД. Положения Cα-атомов остатков канала, не формирующих вестибюль его поры, а также Nε-атом остатка K22 в Tk-hefu-10 фиксировали во время уравновешивания для предотвращения дестабилизации исходного комплекса. Затем рассчитывали МД длительностью 500 нс. Все МД эксперименты были выполнены с помощью программного обеспечения GROMACS, версия 2020 [14], с использованием набора параметров AMBER99SB-ILDN [15]. Моделирование проводили с временным шагом 2 фс, с использованием трехмерных периодических граничных условий, в изотермическом-изобарическом (NPT) ансамбле с полуизотропным давлением 1 бар и при температуре 37°C. Использовали алгоритмы баростата Берендсена [16] и термостата V-rescale [17]. Ван-дер-ваальсовы взаимодействия рассчитывали с применением сферической функции обрезания потенциала с отсечкой 1.4 нм. Электростатические взаимодействия учитывали с помощью алгоритма PME.
Анализ межмолекулярных контактов в ходе МД выполняли с использованием программного пакета IMPULSE аналогично процедурам, подробно описанным в предшествующем исследовании [8]. Водородные связи оценивали с использованием параметров утилиты hbond пакета GROMACS [14] (расстояние D–A ≤ 0.35 нм и угол D–H–A ≥ 150° для водородной связи D–H···A, где D и A – донор и акцептор водородной связи соответственно); солевые мостики, π-катионные и стэкинг-взаимодействия, а также гидрофобные контакты рассчитывали, как описано ранее [18, 19]. Визуализация трехмерных структур белковых комплексов была выполнена с помощью программы PyMOL.
Получение рекомбинантного пептида. Tk-hefu-12 был получен с использованием нашего стандартного подхода [7–9]. Пептид был получен в бактериальной системе экспрессии в составе гибридного белка Trx–Tk-hefu-12, также содержащего вспомогательный белок тиоредоксин (Trx) [20], сайт гидролиза энтеропептидазы человека [21] и гексагистидиновую последовательность.
Последовательность ДНК, кодирующая Tk-hefu-12, была получена из синтетических олигонуклеотидов при помощи ПЦР. На первом этапе полная целевая последовательность была синтезирована в результате пяти циклов ПЦР с использованием двух прямых (F1 и F2) и двух обратных праймеров (R1 и R2; табл. 1). Затем реакционная смесь была разведена в 100 раз и использовалась в качестве матрицы. Для наработки целевой последовательности использовались только крайние праймеры (F1 и R1). Амплифицированный фрагмент ДНК вставили в экспрессионный вектор pET-32b (Novagen) по сайтам рестрикции KpnI и BamHI — в результате была получена плазмида pET-32b-Tk-hefu-12.
Таблица 1.
Последовательности олигонуклеотидов, использованных для синтеза гена Tk-hefu-12
| Название | Последовательность (5'—3') |
|---|---|
| F1 | GCGATAGGTACCGACGACGATGACCGTTCCCAGCGTCGTTGC |
| F2 | GCCAGCGTTATCATCAGCGTCGTCAGCGTCGTCAGTGCAAACGTGGCTGC |
| R1 | TATCGCGGATCCCTAACGACGGCAGCCACGTTTGCACTG |
| R2 | CGCTGATGATAACGCTGGCACATCTGTTTGCAACGACGCTGGGAACG |
Эта плазмида затем использовалась для трансформации штамма Escherichia coli SHuffle T7 Express (New England Biolabs) [22]. Трансформированные бактерии культивировались в присутствии ампициллина при температуре 30°C в среде LB до середины экспоненциальной фазы роста. Экспрессию гена гибридного белка Trx–Tk-hefu-12 индуцировали 0.2 мМ изопропил-β-D-тиогалагктопиранозида, после чего бактериальную культуру инкубировали при комнатной температуре (24°C) в течение 16 ч. Клеточную массу отделили центрифугированием, ресуспендировали в стартовом буфере для аффинной хроматографии (300 мM NaCl, 50 мM Tris-HCl, pH 8.0) и обработали ультразвуком. Полученный лизат наносили на колонку со смолой HisPur Cobalt Resin (Thermo Fisher Scientific). Гибридный белок очищали по протоколу производителя смолы.
Полученный гибридный белок Trx–Tk-hefu-12 растворяли в 50 мM Tris-HCl (pH 8.0) в концентрации 1 мг/мл. К раствору белка добавляли легкую цепь энтеропептидазы человека (1 МЕ фермента на 1 мг белка). Протеолиз проводили в течение 16 ч при 37°C. Отщепленный пептид Tk-hefu-12 очищали с использованием обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) на колонке Jupiter C5 (4.6 × 250 мм; Phenomenex) в линейном градиенте концентрации ацетонитрила (0–60% за 60 мин) в присутствии 0.1%-ного раствора трифторуксусной кислоты.
Масс-спектрометрия. Для измерения молекулярной массы пептида использовали метод матрично-активированной лазерной десорбции/ионизации (МАЛДИ) масс-спектрометрии. Измерение проводили на приборе Ultraflex TOF-TOF (Bruker Daltonik) в режиме рефлектрона с ошибкой масс не более 100 ppm как было описано ранее [23].
Электрофизиология. Эксперименты выполнялись как описано ранее [24]. Ген KV1.3 человека (GenBank ID: NM002232) экспрессировали в ооцитах лягушки Xenopus laevis. Для этого линеаризованная плазмида pCI-neo, содержащая соответствующий ген, была транскрибирована in vitro с использованием набора T7 mMESSAGE-mMACHINE (ThermoFisher Scientific). мРНК, кодирующая канал, инъецировали в ооциты при помощи микроинжектора (Drummond Scientific). Ооциты инкубировали в буфере ND96: (в мМ) 96 NaCl, 2 KCl, 1.8 CaCl2, 2 MgCl2 и 5 HEPES (pH 7.4), также содержащем 50 мг/л сульфата гентамицина.
Для регистрации токов через мембрану ооцитов использовали метод двухэлектродной фиксации потенциала. Эксперименты проводили при комнатной температуре (18–22°C) с использованием усилителя Geneclamp 500 (Molecular Devices) и программного обеспечения pClamp (Axon Instruments). В качестве омывающего ооциты раствора использовали буфер ND96. Ток через KV1.3 вызывался импульсом от –90 до 0 мВ в течение 250 мс, за которым следовал импульс до –50 мВ. Для построения кривой доза – ответ данные анализировали по уравнению Хилла:
Все измерения проведены в трех или более повторах (n ≥ 3).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Наши предыдущие исследования показали, что введение положительно заряженных остатков в область Tk-hefu, взаимодействующую с KV, улучшает связывание [9]. И наоборот, присутствие отрицательно заряженных остатков ослабляет его (как в случае Tk-hefu и Tk-hefu-4, имеющих остатки E23 и E6 соответственно). Это хорошо согласуется с наблюдением, что внешний вестибюль поры KV обычно заряжен отрицательно [25]. В результате проведенного компьютерного исследования была получена траектория МД комплекса Tk-hefu-10–KV1.3 в водно-мембранном окружении продолжительностью 500 нс (рис. 1b, c). Отмечено, что ориентация Tk-hefu-10 относительно канала не претерпевает значительных изменений в течение МД. Анализ траектории продемонстрировал высокую стабильность комплекса: среднеквадратичное отклонение положения Cα-атомов Tk-hefu-10 составило в среднем 0.37 нм. Строение комплекса на протяжении траектории МД оставалось похожим на молекулярные системы, исследованные нами ранее [8–10].
Стратегия внесения модификаций. Внимательное рассмотрение модели комплекса Tk-hefu-10–KV1.3 а также имеющиеся экспериментальные данные об активности Tk-hefu-10 и его аналогов [8–10] позволили нам предложить аминокислотные замены в структуру пептида для увеличения его аффинности в отношении KV1.3 (рис. 1a):
1. Исходя из того, что остатки аргинина имеют больше возможностей для образования специфических контактов (водородных связей, солевых мостиков, π–π и π-катионных взаимодействий), чем остатки лизина, было принято решение внести замены K3R и K23R. Аналогично предложена замена A1S: в отличие от аланина, серин способен образовывать водородные связи своей боковой цепью.
2. При анализе траектории комплекса Tk-hefu-10–KV1.3 были сделаны следующие наблюдения: (а) карбоксильная группа C-концевого остатка пептида G28 находится вблизи одноименно заряженных боковых цепей остатков KV1.3: E420, D422, D423, D433 и D449, что может негативно сказываться на устойчивости комплекса ввиду их взаимного отталкивания; (б) эта же карбоксильная группа образует внутримолекулярный солевой мостик и водородную связь с аминогруппой остатка A1, что может препятствовать образованию его контактов с каналом. С целью уменьшения негативного влияния этих факторов было принято решение укоротить пептид на один остаток с C-конца.
3. Поскольку боковая цепь Y27 в комплексе Tk-hefu-10 с KV1.3 находится рядом с остатками канала E420, D422 и D423, было принято решение произвести замену Y27R. Вводимый остаток аргинина, как было отмечено выше, имеет обширные возможности образования новых полярных контактов.
Кроме того, мы также решили заменить единственный остаток метионина в структуре пептида. Дело в том, что в лабораторной практике зачастую проще и быстрее получать рекомбинантные пептиды с использованием бромциана для расщепления гибридного белка. Из двух возможных остатков, имеющих примерно равные по размеру боковые цепи с метионином (лейцин и изолейцин), мы выбрали изолейцин (замену M8I), поскольку, к примеру, среди харибдотоксина и родственных блокаторов KV имеет место именно такая замена [26].
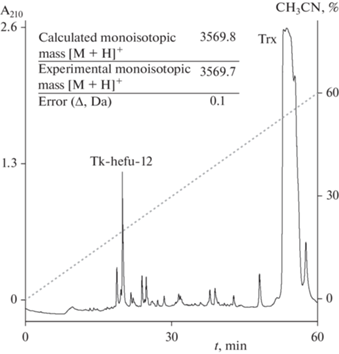
Получение и тестирование оптимизированного α-гарпинина. Все вышеперечисленные изменения привели к структуре Tk-hefu-12 (рис. 1a). Для экспериментальной проверки эффекта предложенных замен пептид Tk-hefu-12 был получен с использованием подходов молекулярной биологии и химии белка. Мы использовали штамм E. coli SHuffle T7 Express, оптимальный для наработки дисульфид-содержащих белков. Синтетический ген, кодирующий пептид, был вставлен в экспрессионный вектор pET-32b, Trx был использован как белок-помощник для увеличения выхода. Целевой пептид был получен в результате ферментативного гидролиза слитного белка энтеропептидазой человека с последующим разделением при помощи ОФ-ВЭЖХ и идентификацией с помощью МАЛДИ масс-спектрометрии (рис. 2). Итоговый выход Tk-hefu-12 составил ~2 мг с 1 литра питательной среды.
Рис. 2.
Получение Tk-hefu-12. Профиль разделения гидролизата гибридного белка Trx–Tk-hefu-12 при помощи ОФ-ВЭЖХ. В таблице указаны расчетная и экспериментально измеренная молекулярные массы Tk-hefu-12.
Активность полученного пептида была изучена на канале KV1.3 методом двухэлектродной фиксации потенциала (рис. 3). Значение ИК50 составило 68.1 ± 11.0 нM (h = 0.66 ± 0.07). Таким образом, можно сказать, что внесенные замены в последовательность Tk-hefu-10 позволили увеличить аффинность пептида по отношению к каналу KV1.3 в два раза.
Рис. 3.
(a) – Репрезентативная запись токов через мембрану ооцитов в контроле (черная кривая) и в присутствии 70 нМ пептида Tk-hefu-12 (серая кривая). (b) – Кривая зависимости ингибирования тока через канал от концентрации пептида Tk-hefu-12. Вертикальные линии на квадаратах показывают стандартную ошибку среднего (n ≥ 3).
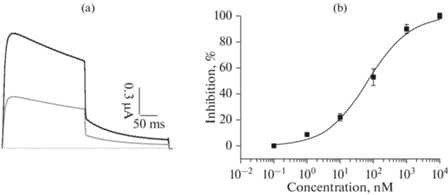
Этот результат указывает на то, что выбранные модификации действительно привели к желаемому эффекту стабилизации комплекса пептида с каналом. Однако увеличение аффинности только в два раза скорее всего вызвано тем, что отдельные модификации на самом деле, вопреки нашим ожиданиям, вносят отрицательный вклад в комплексообразование. Для выяснения роли отдельных замененных остатков необходимо будет получить производные с единичными мутациями.
ЗАКЛЮЧЕНИЕ
Нашей целью является дальнейшая оптимизация α-гарпининовой укладки. Этот минифолд показывает себя с лучшей стороны в качестве удобного каркаса для скаффолд-инженерии. В настоящей работе нам удалось получить оптимизированный пептид Tk-hefu-12 с увеличенной аффинностью в отношении важной фармакологической мишени.
Помимо внесения замен, было показано, что Tk-hefu можно укоротить путем удаления C-концевого остатка глицина, который по результатам нашего моделирования является помехой для формирования стабильного комплекса с каналом. Вполне вероятно, что имеется возможность и дальнейшей миниатюризации пептида.
Еще одним шагом в оптимизации Tk-hefu является внесение замены M8I в структуру пептида. Так как в модели комплекса остаток метионина не образует контактов с KV, то замена на схожий по физико-химическим свойствам остаток не должна повлиять на активность пептида. Заменив метионин, мы получаем возможность использовать бромциан для гидролиза слитных белков, что в лабораторных условиях зачастую представляет собой более удобный способ получения пептидов.
Список литературы
Hille B (2001) Ion Channels of Excitable Membranes, 3rd ed. Sinauer Associates, Inc., Sunderland. Mass.
Feske S, Wulff H, Skolnik EY (2015) Ion channels in innate and adaptive immunity. Annu Rev Immunol 33: 291–353. https://doi.org/10.1146/ANNUREV-IMMUNOL-032414-112212
Wulff H, Calabresi PA, Allie R, Yun S, Pennington M, Beeton C, Chandy KG (2003) The voltage-gated Kv1.3 K(+) channel in effector memory T cells as new target for MS. J Clin Invest 111: 1703–1713. https://doi.org/10.1172/JCI16921
Chandy KG, Wulff H, Beeton C, Pennington M, Gutman GA, Cahalan MD (2004) K+ channels as targets for specific immunomodulation. Trends Pharmacol Sci 25: 280–289. https://doi.org/10.1016/j.tips.2004.03.010
Beeton C, Wulff H, Standifer NE, Azam P, Mullen KM, Pennington MW, Kolski-Andreaco A, Wei E, Grino A, Counts DR, Wang PH, LeeHealey CJ, S Andrews B, Sankaranarayanan A, Homerick D, Roeck WW, Tehranzadeh J, Stanhope KL, Zimin P, Havel PJ, Griffey S, Knaus H-G, Nepom GT, Gutman GA, Calabresi PA, Chandy KG (2006) KV1.3 channels are a therapeutic target for T cell-mediated autoimmune diseases. Proc Natl Acad Sci USA 103: 17 414–17 419. https://doi.org/10.1073/pnas.0605136103
Valverde P, Kawai T, Taubman MA (2004) Selective blockade of voltage-gated potassium channels reduces inflammatory bone resorption in experimental periodontal disease. J Bone Miner Res 19: 155–164. https://doi.org/10.1359/JBMR.0301213
Berkut AA, Usmanova DR, Peigneur S, Oparin PB, Mineev KS, Odintsova TI, Tytgat J, Arseniev AS, Grishin E V., Vassilevski AA (2014) Structural similarity between defense peptide from wheat and scorpion neurotoxin permits rational functional design. J Biol Chem 289: 14331–14340. https://doi.org/10.1074/jbc.M113.530477
Berkut AA, Chugunov AO, Mineev KS, Peigneur S, Tabakmakher VM, Krylov NA, Oparin PB, Lihonosova AF, Novikova EV, Arseniev AS, Grishin EV, Tytgat J, Efremov RG, Vassilevski AA (2019) Protein surface topography as a tool to enhance the selective activity of a potassium channel blocker. J Biol Chem 294(48): 18349–18359. https://doi.org/10.1074/jbc.RA119.010494
Tabakmakher VM, Gigolaev AM, Peigneur S, Krylov NA, Tytgat J, Chugunov AO, Vassilevski AA, Efremov RG (2021) Potassium channel blocker crafted by α-hairpinin scaffold engineering. Biophys J 120: 2471–2481. https://doi.org/10.1016/j.bpj.2021.04.020
Gigolaev AM, Lushpa VA, Pinheiro-Junior EL, Tabakmakher VM, Peigneur S, Ignatova AA, Feofanov AV., Efremov RG, Mineev KS, Tytgat J, Vassilevski AA (2022) Artificial pore blocker acts specifically on voltage-gated potassium channel isoform KV1.6. J Biol Chem: 102467. https://doi.org/10.1016/J.JBC.2022.102467
Lyukmanova EN, Shenkarev ZO, Shulepko MA, Paramonov AS, Chugunov AO, Janickova H, Dolejsi E, Dolezal V, Utkin YN, Tsetlin VI, Arseniev AS, Efremov RG, Dolgikh DA, Kirpichnikov MP (2015) Structural insight into specificity of interactions between nonconventional three-finger weak toxin from Naja kaouthia (WTX) and muscarinic acetylcholine receptors. J Biol Chem 290(39): 23616–23630. https://doi.org/10.1074/jbc.M115.656595
Chugunov AO, Volynsky PE, Krylov NA, Nolde DE, Efremov RG (2016) Temperature-sensitive gating of TRPV1 channel as probed by atomistic simulations of its trans- and juxtamembrane domains. Sci Rep 6: 33112. https://doi.org/10.1038/srep33112
Jorgensen WL, Chandrasekhar J, Madura JD, Impey RW, Klein ML (1983) Comparison of simple potential functions for simulating liquid water. J Chem Phys 79: 926–935. https://doi.org/10.1063/1.445869
Abraham MJ, Murtola T, Schulz R, Páll S, Smith JC, Hess B, Lindah E (2015) Gromacs: High performance molecular simulations through multi-level parallelism from laptops to supercomputers. SoftwareX 1: 19–25. https://doi.org/10.1016/j.softx.2015.06.001
Lindorff-Larsen K, Piana S, Palmo K, Maragakis P, Klepeis JL, Dror RO, Shaw DE (2010) Improved side-chain torsion potentials for the Amber ff99SB protein force field. Proteins Struct Funct Bioinform 78(8): 1950–1958. https://doi.org/10.1002/prot.22711
Berendsen HJC, Postma JPM, Van Gunsteren WF, Dinola A, Haak JR (1984) Molecular dynamics with coupling to an external bath. J Chem Phys 81: 3684–3690. https://doi.org/10.1063/1.448118
Bussi G, Donadio D, Parrinello M (2007) Canonical sampling through velocity rescaling. J Chem Phys 126(1): 014101. https://doi.org/10.1063/1.2408420
Pyrkov T V., Efremov RG (2007) A fragment-based scoring function to re-rank ATP docking results. Int J Mol Sci 8: 1083–1094. https://doi.org/10.3390/i8111083
Pyrkov T V., Chugunov AO, Krylov NA, Nolde DE, Efremov RG (2009) PLATINUM: A web tool for analysis of hydrophobic/hydrophilic organization of biomolecular complexes. Bioinformatics 25: 1201–1202. https://doi.org/10.1093/bioinformatics/btp111
McCoy J, LaVallie E (2001) Expression and Purification of Thioredoxin Fusion Proteins. In: Current Protocols in Molecular Biology. John Wiley & Sons, Inc., Hoboken. NJ. USA. 16.8.1–16.8.14.
Gasparian ME, Ostapchenko VG, Schulga AA, Dolgikh DA, Kirpichnikov MP (2003) Expression, purification, and characterization of human enteropeptidase catalytic subunit in Escherichia coli. Protein Exp Purif 31(1): 133–139. https://doi.org/10.1016/S1046-5928(03)00159-1
Lobstein J, Emrich CA, Jeans C, Faulkner M, Riggs P, Berkmen M (2012) SHuffle, a novel Escherichia coli protein expression strain capable of correctly folding disulfide bonded proteins in its cytoplasm. Microb Cell Fact 11: 56. https://doi.org/10.1186/1475-2859-11-56
Kuzmenkov AI, Sachkova MY, Kovalchuk SI, Grishin EV, Vassilevski AA (2016) Lachesana tarabaevi, an expert in membrane-Active toxins. Biochem J 473: 2495–2506. https://doi.org/10.1042/BCJ20160436
Peigneur S, Billen B, Derua R, Waelkens E, Debaveye S, Béress L, Tytgat J (2011) A bifunctional sea anemone peptide with Kunitz type protease and potassium channel inhibiting properties. Biochem Pharmacol 82(1): 81–90. https://doi.org/10.1016/j.bcp.2011.03.023
Banerjee A, Lee A, Campbell E, MacKinnon R (2013) Structure of a pore-blocking toxin in complex with a eukaryotic voltage-dependent K+ channel. Elife 21(2): e00594. https://doi.org/10.7554/eLife.00594
Tabakmakher VM, Krylov NA, Kuzmenkov AI, Efremov RG, Vassilevski AA (2019) Kalium 2.0, a comprehensive database of polypeptide ligands of potassium channels. Sci Data 61(6): 1–8. https://doi.org/10.1038/s41597-019-0074-x
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


