Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 1, стр. 34-45
Участие дигидропиримидиназа-подобного белка 2 в регуляции тревожности у человека
Ш. М. Гулиева 1, А. А. Мехтиев 2, *
1 Нахичеванский государственный университет
Нахичевань, Азербайджан
2 Институт физиологии им. академика Абдуллы Гараева НАН
Баку, Азербайджан
* E-mail: arifmekht@yahoo.com
Поступила в редакцию 21.06.2022
После доработки 10.10.2022
Принята к публикации 10.10.2022
- EDN: IZMQDE
- DOI: 10.31857/S0869813923010077
Аннотация
Целью исследования было изучение роли дигидропиримидиназа-подобного белка 2 (ДПБ2) в регуляции тревожности у человека и животных. Для этого определяли уровень ДПБ2 в тромбоцитах и слюне и уровень естественных аутоантител к ДПБ2 в сыворотке крови у пациентов, имевших назначение на операцию, а также изучали влияние ДПБ2 на поведение крыс в модели приподнятого крестообразного лабиринта. Пробы крови у пациентов, испытывавших ощущение тревожности в день операции, забирали из вены в пробирки, содержавшие 5%-ный раствор ЭДТ-А в качестве антикоагулянта, выделяли тромбоциты и сыворотку, и методом непрямого иммуноферментного анализа в тромбоцитах определяли уровень ДПБ2, а в сыворотке крови – уровень естественных аутоантител к ДПБ2. В слюне у этих больных также определяли уровень ДПБ2. Результаты исследования выявили повышение уровня ДПБ2 в тромбоцитах (p < 0.05 по t-критерию Стьюдента) и уровня естественных аутоантител к ДПБ2 в сыворотке (p < 0.001) у пациентов по сравнению со здоровыми испытуемыми. Также выявлено увеличение уровня стрессорного гормона кортизола в сыворотке крови у пациентов (p < 0.01). В то же время в слюне у них было обнаружено снижение уровня ДПБ2 (p < 0.01). Внутримозговое введение крысам ДПБ2 вызывало увеличение количества пересеченных квадратов в открытых рукавах лабиринта относительно крыс контрольной группы (инактивированный ДПБ2; p < 0.01 по U-критерию Уилкоксона и Манна–Уитни), что свидетельствует о снижении у них уровня тревожности. Основываясь на повышении уровней ДПБ2 в тромбоцитах и аутоантител к ДПБ2 в сыворотке крови, а также снижении его уровня в слюне при параллельном повышении уровня кортизола в сыворотке у пациентов, испытывавших ощущение тревожности, можно сделать заключение о том, что определение уровня ДПБ2 и естественных аутоантител к ДПБ2 в указанных средах организма может служить показателем адаптации к уровню тревожности у человека.
Современная жизнь человека характеризуется высокими скоростями, информационной перегруженностью и чрезвычайным возбуждением. Следует указать, что определенные виды деятельности требуют спокойного и уравновешенного психоэмоционального состояния, правильной и безошибочной оценки часто возникающих непредвиденных ситуаций и принятия быстрых и адекватных решений в подобных ситуациях. К настоящему времени доказано, что причиной более, чем 80% авиакатастроф является человеческий фактор, т.е. ошибки авиадиспетчеров, обусловленные неверным или несвоевременным принятием решений [1]. В этой связи представляют интерес изучение вырабатываемого навыка подкрепления/наказания у пациентов с патологией генерализованного возбуждения, с генерализованной социальной фобией и у здоровых испытуемых. Использование этого навыка позволяет оценить способность индивидуумов определять значимость объектов и осуществлять выбор между ними с целью усиления подкрепления и ослабления эффекта наказания. При этом было обнаружено, что у пациентов с патологией общего возбуждения наблюдалось нарушение выполнения навыка подкрепления/наказания при сравнении как с пациентами с генерализованной социальной фобией, так и со здоровыми испытуемыми [2]. Аналогичным образом, исследование, выполненное на субклинических индивидуумах, обладавших повышенным уровнем тревожности, показало, что в большинстве случаев такие участники демонстрировали признаки нарушения принятия правильного решения: выбор правильных решений у лиц с высоким уровнем тревожности был значительно ниже в сравнении с индивидуумами с низким уровнем тревожности [3]. При анализе пациентов с генерализованной тревожностью в модели пассивного избегания было обнаружено, что пациенты допускали больше ошибок при выборе пассивного избегания, чем здоровые испытуемые, причем уровень совершаемых ошибочных реакций коррелировал с уровнем их функциональных нарушений [4]. Принимая во внимание приведенные аргументы, становится очевидным, что одной из важных проблем современной жизни является разработка точного, быстрого и неинвазивного метода оценки психоэмоционального состояния и/или переутомления лиц, выполняющих свои профессиональные обязанности в сферах деятельности, несовместимых с принятием ошибочных решений.
Рассматривая возможные молекулярные агенты, которые могли бы быть использованы в качестве надежных индикаторов психоэмоционального состояния человека, следует выделить серотонинергическую систему головного мозга, наиболее быстро и адекватно реагирующую на изменение психоэмоционального состояния индивидуумов. В частности, установлено участие серотонинергической системы в патогенезе депрессий и соответствие изменений уровня серотонина в тромбоцитах степеням тяжести заболевания [5, 6]. В этой связи представляет интерес изучение дигидропиримидиназа подобного белка 2 (ДПБ2), находящегося в прямой зависимости от уровня серотонина в структурах головного мозга [7].
ДПБ2, также называемый в англоязычной литературе “collapsing-response mediator protein (CRMP2)”, экспрессируется на ранней стадии нейронной дифференциации, совпадающей с очень активным периодом развития нейронов, включающим формирование аксонов и синаптических связей [8]. Кроме того, ДПБ2 был обнаружен в растущих аксонах, и была выявлена его способность индуцировать аксональный спраутинг у нейронов гиппокампа [9]. Методом двумерного дифференциального электрофореза в геле с последующей идентификацией белковых фракций методом масс-спектрометрии было продемонстрировано изменение уровня ДПБ2 в вентральном гиппокампе у крыс под влиянием продолжительного умеренного стресса, а также под влиянием транквилизатора эсциталопрама, нивелирующего его воздействие [10]. Наряду с этим было показано, что отсроченные последствия отнятия крысят от матерей (материнская депривация) проявляются в виде депрессивно-подобного поведения во взрослом состоянии и сопровождаются нарушением функционирования сигнального пути, опосредованного ДПБ2, а также повышенным фосфорилированием ДПБ2 в гиппокампе, снижающим его способность к взаимодействию с тубулином [11]. Уровень метилирования ДНК в области промотера ДПБ2 в гиппокампе у крыс, подвергнутых воздействию продолжительного непредсказуемого умеренного стресса, также был значительно выше, чем у животных контрольной группы. Кроме того, уровни экспрессии мРНК ДПБ2 и самого ДПБ2 в гиппокампе и префрональной коре в группе подвергнутых стрессу крыс были значительно ниже, чем у контрольных животных [12].
В задачу проведенного нами исследования входило определение уровня ДПБ2 в тромбоцитах и слюне людей, испытывающих выраженную тревожность, уровня естественных аутоантител к ДПБ2 в сыворотке их крови, а также влияние внутримозгового введения ДПБ2 на поведение крыс в модели приподнятого крестообразного лабиринта, которая широко применяется в мировой практике для исследования состояния тревожности.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования выполнены на пациентах обоего пола в возрасте до 40 лет, которым было назначено проведение планового оперативного вмешательства в хирургических отделениях Центральной больницы Нахичеванской Автономной Республики (г. Нахичевань, ул. А. Алиева, 1), НИИ Клинической хирургии им. М. Топчубашева (г. Баку, ул. А.М. Шариф-заде, 196) и Премиум клиники (г. Баку, ул. А. Магеррамова, 25B). Предварительно от пациентов было получено письменное согласие на предмет использования проб крови и слюны в проводимом исследовании. Поведенческие эксперименты проводились на крысах-самцах линии Вистар массой тела 160–220 г из вивария Института физиологии им. академика Абдуллы Гараева.
У пациентов из локтевой вены забирали кровь в объеме 5 мл в пробирки, содержавшие 0.5 мл 5%-ного антикоагулянта этилендиаминтетраацетата (ЭДТА). Пробирки с пробами крови центрифугировали со скоростью 1000 g в течение 7 мин, собирали плазму, переносили в пробирки эппендорф и центрифугировали со скоростью 9000 g в течение 15 мин. Полученную сыворотку собирали в отдельные пробирки эппендорф. Пробирки с осевшими тромбоцитами, плазмой и сывороткой хранили при –70°С. У этих же больных собирали слюну и замораживали. В качестве контроля использовали пробы крови и слюну здоровых испытуемых того же возраста.
ДПБ2 выделяли из головного мозга коров. Основным этапами фракционирования были: 1) дробное осаждение белков из белкового экстракта головного мозга сульфатом аммония в конечной концентрации 40%; 2) гель-хроматография на колонке сефадекс G-150 (3 × 60 см); 3) экспозиция в 40 мМ растворе ЭДТА в течение ночи на встряхивателе; 4) препаративное изоэлектрическое фокусирование в геле с использованием амфолинов узкого диапазона (рН 4–6). Фракционирование осуществляли под контролем непрямого иммуноферментного анализа с использованием иммуноглобулинов к ДПБ2. Гомогенность выделенного белка определяли методом электрофореза с додецилсульфатом натрия в присутствии белков-стандартов с известными значениями молекулярных масс.
Поликлональные иммуноглобулины к ДПБ2 получали в результате 5-месячной иммунизации трех кроликов очищенным белком в смеси с равным объемом полного адъюванта Фрейнда (Sigma, Германия) по следующей схеме: первые три инъекции с интервалом 14 сут, далее 1 раз в месяц. Через 10 сут после 3-й и последующих инъекций из краевой ушной вены забирали кровь, отделяли сыворотку и осаждали иммуноглобулины добавлением 100%-ного раствора сульфата аммония до конечной 50%-ной концентрации.
В первой серии исследований из тромбоцитов пациентов (n = 18) и здоровых испытуемых (n = 11) экстрагировали водорастворимые белки 0.05 M фосфатным буфером, содержащим 0.3 М NaCl, 5 мМ ЭДТА и 0.1% тритон Х-100 (рН 7.3), после чего гомогенат тромбоцитов центрифугировали при 9000 g в течение 10 мин, собирали надосадочную жидкость, которую использовали в качестве антигенов в концентрации 20 мкг/мл в 0.1 М буфере трис-НСl (рН 8.6) в твердофазном непрямом иммуноферментном анализе (ТНИФА) на 96-луночных полистироловых планшетах с умеренным уровнем сорбции (Sigma, Германия). В качестве первичных антител использовали кроличьи поликлональные иммуноглобулины к ДПБ2, разведенные в 40 раз буфером для антител, содержавшим 0.04 М фосфатный буфер, 0.15 М хлористый натрий, 0.05%-ный Tween-20 и 1%-ный бычий сывороточный альбумин (рН 7.3). В качестве вторичных антител использовали противокроличьи козьи иммуноглобулины, конъюгированные с пероксидазой хрена, разведенные в 2000 раз буфером для антител (рН 7.3). Визуализацию реакции осуществляли с помощью субстрата пероксидазы хрена – ортофенилендиамина в концентрации 0.5 мг/мл в 0.05 М цитрат-фосфатном буфере (рН 4.5). Реакцию останавливали заливанием в лунки по 50 мкл 3 М раствора гидроокиси натрия. Результаты реакции считывали в фотометре для иммуноферментного анализа “Molecular Devices Spectra Max 250” (MTX Lab Systems, Inc., США) на длине волны 492 нм (длина волны сравнения – 630 нм).
Одновременно проводили ТНИФА с пробами слюны, взятых у этих же пациентов и у здоровых испытуемых. Реакцию осуществляли так же, как и с белковыми экстрактами тромбоцитов.
Во второй серии исследований методом ТНИФА определяли уровень естественных аутоантител к ДПБ2 в сыворотке крови и слюне у этих же пациентов. В качестве антигена использовали очищенный ДПБ2 в концентрации 20 мкг/мл в 0.1 М буфере трис-НСl (рН 8.6). В качестве первичных антител использовали пробы сыворотки крови и слюны, разведенные в 100 раз буфером для антител (рН 7.3). В качестве вторичных антител использовали мышиные иммуноглобулины против иммуноглобулинов человека, конъюгированные с пероксидазой хрена и разведенные в 1000 раз буфером для антител (рН 7.3). Далее реакцию проводили, как описано выше.
В третьей серии исследований в сыворотке крови этих же пациентов определяли уровень кортизола методом конкурентного иммуноферментного анализа с использованием сенсибилизированных полистироловых планшетов (Хема, РФ). На основании стандартов набора строили калибровочную кривую, по которой определяли концентрацию кортизола в образцах сыворотки больных.
Четвертая серия исследований была выполнена на крысах-самцах линии Вистар в крестообразном лабиринте, приподнятом на высоту 1 м над полом и предназначенном для исследования изменения уровня тревожности у животных под влиянием вводимых препаратов, с целью изучения влияния внутримозгового введения ДПБ2 на поведение. Были сформированы 2 группы крыс: 1) контрольная группа (n = 9) и 2) опытная группа (n = 9). В 1-й день животных помещали в лабиринт на 300 с и регистрировали количество пересеченных ими квадратов в закрытых и открытых рукавах лабиринта в целях определения у них исходного уровня тревожности. Изучение поведения животных в лабиринте осуществляли в затемненной комнате для создания естественных для крыс условий обитания. Через 24 ч животным, наркотизированным этаминалом натрия (40 мг/кг массы тела, внутрибрюшинно), вводили препараты: в контрольной группе вводили инактивированный ДПБ2 (35 мин на водяной бане при температуре 60°С), а в опытной группе – нативный ДПБ2. Введение препаратов осуществляли в левый боковой желудочек головного мозга крыс, в концентрации 1.0 мг/мл и объеме 10 мкл в физиологическом растворе на фосфатном буфере (рН 7.3). Через 24 ч после введения препаратов животных обеих групп вновь помещали в лабиринт на 300 с и регистрировали количество пересеченных квадратов в открытом и закрытом рукавах.
По биохимическим показателям уровень достоверности различий между группами пациентов и здоровых испытуемых оценивали по t-критерию Стьюдента. По показателям поведения крыс в ПКЛ межгрупповые различия анализировали по U-критерию Вилкоксона и Манна–Уитни. Значения считались статистически достоверными при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ уровня ДПБ2 в тромбоцитах у пациентов
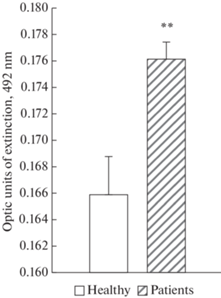
По итогам первой серии исследований было обнаружено повышение уровня ДПБ2 в тромбоцитах у пациентов непосредственно перед плановой полостной операцией относительно его уровня у здоровых испытуемых. В частности, если уровень ДПБ2 у здоровых испытуемых в тромбоцитах составлял 0.165 ± 0.004 оптических единиц поглощения, то у пациентов его уровень достигал 0.176 ± 0.001 опт. ед. (p < 0.01 по t-критерию Стьюдента; рис. 1).
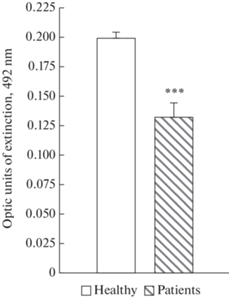
В то же время в слюне у этих пациентов, напротив, отмечалось заметное снижение уровня ДПБ2 относительного его уровня у здоровых испытуемых: у здоровых испытуемых уровень ДПБ2 составлял 0.199 ± 0.005 опт. ед., тогда как у пациентов – 0.147 ± 0.009 опт. ед. (p < 0.001 по t-критерию Стьюдента; рис. 2).
Определении уровня естественных аутоантител к ДПБ2
Во второй серии исследований при определении уровня естественных аутоантител к ДПБ2 в сыворотке у пациентов было обнаружено его резкое повышение (в 2.5 раза) относительно уровня здоровых испытуемых. Так, уровень естественных аутоантител к ДПБ2 в сыворотке у здоровых испытуемых равнялся 0.0063 ± ± 0.0005 опт. ед., тогда как в сыворотке у больных их уровень составлял 0.01583 ± ± 0.0013 опт. ед. (p < 0.001 по t-критерию Стьюдента; рис. 3а). Параллельно было проведено сравнение уровней естественных аутоантител к ДПБ2 в сыворотке у пациентов, согласно их половой принадлежности. Вследствие того, что разница в уровнях аутоантител к ДПБ2 у мужчин (0.014 ± 0.002) и у женщин (0.017 ± 0.002) была недостоверной (p > 0.05; рис. 3b), объединение их значений в одну группу, равно как и других показателей в первой и второй сериях исследований, считалось правомочным.
Рис. 3.
Изменение уровня естественных аутоантител к ДПБ2 в сыворотке у пациентов. *** – p < 0.001 (a) по t-критерию Стьюдента. Сравнение уровней естественных аутоантител к ДПБ2 в сыворотке у пациентов разного пола (b).

При определении уровня естественных аутоантител к ДПБ2 в слюне у пациентов и здоровых испытуемых было обнаружено, что величины оптического поглощения в лунках полистироловой планшеты с пробами слюны, полученными как от пациентов, так и от здоровых испытуемых, не отличались от величины оптического поглощения в “пустых” лунках, в которые вместо антигенов был нанесен 0.1 М трис-HCl (рН 8.6), использовавшийся для разведения проб слюны. Нанесение в лунки только буфера для разведения антигенов (“blank control”) обычно используют при постановке ТНИФА для оценки уровня неспецифической сорбции первичных и вторичных антител: чем ниже значения оптического поглощения в “пустых” лунках в конце реакции, тем ниже уровень неспецифической сорбции обоих видов антител и тем более убедительны получаемые в ТНИФА различия между исследуемыми группами. На основании того, что различий между оптическим поглощением в лунках с пробами слюны от обеих групп испытуемых и в “пустых” лунках не было обнаружено (т.е. в лунках, отведенных для проб слюны пациентов и здоровых испытуемых, антитела отсутствовали), было сделано заключение о том, что антитела не способны проникать через гемато-саливарный барьер.
Определение уровня кортизола
В третьей серии исследований определение уровня стрессорного гормона кортизола в сыворотке у пациентов выявило повышение его уровня относительно уровня у здоровых испытуемых. В частности, если у здоровых испытуемых уровень кортизола в сыворотке составил 443.3 ± 26.1 нМ, то у пациентов – 582.9 ± 43.5 нМ (p < 0.01; рис. 4а).
Рис. 4.
Изменение уровня кортизола в сыворотке крови у пациентов, ** – p < 0.01 по t-критерию Стьюдента (a) и сравнение уровней кортизола в сыворотке у пациентов разного пола (b).

В этой серии также проводили сравнение уровней кортизола у пациентов в связи с их половой принадлежностью. Поскольку достоверных различий между группами пациентов разного пола выявлено не было: 511.8 ± 21.6 нМ у мужчин против 607.4 ± 59.2 нМ у женщин (p > 0.05; рис. 4b), значения уровней кортизола у пациентов обоего пола также объединили в одну общую группу.
Таким образом, результаты первых трех серий исследований свидетельствуют о повышении уровня ДПБ2 в тромбоцитах и повышении уровня аутоантител в сыворотке наряду со снижением его уровня в слюне у пациентов непосредственно перед запланированным оперативным вмешательством. Наряду с указанными изменениями, в сыворотке у этих пациентов было выявлено повышение уровня кортизола. Для выявления роли ДПБ2 в формировании состояния тревожности в следующей (четвертой) серии изучали влияние его введения на поведение крыс.
Изучение влияния внутримозгового введения ДПБ2 на поведение крыс
В этой серии экспериментов было проведено изучение влияния внутримозгового введения ДПБ2 на поведение крыс в модели приподнятого крестообразного лабиринта. Было обнаружено заметное увеличение количества пересеченных квадратов в открытых рукавах лабиринта у крыс опытной группы после введения ДПБ2 по сравнению с количеством пересеченных квадратов этими животными до введения белка – 5.9 ± 2.4 квадратов после введения ДПБ2 против 1.4 ± 1.4 квадрата до его введения (p < 0.01 по U-критерию Уилкоксона и Манна–Уитни; рис. 5). В группе животных с введением инактивированного ДПБ2 не было выявлено достоверных отличий по количеству пересеченных квадратов (1.4 ± 1.1) в открытых рукавах камеры по сравнению с интактными животными. Наконец, следует отметить, что было выявлено значительное увеличение количества пересеченных квадратов в открытых рукавах камеры крысами опытной группы после введения ДПБ2 по сравнению с животными контрольной группы, получивших инъекции инактивированного ДПБ2 (5.9 ± 2.4 квадратов против 1.4 ± 1.1, p < 0.05 по U-критерию Уилкоксона и Манна–Уитни; рис. 5).
Рис. 5.
Изменение количества пересеченных квадратов крысами в открытых рукавах приподнятого крестообразного лабиринта под влиянием внутримозгового введения ДПБ2 (Experimental) в сравнении с интактными животными (Intact) и контрольной группой (Control), инъецированных инактивированным ДПБ2. * – p < 0.05; ** – p < 0.01 по U-критерию Уилкоксона и Манна–Уитни.

Таким образом, внутримозговое введение крысам ДПБ2 вызывало повышение количества пересеченных квадратов в открытых рукавах приподнятого крестообразного лабиринта относительно значений этого показателя до введения ДПБ2 у животных опытной группы и относительно его значений у контрольных крыс, что свидетельствует о снижении их тревожности. Результаты исследований, полученные как на пробах пациентов, так и в экспериментальной модели на животных свидетельствуют о непосредственном участии ДПБ2 в развитии состояния тревожности.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На сегодняшний день довольно сложно подобрать адекватный показатель для оценки уровня состояния тревожности и беспокойства у человека. В настоящее время большинство используемых иммунохимических методов, ориентированных на выявление этого состояния, по сути, определяют уровень общего стресса. Вместе с тем следует указать, что состояние тревожности имеет характерную нейрохимическую и поведенческую (на соответствующих моделях животных) специфичность.
Модель приподнятого крестообразного лабиринта служит адекватной и широко используемой моделью для определения уровня тревожности у крыс под влиянием различных фармакологических препаратов [13, 14].
Выявленное в наших экспериментах повышение количества пересеченных квадратов в открытых рукавах лабиринта у животных опытной группы после внутримозгового введения ДПБ2 по сравнению с их количеством у этих животных до введения им белка и относительно количества пересеченных квадратов в открытых рукавах у животных контрольной группы (инактивированный ДПБ2) указывает на снижение уровня тревожности (анксиолитическое влияние) у животных под влиянием искусственного повышения уровня ДПБ2 в головном мозге. Заключение об анксиолитическом влиянии ДПБ2 на поведение животных, сделанное на основании повышения количества пересеченных ими квадратов в открытых рукавах приподнятого крестообразного лабиринта, согласуется с результатами других авторов, продемонстрировавших наличие отрицательной коррелятивной взаимосвязи между нахождением животных в области открытых рукавов лабиринта и уровнем стресса, оцененного по содержанию стрессорного гормона кортикостерона в их плазме [15, 16]. Следовательно, определения уровня этого белка в тромбоцитах и слюне, а также уровня естественных аутоантител к нему в сыворотке крови у человека могут быть использованы в качестве показателей развития состояния тревожности.
Следует отметить, что определенный в данном исследовании повышенный уровень ДПБ2 в тромбоцитах у пациентов отражает его уровень в коре головного мозга [5, 6], тогда как повышенный уровень естественных аутоантител к ДПБ2 в сыворотке крови у пациентов – уровень ДПБ2 в подкорковых структурах их головного мозга. Взаимосвязь между уровнем естественных аутоантител к ДПБ2 и его уровнем в подкорковых структурах головного мозга была ранее выявлена методом ТНИФА в экспериментах, выполненных на модели доминантного поведения у крыс [17].
Снижение уровня ДПБ2 в слюне у пациентов, находящихся в состоянии тревожности, видимо, связано с повышенным уровнем естественных аутоантител к этому белку в сыворотке крови, связывающихся с ДПБ2 и препятствующих его прохождению через гемато-саливарный барьер. При этом комплекс белка со связанными с ним антителами не способен проходить через гемато-саливарный барьер, поскольку, как показали наши результаты, гемато-саливарный барьер непроницаем для самих естественных аутоантител к ДПБ2.
Таким образом, результаты проведенных исследований продемонстрировали, что повышение уровня ДПБ2 в тромбоцитах и снижение его уровня в слюне, а также повышение уровня естественных аутоантител к ДПБ2 в сыворотке крови у пациентов, сопровождавшиеся повышением уровня кортизола в сыворотке крови, могут служить маркерами адаптивной и мобилизационной тревожности и отражать изменения уровня ДПБ2 в соответствующих структурах головного мозга. О влиянии ДПБ2 на изменение поведенческих коррелятов тревожности также свидетельствуют данные, полученные на животных после внутримозгового введения им очищенного препарата этого белка.
Список литературы
Shapell S, Detwiler C, Boquet A, Wiegmann D (2006) Human error and commercial aviation accidents: A comprehensive, fine-grained analysis using HFACS. Federal Aviation Administration. DOT/FAA/AM-06/18. Office of Aerospace Medicine Washington, DC 20591.
Devido G, Jones M, Geraci M, Hollon N, Blair RJ, Pine DS, Blair K (2009) Stimulus-reinforcement-based decision making and anxiety: impairment in generalized anxiety disorder (GAD) but not in generalized social phobia (GSP). Psychol Med 39: 1153–1161. https://doi.org/10.1017/S003329170800487X
Luhman CC, Ishida K, Hajcak G (2011) Intolerance of uncertainty and decisions about delayed, probabilistic rewards. Behav Ther 42: 378–386. https://doi.org/10.1016/j.beth.2010.09.002
Teng C, Otero M, Geraci M, Blair RJR, Pine DS, Grillon Ch, Blair KS (2016) Abnormal decision-making in generalized anxiety disorder: Aversion of risk or stimulus-reinforcement impairment? Psych Res 237: 351–356. https://doi.org/10.1016/j.psychres.2015.12.031
Elliott JM, Kent A (1989) Comparison of [125I]iodolysergic acid diethylamide binding to human frontal cortex and platelet tissue. J Neurochem 53: 191–196. https://doi.org/10.1111/j.1471-4159.1989.tb07313.x
Collins ChM, Kloek J, Elliott JM (2013) Parallel changes in serotonin levels in brain and blood following acute administration of MDMA. J Psychopharm 27: 109–112. https://doi.org/10.1177/0269881112463123
Мехтиев АА (2000) Обнаружение в головном мозге крыс белка, обладающего антиконсолидационными свойствами. Бюл экспер биол мед 129: 147–150. [Mekhtiev AA (2000) Revealing in the brain of rats the protein possessing anticonsolidation properties. Bull Exp Biol Med 129: 147–150. (In Russ)].https://doi.org/10.1007/BF02766081
Goshima Y, Nakamura F, Strittmatter P, Strittmatter SM (1995) Collapsin-induced growth cone collapse mediated by an intracellular protein related to UNC-33. Nature 376: 509–514. https://doi.org/10.1038/376509a0
Inagaki N, Chihara K, Arimura N, Ménager C, Kawano MN, Matsuo N, Nishimura T, Amano M, Kaibuchi K (2001) CRMP-2 induces axons in cultured hippocampal neurons. Nat Neurosci 4: 781–782. https://doi.org/10.1038/90476
Bisgaard ChF, Jayatissa MN, Enghild JJ, Sanchéz C, Artemychyn R, Wiborg O (2007) Proteomic investigation of the ventral rat hippocampus links DRP-2 to escitalopram treatment resistance and SNAP to stress resilience in the chronic mild stress model of depression. J Mol Neurosci 32: 132–144. https://doi.org/10.1007/s12031-007-0025-4
Wei Y, Wang G, Chen J, Xiao L, Wu Z, He J, Zhang N (2021) Maternal deprivation induces cytoskeletal alterations and depressive-like behavior in adult male rats by regulating the AKT/GSK3β/CRMP2 signaling pathway. Physiol & Behav 242: 113625. https://doi.org/10.1016/j.physbeh.2021.113625
Xiang D, Xiao J, Sun S, Fu L, Yao L, Wang G, Liu Z (2020) Differential regulation of DNA methylation at the CRMP2 promoter region between the hippocampus and prefrontal cortex in a CUMB depression model. Front Psychiatr 11: 141. https://doi.org/10.3389/fpsyt.2020.00141
Walf AA, Frye CA (2007) The use of the elevated plus maze as an assay of anxiety-related behavior in rodents. Nat Protoc 2: 322–328. https://doi.org/10.1038/nprot.2007.44
Kraeuter A-K, Guest PC, Sarnyai Z (2019) The Elevated Plus Maze Test for Measuring Anxiety-Like Behavior in Rodents. Methods Mol Biol 1916: 69–74. https://doi.org/10.1007/978-1-4939-8994-2_4
File SE, Zangrossi H Jr, Sanders FL, Mabbutt PS (1994) Raised corticosterone in the rat after exposure to the elevated plus-maze. Psychopharmacology 113: 543–546. https://doi.org/10.1007/BF02245237
Rodgers RJ, Haller J, Holmes A, Halasz J, Walton TJ, Brain PF (1999) Corticosterone response to the plus-maze: high correlation with risk assessment in rats and mice. Physiol Behav 68: 47–53. https://doi.org/10.1016/s0031-9384(99)00140-7
Hasanova LF (2022) The changes of serotonin-modulating anticonsolidation protein and dihydropyrimidinase-related protein 2 in the amygdala and blood of depressive rats. Azerb J Physiol 37: 7–12.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова