Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 1, стр. 46-60
Цитокин 14-3-3η как новый биомаркер в оценке активности ревматоидного артрита
А. А. Королькова 1, В. В. Хижа 2, Д. И. Козлова 2, *, Д. С. Васильев 2, А. Л. Маслянский 3, Т. В. Вавилова 3, М. Ф. Баллюзек 4, А. В. Рыбаков 2, 5, М. Е. Шевалдина 5, К. А. Юрьева 6
1 Сыктывкарский государственный университет им. Питирима Сорокина
Сыктывкар, Россия
2 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
3 Национальный медицинский исследовательский центр им. В.А. Алмазова МЗ России
Санкт-Петербург, Россия
4 Санкт-Петербургская больница РАН
Санкт-Петербург, Россия
5 Санкт-Петербургский политехнический университет Петра Великого
Санкт-Петербург, Россия
6 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: di.kozlova.official@gmail.com
Поступила в редакцию 28.09.2022
После доработки 25.11.2022
Принята к публикации 27.11.2022
- EDN: IZJWJC
- DOI: 10.31857/S0869813923010090
Аннотация
В настоящее время рутинная оценка активности ревматоидного артрита заключается в определении показателей суставного синдрома, таких как число болезненных и припухших суставов, а также ряда лабораторных показателей. Наибольший интерес представляют последние, к числу которых относится ревматоидный фактор (РФ), антитела к циклическому цитруллинированному пептиду и ряд острофазовых показателей, однако они имеют низкую чувствительность и специфичность, особенно на ранних стадиях заболевания, когда еще есть возможность привести показатели к возрастной норме и достичь устойчивой ремиссии заболевания. Кроме того, некоторые из них весьма дороги и не покрываются обязательным медицинским страхованием. Несмотря на достижения современной науки до сих пор отсутствуют надежные инструменты оценки развития воспалительных процессов в суставах при ревматоидном артрите (РА) в зависимости от степени выраженности патологии и применяемой стратегии лечения. В статье анализирована возможность использования белка 14-3-3η как перспективного маркера оценки активности иммуновоспалительного процесса в суставах. Показана более высокая информативность (по характеристикам точности, чувствительности, специфичности) исследуемого показателя по сравнению с традиционными показателями острого воспаления, такими как скорость оседания эритроцитов и С-реактивный белок.
Ревматоидный артрит (РА) является наиболее распространенным аутоиммунным заболеванием человека, затрагивающим от 0.5 до 1% населения в мире, при котором основной мишенью воспалительного процесса являются периферические суставы с развитием эрозивно-деструктивных изменений в них. В настоящее время определение активности РА остается важной клинической задачей и представляет собой трудоемкий и длительный процесс [1]. Ассоциация ревматологов России рекомендует оценивать активность РА с помощью индекса DAS28 (Disease Activity Score) [2]. Эксперты EULAR предлагают использовать один из трех суммарных индексов активности болезни – DAS28, SDAI (Simplified Disease Activity Index) или CDAI (Clinical Disease Activity Index) [3].
Для определения активности РА используется оценка ряда клинических и лабораторных параметров, включающих в себя число болезненных (ЧБС) и припухших суставов (ЧПС), некоторые острофазовые показатели, такие как скорость оседания эритроцитов (СОЭ) и С-реактивный белок (СРБ), а также субъективные оценки пациента (общая оценка заболевания пациентом (ООЗП), визуальная аналоговая шкала (ВАШ)) и врача (общая оценка заболевания врачом (ООЗВ)) [4–6]. Поскольку по отдельности эти параметры в полной мере не отражают активность воспалительного процесса, экспертами OMERACT были использованы составные индексы на основе клинических показателей (CDAI) и лабораторных данных (DAS28), дающие более объективную оценку тому, насколько активно развивается комплексная воспалительная реакция организма в ответ на атаку иммунной системы на собственную костную и хрящевую ткань [7–9].
Однако используемые в настоящее время композитные индексы недостаточно надежны в оценке активности РА, т. к. имеют определенную долю субъективизма, что подтверждается в многих исследованиях. Так, подсчет числа припухших и болезненных суставов утомителен, требует много времени, плохо воспроизводится [10, 11], а также зависит от навыков и интерпретации врача-исследователя [12]. Традиционные острофазовые маркеры (СОЭ, СРБ) как лабораторные показатели активности РА являются неспецифичными и отражают в большей степени системные эффекты интерлейкина-6, а не собственно активность воспалительного процесса в суставе. Важно отметить, что СОЭ остается повышенной в течение некоторого времени после уменьшения воспаления на фоне терапии у пациентов с РА; также на этот показатель могут влиять анемия, уровень фибриногена в крови и возраст. Известно, что повышение СОЭ и СРБ характерно для многих воспалительных процессов, но эти показатели не повышаются более чем у трети пациентов с РА, в том числе с высокой активностью заболевания. Ввиду относительно низкой чувствительности и специфичности острофазовых маркеров в оценке активности РА, использование только этих показателей может дать ложную информацию об активности иммуновоспалительного процесса в суставах [13, 14]. У части пациентов с РА, которые находятся в ремиссии, согласно индексу DAS28, тем не менее, отмечается рентгенологическое прогрессирование заболевания, что в дальнейшем может привести к инвалидизации.
В 2011 г. ACR и EULAR совместно были разработаны новые критерии ремиссии РА для применения в клинических исследованиях. Согласно рекомендациям, ремиссией считается состояние, при котором ЧБС ≤ 1, ЧПС ≤ 1, уровень СРБ ≤ 1 мг/дл, ООЗП ≤ 10 мм по ВАШ или значение SDAI ≤ 3.3 [37]. Однако даже соблюдение более строгих критериев, таких как критерии ремиссии ACR/EULAR не гарантирует полный контроль над воспалением в суставах у пациентов с РА [15]. В статье Kamel с соавт. было показано, что субклиническая активность РА может быть лучше обнаружена с помощью УЗИ суставов, но никак не отражается на параметрах, входящих в композитные индексы активности, в том числе и DAS28 [16]. В статье Oderda с соавт. также приводятся данные о том, что традиционные способы оценки активности заболевания РА могут приводить к переоценке улучшения и недооценки прогрессирования активности болезни, так как они частично основаны на эмпирических и качественных данных. Результат оценки активности может осложняться сопутствующими заболеваниями и собственным восприятием пациентом болезни, что приводит к дальнейшей неопределенности [17]. В исследовании Bensen с соавт. было обнаружено, что восприятие пациентом активности своего заболевания (ООЗП, ВАШ) очень субъективно и значимо отличается от клинических показателей активности РА [18].
В последнее время были предприняты попытки разработать мультибиомаркерные тесты для оценки активности РА [19–25]. Однако клиническое использование отдельных биомаркеров ограничено, поскольку ни один маркер в полной мере не отражает активность заболевания или ответ на терапию РА [20, 26, 27].
Таким образом, информативность традиционных острофазовых маркеров активности заболевания недостаточна, а все комбинированные индексы трудоемки и имеют определенную долю субъективизма. Между тем, рутинная клиническая практика требует более точной, быстрой и легко воспроизводимой оценки активности РА, что делает актуальным поиск новых биомаркеров, отражающих в полной мере иммуновоспалительный процесс в суставах. В качестве перспективного маркера рассматривается белок 14-3-3η плазмы крови, который продуцируется клетками синовиальной оболочки при активном воспалении. Полученные данные проводимых ранее исследований относительно нового биомаркера позволяют предположить, что он может быть достаточно эффективен при оценке активности РА [28–30].
14-3-3η является одним из членов семейства регуляторных молекул – шаперонов. Многообещающие данные оценки его содержания позволили включить этот белок в исследование в качестве нового биомаркера активности РА, что и являлось предметом нашего исследования. Экспрессия изоформы “η” (eta) ограничена синовиальной тканью и тканями ЦНС. Таким образом, пораженный сустав является вероятным источником изоформы “η” белков 14-3-3 [31]. Внеклеточный белок 14-3-3η индуцирует провоспалительные каскады, такие как MAPK (mitogen‑activated protein kinase) и NFkB (nuclear factor kappa-light-chain-enhancer of activated B cells) в моноцитарных клетках THP-1 in vitro, что сопоставимо с эффектами ФНО-α (фактор некроза опухоли α), и является подобным ему провоспалительными цитокином. Таким образом, данный биомаркер регулирует такие процессы, как клеточная сигнализация, активирует клеточные сигнальные пути и индуцирует факторы, потенциируя воспаление и повреждение тканей, что приводит к индукции провоспалительных молекул, таких как ИЛ-1, ИЛ-6, а также ММП (матриксными металлопротеиназами) 1 и 9, которые, как известно, участвуют патогенезе РА [28, 31–33].
В настоящее время крупных и многоцентровых исследований по изучению связи белка 14-3-3η и кальпротектина с активностью РА недостаточно, чтобы сделать однозначный вывод.
Целью настоящего исследования являлось изучение возможности применения и информативности белка14-3-3η плазмы крови в качестве дополнительного маркера оценки активности ревматоидного артрита.
МЕТОДЫ ИССЛЕДОВАНИЯ
В исследование было включено 113 человек, 79 пациентов с диагнозом РА (основная группа) и 34 здоровых добровольца, которые составляли группу контроля. Критерием включения в исследование являлось соответствие симптоматики классификации Американской коллегии ревматологов/Европейской антиревматической лиги (ACR/EULAR) от 2010 г. для пациентов с РА любой степени активности заболевания вне зависимости от выбранного режима терапии [34]. Критериями исключения во всех группах являлись: отказ пациента от участия в исследовании; наличие любой активной инфекции в период включения в исследование; наличие онкологических заболеваний в период включения в исследование; наличие других аутоиммунных заболеваний, кроме вторичного синдрома Шегрена; наличие хронических неинфекционных заболеваний в стадии декомпенсации; беременность и период лактации. При поступлении всем пациентам была проведена клиническая оценка суставного синдрома: подсчет болезненных и припухших суставов, оценка активности своего заболевания пациентом и врачом по шкале ВАШ. Оценка активности РА рассчитывалась по клинико-лабораторному индексу DAS28-СОЭ и по клиническому индексу СDAI. Лабораторная оценка включала в себя определение СОЭ, СРБ, ревматоидного фактора (РФ) и антител к циклическим цитруллинированным пептидам (АЦЦП). Содержание белка 14-3-3η в плазме крови определялось методом твердофазного иммуноферментного анализа (ELISA) в сыворотке или плазме человека. Набор реагентов для проведения данного анализа был разработан сотрудниками Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН специально для нужд данного исследования с целью последующей разработки прототипа планшетной тест-системы и готового набора для применения в рамках клинической лабораторной диагностики. В состав набора входили антитела к исследуемому белку, наработанные в организме крыс и конъюгированные с биотином. Исследование ELISA проводилось в соответствии со стандартными протоколами на мультимодальном ридере CLARIOstar Plus (BMG LABTECH, Германия).
Статистическая обработка данных
Анализ полученных результатов проводился с помощью программного обеспечения Prism 8.0 (GraphPad Software) и Statistica 12.0. Проводилась оценка распределения на нормальность. При выявлении ненормального характера распределения результаты описывались в виде медианы [25-го; 75-го перцентилей]. Для сравнения количественных значений в нескольких группах использован метод Манна–Уитни; корреляционный анализ выполнен методом ранговой корреляции Спирмена. Для определения диагностической информативности в оценке активности РА с помощью новых биомаркеров проводился ROC-анализ: для него рассчитывались площадь под кривой, чувствительность, специфичность и диагностическая точность. Для определения различий биомаркеров в классификации группы с РА по степени активности применялись дискриминантный и линейный регрессионный анализы. Различия между группами считались достоверными при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В исследовании приняли участие 79 пациентов с диагнозом РА и 34 условно здоровых донора. Демографические характеристики групп значимо не различались.
Медиана длительности заболевания в группе пациентов с РА составила 10 [6; 15] лет. В группе пациентов с диагнозом РА у 68 человек (86%) выявлены повышенные титры АЦЦП и у 66 пациентов (83.5%) – РФ. Согласно индексу DAS28-СОЭ пациенты данной группы были распределены по степени активности РА: 5 человек – ремиссия, 4 – низкая степень активности заболевания, 29 – умеренная и 41 пациент – высокая. Согласно индексу CDAI пациенты группы РА по степени активности распределились следующим образом: 4 – ремиссия, 4 – низкая степень активности заболевания, 30 – умеренная и 41 пациент – высокая. Клиническая характеристика пациентов с РА и лабораторные данные обследованных групп представлены в табл. 1 и 2.
Таблица 1.
Клинико-лабораторные и демографические данные пациентов РА и контрольной группы
| Показатель | Значение |
|---|---|
| Средний возраст, годы, M ± SD | 58 ± 11 |
| Длительность заболевания, годы, Me [25-й; 75-й перцентили] | 10 [6; 15] |
| Соотношение мужчины/женщины, n | 11/68 |
| ЧБС, Me [25-й; 75-й перцентили] | 10 [6; 18] |
| ЧПС, Me [25-й; 75-й перцентили] | 4 [2; 6] |
| ВАШ, баллы, Me [25-й; 75-й перцентили] | 5.0 [4.0; 6.5] |
| Индекс DAS28, баллы, Me [25-й; 75-й перцентили] | 5.10 [4,38; 6.11 ] |
| Активность по DAS28-CОЭ, n (%): | |
| Ремиссия | 5.0 (6.3) |
| Низкая | 4.0 (5.0) |
| Умеренная | 29.0 (36.8) |
| Высокая | 41.0 (51.9) |
| Активность по CDAI, n: | |
| Ремиссия | 4 |
| Низкая | 4 |
| Умеренная | 30 |
| Высокая | 41 |
| Рентгенологическая стадия заболевания по Steinbrocker, n: | |
| I | 2 |
| II | 33 |
| III | 25 |
| IV | 19 |
Таблица 2.
Сравнение серологических данных, а также содержания белка 14-3-3η у пациентов исследуемых групп
| Показатель | Группа контроля | Пациенты с РА | Достоверность различий в парных выборках (р) |
|---|---|---|---|
| СОЭ (мм/ч) | 9.0 [5.5; 12.5] | 29 [18; 51 ] | р < 0.05 |
| СРБ (мг/л) | 2 [1.2; 2.1] | 7.9 [2.5; 17.5] | р < 0.01 |
| РФ + (МЕ/мл), n | 0 | 66 [83.5%] | р < 0.001 |
| АЦЦП + (Ед/мл), n | 0 | 68 [86%] | р < 0.001 |
| 14-3-3η | 4.02 [1.14; 15.33] | 70.77 [61.78; 76.85] | p < 0.0001 |
У больных РА содержание белка 14-3-3η в плазме крови, а также острофазовых показателей СОЭ и СРБ было значимо повышено по сравнению с группой контроля (рис. 1). Различия уровней биомаркера в обоих группах были высоко статистически значимы по данным теста Манна–Уитни (р < 0.001).
Рис. 1.
Сравнение концентрации белка 14-3-3η в крови у пациентов с РА и контрольной группы. Данные представлены в виде Ме [25-й; 75-й перцентили], * – обозначены статистически значимые различия содержания 14-3-3η в плазме крови КГ и РА (р ≤ 0.001).

Чтобы оценить клиническую значимость нового биомаркера, мы исследовали его связь с несколькими параметрами, отражающими активность РА.
Изучалась корреляционная связь между числом припухших/болезненных суставов и каждым из маркеров: 14-3-3η, СОЭ и СРБ. Оценки коэффициента ранговой корреляции таковы: ЧПС и 14-3-3η, r = 0.323, ЧБС и 14-3-3η, r = 0.40 (p < 0.001); для других пар значимой корреляционной зависимости не прослеживается. Таким образом, имеется высоко статистически значимая корреляционная связь между указанными парами (рис. 2a, b).
Рис. 2.
(a) – Корреляционная связь уровня белка 14-3-3η с числом болезненных суставов; (b) – корреляционная связь уровня белка 14-3-3η с числом припухших суставов, (c) – корреляционная связь уровня белка 14-3-3η с индексом активности РА CDAI; (d) – корреляционная связь уровня белка 14-3-3η с индексом активности РА DAS28-СОЭ.

Дополнительно изучена корреляционная связь между значением ВАШ и каждым из исследуемых маркеров. Оценки коэффициента ранговой корреляции таковы: ВАШ и 14-3-3η, r = 0.323 (p < 0.05); ВАШ и СОЭ, r = 0.282 (p < 0.05); для пары ВАШ и СРБ значимой корреляционной зависимости нет.
Оценка коэффициентов ранговой корреляции между клиническим индексом активности РА CDAI и каждой из переменных: СОЭ, 14-3-3η и СРБ показала следующие результаты: СDAI и 14-3-3η, r = 0.472 (p < 0.001), CDAI и СОЭ, r = 0.236 (p < 0.05); между парами СDAI и СРБ корреляция статистически не значима (p > 0.05). Таким образом, имеется положительная корреляционная связь между указанными парами, которая высоко статистически значима для нового биомаркера (рис. 2b).
Изучалась корреляционная связь между индексом активности РА DAS28-СОЭ и каждым из исследуемых маркеров, отражающих степень выраженности воспалительного процесса. Была показана высокая взаимосвязь между указанными парами (рис. 2). Коэффициенты ранговой корреляции по Спирмену для всех переменных представлены в табл. 3.
Таблица 3.
Матрица коэффициентов ранговой корреляции Спирмена для уровня белка 14-3-3η, показателей острой фазы, индексов DAS28-СОЭ и CDAI у пациентов с РА
| СОЭ | СРБ | ЧБС | ЧПС | ВАШ | CDAI | DAS28 | |
|---|---|---|---|---|---|---|---|
| 14-3-3η | 0.35* | 0.15 | 0.40* | 0.32* | 0.33* | 0.47* | 0.57* |
| СОЭ | 0.65* | 0.14 | 0.12 | 0.28* | 0.24* | 0.60* | |
| СРБ | 0.08 | 0.11 | 0.19 | 0.16 | 0.44* | ||
| ЧБС | 0.56* | 0.41* | 0.84* | 0.70* | |||
| ЧПС | 0.32* | 0.72* | 0.64* | ||||
| ВАШ | 0.58* | 0.60* | |||||
| CDAI | 0.88* |
В целом, выявлена высоко статистически значимая корреляция содержания белка 14-3-3η в плазме крови со всеми параметрами активности РА по сравнению с традиционными острофазовыми маркерами СОЭ и СРБ, для которых корреляция с суставным синдромом и индексом CDAI была более слабой, либо статистически не значимой. При сравнении нового биомаркера с острофазовыми показателями необходимо ориентироваться не на индекс DAS28, составным компонентом которого является один из маркеров – СОЭ, а на показатели суставного синдрома (ЧПС, ЧБС), а также клинический индекс CDAI.
Изучалась линейная регрессионная связь между клиническим индексом активности РА CDAI и белком 14-3-3η, а также острофазовыми маркерами СОЭ и СРБ. В каждой из регрессий переменные были значимыми, выборка остатков извлечена из генеральной совокупности и не имела грубых ошибок (выбросов) (применялся критерий Граббса). Изучались значения коэффициентов детерминации R2 и нормированного (скорректированного) коэффициентов детерминации R2adj. При сравнении изучаемых регрессий наиболее точным маркером представлен белок 14-3-3η (R2 = 0.2; R2 adj = 0.2). Однако значение коэффициента детерминации невысоко. Таким образом, по результатам обработки данных статистически значимым в оценке активности РА по индексу CDAI оказался один маркер: белок 14-3-3η (р < 0.05). Значения для СОЭ и СРБ не были статистическими значимыми (р > 0.05), а значит данные показатели не влияли на индекс CDAI.
Проверка биологической вариабельности нового биомаркера активности РА, а именно анализ влияния возраста и пола на уровень белка 14-3-3η во всех группах пациентов производился с помощью линейного регрессионного анализа. По результатам анализа статистически значимого влияния пола и возраста на уровень биомаркера обнаружено не было.
Определение содержания нового биомаркера в сравнении с традиционными острофазовыми показателями в группе РА с разной степенью активности заболевания, а также суставным синдромом позволило провести ROC-анализ, задачами которого были сопоставление диагностической точности, чувствительности и специфичности тестов между собой, определение оптимальных пороговых уровней для разных клинических задач [35]. Графики ROC-кривых приведены на рис. 3–5 .
Рис. 3.
(a) – ROC – кривые взаимосвязи маркеров активности РА с числом болезненных суставов; (b) – ROC – кривые взаимосвязи маркеров активности РА с числом припухших суставов. ESR (Erythrocyte Sedimentation Rate) – скорость оседания эритроцитов; CRP (C-reactive protein) – C-реактивный белок.
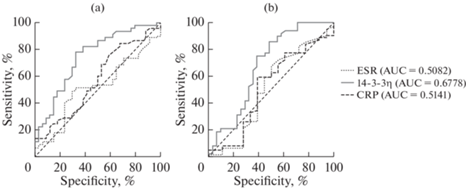
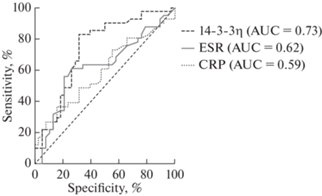
Рис. 4.
ROC – кривые для всех маркеров в зависимости от степени активности РА согласно индексу CDAI (>22).
Большей чувствительностью и специфичностью, а также диагностической точностью в оценке числа болезненных суставов обладает белок 14-3-3η (AСС = 71.99), что нельзя сказать про СОЭ (AСC = 58.37) и СРБ (AСC = 59.74), где показатели низкие. При оценке величины площади под кривой обращает на себя внимание то, что только в двух случаях прослеживается хорошая взаимосвязь биомаркера с ЧБС (AUC > 0.7). Максимальная величина площади под кривой у белка 14-3-3η (AUC = = 0.74, р < 0.001), а показатели для острофазовых маркеров СОЭ (AUC = 0.57, р = = 0.29) и СРБ (AUC = 0.52, р = 0.81) сопоставимы, но их значения статистически не значимы (рис. 3a).
Белок 14-3-3η крови с более высокой диагностической точностью, чувствительностью и специфичностью отражает взаимосвязь с ЧПС (AСC = 68.56) в сравнении с СОЭ и СРБ (AСC = 58.6; AСC = 60.06). Максимальная площадь под кривой была у белка 14-3-3η (AUC = 0.68, р < 0.01), показатели для острофазовых маркеров СОЭ (AUC = 0.51, р = 0.92) и СРБ (AUC = 0.51, р = 0.86) сопоставимы, но их значения описывают слабую взаимосвязь и статистически не значимы (рис. 3b).
При определении взаимосвязи между маркерами и ВАШ различий между показателями для 14-3-3η (AUC = 0.68, р = 0.06), СОЭ (AUC = 0.64, р = 0.14) и СРБ (AUC = 0.56, р = 0.57) не было, но полученные значения оказались статистически не значимыми (р > 0.05).
Проведен ROC-анализ для оценки взаимосвязи всех маркеров со степенью активности РА, определенной по клиническому индексу СDAI. Учитывая преобладание пациентов с умеренной и высокой степенями активности заболевания, мы объединили ремиссию, низкую активность и умеренную в одну группу (CDAI < 22) против пациентов с высокой активностью (СDAI > 22). По результатам анализа выявлено, что уровни белка 14-3-3η имеют более высокие значения диагностической точности, чувствительности и специфичности (AСC = 79.10) в сравнении с СОЭ (AСC = 65.82) и СРБ (AСC = 61.32). При оценке площади под кривой только прослеживается хорошая взаимосвязь нового биомаркера с высокой степенью активности РА (AUC > 0.7). Максимальная площадь под кривой была у белка 14-3-3η (AUC = 0.73, р < 0.001), где показатели высоко статистически значимы; минимальные значения были у СОЭ (AUC = 0.62, р = 0.06) и СРБ (AUC = 0.59, р = 0.15), где показатели оказались статистически не значимыми (рис. 4).
Таким образом, по данным ROC-анализа чувствительность, специфичность, а также диагностическая точность для белка 14-3-3η выше в оценке суставного синдрома, а также активности РА по клиническому индексу CDAI, чем для традиционных острофазовых маркеров. Значения, полученные по данным ROC-анализа для СОЭ и СРБ, статистически недостоверны, и имеют маленькую площадь под кривой.
При проведении линейного дискриминантного анализа из всех показателей содержание только двух показателей: белка 14-3-3η и СОЭ образуют информативное сочетание, но вероятность правильной классификации активности РА согласно индексу DAS28-СОЭ получается только для их логарифмов и составила 67.08%. Согласно индексу CDAI самым информативным вариантом оказалось содержание только одного маркера – белка 14-3-3η, для которого вероятность правильной классификации активности заболевания составила 72%. Важно отметить, что стандартный маркер неспецифического воспаления – СРБ не давал возможности произвести оценку активности РА согласно исследуемым индексам.
Таким образом, при многомерном статистическом анализе данных относительно содержания нового биомаркера активности РА доказана его большая информативность по сравнению с традиционно применяемым показателям острой фазы воспаления.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Согласно современным представлениям, среди провоспалительных цитокинов, участвующих в развитии иммуновоспалительного процесса при РА, значительную роль играет белок 14-3-3η. Локальная продукция данного белка оказывает значимое влияние на миграцию клеток (нейтрофилов, моноцитов/макрофагов, Т-лимфоцитов) в очаг воспаления и течение патологического процесса [28–33]. При изучении локальной и системной продукции белка 14-3-3η было установлено, что у больных РА не только повышено его содержание в сыворотке и плазме крови, а также в синовиальной жидкости, но и отмечается высоко статистически значимая корреляция с интенсивностью локального воспалительного процесса, клиническими параметрами активности РА [28, 30].
Так, в исследовании Maksymowych и соавт. полученные данные свидетельствуют о том, что как при раннем РА, так и при поздней стадии заболевания уровень белка 14-3-3η не коррелировал достоверно с баллами по индексу DAS28 и уровнями СРБ. Однако имела место умеренная корреляция с РФ (r = 0.43, р < 0.01) и АЦЦП (r = 0.31, р < 0.05) в когорте с ранним РА. В этой же статье также сообщалось о положительной связи между белком 14-3-3η и ММП, что подтверждает роль данного биомаркера в патогенезе РА. Таким образом, предполагается, что белок 14-3-3η играет роль в сохранении воспаления за счет индукции таких цитокинов, как ИЛ-6 и за счет усиления разрушения суставов ввиду активации ММП и RANKL (Receptor activator of nuclear factor kappa-B ligand) [30].
В статье Kilborn и соавт. есть данные о том, что высокий уровень 14-3-3η (>0.19 нг/мл) с чувствительностью 63.3% и специфичностью 92.6% позволял выявить пациентов с РА. Более высокие уровни белка 14-3-3η выявлялись при раннем РА (p < 0.05), где пациенты еще не получали лечение, в то время как на более поздних стадиях РА, где пациенты получали достаточно эффективную терапию, не наблюдалось большой разницы по сравнению с контрольной группой. Это может указывать на связь данного биомаркера с активностью заболевания [28].
Имеются данные, что белок 14-3-3η не был связан с острофазовыми показателями такими, как СОЭ и СРБ. В исследованиях также указывается, что исходный уровень белка 14-3-3η был связан с более высокими значениями DAS 28 (6.3 против 5.7, p = 0.026). Также сообщалось о значимых ассоциациях биомаркера с исходным уровнем DAS28-СОЭ, CDAI и SDAI (p < 0.045, p < 0.001); пациенты, достигшие ремиссии, определенной по индексу DAS28-СОЭ, имели более низкую концентрацию белка 14-3-3η, чем пациенты, имеющие высокую активность заболевания [28, 31]. Хорошая взаимосвязь биомаркера с композитным индексом DAS28, а также отсутствие его корреляции с острофазовыми показателями активности РА, свидетельствует о том, что в данный индекс входит клиническая оценка суставного синдрома (ЧПС, ЧБС), с чем, видимо, достаточно хорошо связан белок 14-3-3η. Это подтверждает связь белка 14-3-3η c локальным воспалением у пациентов с РА.
В рекомендациях OMERACT (Outcome Measures in Rheumatology) белок 14-3-3η рассматривался в качестве прогностического биомаркера, отражающего повреждение суставов. Авторами исследования обнаружено, что уровень белка 14-3-3η в сыворотке крови не коррелировал с активностью заболевания согласно индексу DAS28 и с титрами CРБ. Эти результаты показали, что биомаркер может быть связан с прогнозом заболевания независимо от показателей активности [35]. На основе этих результатов в настоящее время проводится проспективное исследование, целью которого является изучение белка 14-3-3η как независимого предиктора состояния и прогрессирования радиографического повреждения суставов при РА [30, 35]. Использование индекса DAS28 при оценке связи новых биомаркеров с активностью РА может также приводить к ложным результатам, так как в состав данного индекса входят один из острофазовых показателей (СОЭ/СРБ) и ВАШ.
В нашем исследовании оценивалась диагностическая точность, чувствительность, специфичность, а также клиническая информативность белка 14-3-3η в оценке активности заболевания у пациентов с РА. В целом мы обнаружили лучшую взаимосвязь между всеми параметрами активности РА и содержанием нового биомаркера в плазме крови. Согласно проводимым клинико – лабораторным сопоставлениям полученных данных и математической обработке результатов, уровень белка 14-3-3η демонстрировал лучшую связь с суставным синдромом, а также имел лучшую площадь под кривой, диагностическую точность, чувствительность и специфичность у пациентов с умеренной и высокой степенью активности РА согласно индексу CDAI. Наши данные сопоставимы с некоторыми результатами, предоставленными зарубежными авторами [28, 30, 31]. Так, в зарубежных статьях было показано, что содержание данного белка существенно повышено у пациентов с РА по сравнению с группой условно здоровых доноров и пациентов с другими заболеваниями, а также данный параметр динамически отражает улучшения при применении эффективной стратегии лечения, что в перспективе позволит ускорить процесс подбора комплексной терапии. Литературные данные также свидетельствуют о том, что 14-3-3η является одним из основных претендентов на включение в перечень диагностических маркеров оценки состояния пациентов с РА.
Таким образом, данные нашего исследования соотносятся с результатами исследований большинства зарубежных авторов и позволяют считать белок 14-3-3η высокоинформативным и рекомендовать проведение исследований на его содержание в плазме крови при комплексной оценке и мониторинге состояния воспалительного процесса у пациентов с РА.
Проведенное исследование продемонстрировало статистически значимое повышение содержания белка 14-3-3η у больных РА в сравнении со здоровыми добровольцами. Анализ взаимосвязи содержания нового биомаркера в плазме крови с параметрами активности РА показал, что наиболее тесная взаимосвязь маркера прослеживается с суставным синдромом, а также с композитным индексом DAS28-СОЭ, ввиду чего возникла необходимость использовать для дальнейшего анализа клинический индекс CDAI. На основании ранговой корреляции Спирмена была выявлена высоко статистически значимая связь содержания белка 14-3-3η со всеми параметрами активности РА в сравнении с традиционными острофазовыми показателями СОЭ и СРБ. По данным линейного регрессионного анализа высоко значимыми в оценке активности РА, согласно индексу CDAI, был уровень белка 14-3-3η. Значения для СОЭ и СРБ были статистическими не значимыми (р > 0.05), а значит эти показатели при выполнении данного статистического анализа не влияли на индекс CDAI. По данным ROC-анализа показатели чувствительности, специфичности, а также диагностической точности уровня нового биомаркера значительно выше в оценке суставного синдрома и активности РА по клиническому индексу CDAI, чем для традиционных острофазовых маркеров. Значения, полученные по данным ROC-анализа для СОЭ и СРБ, статистически не достоверны, и имеют маленькую площадь под кривой. При проведении линейного дискриминантного анализа наиболее информативным оказалось сочетание десятичных логарифмов содержания белка 14-3-3η и показателями СОЭ, для которых вероятность правильной классификации активности РА согласно индексу DAS28-СОЭ составила 68.08%. Для определения активности РА согласно индексу CDAI самым информативным вариантом оказалось содержание только одного маркера – белка 14-3-3 η, для которого вероятность правильной классификации активности заболевания составила 72%.
Показано, что белок 14-3-3η плазмы крови – новый перспективный лабораторный биомаркер в оценке активности воспалительного процесса при РА, так как является потенциально более информативным, чувствительным и специфичным маркером активности заболевания, чем традиционные острофазовые показатели СОЭ и СРБ. Данный биомаркер можно рассматривать как провоспалительный цитокин. Ввиду этого в дальнейшей перспективе возможно создание более информативного лабораторного индекса активности РА на основе нового биомаркера.
Список литературы
Smolen JS, Aletaha D, Bijlsma JWJ, Breedveld FC, Boumpas D, Burmester G, Combe B, Cutolo M, de Wit M, Dougados M, Emery P, Gibofsky A, Gomez-Reino JJ, Haraoui B, Kalden J, Keystone EC, Kvien TK, McInnes I, Martin-Mola E, Montecucco C, Schoels M, van der Heijde D (2010) Treating rheumatoid arthritis to target: recommendations of an international task force. Ann Rheumat Disease 69(4): 631–637. https://doi.org/10.1136/ard.2009.123919
Karateev DE, Olunin YA (2008) About classification of rheumatoid arthritis. Rheumatol Sci Pract 5. https://doi.org/10.14412/1995-4484-2008-848
Smolen JS, Landewé R, Bijlsma J, Burmester G, Chatzidionysiou K, Dougados M, Nam J, Ramiro S, Voshaar M, van Vollenhoven R, Aletaha D, Aringer M, Boers M, Buckley CD, Buttgereit F, Bykerk V, Cardiel M, Combe B, Cutolo M, van Eijk-Hustings Y, Emery P, Finckh A, Gabay C, Gomez-Reino J, Gossec L, Gottenberg J, Hazes JMW, Huizinga T, Jani M, Karateev D, Kouloumas M, Kvien T, Li Z, Mariette X, McInnes I, Mysler E, Nash P, Pavelka K, Poór G, Richez C, van Riel P, Rubbert-Roth A, Saag K, da Silva J, Stamm T, Takeuchi T, Westhovens R, de Wit M, van der Heijde D (2017) Eular recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Ann Rheumat Disease 76: 960–977. https://doi.org/10.1136/annrheumdis-2016-210715
Fransen J, Stucki G, van Riel P (2003) Rheumatoid arthritis measures: Disease activity score (DAS), disease activity score-28 (DAS28), rapid assessment of disease activity in rheumatology (radar), and rheumatoid arthritis disease activity index (Radai). Arthrit & Rheumat 49(S5): S214–S224. https://doi.org/10.1002/art.11407
Prevoo MLL, van’t Hof MA, Kuper HH, van Leeuwen MA, van de Putte LBA, van Riel PLCM (1995) Modified disease activity scores that include twenty-eight-joint counts development and validation in a prospective longitudinal study of patients with rheumatoid arthritis. Arthrit & Rheumat 38(1): 44–48. https://doi.org/10.1002/art.1780380107
van der Heijde DM, van’t Hof MA, van Riel PL, Theunisse LA, Lubberts EW, van Leeuwen MA, van Rijswijk MH, van de Putte LB (1990) Judging disease activity in clinical practice in rheumatoid arthritis: first step in the development of a disease activity score. Ann Rheumat Disease 49(11): 916–920. https://doi.org/10.1136/ard.49.11.916
Inoue E, Yamanaka H, Hara M, Tomatsu T, Kamatani N (2007) Comparison of Disease Activity Score (DAS)28- erythrocyte sedimentation rate and DAS28- C-reactive protein threshold values. Ann Rheumat Disease 66(3): 407–409. https://doi.org/10.1136/ard.2006.054205
Boers M, Tugwell P (1993) OMERACT conference questionnaire results. OMERACT Committee. J Rheumat 20(3): 552–554.
Boers M, Riel PLCM, Felson DT, Tugwell P (1995) Assessing the activity of rheumatoid arthritis. Baillière's Clin Rheumat 9: 305–317. https://doi.org/10.1016/s0950-3579(05)80192-x
Bombardier CPACGW, Tugwell P, Sinclair A, Dok C, Anderson G, Buchanan W (1982) Preference for endpoint measures in clinical trials: results of structured workshops. J Rheumat 9(5): 798–801.
Pincus T (2008) Limitations of a quantitative swollen and tender joint count to assess and monitor patients with rheumatoid arthritis. Bull NYU Hospital Jt Disease 66(3).
Marhadour T, Jousse-Joulin S, Chalès G., Grange L, Hacquard C, Loeuille D, Sellam J, Albert JD, Bentin J, Chary Valckenaere I, D’agostino MA, Etchepare F, Gaudin P, Hudry C, Dougados M, Saraux A (2010) Reproducibility of Joint Swelling Assessments in Long-lasting Rheumatoid Arthritis: Influence on Disease Activity Score-28 Values (SEA-Repro Study Part I). J Rheumat 37(5): 932–937. https://doi.org/10.3899/jrheum.090879
Wells G, Li T, Maxwell L, Maclean R, Tugwell P (2008) Responsiveness of patient reported outcomes including fatigue, sleep quality, activity limitation, and quality of life following treatment with abatacept for rheumatoid arthritis. Ann Rheumat Disease 67(2): 260–265. https://doi.org/10.1136/ard.2007.069690
Svedberg CA (1967) Normal erythrocyte sedimentation rate and age. Br Med J 2(5544): 85.
Ramírez J, Narváez JA, Ruiz-Esquide V, Hernández-Gañán J, Cuervo A, Inciarte-Mundo J, Hernández MV, Sampayo-Cordero M, Pablos JL, Sanmartí R, Cañete JD (2017) Clinical and sonographic biomarkers of structural damage progression in RA patients in clinical remission: A prospective study with 12 months follow-up. Seminars Arthrit & Rheumat 47(3): 303–309. https://doi.org/10.1016/j.semarthrit.2017.04.007
Kamel SR, Sadek HA, Mohamed FA, Osman HM (2018) Role of ultrasound disease activity score in assessing inflammatory disease activity in rheumatoid arthritis patients. Egypt Rheumat 40(1): 1–5. https://doi.org/10.1016/j.ejr.2017.04.002
Oderda GM, Lawless GD, Wright GC, Nussbaum SR, Elder R, Kim K, Brixner DI (2018) The potential impact of monitoring disease activity biomarkers on rheumatoid arthritis outcomes and costs. Personal Med 15(4): 291–301. https://doi.org/10.2217/pme-2018-0001
Bensen WG, Jovaisas A, Thorne C, Baer P, Khraishi M, Dixit S, Choquette D, Starr M, Fortin I, Sholter D, Rampakakis E, Sampalis JS, Lehman AJ, Nantel F, Shawi M, Otawa S (2013) SAT0035 Variability in the Classification of Remission among Disease Activity Indices and Their Correlation: An Analysis From a Prospective, Observational Registry. Ann Rheumat Disease 72(Suppl 3): A591–A592. https://doi.org/10.1136/annrheumdis-2013-eular.1761
Syversen SW, Haavardsholm EA, Boyesen P, Goll GL, Okkenhaug C, Gaarder P I, van der Heijde D, Kvien TK (2010) Biomarkers in early rheumatoid arthritis: longitudinal associations with inflammation and joint destruction measured by magnetic resonance imaging and conventional radiographs. Ann Rheumat Disease 69(5): 845–850. https://doi.org/10.1136/ard.2009.122325
Chandra PE, Sokolove J, Hipp BG, Lindstrom TM, Elder JT, Reveille JD, Eberl H, Klause U, Robinson WH (2011) Novel multiplex technology for diagnostic characterization of rheumatoid arthritis. Arthrit Res & Therap 13(3): R102. https://doi.org/10.1186/ar3383
Sagoo P, Perucha E, Sawitzki B, Tomiuk S, Stephens DA, Miqueu P, Chapman S, Craciun L, Sergeant R, Brouard S, Rovis F, Jimenez E, Ballow A, Giral M, Rebollo-Mesa I, le Moine A, Braudeau C, Hilton R, Gerstmayer B, Bourcier K, Sharif A, Krajewska M, Lord GM, Roberts I, Goldman M, Wood KJ, Newell K, Seyfert-Margolis V, Warrens AN, Janssen U, Volk HD, Soulillou JP, Hernandez-Fuentes MP, Lechler R (2010) Development of a cross-platform biomarker signature to detect renal transplant tolerance in humans. J Clin Invest 120(6): 1848–1861. https://doi.org/10.1172/JCI39922
Wener MH (2011) Multiplex, megaplex, index, and complex: the present and future of laboratory diagnostics in rheumatology. Arthrit Res & Therapy 13(6): 134. https://doi.org/10.1186/ar3498
Novikov A, Aleksandrova E, Gerasimov A, Cherkasova M, Karateev D, Luchikhina E, Nasonov E (2013) Multiparameter analysis of biomarkers in the laboratory diagnosis of early rheumatoid arthritis. Rheumat Sci and Practic 51(2): 111–116. https://doi.org/10.14412/1995-4484-2013-636
Novikov A, Aleksandrova E, Nasonov E (2014) Elaboration and application of the diagnostic index based on multivariate analysis of biomarkers to determine the activity of rheumatoid arthritis. Rheumat Sci and Pract 52(1): 72–78. https://doi.org/10.14412/1995-4484-2014-72-78
Maslaynski A, Lapin S, Mazing A, Bulgakova T, Lazareva N, Cheshuina M, Oleinick P, Ilivanova E, Totolyan A, Mazurov V (2012) Diagnostic value of serological markers of rheumatoid arthritis. Rheumat Sci and Pract 50(5): 20–24. https://doi.org/10.14412/1995-4484-2012-1175
Hueber W, Tomooka BH, Zhao X, Kidd BA, Drijfhout JW, Fries JF, van Venrooij WJ, Metzger AL, Genovese MC, Robinson WH (2007) Proteomic analysis of secreted proteins in early rheumatoid arthritis: anti-citrulline autoreactivity is associated with up regulation of proinflammatory cytokines. Ann Rheumat Disease 66(6): 712–719. https://doi.org/10.1136/ard.2006.054924
van der Pouw Kraan TCTM, van Gaalen FA, Kasperkovitz PV, Verbeet NL, Smeets TJM, Kraan MC, Fero M, Tak PP, Huizinga TWJ, Pieterman E, Breedveld FC, Alizadeh AA, Verweij CL (2003) Rheumatoid arthritis is a heterogeneous disease: Evidence for differences in the activation of the STAT-1 pathway between rheumatoid tissues. Arthrit & Rheumat 48(8): 2132–2145. https://doi.org/10.1002/art.11096
Kilborn S, Bukhari M (2018) AB0302 The role of the biomarker 14-3-3 eta in rheumatoid arthritis: a review. Rheumat Arthrit – Prognosis, Predictors and Outcome 1329.1–1329. https://doi.org/10.1136/annrheumdis-2018-eular.6614
Lee DG, Woo JW, Kwok SK, Cho ML, Park SH (2013) MRP8 promotes Th17 differentiation via upregulation of IL-6 production by fibroblast-like synoviocytes in rheumatoid arthritis. Exp Mol Med 45(4): e20–e20. https://doi.org/10.1038/emm.2013.39
Bach M, Moon J, Moore R, Pan T, Nelson J, Lood C (2020) Neutrophil Activation Biomarker Panel in Prognosis and Monitoring of Patients with Rheumatoid Arthritis. Arthrit & Rheumat 72(1): 47–56. https://doi.org/10.1002/art.41062
Maksymowych WP, van der Heijde D, Allaart CF, Landewé R, Boire G, Tak PP, Gui Y, Ghahary A, Kilani R, Marotta A (2014) 14-3-3η is a novel mediator associated with the pathogenesis of rheumatoid arthritis and joint damage. Arthrit Res & Therap 16(2): R99. https://doi.org/10.1186/ar4547
Zhukov OS, Abolhosn RW, Popov JM, Naides SJ (2013) FRI0054 Elevated 14-3-3 eta in rheumatoid arthritis and arthritogenic viral infections. Ann Rheumat Disease 72(Suppl 3): A386.2–A386. https://doi.org/10.1136/annrheumdis-2013-eular.1181
Kadavath S, Chittalae S, Nidal Shuaib O, Soon Goh K, Tosic M, Giles J, Efthimiou P (2014) SAT0211 14-3-3 ETA Protein: A Novel Biomarker for the Diagnosis of Rheumatoid Arthritis: Ann Rheumat Disease 73(Suppl 2): 666.1–666. https://doi.org/10.1136/annrheumdis-2014-eular.5776
Altman R, Asch E, Bloch D, Bole G, Borenstein D, Brandt K, Christy W, Cooke TD, Greenwald R, Hochberg M, Howell D, Kaplan D, Koopman W, Longley S, Mankin H, McShane DJ, Medsger T, Meenan R, Mikkelsen W, Murphy W, Rothschild B, Segal M, Sokoloff L, Wolfe F (1986) Development of criteria for the classification and reporting of osteoarthritis: Classification of osteoarthritis of the knee. Arthrit & Rheumat 29(8): 1039–1049. https://doi.org/10.1002/art.1780290816
Metz CE (1978) Basic principles of ROC analysis. Sem Nuc Med 8: 283–298. https://doi.org/10.1016/s0001-2998(78)80014-2
Maksymowych W, Landewé R, Tak P, Ritchlin C, Ostergaard M, Mease P, El-Gabalawy H, Garnero P, Gladman D, Fitzgerald O, Aletaha D, Bykerk V, Bathon J, Syversen S, Boers M, Geusens P, Inman R, Kraus V, Kvien T, Taylor W, Wells G, Van der Heijde D (2009) Reappraisal of OMERACT 8 draft validation criteria for a soluble biomarker reflecting structural damage endpoints in rheumatoid arthritis, psoriatic arthritis, and spondyloarthritis: the OMERACT 9 v2 criteria. J Rheumat 36 (8): 1785–1791. https://doi.org/10.3899/jrheum.090346
Felson DT, Smolen JS, Wells G, Zhang B, van Tuyl LHD, Funovits J, Aletaha D, Allaart CF, Bathon J, Bombardieri S, Brooks P, Brown A, Matucci-Cerinic M, Choi H, Combe B, de Wit M, Dougados M, Emery P, Furst D, Hawker G, Keystone E, Khanna D, Kirwan J, Kvien TK, Landewé R, Listing J, Michaud K, Martin-Mola E, Montie P, Pincus T, Richards P, Siegel JN, Simon LS, Sokka T, Strand V, Tugwell P, Tyndall A, van der Heijde D, Verstappen S, White B, Wolfe F, Zink A, Boers M (2011) American College of Rheumatology/European League Against Rheumatism provisional definition of remission in rheumatoid arthritis for clinical trials. Arthrit & Rheumat 63(3): 573–586. https://doi.org/10.1002/art.30129
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


