Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 10, стр. 1457-1475
Сравнение влияния содержания крыс в горах и на равнине на развитие стрептозотоцин-индуцированного диабета и язвообразование в желудке
Т. Т. Подвигина 1, *, О. П. Комкова 1, О. В. Ветровой 1, 2, Н. И. Ярушкина 1, Л. П. Филаретова 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: podviginatt@infran.ru
Поступила в редакцию 13.08.2023
После доработки 17.09.2023
Принята к публикации 19.09.2023
- EDN: QRCCBD
- DOI: 10.31857/S0869813923100096
Аннотация
Гипоксия может корректировать развитие диабета и его осложнений у животных и человека, а диабет усугубляет язвообразование в желудке. Однако влияние гипоксии на язвообразование в желудке при диабете остается неизвестным. Задача работы состояла в сравнении влияния содержания крыс в горах при умеренной естественной гипоксии и на равнине на развитие диабета 1-го типа и язвообразование в желудке. Через 2 нед. после акклиматизиции крыс к гипоксии (Приэльбрусье, 2125 м над уровнем моря) им вводили стрептозотоцин (СТР, 50 или 70 мг/кг) или его растворитель. Одновременно крыс на равнине инъецировали СТР (или растворителем) в тех же дозах. Спустя 2 нед. на фоне 24-часового голодания крысам как в горах, так и на равнине, вводили индометацин (35 мг/кг), что приводило к образованию эрозий в слизистой оболочке желудка через 4 ч. Введение СТР (50 и 70 мг/кг) вызывало дозозависимое увеличение уровня глюкозы в крови у крыс как в горах, так и на равнине, что свидетельствует о развитии диабета разной степени тяжести. У крыс на равнине введение СТР (50 и 70 мг/кг) приводило к дозозависимому увеличению площади эрозий, индуцированных индометацином, по сравнению с контрольными животными (растворитель СТР). У крыс в горах наблюдалось усугубление повреждений слизистой оболочки желудка, вызванное индометацином, как у контрольных крыс (растворитель СТР), так и у животных со СТР-индуцированным диабетом по сравнению с повреждениями у крыс соответствующих групп на равнине. Наибольшее усиление проульцерогенного действия СТР в горах наблюдалось при его введении в дозе 70 мг/кг. Таким образом, постоянная умеренная гипоксия может приводить к усилению язвообразования в желудке, вызванного индометацином, у крыс с диабетом 1-го типа, и кроме того, сама по себе усугублять ульцерогенное действие индометацина.
ВВЕДЕНИЕ
Диабет относится к числу заболеваний, приводящих к ранней инвалидности и смертности, при этом распространенность диабета во всем мире неуклонно растет. Количество пациентов с сахарным диабетом в 2021 г. достигло 537 млн человек [1]. В Российской Федерации общая численность пациентов с диабетом к началу 2023 г. составила почти 5 млн человек (3.31% населения) [2].
Пропорционально росту распространенности диабета увеличивается и численность пациентов с тяжелыми сопутствующими осложнениями этого заболевания [3]. Ретинопатия, нефропатия, нейропатия – среди известных тяжелых последствий диабета [3]. Диабет является одной из ведущих причин слепоты [4], почечной недостаточности [5], сердечных приступов, инсульта [6], ампутации нижних конечностей [7].
Гипергликемия, развивающаяся при диабете, связана либо с неспособностью вырабатывать инсулин из-за потери бета-клеток поджелудочной железы (диабет 1-го типа) или из-за резистентности к инсулину (диабет 2-го типа). Несмотря на различие в этиологии заболевания, хроническая гипергликемия остается ключевой проблемой для всех типов диабета [3] и соответственно на нее направлены лечебные воздействия.
Превалирующими являются медикаментозные способы лечения диабета. Инсулиновая терапия, основанная на контроле уровня глюкозы в крови с помощью экзогенного инсулина, является доминирующим подходом при лечении диабета у человека и животных [8–12]. В настоящее время проводятся исследования, в которых ведется поиск более эффективных способов использования инсулина, среди них – способ его интраназального введения [13]. К числу перспективных подходов, направленных на лечение диабета, относятся также целенаправленная доставка антидиабетических факторов; заместительная терапия β-клетками путем трансплантации островковой ткани, терапия на основе генов и стволовых клеток, иммунотерапия и автоматизированное лечение с помощью искусственной поджелудочной железы и другие [14–17].
Наряду с использованием медикаментозных способов лечения диабета и его последствий, все большее внимание в настоящее время уделяется и немедикаментозным подходам. Общепризнано, что физические упражнения, в частности бег, доступный и животным, и людям, ослабляет развитие диабета и сопутствующих осложнений [18, 19].
Среди разработок немедикаментозных подходов выделяется гипоксия. В литературе обсуждается вопрос о влиянии гипоксии на течение диабета. При этом данные противоречивы, что во многом объясняется разными моделями гипоксии: от апноэ во время сна [20], которое оказывает негативное влияние на организм, до искусственной гипоксии в барокамере, влияние которой зависит от используемой модели. Наиболее часто применяется периодическая гипоксия. Условия исследования в этой модели могут различаться по степени гипоксии, по продолжительности применения ежедневной гипоксии и по длительности ежедневного пребывания в камере (от минут до часов). Используют как нормобарическую (при нормальном давлении в камере снижают содержание кислорода в смеси газов), так гипобарическую гипоксию (снижение давления в камере, что приближает эту модель к условиям гор). Несмотря на эти различия в условиях исследований, имеется целый ряд работ, в которых показан корректирующий эффект периодической гипоксии на показатели метаболического синдрома и диабета 1-го и 2-го типа как у людей [21, 22], так и у животных [23, 24]. Для пациентов с диабетом более эффективным подходом к облегчению болезни считается сочетание гипоксии с физическими упражнениями [21, 25–27]. В экспериментах на крысах при метаболическом синдроме и диабете обнаружен позитивный эффект периодической гипоксии на сопутствующие осложнения сердечно-сосудистой системы [28, 29], почек [23], печени [23].
Исследования на людях проведены не только при искусственной гипоксии, в частности в барокамерах, но и при естественной – пребывании в горах. Обнаружен корректирующий эффект гипоксии на развитие диабета при длительной акклиматизации людей к среднегорью в сочетании с физической нагрузкой [26, 27]. Кроме того, показано, что в популяции населения, проживающего в горах Чили [30] или Китая [31], процент заболевания диабетом значительно ниже, чем по стране в целом. Эксперименты на животных, проведенные в условиях акклиматизации к гипоксии в горах, единичны [32], и они не связаны с диабетом и/или язвообразованием.
Диабет нарушает функционирование всех систем организма, в том числе и желудочно-кишечного тракта. Хотя термин “диабетическая гастропатия” [33], на наш взгляд, остается не таким распространенным как ретинопатия, нефропатия, нейропатия [3], но тем не менее, гастропатия при диабете – это не только патология, но и угроза жизни. При диабете усугубляется чувствительность слизистой оболочки желудка к повреждающим воздействиям в результате чего увеличивается риск язвообразования в желудке [33–39]. Язвообразование в желудке само по себе остается серьезной клинической проблемой [40], эта проблема значительно усугубляется для пациентов с диабетом [39], и, следовательно, требует разработки эффективных подходов к ее решению. Наши научные интересы связаны с исследованием язвообразования в желудке при диабете у экспериментальных животных, которые проводятся в разных аспектах [18, 34, 35, 41, 42], в том числе и в направлении поиска немедикаментозных подходов для профилактики и лечения язвообразования при диабете. В связи с этим нас интересовал вопрос, может ли такой немедикаментозный подход, как гипоксия, оказывающая влияние на развитие и течение диабета, влиять и на язвообразование в желудке.
Нам не удалось найти данных литературы о влиянии гипоксии на слизистую оболочку желудка при диабете. При этом мы нашли немногочисленные сведения о влиянии гипоксии самой по себе (без диабета) на слизистую оболочку желудка крыс. Согласно этим данным, гипоксия не только не оказывает позитивного влияния на чувствительность слизистой оболочки желудка к ульцерогенным воздействиям, а наоборот, приводит к негативным эффектам. В частности, было показано ульцерогенное действие на желудок тяжелой гипоксии в барокамере самой по себе [43, 44].
Настоящая работа является первой по исследованию влияния гипоксии на язвообразование в желудке у животных с диабетом. Работа выполнена с использованием естественной умеренной гипоксии среднегорья.
Задача настоящей работы состояла в сравнении влияния содержания крыс в горах при умеренной естественной гипоксии и на равнине на развитие стрептозотоцин-индуцированного диабета и язвообразование в желудке.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проводились на крысах-самцах линии Спрейг-Доули массой 240–270 г из ЦКП “Биоколлекция Института физиологии РАН” (Колтуши, Ленинградская обл.). Для сравнительного исследования влияния содержания крыс в горах и на равнине на развитие стрептозотоцин-индуцированного диабета и язвообразование в желудке были использованы две группы крыс. Одна группа крыс была транспортирована в условия среднегорья: Приэльбрусье (п. Терскол). При транспортировке в Терскол наземным транспортом, которая заняла 2 дня, крысы находились при постоянном доступе к воде и пище. После прибытия на экспериментальную станцию в Терскол животные в течение двух недель акклиматизировались к умеренной естественной гипоксии условий среднегорья на высоте 2125 м над уровнем моря (что соответствует примерно 77% от нормоксического парциального давления кислорода [32]. Одновременно другая группа крыс, оставшаяся на равнине (Колтуши), после перемещения из институтского вивария в лабораторный также в течение двух недель адаптировалась к условиям лабораторного вивария (соответственно это группа неакклиматизированных к гипоксии животных). И в горах, и на равнине крысы содержались по 5 особей в клетке в стандартных лабораторных условиях: температура 21–22°C, световой режим 12 ч:12 ч (включение света в 8 ч, выключение в 20 ч).
Диабет 1-го типа был индуцирован введением стрептозотоцина (СТР) (Sigma-Aldrich, Германия). Введение СТР является широко распространенной экспериментальной моделью инсулин-зависимого диабета [45].
Для развития диабета 1-го типа разной степени тяжести СТР вводили в двух дозах: 50 или 70 мг/кг (3 мл/кг), внутрибрюшинно. Контрольным крысам вводили растворитель СТР: 0.1 М цитратный буфер (pH 5.0) в таком же объеме.
В качестве ульцерогенного стимула использовали нестероидный противовоспалительный препарат (НСПВП) – индометацин (ИМ) (Sigma-Aldrich, Германия), который вводили в дозе 35 мг/кг (5 мл/кг) подкожно предварительно голодавшим 24 ч крысам. Выбор ИМ для ульцерогенеза определялся клинической значимостью: использование НСПВП в клинике является одной из наиболее распространенных причин повреждения желудочно-кишечного тракта [39, 46]. Согласно результатам наших предыдущих исследований, введение ИМ в данной дозе приводит к образованию хорошо видимых геморрагических эрозий в слизистой оболочке желудка через 4 ч после его введения [47]. Контрольным животным вводили растворитель ИМ (физиологический раствор с каплей Твина) в таком же объеме.
Через две недели после акклиматизации крыс к гипоксии в горах или адаптации к лабораторным условиям на равнине животные каждой группы были разделены на четыре подгруппы. Введение препаратов каждой подгруппе осуществлялось в следующей комбинации: 1) растворитель СТР + растворитель ИМ; 2) растворитель СТР + ИМ, 3) СТР в дозе 50 мг/кг + ИМ, 4) СТР в дозе 70 мг/кг + ИМ. Первая, контрольная, подгруппа (растворитель СТР + растворитель ИМ) была создана для сравнения базального уровня кортикостерона и связанных с ним показателей (относительная масса надпочечников и тимуса) у крыс, находящихся в горах и на равнине. Кроме того, с использованием этой контрольной группы проверяли возможность влияния гипоксии самой по себе (без диабета и ИМ) на слизистую оболочку желудка.
Для наблюдения за развитием диабета в динамике у крыс определяли уровень глюкозы в крови и массу тела. Глюкозу измеряли в капле крови, взятой из хвостовой вены крыс до введения СТР и после его введения на 3-й, 7-й, 13-й (до голода) дни и на 14-й день (после голода). Массу тела крыс измеряли перед введением СТР (1-й день), на 13-й и 14-й дни после введения СТР. На 13-й день после тестирования уровня глюкозы и взвешивания у всех крыс убирали пищу, оставляя при этом воду. После 24-часового голодания на 14-й день крысам трех подгрупп (за исключением 1-й подгруппы: растворитель СТР + растворитель ИМ) вводили ИМ в ульцерогенной дозе (35 мг/кг) и убирали воду. Через 4 ч после введения ИМ или его растворителя крыс декапитировали.
После декапитации собирали пробы крови для определения уровней кортикостерона и глюкозы в крови, извлекали желудок для оценки состояния его слизистой оболочки, а также тимус и надпочечники для определения их массы. Площадь эрозий оценивали на основании фотографий желудков с помощью модифицированной компьютерной программы Image J [48]. Оценивали относительную (по отношению к массе тела) массу тимуса и надпочечников. Содержание глюкозы определяли с помощью тест-полосок системы (One Touch Ultra, США). Уровень кортикостерона в плазме крови определяли иммуноферментным методом с использованием набора реагентов “Кортикостерон крыса/мышь-ИФА” (“ХЕМА”).
Результаты представлены как среднее ± стандартная ошибка среднего. Данные были проанализированы с помощью программы MedCalc 12.7.0.0. (Статистика для биомедицинских исследований, MedCalc Software, Бельгия). Двухфакторный дисперсионный анализ для повторных измерений (Repeated measures ANOVA) использовали для анализа данных об изменении уровня глюкозы. Сравнение площадей язв, уровней кортикостерона и соматических показателей осуществлялось с помощью теста Kruskal–Wallis. Различия между группами считались достоверными при уровне значимости p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Введение СТР в дозах 50 и 70 мг/кг крысам, находящимся как на равнине, так и в горах, привело к дозозависимому увеличению уровня глюкозы в крови, что свидетельствует о развитии диабета разной степени тяжести. Повышенный уровень глюкозы наблюдался уже через 3 дня после введения СТР (50 или 70 мг/кг), и в этой временной точке после введения СТР в определенной дозе не было обнаружено достоверных отличий между уровнями глюкозы у крыс, находящихся в условиях среднегорья и на равнине (рис. 1a, b). На 13-й день исследования после введения СТР в дозе 70 мг/кг уровень глюкозы у крыс в горах также достоверно не отличался от такового у крыс на равнине. Однако на 13-й день после введения СТР в дозе 50 мг/кг уровень глюкозы у крыс, находящихся в горах, был достоверно ниже уровня глюкозы у крыс на равнине. Рис. 1с демонстрирует эти различия в уровнях глюкозы в горах и на равнине.
Рис. 1.
Динамика уровней глюкозы в крови у крыс, находящихся на равнине (a) и в горах (b) после введения СТР или его растворителя. (c) – Сравнение уровней глюкозы в горах и на равнине. На (a, b) – Контроль – введение растворителя СТР; СТР 50, СТР 70 – введение СТР в дозе 50 или 70 мг/кг. Repeated measures Anova: (a) – group F2,40 = 42.75 (p < 0.001); time F4,40 = 113.7 (p < 0.001); group × time F8,40 = 496.64 (p < 0.001); (b) – group F2,40 = 71.62 (p < 0.001); time F4,40 = 158.7 (p < 0.001); group × time F4,40 = 42.19 (p < 0.001). Достоверность отличий между группами в каждой временной точке при p < 0.05 (Kruskal–Wallis test): * – от контроля (равнина или горы), # – от дозы СТР 50 мг/кг (равнина или горы), + – от соответствующего значения в группе “Равнина”. Количество случаев (n) в группе 10–15.
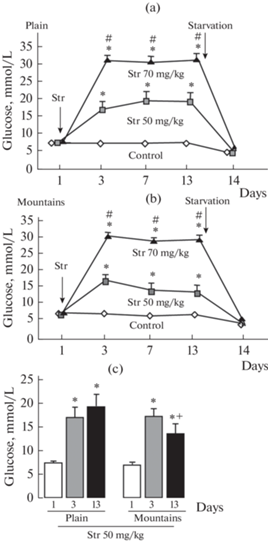
На 14-й день после 24-часового голодания наблюдалось падение уровня глюкозы ниже исходного базального уровня (до введения СТР) как в горах (p < 0.001), так и на равнине (p < 0.001). Однако снижение уровня глюкозы в горах было больше по сравнению c уровнем на равнине (рис. 2), при этом были обнаружены также отличия между уровнями глюкозы внутри групп, находящихся в горах и на равнине (Kruskal–Wallis test, p < 0.001): у крыс с введением СТР в дозе 70 мг/кг (на равнине) и в дозе 50 мг/кг (в горах) уровни глюкозы были выше по сравнению с соответствующим контролем (рис. 2). Обращаем внимание на наиболее ярко выраженную разницу в средних уровнях глюкозы у крыс в среднегорье и равнине в подгруппах с введением СТР в дозе 70 мг/кг. Данные, представленные на рис. 2, являются детализацией временной точки 14-й день на рис. 1a, b.
Рис. 2.
Средние уровни глюкозы в крови после 24 ч голодания (через 4 ч после введения индометацина) у крыс, находящихся на равнине и в горах, на 14-й день после введения СТР или его растворителя. Контр (контроль) – введение растворителя СТР; СТР 50, СТР 70 – введение СТР в дозе 50 или 70 мг/кг. Достоверность отличий у при p < 0.05 (Kruskal–Wallis test): * – от всех групп, # – от соответствующей группы на равнине, + – от контроля (горы). Количество случаев (n) в группе 10–15.
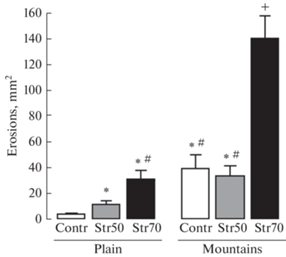
Введение СТР в двух дозах (50 и 70 мг/кг) крысам, находящимся на равнине, привело и к дозозависимому увеличению площади эрозий в слизистой оболочке желудка, индуцированных ИМ, по сравнению с этим показателем у контрольных животных с введением растворителя СТР (рис. 3). В сравнении с крысами на равнине у животных, акклиматизированных в течение двух недель к условиям среднегорья, наблюдалось усугубление повреждений слизистой оболочки желудка, вызванное ИМ, причем не только у крыс с диабетом, но и у контрольных животных (рис. 3), т.е. проульцерогенный эффект наблюдался при этом независимо от того, вводили СТР или нет. Наиболее ярко это усугубление проявилось у контрольных животных и у крыс с введением СТР в дозе 70 мг/кг: средняя площадь эрозий у контрольных крыс и крыс с введением СТР в дозе 70 мг/кг в горах существенно превышала площадь эрозий в соответствующих группах на равнине. При этом важно отметить, что крысы подгруппы с введением СТР в дозе 70 мг/кг в горах отличались максимальной средней площадью ИМ-индуцированных эрозий, резко превышающей таковую у всех других подгрупп (рис. 3). Введение СТР в дозе 50 мг/кг крысам в горах, хотя и приводило к большей площади эрозий по сравнению с таковой у крыс на равнине (СТР 50 мг/кг), однако не вызывало достоверных различий по сравнению с этим показателем у контрольных крыс (введение растворителя СТР), находящихся также в горах (рис. 3). У контрольных крыс 1-й подгруппы (растворитель СТР + растворитель ИМ), также подвергнутых 24-часовому голоданию, не было обнаружено эрозивных повреждений слизистой оболочки желудка.
Рис. 3.
Средняя площадь эрозий слизистой оболочки желудка, индуцированных введением индометацина (35 мг/кг, подкожно), у крыс после введения СТР или его растворителя в горах и на равнине. Контр (контроль) – введение растворителя СТР; СТР 50, СТР 70 – введение СТР в дозе 50 или 70 мг/кг. Достоверность отличий при p < 0.05 (Kruskal–Wallis test): * – от контроля (равнины), # – от дозы СТР 50 мг/кг (равнины), + – от всех групп. Количество случаев (n) в группе 5–13.
Средние базальные уровни кортикостерона у контрольных крыс (растворитель СТР + растворитель ИМ) в горах и на равнине достоверно не отличались друг от друга и составляли 12.5 ± 1.3 (n = 5) и 16.4 ± 2.1 мкг/дл (n = 5) соответственно. Не было выявлено также достоверных различий у крыс в горах и на равнине по средним показателям относительной массы надпочечников (19.3 ± 1.4 (n = 5) и 18.7 ± 1.4 мг/100 г (n = 5) соответственно) и тимуса (242.6 ± 31.6 (n = 5) и 235 ± ± 12.8 мг/100 г (n = 5) соответственно).
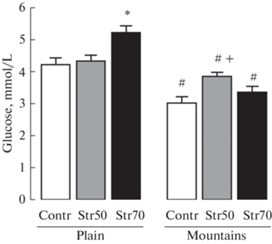
На рис. 4а представлены средние уровни кортикостерона у крыс разных подгрупп через 4 ч после введения ИМ. После введения СТР в дозе 70 мг/кг средний уровень кортикостерона в плазме крови у крыс на равнине был достоверно повышен по сравнению с уровнем у контрольных животных (рис. 4a). Кроме этого увеличения, ярко выраженные изменения уровня кортикостерона наблюдались у контрольных животных (растворитель СТР + ИМ) в горах: средний уровень кортикостерона у них в горах значительно превышал таковой у подобной подгруппы контрольных крыс на равнине и не отличался от высокого уровня кортикостерона, выявленного у крыс на равнине после введения СТР в дозе 70 мг/кг (рис. 4a). В то же время уровни кортикостерона у крыс в горах после введения СТР в обеих дозах достоверно не отличались как от высокого уровня в своей контрольной подгруппе, так и от соответствующих уровней гормона (после введения СТР) на равнине (рис. 4a).
Рис. 4.
Cредние уровни кортикостерона в плазме крови (a) и относительная масса надпочечников (b) через 4 ч после введения индометацина у крыс с предварительным введением СТР (или его растворителя). Контр (контроль) – введение растворителя СТР; СТР 50, СТР 70 – введение СТР в дозе 50 или 70 мг/кг. Достоверность отличий при p < 0.05 (Kruskal–Wallis test): (a) – * от контроля (равнины), # – от дозы СТР 50 мг/кг (равнины), + – от дозы СТР 50 мг/кг (горы); (b) – * от контроля (равнины), # – от дозы СТР 70 мг/кг (равнины), + – от всех групп. Количество случаев (n) в группе 5–13 (a); 5 – 8 (b).

Введение СТР в дозе 50 или 70 мг/кг привело к увеличению относительной массы надпочечников на равнине (рис. 4b). В условиях среднегорья наблюдалось еще большее увеличение относительной массы надпочечников у крыс после введения СТР в дозе 70 мг/кг по сравнению с этим показателем у крыс, находящихся на равнине, а также по сравнению с этим показателем у контрольных крыс и у животных с введением СТР в дозе 50 мг/кг в своей подгруппе (рис. 4b).
У контрольных животных (растворитель СТР + ИМ), находящихся в горах и на равнине не выявлено достоверных различий в приросте массы тела. У животных, находящихся на равнине, введение СТР в дозах 50 и 70 мг/кг привело к дозозависимому снижению прироста массы тела за 13 дней исследования после введения СТР по сравнению с этим показателем у контрольных крыс (растворитель СТР + ИМ). У крыс, акклиматизированных к условиям среднегорья, после введения СТР в дозе 50 мг/кг наблюдался достоверно больший прирост массы тела по сравнению с этим показателем у крыс на равнине (также после введения СТР в дозе 50 мг/кг), причем прирост массы тела в горах не отличался от такового в своей контрольной группе (рис. 5a). После введения СТР в дозе 70 мг/кг у крыс в горах прирост массы тела был минимальным по сравнению с таковым у всех других подгрупп в горах и на равнине.
Рис. 5.
Влияние пребывания крыс в горах и на равнине на прирост массы тела (a) и относительную массу тимуса (b) после введения СТР или его растворителя. Контр (контроль) – введение растворителя СТР; СТР 50, СТР 70 – введение СТР в дозе 50 или 70 мг/кг. Прирост массы тела рассчитывали у каждого животного как разность между массой тела на 1-й и 13-й день после введения СТР (до голода). Тимус был извлечен через 4 ч после введения ИМ на 14-й день после введения СТР у предварительно голодавших 24 ч крыс. Достоверность отличий при p < 0.05 (Kruskal–Wallis test): (a) – * от контроля (равнины), #– от дозы СТР 70 мг/кг (равнины); & – от дозы СТР 70 мг/кг (горы); + – от всех групп; (b) – * от контроля (равнины и горы), # – от дозы СТР 50 мг/кг (равнины и горы). Количество случаев (n) в группе 10–15 (a); 5–8 (b).
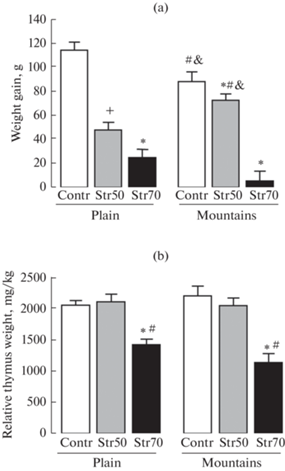
Относительная масса тимуса у всех подгрупп крыс в горах не отличалась от относительной массы тимуса крыс, находящихся на равнине (рис. 5b). Как в горах, так и на равнине относительная масса тимуса у крыс после введения СТР в дозе 70 мг/кг была снижена по сравнению с этим показателем у контрольных крыс (растворитель СТР + ИМ) и у животных после введения СТР в дозе 50 мг/кг (рис. 5b).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В результате сравнительного изучения влияния условий содержания крыс в горах (высота 2125 м над уровнем моря) и на равнине на развитие СТР-индуцированного диабета и на язвообразование в желудке был выявлен новый факт, свидетельствующий о повышении чувствительности слизистой оболочки желудка к повреждающему действию ИМ в условиях среднегорья как у контрольных крыс (растворитель СТР), так и у животных со СТР-индуцированным диабетом по сравнению с этим показателем у крыс, находящихся на равнине.
Наиболее ярко выраженное различие проявилось в резком усилении проульцерогенного действия СТР, введенного в дозе 70 мг/кг, у крыс, находящихся в условиях среднегорья. У этих животных наблюдалась максимальная средняя площадь ИМ-индуцированных эрозий по сравнению с таковой у всех других подгрупп, а также минимальный прирост массы тела. Резкое повышение чувствительности слизистой оболочки желудка к ульцерогенному действию ИМ в условиях среднегорья выявлено и у контрольных крыс без диабета: средняя площадь эрозий у этих животных в несколько раз превышала таковую у крыс на равнине и была сопоставима со средней площадью эрозий у крыс на равнине после введения СТР в дозе 70 мг/кг.
Одной из возможных причин повышения чувствительности слизистой оболочки к ульцерогенному действию ИМ у крыс в горах может являться гипоксия, поскольку известно, что для поддержания защитной функции слизистой оболочки желудка необходимо ее нормальное снабжение кислородом [49]. Полученные нами данные о проульцерогенном влиянии гипоксии на желудок самой по себе (без диабета) находятся в соответствии с результатами немногочисленных работ об ульцерогенном действии гипоксии в камере. Было показано, что жесткая гипоксия в камере, соответствующая пребыванию крыс на высоте 5000 м и продолжающаяся 6 дней, сама по себе приводит к появлению эрозий слизистой оболочки желудка [43]. Согласно нашим результатам, даже умеренная естественная гипоксия на высоте 2125 м над уровнем моря, но продолжающаяся 2 недели, может оказывать проульцерогенное действие в условиях ИМ-индуцированного язвообразования. Из данных литературы известно, что продолжительность гипоксии влияет на степень изъязвления слизистой оболочки желудка. Показана зависимость ульцерогенного влияния постоянной достаточно жесткой гипоксии (10% кислорода) от продолжительности (1, 7, 14 и 21 день) пребывания крыс в камере [44]. Представленные данные о влиянии гипоксии на желудок (в камере), как и результаты нашей работы, получены в условиях постоянной гипоксии. Данных о влиянии периодической гипоксии на желудок в литературе нам найти не удалось.
Согласно полученным данным, гипоксия может вносить свой вклад в усугубление ИМ-индуцированных эрозий у крыс как без диабета, так и с диабетом. При анализе причин усугубления именно ИМ-индуцированных эрозий у крыс следует принимать во внимание, что введение ИМ приводит к дефициту важнейших гастропротективных факторов простагландинов [50], дефицит этот в условиях гипоксии может быть особенно опасен из-за предотвращения реализации возможных адаптивных реакций.
Критически важными для адаптивного ответа на гипоксию являются факторы, индуцируемые гипоксией (HIF), факторы транскрипции [51]. В качестве основного механизма позитивного влияния гипоксии на показатели метаболического синдрома и диабета рассматривается повышение образования HIF1a и HIF2a, приводящего к увеличению экспрессии ростовых факторов, способствующих ангиогенезу, а также других белков для адаптации организма к гипоксии [22, 23, 28, 52]. Существует мнение, что индуцированная гипергликемией репрессия HIF при диабете может быть одной из причин осложнений при этой патологии [53]. Хотя при рассмотрении механизмов влияния гипоксии самой по себе на функционирование разных систем организма роль HIF достаточно активно обсуждается, в отношении его влияния на язвообразование в желудке данные немногочисленны. Показан вклад HIF в заживление язв желудка у крыс за счет увеличения экспрессии ростовых факторов и усиления ангиогенеза [54, 55].
В настоящее время хорошо известным эффектом СТР-индуцированного диабета (без гипоксии), продемонстрированным в настоящей работе и в наших предыдущих исследованиях [34, 41, 42], является его проульцерогенный/ульцерогенный эффект на желудок [33, 36–38, 45]. Впервые об этом сообщили, обнаружив спонтанное язвообразование в желудке у крыс со СТР-индуцированном диабетом после их голодания [56]. Позднее Takeuchi и соавт. подтвердили этот факт (на модели СТР-индуцированного диабета, СТР 70 мг/кг, с 18-часовым голоданием) и дополнительно показали, что резкое падение уровня глюкозы в крови во время голодания диабетических крыс может являться причиной появления повреждений в желудке [45]. В последующие годы это было подтверждено другими исследователями [57, 58], которые, кроме того, обнаружили, что гипогликемия, развивающаяся вследствие 24-часового голодания у крыс с диабетом, приводит к значительной потере гликопротеинов, входящих в состав слизи [58], и, следовательно, истощению защитного слоя слизи, что, в свою очередь, способствует ульцерогенезу. Исходя их этих данных, можно предположить, что наблюдающееся в наших экспериментах достоверно большее снижение уровня глюкозы после 24 ч голодания у крыс в горах по сравнению со снижением у крыс на равнине, также могло вносить свой вклад в усугубление ульцерогенного действия ИМ в горах, в том числе и за счет большего дефицита гликопротеинов в этих условиях. Полученные нами результаты о проульцерогенном действии диабета на ИМ-индуцированные эрозии в желудке хорошо согласуются с данными литературы о проульцерогенном эффекте диабета при действии других ульцерогенных стимулов: стрессоров [59], ишемии-реперфузии [60]. Помимо негативного влияния на формирование повреждений слизистой оболочки желудка, диабет еще и замедляет их заживление [33, 37, 61].
Поскольку отсутствуют данные о сочетанном влиянии диабета и гипоксии на язвообразование в желудке и соответственно механизмах такого влияния, то при обсуждении возможных механизмов выявленных нами совместных эффектов, мы опираемся на данные о механизмах раздельного действия диабета и гипоксии. Интенсивное изучение возможных механизмов проульцерогенного действия диабета проводилось японскими исследователями Takeuchi и соавт., в результате чего было показано, что при СТР-индуцированном диабете (70 мг/кг) у крыс существенно ослабляются ключевые защитные механизмы слизистой оболочки желудка. В условиях диабета страдают ключевые факторы защиты кровоснабжение слизистой оболочки желудка [62] и слизисто-бикарбонатный барьер [61]. Выявлено, что ухудшение кровотока у крыс с диабетом связано с дисфункцией капсаицин-чувствительных афферентных нейронов (по выражению авторов, их диабетической десенситизацией) [62], которые, как известно, вносят важный вклад в гастропротекцию за счет поддержания кровотока [63]. При дисфункции капсаицин-чувствительных афферентных нейронов у крыс с диабетом ухудшается кровоток и снабжение тканей не только нутриентами, но и кислородом, что особенно опасно в условиях гипоксии. При этом следует помнить, что дополнительно к диабету и гипоксии в наших экспериментальных условиях существует еще и индуцированный ИМ дефицит простагландинов, который также сильно сказывается на ослаблении защитных механизмов слизистой оболочки. Все это, на наш взгляд, вносит вклад в то ярко выраженное усугубление ИМ-индуцированного изъязвления слизистой оболочки желудка, которое мы наблюдали у крыс с диабетом (СТР 70 мг/кг) в горах.
В горы крысы транспортировались. На наш взгляд, маловероятно, что выявленные в работе эффекты на язвообразование в желудке обусловлены этой транспортировкой, а не пребыванием крыс в горах. Во-первых, после транспортировки до введения СТР прошло две недели, во время которых крысы адаптировались к новым условиям среднегорья. Во-вторых, базальный уровень кортикостерона (без введения ИМ) не отличался у животных, находящихся на равнине и в горах. Более того, если даже обсуждать влияние стрессорного прекондиционирования, в качестве которого можно рассматривать транспортировку крыс, на язвообразование, то, согласно результатам наших исследований, стрессорное прекондицицирование оказывает гастропротективный эффект и не приводит к усугублению ИМ-индуцированного образования эрозий в желудке даже при ежедневном непредсказуемом предъявлении сильных стрессоров разной модальности в течение 14 дней [64–66]. Приведенные факты свидетельствуют в пользу того, что выявленные негативные различия связаны с условиями среднегорья и гипоксией.
Помимо негативных влияний условий среднегорья, в нашей работе выявлено и их позитивное влияние: через две недели после введения СТР в дозе 50 мг/кг обнаружено снижение уровня глюкозы в крови у крыс, находящихся в горах, по сравнению с таковым у крыс на равнине. Об общем позитивном влиянии условий среднегорья на организм крыс, которым вводили СТР в дозе 50 мг/кг, может свидетельствовать сохранение у них такого же прироста массы тела, как и у контрольных животных в горах, а также и увеличение прироста массы тела по сравнению с этим показателем у крыс на равнине. Кроме того, следует отметить, что именно у этой подгруппы крыс не наблюдалось усугубления ульцерогенного действия ИМ по сравнению с таковым у контрольных крыс (растворитель СТР), также находящихся в горах.
Введение СТР привело к дозозависимому повышению уровня глюкозы в крови у крыс, содержащихся как на равнине, так и в горах. Различия в развитии тяжести диабета после введения СТР в разных дозах (50 и 70 мг/кг) как в горах, так и на равнине, выявлены и по другим исследованным показателям. Пользуясь терминологией, используемой в работе [67], можно считать, что в нашем случае введение СТР в дозе 50 мг/кг индуцировало “мягкий диабет 1-го типа”, а введение в дозе 70 мг/кг – “острый диабет 1-го типа”. Согласно полученным нами результатам, акклиматизация крыс к гипоксии в условиях среднегорья может смягчать развитие “мягкого диабета 1-го типа” и сопутствующих осложнений, и, наоборот, усугублять сопутствующие осложнения “острого диабета 1-го типа”.
Данные, характеризующие развитие диабета после введения СТР в дозе 70 мг/кг, полученные в нашей работе, соответствуют общепринятым в литературе критериям диабета 1-го типа [34, 36, 37, 42, 62].
Одним из признаков диабета, индуцированного СТР (70 мг/кг), является повышение уровня кортикостерона в крови у крыс, что было показано в наших предыдущих работах [34, 68] и подтверждено в настоящей работе. После введения СТР в дозе 70 мг/кг уровень кортикостерона в плазме крови у крыс (через 4 ч после введения ИМ) на равнине был повышен по сравнению с уровнем у контрольных животных. Существенные различия между среднегорьем и равниной по уровню кортикостерона обнаружены только у контрольных крыс (с введением ИМ): показано достоверное повышение среднего уровня кортикостерона в крови у крыс, находящихся в горах, по сравнению с этим показателем у крыс на равнине. Поскольку базальный уровень кортикостерона (без введения ИМ) не отличался у животных, находящихся на равнине и в горах, можно предположить, что повышенный уровень кортикостерона каким-то образом связан с сочетанным действием ИМ и гипоксии. Увеличенная масса надпочечников после введения СТР в дозе 70 мг/кг у крыс в горах по сравнению с этим показателем у крыс на равнине свидетельствует об усилении процессов, связанных с синтезом кортикостерона у этих животных.
Большинство работ, в которых выявлен позитивный эффект гипоксии на развитие диабета и сопутствующих осложнений, проведены в условиях периодической (прерывистой) гипоксии [22–24, 28, 29, 52]. Периодическая гипоксия используется также и для коррекции патологий, не связанных с диабетом. Кондиционирование периодической гипоксией, как немедикаментозным системным вмешательством, уменьшает повреждение головного мозга после инсульта, и может применяться для профилактики и функционального восстановления [69]. Прерывистая гипоксическая тренировка рассматривается в качестве способа повышения адаптационного потенциала, выносливости и работоспособности мозга [70]. Потенциал прерывистой гипоксии остается высоким, в том числе и для наших исследований.
Настоящая работа является первой из известных нам экспериментальных работ по исследованию влияния гипоксии на язвообразование в желудке при диабете. Значимость ее еще связана и с использованием естественной гипоксии в горах, что мы рассматриваем как редкую возможность. Работы по акклиматизации животных к гипоксии в горах единичны и связаны с изучением влияния гипоксии на функцию нервной системы [32]. В использованной нами естественной модели умеренной гипоксии, вызванной пребыванием крыс в горах на высоте 2125 м, показан проульцерогенный эффект гипоксии при ИМ-индуцированном язвообразовании не только у крыс с диабетом, но и у контрольных животных. Таким образом, постоянная умеренная гипоксия может приводить к усилению ИМ-индуцированного язвообразования в желудке у крыс с диабетом 1-го типа, и кроме того, сама по себе усугублять ульцерогенное действие ИМ.
С практической точки зрения эти результаты свидетельствуют о том, что людям с проблемами желудочно-кишечного тракта следует соблюдать осторожность (избегать голодания, применения НСПВП) при пребывании в горах даже в условиях умеренной гипоксии.
Перспектива этой работы видится в поиске режимов прерывистой гипоксии, при которых могут быть выявлены корректирующие эффекты гипоксии на развитие диабета и язвообразования в желудке, индуцированное стимулами разной модальности. При этом рациональным кажется и исследование сочетанного действия гипоксии и бега, гастропротективное действие которого выявлено в наших предыдущих исследованиях [18, 71].
Список литературы
Sun H, Saeedi P, Karuranga S, Pinkepank M, Ogurtsova K, Duncan BB, Stein C, Basit A, Chan JCN, Mbanya JC, Pavkov ME, Ramachandaran A, Wild SH, James S, Herman WH, Zhang P, Bommer C, Kuo S, Boyko EJ, Magliano DJ (2022) IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045. Diabetes Res Clin Pract 183. https://doi.org/10.1016/J.DIABRES.2021.109119
Дедов ИИ, Шестакова МВ, Викулова ОК, Железнякова АВ, Исаков МА, Сазонова ДВ, Мокрышева НГ (2023) Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010–2022 гг. Сахарный диабет 26(2): 104–123. [Dedov II, Shestakova MV, Vikulova OK, Zheleznyakova AV, Isakov MA, Sazonova DV, Mokrysheva NG (2023) Diabetes mellitus in the Russian Federation: dynamics of epidemiological indicators according to the Federal Register of Diabetes Mellitus for the period 2010–2022. Diabetes mellitus 26(2): 104–123. (In Russ)]. https://doi.org/10.14341/DM13035
Reynolds L, Luo Z, Singh K (2023) Diabetic complications and prospective immunotherapy. Front Immunol 14: 1219598. https://doi.org/10.3389/FIMMU.2023.1219598
Mahmood T, Fahim MF, Ahsan S, Qidwai U, Memon MS (2023) Ocular Complications Associated With Diabetes And The Risk Of Sustainable Blindness; A Real World Analysis. J Pak Med Assoc 73: 1453–1456. https://doi.org/10.47391/JPMA.8001
Vučić Lovrenčić M, Božičević S, Smirčić Duvnjak L (2023) Diagnostic challenges of diabetic kidney disease. Biochem Med 33(3): 030501. https://doi.org/10.11613/BM.2023.030501
Mosenzon O, Cheng AYY, Rabinstein AA, Sacco S (2023) Diabetes and Stroke: What Are the Connections? J Stroke 25: 26–38. https://doi.org/10.5853/JOS.2022.02306
Armstrong DG, Tan T-W, Boulton AJM, Bus SA (2023) Diabetic Foot Ulcers: A Review. JAMA 330: 62. https://doi.org/10.1001/JAMA.2023.10578
Home P (2021) The evolution of insulin therapy. Diabetes Res Clin Pract 175: 108816. https://doi.org/10.1016/J.DIABRES.2021.108816
Phadtare P, Patil D, Desai S (2023) Nanotechnology: Newer Approach in Insulin Therapy. Pharm Nanotechnol 11: 3–9. https://doi.org/10.2174/2211738510666220928111142
Sakurai T, Kubota S, Kato T, Yabe D (2023) Advances in insulin therapy from discovery to βрcell replacement. J Diabetes Investig 14: 15–18. https://doi.org/10.1111/JDI.13902
Захарова ИО, Баюнова ЛВ, Деркач КВ, Илясов ИО., Шпаков АО, Аврова НФ (2022) Влияние интраназально вводимых инсулина и ганглиозидов на метаболические показатели и активность инсулиновой системы в печени крыс с сахарным диабетом 2-го типа. Журн эвол биохим физиол 58(2): 141–154. [Zakharova IO, Bayunova LV, Derkach KV, Ilyasov IO, Shpakov AO, Avrova NF (2022) Influence of intranasally insulin and gangliosides on metabolic parameters and of activity of the insulin system in the liver of rats with type 2 diabetes. J Evol Biochem Physiol 58(2): 141–154. (In Russ)].
Деркач КВ, Бахтюков АА, Басова НЕ, Бондарева ВМ, Шпаков АО (2022) Интраназально вводимый инсулин, но не С-пептид проинсулина, нормализует гормональные показатели и экспрессию гипоталамических генов у самцов крыс с диабетом 2-го типа и ожирением. Интеграт физиол 3(1): 41–57. [Derkach KV, Bakhtyukov AA, Basova NE, Bondareva VM, Shpakov AO (2022) Intranasally insured insulin, but not proinsulin C-peptide, normalizes hormonal parameters and expression of hypothalamic genes in male rats with type 2 diabetes and obesity. Integrat Physiol 3(1): 41–57. (In Russ)]. https://doi.org/10.33910/2687-1270-2022-3-1-41-57
Shpakov AO, Zorina II, Derkach KV (2023) Hot Spots for the Use of Intranasal Insulin: Cerebral Ischemia, Brain Injury, Diabetes Mellitus, Endocrine Disorders and Postoperative Delirium. Int J Mol Sci 24(4): 3278. https://doi.org/10.3390/IJMS24043278
Chuzho N, Mishra N, Tandon N, Kumar N (2023) Therapies for Type 1 Diabetes: Is a Cure Possible? Curr Diabetes Rev 19(7): e021222211565. https://doi.org/10.2174/1573399819666221202161259
Li Y, He C, Liu R, Xiao Z, Sun B (2023) Stem cells therapy for diabetes: from past to future. Cytotherapy S1465-S3249(23)00129-9. https://doi.org/10.1016/J.JCYT.2023.04.012
Geng L, Lam KSL, Xu A (2020) The therapeutic potential of FGF21 in metabolic diseases: from bench to clinic. Nat Rev Endocrinol 16: 654–667. https://doi.org/10.1038/S41574-020-0386-0
Bazhan NM, Jakovleva TV, Kazantseva AY, Kostina NE, Orlov PE, Balybina NY, Baranov KO, Makarova EN (2023) Studying sex differences in responses to fibroblast growth factor 21 administration in obese mice consuming a sweet-fat diet. Vavilov Zhurn Genet Selekt 27: 333–341. https://doi.org/10.18699/VJGB-23-40
Podvigina T, Yarushkina NI, Filaretova LP (2022) Effects of Running on the Development of Diabetes and Diabetes-Induced Complications. J Evol Biochem Physiol 58(1): 174–192. https://doi.org/10.31857/S0869813922020078
Zaharieva DP, Riddell MC (2023) Advances in Exercise and Nutrition as Therapy in Diabetes. Diabetes Technol Ther 25: S146–S160. https://doi.org/10.1089/DIA.2023.2509
Ota H, Fujita Y, Yamauchi M, Muro S, Kimura H, Takasawa S (2019) Relationship Between Intermittent Hypoxia and Type 2 Diabetes in Sleep Apnea Syndrome. Int J Mol Sci 20(19): 4756. https://doi.org/10.3390/IJMS20194756
Kindlovits R, Pereira AMDS, Sousa AC, Viana JL, Teixeira VH (2022) Effects of Acute and Chronic Exercise in Hypoxia on Cardiovascular and Glycemic Parameters in Patients with Type 2 Diabetes: A Systematic Review. High Alt Med Biol 23: 301–312. https://doi.org/10.1089/HAM.2022.0029
Serebrovska TV, Portnychenko AG, Drevytska TI, Portnichenko VI, Xi L, Egorov E, Gavalko A V., Naskalova S, Chizhova V, Shatylo VB (2017) Intermittent hypoxia training in prediabetes patients: Beneficial effects on glucose homeostasis, hypoxia tolerance and gene expression. Exp Biol Med 242: 1542–1552. https://doi.org/10.1177/1535370217723578
Tian YM, Liu Y, Wang S, Dong Y, Su T, Ma HJ, Zhang Y (2016) Anti-diabetes effect of chronic intermittent hypobaric hypoxia through improving liver insulin resistance in diabetic rats. Life Sci 150: 1–7. https://doi.org/10.1016/J.LFS.2016.02.053
Cui F, Guan Y, Guo J, Tian YM, Hu HF, Zhang XJ, Zhang Y (2018) Chronic intermittent hypobaric hypoxia protects vascular endothelium by ameliorating autophagy in metabolic syndrome rats. Life Sci 205: 145–154. https://doi.org/10.1016/J.LFS.2018.05.008
Żebrowska A, Jastrzȩbski D, Sadowska-Krȩpa E, Sikora M, Di Giulio C (2019) Comparison of the Effectiveness of High-Intensity Interval Training in Hypoxia and Normoxia in Healthy Male Volunteers: A Pilot Study. Biomed Res Int 2019: 7315714. https://doi.org/10.1155/2019/7315714
De Mol P, Fokkert MJ, De Vries ST, De Koning EJP, Dikkeschei BD, Gans ROB, Tack CJ, Bilo HJG (2012) Metabolic effects of high altitude trekking in patients with type 2 diabetes. Diabetes Care 35: 2018–2020. https://doi.org/10.2337/DC12-0204
Schobersberger W, Schmid P, Lechleitner M, von Duvillard SP, Hörtnagl H, Gunga HC, Klingler A, Fries D, Kirsch K, Spiesberger R, Pokan R, Hofmann P, Hoppicher F, Riedmann G, Baumgartner H, Humpeler E (2003) Austrian Moderate Altitude Study 2000 (AMAS 2000). The effects of moderate altitude (1700 m) on cardiovascular and metabolic variables in patients with metabolic syndrome. Eur J Appl Physiol 88: 506–514. https://doi.org/10.1007/S00421-002-0736-8
Akat F, Fıçıcılar H, Durak A, Tuncay E, Dursun AD, Çelikkan FT, Sabuncuoğlu B, Turan B, Baştuğ M (2018) Intermittent hypoxia induces beneficial cardiovascular remodeling in left ventricular function of type 1 diabetic rat. Anatol J Cardiol 19: 259–266. https://doi.org/10.14744/ANATOLJCARDIOL.2018.00236
Güzel D, Dursun AD, Fıçıcılar H, Tekin D, Tanyeli A, Akat F, Çelikkan FT, Sabuncuoğlu B, Baştuğ M (2016) Effect of intermittent hypoxia on the cardiac HIF-1/VEGF pathway in experimental type 1 diabetes mellitus. Anatol J Cardiol 16: 76–83. https://doi.org/10.5152/AKD.2015.5925
Santos JL, Pérez-Bravo F, Carrasco E, Calvillán M, Albala C (2001) Low prevalence of type 2 diabetes despite a high average body mass index in the Aymara natives from Chile. Nutrition 17: 305–309. https://doi.org/10.1016/S0899-9007(00)00551-7
Peng W, Li K, Yan AF, Shi Z, Zhang J, Cheskin LJ, Hussain A, Wang Y (2022) Prevalence, Management, and Associated Factors of Obesity, Hypertension, and Diabetes in Tibetan Population Compared with China Overall. Int J Environ Res Public Health 19(14): 8787. https://doi.org/10.3390/IJERPH19148787
Rybnikova EA, Zenko MY, Barysheva VS, Vetrovoy O (2020) Acclimatization to Middle Attitude Hypoxia Masks the Symptoms of Experimental Posttraumatic Stress Disorder, but Does Not Affect Its Pathogenetic Mechanisms. Bull Exp Biol Med 168: 614–617. https://doi.org/10.1007/S10517-020-04763-3
Szlachcic A, Majka J, Strzalka M, Szmyd J, Pajdo R, Ptak-Belowska A, Kwiecien S, Brzozowski T (2013) Experimental healing of preexisting gastric ulcers induced by hormones controlling food intake ghrelin, orexin-A and nesfatin-1 is impaired under diabetic conditions. A key to understanding the diabetic gastropathy? J Physiol Pharmacol 64(5): 625–637.
Подвигина ТТ, Филаретова ЛП (2020) Чувствительность слизистой оболочки желудка к ульцерогенным факторам и активность гипоталамо-гипофизарно-адренокортикальной системы. Рос физиол журн им ИМ Сеченова 106(2): 176–188. [Podvigina TT, Filaretova LP (2020) Sensitivity of the gastric mucosa to ulcerogenic factors and the activity of the hypothalamo-pituitary-adrenocortical system in the development of streptozotocin-induced diabetes. Russ J Physiol 106(2): 176–188. (In Russ)].
Podvigina TT, Bagaeva TR, Bobryshev PY, Filaretova LP (2011) High sensitivity of gastric mucosa to ulcerogenic effect of indomethacin in rats with diabetes. Bull Exp Biol Med 152: 43–46. https://doi.org/10.1007/S10517-011-1449-Y
Takeuchi K, Hatazawa R, Korolkiewicz R, Tashima K (2006) Alterations in gastric mucosal homeostasis under diabetic conditions. In: Pathophysiological and biochemical analysis of life-style related or intractable diseases – Target validation for drug therapy. Nishino T, Takeuchi K (Eds). Research Signpost. Kerala. 49–77.
Konturek PC, Brzozowski T, Burnat, Szlachcic A, Koziel J, Kwiecien S, Konturek SJ, Harsch IA (2010) Gastric ulcer healing and stress-lesion preventive properties of pioglitazone are attenuated in diabetic rats. J Physiol Pharmacol 61(4): 429–436.
Morsy MA, Ashour OM, Fouad AA, Abdel-Gaber SA (2010) Gastroprotective effects of the insulin sensitizers rosiglitazone and metformin against indomethacin-induced gastric ulcers in Type 2 diabetic rats. Clin Exp Pharmacol Physiol 37: 173–177. https://doi.org/10.1111/J.1440-1681.2009.05250.X
AbdelAziz EY, Tadros MG, Menze ET (2021) The effect of metformin on indomethacin-induced gastric ulcer: Involvement of nitric oxide/Rho kinase pathway. Eur J Pharmacol 892: 173812. https://doi.org/10.1016/J.EJPHAR.2020.173812
Idris M, Smiley A, Patel S, Latifi R (2022) Risk Factors for Mortality in Emergently Admitted Patients with Acute Gastric Ulcer: An Analysis of 15,538 Patients in National Inpatient Sample, 2005–2014. Int J Environ Res Public Health 19(23): 16263. https://doi.org/10.3390/IJERPH192316263
Подвигина ТТ, Багаева ТР, Филаретова ЛП (2016) Гастропротективный эффект кортикотропин-рилизинг фактора в модели стрептозотоцин-индуцированного диабета у крыс. Рос физиол журн им ИМ Сеченова 102(11): 1352–1362. [Podvigina TT, Bagaeva TR, Filaretova LP (2016) Gastroprotective effect of corticotropin-releasing factor in a model of streptozotocin-induced diabetes in rats. Russ J Physiol 102(11): 1352–1362. (In Russ)].
Подвигина ТТ, Багаева ТР, Морозова ОЮ, Филаретова ЛП (2011) Чувствительность слизистой оболочки желудка к ульцерогенному действию индометацина в разные сроки развития стрептозотоцин-индуцированного диабета у крыс. Рос физиол журн им ИМ Сеченова 97 (9): 957–967. [Podvigina TT, Bagaeva TR, Morozova OY, Filaretova LP (2011) Sensitivity of the gastric mucosa to the ulcerogenic action of indomethacin at different stages of the development of streptozotocin-induced diabetes in rats. Russ J Physiol 97(9): 957–967. (In Russ)].
Yang M, Yang Z, Li Y, Su S, Li Z, Lu D (2022) Mechanism of Traditional Tibetan Medicine Grubthobrildkr Alleviated Gastric Ulcer Induced by Acute Systemic Hypoxia in Rats. Biomed Res Int 2022: 4803956. https://doi.org/10.1155/2022/4803956
Syam AF, Simadibrata M, Wanandi SI, Hernowo BS, Sadikin M, Rani AA (2011) Gastric ulcers induced by systemic hypoxia. Acta Med Indones 43(4): 243–248.
Takeuchi K, Ueshima K, Ohuchi T, Okabe S (1994) Induction of gastric lesions and hypoglycemic response by food deprivation in streptozotocin-diabetic rats. Dig Dis Sci 39: 626–634. https://doi.org/10.1007/BF02088352
Teixeira DF, Santos AM, Oliveira AMS, Nascimento Júnior JAC, Frank LA, Santana Souza MT De, Camargo EA, Serafini MR (2021) Pharmaceuticals agents for preventing NSAID-induced gastric ulcers: a patent review. Expert Rev Clin Pharmacol 14: 677–686. https://doi.org/10.1080/17512433.2021.1909475
Filaretova LP, Morozova OY, Yarushkina NI (2021) Peripheral corticotropin-releasing hormone may protect the gastric musosa against indometacin-induced injury through involvement of glucocorticoids. J Physiol Pharmacol 72: 1–10. https://doi.org/10.26402/JPP.2021.5.06
Солнушкин СД, Чихман ВН (2018) Компьютерная обработка биологических изображений. Биомед радиоэлектрон 2: 35–40. [Solnushkin SD, Chikhman VN (2018) Computer processing of biological images. Biomed Radioelectron 2: 35–40. (In Russ)].
Fournell A, Schwarte LA, Kindgen-Milles D, Müller E, Scheeren TWL (2003) Assessment of microvascular oxygen saturation in gastric mucosa in volunteers breathing continuous positive airway pressure. Crit Care Med 31: 1705–1710. https://doi.org/10.1097/01.CCM.0000063281.47070.53
Filaretova L, Tanaka A, Komoike Y, Takeuchi K (2002) Selective cyclooxygenase-2 inhibitor induces gastric mucosal damage in adrenalectomized rats. Inflammopharmacology 10(4-6): 413–422.
Suresh MV, Balijepalli S, Solanki S, Aktay S, Choudhary K, Shah YM, Raghavendran K (2023) Hypoxia-Inducible Factor 1α and Its Role in Lung Injury: Adaptive or Maladaptive. Inflammation 46: 491–508. https://doi.org/10.1007/S10753-022-01769-Z
Serebrovska TV, Portnychenko AG, Portnichenko VI, Xi L, Egorov E, Antoniuk-Shcheglova I, Naskalova S, Shatylo VB (2019) Effects of intermittent hypoxia training on leukocyte pyruvate dehydrogenase kinase 1 (PDK-1) mRNA expression and blood insulin level in prediabetes patients. Eur J Appl Physiol 119: 813–823. https://doi.org/10.1007/S00421-019-04072-2
Catrina SB, Zheng X (2021) Hypoxia and hypoxia-inducible factors in diabetes and its complications. Diabetologia 64: 709–716. https://doi.org/10.1007/S00125-021-05380-Z
Hashimoto H, Akimoto M, Maeda A, Shigemoto M, Yamashito K (2004) Relation of hypoxia-inducible factor-1alpha to vascular endothelial growth factor and vasoactive factors during healing of gastric ulcers. J Cardiovasc Pharmacol 44 Suppl 1: S407–S409. https://doi.org/10.1097/01.FJC.0000166305.79055.AD
Tarnawski AS, Ahluwalia A (2021) The Critical Role of Growth Factors in Gastric Ulcer Healing: The Cellular and Molecular Mechanisms and Potential Clinical Implications. Cells 10(8): 1964. https://doi.org/10.3390/CELLS10081964
Russell J, Ward J, Becci M, Mir GN (1987) Spontaneous gastric ulceration in streptozotocin (STZ)-diabetic rats. Gastroenterology 92: 1605.
Vador N, Jagtap AG, Damle A (2012) Vulnerability of Gastric Mucosa in Diabetic Rats, Its Pathogenesis and Amelioration by Cuminum cyminum. Indian J Pharm Sci 74: 387–396. https://doi.org/10.4103/0250-474X.108413
Igarashi S, Kume E, Narita H, Kinoshita M (2000) Food deprivation depletes gastric mucus glycoprotein in streptozotocin-induced diabetic rats. Jpn J Pharmacol 84: 51–55. https://doi.org/10.1254/JJP.84.51
Korolkiewicz R, Tashima K, Kubomi M, Kato S, Takeuchi K (1999) Increased susceptibility of diabetic rat gastric mucosa to food deprivation during cold stress. Digestion 60: 528–537. https://doi.org/10.1159/000007702
Tashima K, Fujita A, Takeuchi K (2000) Aggravation of ischemia/reperfusion-induced gastric lesions in streptozotocin-diabetic rats. Life Sci 67: 1707–1718. https://doi.org/10.1016/S0024-3205(00)00754-2
Takeuchi K, Takehara K, Tajima K, Kato S, Hirata T (1997) Impaired healing of gastric lesions in streptozotocin-induced diabetic rats: effect of basic fibroblast growth factor. J Pharmacol Exp Ther 281(1): 200–207.
Tashima K, Korolkiewicz R, Kubomi M, Takeuchi K (1998) Increased susceptibility of gastric mucosa to ulcerogenic stimulation in diabetic rats–role of capsaicin-sensitive sensory neurons. Br J Pharmacol 124: 1395–1402. https://doi.org/10.1038/SJ.BJP.0701974
Holzer P, Livingston EH, Guth PH (1991) Sensory neurons signal for an increase in rat gastric mucosal blood flow in the face of pending acid injury. Gastroenterology 101: 416–423. https://doi.org/10.1016/0016-5085(91)90020-L
Комкова ОЮ, Подвигина ТТ, Филаретова ЛП (2017) Трансформация гастропротективного эффекта стресса в проульцерогенные последствия: разработка экспериментальных моделей. Рос физиол журн им ИМ Сеченова 103(2): 182–192. [Komkova OYu, Podvigina TT, Filaretova LP (2017) Transformation of the gastroprotective effect of stress into proulcerogenic consequences: development of experimental models. Russ J Physiol 103(2): 182–192. (In Russ)].
Filaretova L (2017) Gastroprotective Effect of Stress Preconditioning: Involvement of Glucocorticoids. Curr Pharm Des 23: 3923–3927. https://doi.org/10.2174/1381612823666170215145125
Filaretova LP, Bagaeva TR, Amagase K, Takeuchi K (2008) Contribution of glucocorticoids to protective influence of preconditioning mild stress against stress-induced gastric erosions. Ann NY Acad Sci 1148: 209–212. https://doi.org/10.1196/annals.1410.005
Деркач КВ, Бондарева ВМ, Шпаков АО (2017) Совместное интраназальное введение инсулина и С-пептида проинсулина крысам с сахарным диабетом 1-го и 2-го типа восстанавливает у них метаболические показатели. Успехи геронтол 30(6): 851–858. [Derkach KV, Bondareva VM, Shpakov AO (2017) Co-administration of intranasally delivered insulin and proinsulin C-peptide to rats with the types 1 and 2 diabetes mellitus restores their metabolic parameters. Adv Gerontol 30(6): 851–858. (In Russ)].
Zelena D, Filaretova L, Mergl Z, Barna I, Tóth ZE, Makara GB (2006) Hypothalamic paraventricular nucleus, but not vasopressin, participates in chronic hyperactivity of the HPA axis in diabetic rats. Am J Physiol - Endocrinol Metab 290: 243–250. https://doi.org/10.1152/AJPENDO.00118.2005
Yuan H, Liu J, Gu Y, Ji X, Nan G (2022) Intermittent hypoxia conditioning as a potential prevention and treatment strategy for ischemic stroke: Current evidence and future directions. Front Neurosci 16: 1067411. https://doi.org/10.3389/FNINS.2022.1067411
Rybnikova EA, Nalivaeva NN, Zenko MY, Baranova KA (2022) Intermittent Hypoxic Training as an Effective Tool for Increasing the Adaptive Potential, Endurance and Working Capacity of the Brain. Front Neurosci 16: 941740. https://doi.org/10.3389/FNINS.2022.941740
Yarushkina NI, Komkova OP, Filaretova LP (2020) Influence of forced treadmill and voluntary wheel running on the sensitivity of gastric mucosa to ulcerogenic stimuli in male rats. J Physiol Pharmacol 71: 1–13. https://doi.org/10.26402/JPP.2020.6.04
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


