Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 10, стр. 1443-1456
Реактивность ЭЭГ во время слухового восприятия слов у детей дошкольного и младшего школьного возраста
М. А. Начарова 1, *, Д. В. Начаров 2, В. Б. Павленко 1
1 Крымский федеральный университет им. В.И. Вернадского
Симферополь, Россия
2 Севастопольский государственный университет
Севастополь, Россия
* E-mail: alikina93@gmail.com
Поступила в редакцию 18.06.2023
После доработки 08.09.2023
Принята к публикации 08.09.2023
- EDN: TDFUBW
- DOI: 10.31857/S0869813923100072
Аннотация
Проведен анализ связанных с событиями изменений спектра электроэнцефалограммы (ЭЭГ) во время слухового восприятия слов-существительных у 83 типично развивающихся детей в возрасте от 4 до 10 лет, в том числе 50 детей дошкольного возраста и 33 детей младшего школьного возраста. Выявлены межгрупповые различия – у детей дошкольного возраста в обработку слов в большей степени вовлечены нейронные системы, активность которых отражается в обширной десинхронизации альфа- и синхронизации тета-активности в лобных зонах левого полушария. Для реактивности ЭЭГ детей младшего школьного возраста свойственна двусторонняя и более выраженная тета-синхронизация, что указывает на повышенную интенсивность лексико-семантических операций, а также на снижение фоновой и рост вызванной тета-активности. У детей данной группы также наблюдалась синхронизация ЭЭГ в бета-диапазоне, представленная отдельными вспышками и наиболее выраженная в лобных отведениях, что характерно для более зрелых механизмов обработки речи. Результаты исследования важны для уточнения механизмов понимания речи у типично развивающихся детей дошкольного и младшего школьного возраста.
ВВЕДЕНИЕ
Распознавание отдельных слов и ассоциирование их с конкретными объектами – это процесс, который возникает, как это экспериментально подтверждено, уже у полугодовалых младенцев [1] и активно развивается у детей раннего возраста [2]. Данный процесс лежит в основе формирования словарного запаса и адекватного речевого развития в целом [3, 4]. Исследования показывают, что развитие языковых способностей и созревание нейронных структур, лежащих в их основе, продолжается по меньшей мере до возраста 12 лет [5]. Нейрофизиологические механизмы становления рецептивной речи у детей активно изучаются с применением целого ряда методов, в том числе электроэнцефалографии. Было установлено, что процесс восприятия слов отражается в динамике мощности тета-, альфа- и бета-ритмов ЭЭГ, а также характеристиках компонентов связанных с событиями потенциалов (ССП), в частности N400 и P600 [5–7].
Одним из способов исследования процесса понимания слов является частотно-временной анализ ЭЭГ, в частности анализ связанных с событиями спектральных пертурбаций (СССП). Используя этот метод, можно определить изменения мощности ЭЭГ в различных частотных диапазонах во время выполнения языкового задания. Предполагается, что увеличение мощности в определенной частотной полосе связано с активацией дополнительных нейронных ансамблей, возбуждающихся на той же частоте [8]. Анализ СССП дает возможность оценить изменения классических ритмов ЭЭГ, функциональное значение которых достаточно хорошо изучено. Дополнительно отмечают, что этот метод позволяет обнаружить изменения в ЭЭГ, которые не выявляются при традиционном анализе ССП. Это преимущество подчеркнуто исследованием с участием детей школьного возраста [9], которое выявило при восприятии правильных и содержащих семантические ошибки предложений различия в реактивности тета-ритма, но не в параметрах ССП.
У детей и взрослых наиболее убедительно установлена связь процесса обработки слов с синхронизацией тета-ритма [5, 10–12]. Предполагается, что рост тета-активности с латентным периодом 150–200 мс от начала стимула связан с лексико-семантическими операциями поиска и извлечения слов из памяти при восприятии речевых сообщений [7]. Чем сложнее процесс этого поиска, тем больше растет мощность тета-ритма. Этим объясняют тот факт, что увеличение мощности указанного ритма больше при обработке псевдослов, чем реальных слов [13].
Несмотря на схожесть динамики тета-ритма при восприятии слов у детей и взрослых, появляется все больше свидетельств того, что амплитуда и топография тета-синхронизации меняются с возрастом [9]. Например, дети 10 лет во время чтения слов демонстрируют более выраженное по сравнению со взрослыми увеличение тета-активности в правом полушарии [14], а в 12-летнем возрасте правополушарная синхронизация тета-активности значительно уменьшается [7].
Наряду с синхронизацией тета-активности наблюдается десинхронизация альфа-ритма ЭЭГ, которая может отражать как активацию процессов внимания [15], так и специфически связанные с восприятием речи процессы [16]. Так, было показано, что восприятие речевых сигналов вызывает более значимую десинхронизацию альфа-ритма в центральных областях коры по сравнению с восприятием неречевых стимулов [17]. В то же время некоторыми исследователями был обнаружен рост мощности мю- и альфа-ритма в центральных, теменных и затылочных регионах в процессе восприятия предложений у детей 2–3 [18] и 10–12 лет [5]. Данный феномен связывают с активацией процессов рабочей памяти при восприятии целостного речевого сообщения.
Также отмечается увеличение мощности бета-ритма в обширных областях неокортекса, которое, как предполагают [10, 11, 19, 20], отражает поддержание активного состояния нейронных сетей, участвующих в процессах восприятия речи. В отдельных исследованиях [16] выявлен как рост мощности бета-ритма в височных и теменных областях, так и ее снижение над моторными областями неокортекса. Указанное снижение связывают с процессами активации моторного репертуара речи.
В то время как реактивность ЭЭГ во время восприятия речи у взрослых относительно хорошо изучена [10–12, 16], исследования с участием детей по-прежнему немногочисленны. Кроме этого, в большинстве работ изучается процесс чтения слов и предложений у детей школьного возраста [7, 21]. Такое исследование невозможно провести у детей более раннего возраста в связи с отсутствием у них навыка чтения. Однако выявление изменений в становлении процесса восприятия речи у детей дошкольного возраста является актуальным в связи с ростом числа детей с речевыми нарушениями [22].
Целью настоящего исследовании является анализ СССП во время слухового восприятия слов у типично развивающихся детей 4–10 лет, а также выявление возможных различий реакций ЭЭГ у детей дошкольного и младшего школьного возрастов. В качестве экспериментальной ситуации выбрано пассивное прослушивание слов, которое может выполняться детьми с нарушениями речи, испытывающими трудности в выполнении сложной инструкции.
Основываясь на результатах работ других авторов, можно предположить, что, как и у более старших детей и взрослых, восприятие слов участниками исследования 4–10 лет отражается в росте мощности тета-активности, а также преобладании десинхронизации альфа-ритма. Однако поскольку дети 7–10 лет, уже посещающие школу, могут использовать иные, более зрелые стратегии для успешной обработки речевых сигналов, чем дошкольники 4–6 лет, паттерны СССП этих возрастных групп будут существенно отличаться.
МЕТОДЫ ИССЛЕДОВАНИЯ
Характеристика выборки. В исследовании приняли участие 83 типично развивающихся ребенка (55 мальчиков и 28 девочек), представленных двумя группами – 50 детей дошкольного возраста (4–6 лет, средний возраст 5.2 ± 1.2 года, 31 мальчик и 19 девочек) и 33 – младшего школьного возраста (7–10 лет, средний возраст 8.6 ± 1.9 года, 24 мальчика и 9 девочек). Все дети были правшами, имели нормальные или приближающиеся к нормальным показатели зрения и слуха. В указанные группы не были включены дети с массой тела при рождении менее 2.5 кг, с наличием генетических заболеваний, а также те дети, в ЭЭГ которых во время клинических обследований были выявлены эпизоды эпилептиформной активности. Дети дали устное, а их родители – письменное согласие на участие в эксперименте, с процедурой которого они были заранее ознакомлены.
Регистрацию ЭЭГ проводили с помощью электроэнцефалографа Нейрон-Спектр-3 (“Нейрософт” , Россия) монополярно в соответствии с международной системой 10–20 в лобных (Fp1, Fp2, Fz, F3, F4, F7, F8), центральных (Cz, C3, C4), височных (T3, T4, T5, T6), теменных (Pz, P3, P4) и затылочных (O1, O2) отведениях. В качестве референтного использовался объединенный ушной электрод. Сопротивление электродов не превышало 5 кОм. Частота дискретизации составляла 500 Гц.
Испытуемых просили сидеть спокойно, глядя перед собой, и внимательно слушать аудиозапись речи. При этом использовали акустические колонки, находящиеся на расстоянии около двух метров от ребенка. Громкость звука в этой области в среднем составляла 85 дБ. В качестве стимулов были подобраны 30 часто употребляемых конкретных слов-существительных, знакомых детям четырех лет (мяч, яблоко, карандаш и т.п.). Средняя продолжительность слов составляла 296 ± 84 мс, а межстимульный интервал – 4500–5500 мс. Перед началом регистрации ЭЭГ несколько слов воспроизводили в тестовом режиме с целью дать возможность ребенку освоиться с таким способом предъявления речевых сигналов и убедиться, что он не повторяет слов вслух.
Анализ ЭЭГ-данных проводили с помощью программы EEGLAB (http://www.sccn.ucsd.edu/eeglab/). Записи ЭЭГ были отфильтрованы в диапазоне от 1 до 50 Гц, артефакты удалялись с помощью метода анализа независимых компонент. Непрерывную запись ЭЭГ разбивали на эпохи длительностью 4000 мс, соответствующие моментам предъявления стимулов. Предстимульный (фоновый) интервал имел длительность 1000 мс, постстимульным интервалом являлся отрезок времени длительностью 3000 мс от момента начала предъявления слова. СССП ЭЭГ выявляли с помощью частотно-временного анализа на основе вейвлета Морле. Показатели СССП рассчитывали как логарифм отношения мощностей ритмических диапазонов постстимульной и предстимульной ЭЭГ. Отрицательные значения СССП соответствуют десинхронизации ЭЭГ и отмечены на графиках синим цветом, положительные значения – синхронизации, отмечены на графиках красным цветом. Частотное разрешение составило 0.6 Гц. Временно́е разрешение составило 14.7 мс и рассчитывалось как отношение длительности анализируемого интервала (3000 мс с учетом исключения краевых эффектов) и количества отсчетов (200 отсчетов). В качестве тета-, альфа- и бета-активности у детей дошкольного возраста рассматривали активность в частотных диапазонах 3–7, 7–12, 13–25 Гц, а у школьников – 3–8, 8–13, 13–30 Гц [23].
Статистическую обработку данных проводили с использованием пакета прикладных программ MATLAB и набора инструментов EEGLAB.
Для оценки значимости связанных с прослушиванием слов реакций ЭЭГ в общей выборке детей дошкольного и младшего школьного возраста и внутри каждой из групп использовали многофакторный дисперсионный анализ с повторными измерениями (repeated measures ANOVA) с факторами СИТУАЦИЯ (два уровня – до и после предъявления слов), ЛОКУС (19 отведений ЭЭГ), ЧАСТОТА (52 значения от 1 до 30 Гц). Анализ выполнялся для каждого из 170 временных отсчетов постстимульной ЭЭГ, в качестве данных предстимульной ЭЭГ использовалось усредненное значение данных 30 отсчетов предстимульной ЭЭГ. Для дальнейшего анализа использовали только те временные интервалы, в которых общий эффект взаимодействия всех трех факторов достигал уровня статистической значимости (p < 0.05 с учетом поправки Хьюнха–Фельдта). Для попарных сравнений СССП до и после стимула использовали апостериорные t-тесты (p < 0.01).
Одним из достоинств программы EEGLAB является возможность межгруппового сравнения СССП с помощью пермутационной статистики (статистики перестановок). Пермутационная статистика рекомендована для анализа больших наборов данных, таких как результаты частотно-временного анализа ЭЭГ, поскольку может использоваться вне зависимости от соответствия распределения данных тому или иному закону, относительно надежна при анализе экспериментов с участием небольшого количества испытуемых, не требует применения дополнительных поправок [24]. Пермутационная статистика была применена нами при оценке различий СССП в группах детей дошкольного и младшего школьного возраста. Для каждого канала и точки частотно-временной области на основе метода перестановок генерировалась искусственная выборка, сформированная в результате случайных перестановок данных исходной выборки (дети дошкольного и младшего школьного возрастов), рассчитывалась t-статистика для полученной выборки. Путем повторения данной операции 2000 раз формировалось нулевое распределение, состоящее из 2000 статистик искусственно сгенерированных выборок. Далее статистики исходных выборок сравнивались с полученным нулевым распределением. Значимыми считались различия при p < 0.01 – в этом случае статистики исходной выборки входили в 0.5% наибольших или 0.5% наименьших значений нулевого распределения [25]. В противном случае принималась нулевая гипотеза, делался вывод об отсутствии различий данных в группах детей разных возрастов в определенном отведении и точке частотно-временной области. Дополнительная коррекция на множественные измерения не проводилась, однако интерпретировались частотно-временные кластеры, содержащие не менее 50 пикселей. Преимущества проведения расчетов для каждой точки частотно-временной области заключается в учете возможного различия в распределении параметров ЭЭГ на разных частотах и в разные временные промежутки.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ связанных с событием спектральных пертурбаций общей выборки детей 4–10 лет. Анализ СССП у всех 83 типично развивающихся детей дошкольного и младшего школьного возраста позволил оценить общий паттерн реактивности ЭЭГ при восприятии ими слов-существительных. Было выявлено увеличение мощности ЭЭГ по сравнению с фоновым уровнем в диапазоне тета-активности во временном интервале 200–800 мс после начала стимула в лобных, центральных и височных отведениях, наиболее выраженное в отведениях Fp1, F7, F8 (рис. 1). Наблюдалась десинхронизация активности в альфа- и бета-диапазонах, наиболее выраженная в лобных и центральных зонах.
Рис. 1.
Связанные с прослушиванием слов спектральные пертурбации в 19 отведениях ЭЭГ у 83 типично развивающихся детей в возрасте 4–10 лет. Каждый фрагмент рисунка соответствует временному промежутку от –500 до 2500 мс от начала стимула (момент 0) и диапазону частот от 3 до 28 Гц. Замкнутыми белыми линиями выделены участки графика со статистически значимыми снижением, черными – повышением мощности ЭЭГ относительно предстимульного интервала. Шкала в правой части рисунка отражает логарифм отношения мощностей постстимульной и предстимульной ЭЭГ в дБ.
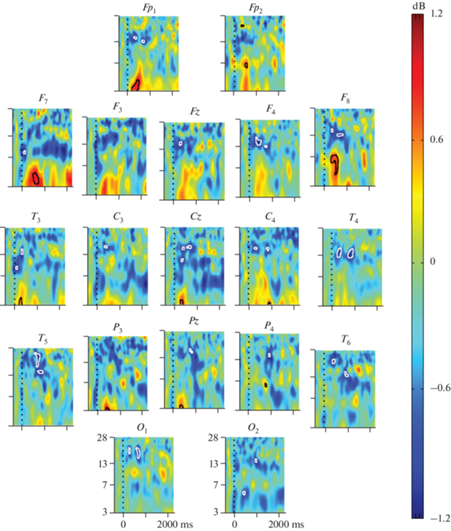
Дисперсионный анализ с повторными измерениями в группе детей 4–10 лет выявил значимое влияние взаимодействия факторов СИТУАЦИЯ, ЛОКУС и ЧАСТОТА для временных промежутков 0–103, 308–1102 мс.
Результаты апостериорного анализа в группах детей 4–10 и 4–6 лет представлены в табл. 1.
Таблица 1.
Отведения ЭЭГ и временные интервалы (мс), в которых выявлены статистически значимые, связанные с прослушиванием слов спектральные пертурбации
| Реактивность ЭЭГ | Отведения | Реактивность в группе 4–10 лет, мс | Реактивность в группе 4–6 лет, мс |
|---|---|---|---|
| Синхронизация тета-активности | Fp1 | 308–704 | |
| Fp2 | 601–675 | ||
| F7 | 702–938 | ||
| F8 | 366–703 | ||
| Cz | 335–496 | ||
| C4 | 1070–1102 | ||
| Pz | 350–584 | ||
| P3 | 454–660 | ||
| P4 | 894–909 | ||
| T3 | 308–367 | ||
| Десинхронизация тета-активности | С3 | 0–45 | |
| O2 | 513–615 | ||
| Десинхронизация альфа-активности | Fp1 | 1690–1764 | |
| F7 | 28–103 | 1617–1764 | |
| F8 | 630–923 | ||
| Cz | 352–441 | 1617–1764 | |
| T3 | 0–103 | ||
| T6 | 1617–1690 | ||
| Синхронизация бета-активности | Fp2 | 439–542 | |
| Десинхронизация бета-активности | Fp1 | 308–396, 733–880 | |
| Fz | 365–511 | 1617–1764 | |
| F4 | 337–645, 850–908 | ||
| F8 | 320–438, 657–949 | ||
| Cz | 394–525, 657–876 | ||
| C3 | 469–557 | ||
| C4 | 410–527, 1026–1102 | ||
| Pz | 803–1102 | ||
| P4 | 1022–1102 | ||
| T3 | 337–366 | ||
| Т4 | 308–527, 803–1102 | ||
| T5 | 770–1022 | ||
| T6 | 441–588, 1020–1102 | ||
| O1 | 337–469, 733–952 | ||
| O2 | 1099–1102 |
Анализ связанных с событием спектральных пертурбаций в группе детей дошкольного возраста. Анализ СССП в группе типично развивающихся детей 4–6 лет показал увеличение мощности ЭЭГ в диапазоне тета-активности, наиболее выраженное в отведениях Fp1, F7, F8 (рис. 2a). Наблюдалась десинхронизация активности в альфа- и бета-диапазонах, наиболее выраженная в лобных и центральных зонах.
Рис. 2.
Связанные с прослушиванием слов спектральные пертурбации в 19 отведениях ЭЭГ у 53 типично развивающихся детей в возрасте 4–6 лет (а), 30 типично развивающихся детей в возрасте 7–10 лет (b), межгрупповые различия, p < 0.01 (c). Каждый фрагмент рисунка соответствует временному промежутку от –500 до 2500 мс от начала стимула (момент 0) и диапазону частот от 3 до 28 Гц. Шкала отражает логарифм отношения мощностей постстимульной и предстимульной ЭЭГ в дБ. Межгрупповые различия при p < 0.01 выделены темным цветом.
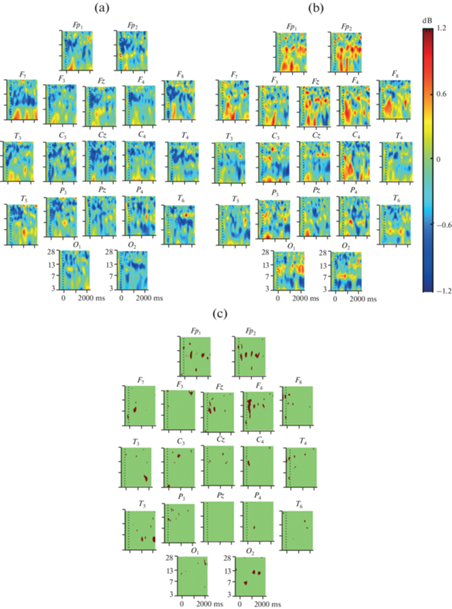
Дисперсионный анализ с повторными измерениями в группе детей 4–6 лет выявил значимое влияние взаимодействия факторов СИТУАЦИЯ, ЛОКУС и ЧАСТОТА для временного промежутка 1617–1764 мс.
Несмотря на выраженную синхронизацию тета-активности в лобных и височных локусах левого полушария, применение поправки Хьюнха–Фельдта показало, что различия с предстимульной активностью не достигли уровня статистической значимости. Зарегистрирована достигающая уровня статистической значимости десинхронизация альфа- и бета-активности (табл. 1).
Анализ связанных с событием спектральных пертурбаций в группе детей младшего школьного возраста. Во время прослушивания слов в группе детей младшего школьного возраста зарегистрирована синхронизация ЭЭГ в тета-диапазоне в лобных, центральных, теменных и височных отведениях; синхронизация альфа- и бета-активности (рис. 2b).
Дисперсионный анализ с повторными измерениями в группе детей 7–10 лет не выявил значимое влияние взаимодействия факторов СИТУАЦИЯ, ЛОКУС и ЧА-СТОТА, что может быть связно с относительно небольшим объемом выборки и коррекцией уровня значимости с применением поправки Хьюнха–Фельдта.
Сравнение связанных с событием спектральных пертурбаций ЭЭГ в группах детей дошкольного и младшего школьного возраста. Во время восприятия слов в группах детей дошкольного и младшего школьного возраста выявлены значимые различия между реактивностью ЭЭГ в тета-, альфа- и бета-диапазонах (рис. 2).
В группе детей школьного возраста в отведении F4 регистрируется более выраженная синхронизация тета-активности через 108–380 мс по сравнению с показателями в группе детей дошкольного возраста (p < 0.01). Аналогичные изменения зарегистрированы в отведениях Fp1 во временном интервале 1055–1200 мс и в Fp2 через 1130–1218 мс после начала стимула. В отведении С3 через 10–250 мс и P4 через 610–740 мс наблюдается синхронизация тета-активности, тогда как у детей дошкольного возраста – десинхронизация. В отведении Т3 на промежутке 1850–2050 мс и в локусе Т5 через 1150–1300 и 2200–2500 мс регистрируется десинхронизация тета-активности, сменяющая предшествующую синхронизацию, тогда как у детей дошкольного возраста продолжается синхронизация тета-активности.
В группах детей дошкольного и младшего школьного возраста выявлены значимые различия в реактивности альфа-ритма во время восприятия слов в отведениях Fp1, Fp2, Fz, F4, F7, F8, T5, C4, P3, O2. У детей дошкольного возраста наблюдалась десинхронизация альфа-активности, тогда как у детей школьного возраста – синхронизация.
Значимые различия в реактивности бета-ритма выявлены в отведениях Fp1, Fp2, Fz, F3, F4, F7, F8, T3, Т4, T5, T6, Cz, C3, C4, P3, O1, O2. У детей дошкольного возраста наблюдалась десинхронизация бета-активности, тогда как у детей школьного возраста – синхронизация.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты настоящего исследования подтвердили данные о более широкой пространственной представленности процессов синхронизации ЭЭГ в тета-диапазоне во время восприятия слов у детей по сравнению со взрослыми [5, 7]. Так, значимый рост мощности тета-активности у детей 4–10 лет наблюдается не только в лобных и теменных отведениях левого полушария, но и в височных и центральных зонах обоих полушарий (рис. 1). Аналогичные особенности динамики ЭЭГ в тета-диапазоне, в частности менее локализованная тета-синхронизация, представленная как в левом, так и в правом полушариях, обнаружены во время обработки речи у детей в ряде других исследований [7, 26–28].
При разделении детей 4–10 лет на группы дошкольного (4–6 лет) и младшего школьного возраста (7–10 лет), как и предполагалось, были выявлены различия в паттернах ЭЭГ во время слухового восприятия слов (рис. 2). У детей дошкольного возраста наиболее выраженная тета-синхронизация происходила в лобных и височных отведениях левого полушария (рис. 2а). У детей 7–10 лет тета-синхронизация была более выраженной и затрагивала не только зоны левого полушария, но и правосторонние области (рис. 2b).
Большее вовлечение правого полушария в процессы восприятия речи в группе школьников по сравнению с детьми дошкольного возраст оказалось неожиданным результатом. Действительно, хотя в исследованиях динамики ЭЭГ в процессе восприятия слов у детей 8–12 лет и подчеркивается роль правого полушария [7], авторы указывают на значительное снижение правосторонней синхронизации тета-активности у более старших из обследованных детей. Следует отметить, что в указанной работе, как и в большинстве исследований, применявших анализ СССП при восприятии речи, дети школьного возраста читали слова, тогда как в нашем исследовании исследовалось слуховое восприятие слов. Несмотря на то, что нейронные сети чтения и слухового восприятия речи частично перекрываются, прослушивание слов требует дополнительного анализа просодических компонентов речи, обработка которых в большей степени происходит в правом полушарии [29–31].
В целом, большую выраженность СССП в тета-диапазоне у детей школьного возраста, по сравнению с дошкольниками, можно объяснить следующим образом. Поскольку увеличение мощности тета-ритма при восприятии речи связывают, как уже отмечалось, с лексико-семантическими операциями поиска и извлечения слов из памяти [7], рост тета-активности может указывать на большую интенсивность указанных операций у старших детей. Кроме того, различия в выраженности СССП в тета-диапазоне у детей дошкольного и младшего школьного возраста могут быть следствием разного уровня предстимульной (фоновой) тета-активности. В ряде исследований [13, 32] фоновую активность в тета-диапазоне рассматривают как “тоническую”, а ее изменения, связанные с обработкой стимула, как “фазическую” активность. Чем ниже тоническая тета-активность, тем выше готовность к восприятию информации, успешнее выполнение когнитивных операций. Амплитуда тонической тета-активности снижается у детей по мере взросления, отражая процесс созревания головного мозга [33, 34]. Таким образом, большая реактивность у детей школьного возраста в тета-диапазоне, отражающая фазическую активность, может быть обусловлена более низким уровнем предстимульной тонической тета-активности у детей этой группы.
В нашем исследовании особенностью реактивности ЭЭГ у детей 4–6 лет явилась хорошо выраженная десинхронизация в альфа-диапазоне, наблюдающаяся практически во всех отведениях. Поскольку десинхронизация альфа-ритма отражает активацию соответствующих зон неокортекса [15], в том числе обеспечивающих процессы как произвольного, так и непроизвольного внимания, можно предположить, что детям этой группы при восприятии речи требуется привлекать больший, чем младшим школьникам, объем соответствующих мозговых ресурсов. Кроме этого, десинхронизация ЭЭГ в указанном частотном диапазоне, развивающаяся над двигательными областями коры, может быть связана с активацией у дошкольников моторных артикуляционных зон [35]. Поскольку по нашим наблюдениям при предварительном тестовом предъявлении сигналов именно дошкольники чаще стремились повторять слова вслух, они, вероятно, в большей степени опирались на механизмы внутреннего проговаривания слов, чем дети более старшего возраста.
У детей 7–10 лет десинхронизация альфа-активности носила менее выраженный характер и была не столь широко представлена в анализируемых отведениях. Мы предполагаем, что данная группа участников исследования, следуя инструкции внимательно слушать слова, в большей степени использовала ресурсы достаточно развитого в этом возрасте произвольного, чем непроизвольного внимания. Именно преобладание процессов произвольного внимания может приводить к более локальному вовлечению зон мозга в процесс обработки слов. Обращает на себя внимание и усиление мощности в альфа-диапазоне в лобных областях коры у младших школьников. Как показано у взрослых испытуемых [36], для выполнения задач, вовлекающих рабочую память, характерна синхронизация альфа-ритма в лобных зонах. Такую синхронизацию объясняют торможением ряда нейронных цепей, благодаря чему, в то время, когда выполняется непрерывная задача по извлечению информации из памяти, лобные области меньше вовлекаются в новые действия. Во время восприятия речевых сигналов поступающие звуки также запускают каскад операций извлечения из памяти, которые делают доступными фонологические, синтаксические и семантические свойства отдельных слов [11]. Таким образом, бо́льшая мощность ЭЭГ в альфа-диапазоне в лобных областях коры у детей 7–10 лет по сравнению с дошкольниками может указывать на формирование более зрелых, сходных с таковыми у взрослых, нейрофизиологических механизмов извлечения информации из памяти при восприятии речи.
Особо можно выделить десинхронизацию в альфа-диапазоне ЭЭГ, выявленную в центральных зонах неокортекса. Такая десинхронизация наблюдалась в отведениях Cz и С3 как в группе дошкольников, так и у младших школьников, причем, межгрупповых различий найдено не было. Десинхронизацию в указанных отведениях при восприятии речи рассматривают как реакцию разновидности альфа-ритма – мю-ритма, и ассоциируют с активацией моторных зон мозга, участвующих не только в процессах продукции речи, но и в ее понимании [35, 37–39]. Также вовлечение моторных зон в процесс восприятия слов-существительных может быть вызвано активацией моторного репертуара [16, 40], связанного с этими словами (мяч – пинать, бросать, ловить; карандаш – рисовать, держать, сжимать и т. д.).
Только в группе детей школьного возраста во время прослушивания слов наблюдалась синхронизация бета-ритма, представленная отдельными вспышками и наиболее выраженная в лобных отведениях (рис. 2b). Вспышки бета-ритма, длящиеся всего несколько сотен миллисекунд, выявлены у взрослых при выполнении задач, требующих участия рабочей памяти [41]. Как считают, они отражают мгновенное обновление или реактивацию содержимого памятного следа. Вслед за другими авторами, сравнивавшими паттерны ЭЭГ при восприятии речи у детей и взрослых [5], мы также предполагаем, что по мере процесса взросления обработка речи у детей все в большей степени вовлекает мозговые механизмы, функционирование которых проявляется в реактивности бета-ритма.
ЗАКЛЮЧЕНИЕ
Анализ динамики ЭЭГ при восприятии слов у всей выборки детей дошкольного и младшего школьного возраста выявил увеличение мощности в диапазоне тета-активности во временном интервале 200–800 мс после начала стимула в лобных, центральных и височных отведениях обоих полушарий. Усиление тета-осцилляций сочеталось с двусторонней десинхронизацией активности в альфа- и бета-диапазонах, наиболее выраженной в лобных и центральных зонах.
У детей 4–6 лет процесс обработки слов отражается в охватывающей большинство отведений десинхронизации альфа-активности, более выраженной, чем у детей школьного возраста. Такие особенности паттерна реактивности ЭЭГ могут быть связаны с большим вовлечением ресурсов головного мозга для обеспечения требуемых процессов внимания, а также с активацией у дошкольников моторных артикуляционных зон.
Для реакций ЭЭГ детей 7–10 лет при восприятии слов свойственна более выраженная, чем у дошкольников, двусторонняя тета-синхронизация. Такие особенности реактивности ЭЭГ указывают на повышенную интенсивность лексико-семантических операций поиска и извлечения слов из памяти. Кроме того, у детей данной группы наблюдалась синхронизация бета-колебаний, представленная отдельными вспышками и наиболее выраженная в лобных отведениях. Таким образом, обработка речи у детей младшего школьного возраста частично вовлекает характерные для взрослых мозговые механизмы, функционирование которых проявляется в реактивности бета-осцилляций.
Список литературы
Tincoff R, Jusczyk PW (2012) Six-month-olds comprehend words that refer to parts of the body. Infancy 17(4): 432–444. https://doi.org/10.1111/j.1532-7078.2011.00084.x
Valleau MJ, Konishi H, Golinkoff RM, Hirsh-Pasek K, Arunachalam S (2018) An eye-tracking study of receptive verb knowledge in toddlers. J Speech Lang Hear Res 61(12): 2917–2933. https://doi.org/10.1044/2018_JSLHR-L-17-0363
Fernald A, Marchman VA (2012) Individual differences in lexical processing at 18 months predict vocabulary growth in typically developing and late-talking toddlers. Child Dev 83: 203–222. https://doi.org/10.1111/j.1467-8624.2011.01692.x
Ference J, Curtin S (2015) The ability to map differentially stressed labels to objects predicts language development at 24 months in 12-month-olds at high risk for autism. Infancy 20: 242–262. https://doi.org/10.1111/infa.12074
Schneider JM, Abel AD, Ogiela DA, McCord C, Maguire MJ (2018) Developmental differences in the neural oscillations underlying auditory sentence processing in children and adults. Brain Lang 186: 17–25. https://doi.org/10.1016/j.bandl.2018.09.002
Panda EJ, Emami Z, Valiante TA, Pang EW (2021) EEG phase synchronization during semantic unification relates to individual differences in children’s vocabulary skill. Dev Sci 24(1): e12984. https://doi.org/10.1111/desc.12984
Maguire MJ, Schneider JM, Melamed TC, Ralph YK, Poudel S, Raval VM, Mikhail D, Abel AD (2022) Temporal and topographical changes in theta power between middle childhood and adolescence during sentence comprehension. Dev Cogn Neurosci 53: 101056. https://doi.org/10.1016/j.dcn.2021.101056
Nunez PL, Srinivasan R (2006) Electric fields of the brain: the neurophysics of EEG. Oxford Univer Press. New York.
Schneider J, Maguire M (2018) Developmental differences in the neural correlates supporting semantics and syntax during sentence processing. Dev Sci 22(4): e12782. https://doi.org/10.1111/desc.12782
Bastiaansen M, Hagoort P (2015) Frequency-based segregation of syntactic and semantic unification during online sentence level language comprehension. J Cogn Neurosci 27(11): 2095–2107. https://doi.org/10.1162/jocn_a_00829
Bastiaansen M, Van der Linden M, ter Keurs M, Dijkstra T, Hagoort P (2005) Theta responses are involved in lexico-semantic retrieval during language processing. J Cogn Neurosci 17: 530–541. https://doi.org/10.1162/0898929053279469
Lam NHI, Schoffelen JM, Uddén J, Hultén A, Hagoort P (2016) Neural activity during sentence processing as reflected in theta, alpha, beta, and gamma oscillations. NeuroImage 142: 43–54. https://doi.org/10.1016/j.neuroimage.2016.03.007
Klimesch W, Doppelmayr M, Wimmer H, Schwaiger J, Röhm D, Gruber W, Hutzler F (2001) Theta band power changes in normal and dyslexic children. Clin Neurophysiol 112(7): 1174–1185. https://doi.org/10.1016/S1388-2457(01)00545-4
Spironelli C, Angrilli A (2010) Developmental aspects of language lateralization in delta, theta, alpha and beta EEG bands. Biol Psychol 85(2): 258–267. https://doi.org/10.1016/j.biopsycho.2010.07.011
Wang L, Bastiaansen M (2014) Oscillatory brain dynamics associated with the automatic processing of emotion in words. Brain and Language 137: 120. https://doi.org/10.1016/j.bandl.2014.07.011
Saltuklaroglu T, Bowers A, Harkrider AW, Casenhiser D, Reilly KJ, Jenson DE, Thornton D (2018) EEG mu rhythms: rich sources of sensorimotor information in speech processing. Brain and Language 187: 141. https://doi.org/10.1016/j.bandl.2018.09.005
Thornton D, Harkrider AW, Jenson D, Saltuklaroglu T (2018) Sensorimotor activity measured via oscillations of EEG mu rhythms in speech and non-speech discrimination tasks with and without segmentation demands. Brain Lang 187: 62–73. https://doi.org/10.1016/j.bandl.2017.03.011
Belalov VV, Bazanova OM, Mikhailova AA, Dyagileva YuO, Pavlenko VB (2020) EEG mu rhythm reactivity during speech perception in children aged from two to three years: influence of rearing conditions. IP Pavlov J Higher Nervous Activity 70(2): 193–205. https://doi.org/10.31857/S0044467720020045
Lewis AG, Wang L, Bastiaansen M (2015) Fast oscillatory dynamics during language comprehension: Unification versus maintenance and prediction? Brain Lang 148: 51–63. https://doi.org/10.1016/j.bandl.2015.01.003
Lewis AG, Schoffelen JM, Schriefers H, Bastiaansen M (2016) A predictive coding perspective on beta oscillations during sentence-level language comprehension. Front Hum Neurosci 10: 85. https://doi.org/10.3389/fnhum.2016.00085
Schneider JM, Abel AD, Momsen J, Melamed TC, Maguire MJ (2021) Neural oscillations reveal differences in the process of word learning among school-aged children from lower socioeconomic status backgrounds. Neurobiol Lang (Camb) 2(3): 372. https://doi.org/10.1162/nol_a_00040
Степаненко ДГ, Сагутдинова ЭШ (2010) О классификациях нарушения речи в детском возрасте. Клин мед 2: 32–43. [Stepanenko DG, Sagutdinova ESh (2010) About speech/ language disorders classifications in childhood. Klin Med 2: 32–43. (In Russ)].
Jiang Z, Waters AC, Liu Y, Li W, Yang Y (2017) Event-related theta oscillatory substrates for facilitation and interference effects of negative emotion on children’s cognition. Int J Psychophysiol 116: 26. https://doi.org/10.1016/j.ijpsycho.2017.02.012
Craig AR, Fisher WW (2019) Randomization tests as alternative analysis methods for behavior-analytic data. J Exp Anal Behav 111(2): 309–328. https://doi.org/10.1002/jeab.500
Maris E, Oostenveld R (2007) Nonparametric statistical testing of EEG- and MEG-data. J Neurosci Methods 164(1): 177–190. https://doi.org/10.1016/j.jneumeth.2007.03.024
Brauer J, Friederici AD (2007) Functional neural networks of semantic and syntactic processes in the developing brain. J Cogn Neurosci 19(10): 1609–1623. https://doi.org/10.1162/jocn.2007.19.10.1609
Friederici AD, Brauer J, Lohmann G (2011) Maturation of the language network: from inter-to intrahemispheric connectivities. PLoS One 6(6): e20726. https://doi.org/10.1371/journal.pone.0020726
Holland SK, Vannest J, Mecoli M, Jacola LM, Tillema JM, Karunanayaka P, Schmithorst VJ, Yuan W, Plante E, Byars AW (2007) Functional MRI of language lateralization during development in children. Int J Audiol 46(9): 533–551. https://doi.org/10.1080/14992020701448994
Walenski M, Europa E, Caplan D, Thompson CK (2019) Neural networks for sentence comprehension and production: An ALE-based meta-analysis of neuroimaging studies. Human Brain Mapping 40(8): 2275. https://doi.org/10.1002/hbm.24523
Stroganova TA, Komarov KS, Goiaeva DE, Obukhova TS, Ovsiannikova TM, Prokofyev AO, Orekhova EV (2021) The effect of periodicity and “vowelness” of a sound on cortical auditory responses in children. IP Pavlov J Higher Nervous Activity 71(4): 563–577. https://doi.org/10.1007/s11055-022-01253-z
Stankova EP, Guillemard DM, Galperina EI (2020) Morpho-functional basis of complex sentence processing in adults and children. Human Physiol 46(3): 332–342. https://doi.org/10.1134/S0362119720030135
Klimesch W (1999) EEG alpha and theta oscillations reflect cognitive and memory performance: a review and analysis. Brain Res Brain Res Rev 29(2-3): 169–195. https://doi.org/10.1016/s0165-0173(98)00056-3
Cellier D, Riddle J, Petersen I, Hwang K (2021) The development of theta and alpha neural oscillations from ages 3 to 24 years. Dev Cogn Neurosci 50: 100969. https://doi.org/10.1016/j.dcn.2021.100969
Meng X, Sun C, Du B, Liu L, Zhang Y, Dong Q, Georgiou GK, Nan Y (2022) The development of brain rhythms at rest and its impact on vocabulary acquisition. Dev Sci 25(2): e13157. https://doi.org/10.1111/desc.13157
Oliveira DS, Saltuklaroglu T, Thornton D, Jenson D, Harkrider AW, Rafferty MB, Casenhiser DM (2021). Mu rhythm dynamics suggest automatic activation of motor and premotor brain regions during speech processing. J Neurolinguist 60: 101006. https://doi.org/10.1016/j.jneuroling.2021.101006
Sauseng P, Klimesch W, Doppelmayr M, Pecherstorfer T, Freunberger R, Hanslmayr S (2005) EEG alpha synchronization and functional coupling during top-down processing in a working memory task. Hum Brain Mapp 26(2): 148–155. https://doi.org/10.1002/hbm.20150
Smalle EH, Rogers J, Mottonen R (2015) Dissociating Contributions of the Motor Cortex to Speech Perception and Response Bias by Using Transcranial Magnetic Stimulation. Cereb Cortex 25(10): 3690–3698. https://doi.org/10.1093/cercor/bhu218
Liebenthal E, Möttönen R (2018) An interactive model of auditory-motor speech perception. Brain Lang 187: 33–40. https://doi.org/10.1016/j.bandl.2017.12.004
Knyazev GG (2022) Coding the meaning in brain activity. IP Pavlov J Higher Nervous Activity 72(6): 800–825. https://doi.org/10.31857/S004446772206003X
Arévalo AL, Baldo JV, Dronkers NF (2012) What do brain lesions tell the human mirror neuron system and us about theories of embodied semantics? Cortex 48(2): 242–254. https://doi.org/10.1016/j.cortex.2010.06.001
Spitzer B, Haegens S (2017) Beyond the Status Quo: A Role for Beta Oscillations in Endogenous Content (Re)Activation. eNeuro 4(4): ENEURO.0170–17.2017. https://doi.org/10.1523/ENEURO.0170-17.2017
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


