Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 12, стр. 1725-1741
Нейрогенная регуляция мозгового кровотока
Д. Д. Ваулина 1, *, Д. Ю. Бутко 2, А. А. Карпов 1, М. М. Галагудза 1, 3
1 Национальный медицинский исследовательский центр имени В.А. Алмазова
Министерства здравоохранения Российской Федерации
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный педиатрический медицинский университет
Министерства здравоохранения Российской Федерации
Санкт-Петербург, Россия
3 Институт аналитического приборостроения Российской академии наук
Санкт-Петербург, Россия
* E-mail: uplavice@gmail.com
Поступила в редакцию 27.06.2023
После доработки 06.10.2023
Принята к публикации 06.10.2023
- EDN: CHNSWE
- DOI: 10.31857/S0869813923120130
Аннотация
Головной мозг имеет хорошо развитую сосудистую сеть, что позволяет ему потреблять до 15% сердечного выброса при незначительной массе относительно массы всего тела. В норме метаболические потребности головного мозга значительно зависят от интенсивности функционирования различных его отделов, что требует постоянной регуляции уровня местного кровотока. С другой стороны, состояние системной гемодинамики может оказывать значительное влияние на органный кровоток. Сложные и многоуровневые механизмы регуляции органного мозгового кровотока направлены на минимизацию возможных неблагоприятных последствий влияния нарушений системной гемодинамики. К основным механизмам регуляции мозгового кровотока относят: миогенную регуляцию, влияние местных гуморальных воздействий и вазоактивных веществ (гормонов, метаболитов) системного кровотока, изменение газового состава крови (повышение или снижение в крови напряжения кислорода или углекислого газа). Кроме того, выделяют эндотелий-зависимые механизмы регуляции. Наконец, еще один уровень регуляции тонуса мозговых артерий представлен воздействием нейротрансмиттеров, высвобождающихся из терминалей вазомоторных волокон симпатического и парасимпатического отделов вегетативной нервной системы, а также из окончаний субкортикальных нейронов и кортикальных интернейронов. В настоящем обзоре рассмотрены принципы нейрогенной регуляции мозгового кровотока. Нейрогенная регуляция сосудистого тонуса представляет собой наиболее сложный контур регуляции. Вегетативная иннервация мозговых сосудов имеет существенные особенности, отличающие ее от таковой в большинстве других органов большого круга кровообращения. Кроме собственно вегетативной иннервации, сосуды головного мозга получают сенсорную иннервацию, а мелкие внутримозговые артериолы также иннервируются непосредственно нейронами подкорковых ядер и кортикальными интернейронами. В этой связи более глубокое понимание молекулярных механизмов нейрогенной регуляции мозгового кровотока в перспективе может послужить основой для разработки новых методов лечения тяжелых заболеваний головного мозга, основанных на нейромодуляции.
ВВЕДЕНИЕ
Головной мозг характеризуется хорошо развитой сосудистой сетью и потребляет около 15% сердечного выброса. При этом масса головного мозга составляет всего 2–3% от массы тела [1]. В норме метаболические потребности головного мозга существенным образом зависят от интенсивности функционирования различных его отделов, что требует постоянной регуляции уровня местного кровотока [2]. С другой стороны, состояние системной гемодинамики может оказывать значительное влияние на органный кровоток. При этом, с учетом огромной важности центральной нервной системы в обеспечении всех физиологических процессов, регуляция органного мозгового кровотока направлена на минимизацию возможных неблагоприятных последствий влияния нарушений системной гемодинамики. Эти эволюционно выработанные особенности мозгового кровотока нашли выражение в сложных физиологических механизмах его регуляции, реализующихся на различных уровнях [3]. При этом диапазон физиологических значений мозгового кровотока не столь широк и варьирует от 25 до 100 мл/100 г мин. [4]. Базовым уровнем регуляции мозгового кровотока является миогенная реакция, которая возникает при изменениях степени растяжения гладкомышечных клеток (ГМК) сосудистой стенки под влиянием давления в просвете сосуда. Миогенный ответ обеспечивает феномен ауторегуляции кровотока в головном мозге. Следующий уровень предполагает наличие внешних местных гуморальных воздействий, в том числе оказываемых метаболитами, на тонус сосудов на уровне нейроваскулярной единицы. Таким образом в основном обеспечиваются локальные изменения мозгового кровотока при функциональной гиперемии. В литературе для обозначения данного феномена часто используется термин “нейрососудистое сопряжение” [5]. Изменения интенсивности мозгового кровотока могут происходить и при повышении концентрации вазоактивных веществ (гормонов, метаболитов) в крови. Вазомоторные реакции сосудов головного мозга опосредованы либо изменением продукции в эндотелии ряда соединений, влияющих на тонус ГМК (эндотелий-зависимые механизмы регуляции), либо действием на ГМК, не требующим участия эндотелия (эндотелий-независимые реакции). Важное значение в регуляции мозгового кровотока имеют повышение или снижение в крови напряжения кислорода или углекислого газа. Указанный механизм хеморегуляции выделяется некоторыми авторами в качестве самостоятельного. Наконец, еще один уровень регуляции тонуса мозговых артерий представлен воздействием нейротрансмиттеров, высвобождающихся из терминалей вазомоторных волокон симпатического и парасимпатического отделов вегетативной нервной системы, а также из окончаний субкортикальных нейронов и кортикальных интернейронов. Между различными контурами регуляции мозгового кровотока существуют множественные взаимодействия, которые заключаются либо во взаимной потенциации их эффектов на сосудистый тонус, либо, напротив, в ослаблении суммарного эффекта при одновременной активации.
В настоящем обзоре рассмотрены принципы нейрогенной регуляции мозгового кровотока. Нейрогенная регуляция сосудистого тонуса представляет собой наиболее сложный контур регуляции. Она осуществляется за счет влияния вазомоторных волокон вегетативной нервной системы, функционально подразделяемых на симпатические и парасимпатические. Вегетативная иннервация мозговых сосудов имеет существенные особенности, отличающие ее от таковой в большинстве других органов большого круга кровообращения [6]. Кроме собственно вегетативной иннервации, сосуды головного мозга получают сенсорную иннервацию, а мелкие внутримозговые артериолы также иннервируются непосредственно нейронами подкорковых ядер и кортикальными интернейронами (центральная иннервация).
ВЕГЕТАТИВНАЯ ИННЕРВАЦИЯ АРТЕРИЙ ГОЛОВНОГО МОЗГА
Симпатическая иннервация
Центральный отдел симпатической нервной системы представлен нейронами ядер гипоталамуса, расположенных вдоль терминальной пластинки (субфорникальный орган, срединное преоптическое ядро, сосудистый орган концевой пластинки). Нейроны указанных структур формируют связи с паравентрикулярным ядром, которое интегрирует информацию от этих и других источников и влияет на преганглионарные нейроны латерального промежуточного ядра спинного мозга как прямо, так и через ростральное вентролатеральное мозговое вещество. Клеточные тела постганглионарных нейронов располагаются в верхнем шейном ганглии. Постганглионарные волокна участвуют в формировании нервного сплетения вокруг сонной артерии и формируют синапсы в адвентиции мозговых артерий различного калибра, вплоть до места входа пиальных артерий в глубину паренхимы мозга. Плотность вегетативного нервного сплетения вокруг внутренней сонной артерии выше, чем вокруг артерий вертебробазилярного бассейна [7]. Основным нейромедиатором симпатических нейронов является норадреналин; часть нервных окончаний также выделяет нейропептид Y. ГМК артерий головного мозга экспрессируют различные подтипы адренорецепторов и кальциевых каналов, причем распределение этих подтипов существенным образом зависит от калибра артерий и их локализации в мозге [8]. Так, например, ГМК крупных экстракраниальных артерий, таких как внутренняя сонная или позвоночная артерия, экспрессируют практически исключительно α1-адренорецепторы, активация которых приводит к сокращению ГМК и вазоконстрикции. При этом в ГМК пиальных артерий, несмотря на наличие α1-адренорецепторов, также присутствуют α2- и β2-адренорецепторы, стимуляция которых вызывает вазодилатацию. На протяжении сосудистой системы головного мозга отмечается и экспрессия кальциевых каналов. Если в ГМК сосудов других органов экспрессируются только кальциевые каналы L-типа, то в сосудах головного мозга в зависимости от их калибра и локализации могут присутствовать как каналы L-, так и T-типа. Так, крупные артерии содержат смешанную популяцию кальциевых каналов L- и T-типа, что обеспечивает более высокую чувствительность к вазоконстрикторным стимулам [9], тогда как в мелких пиальных артериях содержатся только каналы L-типа.
Необходимо отметить, что, несмотря на высокую плотность адренергической иннервации мозговых артерий, ее физиологическая роль в условиях покоя остается не вполне установленной [10]. В то же время имеются убедительные свидетельства в пользу участия симпатической иннервации артерий головного мозга в обеспечении поддержания миогенного тонуса вблизи от верхнего предела ауторегуляции при значительном повышении артериального давления (АД) [11]. Повышение симпатической активности при этом играет охранительную роль, предотвращая “прорыв” системного АД в микроциркуляторное русло и его баротравму.
Обнаружение симпатических нервных терминалей, заканчивающихся в стенке мозговых артерий, позже дополненное данными об экспрессии в них различных популяций адренорецепторов и кальциевых каналов, привело к неверному представлению о том, что симпатическая стимуляция приводит в артериях головного мозга к тем же функциональным последствиям, что и в других органах, т.е. к констрикции артерий и вен, сопровождающейся уменьшением кровотока [12]. При этом эффекты симпатической активации на мозговой кровоток оказались значительно более сложными и неоднозначными. Как уже указывалось выше, возникающие изменения сосудистого тонуса зависят от распределения и плотности адренорецепторов в каждом конкретном сосудистом сегменте, а также от концентрации норадреналина и наличия других вазоактивных соединений [13]. Другими словами, повышение тонуса вазомоторных адренергических волокон может приводить как к констрикции, так и к дилатации в зависимости от характера стимула (локальный или системный) и локализации кровеносного сосуда [14]. Например, повышение тонуса адренергических вазомоторных волокон может вызывать вазоконстрикцию в бассейне внутренней сонной артерии, поскольку в ней экспрессируются исключительно α1-адренорецепторы, но сопровождаться вазодилатацией в задней мозговой артерии и базилярной артерии, в которых представительство α1-адренорецепторов существенно меньше, но при этом экспрессируются β1- и β2-адренорецепторы.
Основной объем данных о роли симпатической нервной системы в регуляции мозгового кровотока у человека получен при использовании фармакологических агонистов или, напротив, блокаторов специфических подтипов адренорецепторов (табл. 1, 2). Для оценки мозгового кровотока в этом случае наиболее часто используется транскраниальная допплерография, которая позволяет оценивать только линейный кровоток. Большинство исследований с применением антагонистов α1-адренорецепторов свидетельствует об участии симпатической иннервации в регуляции мозгового кровотока (табл. 1) [15, 16]. Блокада α1-адренорецепторов сопровождается снижением АД, активаций барорефлекса, гипервентиляцией и гипокапнией. При перепадах АД или гиперкапнии увеличение тонуса симпатических вазомоторных волокон может ограничивать дилатацию артерий мозга и прирост мозгового кровотока. Действительно, в условиях блокады α1-адренорецепторов происходит ослабление прироста мозгового кровотока на гиперкапнию и нарушение динамической ауторегуляции кровотока [17, 18]. Клинические физиологические исследования с применением ганглиоблокаторов или неселективных блокаторов α-адренорецепторов показали, что симпатическая иннервация играет важную роль в обеспечении ауторегуляции мозгового кровотока. Так, например, увеличение линейной скорости кровотока в средней мозговой артерии в ответ на повышение АД под влиянием внутривенной инфузии норадреналина было в четыре раза более выраженным на фоне блокады α-адренорецепторов по сравнению с контролем [19]. Данные о физиологической роли симпатической регуляции мозгового кровотока, связанной с активацией β1- и β2-адренорецепторов, в настоящее время весьма ограничены (табл. 2). Эффект блокады β1-адренорецепторов на мозговой кровоток оценивался только в двух исследованиях на здоровых добровольцах (табл. 2). В обоих исследованиях было отмечено снижение линейной скорости кровотока в средней мозговой артерии после блокады β1-адренорецепторов и снижение прироста кровотока в ответ на физическую нагрузку [20, 21]. Однако ключевыми факторами, вызывающими указанные изменения, в данном случае могут служить значительное снижение сердечного выброса и среднего АД, опосредованные метопрололом. Следовательно, снижение кровотока в упомянутых работах может являться следствием уменьшения перфузионного давления и других вторичных системных изменений, не связанных с симпатической активацией. Данные экспериментальных исследований показывают, что введение антагонистов β2-адренорецепторов также сопровождается уменьшением мозгового кровотока и ограничением способности артерий головного мозга к дилатации [22]. Эти наблюдения подтверждаются единичными работами, выполненными на здоровых добровольцах. Так, Seifert и соавт. [23] показали, что после введения пропранолола у испытуемых уменьшалась степень прироста кровотока по средней мозговой артерии в ответ на физическую нагрузку. Вместе с тем вновь следует подчеркнуть, что в данном исследовании введение пропранолола сопровождалось приростом напряжения СО2 в выдыхаемом воздухе (РETCO2), а также снижением сердечного выброса и АД, что не исключает наличия непрямых эффектов на мозговой кровоток. В связи с этим дизайн подобных исследований требует совершенствования, в частности, путем фиксации значения РETCO2 и коррекции гипотензии введением вазопрессоров.
Таблица 1.
Исследования, посвященные изучению влияния агонистов и антагонистов α-адренорецепторов на мозговой кровоток у человека
| Фармакологический агент | Изменение АД после введения фармакологического агента | Стимул | Дизайн исследования и количество испытуемых | Основные выводы | Источник |
|---|---|---|---|---|---|
| Фентоламин (блокада α1 и α2-адренорецепторов) | Без изменений | Воздействие переменного отрицательного давления на нижнюю часть тела | Сравнение исходного кровотока с кровотоком после блокады α-адренорецепторов (n = 11) | Отсутствие влияния на кровоток в покое; Нарушение ауторегуляции кровотока после блокады α-адренорецепторов |
[16] |
| Дексмедетомидин (блокада α2-адренорецепторов) | Снижение | Без стимуляции (в покое) | Оценка дозозависимых эффектов (4 дозы, n = 6) | Значимое дозозависимое снижение кровотока и увеличение индекса Гослинга | [57] |
| Клонидин (блокада α2-адренорецепторов) | Снижение; нормализация после введения фенилэфрина | Вдыхание СО2 | Сравнение исходного кровотока с кровотоком после введения клонидина и после восстановления АД фенилэфрином (n = 9) | Снижение кровотока в покое; Уменьшение выраженности прироста кровотока в ответ на гиперкапнию после блокады α2-адренорецепторов (в т.ч. после нормализации АД) |
[58] |
| Клонидин (блокада α2-адренорецепторов) | Снижение | Изменение РаСО2 в диапазоне от гипо- к гиперкапнии | Сравнение кровотока в группе с применением клонидина с кровотоком в группе плацебо (n = 18) | Уменьшение выраженности прироста кровотока в ответ на гиперкапнию после блокады α2-адренорецепторов; Отсутствие влияния клонидина на степень снижения кровотока при гипокапнии |
[59] |
| Празозин (блокада α1-адренорецепторов) | Снижение | Гиперкапния, гипокапния |
Сравнение кровотока в группе с применением празозина с кровотоком в группе плацебо (n = 9) | Отсутствие влияния празозина на степень увеличения кровотока при гиперкапнии; Уменьшение выраженности снижения кровотока в ответ на гипокапнию после введения празозина |
[60] |
| Празозин (блокада α1-адренорецепторов) | Снижение | Ортостатическая гипотензия (3 мин после вставания) | Сравнение кровотока в группе с применением празозина с кровотоком в группе плацебо (n = 12) | Более выраженное снижение кровотока в ответ на гипотензию после введения празозина | [61] |
| Празозин (блокада α1-адренорецепторов) | Снижение | Легкая и умеренная физическая нагрузка | Сравнение изменений кровотока в ответ на нагрузку при использовании празозина и без него (n = 10) | Нарушение ауторегуляции кровотока после введения празозина; Ослабление ответа кровотока на нагрузку при применении празозина |
[15] |
| Фентоламин (блокада α1 и α2-адренорецепторов) | Без изменений | Воздействие переменного отрицательного давления на нижнюю часть тела (10 мин) | Сравнение исходного кровотока с кровотоком после блокады α-адренорецепторов (n = 11) | Нарушение статической и динамической ауторегуляции кровотока после блокады α-адренорецепторов фентоламином | [33] |
| Празозин (блокада α1-адренорецепторов) | Снижение | Гипоксия продолжительностью 60, 220 и 330 с | Сравнение кровотока в группе с применением празозина с кровотоком в группе плацебо (n = 12) | Отсутствие влияния празозина на степень выраженности изменений кровотока в ответ на гипоксию | [62] |
| Празозин (блокада α1-адренорецепторов) | Снижение | Спонтанная ауторегуляция | Сравнение кровотока в группе с применением празозина с кровотоком в группе плацебо (n = 10) | Нарушение ауторегуляции кровотока после блокады α-адренорецепторов празозином | [18] |
| Празозин (блокада α1-адренорецепторов) | Без изменений | Изометрическая нагрузка (2 мин) | Сравнение кровотока в группе с применением празозина с кровотоком в группе контроля (n = 9) | В контроле при нагрузке отмечено увеличение кровотока только по контралатеральной
ВСА; При применении празозина нагрузка сопровождалась приростом кровотока и по ипсилатеральной ВСА |
[63] |
| Норадреналин, затем фентоламин (блокада α1 и α2-адренорецепторов) | Повышение после введения норадреналина; снижение после введения фентоламина | Спонтанная ауторегуляция | Сравнение кровотока в группе с применением норадреналина с кровотоком в группе плацебо (n = 7) | Отсутствие влияния норадреналина на кровоток; Нарушение ауторегуляции при применении фентоламина |
[19] |
| Дексмедетомидин (блокада α2-адренорецепторов) | Снижение | Без стимуляции (в покое) | Оценка дозозависимых эффектов (2 дозы, n = 6) | Значимое дозозависимое снижение кровотока | [64] |
| Дексмедетомидин (блокада α2-адренорецепторов) | Снижение | Окклюзия-реперфузия бедренной артерий (динамическая ауторегуляция) | Сравнение кровотока в группе с применением дексметомидина с кровотоком в группе плацебо (n = 14) | Снижение скорости кровотока после введения дексметомидина (в покое); Нарушение ауторегуляции кровотока после введения дексметомидина |
[65] |
Таблица 2.
Исследования, посвященные изучению влияния антагонистов β- и α-/β-адренорецепторов, а также ганглиоблокаторов на мозговой кровоток у человека
| Фармакологический агент | Изменение АД после введения фармакологического агента | Стимул | Дизайн исследования и количество испытуемых | Основные выводы | Источник |
|---|---|---|---|---|---|
| Метопролол (блокада β1-адренорецепторов) | Снижение | Умеренная и интенсивная физическая нагрузка | Сравнение исходного кровотока с кровотоком после введения метопролола (n = 8) | Снижение кровотока в покое; Отсутствие влияния блокады β1-адренорецепторов на ауторегуляцию кровотока |
[21] |
| Пропранолол (блокада β2-адренорецепторов) | Без изменений | Нарастающая физическая нагрузка | Сравнение кровотока в группе с применением пропранолола с кровотоком в группе контроля (n = 8) | Отсутствие изменений кровотока в покое; Снижение кровотока вторично по отношению к уменьшению прироста сердечного выброса в ответ на нагрузку |
[23] |
| Празозин и пропранолол (блокада α1- и β2-адренорецепторов) | Снижение | Гипобарическая гипоксия | Сравнение степени изменений кровотока, полученных при переходе от нормобарии к гипобарии (n = 10) | Снижение кровотока в исходном состоянии; Снижение реактивности на гипоксию |
[66] |
| Триметафан (ганглиоблокатор) | Снижение; восстановление после введения фенилэфрина | Ортостатическая проба | Сравнение исходного кровотока с кровотоком после ортостаза и с кровотоком в условиях применения ганглиоблокатора (n = 6) | Отсутствие влияния триметафана на исходный кровоток и на степень изменения кровотока
на ортостаз; Реактивность кровотока на РаСО2 усиливалась после введения триметафана |
[67] |
| Триметафан (ганглиоблокатор) | Без изменений | Спонтанная ауторегуляция | Сравнение кровотока в группе с применением триметафана с кровотоком в группе плацебо (n = 12) | Снижение исходного кровотока; Нарушение ауторегуляции мозгового кровотока |
[68] |
| Триметафан (ганглиоблокатор) | Снижение | Проба Вальсальвы | Сравнение степени изменения кровотока в группе с применением триметафана с кровотоком в группе плацебо (n = 9) | Нарушение ауторегуляции при выполнении пробы Вальсальвы в группе с применением ганглиоблокатора | [69] |
| Мепивакаин (односторонняя блокада симпатического ганглия) | Повышение | Без стимуляции (в покое) | Изменение кровотока на стороне блокады симпатического ганглия (n = 8) | Увеличение кровотока по ВСА на стороне блокады после блокады симпатического ганглия | [70] |
| Метопролол (блокада β1-адренорецепторов) и лидокаин (односторонняя блокада симпатического ганглия) | Повышение | Физическая нагрузка | Сравнение кровотока в группе контроля с кровотоком после физической нагрузки и односторонней блокады симпатического ганглия (n = 8) | Блокада симпатического ганглия устраняла эффекты метопролола на кровоток после нагрузки | [20] |
| Триметафан (ганглиоблокатор) | Снижение | Воздействие отрицательного давления на нижнюю часть тела | Сравнение исходного кровотока с кровотоком после введения триметафана и с кровотоком после триметафана и воздействия отрицательного давления | Нарушение ауторегуляции кровотока при воздействии отрицательного давления | [71] |
Таким образом, поскольку фармакологическое воздействие на адренорецепторы в условиях целостного организма вызывает значимые изменения системных физиологических параметров, которые сами по себе могут оказывать выраженное влияние на мозговой кровоток, интерпретация результатов таких исследований связана с большими трудностями, поскольку при этом крайне сложно отделить прямые эффекты симпатической нервной системы на кровоток от непрямых эффектов, связанных, например, с изменениями АД или РаСО2.
Парасимпатическая иннервация
Важной особенностью нейрогенной регуляции тонуса мозговых артерий является наличие антагонистических воздействий симпатической и парасимпатической иннервации. Наличие тесно взаимодействующих и переплетающихся между собой терминалей симпатической и парасимпатической нервной системы в адвентиции мозговых артерий было описано в начале 1970-х годов [24]. В отличие от головного мозга, в большинстве других органов прямая парасимпатическая иннервация сосудов отсутствует, а нейрогенная вазодилатация достигается за счет уменьшения импульсации по адренергическим вазомоторным волокнам [25].
Анатомическая организация парасимпатической иннервации экстракраниальных и интракраниальных артерий головного мозга включает центральное звено, представленное нейронами, расположенными в верхнем слюноотделительном ядре Варолиева моста [26]. Преганглионарные парасимпатические волокна проходят в составе лицевого нерва и достигают клеточных тел холинергических нейронов, расположенных в крылонебном и ушном ганглиях [27]. Трансмиссия в указанных ганглиях осуществляется с помощью Н-холинорецепторов и устраняется ганглиоблокаторами. Небольшая доля преганглионарных волокон формирует синаптическое переключение в микроганглиях, расположенных в адвентиции внутренней сонной артерии. Постганглионарные волокна распространяются к адвентиции артерий головного мозга и формируют контакты с ГМК артерий до их вступления в пространство Вирхова–Робина. Иммуногистохимическое окрашивание показывает высокую плотность холинергических нервных терминалей в адвентиции мозговых артерий, расположенных на поверхности мозга. Основным нейротрансмиттером в данном случае является ацетилхолин; некоторые постганглионарные нейроны также выделяют вазоактивный интестинальный полипептид и оксид азота [28]. Стимуляция парасимпатических нервов, включая лицевой нерв, сопровождается дилатацией мозговых артерий и увеличением мозгового кровотока [29]. Напротив, удаление крылонебного ганглия в эксперименте устраняет эффекты стимуляции лицевого нерва на мозговой кровоток [30]. Следует отметить, что выраженность парасимпатической иннервации мозговых артерий является видоспецифичной. Показано, что среди млекопитающих наиболее интенсивная иннервация мозговых артерий волокнами парасимпатической нервной системы наблюдается у собак и крыс [31, 32].
Парасимпатическая иннервация мозговых артерий не участвует в реализации эффектов гипоксии и гиперкапнии на мозговой кровоток, но может участвовать в модуляции миогенного ответа и ауторегуляции мозгового кровотока. В частности, показано, что блокада холинергической нервной передачи повышала нижний предел ауторегуляции мозгового кровотока, что свидетельствует о важной роли активной вазодилатации, опосредованной повышением тонуса парасимпатических волокон, в поддержании кровоснабжения головного мозга при низком перфузионном давлении [33]. Опосредованная парасимпатической иннервацией дилатация артерий головного мозга в настоящее время рассматривается в качестве возможного способа улучшения мозгового кровотока у пациентов с ишемическим инсультом [34]. При этом для компенсации возникающего дефицита перфузии могут использоваться как фармакологические подходы, так и имплантируемые устройства, осуществляющие электростимуляцию крылонебного и ушного ганглиев, а также лицевого нерва [35, 36].
СЕНСОРНАЯ ИННЕРВАЦИЯ АРТЕРИЙ ГОЛОВНОГО МОЗГА
Иннервация мозговых и пиальных артерий осуществляется не только вазомоторными волокнами симпатической и парасимпатической нервной системы, но и сенсорными волокнами тригемино-васкулярной системы [27]. Клеточные тела нейронов тригеминальной сенсорной системы располагаются в ганглии тройничного нерва (узле Гассера), а терминали этих нейронов высвобождают в качестве нейротрансмиттеров субстанцию P, нейрокинин А, кальцитонин-ген-связанный пептид и пептид, активирующий аденилатциклазу гипофиза (PACAP) [37, 38]. Основная часть исследований, посвященных изучению роли этих нейротрансмиттеров в патологии, сосредоточена в области механизмов ноцицепции при мигрени [39]. Немногочисленные экспериментальные исследования позволяют сделать некоторые предварительные выводы относительно участия сенсорных тригеминальных волокон в регуляции мозгового кровотока. Так, известно, что передача сигнала по данным волокнам принимает участие в обеспечения дилатации пиальных артерий по механизму аксон-рефлекса во время эпизодов резкого повышения АД после превышения верхнего предела ауторегуляции мозгового кровотока [40]. Эти данные подчеркивают тот факт, что так называемая пассивная дилатация артерий после срыва ауторегуляции представляет собой более сложное явление, чем механическое растяжение сосудистой стенки под влиянием чрезмерного трансмурального давления. Тем не менее, удаление ганглия тройничного нерва не оказывает значимого эффекта на регионарный мозговой кровоток в состоянии покоя [41], что свидетельствует о минимальной роли тригеминальной системы в регуляции мозгового кровотока в физиологических условиях.
ЦЕНТРАЛЬНАЯ РЕГУЛЯЦИЯ МОЗГОВОГО КРОВОТОКА
Важной отличительной характеристикой иннервации артериального русла головного мозга является то, что волокна периферической нервной системы, т.е. вегетативные и сенсорные нервные окончания, осуществляют полноценную иннервацию лишь до уровня пиальных артерий. Плотность нервных терминалей, образованных этими волокнами в адвентиции артерий, резко уменьшается сразу после погружения пиальных артерий в пространство Вирхова–Робина [27]. При этом пенетрирующие и паренхиматозные артериолы, равно как и микрососуды коры, лишены иннервации со стороны периферической нервной системы [42]. Однако они получают иннервацию непосредственно от таких субкортикальных структур мозга, как голубое пятно, ядро шва, базальное крупноклеточное ядро переднего мозга (ядро Мейнерта), а также от кортикальных интернейронов, которые отдают отростки к периваскулярным пространствам, окружающим артериолы [43, 44]. Такой тип иннервации, в противоположность описанному выше “внешнему” по отношению к ткани головного мозга или “периферическому” по его происхождению из соответствующего отдела нервной системы, получил название “внутреннего” или “центрального”. Терминали нейронов, осуществляющих центральную иннервацию артериол головного мозга, лишь приблизительно в 7% случаев достигают сосудистой стенки и очень редко формируют контакты с ней [43]. Основная доля контактов нервных терминалей в этом случае приходится на астроциты, окружающие артериолы и капилляры в нейропиле [45, 46].
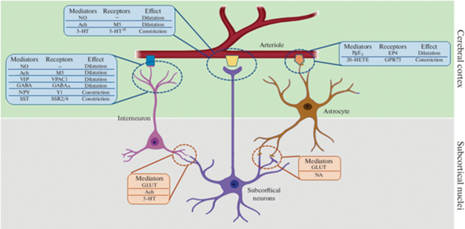
Центральная или внутренняя иннервация кортикальных артериол может осуществляться за счет трех типов связей, показанных на рис. 1. Во-первых, клеточные отростки субкортикальных нейронов могут устанавливать прямые контакты с внешней оболочкой сосудистой стенки. Показано, что, например, серотонинергические нейроны ядра шва обеспечивают констрикцию кортикальных артериол за счет активации серотониновых 1В-рецепторов (5-HT1B) на сосудистых ГМК [47]. Констрикция паренхиматозных артериол может возникать и под влиянием норадренергических нейронов голубого пятна и других центральных адренергических структур, которые активируются, в частности, при повышении внутричерепного давления [48]. Активация α1-адренорецепторов на мембране ГМК приводит к повышению цитоплазматического уровня Ca2+ и вазоконстрикции. β-адренорецепторы преимущественно экспрессируются в пиальных артериях задних отделов мозга, что определяет внутриорганные регионарные особенности регуляции сосудистого тонуса и кровотока [14]. Воздействие норадреналина на β1-адренорецепторы приводит к вазоконстрикции, тогда как стимуляция β2-адренорецепторов, напротив, вызывает вазодилатацию. Более интенсивная экспрессия β-адренорецепторов и относительно более низкая плотность α1-адренорецепторов в задних отделах головного мозга может рассматриваться как эволюционно выработанный механизм поддержания адекватного кровотока в стволе мозга и коре больших полушарий во время эпизодов симпатической гиперактивности. В роли медиаторов, опосредующих корковую вазодилатацию при стимуляции ядра Мейнерта, могут выступать оксид азота и ацетилхолин, действующий через M5-холинорецепторы [49]. Во-вторых, тонус паренхиматозных артериол может изменяться под влиянием медиаторов, высвобождающихся из корковых интернейронов. Воздействие таких медиаторов из окончаний отростков интернейронов как оксид азота, ацетилхолин, вазоактивный интестинальный полипептид и гамма-аминомасляная кислота вызывает расширение артериол и увеличение регионарного кровотока [50, 51]. С другой стороны, корковые интернейроны могут высвобождать из терминалей и такие нейромедиаторы, как нейропептид Y и соматостатин, которые опосредуют противоположную вазомоторную реакцию – вазоконстрикцию – через соответственно рецептор нейропептида Y типа 1 и соматостатиновый рецептор 2/4 (SSR2/4) [52]. Важно подчеркнуть, что корковые интернейроны могут устанавливать синаптические связи с нейронами подкорковых ядер; таким образом, подкорковые нейроны оказывают как прямое, так и непрямое влияние на сосудистый тонус в коре. В-третьих, на диаметр кортикальных артериол могут влиять биологически активные вещества, высвобождающиеся из отростков астроцитов: простагландин E2 через EP4-рецепторы вызывает вазодилатацию [53], а метаболит арахидоновой кислоты 20-гидроксиэйкозатетраеновая кислота вызывает обратный эффект путем активации GRP75-рецепторов [54]. В последнее время появляются данные о существовании четвертого типа взаимосвязей между клетками, участвующими во внутренней регуляции тонуса мозговых артериол: показано, что корковые интернейроны могут индуцировать высвобождение вазоактивных соединений из астроцитов. Так, Mariotti и соавт. [55] показали, что активация корковых интернейронов, экспрессирующих соматостатин, сопровождается поздним, но длительным повышением концентрации в астроцитах ионов кальция [55]. При этом хорошо известно, что повышение концентрации Са2+ в астроцитах вызывает выраженную локальную вазодилатацию [56]. Данный феномен лежит в основе развития функциональной гиперемии.
Рис. 1.
Нейрогенная регуляция тонуса кортикальных паренхиматозных артериол (по [27], с изменениями). АХ – ацетилхолин, 5-HT – серотонин, ГЛУТ – глутамат, НА – норадреналин, NO – оксид азота, ВИП – вазоактивный интестинальный полипептид, ГАМК – гамма-аминомасляная кислота, НП Y – нейропептид Y, СОМ – соматостатин, ПГE2 – простагландин E2, 20-НЕТЕ ‑ 20-гидроксиэйкозатетраеновая кислота, M5 – мускариновый рецептор 5 типа, VPAC1 – рецептор вазоактивного интестинального полипептида 1, ГАМКA – ГАМКА рецептор, Y1 – рецептор нейропептида Y типа 1, SSR2/4 – соматостатиновый рецептор 2/4, 5-HT1B– серотониновый 1В рецептор, EP4 – рецептор простагландина E2, GRP75-Gq – связанный рецептор 20-HETE (на перицитах и эндотелии).
ЗАКЛЮЧЕНИЕ
Несмотря на достаточно большой объем литературы, посвященной особенностям нейрогенной регуляции мозгового кровотока, дальнейшее развитие данного раздела физиологии регионарного кровообращения в настоящее время сдерживается рядом методических сложностей. Так, большой интерес представляют исследования нейрогенных механизмов регуляции мозгового кровотока в клинических условиях как на здоровых лицах, так и у пациентов с различными заболеваниями центральной нервной системы. До последнего времени в таких исследованиях для оценки кровотока практически исключительно применялась методика транскраниальной допплерографии, которая не позволяет учитывать изменения диаметра сосудов и оценивать регионарные особенности регуляции, в частности, на уровне внечерепных артерий головного мозга. Значительные перспективы могут быть связаны с более широким использованием таких методов оценки общего и регионарного мозгового кровотока, как магнитно-резонансная томография и позитронно-эмиссионная томография. С другой стороны, как уже констатировалось выше, в настоящее время для оценки роли тех или иных рецепторных механизмов регуляции мозгового кровообращения используется системное введение фармакологических агентов, которые, помимо непосредственного влияния на тонус мозговых артерий, вызывают генерализованные изменения функции сердечно-сосудистой системы, оказывающие влияние на мозговой кровоток. Единственным способом преодоления данного методического затруднения является быстрая нормализация параметров системной гемодинамики или предотвращение их возникновения с помощью воздействия на мишени, не связанные с регуляцией мозгового кровотока. Вместе с тем для оценки симпатической активности головного мозга могут применяться методики, не связанные с применением агонистов или блокаторов соответствующих адренорецепторов, например, оценка скорости выделения норадреналина путем анализа парных проб артериальной крови и крови из яремной вены.
Очевидно, что вегетативная иннервация артериальных сосудов головного мозга имеет целый ряд особенностей в сравнении с иннервацией артерий большинства других органов. При этом, в частности, степень выраженности и направленность вазомоторных эффектов активации симпатических волокон существенно отличаются в различных отделах головного мозга и зависят от типа адренорецепторов, экспрессирующихся в ГМК. При этом существуют сложные взаимосвязи между симпатической и парасимпатической иннервацией сосудов мозга, которые выражаются во взаимной модуляции этих механизмов. Так, например, дилатация артерий вертебробазилярного бассейна под действием симпатической стимуляции запускается высвобождением оксида азота из парасимпатических терминалей. Дисфункция одного из отделов вегетативной нервной системы неизбежно влечет на собой нарушение функции другого. Более глубокое понимание молекулярных механизмов нейрогенной регуляции мозгового кровотока в перспективе может послужить основой для разработки новых методов лечения тяжелых заболеваний головного мозга, основанных на нейромодуляции.
Список литературы
Attwell D, Laughlin SB (2001) An energy budget for signaling in the grey matter of the brain. J Cereb Blood Flow Metab 21(10): 1133–1145. https://doi.org/10.1097/00004647-200110000-00001
Бабиянц АЯ, Хананашвили ЯА (2018) Мозговое кровообращение: физиологические аспекты и современные методы исследования. Журн фундамент мед биол 3: 46–54. [Babiyanc AYa, Hananashvili YA (2018) Cerebral circulation: physiological aspects and metody issledovaniya. J Fundament Med Biol 3: 46–54. (In Russ)].
Claassen JAHR, Thijssen DHJ, Panerai RB, Faraci FM (2021) Regulation of cerebral blood flow in humans: physiology and clinical implications of autoregulation. Physiol Rev 101(4): 1487–1559. https://doi.org/10.1152/physrev.00022.2020
Thomas SN, Schroeder T, Secher NH, Mitchell JH (1989) Cerebral blood flow during submaximal and maximal dynamic exercise in humans. J Appl Physiol (1985) 67(2): 744–748. https://doi.org/10.1152/jappl.1989.67.2.744
Iadecola C (2017) The Neurovascular Unit Coming of Age: A Journey through Neurovascular Coupling in Health and Disease. Neuron 96(1): 17–42. https://doi.org/10.1016/j.neuron.2017.07.030
Koep JL, Taylor CE, Coombes JS, Bond B, Ainslie PN, Bailey TG (2022) Autonomic control of cerebral blood flow: fundamental comparisons between peripheral and cerebrovascular circulations in humans. J Physiol 600(1): 15–39. https://doi.org/10.1113/JP281058
Bleys RL, Cowen T (2001) Innervation of cerebral blood vessels: morphology, plasticity, age-related, and Alzheimer’s disease-related neurodegeneration. Microsc Res Tech 53(2): 106–118. https://doi.org/10.1002/jemt.1075
Brassard P, Tymko MM, Ainslie PN (2017) Sympathetic control of the brain circulation: Appreciating the complexities to better understand the controversy. Auton Neurosci 207: 37–47. https://doi.org/10.1016/j.autneu.2017.05.003
Paulson OB, Strandgaard S, Edvinsson L (1990) Cerebral autoregulation. Cerebrovasc Brain Metab Rev 2(2): 161–192. PMID: 2201348
Strandgaard S, Sigurdsson ST (2008) Point:Counterpoint: Sympathetic activity does/does not influence cerebral blood flow. Counterpoint: Sympathetic nerve activity does not influence cerebral blood flow. J Appl Physiol (1985) 105(4): 1366–1367; discussion 1367–1368. https://doi.org/10.1152/japplphysiol.90597.2008a
Cassaglia PA, Griffiths RI, Walker AM (2008) Sympathetic nerve activity in the superior cervical ganglia increases in response to imposed increases in arterial pressure. Am J Physiol Regul Integr Comp Physiol 294(4): R1255–R1261. https://doi.org/10.1152/ajpregu.00332.2007
Thomas GD (2011) Neural control of the circulation. Adv Physiol Educ 35(1): 28–32. https://doi.org/10.1152/advan.00114.2010
Gordon GRJ, MacVicar BA, Mulligan SJ (2009) Glia control of blood flow. In: Encyclopedia of Neuroscience. LR Squire (ed). Oxford. Acad Press. 737–742.
Gezalian MM, Mangiacotti L, Rajput P, Sparrow N, Schlick K, Lahiri S (2021) Cerebrovascular and neurological perspectives on adrenoceptor and calcium channel modulating pharmacotherapies. J Cereb Blood Flow Metab 41(4): 693–706. https://doi.org/10.1177/0271678X20972869
Purkayastha S, Saxena A, Eubank WL, Hoxha B, Raven PB (2013) α1-Adrenergic receptor control of the cerebral vasculature in humans at rest and during exercise. Exp Physiol 98(2): 451–461. https://doi.org/10.1113/expphysiol.2012.066118
Hamner JW, Tan CO, Lee K, Cohen MA, Taylor JA (2010) Sympathetic control of the cerebral vasculature in humans. Stroke 41(1): 102–109. https://doi.org/10.1161/STROKEAHA.109.557132
Hamner JW, Tan CO (2014) Relative contributions of sympathetic, cholinergic, and myogenic mechanisms to cerebral autoregulation. Stroke. 45(6): 1771–1777. https://doi.org/10.1161/STROKEAHA.114.005293
Saleem S, Teal PD, Howe CA, Tymko MM, Ainslie PN, Tzeng YC (2018) Is the Cushing mechanism a dynamic blood pressure-stabilizing system? Insights from Granger causality analysis of spontaneous blood pressure and cerebral blood flow. Am J Physiol Regul Integr Comp Physiol 315(3): R484–R495. https://doi.org/10.1152/ajpregu.00032.2018
Kimmerly DS, Tutungi E, Wilson TD, Serrador JM, Gelb AW, Hughson RL, Shoemaker JK (2003) Circulating norepinephrine and cerebrovascular control in conscious humans. Clin Physiol Funct Imaging 23(6): 314–319. https://doi.org/10.1046/j.1475-0961.2003.00507.x
Ide K, Boushel R, Sørensen HM, Fernandes A, Cai Y, Pott F, Secher NH (2000) Middle cerebral artery blood velocity during exercise with beta-1 adrenergic and unilateral stellate ganglion blockade in humans. Acta Physiol Scand 170(1): 33–38. https://doi.org/10.1046/j.1365-201x.2000.00757.x
Ogoh S, Dalsgaard MK, Secher NH, Raven PB (2007) Dynamic blood pressure control and middle cerebral artery mean blood velocity variability at rest and during exercise in humans. Acta Physiol (Oxf) 191(1): 3–14. https://doi.org/10.1111/j.1748-1716.2007.01708.x
Hare GM, Worrall JM, Baker AJ, Liu E, Sikich N, Mazer CD (2006) Beta2 adrenergic antagonist inhibits cerebral cortical oxygen delivery after severe haemodilution in rats. Br J Anaesth 97(5): 617–623. https://doi.org/10.1093/bja/ael238
Seifert T, Rasmussen P, Secher NH, Nielsen HB (2009) Cerebral oxygenation decreases during exercise in humans with beta-adrenergic blockade. Acta Physiol (Oxf) 196(3): 295–302. https://doi.org/10.1111/j.1748-1716.2008.01946.x
Owman C, Edvinsson L, Nielsen KC (1974) Autonomic neuroreceptor mechanisms in brain vessels. Blood Vessels 11(1-2): 2–31. https://doi.org/10.1159/000157996
Roloff EV, Tomiak-Baquero AM, Kasparov S, Paton JF (2016) Parasympathetic innervation of vertebrobasilar arteries: is this a potential clinical target? J Physiol 594(22): 6463–6485. https://doi.org/10.1113/JP272450
Goadsby PJ (2013) Autonomic nervous system control of the cerebral circulation. Handb Clin Neurol 117: 193–201. https://doi.org/10.1016/B978-0-444-53491-0.00016-X
Hamel E (2006) Perivascular nerves and the regulation of cerebrovascular tone. J Appl Physiol (1985) 100(3): 1059–1064. https://doi.org/10.1152/japplphysiol.00954.2005
Edvinsson L, Ekman R (1984) Distribution and dilatory effect of vasoactive intestinal polypeptide (VIP) in human cerebral arteries. Peptides 5(2): 329–331. https://doi.org/10.1016/0196-9781(84)90229-8
Suzuki N, Hardebo JE (1993) The cerebrovascular parasympathetic innervation. Cerebrovasc Brain Metab Rev 5(1): 33–46.
Goadsby PJ, Lambert GA, Lance JW (1984) The peripheral pathway for extracranial vasodilatation in the cat. J Auton Nerv Syst 10(2): 145–155. https://doi.org/10.1016/0165-1838(84)90053-5
D’Alecy LG, Rose CJ (1977) Parasympathetic cholinergic control of cerebral blood flow in dogs. Circ Res 41(3): 324–331. https://doi.org/10.1161/01.res.41.3.324
Scremin OU, Rovere AA, Raynald AC, Giardini A (1973) Cholinergic control of blood flow in the cerebral cortex of the rat. Stroke 4(2): 233–239.
Hamner JW, Tan CO, Tzeng YC, Taylor JA (2012) Cholinergic control of the cerebral vasculature in humans. J Physiol 590(24): 6343–6352. https://doi.org/10.1113/jphysiol.2012.245100
Cheyuo C, Jacob A, Wu R, Zhou M, Coppa GF, Wang P (2011) The parasympathetic nervous system in the quest for stroke therapeutics. J Cereb Blood Flow Metab 31(5): 1187–1195. https://doi.org/10.1038/jcbfm.2011.24
Khurana D, Kaul S, Bornstein NM (2009) ImpACT-1 Study Group. Implant for augmentation of cerebral blood flow trial 1: a pilot study evaluating the safety and effectiveness of the Ischaemic Stroke System for treatment of acute ischaemic stroke. Int J Stroke 4(6): 480–485. https://doi.org/10.1111/j.1747-4949.2009.00385.x
Baker TS, Robeny J, Cruz D, Bruhat A, Iloreta AM, Costa A, Oxley TJ (2021) Stimulating the Facial Nerve to Treat Ischemic Stroke: A Systematic Review. Front Neurol 12: 753182. https://doi.org/10.3389/fneur.2021.753182
Ashina H, Schytz HW, Ashina M (2019) CGRP in Human Models of Migraine. Handb Exp Pharmacol 255: 109–120. https://doi.org/10.1007/164_2018_128
Ashina M, Hansen JM, Do TP, Melo-Carrillo A, Burstein R, Moskowitz MA (2019) Migraine and the trigeminovascular system – 40 years and counting. The Lancet Neurol 18: 795–804. https://doi.org/10.1016/S1474-4422(19)30185-1
Waeber C, Moskowitz MA (2005) Migraine as an inflammatory disorder. Neurology 64(10 Suppl 2): S9–S15. https://doi.org/10.1212/wnl.64.10_suppl_2.s9
Sakas DE, Moskowitz MA, Wei EP, Kontos HA, Kano M, Ogilvy CS (1989) Trigeminovascular fibers increase blood flow in cortical gray matter by axon reflex-like mechanisms during acute severe hypertension or seizures. Proc Natl Acad Sci U S A 86(4): 1401–1405. https://doi.org/10.1073/pnas.86.4.1401
Moskowitz MA, Wei EP, Saito K, Kontos HA (1988) Trigeminalectomy modifies pial arteriolar responses to hypertension or norepinephrine. Am J Physiol 255(1 Pt 2): H1–H6. https://doi.org/10.1152/ajpheart.1988.255.1.H1
Faraci FM, Mayhan WG, Werber AH, Heistad DD (1987) Cerebral circulation: effects of sympathetic nerves and protective mechanisms during hypertension. Circ Res 61(5 Pt 2): 102–106.
Cohen Z, Molinatti G, Hamel E (1997) Astroglial and vascular interactions of noradrenaline terminals in the rat cerebral cortex. J Cereb Blood Flow Metab 17(8): 894–904. https://doi.org/10.1097/00004647-199708000-00008
Estrada C, Mengual E, González C (1993) Local NADPH-diaphorase neurons innervate pial arteries and lie close or project to intracerebral blood vessels: a possible role for nitric oxide in the regulation of cerebral blood flow. J Cereb Blood Flow Metab 13(6): 978–984. https://doi.org/10.1038/jcbfm.1993.122
Allaman I, Pellerin L, Magistretti PJ (2000) Protein targeting to glycogen mRNA expression is stimulated by noradrenaline in mouse cortical astrocytes. Glia 30(4): 382–391.
Kötter K, Klein J (1999) Adrenergic modulation of astroglial phospholipase D activity and cell proliferation. Brain Res 830(1): 138–145. https://doi.org/10.1016/s0006-8993(99)01416-x
Elhusseiny A, Hamel E (2001) Sumatriptan elicits both constriction and dilation in human and bovine brain intracortical arterioles. Br J Pharmacol 132(1): 55–62. https://doi.org/10.1038/sj.bjp.0703763
Guild SJ, Saxena UA, McBryde FD, Malpas SC, Ramchandra R (2018) Intracranial pressure influences the level of sympathetic tone. Am J Physiol Regul Integr Comp Physiol 315(5): R1049–R1053. https://doi.org/10.1152/ajpregu.00183.2018
Elhusseiny A, Hamel E (2000) Muscarinic–but not nicotinic–acetylcholine receptors mediate a nitric oxide-dependent dilation in brain cortical arterioles: a possible role for the M5 receptor subtype. J Cereb Blood Flow Metab 20(2): 298–305. https://doi.org/10.1097/00004647-200002000-00011
Cauli B, Tong XK, Rancillac A, Serluca N, Lambolez B, Rossier J, Hamel E (2004) Cortical G-ABA interneurons in neurovascular coupling: relays for subcortical vasoactive pathways. J Neurosci 24(41): 8940–8949. https://doi.org/10.1523/JNEUROSCI.3065-04.2004
Yang G, Huard JM, Beitz AJ, Ross ME, Iadecola C (2000) Stellate neurons mediate functional hyperemia in the cerebellar molecular layer. J Neurosci 20(18): 6968–6973. https://doi.org/10.1523/JNEUROSCI.20-18-06968.2000
Perrenoud Q, Rossier J, Férézou I, Geoffroy H, Gallopin T, Vitalis T, Rancillac A (2012) Activation of cortical 5-HT(3) receptor-expressing interneurons induces NO mediated vasodilatations and NPY mediated vasoconstrictions. Front Neural Circuits 6: 50. https://doi.org/10.3389/fncir.2012.00050
Davis RJ, Murdoch CE, Ali M, Purbrick S, Ravid R, Baxter GS, Tilford N, Sheldrick RL, Clark KL, Coleman RA (2004) EP4 prostanoid receptor-mediated vasodilatation of human middle cerebral arteries. Br J Pharmacol 141(4): 580–585. https://doi.org/10.1038/sj.bjp.0705645
Yu M, Cambj-Sapunar L, Kehl F, Maier KG, Takeuchi K, Miyata N, Ishimoto T, Reddy LM, Falck JR, Gebremedhin D, Harder DR, Roman RJ (2004) Effects of a 20-HETE antagonist and agonists on cerebral vascular tone. Eur J Pharmacol 486(3): 297–306. https://doi.org/10.1016/j.ejphar.2004.01.009
Mariotti L, Losi G, Lia A, Melone M, Chiavegato A, Gómez-Gonzalo M, Sessolo M, Bovetti S, Forli A, Zonta M, Requie LM, Marcon I, Pugliese A, Viollet C, Bettler B, Fellin T, Conti F, Carmignoto G (2018) Interneuron-specific signaling evokes distinctive somatostatin-mediated responses in adult cortical astrocytes. Nat Commun 9(1): 82. https://doi.org/10.1038/s41467-017-02642-6
Lind BL, Brazhe AR, Jessen SB, Tan FC, Lauritzen MJ (2013) Rapid stimulus-evoked astrocyte Ca2+ elevations and hemodynamic responses in mouse somatosensory cortex in vivo. Proc Natl Acad Sci U S A 110(48): E4678–E4687. https://doi.org/10.1073/pnas.1310065110
Zornow MH, Maze M, Dyck JB, Shafer SL (1993) Dexmedetomidine decreases cerebral blood flow velocity in humans. J Cereb Blood Flow Metab 13(2): 350–353. https://doi.org/10.1038/jcbfm.1993.45
Lee HW, Caldwell JE, Dodson B, Talke P, Howley J (1997) The effect of clonidine on cerebral blood flow velocity, carbon dioxide cerebral vasoreactivity, and response to increased arterial pressure in human volunteers. Anesthesiology 87(3): 553–558. https://doi.org/10.1097/00000542-199709000-00015
Maekawa T, Cho S, Fukusaki M, Shibata O, Sumikawa K (1999) Effects of clonidine on human middle cerebral artery flow velocity and cerebrovascular CO2 response during sevoflurane anesthesia. J Neurosurg Anesthesiol 11(3): 173–177. https://doi.org/10.1097/00008506-199907000-00003
Peebles KC, Ball OG, MacRae BA, Horsman HM, Tzeng YC (2012) Sympathetic regulation of the human cerebrovascular response to carbon dioxide. J Appl Physiol (1985) 113(5): 700–706. https://doi.org/10.1152/japplphysiol.00614.2012
Lewis NC, Ainslie PN, Atkinson G, Jones H, Grant EJ, Lucas SJ (2013) Initial orthostatic hypotension and cerebral blood flow regulation: effect of α1-adrenoreceptor activity. Am J Physiol Regul Integr Comp Physiol 304(2): R147–R154. https://doi.org/10.1152/ajpregu.00427.2012
Lewis NC, Smith KJ, Bain AR, Wildfong KW, Numan T, Ainslie PN (2015) Impact of transient hypotension on regional cerebral blood flow in humans. Clin Sci (Lond) 129(2): 169–178. https://doi.org/10.1042/CS20140751
Fernandes IA, Mattos JD, Campos MO, Machado AC, Rocha MP, Rocha NG, Vianna LC, Nobrega AC (2016) Selective α1-adrenergic blockade disturbs the regional distribution of cerebral blood flow during static handgrip exercise. Am J Physiol Heart Circ Physiol 310(11): H1541–H1548. https://doi.org/10.1152/ajpheart.00125.2016
Drummond JC, Dao AV, Roth DM, Cheng CR, Atwater BI, Minokadeh A, Pasco LC, Patel PM (2008) Effect of dexmedetomidine on cerebral blood flow velocity, cerebral metabolic rate, and carbon dioxide response in normal humans. Anesthesiology 108(2): 225–232. https://doi.org/10.1097/01.anes.0000299576.00302.4c
Ogawa Y, Iwasaki K, Aoki K, Kojima W, Kato J, Ogawa S (2008) Dexmedetomidine weakens dynamic cerebral autoregulation as assessed by transfer function analysis and the thigh cuff method. Anesthesiology 109(4): 642–650. https://doi.org/10.1097/ALN.0b013e3181862a33
Ainslie PN, Lucas SJ, Fan JL, Thomas KN, Cotter JD, Tzeng YC, Burgess KR (2012) Influence of sympathoexcitation at high altitude on cerebrovascular function and ventilatory control in humans. J Appl Physiol (1985) 113(7): 1058–1067. https://doi.org/10.1152/japplphysiol.00463.2012
Jordan J, Shannon JR, Diedrich A, Black B, Costa F, Robertson D, Biaggioni I (2000) Interaction of carbon dioxide and sympathetic nervous system activity in the regulation of cerebral perfusion in humans. Hypertension 36(3): 383–388. https://doi.org/10.1161/01.hyp.36.3.383
Zhang R, Zuckerman JH, Iwasaki K, Wilson TE, Crandall CG, Levine BD (2002) Autonomic neural control of dynamic cerebral autoregulation in humans. Circulation 106(14): 1814–1820. https://doi.org/10.1161/01.cir.0000031798.07790.fe
Zhang R, Crandall CG, Levine BD (2004) Cerebral hemodynamics during the Valsalva maneuver: insights from ganglionic blockade. Stroke 35(4): 843–847. https://doi.org/10.1161/01.STR.0000120309.84666.AE
Umeyama T, Kugimiya T, Ogawa T, Kandori Y, Ishizuka A, Hanaoka K (1995) Changes in cerebral blood flow estimated after stellate ganglion block by single photon emission computed tomography. J Auton Nerv Syst 50(3): 339–346. https://doi.org/10.1016/0165-1838(94)00105-s
Mitsis GD, Zhang R, Levine BD, Tzanalaridou E, Katritsis DG, Marmarelis VZ (2009) Autonomic neural control of cerebral hemodynamics. IEEE Eng Med Biol Mag 28(6): 54–62. https://doi.org/10.1109/MEMB.2009.934908
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


