Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 12, стр. 1742-1762
Роль активных форм кислорода в регуляции тонуса кровеносных сосудов в перинатальном и раннем постнатальном онтогенезе
А. А. Швецова 1, *, Д. К. Гайнуллина 1, О. С. Тарасова 1, 2
1 Московский государственный университет имени М.В. Ломоносова
Москва, Россия
2 Институт медико-биологических проблем РАН
Москва, Россия
* E-mail: anastasiashvetsova92@gmail.com
Поступила в редакцию 01.09.2023
После доработки 12.10.2023
Принята к публикации 16.10.2023
- EDN: CHPLLM
- DOI: 10.31857/S0869813923120105
Аннотация
Активные формы кислорода (АФК) на протяжении многих лет рассматривались в качестве негативных регуляторов сердечно-сосудистой системы. Действительно, избыточная продукция АФК характерна для многих сердечно-сосудистых заболеваний. Особенно ярко повреждающее влияние АФК может проявляться в организме новорожденного, поскольку в этот период констрикторное влияние АФК в сосудах легких остается высоким, как и в сосудах плода, а системы антиоксидантной защиты еще не успели сформироваться. Поэтому в первые часы и дни самостоятельной жизни легочные сосуды склонны к сокращению, прежде всего из-за низкой биодоступности эндотелиального NO, что повышает риск развития легочной гипертензии новорожденных. Вместе с тем в перинатальный период онтогенеза АФК играют важную роль в адаптивных реакциях системы кровообращения: они обеспечивают перекрытие артериального протока и разобщение малого и большого кругов кровообращения сразу после рождения, а также способствуют сокращению периферических сосудов при гипоксии, которая часто сопутствует процессу родов, что обеспечивает приоритетное кровоснабжение головного мозга в этих условиях. Вазомоторное влияние АФК сохраняется и в раннем постнатальном онтогенезе, но имеет иной характер. Действие АФК служит одним из механизмов увеличения эндотелий-зависимого расслабления легочных сосудов в первые недели жизни. Кроме того, в период раннего постнатального онтогенеза АФК могут играть важную роль в регуляции тонуса системных сосудов. В данном обзоре изложены современные представления о вазомоторной роли АФК в сосудах легочного и системного кругов кровообращения и рассмотрены механизмы влияния АФК на функционирование эндотелиальных и гладкомышечных клеток сосудов в перинатальном и раннем постнатальном периодах развития организма.
ВВЕДЕНИЕ
Активные формы кислорода (АФК) – малые химически активные молекулы, образующиеся в клетке в процессе окислительно-восстановительных реакций. К АФК относят кислородные радикалы и пероксиды: обладающий большой реакционной способностью и коротким временем жизни супероксидный анион-радикал ${\text{O}}_{2}^{ - }$ и являющийся более стабильной нерадикальной молекулой пероксид водорода (H2O2) [1, 2]. Также к АФК относятся азотсодержащие соединения, такие как оксид азота (NO), диоксид азота (NO2·) и пероксинитрит (ONOO–). Однако эту группу веществ, как правило, рассматривают отдельно от “классических” АФК, выделяя в категорию активных форм азота [3]. АФК обладают широким спектром функций в различных органах и тканях, в том числе в сердечно-сосудистой системе.
На протяжении многих лет АФК рассматривали в качестве негативных регуляторов, оказывающих повреждающее влияние на функционирование клеток. Действительно, развитие многих заболеваний сердечно-сосудистой системы, таких как легочная и артериальная гипертензия, сахарный диабет и др., связано с повышенной продукцией АФК [4, 5]. В то же время исследования последних лет демонстрируют важную роль АФК в нормальном функционировании системы кровообращения. Так, показано, что АФК участвуют в регуляции тонуса кровеносных сосудов [2, 6]. Кроме того, в относительно низких концентрациях АФК влияют на процессы пролиферации, роста и дифференцировки эндотелиальных и гладкомышечных клеток (ГМК) [1, 7], которые активно протекают в развивающемся организме. Они регулируют процессы васкулогенеза и ангиогенеза [8, 9], а также дифференцировку ГМК в сократительный фенотип [10, 11], то есть задействованы в регуляции формирования и созревания сосудистой системы.
Следует отметить, что регуляция тонуса сосудов как легочного, так и системного кругов кровообращения в перинатальном и раннем постнатальном периодах во многом отличается от таковой у взрослых. Это продемонстрировано для целого ряда механизмов, реализующихся на уровне эндотелия и ГМК. Так, снижение сопротивления легочных сосудов после рождения, а также поддержание системного артериального давления на сравнительно низком уровне у новорожденных во многом связано со значимым сосудорасширяющим влиянием продуцируемого эндотелием оксида азота и калиевых каналов ГМК [12–16]. Наряду с этим, функциональный вклад некоторых проконстрикторных механизмов, например, сигнального пути Rho-киназы, в легочных и системных сосудах также выше в период раннего постнатального онтогенеза [17–19]. Вероятно, одновременное повышение активности как вазодилататорных, так и вазоконстрикторных механизмов создает широкий диапазон изменений сосудистого тонуса, что важно для адаптации новорожденного организма к новым условиям окружающей среды. Примечательно, что АФК прямо или опосредовано способны влиять на перечисленные выше сигнальные пути [2, 3]. В связи с этим участие АФК в регуляции тонуса сосудов у новорожденных может обладать рядом особенностей по сравнению со взрослым организмом. Таким образом, целью данного обзора является обобщение современных представлений о вазомоторной роли АФК в сосудистой системе в периоды перинатального и раннего постнатального онтогенеза.
1. ОСНОВНЫЕ ИСТОЧНИКИ И МИШЕНИ АФК В СОСУДАХ
Основными источниками АФК в клетках кровеносных сосудов являются электрон-транспортная цепь (ЭТЦ) митохондрий, ферменты NADPH-оксидазы (NOX) и супероксиддисмутазы (SOD) [2, 3].
ЭТЦ митохондрий состоит из четырех комплексов, которые последовательно транспортируют электроны с молекул NADH на кислород с образованием воды. По мере переноса электронов происходит транспорт протонов из матрикса в межмембранное пространство, что создает движущую силу, способствующую образованию АТФ в комплексе V (АТФ-синтазе). Большинство электронов, поступающих в ЭТЦ, в конечном итоге восстанавливают кислород до воды в комплексе IV, однако небольшая часть электронов “уходит” из цепи в комплексе I или III с образованием ${\text{O}}_{2}^{ - }$ [20]. Образовавшийся ${\text{O}}_{2}^{ - }$, с одной стороны, способен выходить в цитоплазму через специальные анионные каналы [21]. С другой стороны, супероксиддисмутазы (SOD1 и SOD2), расположенные в митохондриях, катализируют дисмутацию ${\text{O}}_{2}^{ - }$ в H2O2, который может свободно диффундировать из органеллы, опосредуя клеточную передачу сигналов или, в высоких концентрациях, способствуя развитию окислительного стресса.
Еще один функционально важный источник АФК в сосудах – NADPH-оксидазный ферментативный комплекс. В целом описано 7 изоформ NADPH-оксидаз (NOX1-5 и DUOX1-2). В кровеносных сосудах могут экспрессироваться шесть изоформ NOX: NOX1, 2, 4 и 5 (у грызунов NOX5 не обнаружена) и DUOX1-2 [3, 22], при этом NOX1, 2 и 5 продуцируют ${\text{O}}_{2}^{ - }$, а NOX4 и DUOX1-2 – в основном H2O2. NOX, локализованные в плазматической мембране, продуцируют АФК преимущественно во внеклеточное пространство из-за ориентации каталитических субъединиц. Затем ${\text{O}}_{2}^{ - }$ попадает во внутриклеточное пространство через анионные каналы (например, хлорные каналы ClC-3 [23]), либо дисмутируется до H2O2, который может проникать в клетку путем пассивной диффузии через плазматическую мембрану или через аквапориновые каналы [24, 25]. Помимо плазматической мембраны, NOX могут быть локализованы во внутриклеточных органеллах: митохондриях, саркоплазматическом ретикулуме и ядре [2]. Примечательно, что локализация разных изоформ NOX в пределах плазматической мембраны может различаться. Так, в эндотелиальных клетках NOX1, 2 и 5, но не NOX4, локализованы в кавеолах, что может определять сигнальные функции АФК, продуцируемых той или иной изоформой NOX [26].
SOD дисмутируют ${\text{O}}_{2}^{ - }$ до менее агрессивной и более стабильной молекулы H2O2. Таким образом, с одной стороны, SOD можно отнести к антиоксидантным системам (устранение ${\text{O}}_{2}^{ - }$), а с другой стороны – к АФК-продуцирующим ферментам (синтез H2O2). Изоформы SOD отличаются металлами, входящими в состав активного центра фермента, а также локализацией в клетке. Так, в активном центре SOD1 и SOD3 находятся ионы цинка и меди, а SOD2 – марганца. При этом SOD1 является цитоплазматической изоформой, а также локализована в межмембранном пространстве митохондрий, SOD2 расположена в матриксе митохондрий, а SOD3 является внеклеточной изоформой фермента [27]. Все три изоформы SOD экспрессируются в клетках кровеносных сосудов [6, 27].
Эффекты влияния АФК на тонус сосудов во взрослом организме подробно рассмотрены в ранее опубликованных обзорах [1–3, 27]. В целом показано, что АФК способны вызывать как сокращение, так и расслабление артерий. Например, ${\text{O}}_{2}^{ - }$ способствовал сокращению легочных артерий [28, 29] и аорты крыс [30], артерий скелетной мускулатуры [6, 29], средней мозговой артерии [29], а также афферентных почечных артериол мышей [31]. В то же время бедренная артерия и артерии брыжейки крыс расслаблялись в ответ на увеличение продукции ${\text{O}}_{2}^{ - }$ [28, 29]. H2O2 обладал сократительным влиянием в аорте мышей [32], но вызывал расслабление афферентных почечных артериол мышей [31] и бедренной артерии крыс [33]. В коронарных артериях и артериях брыжейки крыс H2O2 способен как усиливать сокращение, так и ослаблять его [34, 35].
Разнонаправленное влияние АФК на тонус сосудов связывают с их влиянием на ряд мишеней в эндотелии и ГМК. Просократительное влияние АФК связано прежде всего со снижением продукции NO эндотелием. Дело в том, что ${\text{O}}_{2}^{ - }$ взаимодействует с NO c образованием пероксинитрита (ONOO–), который способствует разобщению эндотелиальной NO-синтазы (eNOS), окисляя тетрагидробиоптерин (BH4), необходимый для ее димеризации [3]. Разобщенная eNOS производит меньше вазодилатирующего NO, но больше ${\text{O}}_{2}^{ - }$, в результате эндотелий-зависимое расслабление становится менее выраженным.
На уровне ГМК АФК могут способствовать увеличению внутриклеточной концентрации кальция, а следовательно, сокращению несколькими способами: активируя потенциал-управляемые кальциевые каналы L-типа [36, 37] или неселективные катионные каналы TRPC (transient receptor potential channels, type C) [32], увеличивая чувствительность IP3-рецепторов саркоплазматического ретикулума к IP3 (инозитол-3-фосфат) [38], а также снижая активность потенциал-управляемых калиевых каналов (Kv) [39]. Кроме того, АФК могут способствовать сокращению путем влияния на сигнальные пути, активность которых напрямую не зависит от внутриклеточной концентрации кальция: пути МАР-киназ [40, 41], Rho-киназы [28, 42], Src-киназы [43]. Вазорелаксирующее действие АФК может быть связано с их прямым активирующим влиянием на протеинкиназу G [31, 44, 45], которая, в свою очередь, фосфорилирует множество мишеней в ГМК [46], в том числе различные калиевые каналы, приводя в итоге к расслаблению.
Судя по всему, итоговый “знак” вазомоторного влияния АФК зависит от множества факторов и может различаться в зависимости от принадлежности сосуда к малому или большому кругу кровообращения, диаметра/порядка ветвления сосуда, концентрации АФК и компартмента их секреции в клетке. Как будет рассмотрено далее, “знак” влияния АФК на тонус сосудов также может зависеть от стадии развития организма.
2. РОЛЬ АФК В РАЗОБЩЕНИИ ЛЕГОЧНОГО И СИСТЕМНОГО КРУГОВ КРОВООБРАЩЕНИЯ ПОСЛЕ РОЖДЕНИЯ
В малом круге кровообращения сразу после рождения происходят драматические изменения в связи с переходом от плацентарного газообмена к легочному. Относительно гипоксическая среда плода способствует сужению легочных сосудов и соответственно повышению их сопротивления кровотоку [47–50]. Чтобы не перфузировать кровью неработающие легкие, а также снизить нагрузку на правый желудочек, в сердечно-сосудистой системе плода имеются два шунта, соединяющие круги кровообращения: овальное отверстие в межпредсердной перегородке и артериальный (боталлов) проток (АП), который обеспечивает сброс крови из легочной артерии в аорту. После рождения эти шунты закрываются и происходит разобщение двух кругов кровообращения. Доказано, что закрытие АП связано с повышением напряжения кислорода в крови и реализуется с участием АФК (рис. 1).
Рис. 1.
Схема, иллюстрирующая роль АФК (ROS) в сокращении артериального протока при нормоксии. ETC – электрон-транспортная цепь митохондрий, LTCC – потенциал-активируемые кальциевые каналы L-типа, nSMase – нейтральная сфингомиелиназа, NOX – NADPH-оксидаза, Rho-kinase – Rho-киназа. Острые стрелки – активирующее влияние, тупые стрелки – ингибирующее влияние.
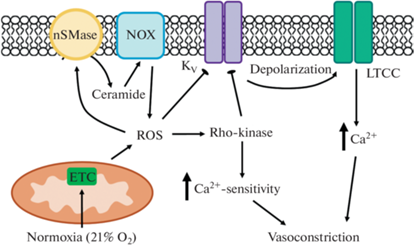
В ранних исследованиях на препаратах АП кролика и человека было показано, что нормоксия (повышение содержания кислорода до 21%) вызывает сокращение, увеличение содержания H2O2, а также подавление тока Kv в ГМК [39, 51]. Ингибиторы ЭТЦ митохондрий устраняли рост продукции H2O2 в ответ на нормоксию [39]. По мнению авторов, нормоксия вызывает повышение продукции АФК митохондриями (преимущественно H2O2), что приводит к снижению активности каналов Kv, деполяризации мембраны ГМК и сокращению АП.
Кроме того, участником сократительной реакции АП млекопитающих на нормоксию может быть Rho-киназа – фермент, играющий ключевую роль в механизме кальциевой сенситизации ГМК [52]. В экспериментах на АП человека и кролика было показано, что сократительный ответ на нормоксию, связанный с генерацией H2O2 митохондриями, уменьшается в три раза после удаления Са2+ из наружного раствора или блокады ключевых механизмов его повышения в цитоплазме ГМК, а остаточный “Са2+-независимый” компонент реакции устраняется ингибитором Rho-киназы [53]. Увеличение содержания О2 в среде приводило к повышению активности Rho-киназы (судя по приросту фосфорилирования ее основной мишени в ГМК – регуляторной субъединицы фосфатазы легких цепей миозина по ингибиторному сайту Thr696), а через час экспозиции – также к повышению содержания белка Rho-киназы в ткани АП.
Позже сходные эффекты АФК были выявлены в экспериментах на легочной части АП куриных эмбрионов [49]. В данном случае легочную часть АП выделяют отдельно, поскольку АП куриных эмбрионов обладает уникальным свойством: в отличие от млекопитающих он формируется в результате слияния двух сосудов с разным эмбриологическим происхождением, морфологией и реактивностью на кислород и АФК [54, 55]. Легочная часть АП состоит преимущественно из клеток-производных нервного гребня, имеет структуру артерии мышечного типа, сокращается на повышение парциального давления O2, как и АП млекопитающих [54, 55]. Аортальная же часть имеет мезодермальное происхождение и морфологию артерии эластического типа, она расслабляется в ответ на O2. Эта особенность позволяет оценивать специфичность реакций на различные стимулы “истинного” АП (легочной части) и “контрольного” сосуда (аортальной части).
В исследовании Cogolludo и соавт. было показано, что нормоксия вызывает сокращение легочной части АП зрелых куриных эмбрионов и расслабление аортальной части [49]. Примечательно, что сокращение легочной части значительно ослаблялось на фоне ингибиторов различных комплексов ЭТЦ митохондрий, потенциал-зависимых кальциевых каналов L-типа, а также Rho-киназы. Кроме того, нормоксия сопровождалась повышением содержания как ${\text{O}}_{2}^{ - }$, так и H2O2 в ткани только легочной части АП. Отсутствие изменений содержания H2O2 в ответ на нормоксию в аортальной части, вероятно, связано с высокой экспрессией в ней каталазы – фермента, катализирующего разложение H2O2 до H2O. Таким образом, механизмы сокращения легочной части АП зрелых куриных эмбрионов при нормоксии схожи с таковыми в АП млекопитающих: увеличение синтеза H2O2, подавление активности каналов Kv, деполяризация и активация потенциал-управляемых кальциевых каналов L-типа, а также повышение чувствительности сократительного аппарата ГМК к Са2+ с участием Rho-киназы.
Еще один участник реакции сокращения АП на нормоксию – церамид, сфинголипид плазматической мембраны, образующийся в результате гидролиза сфингомиелина ферментами сфингомиелиназами. Примечательно, что АФК способны активировать сфингомиелиназы, и, следовательно, способствовать увеличению количества церамида в клетке [56]. Ингибирование активности нейтральной сфингомиелиназы или подавление синтеза этого фермента путем РНК-интерференции вызывало существенное снижение реакций сокращения АП эмбрионов курицы и человека на нормоксию [57]. В соответствии с этим нормоксия приводила к увеличению продукции церамида в ГМК легочной части АП эмбрионов курицы, а добавление экзогенных церамида и сфингомиелиназы воспроизводило эффекты нормоксии на АП, т.е. вызывало снижение амплитуды тока Kv и сокращение [57]. Мишенью церамида в ГМК АП являются NOX [58], их ингибирование значимо ослабляет сократительные реакции АП на нормоксию. Таким образом, авторы предполагают следующую цепочку событий: нормоксия вызывает рост продукции АФК митохондриями, АФК активируют сфингомиелиназу и образуется церамид, активирующий NOX, а продуцируемые NOX АФК подавляют активность каналов Kv, что в конечном счете ведет к сокращению (рис. 1).
Примечательно, что АП незрелых плодов овец (E103–105, продолжительность гестации около 145 дней) и кроликов (E26, продолжительность гестации около 30 дней) развивают менее выраженные сократительные реакции на повышение кислорода по сравнению со зрелыми плодами [59–61]. Легочная же часть АП незрелых куриных эмбрионов (E15) совсем не сокращалась при 21% O2 [49]. В соответствии с этим нормоксия не вызывала изменений содержания АФК в стенке АП незрелых эмбрионов, что может быть связано с более высокой экспрессией SOD1 [49]. Наконец, было показано, что для ГМК легочной части АП незрелых эмбрионов характерно наличие нечувствительных к кислороду Kv токов низкой амплитуды, тогда как Kv токи в ГМК зрелых эмбрионов были чувствительными к кислороду и имели высокую амплитуду. Таким образом, механизм, обеспечивающий сокращение АП в ответ на нормоксию с участием АФК, формируется к концу внутриутробного развития.
Рассмотренные в этом разделе данные позволяют заключить, что АФК играют важную роль в физиологической реакции сокращения АП после рождения, механизмы их вазомоторного влияния обобщены на рис. 1.
3. РОЛЬ АФК В РЕГУЛЯЦИИ ТОНУСА АРТЕРИЙ МАЛОГО КРУГА КРОВООБРАЩЕНИЯ В ПЕРИОД РАННЕГО ПОСТНАТАЛЬНОГО ОНТОГЕНЕЗА
Важно отметить, что поддержание высокого сопротивления сосудов малого круга кровообращения плода в период внутриутробного развития во многом связано с действием АФК [57]. При этом механизмы вазоконстрикторного влияния АФК в легочных артериях плода сходны с таковыми в АП, но стимулом к их активации является не нормоксия, а гипоксия [57]. После рождения вслед за сокращением АП необходимо обеспечить снижение сопротивления малого круга кровообращения. Известно, что сосудорасширяющее влияние эндотелиального NO играет важную роль в снижении тонуса легочных артерий в ранний постнатальный период [15, 16]. В то же время переход от плацентарного дыхания к легочному сопровождается резким повышением оксигенации органов и тканей, что может приводить к избыточной продукции АФК [62–64] и, как следствие, к снижению биодоступности NO [65]. Такие события, по крайней мере отчасти, могут лежать в основе развития легочной гипертензии новорожденных – патологического состояния, являющегося одной из ведущих причин смертности среди младенцев [66]. С другой стороны, целый ряд работ демонстрирует важную роль АФК в нормальной регуляции сосудистого тонуса в раннем постнатальном периоде, в том числе, их участие в реализации эндотелий-зависимого расслабления легочных артерий. Как будет рассмотрено далее, этот механизм созревает постепенно, в связи с чем вазомоторная роль АФК оказывается неодинаковой сразу после рождения и на более поздних стадиях развития (рис. 2).
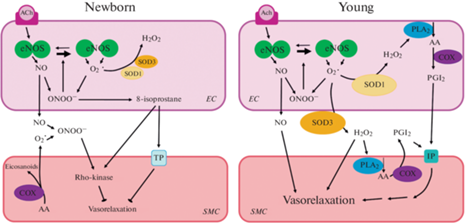
Рис. 2.
Схемы, иллюстрирующие роль АФК в регуляции тонуса легочных артерий у новорожденных (слева) и более зрелых (в возрасте до 4 нед., справа) животных. Слабая выраженность реакции эндотелий-зависимого расслабления в легочных артериях новорожденных животных связана с низкой биодоступностью NO вследствие высокой продукции АФК в эндотелии и ГМК и низкой экспрессией антиоксидантных систем (прежде всего, SOD). На более позднем этапе развития реакции эндотелий-зависимого расслабления становятся выраженными благодаря повышению экспрессии SOD, которые способствуют сохранности NO, а также синтезируют H2O2, вызывающий расслабление ГМК. AA (arachidonic acid) – арахидоновая кислота, Ach (acetylcholine) – ацетилхолин, 8-isoprostane – 8-изопростан, COX (cyclooxygenase) – циклооксигеназа, PGI2 (prostaglandin I2) – простациклин, PLA2 (phospholipase A2) – фосфолипаза А2, EC (endothelial cell) – эндотелиальная клетка, SMC (smooth muscle cell) – ГМК, TP (thromboxane A2 receptor) – рецептор тромбоксана А2, IP (prostaglandin I2 (prostacyclin) receptor) – рецептор простациклина. Острые стрелки – активирующее влияние, тупые стрелки – ингибирующее влияние.
3.1. ВЛИЯНИЕ АФК ОГРАНИЧИВАЕТ ЭНДОТЕЛИЙ-ЗАВИСИМОЕ РАССЛАБЛЕНИЕ АРТЕРИЙ МАЛОГО КРУГА КРОВООБРАЩЕНИЯ У НОВОРОЖДЕННЫХ ЖИВОТНЫХ
В экспериментах на легочных артериях поросят, кроликов и овец показано, что степень выраженности реакций эндотелий-зависимого расслабления в первые часы после рождения существенно меньше, чем на более поздних стадиях развития [15, 16, 67]. Есть основания полагать, что это связано с низкой биодоступностью NO у новорожденных из-за высокого содержания АФК в стенке артерий.
Так, в работе Morecroft и MacLean ацетилхолин вызывал выраженное расслабление артерий четырехдневных и взрослых кроликов, которое полностью устранялось ингибитором NO-синтаз L-NAME [15]. Кроме того, у четырехдневных животных L-NAME вызывал развитие спонтанного тонуса. Таким образом, у четырехдневных и взрослых кроликов NO (1) является главным посредником эндотелий-зависимого расслабления легочных артерий и (2) проявляет выраженное антиконстрикторное влияние (препятствует развитию спонтанного тонуса). Однако у новорожденных кроликов (в первые 12 ч после рождения) L-NAME не влиял на тонус легочных артерий, а расслабление артерий в ответ на ацетилхолин развивалось только в присутствии SOD. Инкубация с SOD также приводила к ослаблению сокращения артерий новорожденных кроликов на агонист α1‑адренорецепторов фенилэфрин, а удаление эндотелия устраняло данный эффект [15]. Авторы заключили, что вклад NO в эндотелий-зависимое расслабление, а также его антиконстрикторное влияние в ткани легочных артерий новорожденных кроликов снижены из-за накопления ${\text{O}}_{2}^{ - }$, и, следовательно, снижения биодоступности NO. Помимо этого, ONOO–, образующийся в результате взаимодействия ${\text{O}}_{2}^{ - }$ с NO, сам по себе способен вызывать сокращение. На легочных артериях новорожденных крысят было показано, что ONOO– может способствовать сокращению путем увеличения количества 8-изопростана, способного активировать рецепторы тромбоксана А2, а также путем активации сигнального пути Rho-киназы [68] (рис. 2, слева).
Накопление ${\text{O}}_{2}^{ - }$ может происходить в результате сниженной экспрессии/активности антиоксидантных систем, в том числе SOD. Показано, что активность и количество белка SOD существенно ниже в легочной ткани новорожденных кроликов по сравнению со взрослыми [69]. Сходным образом экспрессия мРНК SOD1 и SOD2 в легочной ткани человека увеличивалась по мере взросления [70]. Кроме того, содержание белка всех трех изоформ SOD в легочной ткани взрослых мышей выше, чем у мышей в возрасте 7 дней [71]. Активность SOD в легочной ткани кроликов существенно растет от момента рождения уже к возрасту 3–4 дней [62]. Вместе с тем активность SOD в ткани легких и продукция ${\text{O}}_{2}^{ - }$ в легочных артериях были сопоставимыми у новорожденных и двухнедельных поросят [67]. Отсутствие постнатальных изменений этих показателей у поросят может быть связано с их большей зрелостью к моменту рождения по сравнению с другими упоминавшимися выше млекопитающими, то есть изменения экспрессии/активности SOD у них могут происходить на конечном этапе внутриутробного развития.
В ходе развития могут изменяться не только активность и экспрессия ферментов, но и их локализация в ткани. Парадоксально, но в легких плодов и новорожденных кроликов внеклеточная SOD (SOD3) локализуется преимущественно в эпителиальных клетках дыхательных путей и альвеол [69]. Спустя неделю жизни она обнаруживается как внутри, так и вне клеток, а в возрасте 1 месяца и старше содержание SOD3 внутри клеток становится существенно меньше, нежели во внеклеточном матриксе [69]. Если аналогичные изменения локализации SOD3 происходят и в ткани легочных сосудов, это может быть еще одним объяснением увеличения биодоступности NO от момента рождения к более поздним стадиям онтогенеза.
Такое предположение согласуется с результатами функциональных исследований. Несмотря на отсутствие явных возрастных изменений общей активности SOD у поросят [67], ингибитор Cu,Zn-SOD (т.е. SOD1 и SOD3) DETCA подавлял реакции расслабления на ацетилхолин у новорожденных поросят и не оказывал влияния на реакции артерий двухнедельных животных, то есть эти изоформы SOD вовлечены в реализацию эндотелий-зависимого расслабления легочных артерий новорожденных, но не двухнедельных поросят [67]. Важно отметить, что инкубация легочных артерий новорожденных поросят с проникающей в клетку формой SOD (PEG-SOD, конъюгат SOD с полиэтиленгликолем) устраняла влияние DETCA на эндотелий-зависимое расслабление, тогда как непроникающая в клетку форма SOD такого влияния не оказывала [67]. Судя по всему, эндотелий-зависимому расслаблению легочных артерий новорожденных поросят способствуют изоформы SOD, локализованные только внутри клетки, то есть поддержание биодоступности NO за счет дисмутации ${\text{O}}_{2}^{ - }$ в основном происходит во внутриклеточном, а не внеклеточном пространстве.
Анализ приведенных выше работ позволяет заключить, что новорожденный организм может быть особенно восприимчивым к окислительному стрессу из-за сниженной активности антиоксидантных систем, в частности, SOD (рис. 2, слева). Постепенное повышение экспрессии/активности SOD, а также изменение их локализации в ткани (переход из внутриклеточного компартмента во внеклеточную среду) являются важными механизмами увеличения вклада NO в регуляцию тонуса легочных артерий после рождения.
3.2. АФК УЧАСТВУЮТ В ЭНДОТЕЛИЙ-ЗАВИСИМОМ РАССЛАБЛЕНИИ АРТЕРИЙ МАЛОГО КРУГА КРОВООБРАЩЕНИЯ В ПЕРИОД РАННЕГО ПОСТНАТАЛЬНОГО ОНТОГЕНЕЗА
Результаты работ на легочных артериях более зрелых животных (до 4 нед. после рождения) демонстрируют, что АФК могут принимать непосредственное участие в эндотелий-зависимом расслаблении (рис. 2, справа).
Устранение АФК путем инкубации легочных артерий 1–2-недельных поросят с проницаемыми для мембраны SOD-миметиком (перевод ${\text{O}}_{2}^{ - }$ в H2O2) и каталазой (перевод H2O2 в H2O и O2) приводило к существенному ослаблению вазодилатации на ацетилхолин [72, 73]. Интересно, что апоцинин, который ингибирует NOX, а также может служить “ловушкой” нерадикальных окислителей, таких как H2O2 [74, 75], вызывал сходные изменения реакций на ацетилхолин. Эти данные говорят о том, что АФК способствуют эндотелий-зависимому расслаблению на ацетилхолин в легочных артериях 1–2-недельных поросят.
Следует отметить, что существенных изменений вклада АФК в регуляцию расслабления легочных артерий поросят в период с первой по вторую неделю жизни не происходит. Эффекты проникающего в клетку SOD-миметика, PEG-каталазы и апоцинина на ацетилхолин-вызванное расслабление были сопоставимы в артериях 5–6-дневных и 12–13-дневных поросят. В соответствии с этим содержание белка SOD1, SOD2 и SOD3 в легочных артериях 5–6-дневных поросят не отличалось от 12-дневных [72, 76]. Что касается экспрессии NOX, количество белка NOX1 в легочных артериях поросят по одним данным не изменяется от 5–6-дневного к 12-дневному возрасту [76], а по другим сведениям несколько снижается [72]. При этом общее содержание белка p67phox (регуляторная субъединица, активирующая NOX2) растет от 5–6-дневного к 12-дневному возрасту, а содержание p67phox в мембранной фракции не изменяется [72]. Таким образом, с 1-ю по 2-ю неделю жизни в легочных артериях поросят содержание SOD не изменяется, тогда как однозначный вывод об изменении экспрессии NOX сделать сложно.
Механизм участия АФК в эндотелий-зависимом расслаблении легочных артерий в период раннего постнатального онтогенеза может быть связан с функционированием eNOS [77]. Показано, что легочные артерии овец в возрасте 4 нед. расслабляются на ацетилхолин и на Са2+-ионофор А23187 (также способствует активации eNOS) значительно лучше, чем артерии плодов на поздней стадии внутриутробного развития (E136). В обеих группах животных реакции расслабления на A23187 устранялись в присутствии ингибитора NO-синтаз L-NAME, однако ингибитор растворимой гуанилатциклазы ODQ действовал лишь на артерии плодов, но не 4-недельных овец. Последнее указывает на то, что у 4-недельных овец активация eNOS приводит к расслаблению с участием механизма, отличного от синтеза NO. Действительно, в эндотелиальных клетках плодов А23187 вызывал преимущественно синтез NO, тогда как в клетках 4-недельных овец помимо NO в большом количестве продуцировались ${\text{O}}_{2}^{ - }$ и H2O2. PEG-SOD и каталаза не влияли на вызванное А23187 расслабление артерий плодов, в то время как у 4-недельных овец инкубация с PEG-SOD приводила к усилению, а инкубация с комбинацией PEG-SOD и каталазы – к ослаблению дилататорных реакций на A23187. Результаты данного эксперимента позволяют заключить, что релаксация артерий 4-недельных животных, но не плодов, на A23187 связана с влиянием продуцируемого эндотелием H2O2. Наконец, авторы продемонстрировали, что продукция АФК эндотелиальными клетками 4-недельных овец блокируется ингибитором NO-синтаз L-NAME, но не апоцинином (ингибитор NOX). Таким образом, в легочных артериях 4-недельных овец eNOS находится в разобщенном состоянии, что связано с низким содержанием BH4, и продуцирует преимущественно АФК, которые способствуют расслаблению [77].
Основываясь на данных литературы, можно предложить следующий механизм релаксирующего влияния АФК на легочные артерии молодых животных. С одной стороны, известно, что вазодилататоры, зависимые от активности циклооксигеназы (ЦОГ), вносят весомый вклад в эндотелий-зависимое расслабление легочных артерий поросят при действии ацетилхолина [78]. С другой стороны, как было показано на изолированных ГМК аорты крысы, H2O2 может вызывать активацию фосфолипазы А2 и высвобождение арахидоновой кислоты [79]. Поэтому неудивительно, что АФК, генерируемые экзогенной ксантиноксидазой, или же экзогенный H2O2 вызывали расслабление ГМК артерий поросят, причем эти реакции уменьшались под действием ингибитора ЦОГ индометацина [80]. Более того, как ксантиноксидаза, так и H2O2 стимулировали продукцию простациклина в этих артериях. Таким образом, есть основание полагать, что в легочных артериях поросят АФК вызывают расслабление, стимулируя выработку зависимых от ЦОГ вазодилататорных метаболитов арахидоновой кислоты.
Итак, совокупность приведенных экспериментальных работ демонстрирует, что у более зрелых животных АФК способны принимать непосредственное участие в эндотелий-зависимом расслаблении: наряду с NO, АФК (в первую очередь H2O2) могут вызывать дилатацию легочных сосудов, возможно, с участием ЦОГ (рис. 2, справа).
3.3. АФК, ПРОДУЦИРУЕМЫЕ ГМК, СНИЖАЮТ РЕАКТИВНОСТЬ ЛЕГОЧНЫХ АРТЕРИЙ НА ЭКЗОГЕННЫЙ NO
Как известно, АФК-продуцирующие ферменты экспрессируются не только в эндотелии, но и в ГМК [3]. Следовательно, модуляция эффектов эндотелиального NO под действием АФК может происходить и на уровне ГМК. Есть основания полагать, что эти процессы происходят по-разному у новорожденных и более зрелых животных.
Работа Perez-Vizcaino и соавт. была посвящена сравнению реакций легочных артерий новорожденных (в течение 18 ч после рождения) и 15–20-дневных поросят на экзогенный NO и определению роли АФК в этих реакциях [81]. Важно отметить, что все эксперименты были проведены на сосудах с удаленным эндотелием. Артерии новорожденных поросят расслаблялись на газообразный NO существенно хуже по сравнению с артериями более взрослых поросят. При этом расслабление на NO в обеих группах полностью устранялось ингибитором растворимой гуанилатциклазы ODQ, что говорит о запуске классического сигнального цГМФ-зависимого каскада в ГМК.
Исследователи выдвинули гипотезу о том, что ослабленные реакции артерий новорожденных поросят на NO связаны с большей активностью систем, генерирующих ${\text{O}}_{2}^{ - }$, или же с меньшей активностью антиоксидантных систем в гладкой мышце. Инкубация артерий как с непроникающей в клетку SOD, так и с проникающим в клетку SOD-миметиком приводила к усилению реакций расслабления на NO в обеих группах, что указывает на большую сохранность NO на фоне данных веществ, однако степень выраженности эффектов SOD/SOD-миметика была одинакова в артериях новорожденных и более взрослых животных [81]. Вещества, увеличивающие количество ${\text{O}}_{2}^{ - }$ (комплекс ксантиноксидазы с гипоксантином и ингибитор Cu,Zn-SOD DETCA), напротив, ослабляли реакции на NO в обеих группах, что указывает на разрушение NO под действием ${\text{O}}_{2}^{ - }$. При этом эффекты данных веществ также были сопоставимы в сосудах животных двух возрастных групп [81]. Результаты данного исследования позволяют заключить, что менее выраженная реакция расслабления гладкой мышцы легочных артерий на экзогенный NO у новорожденных животных не связана с влиянием SOD.
Вместе с тем оказалось, что у новорожденных, но не более взрослых животных, расслабление на NO усиливается на фоне ингибитора ЦОГ-1 [81]. Исходя из того, что ЦОГ-зависимые пути способны активировать синтез АФК [82, 83], можно предположить, что сниженная реактивность артерий новорожденных поросят на NO связана с повышенной продукцией АФК как побочных продуктов более активной у них гладкомышечной ЦОГ-1 (рис. 2, слева).
Кроме того, показаны возрастные различия в эффектах NOX: ингибитор NOX DPI в большей степени усиливал расслабление артерий на NO в группе 15–20-дневных поросят по сравнению с новорожденными [81]. Хотя это и не объясняет описанные выше возрастные особенности реактивности сосудов на NO [81], но указывает на повышение вклада NOX, локализованных в ГМК, в регуляцию тонуса легочных артерий в ходе постнатального онтогенеза.
Интересно, что экзогенный NO из разных источников инактивируется АФК неодинаково. Показано, что газообразный NO в гораздо большей степени инактивируется ${\text{O}}_{2}^{ - }$, нежели NO, высвобождаемый уже в ткани из NO-доноров SNP или SNAP [84]. Авторы предполагают, что NO, источником которого являются SNP и SNAP, образуется в компартментах клетки, отличных от компартмента образования супероксида. Вероятно, с этим связано отсутствие различий в расслаблении легочных артерий новорожденных и 15–20-дневных поросят на SNP [81], а также отсутствие эффектов SOD, тирона (“ловушки” ${\text{O}}_{2}^{ - }$), ингибиторов NOX и каталазы на SNAP-вызванное расслабление легочных артерий плодов овец и крыс [85–87].
Итак, результаты приведенных исследований демонстрируют, что АФК, продуцируемые ГМК, также способны снижать биодоступность NO, что особенно ярко проявляется в период новорожденности.
4. РОЛЬ АФК В РЕГУЛЯЦИИ ТОНУСА СИСТЕМНЫХ АРТЕРИЙ В ПЕРИНАТАЛЬНЫЙ И РАННИЙ ПОСТНАТАЛЬНЫЙ ПЕРИОДЫ ОНТОГЕНЕЗА
В целом функциональная роль АФК в артериях большого круга кровообращения, играющих ключевую роль в регуляции системного артериального давления, в перинатальный и ранний постнатальный периоды онтогенеза исследована в значительно меньшей степени по сравнению с легочными сосудами и АП. Однако точно известно, что АФК принимают участие в реализации важной реакции, защищающей головной мозг плода от острой гипоксии во время родов (т.н. brain-sparing effect) [88]. У плодов овец эта реакция формируется к концу периода гестации (начиная с Е110) и заключается в сужении периферических сосудов, которое необходимо для перераспределения крови в пользу головного мозга с целью снабжения его кислородом в условиях гипоксии. В ней задействованы как системные нейрогуморальные механизмы, запускаемые в основном хеморецепторами каротидных синусов, так и механизмы местной регуляции сосудистого тонуса, которые реализуются с участием АФК [88].
Известно, что у взрослых птиц и млекопитающих гипоксия вызывает сужение сосудов легких [89], но расширение сосудов системного кровообращения [90]. Однако, как будет рассмотрено далее, на позднем этапе внутриутробного развития периферические сосуды плода демонстрируют противоположные изменения тонуса – сужение в ответ на гипоксию. В экспериментах на беременных самках и плодах овец (срок гестации – около E130) c хронически имплантированными катетерами и датчиками кровотока дыхание матери гипоксической газовой смесью (6% O2 в течение 30 мин, двукратное снижение оксигенации артериальной крови плода) приводило к повышению у плода артериального давления и сопротивления сосудистого бассейна бедренной артерии [91, 92]. Такое сужение сосудов плода значительно уменьшалось под действием аскорбиновой кислоты или ингибитора ксантиноксидазы, причем блокада синтеза NO (введение L-NAME) отменяла эффекты обоих антиоксидантов [91, 92].
Полученные результаты позволили авторам сформулировать положение о развитии у плода “оксидантного тонуса” периферических сосудов: гипоксия при прямом воздействии на сосуды приводит к генерации в них АФК, которые снижают биодоступность продуцируемого эндотелием NO. Следует также отметить, что введение аллопуринола (ингибитор ксантиноксидазы) сопровождалось снижением у плода артериального давления и в отсутствие гипоксии, что указывает на участие АФК в формировании базальных уровней периферического сопротивления и системного артериального давления в позднем пренатальном онтогенезе [92].
Артерии брыжейки куриных эмбрионов также сокращаются в ответ на гипоксию (наиболее выражено в период с E21 по P3), но механизмы этой реакции принципиально иные, чем у млекопитающих [93]. Гипоксическое сужение артерий куриных эмбрионов реализуется независимо от эндотелия (сохраняется после его удаления или в присутствии L-NAME) и включает два компонента: фазический, который наблюдается в течение начальных 10 мин и затем сменяется тоническим. При этом только фазический, но не тонический компонент выражено уменьшался под действием ингибиторов ЭТЦ митохондрий (ротенона и антимицина), а также ингибитора NOX VAS2870, но не изменялся в присутствии непроникающих в клетку форм SOD и каталазы [93]. Таким образом, в артериях брыжейки куриных эмбрионов АФК могут обеспечивать быстрое и транзиторное сокращение ГМК в ответ на гипоксию, реализуя свое влияние внутри клетки. По данным фармакологического анализа, потенциальными мишенями АФК в ГМК артерий куриных эмбрионов могут служить потенциал-управляемые кальциевые каналы L-типа, Rho-киназа и некоторые другие регуляторные молекулы [93].
Интересно, что бедренная артерия куриных эмбрионов (E19), напротив, расслабляется в ответ на гипоксию, однако, по мнению авторов, АФК не принимают значимого участия в развитии этой реакции [94]. В этой же работе было показано, что ингибиторы ЭТЦ митохондрий не оказывают влияния на реакции расслабления артерий, развивающиеся по различным механизмам: при действии ацетилхолина (эндотелий-зависимое расслабление), донора NO SNP и форсколина (активатор аденилатциклазы). Вместе с тем ингибиторы ЭТЦ митохондрий несколько уменьшали сократительные реакции артерий в ответ на норадреналин, что указывает на возможное просократительное влияние АФК в ГМК бедренной артерии куриных эмбрионов при активации внутриклеточных сигнальных путей агонистами мембранных рецепторов [94].
Следует отметить, что фетальный фенотип сосудистой реакции на гипоксию проявляется и в течение некоторого времени после рождения. Было показано, что изолированные артерии брыжейки 3-дневных поросят также сокращаются при снижении содержания O2 в окружающей среде, тогда как в возрасте 35 дней сокращение сменяется расслаблением [95]. Как и у плодов овец, гипоксическое сужение артерий новорожденных поросят исчезает после блокады синтеза NO, а также после удаления эндотелия, то есть связано с инактивацией эндотелиального NO.
Не исключено, что вазомоторное влияние АФК может сохраняться и после третьего дня постнатального развития, особенно у млекопитающих, детеныши которых рождаются сравнительно незрелыми. Результаты работ на культурах ГМК, выделенных из системных артерий человека и лабораторных грызунов, демонстрируют важную роль АФК в формировании сократительного фенотипа ГМК [10, 11]. Следует отметить, что артерии головного мозга [96] и кожи [19] 2‑недельных крысят по содержанию сократительных и регуляторных белков, маркирующих сократительный фенотип ГМК, еще значительно отличаются от артерий взрослых крыс. Логично предположить, что в этом возрасте у крыс может проявляться участие АФК в регуляции тонуса периферических сосудов.
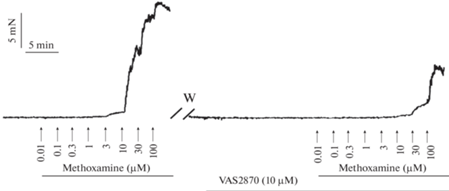
Действительно, по нашим данным, ингибитор NOX VAS2870 существенно ослабляет сократительные ответы подкожной артерии крысят в возрасте двух недель (рис. 3). Это говорит о том, что продуцируемые NOX АФК обладают выраженным проконстрикторным влиянием в сосудистом русле кожи у крыс, по крайней мере, в первые две недели после рождения. Учитывая, что у 1–2-недельных крысят [97] кожный кровоток составляет до 20% сердечного выброса, вазомоторное влияние АФК может проявляться у них и на системном уровне. Безусловно, для ответа на вопрос о механизмах влияния АФК на тонус периферических сосудов в период раннего постнатального онтогенеза необходимы дальнейшие исследования. Подсказками на этом сложном пути могут служить характерные для системных артерий развивающегося организма особенности функционирования вазомоторных механизмов [12, 13, 18, 19], которые могут подвергаться регуляции со стороны АФК [2, 3].
Рис. 3.
Оригинальная запись эксперимента на подкожной артерии крысенка в возрасте 2-х недель. Приведены две зависимости “концентрация–эффект” на агонист α1‑адренорецепторов метоксамин (methoxamine), вторая из зависимостей была получена в присутствии ингибитора NOX VAS2870. Инкубация препарата с VAS2870 (10 мкМ) приводит к значительному ослаблению сократительных ответов. W – washout (отмывка).
ЗАКЛЮЧЕНИЕ
Итак, важная роль АФК в регуляции тонуса сосудов в период раннего постнатального онтогенеза не вызывает сомнений, однако характер их вазомоторного влияния может различаться в легочных и системных сосудах, а также на разных стадиях онтогенеза. В перинатальном онтогенезе (на поздней стадии внутриутробного развития и в течение первых часов и суток после рождения) во всех отделах сосудистой системы преобладает констрикторное влияние АФК, а на более поздних этапах знак их влияния может изменяться.
Индуцируемое нормоксией повышение продукции АФК обеспечивает сокращение АП, необходимое для направления крови к легким после рождения. В легочном круге новорожденного организма действием АФК объясняется ослабление реакций эндотелий-зависимого расслабления в результате снижения биодоступности NO. Мы полагаем, что это отражает “следовое” влияние АФК в первые дни жизни: как известно, они способствуют поддержанию высокого сопротивления легочных сосудов в пренатальный период [57]. Механизмы этого явления связаны с функционированием ферментов, обеспечивающих синтез и деградацию АФК и, вероятно, видоспецифичны (в том числе, в связи с разной степенью зрелости организма на момент рождения). Низкая биодоступность NO в легочных артериях новорожденных кроликов по большей части связана с низкой экспрессией/активностью антиоксидантных систем (в частности, SOD). Поскольку в легких человека и грызунов содержание SOD также растет по мере взросления, у этих видов может работать сходный механизм снижения биодоступности NO в период новорожденности. С другой стороны, у новорожденных поросят низкая биодоступность NO может быть связана с высокой продукцией АФК, в частности, как побочных продуктов локализованной в ГМК ЦОГ-1. Подобные условия создают риск развития патологических состояний, например, кислородно-радикального заболевания новорожденных (“oxygen radical disease in newborn”) [64]. Возможно, в качестве компенсации у новорожденных животных сформировался механизм защиты NO от разрушения под действием АФК, проявляющийся в большей экспрессии и функциональном вкладе SOD3 внутри клетки, а не во внеклеточном пространстве, как у зрелых животных.
На более поздних этапах онтогенеза (в возрасте от 1-ой до 4-х недель) АФК, в частности, H2O2, напротив, могут принимать непосредственное участие в реализации эндотелий-зависимого расслабления легочных сосудов. Иными словами, влияние АФК служит одним из механизмов постепенного увеличения способности легочных сосудов к дилатации, что необходимо для снижения давления в малом круге кровообращения. Данный факт необходимо учитывать ввиду часто применяемой в клинике антиоксидантной терапии в ранний постнатальный период [98, 99].
Наконец, в системных сосудах на поздних стадиях внутриутробного развития АФК обеспечивают важнейшую защитную реакцию от гипоксии, сопровождающей процесс родов. Гипоксия напрямую вызывает сокращение периферических сосудов плода, что способствует перераспределению крови к головному мозгу, тем самым защищая его от повреждающего гипоксического влияния. Доказано, что данный процесс происходит с участием АФК. АФК сохраняют вазомоторное влияние в периферических системных сосудах и на более поздних стадиях раннего постнатального онтогенеза, однако этот вопрос требует дальнейших исследований.
Список литературы
Brown DI, Griendling KK (2015) Regulation of signal transduction by reactive oxygen species in the cardiovascular system. Circ Res 116: 531–549. https://doi.org/10.1161/CIRCRESAHA.116.303584
Knock GA (2019) NADPH oxidase in the vasculature: Expression, regulation and signalling pathways; role in normal cardiovascular physiology and its dysregulation in hypertension. Free Radic Biol Med 145: 385–427. https://doi.org/10.1016/j.freeradbiomed.2019.09.029
Tejero J, Shiva S, Gladwin MT (2019) Sources of vascular nitric oxide and reactive oxygen species and their regulation. Physiol Rev 99: 311–379. https://doi.org/10.1152/physrev.00036.2017
Incalza MA, D’Oria R, Natalicchio A, Perrini S, Laviola L, Giorgino F (2018) Oxidative stress and reactive oxygen species in endothelial dysfunction associated with cardiovascular and metabolic diseases. Vascul Pharmacol 100: 1–19. https://doi.org/10.1016/j.vph.2017.05.005
Zhang Y, Murugesan P, Huang K, Cai H (2020) NADPH oxidases and oxidase crosstalk in cardiovascular diseases: novel therapeutic targets. Nat Rev Cardiol 17: 170–194. https://doi.org/10.1038/s41569-019-0260-8
Borzykh AA, Shvetsova AA, Kuzmin IV, Buravkov SV, Gaynullina DK, Tarasova OS (2021) The Role of Reactive Oxygen Species in the Tone Regulation of Respiratory and Locomotor Muscle Arteries of the Rat. Moscow Univ Biol Sci Bull 76: 111–117. https://doi.org/10.3103/S0096392521030020
Bedard K, Krause KH (2007) The NOX family of ROS-generating NADPH oxidases: Physiology and pathophysiology. Physiol Rev 87: 245–313. https://doi.org/10.1152/physrev.00044.2005
Mittal M, Urao N, Hecquet CM, Zhang M, Sudhahar V, Gao XP, Komarova Y, Ushio-Fukai M, Malik AB (2015) Novel role of reactive oxygen species-activated trp melastatin channel-2 in mediating angiogenesis and postischemic neovascularization. Arterioscler Thromb Vasc Biol 35: 877–887. https://doi.org/10.1161/ATVBAHA.114.304802
Chen C, Li L, Zhou HJ, Min W (2017) The role of NOX4 and TRX2 in angiogenesis and their potential cross-talk. Antioxidants 6(2): 42. https://doi.org/10.3390/antiox6020042
Clempus RE, Sorescu D, Dikalova AE, Pounkova L, Jo P, Sorescu GP, Lassègue B, Griendling KK (2007) Nox4 is required for maintenance of the differentiated vascular smooth muscle cell phenotype. Arterioscler Thromb Vasc Biol 27: 42–48. https://doi.org/10.1161/01.ATV.0000251500.94478.18
Xiao Q, Luo Z, Pepe AE, Margariti A, Zeng L, Xu Q (2009) Embryonic stem cell differentiation into smooth muscle cells is mediated by Nox4-produced H2O2. Am J Physiol – Cell Physiol 296(4): C711–C723. https://doi.org/10.1152/ajpcell.00442.2008
Shvetsova AA, Gaynullina DK, Tarasova OS, Schubert R (2021) Remodeling of Arterial Tone Regulation in Postnatal Development: Focus on Smooth Muscle Cell Potassium Channels. Int J Mol Sci 22: 5413. https://doi.org/10.3390/ijms22115413
Gaynullina DK, Schubert R, Tarasova OS (2019) Changes in endothelial nitric oxide production in systemic vessels during early ontogenesis—A key mechanism for the perinatal adaptation of the circulatory system. Int J Mol Sci 20: 1–12. https://doi.org/10.3390/ijms20061421
Evans AM, Osipenko ON, Haworth SG, Gurney AM (1998) Resting potentials and potassium currents during development of pulmonary artery smooth muscle cells. Am J Physiol 275: H887–H899.
Morecroft I, MacLean MR (1998) Developmental changes in endothelium-dependent vasodilation and the influence of superoxide anions in perinatal rabbit pulmonary arteries. Br J Pharmacol 125: 1585–1593. https://doi.org/10.1038/sj.bjp.0702217
Kolber KA, Gao Y, Raj JU (2000) Maturational changes in endothelium-derived nitric oxide-mediated relaxation of ovine pulmonary arteries. Biol Neonate 77: 123–130. https://doi.org/10.1159/000014206
Belik J, Kerc E, Pato MD (2006) Rat pulmonary arterial smooth muscle myosin light chain kinase and phosphatase activities decrease with age. Am J Physiol – Lung Cell Mol Physiol 290: 509–516. https://doi.org/10.1152/ajplung.00145.2005
Mochalov SV, Tarasova NV, Kudryashova TV, Gaynullina DK, Kalenchuk VU, Borovik AS, Vorotnikov AV, Tarasova OS, Schubert R (2018) Higher Ca2+-sensitivity of arterial contraction in 1-week-old rats is due to a greater Rho-kinase activity. Acta Physiol 12: e13044. https://doi.org/10.1111/apha.13044
Puzdrova VA, Kudryashova TV, Gaynullina DK, Mochalov SV, Aalkjaer C, Nilsson H, Vorotnikov AV, Schubert R, Tarasova OS (2014) Trophic action of sympathetic nerves reduces arterial smooth muscle Ca2+ sensitivity during early post-natal development in rats. Acta Physiol 212: 128–141. https://doi.org/10.1111/apha.12331
Murphy MP (2009) How mitochondria produce reactive oxygen species. Biochem J 417: 1–13. https://doi.org/10.1042/BJ20081386
Han D, Antunes F, Canali R, Rettori D, Cadenas E (2003) Voltage-dependent anion channels control the release of the superoxide anion from mitochondria to cytosol. J Biol Chem 278: 5557–5563. https://doi.org/10.1074/jbc.M210269200
Veit F, Pak O, Egemnazarov B, Roth M, Kosanovic D, Seimetz M, Sommer N, Ghofrani HA, Seeger W, Grimminger F, Brandes RP, Schermuly RT, Weissmann N (2013) Function of NADPH oxidase 1 in pulmonary arterial smooth muscle cells after monocrotaline-induced pulmonary vascular remodeling. Antioxid Redox Signal 19: 2213–2231. https://doi.org/10.1089/ars.2012.4904
Hawkins BJ, Madesh M, Kirkpatrick CJ, Fisher AB (2007) Superoxide Flux in Endothelial Cells via the Chloride Channel-3 Mediates Intracellular Signaling. Mol Biol Cell 18: 2002–2012. https://doi.org/10.1091/mbc.e06-09-0830
Bienert GP, Møller ALB, Kristiansen KA, Schulz A, Møller IM, Schjoerring JK, Jahn TP (2007) Specific aquaporins facilitate the diffusion of hydrogen peroxide across membranes. J Biol Chem 282: 1183–1192. https://doi.org/10.1074/jbc.M603761200
Al Ghouleh I, Frazziano G, Rodriguez AI, Csányi G, Maniar S, St Croix CM, Kelley EE, Egaña LA, Song GJ, Bisello A, Lee YJ, Pagano PJ (2013) Aquaporin 1, Nox1, and Ask1 mediate oxidant-induced smooth muscle cell hypertrophy. Cardiovasc Res 97: 134–142. https://doi.org/10.1093/cvr/cvs295
Chen F, Pandey D, Chadli A, Catravas JD, Chen T, Fulton DJR (2011) Hsp90 regulates NADPH oxidase activity and is necessary for superoxide but not hydrogen peroxide production. Antioxid Redox Signal 14: 2107–2119. https://doi.org/10.1089/ars.2010.3669
Fukai T, Ushio-Fukai M (2011) Superoxide dismutases: Role in redox signaling, vascular function, and diseases. Antioxid Redox Signal 15: 1583–1606. https://doi.org/10.1089/ars.2011.3999
Snetkov VA, Smirnov SV, Kua J, Aaronson PI, Ward JPT, Knock GA (2011) Superoxide differentially controls pulmonary and systemic vascular tone through multiple signalling pathways. Cardiovasc Res 89: 214–224. https://doi.org/10.1093/cvr/cvq275
Kendrick DJ, Mishra RC, John CM, Zhu HL, Braun AP (2022) Effects of Pharmacological Inhibitors of NADPH Oxidase on Myogenic Contractility and Evoked Vasoactive Responses in Rat Resistance Arteries. Front Physiol 12: 1–17. https://doi.org/10.3389/fphys.2021.752366
Jin L, Ying Z, Webb RC (2004) Activation of Rho/Rho kinase signaling pathway by reactive oxygen species in rat aorta. Am J Physiol – Hear Circ Physiol 287: 1495–1500. https://doi.org/10.1152/ajpheart.01006.2003
Li L, Lai EY, Wellstein A, Welch WJ, Wilcox CS (2016) Differential effects of superoxide and hydrogen peroxide on myogenic signaling, membrane potential, and contractions of mouse renal afferent arterioles. Am J Physiol – Renal Physiol 310: F1197–F1205. https://doi.org/10.1152/ajprenal.00575.2015
Ding Y, Winters A, Ding M, Graham S, Akopova I, Muallem S, Wang Y, Hong JH, Gryczynski Z, Yang SH, Birnbaumer L, Ma R (2011) Reactive oxygen species-mediated TRPC6 protein activation in vascular myocytes, a mechanism for vasoconstrictor-regulated vascular tone. J Biol Chem 286: 31799–31809. https://doi.org/10.1074/jbc.M111.248344
Leung HS, Leung FP, Yao X, Ko WH, Chen ZY, Vanhoutte PM, Huang Y (2006) Endothelial mediators of the acetylcholine-induced relaxation of the rat femoral artery. Vascul Pharmacol 44: 299–308.https://doi.org/10.1016/j.vph.2006.01.010
Gao YJ, Hirota S, Zhang DW, Janssen LJ, Lee RMKW (2003) Mechanisms of hydrogen-peroxide-induced biphasic response in rat mesenteric artery. Br J Pharmacol 138: 1085–1092. https://doi.org/10.1038/sj.bjp.0705147
Santiago E, Contreras C, García-Sacristán A, Sánchez A, Rivera L, Climent B, Prieto D (2013) Signaling pathways involved in the H2O2-induced vasoconstriction of rat coronary arteries. Free Radic Biol Med 60: 136–146. https://doi.org/10.1016/j.freeradbiomed.2013.02.014
Sotníková R (1998) Investigation of the mechanisms underlying H2O2-evoked contraction in the isolated rat aorta. Gen Pharmacol 31: 115–119. https://doi.org/10.1016/S0306-3623(97)00392-3
Vogel PA, Yang X, Moss NG, Arendshorst WJ (2015) Superoxide Enhances Ca2+ Entry Through L-Type Channels in the Renal Afferent Arteriole. Hypertension 66: 374–381. https://doi.org/10.1161/HYPERTENSIONAHA.115.05274
Hu Q, Zheng G, Zweier JL, Deshpande S, Irani K, Ziegelstein RC (2000) NADPH oxidase activation increases the sensitivity of intracellular Ca2+ stores to inositol 1,4,5-trisphosphate in human endothelial cells. J Biol Chem 275: 15749–15757. https://doi.org/10.1074/jbc.M000381200
Michelakis ED, Rebeyka I, Wu XC, Nsair A, Thébaud B, Hashimoto K, Dyck JRB, Haromy A, Harry G, Barr A, Archer SL (2002) O2 sensing in the human ductus arteriosus: Regulation of voltage-gated K+ channels in smooth muscle cells by a mitochondrial redox sensor. Circ Res 91: 478–486. https://doi.org/10.1161/01.RES.0000035057.63303.D1
Ushio-Fukai M, Alexander RW, Akers M, Griendling KK (1998) p38 mitogen-activated protein kinase is a critical component of the redox-sensitive signaling pathways activated by angiotensin II. Role in vascular smooth muscle cell hypertrophy. J Biol Chem 273: 15022–15029. https://doi.org/10.1074/jbc.273.24.15022
Touyz RM, Deschepper C, Park JB, He G, Chen X, Neves MFT, Virdis A, Schiffrin EL (2002) Inhibition of mitogen-activated protein/extracellular signal-regulated kinase improves endothelial function and attenuates Ang II-induced contractility of mesenteric resistance arteries from spontaneously hypertensive rats. J Hypertens 20: 1127–1134. https://doi.org/10.1097/00004872-200206000-00024
Knock GA, Snetkov VA, Shaifta Y, Connolly M, Drndarski S, Noah A, Pourmahram GE, Becker S, Aaronson PI, Ward JPT (2009) Superoxide constricts rat pulmonary arteries via Rho-kinase-mediated Ca2+ sensitization. Free Radic Biol Med 46: 633–642. https://doi.org/10.1016/j.freeradbiomed.2008.11.015
Mackay CE, Knock GA (2015) Control of vascular smooth muscle function by Src-family kinases and reactive oxygen species in health and disease. J Physiol 593: 3815–3828. https://doi.org/10.1113/jphysiol.2014.285304
Burgoyne JR, Prysyazhna O, Rudyk O, Eaton P (2012) CGMP-dependent activation of protein kinase g precludes disulfide activation: Implications for blood pressure control. Hypertension 60: 1301–1308. https://doi.org/10.1161/HYPERTENSIONAHA.112.198754
Zhang DX, Borbouse L, Gebremedhin D, Mendoza SA, Zinkevich NS, Li R, Gutterman DD (2012) H2O2-induced dilation in human coronary arterioles: Role of protein kinase G dimerization and large-conductance Ca2+-activated K+ channel activation. Circ Res 110: 471–480. https://doi.org/10.1161/CIRCRESAHA.111.258871
Гайнуллина ДК, Кирюхина ОО, Тарасова ОС (2013) Оксид азота в эндотелии сосудов: регуляция продукции и механизмы действия. Успехи физиол наук 44: 88–102. [Gainullina DK, Kiryukhina OO, Tarasova OS (2013) Nitric oxide in the vascular endothelium: regulation of production and mechanisms of action. Uspekhi fiziol nauk 44: 88–102. (In Russ)].
McMurphy DM, Heymann MA, Rudolph AM, Melmon KL (1972) Developmental changes in constriction of the ductus arteriosus: Responses to oxygen and vasoactive agents in the isolated ductus arteriosus of the fetal lamb. Pediatr Res 6: 231–238. https://doi.org/10.1203/00006450-197204000-00004
Olschewski A, Hong Z, Peterson DA, Nelson DP, Porter VA, Weir EK (2004) Opposite effects of redox status on membrane potential, cytosolic calcium, and tone in pulmonary arteries and ductus arteriosus. Am J Physiol – Lung Cell Mol Physiol 286: 15–22. https://doi.org/10.1152/ajplung.00372.2002
Cogolludo AL, Moral-Sanz J, Van Der Sterren S, Frazziano G, Van Cleef ANH, Menéndez C, Zoer B, Moreno E, Roman A, Pérez-Vizcaino F, Villamor E (2009) Maturation of O2 sensing and signaling in the chicken ductus arteriosus. Am J Physiol - Lung Cell Mol Physiol 297: 619–630. https://doi.org/10.1152/ajplung.00092.2009
Villamor E, Moreno L, Mohammed R, Pérez-Vizcaíno F, Cogolludo A (2019) Reactive oxygen species as mediators of oxygen signaling during fetal-to-neonatal circulatory transition. Free Radic Biol Med 142: 82–96. https://doi.org/10.1016/j.freeradbiomed.2019.04.008
Reeve HL, Tolarova S, Nelson DP, Archer S, Kenneth Weir E (2001) Redox control of oxygen sensing in the rabbit ductus arteriosus. J Physiol 533: 253–261. https://doi.org/10.1111/j.1469-7793.2001.0253b.x
Tarasova OS, Gaynullina DK (2017) Rho-kinase as a key participant in the regulation of vascular tone in normal circulation and vascular disorders. Arter Hypertens 23: 383–394. https://doi.org/10.18705/1607-419X-2017-23-5-383-394
Kajimoto H, Hashimoto K, Bonnet SN, Haromy A, Harry G, Moudgil R, Nakanishi T, Rebeyka I, Thébaud B, Michelakis ED, Archer SL (2007) Oxygen activates the rho/rho-kinase pathway and induces RhoB and ROCK-1 expression in human and rabbit ductus arteriosus by increasing mitochondria-derived reactive oxygen species: A newly recognized mechanism for sustaining ductal constriction. Circulation 115: 1777–1788. https://doi.org/10.1161/CIRCULATIONAHA.106.649566
Dzialowski EM (2018) Comparative physiology of the ductus arteriosus among vertebrates. Semin Perinatol 42: 203–211. https://doi.org/10.1053/j.semperi.2018.05.002
Bergwerff M, DeRuiter MC, Gittenberger-De Groot AC (1999) Comparative anatomy and ontogeny of the ductus arteriosus, a vascular outsider. Anat Embryol (Berl) 200: 559–571. https://doi.org/10.1007/s004290050304
Dumitru CA, Zhang Y, Li X, Gulbins E (2007) Ceramide: A novel player in reactive oxygen species-induced signaling? Antioxid Redox Signal 9: 1535–1540. https://doi.org/10.1089/ars.2007.1692
Moreno L, Moral-Sanz J, Morales-Cano D, Barreira B, Moreno E, Ferrarini A, Pandolfi R, Ruperez FJ, Cortijo J, Sanchez-Luna M, Villamor E, Perez-Vizcaino F, Cogolludo A (2014) Ceramide mediates acute oxygen aensing in vascular tissues. Antioxid Redox Signal 20: 1–14. https://doi.org/10.1089/ars.2012.4752
Frazziano G, Moreno L, Moral-Sanz J, Menendez C, Escolano L, Gonzalez C, Villamor E, Alvarez-Sala JL, Cogolludo AL, Perez-Vizcaino F (2011) Neutral sphingomyelinase, NADPH oxidase and reactive oxygen species. Role in acute hypoxic pulmonary vasoconstriction. J Cell Physiol 226: 2633–2640. https://doi.org/10.1002/jcp.22611
Clyman RI, Waleh N, Kajino H, Roman C, Mauray F (2007) Calcium-dependent and calcium-sensitizing pathways in the mature and immature ductus arteriosus. Am J Physiol – Regul Integr Comp Physiol 293: 1650–1656. https://doi.org/10.1152/ajpregu.00300.2007
Thébaud B, Wu XC, Kajimoto H, Bonnet S, Hashimoto K, Michelakis ED, Archer SL (2008) Developmental absence of the O2 sensitivity of L-type calcium channels in preterm ductus arteriosus smooth muscle cells impairs O2 constriction contributing to patent ductus arteriosus. Pediatr Res 63: 176–181. https://doi.org/10.1203/PDR.0b013e31815ed059
Waleh N, Reese J, Kajino H, Roman C, Seidner S, McCurnin D, Clyman RI (2009) Oxygen-induced tension in the sheep ductus arteriosus: Effects of gestation on potassium and calcium channel regulation. Pediatr Res 65: 285–290. https://doi.org/10.1203/PDR.0b013e31819746a1
Frank L, Groseclose EE (1984) Preparation for birth into an O2-rich environment: The antioxidant enzymes in the developing rabbit lung. Pediatr Res 18: 240–244. https://doi.org/10.1203/00006450-198403000-00004
Friel JK, Friesen RW, Harding SV, Roberts LJ (2004) Evidence of oxidative stress in full-term healthy infants. Pediatr Res 56: 878–882. https://doi.org/10.1203/01.PDR.0000146032.98120.43
Perez M, Robbins ME, Revhaug C, Saugstad OD (2019) Oxygen radical disease in the newborn, revisited: Oxidative stress and disease in the newborn period. Free Radic Biol Med 142: 61–72. https://doi.org/10.1016/j.freeradbiomed.2019.03.035
Shaito A, Aramouni K, Assaf R, Parenti A, Orekhov A, Yazbi A El, Pintus G, Eid AH (2022) Oxidative Stress-Induced Endothelial Dysfunction in Cardiovascular Diseases. Front Biosci – Landmark 27(3): 105. https://doi.org/10.31083/j.fbl2703105
Wedgwood S, Steinhorn RH (2014) Role of reactive oxygen species in neonatal pulmonary vascular disease. Antioxid Redox Signal 21: 1926–1942. https://doi.org/10.1089/ars.2013.5785
Villamor E, Kessels CGA, Fischer MAJ, Bast A, De Mey JGR, Blanco CE (2003) Role of superoxide anion on basal and stimulated nitric oxide activity in neonatal piglet pulmonary vessels. Pediatr Res 54: 372–381. https://doi.org/10.1203/01.PDR.0000077481.15081.C8
Belik J, Jankov RP, Pan J, Tanswell AK (2004) Peroxynitrite inhibits relaxation and induces pulmonary artery muscle contraction in the newborn rat. Free Radic Biol Med 37: 1384–1392. https://doi.org/10.1016/j.freeradbiomed.2004.07.029
Nozik-Grayck EVA, Dieterle CS, Piantadosi CA, Enghild JJ, Oury TD (2000) Secretion of extracellular superoxide dismutase in neonatal lungs. Am J Physiol – Lung Cell Mol Physiol 279: 977–984. https://doi.org/10.1152/ajplung.2000.279.5.l977
Asikainen TM, Raivio KO, Saksela M, Kinnula VL (1998) Expression and developmental profile of antioxidant enzymes in human lung and liver. Am J Respir Cell Mol Biol 19: 942–949. https://doi.org/10.1165/ajrcmb.19.6.3248
Berkelhamer SK, Kim GA, Radder JE, Wedgwood S, Czech L, Steinhorn RH, Schumacker PT (2013) Developmental differences in hyperoxia-induced oxidative stress and cellular responses in the murine lung. Free Radic Biol Med 61: 51–60. https://doi.org/10.1016/j.freeradbiomed.2013.03.003
Dennis KE, Aschner JL, Milatovic D, Schmidt JW, Aschner M, Kaplowitz MR, Zhang Y, Fike CD (2009) NADPH oxidases and reactive oxygen species at different stages of chronic hypoxia-induced pulmonary hypertension in newborn piglets. Am J Physiol – Lung Cell Mol Physiol 297: 596–607. https://doi.org/10.1152/ajplung.90568.2008
Fike CD, Slaughter JC, Kaplowitz MR, Zhang Y, Aschner JL (2008) Reactive oxygen species from NADPH oxidase contribute to altered pulmonary vascular responses in piglets with chronic hypoxia-induced pulmonary hypertension. Am J Physiol – Lung Cell Mol Physiol 295: 881–888. https://doi.org/10.1152/ajplung.00047.2008
Savla SR, Laddha AP, Kulkarni YA (2021) Pharmacology of apocynin: a natural acetophenone. Drug Metab Rev 53: 542–562. https://doi.org/10.1080/03602532.2021.1895203
Heumüller S, Wind S, Barbosa-Sicard E, Schmidt HHHW, Busse R, Schröder K, Brandes RP (2008) Apocynin is not an inhibitor of vascular NADPH oxidases but an antioxidant. Hypertension 51: 211–217. https://doi.org/10.1161/HYPERTENSIONAHA.107.100214
Fike CD, Dikalova A, Slaughter JC, Kaplowitz MR, Zhang Y, Aschner JL (2013) Reactive oxygen species-reducing strategies improve pulmonary arterial responses to nitric oxide in piglets with chronic hypoxia-induced pulmonary hypertension. Antioxid Redox Signal 18: 1727–1738. https://doi.org/10.1089/ars.2012.4823
Mata-Greenwood E, Jenkins C, Farrow KN, Konduri GG, Russell JA, Lakshminrusimha S, Black SM, Steinhorn RH (2006) eNOS function is developmentally regulated: Uncoupling of eNOS occurs postnatally. Am J Physiol – Lung Cell Mol Physiol 290: 232–241. https://doi.org/10.1152/ajplung.00393.2004
Fike CD, Aschner JL, Zhang Y, Kaplowitz MR (2004) Impaired NO signaling in small pulmonary arteries of chronically hypoxic newborn piglets. Am J Physiol – Lung Cell Mol Physiol 286: 1244–1254. https://doi.org/10.1152/ajplung.00345.2003
Rao GN, Runge MS, Alexander RW (1995) Hydrogen peroxide activation of cytosolic phospholipase A2 in vascular smooth muscle cells. Biochim Biophys Acta – Mol Cell Res 1265: 67–72. https://doi.org/10.1016/0167-4889(95)91997-Z
Fike CD, Aschner JL, Slaughter JC, Kaplowitz MR, Zhang Y, Pfister SL (2011) Pulmonary arterial responses to reactive oxygen species are altered in newborn piglets with chronic hypoxia-induced pulmonary hypertension. Pediatr Res 70: 136–141. https://doi.org/10.1203/PDR.0b013e3182207ce7
Pérez-Vizcaíno F, López-López JG, Santiago R, Cogolludo A, Zaragozá-Arnáez F, Moreno L, Alonso MJ, Salaices M, Tamargo J (2002) Postnatal maturation in nitric oxide-induced pulmonary artery relaxation involving cyclooxygenase-1 activity. Am J Physiol – Lung Cell Mol Physiol 283: 839–848. https://doi.org/10.1152/ajplung.00293.2001
Smith WL, DeWitt DL, Garavito RM (2000) Cyclooxygenases: Structural, Cellular, and Molecular Biology. Annu Rev Biochem 69: 145–182. https://doi.org/10.1146/annurev.biochem.69.1.145
Hernanz R, Briones AM, Salaices M, Alonso MJ (2014) New roles for old pathways? A circuitous relationship between reactive oxygen species and cyclo-oxygenase in hypertension. Clin Sci 126: 111–121.https://doi.org/10.1042/CS20120651
López-Lópe JG, Pérez-Vizcaino F, Cogolludo AL, Ibarra M, Zaragozá-Arnáez F, Tamargo J (2001) Nitric oxide- and nitric oxide donors-induced relaxation and its modulation by oxidative stress in piglet pulmonary arteries. Br J Pharmacol 133: 615–624. https://doi.org/10.1038/sj.bjp.0704103
Brennan LA, Steinhorn RH, Wedgwood S, Mata-Greenwood E, Roark EA, Russell JA, Black SM (2003) Increased superoxide generation is associated with pulmonary hypertension in fetal lambs: A role for NADPH oxidase. Circ Res 92: 683–691. https://doi.org/10.1161/01.RES.0000063424.28903.BB
Wedgwood S, Steinhorn RH, Bunderson M, William J, Lakshminrusimha S, Brennan LA, Black SM (2005) Increased hydrogen peroxide downregulates soluble guanylate cyclase in the lungs of lambs with persistent pulmonary hypertension of the newborn. Am J Physiol – Lung Cell Mol Physiol 289: 660–666. https://doi.org/10.1152/ajplung.00369.2004
Guo J, Yu X, Liu Y, Lu L, Zhu D, Zhang Y, Li L, Zhang P, Gao Q, Lu X, Sun M (2022) Prenatal hypothyroidism diminished exogenous NO-mediated diastolic effects in fetal rat thoracic aorta smooth muscle via increased oxidative stress. Reprod Toxicol 113: 52–61. https://doi.org/10.1016/j.reprotox.2022.08.009
Giussani DA (2016) The fetal brain sparing response to hypoxia: Physiological mechanisms. J Physiol 594: 1215–1230. https://doi.org/10.1113/JP271099
Sommer N, Strielkov I, Pak O, Weissmann N (2016) Oxygen sensing and signal transduction in hypoxic pulmonary vasoconstriction. Eur Respir J 47: 288–303. https://doi.org/10.1183/13993003.00945-2015
Jackson WF (2016) Arteriolar oxygen reactivity: where is the sensor and what is the mechanism of action? J Physiol 594: 5055–5077. https://doi.org/10.1113/JP270192
Thakor AS, Richter HG, Kane AD, Dunster C, Kelly FJ, Poston L, Giussani DA (2010) Redox modulation of the fetal cardiovascular defence to hypoxaemia. J Physiol 588: 4235–4247. https://doi.org/10.1113/jphysiol.2010.196402
Kane AD, Hansell JA, Herrera EA, Allison BJ, Niu Y, Brain KL, Kaandorp JJ, Derks JB, Giussani DA (2014) Xanthine oxidase and the fetal cardiovascular defence to hypoxia in late gestation ovine pregnancy. J Physiol 592: 475–489. https://doi.org/10.1113/jphysiol.2013.264275
Brinks L, Moonen RMJ, Moral-Sanz J, Barreira B, Kessels L, Perez-Vizcaino F, Cogolludo A, Villamor E (2016) Hypoxia-induced contraction of chicken embryo mesenteric arteries: Mechanisms and developmental changes. Am J Physiol - Regul Integr Comp Physiol 311: R858–R869. https://doi.org/10.1152/ajpregu.00461.2015
Zoer B, Cogolludo AL, Perez-Vizcaino F, De Mey JGR, Blanco CE, Villamor E (2010) Hypoxia sensing in the fetal chicken femoral artery is mediated by the mitochondrial electron transport chain. Am J Physiol - Regul Integr Comp Physiol 298: 1026–1034. https://doi.org/10.1152/ajpregu.00500.2009
Nankervis CA, Miller CE (1998) Developmental differences in response of mesenteric artery to acute hypoxia in vitro. Am J Physiol – Gastrointest Liver Physiol 274(4): G694–G699. https://doi.org/10.1152/ajpgi.1998.274.4.g694
Charles SM, Zhang L, Cipolla MJ, Buchholz JN, Pearce WJ (2010) Roles of cytosolic Ca2+ concentration and myofilament Ca2+ sensitization in age-dependent cerebrovascular myogenic tone. Am J Physiol - Hear Circ Physiol 299: 1034–1044. https://doi.org/10.1152/ajpheart.00214.2010
Štulcová B (1977) Postnatal Development of Cardiac Output Distribution Measured by Radioactive Microspheres in Rats. Neonatology 32: 119–124. https://doi.org/10.1159/000241004
Jankov RP, Negus A, Keith TA (2001) Antioxidants as therapy in the newborn: Some words of caution. Pediatr Res 50: 681–687. https://doi.org/10.1203/00006450-200112000-00009
Lee JW, Davis JM (2011) Future applications of antioxidants in premature infants. Curr Opin Pediatr 23: 161–166. https://doi.org/10.1097/MOP.0b013e3283423e51
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


