Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 12, стр. 1780-1798
Сродство гемоглобина к кислороду при коронавирусной инфекции: новые грани известной проблемы
В. В. Зинчук 1, *, Н. В. Глуткина 1
1 Гродненский государственный медицинский университет
Гродно, Беларусь
* E-mail: zinchuk@grsmu.by
Поступила в редакцию 06.07.2023
После доработки 25.10.2023
Принята к публикации 26.10.2023
- EDN: CIOAUA
- DOI: 10.31857/S0869813923120178
Аннотация
Развитие коронавирусной инфекции препятствует транспорту кислорода к тканям из-за нарушения насыщения гемоглобина в поврежденном легком. Изменение сродства гемоглобина к кислороду, являющееся наиболее важным фактором компенсации кислородной недостаточности при различных патологических состояниях, лежит в основе процессов адаптации к гипоксии. Активно дискуссируется вопрос о значении сдвига кривой диссоциации оксигемоглобина при данной патологии, при которой отмечается ее сдвиг влево в артериальной крови и смещение вправо в венозной, что в условиях развития гипоксического синдрома отражает активацию механизмов компенсации кислородной недостаточности. Изменение ее положения не является специфичной для данной патологии, а определяется степенью выраженности кислородной недостаточности и разбалансированием механизмов кардиореспираторной системы, а также особенностями статуса пациентов и анализируемого образца крови.
ВВЕДЕНИЕ
Среди широкого диапазона адаптационных реакций, проявляющихся на молекулярном, клеточном и системном уровнях физиологической организации, имеет значение кислородсвязывающие свойства крови, которые могут управлять приспособительными реакциями в специфических условиях среды и при различных физиологических потребностях [1].
Гемоглобин является типовым аллостерическим белком, который определяет состояние кислородтранспортной функции (КТФ) крови. Наши представления о структурно-функциональной организации молекулы гемоглобина существенно расширились благодаря работам таких ученых, как Джозеф Баркрофт, Лайнус Полинг, Макс Перутц, Рут и Рейнгольд Бенеши, Эрнст Джаффе, Л.И. Иржак, М.В. Борисюк, М.В. Ненцкий, И.А. Залесский и многие другие. Никакая другая молекула не может быть сравнима по глубине ее познания. Гемоглобин лучше всего изучен среди всех макромолекул, но не выявил еще все свои тайны физиологического характера, не говоря уже об исследованиях на атомарном уровне.
Несмотря на то, что изучение кислородсвязывающих свойств крови имеет долгую историю, в литературе постоянно появляются обзоры по этой тематике и предпринимаются попытки по-новому взглянуть на эту проблему [2–7]. Несмотря на то, что гемоглобин изучен достаточно хорошо, остается еще много нерешенных вопросов, связанных с его функционированием, в частности, c исследованием молекулярных механизмов передачи сигнала от гемоглобина на другие компоненты клетки. Это тесно связано с изучением механизмов адаптации эритроцитов, их повреждений и устойчивости, а также с разработткой методов стабилизации эритроцитов и использованием данных о разных функциональных формах гемоглобина в клинико-биохимической диагностике [8]. Эта проблема приобрела новое звучание в контексте коронавирусной пандемии COVID-19 (COronaVIrus Disease-2019), которую вызывает штамм коронавируса (SARS-CoV-2). В течение последних двух лет в ряде публикаций проводится активная дискуссия о значении сдвига кривой диссоциации оксигемоглобина (КДО) при данной патологии [9–12], обозначена неоднозначность трактовки сдвига ее положения и роль в генезе этой патологии. В связи с этим в данной работе изложена наша точка зрения на эту проблему.
ХАРАКТЕРИСТИКА КРИВОЙ ДИССОЦИАЦИИ ОКСИГЕМОГЛОБИНА
Адаптационные возможности эритроцитов ограничены цитоплазматическими механизмами, в которых гемоглобин играет ключевую роль, а именно, посттрансляционные модификации, стабилизирующие белок в R-конформации, что повышает его сродство к кислороду [8]. Гемоглобин является временным транспортным депо для кислорода и в этом качестве обладает рядом свойств, обеспечивающих как процесс интенсивного образования оксигемоглобина, так и процесс своевременной отдачи О2 [13]. Молекула кислорода модифицирует структуру гемоглобина, формируя кооперативный эффект. Гемоглобин существует в равновесии между оксигенированной (релаксированное R-состояние) и дезоксигенированной (напряженное Т-состояние) формами. В дезоксигенированном состоянии Fe2+ возвышается над остальным порфириновым кольцом, и электростатические силы стабилизируют в пределах тетрамерной молекулы нековалентные связи как внутри одной β-цепи, так и между β-цепью и соседними α-цепями, а присоединение О2 к Fe2+ в оксигемоглобине оказывает воздействие не только на проксимальный гистидин, но и на всю молекулу белка, в результате чего нековалентные связи разрушаются (переход в R состояние) [14].
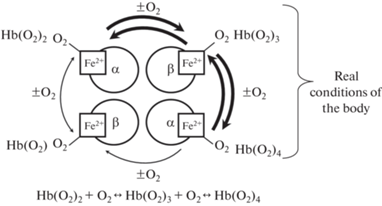
Присоединение кислорода к гемоглобину является ступенчатым: соединение молекулы кислорода с каждым гемом изменяет его конформацию, что обуславливает нелинейную зависимость его насыщения кислородом от парциального давления кислорода (рО2). Процесс связывания кислорода с одной субъединицей гемоглобина влияет на взаимодействие последующих его молекул с другими субъединицами. Следует подчеркнуть, что в организме ни при каких условиях полной деоксигенации крови не наступает. Процессы насыщения крови или ее десатурации осуществляются в пределе Hb(O2)2 ↔ Hb(O2)4 или Hb(O2)3 ↔ Hb(O2)4 (рис. 1), следовательно, различия по содержанию кислорода в артериальном и венозном образцах составляют около одной трети, что является резервом О2, и в случае необходимости позволяет повысить или ограничить его доставку в ткани.
Этот процесс придает КДО особую S-образную форму (рис. 2), что имеет двоякое значение: изменение сродства гемоглобина к кислороду (СГК), обеспечиваемое конкретным белковым окружением гемовой группы, смещает процесс связывания в область концентраций, оптимальных для функционирования этого протеина, и обеспечивает транспорт О2 в ткани в области ограниченной его концентрации.
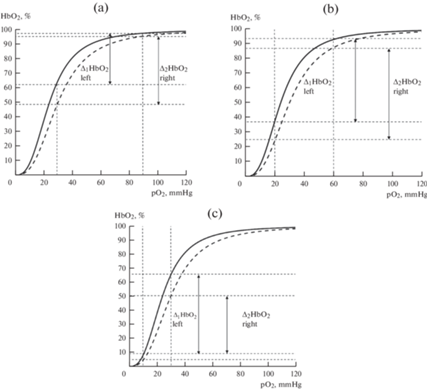
Рис. 2.
Значение сдвига кривой диссоциации оксигемоглобина влево (—) и вправо (- - - - - ) для оксигенации тканей в условиях нормоксии (а), умеренной (b) и глубокой (c) гипоксии.
Положение КДО определяется действием многих факторов, и каждый из них играет определенную роль, за счет чего кривая сдвигается в точке p50 с 16–18 для гемоглобина в чистом растворе до 26–28 мм рт. ст. в цельной крови. СГК есть результат модулирующего действия разных аллостерических эффекторов, таких как H+, Cl–, CO2, органические фосфаты и др., обеспечивающих адаптацию к гипоксии. СГК определяется в значительной степени аллостерическим взаимодействием между гемоглобином и разными модуляторами, которые в совокупности на уровне клеточного компартмента крови образуют внутриэритроцитарную систему регуляции ее кислородсвязывающих свойств. СГК не является статичной функцией данной крови, а представляет собой динамический процесс смещения ее в ту или другую сторону, зависящей, помимо прочих факторов, от выраженности эффекта Вериго–Бора и влияния его основных компонентов: рН, СО2 и других факторов. Следует отметить, что оксигенация гемоглобина является экзотермической реакцией, соответственно при повышении температуры крови происходит снижение СГК и его увеличение при снижении этого параметра.
КДО отражает зависимость между степенью насыщения гемоглобина кислородом и pO2 в состоянии термодинамического равновесия. S-образная конфигурация КДО имеет определенный физиологический смысл, заключающийся в том, что оксигенация крови в легких сохраняется на высоком уровне даже при относительно низком альвеолярном pO2, а ее деоксигенация существенно увеличивается даже при небольшом уменьшении капиллярно-тканевого градиента pO2. Ее горизонтальная часть обеспечивает оксигенацию крови даже при значительном изменении рО2, а ее вертикальный фрагмент обуславливает оксигенацию тканей даже при незначительном изменении рО2 .
КРИТЕРИЙ ОЦЕНКИ СРОДСТВА ГЕМОГЛОБИНА К КИСЛОРОДУ
Для характеристики СГК используют показатель р50 (рО2, при котором кровь насыщается кислородом на 50%). В смешанной венозной крови человека в покое эта величина pО2, обозначаемая p50, колеблется в диапазоне 24.5–30.2 мм рт. ст. При повышении СГК p50 уменьшается (КДО смещается влево), а при снижении – повышается (она сдвигается вправо). Этот показатель, как правило, используется для сравнения функциональной способности различных гемоглобинов, но в организме насыщение гемоглобина кислородом изменяется, как правило, в диапазоне от 96–98% в легких до 40–60% в венозной крови (хотя отдельные молекулы гемопротеида оксигенируются в большей или в меньшей степени).
Положение КДО рассчитывается с помощью уравнения Хилла. Существуют разные методы изучения СГК путем определения всей КДО или одной, двух и более ее точек. Классический метод предполагает приведение проб крови к равновесию с газовыми трехкомпонентными смесями с разным количеством О2 и последующее определение кислорода в этих пробах. Метод требует значительных объемов крови, а из-за необходимости приготовления большого количества газовых смесей, сатурации крови и определения кислорода он остается трудоемким, поэтому в настоящее время применяется редко, хотя считается прецизионным. Для определения p50 наиболее часто используют расчетный или метод “смешивания”.
Mетод “смешивания”, в основе которого лежит принцип соединения разных объемов оксигенированной и деоксигенированной крови для получения пробы крови заданной степени насыщения, отличается высокой информативностью и относительной несложностью в реализации. Данный способ и его различные модификации нашли широкое применение для изучения СГК. Сравнение данного метода с динамическим, проводившимся на крови кролика, подтверждает его высокую информативность и надежность [15]. Более того, его использование также позволяет изучать эффект Вериго–Бора. В последние годы более широко получил распространение метод оценки СГК по показателю р50, определяемого расчетным способом по измеренным значениям рО2 и SO2 крови. Однако этот показатель применим для оценки СГК при значения SO2 в среднем диапазоне, а именно от 30 до 85–90%, т.е. неприемлем для оценки прежде всего артериальных образцов крови.
Был предложен также ряд новых параметров по оценке КТФ крови. Создан новый алгоритм расчета показателей кислородного гомеостаза организма в последних поколениях современных высокоточных многоволновых оксиметров (наиболее известный “Оxygen status algorithm”). В частности, исследователи фирмы “Radiometer” Siggaard-Andersen, Siggaard-Andersen [16] предложили расчет трех новых параметров кислородного обеспечения организма, кислородсвязывающих свойств крови.
Парциальное давление экстракции кислорода (px), т.е. величина pO2, необходимая для экстракции тканями 2.3 ммоль кислорода из 1 л крови. Она идентична величине pvO2 при которой артериовенозная разница по кислороду равна 2.3 ммоль/л. Второй параметр представляет собой содержание экстрагируемого кислорода (сх), величина, описывающая содержание кислорода, экстрагируемого при pvO2 равном 38 мм рт. ст. Также ими был предложен фактор компенсации кислорода (Qх). Его получают как отношение 2.3 ммоль/л кислорода к сх и интерпретируют как величину сердечного выброса, необходимую для обеспечения pvO2, равного 38 мм рт. ст. Эти расчетные параметры характеризуют свойства артериальной крови, и их значения базируются на реальных величинах ее рО2, концентрации “активного” гемоглобина (эквивалента кислородной емкости крови) и СГК.
По мнению Beasley и соавт. [2], для клинической оценки было бы более информативным изображением КДО в модифицированном виде, т.е. лучше ее представлять следующим образом: HbO2 изображать по оси X, а рО2 – по оси Y, что позволило бы не только преодолеть ее преобладающий вид “скользящего наклона”, но и подчеркнуть ее ключевое свойство – поддержание высокого уровня насыщения гемоглобина, несмотря на значительное снижение рО2. И наоборот, относительной стабильности рО2 по мере снижения HbO2, что сохраняет захват О2 гемоглобином несмотря на снижение рО2, и доставку О2 в ткани (т.е. облегчает как захват О2, так и его поступление в ткани). Данный подход не имеет принципиальной новизны, является весьма дискуссионным и может быть оправдан только для лучшего понимания физиологического значения сдвигов КДО.
Очевидна необходимость внедрения в клинических лабораториях методов оценки эритрокринной функции организма, связанных с регуляцией кислородсвязывающей способности гемоглобина, что позволит выбрать наиболее подходящее лечение для конкретного пациента [17].
ЗНАЧЕНИЕ СДВИГА ПОЛОЖЕНИЯ КРИВОЙ ДИССОЦИАЦИИ ОКСИГЕМОГЛОБИНА
СГК критически определяет доступность кислорода в ткани, и его повышение способствует развитию тканевой гипоксии, однако индивидуальные различия p50 не всегда учитываются в клинической практике [18]. Обсуждается вопрос: более высокое или более низкое СГК является более выгодным для организма, когда доступность кислорода ограничена. У лиц с генетическими мутациями в структуре гемоглобина, приводящие к высокому СГК, наблюдается во время гипоксии, покоя и во время физической нагрузки ослабление механизмов регуляции кардиореспираторной системы [7]. Проблема, какое СГК является оптимальным для доставки кислорода тканям при различных условиях, обсуждается и не получила однозначного ответа. У пациентов с нормальным содержанием кислорода, но сниженным сердечным выбросом снижение СГК благоприятно для улучшения доставки кислорода в периферические ткани, однако в условиях гипоксии или при ограниченном потреблении кислорода легкими в кислородном каскаде, увеличение СГК является более полезным [12].
В капиллярах малого круга кровообращения повышенное СГК (сдвиг влево КДО) имеет преимущество, а для большого круга – наоборот. Уменьшение СГК, т.е. сдвиг КДО вправо, повышает отдачу кровью кислорода тканям на уровне капилляров большого круга кровообращения. Снижение СГК (увеличение р50), являющееся наиболее важным фактором компенсации кислородной недостаточности при различных патологических состояниях, лежит в основе процессов адаптации к гипоксии. Увеличение p50 выше физиологических значений благоприятствует росту потока кислорода к тканям преимущественно в условиях нормоксии или умеренной гипоксии (рис. 2a, b). При выраженной гипоксии сдвиг КДО влево увеличивает поток кислорода в ткани организма (рис. 2c), что является адаптивной реакцией организма при различных состояниях с развитием кислородной недостаточности.
Оценка физиологического значения сдвига КДО влево для организма является неоднозначной, несмотря на большое число исследований. Известный специалист в области физиологии Samaja [19] проанализировал несколько десятков статей, посвященных этой проблеме, и указал на различные эффекты сдвига КДО вправо и влево по физиологической значимости. Повышение СГК затрудняет десатурацию крови в микроциркулярном русле большого круга кровообращения, но способствует насыщению кислородом в капиллярах легкого. Высокое СГК определено как потенциально выгодная адаптация к высоте, но с точки зрения кардиореспираторной системы предполагается, что оно полезно для организма при действии гипоксии как в покое, так и при физической нагрузке. Во время гипоксии у лиц с высоким СГК наблюдается уменьшение частоты сердечных сокращений, снижение образования эритропоэтина и более высокое насыщение O2 артериальной крови в покое по сравнению с тем, у кого обычное СГК [7]. Эффект изменения р50 (CГК) на величину артерио-венозной разницы по оксигемоглобину аргументируется расчетами, представленными в табл. 1. Как видим, значение артерио-венозной разницы в условиях нормоксии или умеренной гипоксии наибольшее при увеличении р50, но в условиях выраженной гипоксии при уменьшении р50 оно, наоборот, увеличивается [5].
Таблица 1.
Эффект изменения значения р50 для артериальной и капиллярной крови при различных значениях HbО2 и рО2 [5, в нашей модификации]
| Параметр | Нормоксия | Гипоксия | Нормоксия | Гипоксия | Нормоксия | Гипоксия |
|---|---|---|---|---|---|---|
| р50арт, мм рт. ст. |
24 (сдвиг КДО влево) |
26.8 | 30 (сдвиг КДО вправо) |
|||
| рО2арт, мм рт. ст. |
90 | 45 | 90 | 45 | 90 | 45 |
| HbО2арт, % | 97.8 | 85.2 | 96.9 | 80.7 | 95.8 | 75.2 |
| р50кап, мм рт. ст. |
26.8 (сдвиг КДО влево) |
30 | 33.5 (сдвиг КДО вправо) |
|||
| рО2кап, мм рт. ст. |
30 | 15 | 30 | 15 | 30 | 15 |
| HbO2кап, % | 57.4 | 19.4 | 49.9 | 15.4 | 42,2 | 13.1 |
| ΔHbO2, % | 40.4 | 65.8 | 47 | 65.3 | 53.6 | 62.1 |
Изменения СГК отражает необходимость организма приспосабливаться к постоянно меняющимся потребностям тканей в кислороде, а также степень развивающейся гипоксии и выраженность реакции адаптации к ней.
СРОДСТВО ГЕМОГЛОБИНА К КИСЛОРОДУ ПРИ COVID-19
При COVID-19 наблюдается существенное нарушение кислородного обеспечения организма. Эта патология характеризуется выраженными признаками кислородной недостаточности. Серьезную проблему представляет острый респираторный дистресс-синдром при развитии тяжелой вирусной пневмонии, обладающий молниеносной скоростью развития и высокой летальностью, для которого характерно первичное поражение бронхо-легочной системы и дыхательная недостаточность [20]. У пациентов данной категории отмечается уменьшение насыщения артериальной крови (менее 93.0% в 55.7% случаев) [21]. Гипоксия и ацидоз приводят к дисрегуляции иммунной системы, разнонаправленным про- и противовоспалительным реакциям, в результате чего развивается “цитокиновый шторм” [22].
Патологически измененные легочные сосуды при COVID-19 вызывают увеличение времени газообмена кислорода в капиллярах (явление “диффузионного ограничения”), в связи с чем вентиляционно-перфузионное распределение, величина поражения легкого часто не пропорциональны степени тяжести гипоксемии [23]. Выдвинута гипотеза о потенциальной полезности так называемого “гипоксического кондиционирования” для активации образования индуцируемого гипоксического фактора-1α, как механизма цитозащитной сигнализации, улучшающего функционирование жизненно важных органов при этой патологии [24].
Вентиляционно-перфузионное несоответствие, начиная от шунтов и заканчивая вентиляцией физиологического альвеолярного мертвого пространства, является центральным фактором в генезе гипоксии при этой патологии [25]. При COVID-19 у многих пациентов в состоянии покоя наблюдается заметный разрыв между глубиной гипоксемии и степенью дыхательной недостаточности, т.е. развивается “счастливая” (“тихая”) гипоксемия с быстрым ухудшением состояния [26]. Вирус SARS-CoV-2, в первую очередь, поражает легочную ткань и нарушает газообмен, что приводит к острому, респираторному дистресс-синдрому и системной гипоксии, в связи с чем исследование молекулярных механизмов позволит разработать новые таргетные методы лечения COVID-19 [24]. В условиях данного заболевания претерпевают серьезные изменения практически все составляющие микроциркуляторно-тканевых систем, от поражения сосудистой стенки до активации коагуляционного потенциала крови, изменения реологических свойств крови, морфологических и структурных нарушений в мембранах эритроцитов и их кислородсвязывающей функции [27].
При COVID-19 претерпевают серьезные изменения практически все составляющие микроциркуляторно-тканевых систем, начиная от сосудистой стенки, коагуляционного потенциала крови, ее реологических свойств, структуры мембраны эритроцитов и их кислородтранспортной функции [27]. При коронавирусной инфекции так же, как и при многих воспалительных процессах, происходят классические патофизиологические изменения: нарушение микроциркуляции, ацидоз, повреждение мембраны эритроцитов, ведущие к развитию анемии. В ее генезе имеет значение снижение содержания ферритина, ответственного за создание депо железа в организме, повышенный расход железа, нарушение гемопоэза [28]. Также важная роль в этом принадлежит пептиду острой фазы воспаления – гепцидину, который индуцирует деградацию ферропортина и блокирует избыточное поступление железа, необходимого для синтеза молодых эритроцитов и поддержания должного количества гемоглобина. Гепцидин в ответ на воспаление вызывает гипоферремию путем блокировки главных путей поступления железа в кровь, ограничивая его доступность для синтеза гемоглобина и эритропоэза, инициируя анемию воспаления [29]. Кроме того, свободный гемоглобин, являясь высокоцитотоксическим прооксидантом, инициирует воспалительный каскад и свободнорадикальные процессы с развитием эндотелиальной дисфункции [30].
Показано, что в эритроцитах пациентов с COVID-19 на фоне нарушенного липидного гомеостаза мембраны, N-концевой цитозольный домен мембранного белка полосы 3 активирует окисление структурных белков с внутренней стороны мембраны, нарушается энергетический метаболизм клетки [31]. SARS-CoV-2, воздействуя на рецепторы CD147, CD26 и ангиотензинпревращающий фермент 2, расположенные на эритроцитах, может вызывать возникновение гемолитической анемии [17]. Кроме того, непосредственно гемоглобин эритроцитов может быть потенциальной мишенью для SARS-CoV-2 [32]. Белок ORF8 и поверхностный гликопротеин вируса связывается с порфирином, а белки ORF1ab, ORF10 и ORF3a взаимодействуют с β-цепью гемоглобина, нарушая его газотранспортную функцию, снижая эффективность газообмена [33]. Однако в ретроспективном исследовании DeMartino и соавт. [37] не наблюдалось признаков повреждения гемоглобина и гемолиза во время инфекции SARS-CoV-2. Эта инфекция и связанные с ней провоспалительные заболевания приводят к нарушению функции эритрокрина с последующими воспалительными осложнениями и эндотелиальной дисфункцией из-за дефицита защитных молекул (NO, сфингозин-1 фосфат и АТФ) из эритроцитов [34]. Понимание роли эритроцитов в COVID-19 может помочь в выборе и в методах лечения этой инфекции [17], что предполагает важность нарушений КТФ крови в течение этой патологии. Изменение СГК, являющееся наиболее важным фактором компенсации кислородной недостаточности при различных патологических состояниях, лежит в основе процессов адаптации к гипоксии [6]. Однако его значение, особенно в зависимости от тяжести течения COVID-19, до настоящего времени не выяснено, а имеющиеся работы по этому вопросу единичны и противоречивы.
Положение КДО при COVID-19 исследовалось в ряде работ. Согласно данным Vogel и соавт. [35] значение р50 снижается до 23.4 при коронавирусной инфекции (при повреждении не только легких, но и при анемии) по сравнению с 26.7 мм рт. ст. у здоровых лиц. В другом исследовании не было выявлено существенных различий в значениях р50станд у 14 пациентов с COVID-19 (29.0 ± 2.3 в сравнении со здоровыми 28.5 ± 1.8 мм рт. ст.) на фоне выраженной анемии (9.3 ± 2.3 г/дл) [36]. У пациентов при этой патологии рассчитанные стандартные КДО были незначительно, но достоверно смещены влево на 0.1 мм рт. ст. по сравнению с контрольной группой (27.5 ± 0.2 мм рт. ст.), но расчетный коэффициент эффекта Вериго–Бора для CO2 был снижен при этом. По данным DeMartino и соавт. [37] при этой патологии отмечается тенденция сдвига КДО вправо.
Был проведен ретроспективный анализ СГК артериальной крови в когорте тяжелобольных пациентов с COVID-19 в течение различных временных периодов во время пребывания в отделении интенсивной терапии, в результате чего был выявлен сдвиг КДО влево (значение p50 в начале и в конце лечения составляло 20.63 ± 2.1 против 18.68 ± 3.3 мм рт. ст., p = 0.03), а p50 у пациентов с летальным исходом оно имело большее значение, чем у выживших с данной патологией (24.1 против 18.45 мм рт. ст., р = 0.01) [38]. В другой работе при ретроспективном исследовании газового состава крови у пациентов с COVID-19 было выявлено значение р50 26 (25.2–26.8) против 25.9 (24–27.3) мм рт. ст. (p = 0.42), и более низкое его значение в группе с высоким уровнем карбоксигемоглобина; не было выявлено различий в динамике р50 между 1-ми и 18-ми сутками заболевания [32]. По данным Renoux и соавт. [39] измерение р50 у 7 пациентов с помощью Hemox-Analyzer не выявило значимых отличий этого параметра в сравнении со здоровыми. Согласно исследованиям Bergamaschi и соавт. [40] измерение стандартного р50 in vitro у 289 пациентов с этим заболеванием характеризуется отсутствием его изменений, но наблюдался низкий уровень р50 in vivo (этот эффект был более выражен у выживших пациентов, чем у умерших: 25.2 (24.4–26.3) против 25.8 (24.7–26.9), р < 0.012, мм рт. ст.). У 517 пациентов, госпитализированных с коронавирусной инфекцией, у которых выполняли анализ артериальной крови при госпитализации (т.е. до лечения), выявили более низкие значения p50станд у 76% и p50реал у 85% на протяжении 18 сут лечения в сравнении с исходным уровнем [41].
Ухудшение функции легких при COVID-19 повышает важность альтернативных механизмов компенсации, которые обеспечивают потребление кислорода, в частности, СГК [12]. Daniel и соавт. [36] предполагают, что функция переноса кислорода гемоглобином у пациентов с данной инфекцией не нарушается как для венозной, так и артериальной крови. Однако это не исключает возможности значительного отклонения КДО вправо на аэрогематическом уровне у пациентов с тяжелой формой COVID-19, что может быть фактором, усугубляющим развитие гипоксии [42].
Однако следует отметить, что в большинстве приведенных работ проводилась оценка КТФ только артериальной крови, и это могло повлечь к погрешности в расчете значений р50. Разнообразие значений p50 необходимо учитывать в условиях нарушения оксигенации тканей, и для его прогнозирования рекомендуется оценивать только образцы венозной, а не капиллярной крови [18], тем более артериальной.
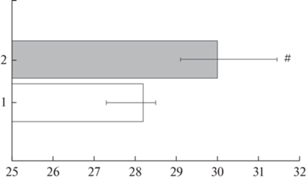
По нашим данным, у пациентов с коронавирусной инфекцией (n = 15) на 4–5-е сут от начала заболевания с достаточно низким значением spO2 (>93%), которым проводилась кислородная ингаляция, КДО венозной крови сдвигается вправо [43]. У данных пациентов по сравнению со здоровыми лицами наблюдалось снижение SO2, pCO2 увеличение pH крови. Выявлен рост показателя p50станд (на 14.0%, р < 0.05), что, очевидно, является типичной реакцией на гипоксию в тканях, возникшую из-за недостаточности легочного кровообращения. Показатель p50реал увеличился по сравнению с контрольной группой на 6.4%, р < 0.05 (рис. 3). Вероятно, это связано с некоторым истощением компенсаторной реакции организма, на что указывает уменьшение содержания pO2 и SO2 в венозной крови. Увеличение p50 и соответственно сдвиг кривой диссоциации вправо способствует росту потока кислорода в ткани при небольшом изменении рО2 [44].
Рис. 3.
Значение показателя сродства гемоглобина к кислороду р50 у здоровых лиц (1) и у пациентов с коронавирусной инфекцией (2). Изменения статистически значимы (критерий Манна–Уитни) по отношению к здоровым лицам – #.
В работах приводимых выше исследователей изучалась только артериальная кровь, а в нашем исследовании изучались газовые показатели венозной крови, взятой из v. cubitalis, что является принципиально важным для оценки ее КТФ. Артериальная и венозная кровь отличаются по содержанию факторов регуляции сродства гемоглобина к кислороду. Венозная кровь в значительной степени интегрально отражает процессы оксигенации тканей. Сдвиг КДО венозной крови вправо в условиях развития коронавирусной инфекции отражает попытку организма компенсировать кислородную недостаточность, но в условиях цитокинового шторма, окислительного стресса, когда нарушена утилизация кислорода тканями и значительная его часть используется в оксигеназных реакциях, ведущих к образованию активных форм кислорода, это может содействовать усилению активности процессов свободнорадикального окисления.
Таким образом, при COVID-19 в реальных условиях организма имеет место сдвиг КДО вправо в венозной крови, что увеличивает поступление О2 из крови в ткани, а влево – уменьшает, а в артериальной крови – наоборот, КДО сдвигается влево, что способствует возрастанию насыщения крови кислородом в легких на уровне капилляров малого круга кровообращения.
МЕХАНИЗМЫ ИЗМЕНЕНИЯ СРОДСТВА ГЕМОГЛОБИНА К КИСЛОРОДУ ПРИ КОРОНАВИРУСНОЙ ИНФЕКЦИИ
Адаптация к гипоксии, направленная на сохранение жизнедеятельности организма в условиях дефицита кислорода, контролируется как центральными, так и периферическими механизмами, необходимыми для поддержания внутриклеточного уровня кислорода. Развитие COVID-19 препятствует транспорту кислорода к тканям из-за нарушения насыщения гемоглобина в поврежденном легком, так и из-за снижения концентрации гемоглобина с последующим уменьшением объема доставляемого кислорода [10].
Через внутриэритроцитарный механизм положение КДО может значительно изменяться в зависимости от потребностей организма в кислороде. Аллостерические эффекторы управления R-/T-конформацией гемоглобина обеспечивают формирование кислородсвязывающих свойств крови в широком физиологическом диапазоне в соответствии с потребностями организма. Благодаря действию модуляторов создаются условия модификации свойств гемоглобина во время циркуляции в сосудистом русле, что формирует его определенную конформацию с иным сродством к кислороду.
Среди различных факторов, определяющих положение КДО, важное значение имеет эффект Вериго–Бора. Данный эффект представляет собой саморегулирующийся механизм доставки кислорода в ткани при гипоксических условиях, при возникающем тканевом ацидозе, который через обратную связь обеспечивает аллостерический контроль СГК [45]. Предполагается, что патогенез тяжелых форм коронавирусной инфекции, как и многих воспалительных заболеваний, может быть связан с ацидозом, так как в соответствии с эффектом Вериго-Бора снижение рН крови приводит к снижению насыщения крови кислородом (рис. 4), что обуславливает ухудшение состояния пациента [22]. Истощение буферной способности крови и в целом ресурсов организма, необходимых для сдерживания развивающегося ацидоза, имеет решающее значение для снижения сатурации крови. В условиях снижения рН и повышения напряжения CО2 (ацидоз и гиперкапния) можно предполагать сдвиг КДО вправо [27].
Рис. 4.
Диаграмма, иллюстрирующая систему прямой и обратной зависимости между воспалением, гипоксией и насыщением крови [22].

Высказано предположение, что сохранение насыщения кислородом, несмотря на низкое pO2 в образцах артериальной крови, происходит из-за сдвига КДО влево, вызванного гипервентиляцией и гипоксемией, а также из-за возможных прямых взаимодействий вируса с гемоглобином [25]. При интенсивном обмене веществ, ведущем к снижению значения рН, гемоглобин легче отдает О2, связывая при этом избыточные протоны, обеспечивая тем самым эффективный транспорт кислорода от легких к тканям и перенос углекислого газа (в основном в виде бикарбоната) в обратном направлении, образуя систему регуляции метаболитов с отрицательной обратной связью, основанную на кооперативном рН-зависимом изменении конформации гемоглобина (эффект Вериго–Бора) [22].
Важными гетеротропными эффекторами гемоглобина являются Н+, СО2 и внутриэритроцитарные органические фосфаты, а именно 2,3-дифосфоглицерат (2,3-ДФГ), который является мощным модулятором СГК. Увеличение его концентрации приводит к смещению КДО вправо, а снижение вызывает противоположный эффект. Образование лактата сопровождается накоплением 2,3-ДФГ (шунт Раппопорта) с миграцией последних в эритроциты. Этот модулятор 2,3-ДФГ входит в состав гемоглобина путем образования солевого мостика между β-субъединицами гетеротетрамера, что предотвращает связывание кислорода.
Анемия различной степени тяжести достаточно широко распространена при COVID-19 [17]. Увеличение дефицита кислорода может приводить к запуску синтеза 2,3-ДФГ, молекулы, стабилизирующей гемоглобин в дезоксиформе, что, инициируя сдвиг КДО вправо, должно улучшать снабжение тканей кислородом. Предполагается, что при тяжелой анемии при COVID-19 происходит смещение КДО вправо из-за возможного адаптивного увеличения концентрации 2,3-ДФГ, однако нет убедительных данных о повышении этого модулятора СГК при этой патологии [10, 35].
Важно также учитывать влияние температуры крови на значение р50, так как у многих пациентов при этой патологии наблюдается лихорадка (примерно у 80% она выше 38°С, что смещает КДО вправо, а р50 повышается почти на 3 мм рт. ст. при подъеме температуры на 2°C) [12]. Температура выступает как регулятор функций гемоглобина в связи с тем, что оксигенация гемической группы является экзотермической реакцией (СГК уменьшается с ростом температуры), а общая энтальпия оксигенации обусловлена эндотермическим вкладом регуляторных молекул, которые преимущественно связываются с дезоксигемоглобином и модулируют связывание либо отщепление О2 [46].
Следует отметить, что при оценке р50 может возникнуть ситуация, когда изменения этого показателя не выявляются, что возможно при выраженных, противоположно направленных, взаимно компенсирующих сдвигах факторов, в частности, при дефиците 2,3-ДФГ, компенсируемом адаптивным поведением, кислой реакцией среды эритроцита, в этом случае уровень р50 остается стабильным, однако это не означает, что КТФ крови при подобном сочетании взаимодействующих факторов следует признать нормальным.
В терапии COVID-19 используются средства, повышающие СГК: 5-гидроксиметил-2-фурфурал, стимулирующих эритропоэз – эритропоэтин, метиленовый синий. Образуемый повышенный уровень метгемоглобина может выступать в качестве потенциальной причины смещения КДО влево, особенно у пациентов, принимающих препараты, способствующие образованию метгемоглобина (такие как хлорохин и гидрохлорохин) [10].
Важно оценивать значение различных субстанций, влияющих на СГК (например, АТФ, Cl–, лактат, глутатион), которые могут играть определенную роль в этом процессе, их вклад должен быть изучен. Особо следует оценить роль газотрансмиттера монооксида азота (NO), поскольку механизм его связывания с гемоглобином подобен образованию его метформы при высоком насыщении кислородом в легких, но изменяется в тканевых капиллярах [10].
Полученные в разных исследованиях данные о характере изменения кислородсвязывающих свойств крови в условиях развития COVID-19 отражают функционирование механизмов относительно автономной системы регуляции ее свойств. Она обеспечивает адаптивное поведение кислородсвязывающих свойств крови при перестройке характера ее функционирования, в целом всей системы транспорта кислорода на разных ее уровнях.
ЗНАЧЕНИЕ ГАЗОТРАНСМИТТЕРОВ (NO, H2S) В ИЗМЕНЕНИИ СРОДСТВА ГЕМОГЛОБИНА К КИСЛОРОДУ ПРИ COVID-19
Почти у всех пациентов с COVID-19 отмечается системное повреждение сердечно-сосудистой системы [47], которая сопровождается выраженным повреждением эндотелия (иногда для подчеркивания этого используют термин “эндотелиит”) [48]. Возникшая дисфункция эндотелия при коронавирусной инфекции характеризуется нарушением способности поддерживать нормальную функцию сосудов, а также приводит к изменению образования различных газотрансмиттеров. NO является ключевой сигнальной молекулой, которая выполняет ряд физиологических функций для поддержания сосудистого гомеостаза, а снижение ее доступности связано с прогрессированием сердечно-сосудистых заболеваний и повышает риск развития патогенных явлений [49]. Этот фактор является универсальным, который регулирует многие физиологические процессы при низких концентрациях, но вреден при более высоких концентрациях [50].
Можно предположить участие системы газотрансмиттеров в изменении кислородсвязующих свойств крови, прежде всего, NO и H2S. Как известно, данные газотрансмиттеры вносят вклад в модификацию СГК, что достигается через различные механизмы: образование различных дериватов гемоглобина, модулирование внутриэритроцитарной системы, а также опосредовано через системные механизмы формирования функциональных свойств гемоглобина [51]. В этом аспекте представляет интерес работа Mortaz и соавт. [52], в которой показано увеличение содержания внутриэритроцитарного NO у пациентов с COVID-19. В другом исследовании показано, что пациенты с тяжелой формой этой патологии имеют более низкие уровни HbNO и нитритов/нитратов, а также более высокий уровень перекисей липидов, являющихся индикатором окислительного стресса, что снижает биодоступность NO и является фактором развития эндотелиальной дисфункции [50]. Измерение величины фракционного NO в выдыхаемом воздухе у пациентов с COVID-19 выявило его более низкое значение, особенно при тяжелом исходе [53].
В нашем исследовании у пациентов (n = 15) с инфекцией SARS-CoV-2 установлено повышенное содержание ${\text{NO}}_{3}^{ - }$/${\text{NO}}_{2}^{ - }$ плазме крови до 28.07 (17.74; 37.74) (p < 0.05) мкмоль/л и снижение H2S до 5.81 (5.22; 8.29) (p < 0.05) мкмоль/л в сравнении со здоровыми 15.42 (14.48; 17.71) и 29.01 (25.21; 37.03) мкмоль/л соответственно [43]. Известно, что газотрансмиттеры (NO и H2S) выполняют роль аллостерического эффектора функциональных свойств гемоглобина, которые изменяют его сродство к кислороду и таким образом влияют на транспорт О2 [54]. Наблюдаемое изменение содержания данных газотрансмиттеров (повышение концентрации нитрат/нитритов и снижение уровня H2S), вносит вклад в изменение СГК. Концентрация NO- и H2S-производных гемоглобина в крови невелика, на каждый из этих дериватов приходится несколько сотен молекул обычного гемоглобина, что относительно мало для их выраженного влияния на кислородсвязывающие свойства крови в обычных условиях, но при патологических состояниях при более высоких концентрациях, выше физиологических, их эффект на модуляцию кислородсвязывающих свойств крови может проявляться более существенно, что может иметь важное значение для процессов газообмена на уровне капилляров.
Система газотрансмиттеров формирует своеобразный щит, ограничивающий действие повреждающих факторов. При создании средств коррекции, изменяющих содержание NO, необходимо учитывать, что данный фактор участвует, как в нормальной регуляции, так и во многих патологических процессах [55], в связи с чем оптимальным будет ограничение гиперпродукции или компенсанции недостатка NO в организме, не затрагивая его существенные регуляторные и защитные функции. Гипоксия является фактором, изменяющим активность различных изоформ NO-синтазы: активирует индуцибельную, но ингибирует эндотелиальную изоформы фермента.
Выявлен новый сигнальный путь, который регулирует способность переноса кислорода в эритроцитах и реализуется через участие газотрансмиттера H2S в продукции 2,3-ДФГ в эритроцитах с последующим повышением СГК [56]. При нормоксии H2S уменьшает транслокацию гемоглобина из цитозоля в мембрану, способствует закреплению дифосфоглицератамутазы на мембране и тем самым снижает уровень 2,3-ДФГ, а при гипоксии снижение уровня H2S способствует закреплению гемоглобина на мембране и высвобождению дифосфоглицератамутазы, что, в конечном итоге, приводит к увеличению продукции 2,3-ДФГ в эритроцитах. Несомненно, данный газотрансмиттер участвует в модификации СГК, что достигается через различные механизмы: образование сульфгемоглобина, модулирование L-аргинин-NO системы, а также опосредовано через системные механизмы. Метаболизм H2S является частью кислородсенсорного механизма: в обычных условиях данный газотрансмиттер окисляется в митохондриях до сульфита, при гипоксии его утилизация уменьшается, в связи с чем возрастает его вклад в гипоксический ответ [57].
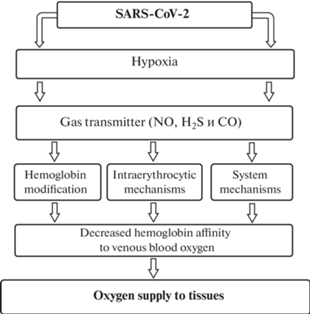
Газотрансмиттеры (NO, H2S а также монооксид углерода СО) выполняют роль аллостерических модуляторов в отношении гемоглобина, изменяя его сродство к кислороду и определяя состояние КТФ крови (рис. 5). Газотрансмиттер H2S участвует в формировании функциональных свойств гемоглобина путем модификации его сродства к кислороду через системные и регионарные, внутриэритроцитарные механизмы регуляции, что имеет значение в патогенезе гипоксического состояния при коронавирусной инфекции.
Рис. 5.
Механизмы изменения сродства гемоглобина к кислороду венозной крови при коронавирусной инфекции.
Многие физиологические эффекты H2S обусловлены его взаимодействием с другими газообразными посредниками (NO, CО), осуществляемым как на уровне регуляции ферментов синтеза, так и мишеней их действия. Исходя из этого, предлагается рассматривать газомедиаторы не по отдельности, а как союз молекул, регулирующих клеточные процессы [46]. H2S занимает особую позицию в регуляции физиологических процессов, в частности, сократительных реакций сосудистых гладких мышц, его вазорелаксирующее влияние обусловлено не только дисфункцией эндотелиально-гладкомышечных взаимоотношений, но и тесным взаимодействием с NO-зависимыми механизмами [58]. Это относится и к его эффектам на красные клетки крови. Показано, что донор H2S – NaHS в физиологической концентрации (6 × 10–5 М) улучшает деформируемость эритроцитов, действуя однонаправленно и сходно по величине с эффектом донора NO (нитропруссидом натрия), однако в более высокой концентрации (10-3 М) NaHS снижает деформируемость эритроцитов за счет увеличения предела текучести мембраны [59]. Согласно нашему исследованию, отмечается рост содержания NO и снижение H2S, свидетельствуя о разнонаправленной активности механизмов генерации этих газотрансмиттеров [60]. Механизмы транспорта кислорода кровью являются важнейшими мишенью эффектов NО и H2S. Нарушение газотрансмиттеробразующей функции приводит к ухудшению кислородсвязующих свойств крови, и как следствие, к снижению адекватного обеспечения кровотоком тканевых потребностей в кислороде, развитию гипоксического синдрома.
ЗАКЛЮЧЕНИЕ
Состояние внутриэритроцитарной системы регуляции СГК существенно влияет на мобильность изменений крови, и в то же время данная автономная система, работающая по принципу обратной связи, способна независимо от условий циркуляции поддерживать адаптивные свойства крови. В реальных условиях организма при COVID-19 действие разных модуляторов обуславливает изменение СГК, что особо важно для обеспечения адекватного кислородного потока в ткани и может быть использовано для устранения кислородного дефицита.
Смещение КДО артериальной крови влево при коронавирусной инфекции способствует насыщению кислородом, а ее сдвиг в венозной крови вправо в условиях развития гипоксического синдрома организма отражает активацию механизмов компенсации кислородной недостаточности, направленных на улучшение оксигенации тканей. Изменение ее положения не является, очевидно, специфичной для данной патологии, а определяется степенью выраженности кислородной недостаточности и разбалансированием механизмов кардиореспираторной системы. В целом полученные данные о положении КДО при этой патологии являются ярким примером мультифакторного процесса изменения ее сдвигов. Положение КДО при COVID-19 может быть обусловлено особенностью статуса пациентов с этой патологией (степень тяжести, стадия заболевания, величина повреждения легких, особенности терапии и другое), а также особенностью образца исследуемой крови.
Таким образом, анализ литературы и собственные результаты выполненных исследований, посвященных изучению СГК и механизмов его регуляции при коронавирусной инфекции, указывают на актуальность данной проблемы, неоднозначность во взглядах на ее трактовку и свидетельствуют о необходимости дальнейшего более глубокого исследования, что позволит осуществить поиск оптимальных средств коррекции дефицита кислорода при этой патологии.
Список литературы
Weber RE, Fago A (2004) Functional adaptation and its molecular basis in vertebrate hemoglobins, neuroglobins and cytoglobins. Respir Physiol Neurobiol 144(2-3): 141–159. https://doi.org/10.1016/j.resp.2004.04.018
Beasley R, McNaughton A, Robinson G (2006) New look at the oxyhaemoglobin dissociation curve. Lancet 367(9517): 1124–1126. https://doi.org/10.1016/S0140-6736(06)68488-2
Michel D (2008) An alternative theoretical formula for hemoglobin oxygenation. Eur Biophys J 37(6): 823–827. https://doi.org/10.1007/s00249-008-0283-2
Mairbäurl H, Weber RE (2012) Oxygen transport by hemoglobin. Compr Physiol 2(2): 1463–1489. https://doi.org/10.1002/cphy.c080113
Storz JF (2016) Hemoglobin-oxygen affinity in high-altitude vertebrates: is there evidence for an adaptive trend? J Exp Biol 219(20): 3190–3203. https://doi.org/10.1242/jeb.127134
Srinivasan AJ, Morkane C, Martin DS, Welsby IJ (2017) Should modulation of p50 be a therapeutic target in the critically ill? Expert Rev Hematol 10(5): 449–458. https://doi.org/10.1080/17474086.2017.1313699
Webb KL, Dominelli PB, Baker SE, Klassen SA, Joyner MJ, Senefeld JW, Wiggins CC (2022) Influence of High Hemoglobin-Oxygen Affinity on Humans During Hypoxia. Front Physiol 12: 1–13. https://doi.org/10.3389/fphys.2021.763933
Kosmachevskaya OV, Topunov AF (2019) Electrophilic signaling: the role of reactive carbonyl compounds. Biochemistry 84(1): 3–23. https://doi.org/10.1134/S0320972519010019
Laredo M, Curis E, Masson-Fron E, Voicu S, Megarbane B (2021) Does COVID-19 alter the oxyhemoglobin dissociation curve? – An observational cohort study using a mixed-effect modelling. Clin Chem Lab Med 59: e416–419. https://doi.org/10.1515/cclm-2021-0387
Böning D, Kuebler WM, Bloch W (2021) The oxygen dissociation curve of blood in COVID-19. Am J Physiol Lung Cell Mol Physiol 321(2): L349-L357. https://doi.org/10.1152/ajplung.00079.2021
Gille T, Sesé L, Aubourg E, Bernaudin JF, Richalet JP, Planès C (2022) Is there a shift of the oxygen-hemoglobin dissociation curve in COVID-19? Am J Physiol Lung Cell Mol Physiol 322(1): L174–L175. https://doi.org/10.1152/ajplung.00390.2021
Böning D, Kuebler WM, Vogel D, Bloch W (2023) The oxygen dissociation curve of blood in COVID-19-An update. Front Med (Lausanne) 10: 1–15. https://doi.org/10.3389/fmed.2023.1098547
Рябов ГА (1988) Гипоксия критических состояний. М. Медицина. [Ryabov GA (1988) Hypoxia of critical conditions. M. Medicine. (In Russ)].
Иржак ЛИ, Гладилов ВВ, Мойсеенко НА (1985) Дыхательная функция крови в условиях гипероксии. М. Медицина. [Irzhak LI, Gladilov VV, Mojseenko NA (1985) Respiratory function of blood under conditions of hyperoxia. M. Medicine. (In Russ)].
Scheid P, Meyer M (1978) Mixing technique for study of oxygen-hemoglobin equilibrium: a critical evaluation. J Appl Physiol Respir Environ Exerc Physiol 45(5): 818–822. https://doi.org/10.1152/jappl.1978.45.5.818
Siggaard-Andersen M, Siggaard-Andersen O (1995) Oxygen status algorithm, version 3, with some applications. Acta Anaesthesiol Scand Suppl 107: 13–20. https://doi.org/10.1111/j.1399-6576.1995.tb04324.x
Kosenko E, Tikhonova L, Alilova G, Montoliu C (2023) Erythrocytes Functionality in SARS-CoV-2 Infection: Potential Link with Alzheimer’s Disease. Int J Mol Sci 24(6): 1–24. https://doi.org/10.3390/ijms24065739
Balcerek B, Steinach M, Lichti J, Maggioni MA, Becker PN, Labes R, Gunga HC, Persson PB, Fähling M (2020) A broad diversity in oxygen affinity to haemoglobin. Sci Rep 10(1): 1–15. https://doi.org/10.1038/s41598-020-73560-9
Samaja M, Crespi T, Guazzi M, Vandegriff KD (2003) Oxygen transport in blood at high altitude: role of the hemoglobin-oxygen affinity and impact of the phenomena related to hemoglobin allosterism and red cell function. Eur J Appl Physiol 90(3-4): 351–359. https://doi.org/10.1007/s00421-003-0954-8
Сережина ЕК, Обрезан АГ (2020) Патофизиологические механизмы и нозологические формы сердечно-сосудистой патологии при COVID-19. Кардиология 60(8): 23–26. [Serezhina EK, Obrezan AG (2020) Cardiovascular pathology in patients with COVID-19. Kardiolоgiya 60(8): 23–26. (In Russ)]. https://doi.org/10.18087/cardio.2020.8.n1215
Бойцов СА, Погосова НВ, Палеев ФН, Ежов МВ, Комаров АЛ, Певзнер ДВ, Груздев КА, Баринова ИВ, Суворов АЮ, Алексеева ИА, Милько ОВ (2021) Клиническая картина и факторы, ассоциированные с неблагоприятными исходами у госпитализированных пациентов с новой коронавирусной инфекцией COVID-19. Кардиология 61(2): 4–14. [Boytsov SA, Pogosova NV, Paleev FN, Ezhov MV, Komarov AL, Pevsner DV, Gruzdev KA, Barinova IV, Suvorov AYu, Alekseeva IA, Milko OV (2021) Clinical characteristics and factors associated with poor outcomes in hospitalized patients with novel coronavirus infection COVID-19. Kardiolоgiya 61(2): 4–14. (In Russ)]. https://doi.org/10.18087/cardio.2021.2.n1532
Nechipurenko YD, Semyonov DA, Lavrinenko IA, Lagutkin DA, Generalov EA, Zaitceva AY, Matveeva OV, Yegorov YE (2021) The Role of Acidosis in the Pathogenesis of Severe Forms of COVID-19. Biology (Basel) 10(9): 1–15. https://doi.org/10.3390/biology10090852
Busana M, Camporota L, Gattinoni L (2022) Hypoxaemia in COVID-19: many pieces to a complex puzzle. Eur Respir Rev 31(164): 1–2. https://doi.org/10.1183/16000617.0090-2022
Serebrovska ZO, Chong EY, Serebrovska TV, Tumanovska LV, Xi L (2020) Hypoxia, HIF-1α, and COVID-19: from pathogenic factors to potential therapeutic targets. Acta Pharmacol Sin 41(12): 1539–1546. https://doi.org/10.1038/s41401-020-00554-8
Dhont S, Derom E, Van Braeckel E, Depuydt P, Lambrecht BN (2020) The pathophysiology of 'happy' hypoxemia in COVID-19. Respir Res 21(1): 1–9. https://doi.org/10.1186/s12931-020-01462-5
Ebihara A, Kitahara A, Iwamoto T, Kuwahira I (2022) Silent Hypoxemia in COVID-19 Pneumonia. Adv Exp Med Biol 1395: 117–122. https://doi.org/10.1007/978-3-031-14190-4_20
Тихомирова ИА (2023) Реология крови и микроциркуляция. Усп физиол наук 54(1): 3–25. [Tikhomirova IA (2023) Blood rheology and microcirculation. Usp fiziol nauk 54(1): 3–25. (In Russ)]. https://doi.org/10.31857/S0301179823010071
Marques O, Weiss G, Muckenthaler MU (2022) The role of iron in chronic inflammatory diseases: from mechanisms to treatment options in anemia of inflammation. Blood 140(19): 2011–2023.https://doi.org/10.1182/blood.202101347235994752
Ganz T (2019) Anemia of Inflammation. N Engl J Med 381(12): 1148–1157.https://doi.org/10.1056/NEJMra180428131532961
Nemeth E, Ganz T (2023) Hepcidin and Iron in Health and Disease. Annu Rev Med 74: 261–277. https://doi.org/10.1146/annurev-med-043021-032816
Thomas T, Stefanoni D, Dzieciatkowska M, Issaian A, Nemkov T, Hill RC, Francis RO, Hudson KE, Buehler PW, Zimring JC, Hod EA, Hansen KC, Spitalnik SL, D’Alessandro A (2020) Evidence of Structural Protein Damage and Membrane Lipid Remodeling in Red Blood Cells from COVID-19 Patients. J Proteom Res 19(11): 4455–4469. https://doi.org/10.1021/acs.jproteome.0c00606
Gille T, Sesé L, Aubourg E, Fabre EE, Cymbalista F, Ratnam KC, Valeyre D, Nunes H, Richalet JP, Planès C (2021) The Affinity of Hemoglobin for Oxygen Is Not Altered During COVID-19. Front Physiol 12: 1–9. https://doi.org/10.3389/fphys.2021.578708
Донина ЖА (2022) Причины гипоксемии при COVID-19. Рос физиол журн им ИМ Сеченова 108 (1): 3–12. [Donina ZhA (2022) Causes of hypoxemia in COVID-19. Russ J Physiol 108(1): 3–12. (In Russ)]. https://doi.org/10.31857/S0869813922010058
Al-Kuraishy HM, Al-Gareeb AI, Onohuean H, El-Saber Batiha G (2022) COVID-19 and erythrocrine function: The roller coaster and danger. Int J Immunopathol Pharmacol 36: 1–7. https://doi.org/10.1177/03946320221103151
Vogel DJ, Formenti F, Retter AJ, Vasques F, Camporota L (2020) A left shift in the oxyhaemoglobin dissociation curve in patients with severe coronavirus disease 2019 (COVID-19). Br J Haematol 191(3): 390–393. https://doi.org/10.1111/bjh.17128
Daniel Y, Hunt BJ, Retter A, Henderson K, Wilson S, Sharpe CC, Shattock MJ (2020) Haemoglobin oxygen affinity in patients with severe COVID-19 infection. Br J Haematol 190(3): 126–127. https://doi.org/10.1111/bjh.16888
DeMartino AW, Rose JJ, Amdahl MB, Dent MR, Shah FA, Bain W, McVerry BJ, Kitsios GD, Tejero J, Gladwin MT (2020) No evidence of hemoglobin damage by SARS-CoV-2 infection. Haematologica 105: 2769–2773. https://doi.org/10.3324/haematol.2020.264267
Ceruti S, Minotti B, Glotta A, Biggiogero M, Bona G, Marzano M, Greco P, Spagnoletti M, Garzoni C, Bendjelid K (2022) Temporal changes in the oxyhemoglobin dissociation curve of critically ill COVID-19 patients. J Clin Med 11(3): 1–14. https://doi.org/10.3390/jcm11030788
Renoux C, Fort R, Nader E, Boisson C, Joly P, Stauffer E, Robert M, Girard S, Cibiel A, Gauthier A, Connes P (2021) Impact of COVID-19 on red blood cell rheology. Br J Haematol 192(4): e108–e111. https://doi.org/10.1111/bjh.17306
Bergamaschi G, Barteselli C, Del Rio V, Borrelli de Andreis F, Pellegrino I, Mengoli C, Miceli E, Colaneri M, Zuccaro V, Di Stefano M, Bruno R, Di Sabatino A (2023) Impaired respiratory function reduces haemoglobin oxygen affinity in COVID-19. Br J Haematol 200(5): e44–e47. https://doi.org/10.1111/bjh
Valle A, Rodriguez J, Camiña F, Rodríguez-Segade M (2022) The oxyhaemoglobin dissociation curve is generally left-shifted in COVID-19 patients at admission to hospital, and this is associated with lower mortality. Br J Haematol 199(3): 332–338. https://doi.org/10.1111/bjh.18431
Сабиров ИС, Мамедова КМ, Султанова МС, Кожоева МЗ, Ибадуллаев БМ (2021) Роль и значение гипоксического компонента в развитии осложнений новой коронавирусной инфекции (COVID-19). Науч насл 62-2(62): 21–28. [Sabirov I, Mamedova K, Sultanova M, Kozhoeva M, Ibadullaev B (2021) The role and significance of the hypoxic component in the development of complications of the new coronavirus infection (COVID-19). Sci Herit 62-2(62): 21–28. (In Russ)]. https://doi.org/10.24412/9215-0365-2021-62-2-21-28
Hlutkina N, Zinchuk V (2022) Hemoglobin-oxygen affinity and gaseous transmitters (nitric oxide, hydrogen sulfide) in patients with COVID-19. Ann Clin Case Rep 7: 1–5.
Зинчук ВВ, Глуткина НВ (2013) Кислородсвязывающая способность гемоглобина и оксида азота. Рос физиол журн им ИМ Сеченова 99(5): 537–554. [Zinchuk VV, Glutkina NV (2013) Oxygen-binding capacities of hemoglobinand nitric oxide. Russ J Physiol 99(5): 537–554. (In Russ)].
Zinchuk V, Biletskaya E (2023) Effect of ozone on oxygen transport and pro-oxidant-antioxidant balance of red blood cell suspension. Acta Chim Slov 70(2): 226–230. https://doi.org/10.17344/acsi.2023.8032
Зинчук ВВ (2021) Кислородтранспортная функция крови и газотрансмиттер сероводород. Усп физиол наук 52(3): 41–55. [Zinchuk VV (2021) Оxygen transport functions of blood and hydrogen sulfide gazotransmitter. Usp fiziol nauk 52(3): 41–55. (In Russ)]. https://doi.org/10.31857/S0301179821030085
Драпкина ОМ, Васильева ЛЭ (2020) Спорные вопросы применения ингибиторов ангиотензинпревращающего фермента и антагонистов рецепторов ангиотензина у пациентов с COVID-19. Кардиоваск терапия и профилакт 19(3): 2580. [Drapkina OM, Vasilyeva LE (2020) Debatable points of using angiotensin-converting enzyme inhibitors and angiotensin receptor antagonists in patients with COVID-19. Cardiovasc Therapy and Prevent 19(3): 2580. (In Russ)]. https://doi.org/10.15829/1728-8800-2020-2580
Петрищев НН, Халепо ОВ, Вавиленкова ЮА, Власов ТД (2020) COVID-19 и сосудистые нарушения (обзор литературы). Регион кровообр и микроцирк 19(3): 90–98. [Petrishchev NN, Khalepo OV, Vavilenkova YuA, Vlasov TD (2020) COVID-19 and vascular disorders (literature review). Region Blood Circulat and Microcirc 19(3): 90–98. (In Russ)]. https://doi.org/10.24884/1682-6655-2020-19-3-90-98
Liddle L, Monaghan C, Burleigh MC, Baczynska KA, Muggeridge DJ, Easton C (2022) Reduced nitric oxide synthesis in winter: A potential contributing factor to increased cardiovascular risk. Nitric Oxide 127: 1–9. https://doi.org/10.1016/j.niox.2022.06.007
Mandal SM (2023) Nitric oxide mediated hypoxia dynamics in COVID-19. Nitric Oxide 133: 18–21. https://doi.org/10.1016/j.niox.2023.02.002
Zinchuk V, Zhadko D (2019) Association of endothelial nitric oxide synthase gene G894T polymorphism with blood oxygen transport. Nitric Oxide 84: 45–49. https://doi.org/10.1016/j.niox.2019.01.007
Mortaz E, Malkmohammad M, Jamaati H, Naghan PA, Hashemian SM, Tabarsi P, Varahram M, Zaheri H, Chousein EGU, Folkerts G, Adcock IM (2020) Silent hypoxia: higher NO in red blood cells of COVID-19 patients. BMC Pulm Med 20(1): 269–272. https://doi.org/10.1186/s12890-020-01310-8
Lior Y, Yatzkan N, Brami I, Yogev Y, Riff R, Hekselman I, Fremder M, Freixo-Lima G, Be’er M, Amirav I, Lavie M (2022) Fractional exhaled Nitric Oxide (FeNO) level as a predictor of COVID-19 disease severity. Nitric Oxide 124: 68–73. https://doi.org/10.1016/j.niox.2022.05.002
Kolluru GK, Prasai PK, Kaskas AM, Letchuman V, Pattillo CB (2016) Oxygen tension, H2S, and NO bioavailability: is there an interaction? J Appl Physiol 120(2): 263–270. https://doi.org/10.1152/japplphysiol.00365.2015
Ивашкин ВТ, Драпкина ОМ (2011) Клиническое значение оксида азота и белков теплового шока. 2-е изд. Гэотар-Медиа. [Ivashkin VT, Drapkina OM (2011) Clinical significance of nitric oxide and heat shock proteins. 2nd ed. Geotar Media. (In Russ)].
Wang G, Huang Y, Zhang N, Liu W, Wang C, Zhu X, Ni X (2021) Hydrogen Sulfide Is a Regulator of Hemoglobin Oxygen-Carrying Capacity via Controlling 2,3-BPG Production in Erythrocytes. Oxid Med Cell Longev 2021: 1–16. https://doi.org/10.1155/2021/8877691
Olson KR (2008) Hydrogen sulfide and oxygen sensing: implications in cardiorespiratory control. J Exp Biol 211(17): 2727–2734.https://doi.org/10.1242/jeb.010066
Birulina YG, Ivanov VV, Buyko EE, Gabitova IO, Kovalev IV, Nosarev AV, Smagliy LV, Gusakova SV (2021) Role of H2S in regulation of vascular tone in metabolic disorders. Bull Exp Biol Med 171(4): 436–440.https://doi.org/10.1007/s10517-021-05243-y
Fadyukova OE, Koshelev VB (2020) The effect of hydrogen sulfide on the rat erythrocyte deformability. Bull Exp Biol Med 169(6): 725–728. https://doi.org/10.1007/s10517-020-04965-9
Зинчук ВВ, Глуткина НВ, Кулага ЕЯ (2022) Газотрансмиттеры (NO, H2S) и механизмы транспорта кислорода кровью у пациентов с коронавирусной инфекцией COVID-19. Смоленск мед альм 2: 79–81. [Zinchuk VV, Glutkina NV, Kulaga EI (2022) Gasotransmitters (NO, H2S) and mechanisms of oxygen transport in blood in patients with coronavirus infection COVID-19. Smol Мed Аlm 2: 79–81. (In Russ)]. https://doi.org/10.37903/SMA.2022.2.16
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова