Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 2, стр. 139-162
Метаанализ экспериментальных исследований влияния монотерапии мелатонином на уровень циркулирующих триглицеридов, холестерина, глюкозы и инсулина в зависимости от диеты крыс
Н. В. Кузьменко 1, 2, *, В. А. Цырлин 1, М. Г. Плисс 1, 2
1 Национальный медицинский исследовательский центр им. В.А. Алмазова Минздрава России
Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет
им. академика И.П. Павлова, Минздрава России
Санкт-Петербург, Россия
* E-mail: nat.kuzmencko2011@yandex.ru
Поступила в редакцию 21.11.2022
После доработки 10.01.2023
Принята к публикации 13.01.2023
- EDN: NDTFDK
- DOI: 10.31857/S0869813923020061
Аннотация
Известно, что мелатонин модулирует суточные и сезонные ритмы метаболизма. Однако до сих пор неясен эффект продолжительного приема экзогенного мелатонина на параметры липидного и углеводного обмена при различных диетах. В данной работе мы провели метаанализ 53 публикаций, исследующих влияние монотерапии мелатонином на показатели липидного и углеводного обмена у крыс, содержащихся на стандартной диете (44 публикации), а также на диетах с повышенным содержанием фруктозы (7 публикаций), жиров (11 публикаций) и холестерина (5 публикаций). По литературным данным диета, обогащенная фруктозой, вызывала у крыс существенное повышение уровня триглицеридов, глюкозы и инсулина. У крыс, находящихся на диете, обогащенной жирами, наблюдалось увеличение уровня триглицеридов, общего холестерина (ОХ), инсулина и снижение концентрации липопротеинов высокой плотности (ЛВП). У крыс, содержащихся на диете, обогащенной холестерином, наблюдалось увеличение уровня ОХ и снижение концентрации ЛВП. Терапия мелатонином снижала уровень триглицеридов, ОХ и инсулина, но не изменяла уровень глюкозы у крыс, содержащихся на диетах, обогащенных фруктозой и жирами. При диете, обогащенной холестерином, мелатонин (без учета дозы) снижал уровень ОХ и увеличивал уровень ЛВП и глюкозы, но не изменял концентрацию триглицеридов. Наш метаанализ не выявил положительного эффекта увеличения дозы мелатонина при обогащенных диетах. При стандартной диете длительная терапия мелатонином также снижала уровень инсулина, но не оказывала влияния на ОХ и увеличивала уровень глюкозы. Ухудшение показателей углеводного обмена было ассоциировано с более высокими дозами мелатонина в начале терапии, с внутрибрюшинным введением или с введением через желудочный зонд, с введением в светлую фазу. Кроме того, высокие дозы мелатонина были ассоциированы с ухудшением показателей липидного обмена при стандартной диете. Эффект мелатонина был направлен в сторону минимизации изменений в липидном профиле, вызванных диетой, что подтверждает гомеостатическую роль мелатонина в метаболизме липидов.
ВВЕДЕНИЕ
Известно, что гормон эпифиза мелатонин регулирует суточные и сезонные изменения в общем метаболизме позвоночных. К настоящему времени появилось много сообщений об эффективности мелатонина в нормализации показателей липидного профиля и резистентности к инсулину у людей с метаболическими нарушениями [1–4]. Это позволяет рассматривать мелатонин в качестве альтернативного метода профилактики и терапии метаболических нарушений, тем более что он имеет минимальные побочные эффекты.
Установлено, что помимо пинеальной железы мелатонин синтезируется практически во всех органах и тканях, включая различные отделы головного мозга, щитовидную железу, желудочно-кишечный тракт, печень, поджелудочную железу [5]. Кроме того, практически все ткани и органы имеют мелатонинергические рецепторы (МТ). Эффекты мелатонина на общий метаболизм могут реализовываться через МТ-рецепторы и посредством антиоксидантного действия мелатонина [2, 6–9]. Показано, что мелатонин ингибирует биосинтез и всасывание холестерина, а также увеличивает его распад и защищает клетки от токсического действия окисленных липопротеинов [2, 6]. Было подтверждено, что мелатонин улучшает чувствительность к инсулину, индуцирует регенерацию β-клеток в поджелудочной железе, способствует синтезу гликогена в печени [7]. Дефицит мелатонина в результате пинеалэктомии вызывал увеличение уровня триглицеридов, холестерина, глюкозы и инсулина у крыс [10, 11]. Также сниженный синтез мелатонина был ассоциирован с риском развития инсулинорезистентности и диабета 2-го типа у людей [12, 13].
Несмотря на то, что метаанализы клинических исследований [1–4] показали положительный эффект мелатонина на параметры липидного и углеводного обмена, до сих пор остается неясным зависимость этого эффекта от дозы и продолжительности терапии, а также от диеты. Кроме того, в клинических исследованиях часто мелатонин комбинируют с другими препаратами. К настоящему времени проведено много экспериментальных работ на крысах, исследующих влияние монотерапии мелатонином на уровень триглицеридов, холестерина, инсулина и глюкозы в условиях стандартной диеты, а также при диетах с повышенным содержанием углеводов (фруктозы), жиров и холестерина. Наша статья посвящена метаанализу результатов этих исследований.
МЕТОДЫ ИССЛЕДОВАНИЯ
Метаанализ был выполнен в соответствии с рекомендациями PRISMA (http://www.prisma-statement.org). Поиск исследований осуществлялся летом–осенью 2022 г. на английском и русском языках независимо двумя людьми в базах PubMed, Scopus, Google Scholar, elibrary без ограничения периода публикации. При поиске были использованы ключевые слова, характеризующие параметры липидного и углеводного обмена (липиды, углеводы, триглицериды, холестерин, липопротеины, глюкоза, инсулин), которые сочетались с воздействием (мелатонин, терапия мелатонином, инфузия мелатонина), объектом исследования (крысы, диета, корм, фруктоза, жиры, холестерин). Кроме того, дополнительно были просмотрены списки литературы публикаций, отобранных для метаанализа.
В метаанализ были включены исследования только монотерапии мелатонином. Отбирались только те работы, в которых животные содержались в стандартных лабораторных условиях при освещении 12:12 или 14:10 день/ночь. Были исключены исследования, в которых крысы находились при постоянных или непропорционально длительной темноте или освещении. Если в публикации не были уточнены условия содержания, то мы считали, что животные содержались в стандартных лабораторных условиях. Также мы исключили экспериментальные работы, поставленные на линиях крыс, чувствительных к изменению фотопериода (например Fisher) и с генетическими нарушениями метаболизма (например Zucker). Были исключены работы, исследующие влияние мелатонина на модели диабета/метаболического синдрома, вызванного введением токсичных веществ. В метаанализ включались исследования, проведенные только на интактных или ложнооперированных животных. Исключались работы с использованием новорожденных или слишком старых крыс, а также беременных самок. Кроме того, были исключены публикации, в которых результаты были отображены в непонятной форме, не позволяющей оценить среднее значение и SD/SEM.
Из отобранных работ извлекались данные по уровню в крови триглицеридов, общего холестерина (ОХ), липопротеинов высокой плотности (ЛВП), глюкозы и инсулина в контрольной группе и в группе животных, которые находились на терапии мелатонином. После извлечения из публикаций значения исследуемых биохимических показателей были переведены в одинаковые единицы измерения с помощью online калькулятора http://unitslab.com/ru (мг/дл – для концентрации триглицеридов, ОХ, ЛВП и глюкозы, мМЕ/л – для концентрации инсулина). Если в публикации концентрация инсулина была представлена в весовой форме, то она сначала переводилась в молярную, а затем с помощью http://unitslab.com/ru в мМЕ/л. Если данные были представлены отдельно для самцов и самок, то рассчитывалось среднее арифметическое.
При проведении метаанализа отдельно исследовались крысы на стандартной диете, на диете с повышенным содержанием фруктозы, на диете с повышенным содержанием жиров и на диете, обогащенной холестерином. Далее данные объединялись в субгруппы по времени терапии мелатонином (без учета дозы). Кроме того, там, где позволяло количество исследований, был проведен анализ зависимости эффекта от дозы, способа и времени введения мелатонина.
Метаанализ результатов исследований проводился с помощью статистической программы Review Manager 5.3 (Cochrane Library). Для анализа был использован inverse variance тест (Mean Difference). Гетерогенность включенных в метаанализ исследований устанавливали по критерию I2. Выбор модели фиксированных или рандомизированных эффектов осуществлялся в соответствии с рекомендациями [14]. Для оценки статистической значимости суммарных результатов применялся Z-тест. Предвзятость при отборе публикаций проверялась с помощью графика – воронки. Доверительный интервал – 95%. Различия считались статистически значимыми при p < 0.05. В тексте данные приведены в виде медианы и интерквартильного размаха или в виде среднего значения ± стандартное отклоненияе.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
По теме метаанализа в базах было найдено 1672 публикации, из них 74 обзора литературы. Было отобрано 53 работы [15–67 ], исследующих влияние монотерапии мелатонином на показатели липидного и углеводного обмена у крыс при различных диетах. Основные характеристики исследований представлены в таблице S (Приложение) , о рандомизации при выделении контрольной и опытной группы сообщалось в 23 публикациях. Терапия мелатонином продолжалась от 1 до 16 нед. Мелатонин вводился животным орально (через зонд или с питьевой водой), внутрибрюшинно и подкожно в дозах 0.15–50 мг/кг/день. В 13 работах мелатонин вводили перед или в темную фазу, в 12 – до полудня, в остальных работах – время введения не указано. В 31 работе сообщается о сборе крови натощак, в 2 работах [32, 55] авторы пишут, что крысы не голодали перед сбором крови, в остальных работах авторы не уточняют этот момент.
Стандартная диета
Всего было найдено 44 публикации, изучающие влияние терапии мелатонином на показатели липидного и углеводного обмена у крыс, содержащихся на стандартной диете. В 27 работах исследовалось влияние введения мелатонина на уровень циркулирующих триглицеридов и ОХ, в 16 работах – на уровень ЛВП, в 37 работах – на уровень глюкозы, в 18 – на уровень инсулина (табл. S ). У крыс, содержащихся на стандартной диете, средний уровень триглицеридов был 88 ± 47 мг/дл (M ± SD), ОХ – 79 ± 38 мг/дл, ЛВП – 38 ± 18 мг/дл, глюкозы – 118 ± 35 мг/дл, инсулина – 21 ± 15 мМЕ/л. Терапия мелатонином в дозе 0.1–40 мг/кг/день продолжалась в течение 1–16 нед. и не оказывала (без учета дозы) существенного влияния на уровень циркулирующих триглицеридов, ОХ и ЛВП у крыс, содержащихся на стандартной диете (рис. 1). Однако при этом на 2–6-й нед. терапии у крыс наблюдалось увеличение уровня глюкозы на 5.51 [1.98, 9.05] мг/дл, I2 = 28%, Z = 3.06, p = 0.002, а на 9–11-й неделе – снижение уровня инсулина на –2.66 [–5.11, –0.22] мМЕ/л, I2 = 0%, Z = 2.13, p = 0.03 (рис. 2).
Рис. 1.
Влияние терапии мелатонином на уровень триглицеридов, общего холестерина и липопротеинов высокой плотности у крыс, содержащихся на стандартной диете. I2 – гетерогенность, Z – суммарный эффект, p – значимость различий. Метаанализ проведен без стандартизации по дозе, способу и времени введения.

Рис. 2.
Влияние терапии мелатонином на уровень глюкозы и инсулина у крыс, содержащихся на стандартной диете. I2 – гетерогенность, Z – суммарный эффект, p – значимость эффекта. Метаанализ проведен без стандартизации по дозе, способу и времени введения.

Анализ зависимости эффекта от дозы без учета продолжительности терапии показал увеличение ЛВП и уменьшение инсулина при низких, но не при высоких дозах мелатонина. Изменение других показателей не зависело от дозы (рис. 3). Однако анализ зависимости эффекта мелатонина от дозы с учетом продолжительности терапии показал, что через 2 нед. терапии мелатонин в дозе ≥10 мг/кг/день вызывал значимое повышение уровня триглицеридов, глюкозы и инсулина, однако через 8 нед. этот эффект терапии не был выражен при любой дозе (табл. 1). Эффект мелатонина на концентрацию ОХ не зависел от дозы, однако через 8 нед. терапии мелатонин в дозе ≤1 мг/кг/день вызывал увеличение ЛВП, а в дозе ≥10 мг/кг/день, наоборот, незначительное уменьшение ЛВП (табл. 1).
Рис. 3.
Влияние дозы, способа и времени введения мелатонина на показатели липидного профиля, глюкозу и инсулин у крыс при разных диетах. I2 – гетерогенность, Z – суммарный эффект, p – значимость эффекта. Метаанализ проведен без дополнительной стандартизации.

Таблица1.
Зависимость от дозы эффекта мелатонина на показатели липидного и углеводного обмена у крыс, содержащихся на стандартной диете
| Неделя терапии | Доза мелатонина | N работ |
Объем выборки мелатонин/контроль |
Средняя разность | I2,% | Z | p | Тест на различия между субгруппами, p |
|---|---|---|---|---|---|---|---|---|
| Триглицериды (мг/дл) | ||||||||
| 2-я | ≤ 1 мг/кг/день | 3 | 21/21 | –8.86 [–20.66, 2.93] | 79 | 1.47 | 0.14 | 0.03 |
| 2-я | ≥ 10 мг/кг/день | 5 | 31/31 | 5.77 [0.33, 11.21] | 10 | 2.08 | 0.04 | |
| 8-я | ≤ 1 мг/кг/день | 2 | 14/14 | 2.80 [–6.82, 12.42] | 0 | 0.57 | 0.57 | 0.32 |
| 8-я | ≥ 10 мг/кг/день | 3 | 28/28 | –18.91 [–60.19, 22.38] | 94 | 0.90 | 0.37 | |
| Общий холестерин (мг/дл) | ||||||||
| 2-я | ≤ 1 мг/кг/день | 3 | 21/21 | –0.18 [–4.35, 4.00] | 66 | 0.08 | 0.93 | 0.83 |
| 2-я | ≥ 10 мг/кг/день | 5 | 31/31 | 0.75 [–6.88, 8.39] | 51 | 0.19 | 0.85 | |
| 8-я | ≤ 1 мг/кг/день | 2 | 14/14 | 1.81 [–22.24, 25.86] | 0 | 0.15 | 0.88 | 0.75 |
| 8-я | ≥ 10 мг/кг/день | 3 | 28/28 | –2.49 [–14.49, 9.52] | 90 | 0.41 | 0.68 | |
| Липопротеины высокой плотности (мг/дл) | ||||||||
| 2-я | ≤ 1 мг/кг/день | 3 | 21 / 21 | 1.61 [–1.11, 4.34] | 71 | 1.16 | 0.25 | 0.90 |
| 2-я | ≥ 10 мг/кг/день | 3 | 17 / 17 | 2.00 [–3.80, 7.80] | 80 | 0.68 | 0.50 | |
| 8-я | ≤ 1 мг/кг/день | 2 | 14 / 14 | 8.43 [2.83, 14.02] | 0 | 2.95 | 0.003 | 0.003 |
| 8-я | ≥ 10 мг/кг/день | 2 | 18 / 18 | –5.29 [–12.30, 1.72] | 96 | 1.48 | 0.14 | |
| Глюкоза (мг/дл) | ||||||||
| 2-я | ≤ 1 мг/кг/день | 3 | 19 / 19 | 2.12 [–8.35, 12.60] | 54 | 0.40 | 0.69 | 0.31 |
| 2-я | ≥ 10 мг/кг/день | 5 | 31 / 31 | 8.48 [2.26, 14.69] | 6 | 2.67 | 0.008 | |
| 8-я | ≤ 1 мг/кг/день | 5 | 46 / 43 | –0.32 [–12.58, 11.94] | 80 | 0.05 | 0.96 | 0.96 |
| 8-я | ≥ 10 мг/кг/день | 6 | 52 / 50 | 0.03 [–6.94, 7.00] | 65 | 0.01 | 0.99 | |
| Инсулин (мМЕ/л) | ||||||||
| 2-я | ≤ 1 мг/кг/день | 2 | 13 / 13 | –3.69 [–11.53, 4.14] | 62 | 0.92 | 0.36 | 0.29 |
| 2-я | ≥ 10 мг/кг/день | 3 | 18 / 18 | 0.50 [0.15, 0.86] | 0 | 2.80 | 0.005 | |
Мы оценили влияние способа введения мелатонина на его эффекты при стандартной диете без учета дозы и продолжительности терапии. Терапия мелатонином вызывала значимое повышение уровня триглицеридов и ЛВП при внутрибрюшинном введении; значимое снижение уровня триглицеридов и увеличение ЛВП – при подкожном введении; значимое снижение уровня инсулина – при введении с питьевой водой (рис. 3). Наиболее сильно уровень глюкозы повышался при внутрибрюшинном введении и при введении через желудочный зонд (рис. 3). Не было существенного влияния способа введения мелатонина на его эффект на уровень ОХ (рис. 2). Однако большой разброс по дозам и продолжительности терапии не позволяет нам сделать окончательный вывод. Если сравнивать отдельные работы, в которых использовались одинаковые дозы мелатонина, то после 2 нед. терапии введение мелатонина в дозе 10 мг/кг/день через зонд [15] и внутрибрюшинно [40] не оказывало эффекта на уровень триглицеридов, ОХ, глюкозы и инсулина, но внутрибрюшинное введение повышало концентрацию ЛВП. После 3 нед. терапии мелатонин, введенный орально [16] или подкожно [30] в дозе 10 мг/кг/день, не изменял уровень ОХ и ЛВП, но при подкожном введении снижал уровень триглицеридов. 8-недельный оральный прием мелатонина в дозе 10 мг/кг/день не изменял или слегка повышал уровень глюкозы [35, 64, 67], а внутрибрюшинное 8-недельное введение мелатонина слегка снижало уровень глюкозы [53].
Прием мелатонина в светлую фазу способствовал увеличению уровня глюкозы и ЛВП, перед темной фазой или в темную фазу – снижал уровень триглицеридов (рис. 3). Однако при проведении этого метаанализа мы не учитывали продолжительность терапии, дозу и способ введения. При сравнении отдельных исследований, в которых использовались одинаковая доза (около 1 мг/кг/день), способ (внутрибрюшинное) и продолжительность (8 нед.) введения, при утреннем введении мелатонин незначительно повышал уровень глюкозы, а при вечернем – наблюдалось существенное снижение [28, 46].
В нашей работе мы не исследовали влияния возраста животных на эффект мелатонина ввиду того, что было мало работ с использованием возрастных крыс, большинство исследователей проводили эксперименты на 1.5–3-месячных крысах. Однако установлено, что старение ассоциировано с ухудшением показателей липидного профиля и толерантности к глюкозе [68, 69]. Интересно отметить, что прием мелатонина в течение 5–16 нед. снижал уровень триглицеридов, но не ОХ у крыс 5–12-месячного возраста, содержащихся на стандартной диете [21, 23, 44]. Причем мелатонин (в дозе 0.5 мг/кг/день, 12 нед.) лучше снижал триглицериды и глюкозу у самок, а инсулин – у самцов [23]. Снижение уровня глюкозы у 3-месячных самок наблюдал и Chuffa с соавт. [28] после 8-недельной терапии мелатонином в дозе 1 мг/кг/день. Однако по сообщениям Mustonen с соавт. [48] при стандартном освещении и диете 4 недельная терапия мелатонином в дозе 2 мг/кг/день незначительно увеличивала уровень глюкозы у 2-месячных самцов и самок, а уровень инсулина – только у самцов.
Диета, обогащенная фруктозой
Всего было отобрано 7 публикаций, изучающих влияние терапии мелатонином на показатели липидного и углеводного обмена у крыс, содержащихся на диете, обогащенной фруктозой. Фруктоза в разных концентрациях добавлялась либо в питьевую воду, либо в корм. Во всех работах, кроме двух, введение фруктозы и мелатонина начиналось одновременно. В 2 исследованиях [40, 52] добавление фруктозы в диету начиналось за 4 и 8 нед. до начала терапии и продолжалась во время терапии. В 7 работах исследовалось влияние введения мелатонина на уровень циркулирующих триглицеридов, в 6 работах – на уровень ОХ, в 5 работах – на уровень ЛВП, в 4 работах – на уровень глюкозы и инсулина (табл. S ). У крыс, содержащихся на диете, обогащенной фруктозой, средний уровень триглицеридов был 164 ± 115 мг/дл, ОХ – 89 ± 31 мг/дл, ЛВП – 34 ± 26 мг/дл, глюкозы – 190 ± 58 мг/дл, инсулина – 34 ± 19 мМЕ/л. Терапия мелатонином в дозе 1–30 мг/кг/день продолжалась в течение 2–10 нед. и снижала уровень циркулирующих триглицеридов, ОХ и инсулина. Наблюдалась тенденция увеличения ЛВП при приеме мелатонина (рис. 4). Эффект терапии был заметен уже через 2 нед. после начала. Концентрация глюкозы существенно не изменялась при приеме мелатонина на данной диете (рис. 4). Эффект терапии был незначительно лучше при более низких дозах мелатонина (рис. 3). Внутрибрюшинное введение увеличивало уровень ЛВП, для других параметров не удалось установить зависимость от способа введения (рис. 3). Мы не смогли оценить зависимость эффекта терапии от времени введения мелатонина, поскольку во многих работах время введения не было указано.
Диета, обогащенная жирами
Всего было отобрано 11 публикаций, изучающих влияние терапии мелатонином на показатели липидного и углеводного обмена у крыс, содержащихся на диете, обогащенной различными пищевыми жирами. В 9 исследованиях [22, 38, 49–51, 55, 57, 62, 66] высокожировая диета и терапия мелатонином начинались одновременно, в 2 исследованиях [63, 65] высокожировая диета начиналась за 4 и 8 недель до начала терапии и продолжалась во время терапии. В 9 работах исследовалось влияние введения мелатонина на уровень циркулирующих триглицеридов, в 8 работах – на уровень ОХ, в 6 работах – на уровень ЛВП, в 7 работах – на уровень глюкозы, в 6 работах – на уровень инсулина (табл. S ). У крыс, содержащихся на диете, обогащенной жирами, средний уровень триглицеридов был 135 ± 101 мг/дл, ОХ – 129 ± 45 мг/дл, ЛВП – 24 ± 16 мг/дл, глюкозы – 109 ± 31 мг/дл, инсулина – 63 ± 74 мМЕ/л. Терапия мелатонином в дозе 1–50 мг/кг/день продолжалась в течение 2–16 нед. Мелатонин существенно снижал уровень триглицеридов и ОХ у крыс, содержащихся на жирной диете (рис. 5). Также наблюдалась тенденция снижения уровня глюкозы и инсулина (рис. 5). Данные по влиянию терапии на уровень ЛВП очень противоречивы (рис. 5). Результаты включенных в метаанализ работ показали, что при более низких дозах мелатонин увеличивал уровень ЛВП, при высоких дозах – незначительно уменьшал (рис. 3). На другие параметры доза не оказывала существенного влияния (рис. 3). Зависимость эффекта терапии от способа и времени введения мы не смогли оценить из-за недостаточного количества публикаций.
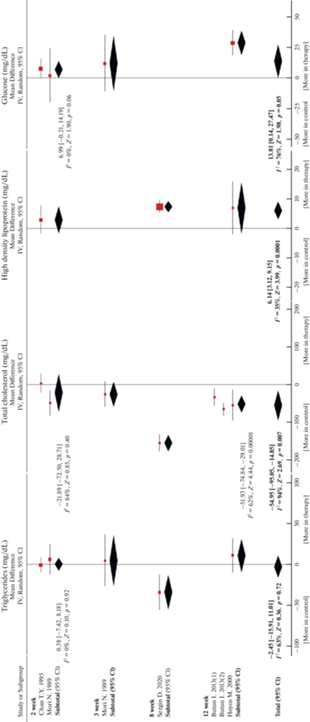
Диета, обогащенная холестерином
Всего было отобрано 5 публикаций, изучающих влияние терапии мелатонином на показатели липидного и углеводного обмена у крыс, содержащихся на диете, обогащенной холестерином. Холестерин (1–2%) вместе с холевой кислотой (0.2–0.5%) добавлялся в стандартный корм. В 5 работах высокохолестериновая диета и терапия мелатонином начинались одновременно, в 1 работе наряду с одновременным введением было исследовано введение мелатонина через 2 нед. высокохолестериновой диеты [60]. В 4 работах исследовалось влияние введения мелатонина на уровень циркулирующих триглицеридов, в 5 работах – на уровень ОХ, в 3 работах – на уровень ЛВП, в 3 работах – на уровень глюкозы (табл. S ). У крыс, содержащихся на диете, обогащенной холестерином, средний уровень триглицеридов был 65 ± 21 мг/дл, ОХ – 165 ± 43 мг/дл, ЛВП – 17 ± 11 мг/дл, глюкозы – 108 ± 11 мг/дл. Терапия мелатонином в дозе 0.3–17 мг/кг/день продолжалась в течение 2–12 нед. Мелатонин значимо снижал уровень ОХ и увеличивал уровень ЛВП, но не оказывал влияния на концентрацию триглицеридов (рис. 6). Также наблюдалась тенденция увеличения уровня глюкозы на фоне терапии (рис. 6). Не было установлено зависимости эффекта от дозы (рис. 3). Работ, исследующих влияния введения мелатонина на уровень инсулина при данной диете, не было найдено. Во всех работах, кроме одной [34], мелатонин вводился внутрибрюшинно. Зависимость эффекта терапии от времени введения мы также не смогли оценить из-за недостаточного количества публикаций.
Рис. 6.
Влияние терапии мелатонином на показатели липидного профиля и глюкозу у крыс, содержащихся на диете, обогащенной холестерином. I2 – гетерогенность, Z – суммарный эффект, p – значимость эффекта. Метаанализ проведен без стандартизации по дозе, способу и времени введения.
По результатам нашего метаанализа, терапия мелатонином максимально снижала уровень триглицеридов и инсулина у крыс, находящихся на диете с добавлением фруктозы, а уровень ОХ – у крыс, содержащихся на диете, обогащенной жирами и холестерином. Эффект терапии на уровень ЛВП был максимально выражен на диете, обогащенной холестерином. В табл. 2 отображены суммарные эффекты монотерапии мелатонином на показатели липидного и углеводного обмена при различных диетах.
Таблица 2.
Зависимость от диеты эффекта мелатонина на показатели липидного и углеводного обмена
| Параметры | Стандартная диета | Диета, обогащенная фруктозой | Диета, обогащенная жирами | Диета, обогащенная холестерином |
|---|---|---|---|---|
| Триглицериды | б/и или ↑ * # ^ $ |
↓ | ↓ | б/и |
| Общий холестерин | б/ и | ↓ | ↓ | ↓ |
| Липопротеины высокой плотности | б/и или ↑ * ^ $ |
б/и или ↑ ^ |
↓ или ↑ * |
↑ |
| Глюкоза | б/и или ↑ * # $ |
б/и | б/и | ↑ или б/и |
| Инсулин | б/и или ↑ или ↓ * # ^ |
↓ | ↓ или б/и | – |
Следует отметить, что мы не исследовали в нашем метаанализе влияние терапии мелатонином на липопротеины низкой плотности (ЛНП) из-за разной методики оценки в разных публикациях (показатели ЛНП могли включать, а могли и не включать липопротеины очень низкой плотности), что привело к очень большому разбросу значений ЛНП даже у крыс, находящихся на стандартной диете (от 7 до 126 мг/дл). Однако то, что у крыс, находящихся на диете с добавлением фруктозы, жиров и холестерина, терапия мелатонином вызывала снижение ОХ без изменения или с увеличением ЛВП, свидетельствует о том, что снижение ОХ происходило, главным образом, за счет уменьшения концентрации ЛНП. Об этом также свидетельствуют и опубликованные результаты исследований [22, 24, 26, 31, 34, 37, 38, 51, 60, 63].
При анализе диет мы не учитывали точный состав диет и время начала диеты (до или одновременно с терапией мелатонином), поскольку было мало работ, в которых диета предшествовала терапии и продолжалась далее вместе с терапией. Но исследование высокохолестериновой диеты показало, что мелатонин был эффективен в любом случае [60].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенный нами метаанализ показал, что у крыс, содержащихся на стандартной диете, мелатонин значимо снижал уровень инсулина (9–11 нед.) и увеличивал концентрацию глюкозы в крови (2–6 нед.), а при дозе ≥10 мг/кг/день также вызывал повышение уровня циркулирующих триглицеридов и инсулина в начале терапии (2 нед.). Эффект мелатонина на концентрацию ОХ не зависел от дозы у крыс, содержащихся на стандартной диете, однако через 8 нед. терапии мелатонин в дозе ≤1 мг/кг/день вызывал увеличение ЛВП, а в дозе ≥10 мг/кг/день, наоборот, незначительное уменьшение ЛВП. Интересно отметить, что в работах, где одновременно исследовались разные дозы мелатонина при стандартной диете, не был зафиксирован существенный эффект дозы на параметры липидного профиля, но наблюдалось незначительное увеличение уровня глюкозы при более высоких дозах при терапии 2 и 6, но не 8 нед. [40, 46, 58].
Диета, обогащенная фруктозой, вызывала у крыс существенное повышение уровня триглицеридов, глюкозы и инсулина. Известно, что при метаболизме фруктозы наряду с глюкозой образуется глицерол, из которого и синтезируются триглицериды [70]. У крыс, находящихся на диете, обогащенной жирами, наблюдалось увеличение уровня триглицеридов, ОХ, инсулина и снижение концентрации ЛВП. Жирная диета, по сравнению с диетой с добавлением фруктозы, вызывала изменение триглицеридов в меньшей степени, а инсулина и ОХ – в большей. У крыс, содержащихся на диете, обогащенной холестерином, наблюдалось увеличение уровня ОХ и снижение концентрации ЛВП без увеличения уровня триглицеридов. По результатам метаанализа при диетах с повышенным содержанием фруктозы и жира терапия мелатонином снижала концентрацию триглицеридов, ОХ и инсулина; а при диете, обогащенной холестерином, мелатонин снижал уровень ОХ и повышал уровень ЛВП, но не изменял концентрацию триглицеридов. При этом уровень триглицеридов и инсулина максимально снижался мелатонином у крыс, находящихся на диете с добавлением фруктозы, а уровень ОХ – у крыс, содержащихся на диете, обогащенной жирами и холестерином. В работe [63] после 8-недельного введения мелатонина крысам, содержащимся на жирной диете, наблюдали увеличение фекального холестерина, как предполагают, за счет стимуляции секреции холестерина желчи и снижения поглощения холестерина в кишечнике. После терапии мелатонином уровень глюкозы оставался без существенных изменений при диетах с добавлением фруктозы и жиров, но увеличивался при диете, обогащенной холестерином. Мы не выявили положительного эффекта увеличения дозы мелатонина на показатели липидного и углеводного обмена ни при одной из исследованных диет. Однако отдельные работы показали незначительное усиление положительного эффекта терапии на уровень ОХ с увеличением дозы мелатонина у крыс, содержащихся на диетах, обогащенных фруктозой, жирами и холестерином [24, 40, 63]. Поскольку эффект терапии зависел от диеты, это подтверждает гомеостатическую роль мелатонина в метаболизме липидов.
Вероятно, способ введения мелатонина также мог оказать влияние на эффект мелатонина по причине различий в биодоступности, периоде до достижения максимальной концентрации и выведения. Так, при стандартной диете уровень триглицеридов максимально повышался при внутрибрюшинном введении, глюкозы – при введениях внутрибрюшинном или через желудочный зонд. Инсулин максимально снижался при введении с питьевой водой, когда поступление мелатонина в организм растянуто во времени. У крыс, содержащихся на стандартной диете и диете, обогащенной фруктозой, внутрибрюшинное и подкожное введение мелатонина повышало уровень ЛВП. Показано, что внутрибрюшинное и подкожное введение препаратов по сравнению с оральным введением ассоциировано с большей биодоступностью и с более коротким временем достижения максимальных плазменных концентраций [71, 72]. В то же время, по результатам нашего метаанализа, при всех диетах снижение ЛВП было ассоциировано с низкими дозами мелатонина. Кроме того (без учета дозы и продолжительности терапии), при стандартной диете введение мелатонина в светлую фазу способствовало повышению уровня глюкозы и ЛВП, а в темную фазу – способствовало снижению уровня триглицеридов. По результатам работы [55] у крыс, содержащихся на жирной диете, амплитуда снижения уровня триглицеридов и инсулина была незначительно больше при вечернем приеме мелатонина, чем при утреннем, но эффект на уровень глюкозы не зависел от времени приема. Здесь, вероятно, играет роль усиление или ослабление экзогенным мелатонином циркадных изменений метаболизма. Интересно отметить, что введение мелатонина перед темной фазой сильнее смещало циркадный профиль глюкозы, чем введение мелатонина непосредственно в темную фазу [57, 58].
В основе влияния мелатонина на метаболизм большую роль, вероятно, играет то, что он модулирует уровень инсулина и чувствительность к нему. Известно, что инсулин является одним из главных гормонов обмена веществ. Основные эффекты инсулина на углеводно-липидный обмен состоят в: утилизации глюкозы тканями, накоплении гликогена, в синтезе жирных кислот и подавлении липолиза [73, 74]. Инсулинорезистентность сопровождается снижением чувствительности клеток к инсулину, что приводит к увеличению уровня циркулирующих липидов, глюкозы и инсулина, а также к ухудшению липидного профиля за счет увеличения ЛНП и уменьшения ЛВП [74]. Повышенное употребление фруктозы и жиров ассоциировано с развитием инсулинорезистентности [70, 74]. В экспериментах мелатонин не изменял толерантность к глюкозе и чувствительность к инсулину при стандартной диете, но уменьшал инсулинорезистентность при диете, обогащенной жирами или фруктозой [40, 51]. У крыс, содержащихся на стандартной диете, мелатонин не изменял экспрессии инсулиновых рецепторов в гепатоцитах и поджелудочной железе [33, 54], но увеличивал их экспрессию в шишковидной железе [54]. Кроме того, после 10-недельной терапии мелатонином снижение экспрессии инсулиновых рецепторов в гипоталамусе наблюдалось и при стандартной, и при жирной диете, но эффект при жирной диете был выражен сильнее [75]. Поскольку, по результатам нашего метаанализа, длительная терапия мелатонином вызывала снижения уровня инсулина, триглицеридов и ОХ, но при этом увеличивала или не изменяла концентрацию глюкозы в крови, можно предположить, что продолжительный прием мелатонина уменьшает синтез инсулина.
Результаты экспериментов, исследующих влияние мелатонина на обмен глюкозы, очень противоречивы. Так, в экспериментах in vitro наблюдали увеличение секреции соматостатина (гормона, ингибирующего инсулин) в культуре клеток островков поджелудочной железы человека после обработки мелатонином [76]. Однако прием мелатонина вызывал снижение уровня соматостатина в крови у людей и грызунов [77, 78]. В экспериментах наблюдали повышение уровня глюкозы, инсулина, ОХ и ЛВП через 30–60 мин после однократного периферического введения мелатонина [79, 80]. При этом интрацеребровентрикулярная инъекция мелатонина подавляла глюконеогенез в печени крыс [81]. Ряд исследований показал увеличение уровня глюкозы при дефиците мелатонина, вызванном пинеалэктомией или постоянным освещением [10, 82, 83].
Эффекты мелатонина на уровень инсулина реализуются через мембранные МТ‑ (МТ1 и МТ2) рецепторы, сопряженные с G-белками. Рецепторы МТ1 и МТ2 проявляют разную чувствительность к физиологическим (30–400 пМ) и супрафизиологическим (1–1000 нМ) концентрациями мелатонина [84]. К числу эффекторных систем, которые активируются мелатонином, относятся аденилатциклаза, фосфолипаза С, фосфолипаза А2, калиевые каналы, гуанилатциклаза, кальциевые каналы. В желудочно-кишечном тракте, в том числе в поджелудочной железе и в печени, экспрессируют как МТ1-, так и МТ2-рецепторы [84, 85]. Причем плотность МТ1- и МТ2-рецепторов в поджелудочной железе самая высокая в бета-клетках у недиабетических пациентов и в дельта-клетках у пациентов с диабетом [84]. С одной стороны, мелатонин ингибирует секрецию инсулина бета-клетками, подавляя через МТ1- и МТ2-рецепторы путь аденилатциклазы, а также через МТ2-рецепторы путь гуанилатциклазы. С другой стороны, мелатонин может также стимулировать секрецию инсулина через МТ2-рецепторы за счет высвобождения инозитолтрифосфата. Кроме того, мелатонин может модулировать реакцию инсулина на глюкагоноподобный пептид 1, глюконеогенез, секрецию глюкагона и соматостатина, чувствительность печени к инсулину, активность липопротеиновой липазы, механизмы регуляции гипоталамус–печень [6, 84]. Установлено, что линии мышей с генетической делецией МТ1- и МТ1/МТ2-рецепторов демонстрируют повышенный уровень инсулина в старом возрасте [86]; а риск диабета у людей был ассоциирован с повышенной экспрессией МТ-рецепторов в островках поджелудочной железы [87] и с определенными вариантами MTNR1B гена [84]. Мутация в гене GPR50 (сиротский рецептор, который структурно схож с рецепторами мелатонина без способности связывать мелатонин) ассоциирована с повышенным уровнем триглицеридов и снижением ЛВП [88]. У мышей с нокаутом GPR50 наблюдались уменьшение прироста массы тела и жира при высококалорийной диете, но меньшие потери массы при голодании [89]. Экспрессия МТ-рецепторов связана с циркадным циклом, а экспрессия GPR50 чувствительна не только к изменениям фотопериода, но и к энергетическому статусу, уровню лептина и диете [88–90]. В экспериментах у мышей экспрессия GPR50 в головном мозге (в эпендиме третьего желудочка и в дорсомедиальных ядрах гипоталамуса) снижалась как при голодании, так и при высококалорийной диете [89]. Известно, что МТ1-, МТ2- и GPСR-рецепторы могут образовывать гетеродимеры, причем GPR50 угнетает аффинность МТ1-рецепторов, но не МТ2 [88]. Можно предположить, что зависимость физиологических эффектов мелатонина от дозы и диеты объясняется разной чувствительностью типов МТ-рецепторов к мелатонину и изменением их экспрессии при различных диетах.
Было установлено, что мелатонин влияет на экспрессию многих генов, участвующих в гомеостазе холестерина, глюконеогенезе, липидном обмене, чувствительности к инсулину, антиоксидантных эффектах (Abc, Acsl3, Aldh3a2, Dhodh, Gpi, Gpt2, PGC1α, PPARα, PPARγ, NRF, SIRT1, C/EBP и др.) [6, 64, 91]. В экспериментах при повышенном потреблении фруктозы и жира наблюдали изменения экспрессии этих генов, а также циркадных генов, которые могли быть нивелированы введением мелатонина [57, 64, 91, 92]. Есть гипотеза, что мелатонин может реализовывать свои эффекты не только через мембранные МТ-рецепторы, но также через связанные с ретиноевой кислотой ядерные ROR-рецепторы. Предполагают, что мелатонин является лигандом средней аффинности для ROR, при этом лигандами высокой аффинности для ROR является холестерин и стероиды [93]. Кроме того, некоторые авторы допускают модуляцию мелатонином экспрессии генов посредством метилирования ДНК [6].
Мелатонин может оказывать влияние на показатели липидного и углеводного обмена через модуляцию аппетита и пищевого поведения. Есть наблюдения изменения под действием мелатонина экспрессии генов POMC, NPY, leptin-R (участвуют в регуляции аппетита) в гипоталамусе [75], а также уменьшения концентрации лептина у крыс, содержащихся на жирной диете [49, 55, 57]. Однако длительный прием мелатонина по результатам одних работ не вызывал у крыс независимо от диеты существенного изменения количества потребляемой пищи [23, 29, 37, 48, 61, 63], по результатам других – увеличивал [50] или уменьшал [28, 45].
Известно, что в природе снижение метаболизма зимой у позвоночных животных связано с угнетением под действием мелатонина секреции тиреотропного гормона гипофиза (ТТГ), что в итоге приводит к уменьшению экспрессии гена DIO2 (с активацией DIO3) и секреции активного трийодтиронина (Т3) [8]. Содержание крыс в условиях короткого дня сопровождалось увеличением уровня мелатонина и уменьшением концентрации циркулирующих тироксина и Т3 [94]. Гормоны щитовидной железы участвуют как в глюконеогенезе, так и в гликогенолизе, как в липогенезе, так и в липолизе. Кроме того, установлено, что Т3 необходим для перехода клеток островков поджелудочной железы в чувствительные к глюкозе клетки, секретирующие инсулин [95]. В экспериментах наблюдали у крыс после внутривенного введения мелатонина дозозависимое снижение уровня ТТГ в плазме [96], а прием мелатонина (в дозе 3–10 мг/кг/день) в течение 1–5 нед. существенно снижал уровень тиреоидных гормонов [17, 21, 97, 98]. Однако к 8 нед. терапии (мелатонин в дозе 1–10 мг/кг/день) активность гормонов щитовидной железы, по-видимому, нормализовывалась или даже увеличивалась [64, 99, 100]. С другой стороны, терапия в дозе 10 мг/л (1.5 мг/кг/день) продолжительностью 32 нед. и более также была ассоциирована с уменьшением ТТГ и свободного Т3 [100]. В ряде работ были обнаружены изменения уровней ТТГ и тиреоидных гормонов у крыс, содержащихся на диетах с повышенным содержанием фруктозы и жира [101–104].
Мелатонин также оказывает влияние на метаболизм через свои антиоксидантные свойства. Есть сообщения, что секреция инсулина может ингибироваться мелатонином посредством снижения уровня активных форм кислорода в островках поджелудочной железы [105]. Диеты с повышенным содержанием фруктозы, жиров и холестерина ассоциированы с угнетением антиоксидантных ферментативных систем и с увеличением окислительного стресса [31, 40, 50, 51, 60, 70, 91, 106]. Известно, что при фруктолизе и липолизе вырабатываются первичные метаболиты (свободные жирные кислоты, желчные кислоты, мочевая кислота, лактат), повышение концентраций которых вызывает увеличение активных форм кислорода [70, 106]. Прием мелатонина может ослабить окислительный стресс благодаря своим антиоксидантным свойствам и способности снижать уровень вредных метаболитов [9, 26, 34]. В экспериментах терапия мелатонином снижала концентрацию мочевой кислоты и малонового диальдегида (индикатора окислительного стресса) в крови, при этом повышая концентрацию ферментов, защищающих от окислительного повреждения. Кроме того, мелатонин улучшал функционирование митохондрий, которое было существенно нарушено при метаболическом синдроме [9]. Антиоксидантный эффект мелатонина был сильнее выражен у крыс, содержащихся на диетах с повышенным содержанием фруктозы, жиров и холестерина по сравнению с животными, потребляющими стандартную диету [31, 34, 40, 50, 51, 60].
ЗАКЛЮЧЕНИЕ
В итоге, наш метаанализ показал, что длительная монотерапия мелатонином улучшает показатели липидного профиля (снижает уровень триглицеридов и ОХ в основном за счет снижения уровня ЛНП) у крыс, содержащихся на диетах, обогащенных фруктозой, жирами и холестерином. Это делает возможным использование мелатонина для профилактики и лечения метаболических нарушений, сопровождающихся гиперлипидемией. Следует учесть, что мелатонин может несколько повышать уровень глюкозы в крови. Однако этот эффект был выражен на стандартной диете и на диете, обогащенной холестерином, но не на диетах с повышенным содержанием фруктозы и жира. Некоторые исследователи установили, что это побочное действие мелатонина существенно уменьшается, если прием пищи и прием мелатонина разделены во времени [87]. Как показал наш метаанализ, у крыс, содержащихся на стандартной диете, ухудшение показателей углеводного обмена при терапии было ассоциировано с более высокими дозами мелатонина в начале терапии, с внутрибрюшинным введением или с введением через желудочный зонд, с введением в светлую фазу. Однако следует учесть, что крысы, являясь ночными животными, основную часть корма и воды потребляют именно ночью. Кроме того, высокие дозы мелатонина были ассоциированы с ухудшением показателей липидного обмена при стандартной диете. Наш метаанализ не выявил положительного эффекта увеличения дозы мелатонина при диетах, обогащенных фруктозой, жирами и холестерином. Зависимость эффекта мелатонина от диеты подтверждает важную роль мелатонина в поддержании гомеостаза.
Список литературы
Mohammadi-Sartang M, Ghorbani M, Mazloom Z (2018) Effects of melatonin supplementation on blood lipid concentrations: A systematic review and meta-analysis of randomized controlled trials. Clin Nutr 37 (6 Pt A): 1943–1954. https://doi.org/10.1016/j.clnu.2017.11.003
Loloei S, Sepidarkish M, Heydarian A, Tahvilian N, Khazdouz M, Heshmati J, Pouraram H (2019) The effect of melatonin supplementation on lipid profile and anthropometric indices: A systematic review and meta-analysis of clinical trials. Diabetes Metab Syndr 13 (3): 1901–1910. https://doi.org/10.1016/j.dsx.2019.04.043
Lauritzen ES, Kampmann U, Smedegaard SB, Støy J (2021) Effects of daily administration of melatonin before bedtime on fasting insulin, glucose and insulin sensitivity in healthy adults and patients with metabolic diseases. A systematic review and meta-analysis. Clin Endocrinol (Oxf) 95 (5): 691–701. https://doi.org/10.1111/cen.14576
Delpino FM, Figueiredo LM, Nunes BP (2021) Effects of melatonin supplementation on diabetes: A systematic review and meta-analysis of randomized clinical trials. Clin Nutr 40 (7): 4595–4605. https://doi.org/10.1016/j.clnu.2021.06.007
Acuña-Castroviejo D, Escames G, Venegas C, Díaz-Casado ME, Lima-Cabello E, López LC, Rosales-Corral S, Tan DX, Reiter RJ (2014) Extrapineal melatonin: sources, regulation, and potential functions. Cell Mol Life Sci 71 (16): 2997–3025. https://doi.org/10.1007/s00018-014-1579-2
Karolczak K, Watala C (2019) The Mystery behind the Pineal Gland: Melatonin Affects the Metabolism of Cholesterol. Oxid Med Cell Longev : 4531865. https://doi.org/10.1155/2019/4531865
Guan Q, Wang Z, Cao J, Dong Y, Chen Y (2021) Mechanisms of Melatonin in Obesity: A Review. Int J Mol Sci 23 (1): 218. https://doi.org/10.3390/ijms23010218
Dardente H, Wyse CA, Birnie MJ, Dupré SM, Loudon A.S, Lincoln GA, Hazlerigg DG (2010) A molecular switch for photoperiod responsiveness in mammals. Curr Biol 20 (24): 2193–2198. https://doi.org/10.1016/j.cub.2010.10.048
Chitimus DM, Popescu MR, Voiculescu SE, Panaitescu AM, Pavel B, Zagrean L, Zagrean AM (2020) Melatonin’s Impact on Antioxidative and Anti-Inflammatory Reprogramming in Homeostasis and Disease. Biomolecules10 (9): 1211. https://doi.org/10.3390/biom1009121
Wang Y, Liu X, Wang W, Song W, Chen L, Fang Q, Yan X (2013) The expression of inflammatory cytokines on the aorta endothelia are up-regulated in pinealectomized rats. Inflammation 36 (6): 1363–1373. https://doi.org/10.1007/s10753-013-9676-1
Santos RMD, Marani F, Chiba FY, Mattera MSLC, Tsosura TVS, Tessarin GWL, Pereira RF, Belardi BE, Pinheiro BCES, Sumida DH (2018) Melatonin promotes reduction in TNF levels and improves the lipid profile and insulin sensitivity in pinealectomized rats with periodontal disease. Life Sci 213: 32–39. https://doi.org/10.1016/j.lfs.2018.09.056
McMullan CJ, Curhan GC, Schernhammer ES, Forman JP (2013) Association of nocturnal melatonin secretion with insulin resistance in nondiabetic young women. Am J Epidemiol 178 (2): 231–238. https://doi.org/10.1093/aje/kws470
McMullan CJ, Schernhammer ES, Rimm EB, Hu FB, Forman JP (2013) Melatonin secretion and the incidence of type 2 diabetes. JAMA 309 (13): 1388–1396. https://doi.org/10.1001/jama.2013.2710
Borenstein M, Hedges LV, Higgins JPT, Rothstein HR (2009) Introduction to Meta-analysis. Wiley: Chichester.
Abdulwahab DA, El-Missiry MA, Shabana S, Othman AI, Amer ME (2021) Melatonin protects the heart and pancreas by improving glucose homeostasis, oxidative stress, inflammation and apoptosis in T2DM-induced rats. Heliyon 7 (3): e06474. https://doi.org/10.1016/j.heliyon.2021.e06474
Adeyemi WJ, Abdussalam TA, Abdulrahim A, Olayaki LA (2020) Elevated, sustained, and yet reversible biotoxicity effects of lead on cessation of exposure: Melatonin is a potent therapeutic option. Toxicol Ind Health 36 (7): 477–486. https://doi.org/10.1177/0748233720937199
Ahmed HH, Mannaa F, Elmegeed GA, Doss SH (2005) Cardioprotective activity of melatonin and its novel synthesized derivatives on doxorubicin-induced cardiotoxicity. Bioorg Med Chem 13 (5): 1847–1457. https://doi.org/10.1016/j.bmc.2004.10.066
Alqasim AA, Nour Eldin EEM, Hammadi SH, Esheba GE (2020) Comparing the renoprotective effects of the antioxidants melatonin, vitamin D and vitamin E in diabetic rats. J Taibah Univ Med Sci 15 (5): 351–357. https://doi.org/10.1016/j.jtumed.2020.05.007
Aoyama H, Mori N, Mori W (1987) Anti-glucocorticoid effects of melatonin on adult rats. Acta Pathol Jpn 37 (7): 1143–1148. https://doi.org/10.1111/j.1440-1827.1987.tb00431.x
Aydin M, Oktar S, Ozkan OV, Alçin E, Oztürk OH, Nacar A (2011) Letrozole induces hepatotoxicity without causing oxidative stress: the protective effect of melatonin. Gynecol Endocrinol 27 (4): 209–215. https://doi.org/10.3109/09513590.2010.488769
Benova T, Viczenczova C, Radosinska J, Bacova B, Knezl V, Dosenko V, Weismann P, Zeman M, Navarova J, Tribulova N (2013) Melatonin attenuates hypertension-related proarrhythmic myocardial maladaptation of connexin-43 and propensity of the heart to lethal arrhythmias. Can J Physiol Pharmacol 91 (8): 633–639. https://doi.org/10.1139/cjpp-2012-0393
Bernasconi PA, Cardoso NP, Reynoso R, Scacchi P, Cardinali DP (2013) Melatonin and diet-induced metabolic syndrome in rats: impact on the hypophysial-testicular axis. Horm Mol Biol Clin Investig16 (2): 101–112. https://doi.org/10.1515/hmbci-2013-0005
Bojková B, Orendás P, Friedmanová L, Kassayová M, Datelinka I, Ahlersová E, Ahlers I (2008) Prolonged melatonin administration in 6-month-old Sprague-Dawley rats: metabolic alterations. Acta Physiol Hung 95 (1): 65–76. https://doi.org/10.1556/APhysiol.95.2008.4
Butun I, Ekmekci H, Ciftci O, Sonmez H, Caner M, Altug T, Kokoglu E (2013) The effects of different doses of melatonin on lipid peroxidation in diet-induced hypercholesterolemic rats. Bratisl Lek Listy 114 (3): 129–132. https://doi.org/10.4149/bll_2013_028
Cam M, Yavuz O, Guven A, Ercan F, Bukan N, Ustündag N (2003) Protective effects of chronic melatonin treatment against renal injury in streptozotocin-induced diabetic rats. J Pineal Res 35 (3): 212–220. https://doi.org/10.1034/j.1600-079x.2003.00082.x
Cardinali DP, Bernasconi PA, Reynoso R, Toso CF, Scacchi P (2013) Melatonin may curtail the metabolic syndrome: studies on initial and fully established fructose-induced metabolic syndrome in rats. Int J Mol Sci 14 (2): 2502–2514. https://doi.org/10.3390/ijms14022502
Chan TY, Tang PL (1995) Effect of melatonin on the maintenance of cholesterol homeostasis in the rat. Endocr Res 21 (3): 681–696. https://doi.org/10.1080/07435809509030483
Chuffa LG, Amorim JP, Teixeira GR, Mendes LO, Fioruci BA, Pinheiro PF, Seiva FR, Novelli EL, Mello Júnior W, Martinez M, Martinez FE (2011) Long-term melatonin treatment reduces ovarian mass and enhances tissue antioxidant defenses during ovulation in the rat. Braz J Med Biol Res 44 (3): 217–223. https://doi.org/10.1590/s0100-879x2011007500018
Djordjevic B, Cvetkovic T, Stoimenov TJ, Despotovic M, Zivanovic S, Basic J, Veljkovic A, Velickov A, Kocic G, Pavlovic D, Sokolovic D (2018) Oral supplementation with melatonin reduces oxidative damage and concentrations of inducible nitric oxide synthase, VEGF and matrix metalloproteinase 9 in the retina of rats with streptozotocin/nicotinamide induced pre-diabetes. Eur J Pharmacol 833: 290–297. https://doi.org/10.1016/j.ejphar.2018.06.011
Ebaid H, Bashandy SA, Alhazza IM, Rady A, El-Shehry S (2013) Folic acid and melatonin ameliorate carbon tetrachloride-induced hepatic injury, oxidative stress and inflammation in rats. Nutr Metab (Lond) 10 (1): 20. https://doi.org/10.1186/1743-7075-10-20
Ewida SF, Al-Sharaky DR (2016) Implication of Renal Aquaporin-3 in Fructose-Induced Metabolic Syndrome and Melatonin Protection. J Clin Diagn Res 10 (4): CF06–CF11. https://doi.org/10.7860/JCDR/2016/18362.7656
Görgün FM, Oztürk Z, Gümüştaş MK, Kökogu E (2002) Melatonin administration affects plasma total sialic acid and lipid peroxidation levels in streptozotocin induced diabetic rats. J Toxicol Environ Health A 65 (10): 695–700. https://doi.org/10.1080/00984100290071045
Hajam YA, Rai S (2019) Melatonin and insulin modulates the cellular biochemistry, histoarchitecture and receptor expression during hepatic injury in diabetic rats. Life Sci 239:117046.https://doi.org/10.1016/j.lfs.2019.117046
Hoyos M, Guerrero JM, Perez-Cano R, Olivan J, Fabiani F, Garcia-Pergañeda A, Osuna C (2000) Serum cholesterol and lipid peroxidation are decreased by melatonin in diet-induced hypercholesterolemic rats. J Pineal Res 28 (3): 150–155. https://doi.org/10.1034/j.1600-079x.2001.280304.x
Kadry SM, El-Dakdoky MH, Haggag NZ, Rashed LA, Hassen MT (2018) Melatonin improves the therapeutic role of mesenchymal stem cells in diabetic rats. Toxicol Mech Methods 28 (7): 529–538. https://doi.org/10.1080/15376516.2018.1471634
Kamsrijai U, Wongchitrat P, Nopparat C, Satayavivad J, Govitrapong P (2020) Melatonin attenuates streptozotocin-induced Alzheimer-like features in hyperglycemic rats. Neurochem Int 132: 104601. https://doi.org/10.1016/j.neuint.2019.104601
Kantar Ş, Türközkan N, Bircan FS, Paşaoğlu ÖT (2015) Beneficial effects of melatonin on serum nitric oxide, homocysteine, and ADMA levels in fructose-fed rats. Pharm Biol 53 (7): 1035–1041. https://doi.org/10.3109/13880209.2014.957782
Khalil SS, Aziz JA, Ismail KA, El-Malkey NF (2021) Comparative protective effects of N-acetylcysteine and melatonin against obesity-induced testicular dysfunction in rats. Can J Physiol Pharmacol 99 (7): 708–719. https://doi.org/10.1139/cjpp-2020-0499
Kim C, Kim N, Joo H, Youm JB, Park WS, Cuong DV, Park YS, Kim E, Min CK, Han J (2005) Modulation by melatonin of the cardiotoxic and antitumor activities of adriamycin. J Cardiovasc Pharmacol 46 (2): 200–210. https://doi.org/10.1097/01.fjc.0000171750.97822.a2
Kitagawa A, Ohta Y, Ohashi K (2012) Melatonin improves metabolic syndrome induced by high fructose intake in rats. J Pineal Res 52 (4): 403–413. https://doi.org/10.1111/j.1600-079X.2011.00955.x
Korkmaz GG, Uzun H, Cakatay U, Aydin S (2012) Melatonin ameliorates oxidative damage in hyperglycemia-induced liver injury. Clin Invest Med 35 (6): E370–E377. https://doi.org/10.25011/cim.v35i6.19209
Leibowitz A, Peleg E, Sharabi Y, Shabtai Z, Shamiss A, Grossman E (2008) The role of melatonin in the pathogenesis of hypertension in rats with metabolic syndrome. Am J Hypertens 21 (3): 348–351. https://doi.org/10.1038/ajh.2007.60
Li T, Ni L, Zhao Z, Liu X, Lai Z, Di X, Xie Z, Song X, Wang X, Zhang R, Liu C (2018) Melatonin attenuates smoking-induced hyperglycemia via preserving insulin secretion and hepatic glycogen synthesis in rats. J Pineal Res 64 (4): e12475. https://doi.org/10.1111/jpi.12475
Mendes C, Lopes AM, do Amaral FG, Peliciari-Garcia RA, Turati Ade O, Hirabara SM, Scialfa Falcão JH, Cipolla-Neto J (2013) Adaptations of the aging animal to exercise: role of daily supplementation with melatonin. J Pineal Res 55 (3): 229–239. https://doi.org/10.1111/jpi.12065
Montano ME, Molpeceres V, Mauriz JL, Garzo E, Cruz IB, González P, Barrio JP (2010) Effect of melatonin supplementation on food and water intake in streptozotocin-diabetic and non-diabetic male Wistar rats. Nutr Hosp 25 (6): 931–938.
Montilla PL, Vargas JF, Túnez IF, Muñoz de Agueda MC, Valdelvira ME, Cabrera ES (1998) Oxidative stress in diabetic rats induced by streptozotocin: protective effects of melatonin. J Pineal Res 25 (2): 94–100. https://doi.org/10.1111/j.1600-079x.1998.tb00545.x
Mori N, Aoyama H, Murase T, Mori W (1989) Anti-hypercholesterolemic effect of melatonin in rats. Acta Pathol Jpn 39 (10): 613–618. https://doi.org/10.1111/j.1440-1827.1989.tb02407.x
Mustonen AM, Nieminen P, Hyvärinen H (2002) Effects of continuous light and melatonin treatment on energy metabolism of the rat. J Endocrinol Invest 25 (8): 716–723. https://doi.org/10.1007/BF03345106
Nduhirabandi F, Du Toit EF, Blackhurst D, Marais D, Lochner A (2011) Chronic melatonin consumption prevents obesity-related metabolic abnormalities and protects the heart against myocardial ischemia and reperfusion injury in a prediabetic model of diet-induced obesity. J Pineal Res 50 (2): 171–182. https://doi.org/10.1111/j.1600-079X.2010.00826.x
Obayemi MJ, Akintayo CO, Oniyide AA, Aturamu A, Badejogbin OC, Atuma CL, Saidi AO, Mahmud H, Olaniyi KS (2021) Protective role of melatonin against adipose-hepatic metabolic comorbidities in experimentally induced obese rat model. PLoS One 16 (12): e0260546. https://doi.org/10.1371/journal.pone.0260546
Oladele CA, Akintayo CO, Badejogbin OC, Oniyide AA, Omoaghe AO, Agunbiade TB, Olaniyi KS (2022) Melatonin ameliorates endocrine dysfunction and defective sperm integrity associated with high-fat diet-induced obesity in male Wistar rats. Andrologia 54 (1): e14242. https://doi.org/10.1111/and.14242
Ovali MA, Oztopuz O, Vardar SA (2021) Melatonin ameliorates cardiac remodelling in fructose-induced metabolic syndrome rat model by using genes encoding cardiac potassium ion channels. Mol Biol Rep 48 (8): 5811–5819. https://doi.org/10.1007/s11033-021-06526-3
Paskaloglu K, Sener G, Ayanğolu-Dülger G (2004) Melatonin treatment protects against diabetes-induced functional and biochemical changes in rat aorta and corpus cavernosum. Eur J Pharmacol 499 (3): 345–354. https://doi.org/10.1016/j.ejphar.2004.08.002
Peschke E, Schucht H, Mühlbauer E (2010) Long-term enteral administration of melatonin reduces plasma insulin and increases expression of pineal insulin receptors in both Wistar and type 2-diabetic Goto-Kakizaki rats. J Pineal Res 49 (4): 373–381. https://doi.org/10.1111/j.1600-079X.2010.00804.x
Prunet-Marcassus B, Desbazeille M, Bros A, Louche K, Delagrange P, Renard P, Casteilla L, Pénicaud L (2003) Melatonin reduces body weight gain in Sprague Dawley rats with diet-induced obesity. Endocrinology 144 (12): 5347–5352. https://doi.org/10.1210/en.2003-0693
Rao MV, Purohit A, Patel T (2010) Melatonin protection on mercury-exerted brain toxicity in the rat. Drug Chem Toxicol 33 (2): 209–216. https://doi.org/10.3109/01480540903349258
Ríos-Lugo MJ, Cano P, Jiménez-Ortega V, Fernández-Mateos MP, Scacchi PA, Cardinali DP, Esquifino AI (2010) Melatonin effect on plasma adiponectin, leptin, insulin, glucose, triglycerides and cholesterol in normal and high fat-fed rats. J Pineal Res 49 (4): 342–348. https://doi.org/10.1111/j.1600-079X.2010.00798.x
Sankaran M, Subramanian P (2006) Modulation of biochemical circadian rhythms during long-term melatonin treatment in rats. Singapore Med J 47 (1): 424–427.
Sener G, Sehirli O, Yegen BC, Cetinel S, Gedik N, Sakarcan A (2004) Melatonin attenuates ifosfamide-induced Fanconi syndrome in rats. J Pineal Res 37 (1): 17–25. https://doi.org/10.1111/j.1600-079X.2004.00131.x
Sezgin D, Aslan G, Sahin K, Tuzcu M, İlhan N, Sahna E (2020) The effects of melatonin against atherosclerosis-induced endothelial dysfunction and inflammation in hypercholesterolemic rats. Arch Physiol Biochem: 1–8. https://doi.org/10.1080/13813455.2020.1838550
Terrón MP, Delgado-Adámez J, Pariente JA, Barriga C, Paredes SD, Rodríguez AB (2013) Melatonin reduces body weight gain and increases nocturnal activity in male Wistar rats. Physiol Behav118: 8–13. https://doi.org/10.1016/j.physbeh.2013.04.006
Труфакин ВА, Шурлыгина АВ, Душкин МИ, Храпова МВ, Мичурина СВ, Мельникова ЕВ, Пантелеева НГ, Тендитник МВ (2014) Влияние мелатонина на клеточный состав селезенки и показатели липидного обмена у крыс с алиментарным ожирением. Бюл экспер биол мед 158 (7): 49–52. [Trufakin VA, Shurlygina AV, Dushkin MI, Khrapova MV, Michurina SV, Mel’nikova EV, Panteleeva NG, Tenditnik MV (2014) Effect of melatonin on cellular composition of the spleen and parameters of lipid metabolism in rats with alimentary obesity. Bull Exp Biol Med 158(7): 49–52. (In Russ)]. https://doi.org/10.1007/s10517-014-2687-6
Tung YT, Chiang PC, Chen YL, Chien YW (2020) Effects of Melatonin on Lipid Metabolism and Circulating Irisin in Sprague-Dawley Rats with Diet-Induced Obesity. Molecules 25 (15): 3329. https://doi.org/10.3390/molecules25153329
Wang L, McFadden JW, Yang G, Zhu H, Lian H, Fu T, Sun Y, Gao T, Li M (2021) Effect of melatonin on visceral fat deposition, lipid metabolism and hepatic lipo-metabolic gene expression in male rats. J Anim Physiol Anim Nutr (Berl) 105 (4): 787–796. https://doi.org/10.1111/jpn.13497
Wongchitrat P, Klosen P, Pannengpetch S, Kitidee K, Govitrapong P, Isarankura-Na-Ayudhya C (2017) High-fat diet-induced plasma protein and liver changes in obese rats can be attenuated by melatonin supplementation. Nutr Res 42: 51–63. https://doi.org/10.1016/j.nutres.2017.04.011
Yildirim A, Arabacı Tamer S, Sahin D, Bagriacik F, Kahraman MM, Onur ND, Cayirli YB, Cilingir Kaya ÖT, Aksu B, Akdeniz E, Yuksel M, Çetinel Ş, Yeğen BÇ (2019) The effects of antibiotics and melatonin on hepato-intestinal inflammation and gut microbial dysbiosis induced by a short-term high-fat diet consumption in rats. Br J Nutr 122 (8): 841–855. https://doi.org/10.1017/S0007114519001466
Zaitone S, Hassan N, El-Orabi N, El-Awady el-S (2011) Pentoxifylline and melatonin in combination with pioglitazone ameliorate experimental non-alcoholic fatty liver disease. Eur J Pharmacol 662 (1-3): 70–77. https://doi.org/10.1016/j.ejphar.2011.04.049
Quirós Cognuck S, Reis WL, Silva M, Debarba LK, Mecawi AS, de Paula FJA, Rodrigues Franci C, Elias LLK, Antunes-Rodrigues J (2020) Sex differences in body composition, metabolism-related hormones, and energy homeostasis during aging in Wistar rats. Physiol Rep 8 (20): e14597. https://doi.org/10.14814/phy2.14597
Boudet J, Roullet JB, Lacour B (1988) Influence of fast, body weight and diet on serum cholesterol, triglycerides, and phospholipids concentrations in the aging rat. Horm Metab Res 20 (12): 734–737. https://doi.org/10.1055/s-2007-1010934
Zhang DM, Jiao RQ, Kong LD (2017) High Dietary Fructose: Direct or Indirect Dangerous Factors Disturbing Tissue and Organ Functions. Nutrients 9 (4): 335. https://doi.org/10.3390/nu9040335
Al Shoyaib A, Archie SR, Karamyan VT (2019) Intraperitoneal Route of Drug Administration: Should it Be Used in Experimental Animal Studies? Pharm Res 37(1): 12. https://doi.org/10.1007/s11095-019-2745-x
Zetner D, Andersen LP, Rosenberg J (2016) Pharmacokinetics of Alternative Administration Routes of Melatonin: A Systematic Review. Drug Res (Stuttg) 66(4): 169–173. https://doi.org/10.1055/s-0035-1565083
Petersen MC, Shulman GI (2018) Mechanisms of Insulin Action and Insulin Resistance. Physiol Rev 98 (4): 2133–2223. https://doi.org/10.1152/physrev.00063.2017
Lebovitz HE (2001) Insulin resistance: definition and consequences. Exp Clin Endocrinol Diabetes 109 Suppl 2: S135–S148. https://doi.org/10.1055/s-2001-18576
Ríos-Lugo MJ, Jiménez-Ortega V, Cano-Barquilla P, Mateos PF, Spinedi EJ, Cardinali DP, Esquifino AI (2015) Melatonin counteracts changes in hypothalamic gene expression of signals regulating feeding behavior in high-fat fed rats. Horm Mol Biol Clin Invest 21(3): 175–183. https://doi.org/10.1515/hmbci-2014-0041
Zibolka J, Mühlbauer E, Peschke E (2015) Melatonin influences somatostatin secretion from human pancreatic δ-cells via MT1 and MT2 receptors. J Pineal Res 58(2): 98–209. https://doi.org/10.1111/jpi.12206
Nassar E, Mulligan C, Taylor L, Kerksick C, Galbreath M, Greenwood M, Kreider R, Willoughby DS (2007) Effects of a single dose of N-Acetyl-5-methoxytryptamine (Melatonin) and resistance exercise on the growth hormone/IGF-1 axis in young males and females. J Int Soc Sports Nutr 4: 14. https://doi.org/10.1186/1550-2783-4-14
Cuesta S, Kireev R, García C, Rancan L, Vara E, Tresguerres JA (2013) Melatonin can improve insulin resistance and aging-induced pancreas alterations in senescence-accelerated prone male mice (SAMP8). Age (Dordr) 35 (3): 659–671. https://doi.org/10.1007/s11357-012-9397-7
Niijima A, Chun SJ, Shima T, Bizot-Espiard JG, Guardiola-Lemaitre B, Nagai K (1998) Effect of intravenous administration of melatonin on the efferent activity of the adrenal nerve. J Auton Nerv Syst 71 (2-3): 134–138. https://doi.org/10.1016/s0165-1838(98)00067-8
Fabiś M, Pruszyńska E, Maćkowiak P (2002) In vivo and in situ action of melatonin on insulin secretion and some metabolic implications in the rat. Pancreas 25 (2): 166–169. https://doi.org/10.1097/00006676-200208000-00009
Faria JA, Kinote A, Ignacio-Souza LM, de Araújo TM, Razolli DS, Doneda DL, Paschoal LB, Lellis-Santos C, Bertolini GL, Velloso LA, Bordin S, Anhê GF (2013) Melatonin acts through MT1/MT2 receptors to activate hypothalamic Akt and suppress hepatic gluconeogenesis in rats. Am J Physiol Endocrinol Metab 305 (2): E230–E242. https://doi.org/10.1152/ajpendo.00094.2013
la Fleur SE, Kalsbeek A, Wortel J, van der Vliet J, Buijs RM (2001) Role for the pineal and melatonin in glucose homeostasis: pinealectomy increases night-time glucose concentrations. J Neuroendocrinol 13 (12): 1025–1032. https://doi.org/10.1046/j.1365-2826.2001.00717.x
Xing L, Wu S, Shi Y, Yue F, Wei L, Russell R, Zhang D (2022) Chronic constant light exposure aggravates high fat diet-induced renal injury in rats. Front Endocrinol (Lausanne) 13: 900392. https://doi.org/10.3389/fendo.2022.900392
Nikolaev G, Robeva R, Konakchieva R (2021) Membrane Melatonin Receptors Activated Cell Signaling in Physiology and Disease. Int J Mol Sci 23 (1): 471. https://doi.org/10.3390/ijms23010471
Mathes AM (2010) Hepatoprotective actions of melatonin: possible mediation by melatonin receptors. World J Gastroenterol 16 (48): 6087–6097. https://doi.org/10.3748/wjg.v16.i48.6087
Bazwinsky-Wutschke I, Bieseke L, Mühlbauer E, Peschke E (2014) Influence of melatonin receptor signalling on parameters involved in blood glucose regulation. J Pineal Res 56 (1): 82–96. https://doi.org/10.1111/jpi.12100
Garaulet M, Qian J, Florez JC, Arendt J, Saxena R, Scheer FAJL (2020) Melatonin Effects on Glucose Metabolism: Time To Unlock the Controversy. Trends Endocrinol Metab 31 (3): 192–204. https://doi.org/10.1016/j.tem.2019.11.011
Jockers R, Maurice P, Boutin JA, Delagrange P (2008) Melatonin receptors, heterodimerization, signal transduction and binding sites: what’s new? Br J Pharmacol 154(6): 1182–1195. https://doi.org/10.1038/bjp.2008.184
Ivanova EA, Bechtold DA, Dupré SM, Brennand J, Barrett P, Luckman SM, Loudon AS (2008) Altered metabolism in the melatonin-related receptor (GPR50) knockout mouse. Am J Physiol Endocrinol Metab 294 (1): E176–E182. https://doi.org/10.1152/ajpendo.00199.2007
Bechtold DA, Sidibe A, Saer BR, Li J, Hand LE, Ivanova EA, Darras VM, Dam J, Jockers R, Luckman SM, Loudon AS (2012) A role for the melatonin-related receptor GPR50 in leptin signaling, adaptive thermogenesis, and torpor. Curr Biol 22 (1): 70–77. https://doi.org/10.1016/j.cub.2011.11.043
Valenzuela-Melgarejo FJ, Caro-Díaz C, Cabello-Guzmán G (2018) Potential Crosstalk between Fructose and Melatonin: A New Role of Melatonin-Inhibiting the Metabolic Effects of Fructose. Int J Endocrinol: 7515767. https://doi.org/10.1155/2018/7515767
de Farias TDSM, Cruz MM, de Sa RCDC, Severi I, Perugini J, Senzacqua M, Cerutti SM, Giordano A, Cinti S, Alonso-Vale MI (2019) Melatonin Supplementation Decreases Hypertrophic Obesity and Inflammation Induced by High-Fat Diet in Mice. Front Endocrinol (Lausanne) 10: 750. https://doi.org/10.3389/fendo.2019.00750
Ma H, Kang J, Fan W, He H, Huang F (2021) ROR: Nuclear Receptor for Melatonin or Not? Molecules 26 (9): 2693. https://doi.org/10.3390/molecules26092693
Ostrowska Z, Kos-Kudla B, Marek B, Kajdaniuk D (2003) Influence of lighting conditions on daily rhythm of bone metabolism in rats and possible involvement of melatonin and other hormonesin this process. Endocr Regul 37(3): 163–174.
Mullur R, Liu YY, Brent GA (2014) Thyroid hormone regulation of metabolism. Physiol Rev 94 (2): 355–382. https://doi.org/10.1152/physrev.00030.2013
Mitsuma T, Nogimori T (1985) Effects of various drugs on thyrotropin secretion in rats. Horm Metab Res 17 (7): 337–341. https://doi.org/10.1055/s-2007-1013537
Baltaci AK, Mogulkoc R, Kul A, Bediz CS, Ugur A (2004) Opposite effects of zinc and melatonin on thyroid hormones in rats. Toxicology 195 (1): 69–75. https://doi.org/10.1016/j.tox.2003.09.001
Ozturk G, Coşkun S, Erbaş D, Hasanoglu E (2000) The effect of melatonin on liver superoxide dismutase activity, serum nitrate and thyroid hormone levels. Jpn J Physiol 50 (1): 149–153. https://doi.org/10.2170/jjphysiol.50
Mirunalini S, Subramanian P (2005) Temporal oscillations of thyroid hormones in long term melatonin treated rats. Pharmazie 60 (1): 52–56.
Виноградова ИА (2009) Влияние препаратов “мелатонин” и “эпиталон” на возрастную динамику тиреотропной активности гипофиза и функции щитовидной железы в разных световых режимах. Успехи геронтол 22 (4): 631–638. [Vinogradova IA (2009) Effect of preparations melatonin and epitalon on the age-related dynamics of thyrotrophic activity of the hypophysis and thyroid gland function in different light regimes. Adv Gerontol 22(4):631–638. (In Russ)].
Macdonald I (1989) Some effects of various dietary carbohydrates on thyroid activity in the rat. Ann Nutr Metab 33 (1): 15–21. https://doi.org/10.1159/000177516
El-Sayed SM, Ibrahim HM (2020) Effect of high-fat diet-induced obesity on thyroid gland structure in female rats and the possible ameliorating effect of metformin therapy. Folia Morphol (Warsz) 79 (3): 476–488. https://doi.org/10.5603/FM.a2019.0100
Shao SS, Zhao YF, Song YF, Xu C, Yang JM, Xuan SM, Yan HL, Yu CX, Zhao M, Xu J, Zhao JJ (2014) Dietary high-fat lard intake induces thyroid dysfunction and abnormal morphology in rats. Acta Pharmacol Sin 35(11): 1411–1420. https://doi.org/10.1038/aps.2014.82
Araujo RL, Andrade BM, Padrón AS, Gaidhu MP, Perry RL, Carvalho DP, Ceddia RB (2010) High-fat diet increases thyrotropin and oxygen consumption without altering circulating 3,5,3'-triiodothyronine (T3) and thyroxine in rats: the role of iodothyronine deiodinases, reverse T3 production, and whole-body fat oxidation. Endocrinology 151 (7): 3460–3469. https://doi.org/10.1210/en.2010-0026
Simões D, Riva P, Peliciari-Garcia RA, Cruzat VF, Graciano MF, Munhoz AC, Taneda M, Cipolla-Neto J, Carpinelli AR (2016) Melatonin modifies basal and stimulated insulin secretion via NADPH oxidase. J Endocrinol 231 (3): 235–244. https://doi.org/10.1530/JOE-16-0259
Hauck AK, Huang Y, Hertzel AV, Bernlohr DA (2019) Adipose oxidative stress and protein carbonylation. J Biol Chem 294 (4): 1083–1088. https://doi.org/10.1074/jbc.R118.003214
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Таблица S. Публикации, отобранные для метаанализа
Инструменты
Российский физиологический журнал им. И.М. Сеченова




