Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 2, стр. 163-177
Белок YB-1 предотвращает возрастное снижение уровня эстрадиола в плазме крови у трансгенных стареющих самок мышей 5xFAD
Д. Ю. Жданова 1, В. И. Ковалев 1, А. В. Чаплыгина 1, Н. В. Бобкова 1, Р. А. Полтавцева 2, *, Г. Т. Сухих 2
1 Институт биофизики клетки РАН
Пущино, Россия
2 НМИЦ акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова Минздрава России
Москва, Россия
* E-mail: rimpol@mail.ru
Поступила в редакцию 02.12.2022
После доработки 20.12.2022
Принята к публикации 26.12.2022
- EDN: NEECQX
- DOI: 10.31857/S0869813923020103
Аннотация
Болезнь Альцгеймера (БА) представляет собой неизлечимое нейродегенеративное заболевание, которое является основной причиной деменции в пожилом возрасте. При поиске новых методов лечения БА было обращено внимание на мультифункциональный Υ-бокс-связывающий белок 1 (YB-1). Ранее нами было выявлено положительное влияние интраназального введения YB-1 на обучение и пространственную память наряду со снижением содержания церебрального β-амилоида и интенсивности бляшкообразования, с улучшением выживаемости нейронов в коре и гиппокампе самцов мышей, моделирующих БА. Однако БА в 2 раза чаще развивается у женщин по сравнению с мужчинами, поэтому большой интерес представляет изучение эффектов YB-1 на стареющих самках. Эстрогены и андрогены необходимы для сохранения когнитивной функции в процессе старения и, по-видимому, могут препятствовать развитию БА. В данной работе изучали периферические уровни эстрадиола и цитокинов после интраназального введения YB-1 стареющим самкам трансгенных мышей 5xFAD и контрольным нетрансгенным животным. У интактных стареющих животных обеих групп выявлено нарушение эстрального цикла и снижение уровня эстрадиола в плазме крови. У мышей, которым вводили YB-1, не наблюдалось характерного возрастного снижения уровня эстрадиола в плазме. Введение YB-1 не влияло на периферический уровень цитокинов. Таким образом, показан новый, ранее не описанный эффект YB-1 на уровень эстрадиола в плазме у стареющих самок мышей. Эти данные указывают на то, что YB-1 может быть перспективным соединением в профилактике и лечении нейродегенеративных заболеваний. Тем не менее, необходимы дальнейшие эксперименты, чтобы получить представление о подробных механизмах действия YB-1.
ВВЕДЕНИЕ
Как известно, болезнь Альцгеймера (БА) представляет собой неизлечимое нейродегенеративное заболевание, которое является основной причиной деменции в пожилом возрасте [1]. Специфический нейродегенеративный процесс, затрагивающий структуры мозга, ответственные за память, приводит к развитию этого заболевания. При поиске новых методов лечения БА было обращено внимание на мультифункциональный Υ-бокс-связывающий белок 1 (YB-1 или YBX1). Белок YB-1 относится к семейству высококонсервативных белков с доменом холодового шока. Так, например, аминокислотная последовательность YB-1 человека и кролика отличается всего двумя синонимичными аминокислотными заменами (E24D, D293E). Этот ДНК- и РНК-связывающий белок участвует в целом ряде клеточных процессов, включая пролиферацию, дифференцировку и ответ на стрессовые воздействия.
Связываясь с определенными нуклеотидными последовательностями в промоторах ряда важнейших генов, YB-1 позитивно или негативно влияет на их транскрипцию [2]. Кроме того, YB-1 обладает повышенным сродством к участкам ДНК с нарушенной вторичной структурой и способствует процессу репарации ДНК, а ускоряя обмен комплементарных нуклеотидных последовательностей в двойных спиралях ДНК, он, как предполагается, может участвовать в рекомбинации ДНК [3]. YB-1 участвует в альтернативном сплайсинге предшественников мРНК в ядре, упаковывает молекулы мРНК в цитоплазме, определяет их функциональную активность, стабильность, а также локализацию транслирующихся мРНК на актиновом скелете [4]. YB-1 может секретироваться из клеток по неклассическому механизму [5], что предполагает возможность его внеклеточной активности, в частности в качестве лиганда рецептора Notch3 [6], чей сигнальный путь часто нарушается при нейродегенеративных патологиях. YB-1 участвует в регуляции клеточной пролиферации, поддержании статуса стволовых клеток и дифференцировке нейрональных предшественников [7]. YB-1 повышает стрессоустойчивость клеток и препятствует их преждевременному старению. YB-1 локализуется в клетках многих органов и тканей, а в головном мозге этот белок обнаружен в нейронах коры мозга и гиппокампа [8, 9], однако его количество резко уменьшается с возрастом. На двух экспериментальных моделях БА in vivo ранее нами было выявлено положительное влияние интраназального введения YB-1 на обучение и пространственную память наряду со снижением содержания церебрального β-амилоида и интенсивности амилоидогенеза, а также с улучшением выживаемости нейронов в коре и гиппокампе [10]. Все описанные свойства белка YB-1 демонстрируют его как перспективный объект при поиске средств лечения нейродегенеративных заболеваний, в том числе и БА.
Стоит отметить, что все ранее опубликованные нами данные о нейропротекторных свойствах белка YB-1 были получены при работе с самцами животных, хотя, как известно, БА в 2 раза чаще развивается у женщин по сравнению с мужчинами [11]. Поэтому исследование эффектов YB-1 на стареющих самках представляет большой интерес. В качестве одного из факторов риска БА, которое увеличивает возможность развития патологических нейродегенеративных процессов, деменции и БА у мужчин и женщин [11–16], мы рассматриваем возрастное снижение уровня половых стероидных гормонов, таких как тестостерона и эстрадиола (Е2). После менопаузы у женщин относительно быстро падает уровень половых гормонов яичников, 17-бета-эстрадиола и прогестерона, что наблюдается как в крови, так и в головном мозге, при этом повышается подверженность нейронов нейродегенеративным изменениям [14, 15, 17]. У стареющих мужчин также происходит значительное снижение уровня циркулирующего тестостерона (явление, известное как дефицит андрогенов у стареющих мужчин), однако это не обязательно связано с потерей репродуктивной функции. Такие гормональные изменения происходят постепенно и, начиная с 30-летнего возраста, биодоступные уровни тестостерона снижаются на 2–3% ежегодно [17]. Истощение половых стероидных гормонов происходит вследствие нормального старения организма, при котором возрастает вероятность развития патологии в чувствительных к гормонам тканях, включая и мозг [15–19].
Е2, основной женский половой стероидный гормон, синтезируется из холестерина в несколько стадий как в периферических тканях и в органах, в том числе в яичниках, семенниках, надпочечниках, печени, молочной железе, так и во многих областях мозга. Он взаимодействует с эстрогеновыми рецепторами (ER) ERα, ERβ и GPER1 [20–22]. Хорошо изучен прямой, так называемый классический, механизм передачи сигналов эстрогенов. В этом процессе эстрогеновые рецепторы ERα и ERβ выступают в качестве факторов транскрипции, активируемых лигандом. Эстроген, проникая через клеточную мембрану, образует комплекс с ядерными ERα и ERβ и перемещается к ядру, где взаимодействует с определенными участками ДНК и регулирует активность многих генов и, в итоге, синтез ряда белков. Негеномная активность эстрогенов опосредуется подмножеством классических мембранных ER, ERα и ERβ, связанных с двумя сигнальными путями. Эстрогеновый рецептор α (ERα) передает сигнал через метаботропный глутаматный рецептор 1a (mGluR1a), который вызывает активацию Gq, PLC, IP3 и MAPK и, наконец, фосфорилирование фактора транскрипции CREB. Это позволяет предположить, что взаимодействие между ER и mGluR1a может иметь важное значение для улучшения памяти. Второй путь – активация, опосредованная кавеолином. Кавеолы представляют собой специализированные мембранные инвагинации, обогащенные каркасным белком кавеолином-1. Кавеолы облегчают передачу сигнала, предоставляя место для взаимодействия различных сигнальных молекул с их лигандами. Опосредованная кавеолином активация mGluR2/3 с помощью ER приводит к ингибированию Са2+-каналов L-типа и блокаде протеинкиназы-A [23]. Мембранные ER также активируют мембранные тирозинкиназные рецепторы. ERα, активированный эстрадиолом, взаимодействует непосредственно с рецептором IGF-I, что приводит к активации сигнального пути, запускаемого через MAPK. Также есть данные о негеномных действиях 17β-эстрадиола, включая мобилизацию ионов внутриклеточного кальция, а также стимуляцию активности аденилатциклазы и продукцию цАМФ. Член семейства рецепторов, связанных с G-белком (GPCR), GPR30 также с высокой аффинностью взаимодействует с эстрадиолом и частично отвечает за его быстрое негеномное действие [22, 24].
Системный уровень эстрадиола (Е2) имеет значительные индивидуальные колебания, но всегда повышается в преовуляторную фазу менструального цикла или в фазу течки. Менопауза характеризуется исчезновением менструального цикла и снижением уровня циркулирующего эстрадиола [25–27].
В гиппокампе взрослых грызунов Е2, взаимодействуя с ядерными ER, стимулирует нейрогенез, усиливает пролиферацию, ускоряет дифференцировку нейронов и увеличивает выживаемость клеток в зубчатой извилине [28]. Е2 участвует в экспрессии генов, связанных с регуляцией транскрипции [29] и в усилении передачи сигналов ERK/MAPK [30]. Кроме того, эстрогены модулируют активность дофаминовых, серотониновых и холинергических ионотропных рецепторов. Введение Е2 улучшает когнитивные функции у экспериментальных животных [25, 26], что связано с активацией эндогенного нейрогенеза [31–33]. Систематический обзор взаимосвязи между использованием гормональной терапии у женщин в постменопаузе с риском развития БА или ее применения для лечения симптоматики БА показывает, что из 11 контролируемых клинических испытаний, проведенных с января 1994 г. по декабрь 2020 г., в семи было показано улучшение когнитивных функций после гормональной терапии. В оставшихся четырех испытаниях не было обнаружено различий между пациентами с гормонотерапией и контрольной группой женщин [34].
В настоящее время становится ясно, что нейровоспаление играет значительную роль в инициации и прогрессировании БА, для которого характерны аномальная активация микроглии, приводящая к гиперпродукции белков острой фазы и высвобождению провоспалительных цитокинов, интерлейкинов и хемокинов [35–39]. Однако ввиду противоречивости данных, полученных в разных исследованиях, нет определенной ясности в вопросе о том, как патологические изменения в головном мозге влияют на периферические показатели. Поиск маркеров, отражающих начавшийся нейродегенеративный процесс в мозге, важен как для ранней диагностики, так и для контроля эффективности проводимой терапии. Также известно, что Е2 участвует в ингибировании нейровоспалительных сигнальных путей, связанных с IL-1β, IL-6 и TNF, и снижает уровень оксида азота и активных форм кислорода [40–44].
Возрастное снижение периферического E2, по-видимому, отражает аналогичный процесс в головном мозге и является одним из факторов риска БА. Корреляция между уровнями воспалительных факторов при БА в головном мозге и периферической системе весьма неоднозначна. В то же время белок YB-1 предотвращает развитие нейродегенерации в головном мозге. Это позволяет предположить, что введение YB-1 может оказывать влияние и на системный уровень эстрадиола у стареющих животных.
Целью работы было изучение эффектов длительного интраназального введения YB-1 на уровень Е2 в плазме крови стареющих трансгенных самок 5xFAD – классической модели фамильной формы БА [45] в сопоставлении с этим показателем у нетрансгенных мышей возрастного контроля. Также проведен анализ влияния интраназального введения YB-1 на маркеры периферического воспаления, связанного с нейровоспалением в мозге, для чего определены уровни провоспалительных интерлейкинов IL-1β, IL-6 в плазме у стареющих трансгенных самок 5xFAD до и после введения YB-1.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные
Мыши линии 5xFAD – широко используемая модель фамильной формы БА, получены на смешанном фоне SJL/C57B16 путем коэкспрессии гена АРР человека (APP695) со шведской (K670N/M671L), флоридской (I716V) и лондонской (V717I) мутациями, а также гена пресенилина человека с мутациями M146L и L286V под Thy1 промотором. Мыши 5xFAD были ранее приобретены у JAX и содержались на смешанном фоне SJL/C57Bl6. Животные содержались в специализированном виварии со свободным доступом к воде и стандартизированному корму при температуре 22–24°C и естественной освещенности.
Трансгенных мышей генотипировали с помощью классической ПЦР с использованием ДНК, выделенной из биоптатов уха. Наличие трансгенной кассеты выявляется с помощью праймеров 5'-AGG ACT GAC CAC TCG ACC AG-3' и 5'-CGGGGG TCT AGT TCT GCA T-3', с последующим электрофоретическим визуализированием для выявления носителей ТГ кассеты длиной 377 пар нуклеотидов. Трансгены вставлены в один локус Chr3:6297836, где они не влияют ни на какие известные гены.
Уровень Е2 анализировали у 11–12-месячных трансгенных самок гетерозиготных мышей 5xFAD и однопометных 11–12-месячных нетрансгенных самок возрастного контроля.
Интраназальное введение YB-1
Белок YB-1 был любезно предоставлен нам академиком Л.П. Овчинниковым, руководившим совместными исследованиями свойств этого белка [3, 4, 10]. Мыши были разделены на четыре группы (по 6–9 животных в каждой) трансгенных (тг) и нетрансгенных (нтг) мышей, получавших интраназально YB-1 – “тг + YB-1” и “нтг + + YB-1”, а также группы животных, получавших физиологический раствор – “тг + + ФР” и “нтг + ФР”. Раствор YB-1 (4 мкл, 0.5 мкг/мкл) или стерильный физиологический раствор вводили интраназально ежедневно в соответствии с обозначенной группой мышей в течение 40 дней. Для этого микропипетку располагали в непосредственной близости от ноздри животного так, чтобы раствор мог естественным путем попасть в носовую полость при нормальном дыхании.
Определение стадий эстрального цикла
У каждой самки брали вагинальные мазки (смывы) за 7 дней до начала эксперимента и 7 дней после окончания, включая дни забора плазмы. Забор мазков, а также визуальную оценку цитологической картины мазка проводили по общепринятой методике [46], что позволило выделить стадии эстрального цикла: проэструс, эструс, метэструс и диэструс. Нормальный цикл включает последовательную смену четырех стадий: проэструс, эструс, метэструс, диэструс, каждая из которых характеризуется специфической цитологической картиной. При проэструсе мазок состоит из отдельных округлых эпителиальных клеток с довольно крупным ядром; в стадии эструса присутствуют только крупные безъядерные ороговевшие клетки неправильной формы, при этом отсутствуют эпителиоциты и лейкоциты; стадия метэструса характеризуется наличием всех трех типов клеток. В мазке могут появляться лейкоциты, единичные эпителиоциты, слизь. В стадии диэструса в мазке присутствует большое количество лейкоцитов и слизи, а также единичные эпителиоциты.
Забор крови
Уровень Е2 определяли в образцах крови из глазной вены за сутки до интраназального введения YB-1 и через 40 дней после применения препарата. Полученные образцы центрифугировали при 1000 g и 4–8°С в течение 15 мин (Eppendorf, Германия), после чего микропипеткой отбирали плазму крови. В качестве антикоагулянта использовали гепарин. Образцы плазмы хранили при температуре –80°C в соответствии с рекомендациями, изложенными в наборе для иммуноферментного анализа E2.
Анализ уровня эстрадиола в плазме крови
Уровень E2 в образцах периферической крови самок мышей определяли методом иммуноферментного анализа с использованием набора для иммуноферментного анализа на E2 (Cloud-Clone Corp., США). Следует отметить, что точность определения Е2 методом иммуноферментного анализа используется наряду с другими, более точными методами, такими как высокоэффективная жидкостная хроматография в тандеме с масс-спектрометрией [47, 48]. Все процедуры проводились в соответствии с инструкциями производителя. Согласно методике, в лунки планшета наносятся моноклональные антитела, специфичные к E2. Конкурентная ингибиторная реакция протекает между E2, меченным биотином, и немеченым E2 (стандарты или образцы) с нанесенными антителами специфичными к E2. После инкубации не связавшийся конъюгат смывают. Затем в каждую лунку планшета добавляют авидин, конъюгированный с пероксидазой хрена, и образцы инкубируют в течение обозначенного производителем времени. Количество связанного конъюгата пероксидазы хрена обратно пропорционально концентрации Е2 в образце. После добавления раствора субстрата интенсивность окраски также обратно пропорциональна концентрации Е2 в образце. Минимальное количество Е2, которое можно определить с помощью этого набора, составляет менее 4.45 пг/мл. Оптическую плотность раствора в лунках определяли с помощью ридера Multiskan FC (Thermo Scientific, США) при длине волны 450 нм.
Определение провоспалительных цитокинов IL-1β и IL-6 в плазме крови
Для оценки уровня провоспалительных цитокинов IL-1β использовали наборы IL-6 ELISA и IL-1β ELISA (Abcam, США) с чувствительностью детекции цитокинов <0.8 и <6.5 пг/мл соответственно. На первом этапе одновременно инкубировали образцы и биотинилированные моноклональные антитела, специфичные к соответствующему интерлейкину. После промывки добавляли ферментный конъюгат стрептавидин-пероксидазы хрена, который связывает биотинилированные антитела при второй инкубации. После промывки добавляли субстратный раствор гидрохлорида тетраметилбензидина, который действует на связанный фермент, вызывая окрашивание продукта реакции. Интенсивность окрашивания прямо пропорциональна концентрации цитокина, присутствующего в образцах. С помощью Multiskan FC (Thermo Scientific, США) определяли оптическую плотность образцов при 450 нм.
Статистический анализ
Статистическую обработку результатов проводили с помощью программы STATISTICA 12. Данные представлены в виде среднего значения и стандартной ошибки среднего. Для сравнения различий между группами и определения статистической значимости использовались: t-критерий Стьюдента, однофакторный дисперсионный анализ ANOVA с апостериорным сравнением групп по методу Тьюки, а также непараметрического критерия Манна–Уитни. Во всех случаях различия считались достоверными при p ≤ 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Полученные нами данные свидетельствуют, что у всех стареющих самок мышей, независимо от трансгенности, наблюдался измененный эстральный цикл. Некоторые стадии цикла отсутствовали или их последовательность была нарушена у большинства животных, что подтверждает наличие серьезных нарушений эстрального цикла у стареющих самок.
В табл. 1 представлены абсолютные индивидуальные значения уровня эстрадиола в плазме крови самок мышей на разных стадиях эстрального цикла до начала эксперимента. Стадии цикла определяли по вагинальным мазкам.
Таблица 1.
Содержание эстрадиола у мышей в начале эксперимента
| Группа животных | Стадия эстрального цикла | Уровень эстрадиола, пг/мл | Средний уровень эстрадиола на каждой стадии ± ст. ошибка среднего, пг/мл |
|---|---|---|---|
| нтг | Проэструс | 42.34 | 42.34 |
| Эструс | 33.68 | 46.57 ± 12.89 | |
| 59.45 | |||
| Метаэструс | 8.45 | 29.96 ± 12.26 | |
| 16.48 | |||
| 30.94 | |||
| 63.99 | |||
| Диэструс | 12.21 | 33.18 ± 8.28 | |
| 17.36 | |||
| 24.04 | |||
| 28.79 | |||
| 57.6 | |||
| 59.05 | |||
| тг | Проэструс | 28.42 | 33.25 ± 2.42 |
| 35.32 | |||
| 36.01 | |||
| Эструс | 13.41 | 23.52 ± 2.65 | |
| 23.89 | |||
| 24.85 | |||
| 26.97 | |||
| 28.48 | |||
| Метаэструс | 13.92 | 23.59 ± 5.01 | |
| 26.15 | |||
| 30.71 | |||
| Диэструс | 13.77 | 23.58 ± 2.95 | |
| 19.02 | |||
| 21.7 | |||
| 23.38 | |||
| 30.12 | |||
| 33.47 |
У каждой самки сначала определяли стадию эстрального цикла по вагинальным лаважам, а затем уровень эстрадиола, после чего рассчитывали средний уровень эстрадиола на каждом этапе как отношение суммы уровней эстрадиола к количеству животных на данном этапе и представляли как среднее ± стандартная ошибка среднего.
Показаны значительные индивидуальные колебания уровня эстрадиола, не коррелирующие со стадиями эстрального цикла как у стареющих трансгенных, так и у нетрансгенных самок мышей. В начале экспериментов тг-животные характеризовались более низким средним уровнем Е2 (25.27 ± 1.74 пг/мл) по сравнению с контрольными (нтг) стареющими мышами (34.95 ± 5.45 пг/мл) (рис. 1).
Рис. 1.
Концентрация эстрадиола (E2) в плазме до эксперимента и через 40 дней после введения YB-1 у нетрансгенных (a) и трансгенных (b) стареющих мышей, пг/мл; статистическая обработка с использованием дисперсионного анализа с апостериорным сравнением по критерию Тьюки. *р < 0.05.
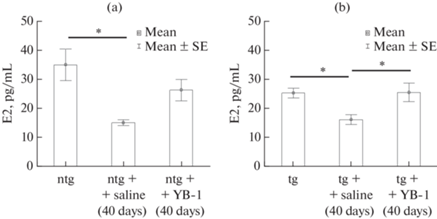
Уровни Е2 были достоверно (p < 0.05) снижены в контрольных группах “тг + ФР” (в среднем на 38%) и “нтг + ФР” (в среднем на 57%) через 40 дней после начала эксперимента.
Согласно полученным данным, влияние возраста на уровень Е2 более выражено у нтг-животных (на ~20%), по сравнению с тг. Важно отметить, что введение YB-1 замедляло возрастные изменения уровня E2 в плазме и предотвращало снижение содержания E2 как в группах “тг + YB-1”, так и в группах “нтг + YB-1”.
В наших экспериментах также было показано, что трансгенность самок мышей не влияет на уровень периферических провоспалительных цитокинов (IL-1β и IL-6) (табл. 2).
Таблица 2.
Концентрация интерлейкинов плазмы до эксперимента и через 40 дней после введения YB-1 у трансгенных и нетрансгенных стареющих самок мышей
| нтг (0д) | нтг + ФР (40 д) | нтг + YB-1 (40 д) | тг (0 д) | тг + ФР (40 д) | тг + YB-1 (40 д) | |
|---|---|---|---|---|---|---|
| IL-6 (пг/мл) | 0.88 ± 0.22 | 0.86 ± 0.29 | 1.05 ± 0.25 | 0.89 ± 0.19 | 0.86 ± 0.16 | 0.74 ± 0.17 |
| IL-1β (пг/мл) | 6.22 ± 0.4 | 5.86 ± 0.21 | 5.67 ± 0.15 | 6.25 ± 0.22 | 6.1 ± 0.3 | 5.97 ± 0.19 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Серьезные нарушения характеристик эстрального цикла, наблюдаемые нами у стареющих самок, позволяют предположить, что состояние подопытных мышей было близко к пременопаузальному периоду у женщин, когда происходит нарушение менструального цикла. Это позволяет нам экстраполировать полученные данные на человека, хотя, безусловно, в ограниченной степени.
Далее мы сравнили средние уровни гормонов в опытных группах до и через 40 дней после введения YB-1 без учета колебаний уровня Е2 без разделения животных на группы, связанные со стадиями эстрального цикла.
Мы предполагаем, что снижение уровня Е2 в обеих контрольных группах тг + ФР и нтг + ФР напрямую связано со старением. Следует отметить, что 40 дней жизни мыши примерно можно приравнять к 2.5 годам жизни человека. Известно, что предклимактерический период у женщин также длится от двух до четырех лет. Мы обнаружили, что влияние возраста на уровень Е2 более выражено у нтг-животных (на ~20%) по сравнению с тг. Мы полагаем, что тг-мыши на момент начала эксперимента уже прошли фазу интенсивного возрастного снижения Е2, так как самки тг-мышей характеризовались более низким уровнем Е2 еще до начала экспериментов. Ранее, при анализе морфологического состояния нейронов гиппокампа мы выявили, что у животных 5xFAD, классической модели фамильной формы БА, признаки старения и дегенерации появляются значительно раньше, чем у нтг-мышей того же возраста [49]. В связи с этим мы полагаем, что самки тг-мышей фактически имеют более преклонный биологический возраст, чем самки нтг, хотя календарный возраст у них одинаков. Важно отметить, что лечение YB-1 препятствовало развитию возрастных изменений в уровне E2 в плазме, а следовательно, замедляло старение как в группах “тг + YB-1”, так и в группах “нтг + YB-1”.
Как было показано ранее другими авторами, снижение уровня эстрадиола усугубляет патологию у животных, моделирующих БА. Так, овариэктомия индуцировала активацию микроглии, увеличение продукции β-амилоида и ухудшение памяти у мышей линии 3xТg [50]. Также овариэктомия усугубляла патологию головного мозга, вызванную внутрижелудочковым введением Аβ1-42 [51]. Терапия с помощью Е2 значительно снижала или даже устраняла эффект хирургического вмешательства в этих опытах, что доказывает защитную роль половых гормонов, препятствующих развитию нейродегенерации.
Изменение уровня эстрадиола тесно связано с нейродегенерацией альцгеймеровского типа у тг-животных. Ранее мы показали, что интраназальное введение YB-1 оказывает положительный эффект на двух животных моделях БА [10]. В данном исследовании мы обнаружили, что YB-1 предотвращает возрастное снижение уровня Е2 в плазме крови как у стареющих самок мышей линии 5xFAD, так и у нетрансгенных животных. Необходимо иметь в виду, что Е2 отвечает за многие функции головного мозга, в частности стимулирует образование дендритных шипиков на нейронах гиппокампа [52, 53], предотвращает агрегацию β-амилоида, снижает его нейротоксичность, а также оказывает защитное действие на митохондрии [54, 55]. Подробные механизмы этого эффекта YB-1 требуют дальнейшего тщательного изучения. Мы предполагаем существование перекрестных факторов, регулирующих периферический и центральный уровни Е2, поскольку одной из мишеней YB-1 является синтез половых гормонов, регулируемый в головном мозге. Имеются данные, что YB-1 необходим для фолликулостимулирующей гормон-опосредованной активации генов Cyp19a1, Hsd17b1 и Pappa, которые участвуют в биосинтезе эстрогенов [56] и показывают ранее не идентифицированную роль YB-1. В недавнем исследовании было показано, что Е2 у самок мышей линии 5xFAD выполняет нейропротекторные функции, снижая интенсивность β-амилоидного каскада, а также подавляя такой патологический белок, связанный с БА, как pTau [57].
В наших экспериментах было показано, что трансгенность мышей не влияет на уровень периферических провоспалительных цитокинов (IL-1β и IL-6) (табл. 2), хотя некоторые авторы сообщают о повышенном уровне этих цитокинов в мозге трансгенных мышей и крыс [58–60]. Здесь следует отметить, что в настоящее время нет четкого понимания того, как соотносятся мозговой и периферический уровни провоспалительных факторов, в частности цитокинов IL-1β и IL-6, хотя уровень этих интерлейкинов заметно повышен в мозге больных БА. У человека соотношение уровней церебрального и периферического IL-1β может составлять 1 : 15–1 : 30. Для животных моделей сообщалось, что экспрессия IL-1β и IL-6 была значительно увеличена в гиппокампе мышей 5xFAD по сравнению с мышами дикого типа. Во время начальной воспалительной реакции микроглия активируется Aβ для высвобождения цитокинов. Провоспалительные медиаторы, такие как IL-6, IL-1β, связываются с рецепторами на мембране микроглии и активируют сигнальный путь NF-κB. Фосфорилированный NF-κB проникает в ядро и активирует систему транскрипции для выработки большего количества провоспалительных факторов. При этом цитокины, продуцируемые активированной микроглией, ускоряют выработку Aβ путем процессинга и модификации APP, тем самым усугубляя нейровоспаление [61]. В настоящее время нет единого мнения о том, как изменяется уровень интерлейкинов в плазме крови у пациентов с БА по сравнению со здоровым контролем [62]. Сообщается как об увеличении, так и о снижении уровня интерлейкинов [63–66]. Используя наши (табл. 2, тг (0 д)) и литературные данные, можно рассчитать, что примерное соотношение церебрального и периферического уровней IL-1β у мышей 5xFAD находится в диапазоне 1 : 12–1 : 22. (0.5 пг/мл : 6.03 пг/мл–0.3 пг/мл : 6.47 пг/мл, в абсолютных значениях) соответственно. По-видимому, повышение содержания цитокинов в ткани мозга в определенных пределах может не влиять на их системный уровень и остается незамеченным. По-видимому, это одна из причин, по которой нам не удалось выявить влияние введения YB-1 на уровень периферических интерлейкинов или выявить различия в уровне провоспалительных цитокинов в плазме крови самок трансгенных мышей и мышей дикого типа. Системное воспаление, наоборот, может индуцировать нейровоспаление, которому также способствует разрушение гематоэнцефалического барьера, характерное для многих заболеваний.
Таким образом, наши результаты показывают, что интраназальное введение белка YB-1 оказывает положительный эффект, замедляя возрастное падение уровня эстрадиола в плазме крови как у трансгенных, так и у нетрансгенных стареющих самок мышей. Трансгенность мышей не влияет на уровень периферических провоспалительных цитокинов (IL-1β и IL-6). Также интраназальное введение YB-1 не влияет на уровень IL-1β и IL-6 в плазме крови трансгенных и нетрансгенных животных.
Воздействуя на регуляторные механизмы в головном мозге, белок YB-1 эффективно задерживает возрастное падение уровня Е2 и может рассматриваться как перспективное соединение для разработки профилактического и терапевтического средства против нейродегенеративных заболеваний, а также старения у женщин.
Список литературы
Kumar A, Singh A, Ekavali (2015) A review on Alzheimer’s disease pathophysiology and its management: An update. Pharmacol Rep 67: 195–203. https://doi.org/10.1016/j.pharep.2014.09.004
Kohno K, Izumi H, Uchiumi T, Ashizuka M, Kuwano M (2003) The pleiotropic functions of the Y-box-binding protein, YB-1. Bioessays 25: 691–698. https://doi.org/10.1002/bies.10300
Skabkin MA, Evdokimova V, Thomas AA, Ovchinnikov LP (2001) The major messenger ribonucleoprotein particle protein p50 (YB-1) promotes nucleic acid strand annealing. J Biol Chem 276: 44841–44847. https://doi.org/10.1074/jbc.m107581200
Skabkin MA, Kiselyova OI, Chernov KG, Sorokin AV, Dubrovin EV, Yaminsky IV, Vasiliev VD, Ovchinnikov LP (2004) Structural organization of mRNA complexes with major core mRNP protein YB-1. Nucleic Acids Res 32: 5621–5635. https://doi.org/10.1093/nar/gkh889
Frye BC, Halfter S, Djudjaj S, Muehlenberg P, Weber S, Raffetseder U, En-Nia A, Knott H, Baron JM, Dooley S, Bernhagen J, Mertens PR (2009) Y-box protein-1 is actively secreted through a non-classical pathway and acts as an extracellular mitogen. EMBO Rep 10: 783–789. https://doi.org/10.1038/embor.2009.81
Moiseeva NI, Stromskaya TP, Rybalkina EY, Vaiman AV, Malyshkina MA, Kim ER, Eliseeva IA, Kulakovskiy IV, Ovchinnikov LP, Stavrovskaya AA (2013) Effects of extracellular YB-1 protein on cultured cells of human breast cancer. Biochem Suppl Ser A Membr Cell Biol 7: 21–28.
Fotovati A, Abu-Ali S, Wang P-S, Deleyrolle LP, Lee C, Triscott J, Chen JY, Franciosi S, Nakamura Y, Sugita Y, Uchiumi T, Kuwano M, Leavitt BR, Singh SK, Jury A, Jones C, Wakimoto H, Reynolds BA, Pallen CJ, Dunn SE (2011) YB-1 bridges neural stem cells and brain tumor-initiating cells via its roles in differentiation and cell growth. Cancer Res 71: 5569–5578. https://doi.org/10.1158/0008-5472.CAN-10-2805
Lu ZH, Books JT, Ley TJ (2005) YB-1 is important for late-stage embryonic development, optimal cellular stress responses, and the prevention of premature senescence. Mol Cell Biol 25: 4625–4637. https://doi.org/10.1128/MCB.25.11.4625-4637.2005
Hanssen L, Frye B, Ostendorf T, Alidousty C, Djudjaj S, Boor P, Rauen T, Floege J, Mertens P, Raffetseder U (2011) Y-Box Binding Protein-1 Mediates Profibrotic Effects of Calcineurin Inhibitors in the Kidney. J Immunol 187: 298–308. https://doi.org/10.4049/jimmunol.1100382
Bobkova NV, Lyabin DN, Medvinskaya NI, Samokhin AN, Nekrasov PV, Nesterova I V, Aleksandrova IY, Tatarnikova OG, Bobylev AG, Vikhlyantsev IM, Kukharsky MS, Ustyugov AA, Polyakov DN, Eliseeva IA, Kretov DA, Guryanov SG, Ovchinnikov LP (2015) The Y-Box Binding Protein 1 Suppresses Alzheimer’s Disease Progression in Two Animal Models. PLoS One 10: e0138867. https://doi.org/10.1371/journal.pone.0138867
Henderson VW, Paganini-Hill A, Miller BL, Elble RJ, Reyes PF, Shoupe D, McCleary CA, Klein RA, Hake AM, Farlow MR (2000) Estrogen for Alzheimer’s disease in women: randomized, double-blind, placebo-controlled trial. Neurology 54(2): 295–301. https://doi.org/10.1212/WNL.54.2.295
Vest RS, Pike CJ (2013) Gender, sex steroid hormones, and Alzheimer’s disease. Horm Behav 63: 301–307. https://doi.org/10.1016/j.yhbeh.2012.04.006
Grimm A, Lim Y-A, Mensah-Nyagan AG, Götz J, Eckert A (2012) Alzheimer’s Disease, Oestrogen and Mitochondria: an Ambiguous Relationship. Mol Neurobiol 46: 151–160. https://doi.org/10.1007/s12035-012-8281-x
Coffey CE, Lucke JF, Saxton JA, Ratcliff G, Unitas LJ, Billig B, Bryan RN (1998) Sex Differences in Brain Aging: A Quantitative Magnetic Resonance Imaging Study. Arch Neurol 55: 169–179. https://doi.org/10.1001/archneur.55.2.169
Morinaga A, Ono K, Takasaki J, Ikeda T, Hirohata M, Yamada M (2011) Effects of sex hormones on Alzheimer’s disease-associated β-amyloid oligomer formation in vitro. Exp Neurol 228: 298–302. https://doi.org/10.1016/j.expneurol.2011.01.011
Veiga S, Melcangi RC, DonCarlos LL, Garcia-Segura LM, Azcoitia I (2004) Sex hormones and brain aging. Exp Gerontol 39: 1623–1631. https://doi.org/10.1016/j.exger.2004.05.008
Barron AM, Pike CJ (2012) Sex hormones, aging, and Alzheimer’s disease. Front Biosci Elit 4 E: 976–997. https://doi.org/10.2741/e434
Maioli S, Leander K, Nilsson P, Nalvarte I (2021) Estrogen receptors and the aging brain. Essays Biochem 65: 913–925. https://doi.org/10.1042/EBC20200162
Chen P, Li B, Ou-Yang L (2022) Role of estrogen receptors in health and disease. Front Endocrinol (Lausanne) 13: 839005. https://doi.org/10.3389/fendo.2022.839005
Dubal DB, Zhu H, Yu J, Rau SW, Shughrue PJ, Merchenthaler I, Kindy MS, Wise PM (2001) Estrogen receptor α, not β, is a critical link in estradiol-mediated protection against brain injury. Proc Natl Acad Sci U S A 98: 1952–1957. https://doi.org/10.1073/pnas.041483198
Pérez SE, Chen EY, Mufson EJ (2003) Distribution of estrogen receptor alpha and beta immunoreactive profiles in the postnatal rat brain. Dev Brain Res 145: 117–139. https://doi.org/10.1016/S0165-3806(03)00223-2
Hazell GGJ, Yao ST, Roper JA, Prossnitz ER, O’Carroll AM, Lolait SJ (2009) Localisation of GPR30, a novel G protein-coupled oestrogen receptor, suggests multiple functions in rodent brain and peripheral tissues. J Endocrinol 202: 223–236. https://doi.org/10.1677/JOE-09-0066
Luoma JI, Boulware MI, Mermelstein PG (2008) Caveolin proteins and estrogen signaling in the brain. Mol Cell Endocrinol 290: 8–13. https://doi.org/10.1016/j.mce.2008.04.005
Bjornstrom L, Sjoberg M (2005) Mechanisms of estrogen receptor signaling: convergence of genomic and nongenomic actions on target genes. Mol Endocrinol 19(4): 833–842. https://doi.org/10.1210/me.2004-0486
Gordon JL, Peltier A, Grummisch JA, Sykes Tottenham L (2019) Estradiol fluctuation, sensitivity to stress, and depressive symptoms in the menopause transition: a pilot study. Front Psychol 10: 1319. https://doi.org/10.3389/fpsyg.2019.01319
Carugno J (2020) Clinical management of vaginal bleeding in postmenopausal women. Climacteric 23(4): 343–349. https://doi.org/10.1080/13697137.2020.1739642
Mueck AO, Römer T (2019) Choice of progestogen for endometrial protection in combination with transdermal estradiol in menopausal women. Horm Mol Biol Clin Invest 37(2). https://doi.org/10.1515/hmbci-2018-0033
Duarte-Guterman P, Lieblich SE, Chow C, Galea LAM (2015) Estradiol and GPER Activation Differentially Affect Cell Proliferation but Not GPER Expression in the Hippocampus of Adult Female Rats. PLoS One 10: e0129880. https://doi.org/10.1371/journal.pone.0129880
Aenlle K, Cui L, Jackson T, Foster T (2007) Estrogen effects on cognition and hippocampal transcription in middle-aged mice. Neurobiol Aging 30: 932–945. https://doi.org/10.1016/j.neurobiolaging.2007.09.004
Fan L, Zhao Z, Orr PT, Chambers CH, Lewis MC, Frick KM (2010) Estradiol-induced object memory consolidation in middle-aged female mice requires dorsal hippocampal extracellular signal-regulated kinase and phosphatidylinositol 3-kinase activation. J Neurosci 30: 4390–4400. https://doi.org/10.1523/JNEUROSCI.4333-09.2010
Walf AA, Paris JJ, Frye CA (2009) Chronic estradiol replacement to aged female rats reduces anxiety-like and depression-like behavior and enhances cognitive performance. Psychoneuroendocrinology 34(6): 909–916. https://doi.org/10.1016/j.psyneuen.2009.01.004
Cui J, Reed J, Crynen G, Ait-Ghezala G, Crawford F, Shen Y, Li R (2019) Proteomic Identification of Pathways Responsible for the Estradiol Therapeutic Window in AD Animal Models. Front Cell Neurosci 13: 437. https://doi.org/10.3389/fncel.2019.004
Sahab-Negah S, Hajali V, Moradi HR, Gorji A (2020) The Impact of Estradiol on Neurogenesis and Cognitive Functions in Alzheimer’s Disease. Cell Mol Neurobiol 40: 283–299. https://doi.org/10.1007/s10571-019-00733-0
Cardinali CAEF, Martins YA, Torrão AS (2021) Use of Hormone Therapy in Postmenopausal Women with Alzheimer’s Disease: A Systematic Review. Drugs Aging 38: 769–791. https://doi.org/10.1007/s40266-021-00878-y
Grammas P (2011) Neurovascular dysfunction, inflammation and endothelial activation: implications for the pathogenesis of Alzheimer’s disease. J Neuroinflammat 8: 26. https://doi.org/10.1186/1742-2094-8-26
Ferreira ST, Clarke JR, Bomfim TR, De Felice FG (2014) Inflammation, defective insulin signaling, and neuronal dysfunction in Alzheimer’s disease. Alzheimers Dement 10: S76–S83. https://doi.org/10.1016/j.jalz.2013.12.010
Walters A, Phillips E, Zheng R, Biju M, Kuruvilla T (2016) Evidence for neuroinflammation in Alzheimer’s disease. Prog Neurol Psychiatry 20: 25–31. https://doi.org/10.1002/pnp.444
Meraz-Ríos MA, Toral-Rios D, Franco-Bocanegra D, Villeda-Hernández J, Campos-Peña V (2013) Inflammatory process in Alzheimer’s Disease. Front Integr Neurosci 7: 59. https://doi.org/10.3389/fnint.2013.00059
Akiyama H, Barger S, Barnum S, Bradt B, Bauer J, Cole GM, Cooper N, Eikelenboom P, Emmerling M, Fiebich B, Finch C, Frautschy S, Griffin W, Hampel H, Hull M, Landreth G, Lue L, Mrak R, Mackenzie I, Mcgeer P, O’Banion M, Pachter J, Pasinetti G, Plata-salamán C, Rogers J, Rydel R, Yong Shen, Streit W, Strohmeyer R, Tooyoma Ikuo, Muiswinkel FL, Veerhuis R, Walker D, Webster S, Wegrzyniak B., Wenk G, Wyss-Coray T (2000) Inflammation and Alzheimer’s disease. Neurobiol Aging 21(3): 383–421. https://doi.org/10.1016/S0197-4580(00)00124-X
O’Léime C, Cryan J, Nolan Y (2017) Nuclear Deterrents: Intrinsic Regulators of IL-1β-induced Effects on Hippocampal Neurogenesis. Brain Behav Immun 66: 394–412. https://doi.org/10.1016/j.bbi.2017.07.153
Khaksari M, Soltani Z, Shahrokhi N (2018) Effects of Female Sex Steroids Administration on Pathophysiologic Mechanisms in Traumatic Brain Injury. Transl Stroke Res 9:393–416. https://doi.org/10.1007/s12975-017-0588-5
Wang M, Tsai BM, Reiger KM, Brown JW, Meldrum DR (2006) 17-β-Estradiol decreases p38 MAPK-mediated myocardial inflammation and dysfunction following acute ischemia. J Mol Cell Cardiol 40(2): 205–212. https://doi.org/10.1016/j.yjmcc.2005.06.019
Cuzzocrea S, Santagati S, Sautebin L, Mazzon E, Calabrò G, Serraino I, Caputi AP, Maggi A (2000) 17β-estradiol antiinflammatory activity in carrageenan-induced pleurisy. Endocrinology 141(4): 1455–1463. https://doi.org/10.1210/endo.141.4.7404
Borrás C, Gambini J, López-Grueso R, Pallardó FV, Viña J (2010) Direct antioxidant and protective effect of estradiol on isolated mitochondria. Biochim Biophys Acta (BBA)-Mol Basis Disease 1802(1): 205–211. https://doi.org/10.1016/j.bbadis.2009.09.007
Oakley HO, Cole SL, Logan S, Maus E, Shao P, Craft J, Guillozet-Bongaarts A, Ohno M, Disterhoft J, Van Eldik L, Berry R, Vassar R (2006) Intraneuronal β-Amyloid Aggregates, Neurodegeneration, and Neuron Loss in Transgenic Mice with Five Familial Alzheimer’s Disease Mutations: Potential Factors in Amyloid Plaque Formation. J Neurosci 26: 10129–10140. https://doi.org/10.1523/JNEUROSCI.1202-06.2006
McLean AC, Valenzuela N, Fai S, Bennett SAL (2012) Performing vaginal lavage, crystal violet staining, and vaginal cytological evaluation for mouse estrous cycle staging identification. J Vis Exp e4389. https://doi.org/10.3791/4389
Farré M, Kuster M, Brix R, Rubio F, de Alda MJL, Barceló D (2007) Comparative study of an estradiol enzyme-linked immunosorbent assay kit, liquid chromatography–tandem mass spectrometry, and ultra performance liquid chromatography–quadrupole time of flight mass spectrometry for part-per-trillion analysis of estrogens in water samples. J Chromatogr A 1160(1-2): 166–175. https://doi.org/10.1016/j.chroma.2007.05.032
Nilsson ME, Vandenput L, Tivesten Å, Norlén A-K, Lagerquist MK, Windahl SH, Börjesson AE, Farman HH, Poutanen M, Benrick A, Maliqueo M, Stener-Victorin E, Ryberg H, Ohlsson C (2015) Measurement of a Comprehensive Sex Steroid Profile in Rodent Serum by High-Sensitive Gas Chromatography-Tandem Mass Spectrometry. Endocrinology 156: 2492–2502. https://doi.org/10.1210/en.2014-1890
Evgen’ev M, Bobkova N, Krasnov G, Garbuz D, Funikov S, Kudryavtseva A, Kulikov A, Samokhin A, Maltsev A, Nesterova I (2019) The Effect of Human HSP70 Administration on a Mouse Model of Alzheimer’s Disease Strongly Depends on Transgenicity and Age. J Alzheimer’s Dis 67: 1391–1404. https://doi.org/10.3233/JAD-180987
Carroll JC, Rosario ER, Chang L, Stanczyk FZ, Oddo S, LaFerla FM, Pike CJ (2007) Progesterone and Estrogen Regulate Alzheimer-Like Neuropathology in Female 3xTg-AD Mice. J Neurosci 27(48): 13357–13365. https://doi.org/10.1523/JNEUROSCI.2718-07.2007
Yun J, Jun I, Ju C, Choi D, Im H, Youg J (2018) Brain, Behavior, and Immunity Estrogen deficiency exacerbates Aβ-induced memory impairment through enhancement of neuroinflammation, amyloidogenesis and NF-ĸB activation in ovariectomized mice. Brain Behav Immun 73: 282–293. https://doi.org/10.1016/j.bbi.2018.05.013
Murphy DD, Segal M (1997) Morphological plasticity of dendritic spines in central neurons is mediated by activation of cAMP response element binding protein. Proc Natl Acad Sci U S A 94(4): 1482–1487. https://doi.org/10.1073/pnas.94.4.1482
Aenlle KK, Foster TC (2010) Aging alters the expression of genes for neuroprotection and synaptic function following acute estradiol treatment. Hippocampus 20: 1047–1060. https://doi.org/10.1002/hipo.20703
Nilsen J, Chen S, Irwin RW, Iwamoto S, Brinton RD (2006) Estrogen protects neuronal cells from amyloid beta-induced apoptosis via regulation of mitochondrial proteins and function. BMC Neurosci 7(1): 1–14. https://doi.org/10.1186/1471-2202-7-74
Yao J, Brinton RD (2012) Estrogen regulation of mitochondrial bioenergetics: implications for prevention of Alzheimer’s disease. Advance Pharmacol 64: 327–371. https://doi.org/10.1016/B978-0-12-394816-8.00010-6
Donaubauer EM, Hunzicker-Dunn ME (2016) Extracellular Signal-regulated Kinase (ERK)-dependent Phosphorylation of Y-Box-binding Protein 1 (YB-1) Enhances Gene Expression in Granulosa Cells in Response to Follicle-stimulating Hormone (FSH). J Biol Chem 291: 12145–12160. https://doi.org/10.1074/jbc.M115.705368
Kim JY, Mo H, Kim J, Kim JW, Nam Y, Rim YA, Ju JH (2022) Mitigating Effect of Estrogen in Alzheimer’s Disease-Mimicking Cerebral Organoid. Front Neurosci 16: 816174. https://doi.org/10.3389/fnins.2022.816174
Boza-Serrano A, Yang Y, Paulus A, Deierborg T (2018) Innate immune alterations are elicited in microglial cells before plaque deposition in the Alzheimer’s disease mouse model 5xFAD. Sci Rep 8: 1550. https://doi.org/10.1038/s41598-018-19699-y
Hanzel CE, Pichet-Binette A, Pimentel LSB, Iulita MF, Allard S, Ducatenzeiler A, Do Carmo S, Cuello AC (2014) Neuronal driven pre-plaque inflammation in a transgenic rat model of Alzheimer’s disease. Neurobiol Aging 35: 2249–2262. https://doi.org/10.1016/j.neurobiolaging.2014.03.026
López-González I, Schlüter A, Aso E, Garcia-Esparcia P, Ansoleaga B, Lorens F, Carmona M, Moreno J, Fuso A, Portero-Otin M, Pamplona R, Pujol A, Ferrer I (2015) Neuroinflammatory signals in Alzheimer disease and APP/PS1 transgenic mice: correlations with plaques, tangles, and oligomeric species. J Neuropathol Exp Neurol 74: 319–344. https://doi.org/10.1097/NEN.0000000000000176
Jiang Y, Li K, Li X, Xu L, Yang Z (2021) Sodium butyrate ameliorates the impairment of synaptic plasticity by inhibiting the neuroinflammation in 5XFAD mice. Chem-Biol Interact 341: 109452. https://doi.org/10.1016/j.cbi.2021.109452
Park J-C, Han S-H, Mook-Jung I (2020) Peripheral inflammatory biomarkers in Alzheimer’s disease: a brief review. BMB Rep 53: 10–19. https://doi.org/10.5483/BMBRep.2020.53.1.309
Forlenza OV, Diniz BS, Talib LL, Mendonça VA, Ojopi EB, Gattaz WF, Teixeira A L (2009) Increased serum IL-1β level in Alzheimer’s disease and mild cognitive impairment. Dementia and Geriatric Cognitive Disorders 28(6): 507–512. https://doi.org/10.1159/000255051
Swardfager W, Lanctôt K, Rothenburg L, Wong A, Cappell J, Herrmann N (2010) A meta-analysis of cytokines in Alzheimer’s disease. Biol Psychiatr 68(10): 930–941. https://doi.org/10.1016/j.biopsych.2010.06.012
Wu YY, Hsu JL, Wang HC, Wu SJ, Hong CJ, Cheng IHJ (2015) Alterations of the neuroinflammatory markers IL-6 and TRAIL in Alzheimer’s disease. Dement Geriatr Cogn Dis Extra 5(3): 424–434. https://doi.org/10.1159/000439214
Richartz E, Stransky E, Batra A, Simon P, Lewczuk P, Buchkremer G, Bartels M, Schott K (2005) Decline of immune responsiveness: a pathogenetic factor in Alzheimer’s disease? J Psychiatr Res 39(5): 535–543. https://doi.org/10.1016/j.jpsychires.2004.12.005
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


