Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 3, стр. 283-299
Нейрофизиологические предпосылки временного анализа звука нейронами слухового центра среднего мозга мыши (Mus musculus)
Г. Д. Хорунжий 1, М. А. Егорова 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: ema6913@yandex.ru
Поступила в редакцию 11.11.2022
После доработки 11.01.2023
Принята к публикации 17.01.2023
- EDN: FSHHXZ
- DOI: 10.31857/S0869813923030032
Аннотация
В работе методом внеклеточной регистрации импульсной активности исследована динамика временных узоров разрядов одиночных нейронов слухового центра среднего мозга домовой мыши, вызванных акустическими сигналами, охватывающими все частотное возбудительное рецептивное поле нейрона. Полученные результаты показали, что в популяции нейронов центрального ядра заднего холма наибольшей стабильностью паттернов ответов отличались нейроны с V-образными частотными рецептивными полями. Разряды остальных нейронов были более вариабельными и с большей вероятностью изменялись при изменении частоты и интенсивности сигнала. У подавляющего большинства исследованных нейронов изменения временных узоров разрядов происходили в пределах 1/2–1/3 октавы в сторону низких или высоких частот от характеристической частоты нейрона. Результаты настоящего исследования обсуждаются с учетом имеющейся информации о формировании ответа нейронов задних холмов вследствие взаимодействия процессов возбуждения и торможения, опосредованных активацией различных типов клеточных рецепторов к глутамату и ГАМК.
ВВЕДЕНИЕ
Особенности временных характеристик активности нейронов слуховых центров мозга (паттерны и латентные периоды ответов) представляют собой нейрофизиологическую основу протекающих в слуховой системе процессов временной обработки звука. Понимание роли временного механизма в кодировании акустических сигналов одиночными слуховыми нейронами требует получения исчерпывающей информации о паттернах и латентных периодах их ответов на звук.
На сегодняшний день внимание исследователей слуха сосредоточено преимущественно на двух центрах обработки информации в восходящем слуховом пути – слуховом центре среднего мозга (задних холмах четверохолмия) и слуховой области коры больших полушарий конечного мозга. Первый из них представляет собой крупнейший стволовой интегративный центр слуха [1–10]. По имеющимся данным, значительная часть базовых процессов кодирования и анализа акустической информации реализуется уже на этом уровне слуховой системы [6]. Значимость временных характеристик активности нейронов задних холмов для раскрытия нейронных механизмов анализа звука побудила российских нейрофизиологов первыми начать такие исследования еще в конце 60-х–начале 70-х гг. 20 века [1–3]. Гершуни с соавт. показали, что временные характеристики активности различных нейронов центрального ядра заднего холма крысы и кошки значительно различаются между собой [1–3]. Это позволило разделить нейроны центрального ядра на два типа. Нейроны первого типа – “медленно суммирующие”, или “длиннолатентные”, имели тонические разряды, выраженную временную суммацию, большой латентный период ответа и большую его дисперсию при пороговых интенсивностях звука. Нейроны второго типа – “быстро суммирующие”, или “коротколатентные”, отличались фазным разрядом, мало выраженной временной суммацией и небольшим латентным периодом ответа с небольшой его дисперсией при пороговых интенсивностях звука [1–3]. Проводились подобные исследования и за рубежом. По результатам анализа перистимульных гистограмм ответов нейронов центрального ядра заднего холма мыши Ehret и Moffat была предложена приведенная ниже классификация временных узоров разрядов нейронов [4]. В соответствии с этой классификацией выделяли: 1) тонический или фазно-тонический ответ, характеризовавшийся равномерным распределением спайков в течение всего действия сигнала; 2) фазный “on”-ответ, представляющий собой 1–2 спайка, генерируемые нейроном в ответ на начало стимуляции; 3) паузный ответ, характеризовавшийся паузой в импульсном разряде нейрона, следовавшей за начальным фазным компонентом ответа; 4) позднелатентный ответ с латентным периодом более 20 мс; 5) тормозный ответ, представляющий собой торможение спонтанной активности нейрона в ответ на звуковой стимул; 6) отсутствие ответа. При исследовании временных свойств активности нейронов центрального ядра заднего холма кошки [9] использовалась классификация, несколько отличная от приведенной выше: 1) фазный разряд (1–2 спайка через небольшой промежуток времени после начала сигнала); 2) фазно-тонический ответ (за коротким фазным компонентом ответа следует тонический разряд, длящийся в течение всего стимула); 3) паузный (фазный компонент завершается паузой, за которой следует тонический компонент); 4) тонический ответ (отличается равномерным распределением спайков в течение всего действия звукового сигнала); 5) “off”-ответ (спайки генерируются нейроном в ответ на окончание стимуляции). Однако в силу методических ограничений работы носили незаконченный характер. Позднее нами было выполнено систематическое исследование временных свойств активности нейронов центрального ядра заднего холма среднего мозга домовой мыши при действии тональных сигналов характеристической частоты (ХЧ) [10–12], а также видоспецифического коммуникационного сигнала раннего онтогенеза мыши (крика дискомфорта мышат) и его моделей [13, 14]. При этом динамика паттернов ответов нейронов на тональные сигналы, охватывающие все возбудительное частотное рецептивное поле нейрона, детально проанализирована не была.
Цель настоящей работы – систематическое исследование динамики паттернов ответов нейронов слухового центра среднего мозга мыши при действии тональных сигналов, охватывающих все возбудительное частотное рецептивное поле нейрона.
МЕТОДЫ ИССЛЕДОВАНИЯ
В работе выполняли внеклеточную регистрацию импульсной активности одиночных нейронов центрального ядра заднего холма у наркотизированных домовых мышей (Mus musculus, самок гибридов линии NMRI и диких мышей) в возрасте 8–15 нед. Методика подготовки животного к эксперименту и регистрации импульсной активности одиночных нейронов подробно описана ранее [7, 10]. У животного оперативно открывали доступ к левому заднему холму. Краниотомию проводили в условиях ингаляционного наркоза (смесь кислорода с 1.5–1.8% галотана). После удаления твердой мозговой оболочки на обнаженную поверхность мозга наносили 2–3 капли теплого силикона. Голову жестко фиксировали в головодержателе таким образом, чтобы дорсальная поверхность мозга располагалась горизонтально. На протяжении эксперимента анестезию поддерживали внутрибрюшинными инъекциями смеси кетамина (кетавет, 35 мг/кг) и ксилазина (ромпун, 0.1 мг/кг) каждые 20–45 мин. Ректальная температура тела поддерживалась на уровне 37 ± 1°С. В качестве регистрирующих электродов использовали стеклянные микропипетки, заполненные 3 М раствором KCl, с сопротивлением 3–8 мОм. Электроды вводили стереотаксически в область левого заднего холма животного на 1–1.5 мм каудальнее и на 0.8–1.0 мм латеральнее λ-точки, что соответствовало расположению центрального ядра левого заднего холма мыши [9, 15]. Электрод вводили вертикально, т.е. перпендикулярно дорсальной поверхности мозга, с контролем глубины погружения.
Импульсную активность нейронов усиливали в 10 000 раз (усилитель биопотенциалов DAM80, WPI, Германия, полоса пропускания 0.3–10 кГц) и выводили параллельно на осциллограф (Tectronix 5A14N, США), громкоговоритель и оконный дискриминатор (model 120, WPI, Германия) для дальнейшей регистрации в форме стандартных импульсов и введения в XT-совместимый компьютер для “on-line” и “off-line” анализа. Генерация сигналов, регистрация импульсной активности и первичная обработка полученных результатов (реконструкция возбудительных частотных рецептивных полей и расчет перистимульных гистограмм ответов нейронов) обеспечивались возможностями специализированного программного обеспечения, разработанного Doerrscheidt (Бохум, Германия), на базе двухканального комплекса Tacita, совмещающего ЦАП и АЦП функции, и системной платы BOTIM3. Каждый канал имел тактовую частоту 250 кГц, разрешение по амплитуде 12 бит и встроенный аттенюатор для регуляции уровня звука. Для излучения звука в диапазоне частот 1–30 кГц использовали электродинамический излучатель (Thiel, C2 33/8), в диапазоне 12–75 кГц – изготовленный по специальному заказу электростатический излучатель [16]. Излучатели были размещены на расстоянии 60 см (электродинамический) и 30 см (электростатический) от уха животного, контралатерального стороне регистрации, под углом 45° к сагиттальной плоскости. Неравномерность частотной характеристики электродинамического излучателя составляла ±6.5 дБ на частотах 1–30 кГц. Электростатический излучатель имел равномерную частотную характеристику в диапазоне 12–90 кГц (±2 дБ). Частотные характеристики излучателей фиксировались в компьютере и автоматически корректировались таким образом, что при звукогенерации отклонения от равномерной характеристики составляли только ±1.5 дБ.
Уровни звукового давления сигналов (УЗД, дБ над 20 мкПа) измеряли в точке расположения ушной раковины животного с помощью системы Брюль & Кьер: 6.5 мм микрофона 4135, предусилителя 2633 и измерительного усилителя 2606. При максимальных значениях используемых сигналов (90 дБ УЗД) уровень основной частоты по крайней мере на 35 дБ (а как правило, более, чем на 50 дБ) превышал уровень продуктов искажений.
На протяжении эксперимента животное находилось в звукозаглушенной анэхоидной камере. Эксперимент начинали с аудиовизуального определения ХЧ и порога ответа нейрона на тон ХЧ. Регистрацию временны́х характеристик активности нейрона – паттернов ответов – выполняли при тестировании его частотного рецептивного поля одиночными тонами. Тестирование производилось автоматически с использованием контролируемой компьютером однотоновой парадигмы. Тональные сигналы длительностью 60 мс, включая время нарастания и спада по 5 мс, предъявляли с интервалом 300 мс. Каждый сигнал предъявляли трижды, в случайном порядке комбинаций 16 фиксированных частот и 16 интенсивностей (т.е. 256 различных тонов). Шаг по интенсивности составлял 5–7 дБ, по частоте – 1/16 от выбранного частотного диапазона по логарифмической шкале.
Измерения производили во всем частотном диапазоне слуховой чувствительности мыши (3–80 кГц) и при интенсивностях сигнала от пороговых до 105 дБ над порогом ответа нейрона (что соответствует диапазону от –20 до 85 дБ над 20 мкПа).
Временные узоры разрядов нейронов (паттерны активности) оценивали по перистимульным гистограммам и растровым диаграммам их ответов на тональные сигналы, вызывавшие возбудительный ответ нейрона (рис. 1, 2).
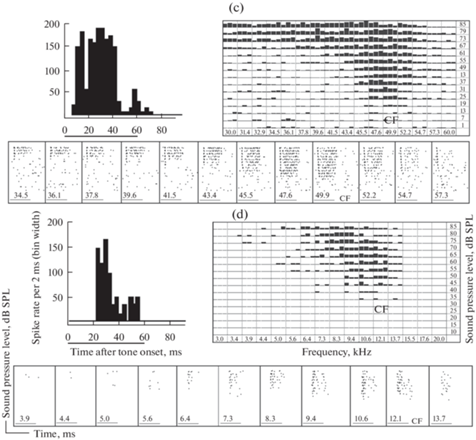
Рис. 1.
Типичная перистимульная гистограмма фазно-тонического ответа нейрона центрального ядра на звуковой сигнал, образованная начальным фазным (phasic component) и поздним тоническим (tonic component) компонентами. По оси абсцисс: длительность, мс; по оси ординат: величина ответа, спайк/с. Горизонтальная линия под гистограммой – отметка стимула.

Рис. 2.
Примеры нейронов центрального ядра с постоянными паттернами ответов на все звуковые сигналы, вызывающие возбудительный ответ: (a) – нейрон с первично-подобным рецептивным полем и пачечным разрядом; (b) – нейрон с V-образным рецептивным полем и фазным разрядом; (c) – первично-подобный нейрон с паузным разрядом; (d) – первично-подобный нейрон с позднелатентым разрядом. В верхней левой части каждого фрагмента: перистимульная гистограмма ответа нейрона на сигнал ХЧ. Горизонтальная линия под осью абсцисс – отметка стимула (60 мс). В верхней правой части каждого фрагмента: диаграмма частотного возбудительного рецептивного поля нейрона, выполненная в координатах частота стимула, кГц (абсцисса) – уровень звукового давления, дБ УЗД над 20 мкПа (ордината). Высота каждого столбика пропорциональна числу спайков в ответе нейрона на сигнал данной частоты и интенсивности. В нижней части каждого фрагмента – растровые диаграммы ответов нейрона. Каждая точка (растр) соответствует разряду нейрона в ответ на сигнал данной частоты и интенсивности. Уровень сигнала увеличивается снизу – вверх. Цифрами на каждой диаграмме указана частота сигнала, кГц. Горизонтальная линия под каждой диаграммой – отметка стимула.

Рис. 2.
Окончание.
Статистическую обработку данных проводили с использованием теста Манна–Уитни (U-test), а также непараметрического критерия согласия Пирсона (критерий χ2). При вычислении критерия χ2 оперировали значениями количества нейронов, а не их процентными соотношениями. Все расчеты выполняли при помощи программного обеспечения SigmaPlot (версия 11).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ временны́х характеристик активности (временны́х узоров разрядов) выполнен для 135 нейронов центрального ядра заднего холма у 45 домовых мышей. ХЧ нейронов занимали диапазон 4.3–60 кГц.
В соответствии с разработанной ранее классификацией нейронов центрального ядра [7, 8] все исследованные нейроны были отнесены к трем основным группам на основе пространственного распределения возбуждающих входов в их рецептивных полях. Из 135 зарегистрированных нейронов 50 единиц (37.0%) были отнесены к группе первично-подобных (рис. 2a, 2с, 2d, рис. 4а, 4с), 44 (32.6%) – к группе тормозно-зависимых нейронов (рис. 4b), у 41 нейрона (30.4%) частотные рецептивные поля имели V-образную форму (рис. 2b).
У зарегистрированных нейронов наблюдали все типы разрядов, выявленных ранее при исследовании ответов нейронов центрального ядра на тон ХЧ [9–11]. Мы использовали следующую классификацию типов разрядов: 1) тонический, отличающийся равномерным распределением спайков в течение всего действия звукового сигнала; 2) фазно-тонический, представляющий собой тонический ответ с выраженным начальным фазным компонентом в виде нескольких, быстро следующих один за другим спайков (рис. 1); 3) паузный, с тоническим разрядом, прерываемым паузой в импульсном ответе нейрона (рис. 2c); 4) позднелатентный, с тоническим разрядом и латентным периодом, превышающим 20 мс (рис. 2d); 5) фазный, содержащий в ответе на сигнал 1–3 начальных спайка (рис. 2b) и 6) пачечный, с разрядом, превышающим по длительности и количеству спайков фазный, но заканчивающимся ранее окончания сигнала (рис. 2a). Таким образом, в ответе любого нейрона (за исключением пачечных разрядов) можно было выделить начальный фазный компонент, занимавший первые 10–11 мс, и/или следующий за ним более поздний тонический компонент, длительность которого соответствовала длительности ответа за вычетом его фазного компонента (рис. 1).
Более трети всех исследованных нейронов не изменяли тип разряда с изменением частоты и интенсивности сигнала (37.8%, 51 нейрон, рис. 2, табл. 1). Около половины из них (47.0%, 24 нейрона) имели рецептивные поля V-образного типа (рис. 2b); 27.0% (14 нейронов) относились к группе первично-подобных нейронов (рис. 2а, 2с, 2d); 26.0% нейронов были тормозно-зависимыми (13 единиц). Критерий χ2 выявил достоверные различия в распределении паттернов ответов среди нейронов трех групп с постоянным временным узором разряда во всей области возбудительного ответа (p < 0.001). Среди первично-подобных нейронов с постоянным паттерном активности преобладали единицы с позднелатентными ответами (рис. 2d). В меньшей степени такие нейроны проявляли фазный, тонический, пачечный (рис. 2а) или паузный (рис. 2с) разряды. Тормозно-зависимые нейроны с постоянным типом разряда демонстрировали, как правило, фазный, в меньшей степени – паузный, пачечный и тонический ответы. Среди нейронов этой группы позднелатентный ответ не встречался. У нейронов с V-образными рецептивными полями преобладали фазные (рис. 2b) и пачечные разряды. Нейроны с фазно-тоническими или паузными ответами в этой группе не встречались. Нейроны с постоянным фазно-тоническим разрядом в исследованной популяции не встречались.
Таблица 1.
Распределение нейронов центрального ядра с различными типами разрядов среди трех основных групп
| Тип разряда | Тип рецептивных полей | Всего | |||
|---|---|---|---|---|---|
| первично- подобные | тормозно- зависимые | V-образные | |||
| Не изменяли тип разряда | Тонический | 2 (14.3%) | 1 (7.7%) | – | 3 |
| Фазно-тонический | – | – | – | – | |
| Паузный | 1 (7.1%) | 2 (15.4%) | – | 3 | |
| Позднелатентный | 6 (42.9%) | 1 (7.7%) | 1 (4.2%) | 8 | |
| Пачечный | 2 (14.3%) | 3 (23.0%) | 8 (33.3%) | 13 | |
| Фазный | 3 (21.4%) | 6 (46.2%) | 15 (62.5%) | 21 | |
| Всего | 14 (100%) | 13 (100%) | 23 (100%) | 50 | |
| Изменяли тип разряда | 36 | 31 | 17 | 84 | |
| Всего | 50 | 44 | 41 | 135 | |
Остальные нейроны (62.2%, 84 нейрона) изменяли тип разряда при изменении частоты и/или интенсивности звука. Среди них более 40% составляли нейроны с первично-подобными рецептивными полями (42.9%, 36 единиц). 31 нейрон (36.9%) имел тормозно-зависимое рецептивное поле. Доля V-образных нейронов с вариабельным паттерном активности была наименьшей и составляла немногим более пятой части (20.2%, 17 единиц). Ответы 31 нейрона (20 первично-подобных и 11 тормозно-зависимых) на любые сигналы всегда содержали тонический компонент, т.е. отличались тоническими характеристиками активности. Ответы 36 нейронов (16 первично-подобных и 20 тормозно-зависимых) хотя бы на некоторые сигналы были фазными и пачечными, т.е. без тонического компонента.
Практически у всех нейронов смена паттерна разряда с изменением частоты и интенсивности сигнала наблюдалась не более, чем дважды во всем возбудительном частотном рецептивном поле (рис. 3, 4). При этом у большинства нейронов (71.4% первично-подобных, 94.7% тормозно-зависимых и 69.2% V-образных единиц) изменение типа разряда происходило в пределах 1/3–1/2 октавы от ХЧ как в сторону низких, так и в сторону высоких частот (рис. 4). Эта величина соответствует ширине критической полосы слуха мыши, определенной нами для нейронов центрального ядра ранее [8, 17–21]. При этом у первично-подобных и тормозно-зависимых нейронов преобладали изменения разряда, связанные с усилением торможения, по сравнению с ответами на тон ХЧ (рис. 3а, 3b; рис. 4а, 4с), а именно: утрата фазного компонента ответа с преобразованием разряда в позднелатентный (рис. 3b), утрата тонического компонента ответа с преобразованием разряда в фазный или пачечный (рис. 3а), появление паузы между компонентами. Ослабление торможения у первично-подобных нейронов наблюдалось только с низкочастотной стороны на границе критической полосы нейрона и за ее пределами (рис. 3с; рис. 4а) и проявлялось в появлении фазного, либо тонического компонента ответа по сравнению с ответом на тон ХЧ, либо в исчезновении паузы между ними. Ослабление торможения у тормозно-зависимых единиц было выявлено всего в четырех случаях (как с низко-, так и с высокочастотной стороны относительно ХЧ). Изменения временного узора разряда первично-подобных нейронов происходили на достоверно большем удалении от ХЧ, чем у тормозно-зависимых единиц (тест Манна–Уитни, p < 0.05, рис. 4a, 4с). Повторное изменение типа разряда встречалось у единичных нейронов (рис. 4a, 4с). У первично-подобных нейронов оно было вызвано ослаблением торможения в области низкочастотного хвоста (рис. 4a); у тормозно-зависимых – усилением торможения с низкочастотной стороны (рис. 4с).
Рис. 3.
Примеры трех нейронов центрального ядра, у которых при отклонении частоты сигнала от ХЧ наблюдали преобразования типа разряда, сопряженные с утратой либо появлением фазного или тонического компонента. (а) – Первично-подобный нейрон, паузный ответ которого на тон ХЧ при дальнейшем росте частоты сигнала переходит в фазный с утратой позднего тонического компонента; (b) – тормозно-зависимый нейрон, в ответе которого наблюдается утрата тонического компонента при понижении частоты сигнала относительно ХЧ и утрата фазного – при ее повышении; (c) – первично-подобный нейрон с фазным ответом на сигнал ХЧ, который преобразуется в паузный (т.е. приобретает тонический компонент) при отклонении частоты тона от ХЧ в низкочастотную сторону. Каждый фрагмент включает диаграмму возбуждающего рецептивного поля данного нейрона (вверху, столбчатая диаграмма) и растровые диаграммы его ответов (внизу). Все обозначения – как на рис. 2.

Как было упомянуто выше, подавляющая часть V-образных нейронов не изменяла тип разряда. Изменения встречались лишь у единичных нейронов и были связаны как с усилением, так и с ослаблением торможения в диапазоне –1…+0.6 октавы относительно ХЧ нейрона (рис. 4е). При столь редко встречающемся изменении типа разряда трудно делать выводы о закономерностях в распределении тормозных входов в рецептивных полях V-образных нейронов, и дальнейший анализ изменений паттернов разрядов у этой группы нейронов не производили.
Рис. 4.
Распределение нейронов центрального ядра в зависимости от положения смены типа разряда по частотной шкале относительно ХЧ нейрона. (a), (b) – Первично-подобные нейроны; (c), (d) – тормозно-зависимые нейроны; (e), (f) – V-образные нейроны. (a), (c), (e) – Распределение числа нейронов относительно расстояния (в октавах) между ХЧ нейрона и частотой сигнала, при действии которого наблюдали изменение типа разряда нейрона, вызванное усилением (заливка черным) или ослаблением (диагональная штриховка) тормозных входов в рецептивном поле нейрона, а также от удаленности от ХЧ нейрона частоты звука, при которой происходила вторая смена паттерна его активности (белая заливка – ослабление торможения, сетчатая штриховка – усиление торможения). Вертикальными пунктирными линиями отмечены границы критических полос слуха мыши ниже и выше по частоте от ХЧ нейрона; сплошными – границы критической полосы нейронов данной группы, для которой ХЧ является центральной частотой критической полосы [16, 17]. (b), (d), (f) – Распределение числа нейронов трех основных групп относительно удаленности (в октавах) от ХЧ нейрона частоты звука, при действии которого происходило вытормаживание фазного (черная заливка) или тонического (штриховка) компонентов ответа нейрона. N – число нейронов.
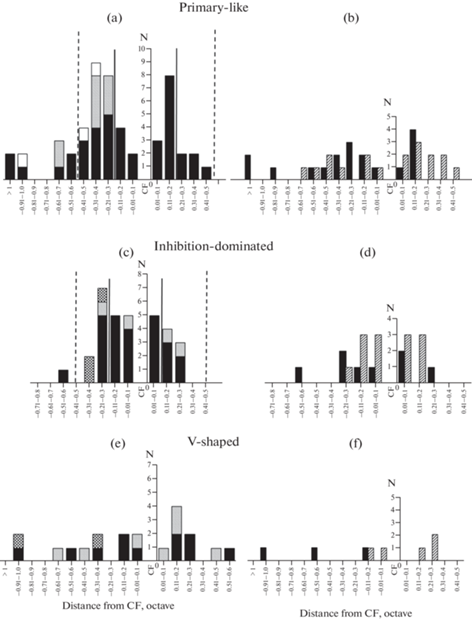
У большинства нейронов преобразование паттернов ответа было связано с утратой его фазного или тонического компонента (по сравнению с ответом на тон ХЧ), т.е. очевидно, с активацией тормозных входов в рецептивном поле нейрона (рис. 4b, 4d, 4f). Достоверных различий в октавном расстоянии между ХЧ нейрона и частотой, на которой происходила утрата фазного или тонического компонента разряда, между первично-подобными и тормозно-зависимыми нейронами выявлено не было (тест Манна–Уитни, p > 0.5). При этом у 78.0% первично-подобных и 86.0% тормозно-зависимых нейронов преобразования ответа происходили не далее, чем в 1/3–1/2 октавы от ХЧ нейрона в сторону низких или высоких частот (рис. 4b, 4d, 4f). У первично-подобных нейронов со стороны высоких частот преобладала утрата тонического компонента, со стороны низких частот вытормаживание обоих компонентов ответа было представлено в равной мере (рис. 4b). У тормозно-зависимых единиц преобладало вытормаживание тонического компонента ответа (рис. 4d). Статистический анализ показал, что: 1) в целом, среди первично-подобных и тормозно-зависимых единиц вытормаживание фазных и тонических компонентов ответа происходило на разных расстояниях от ХЧ (тест Манна–Уитни, р < 0.01); 2) вытормаживание фазных компонентов ответа у первично-подобных нейронов происходило на разном удалении от ХЧ нейрона со стороны низких и со стороны высоких частот (тест Манна–Уитни, р < 0.01); 3) вытормаживание компонентов ответа у тормозно-зависимых нейронов было симметричным относительно ХЧ нейрона.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты настоящей работы показали, что популяция нейронов центрального ядра заднего холма мыши гетерогенна не только по особенностям временных характеристик ответов нейронов на тон ХЧ [10–12], но и по особенностям динамики паттернов ответов в их возбудительных частотных рецептивных полях. Как правило, нейроны с постоянными временными характеристиками ответа имели частотные рецептивные поля V-образного типа и реагировали на сигнал фазным или пачечным разрядом. Остальные нейроны отличались вариабельностью временных характеристик вызванной активности. При этом для первично-подобных и тормозно-зависимых нейронов были характерны разряды с ярко выраженным поздним тоническим компонентом (т.е. тонический, фазно-тонический, паузный или позднелатентный ответ).
Значительная часть нейронов при смене паттерна активности по сравнению с ответом на тон ХЧ проявляла либо ослабление тонического компонента в ответе вплоть до его полного исчезновения (разряд нейрона становился фазным, пачечным или паузным), либо вытормаживание фазного компонента ответа с преобразованием разряда в позднелатентный. Такое ослабление тонического либо фазного компонентов в ответе, по-видимому, объясняется активацией тормозных входов в рецептивных полях нейронов, вызванной воздействием сигналов с определенной частотой и интенсивностью по механизму латерального торможения. Анализ распределения тормозных входов в частотных рецептивных полях, подавляющих фазный либо тонический компонент в ответе нейрона, выявил их преимущественную локализацию в пределах одной критической полосы ниже и выше по частоте относительно ХЧ нейрона. Полученные результаты являются дополнительным доказательством универсальности механизма критических полос, лежащего в основе не только частотного, но и временного анализа в слуховых центрах мозга [19–21]. Морфологическим базисом механизма критических полос в центральном ядре являются строго упорядоченные синаптические связи между нейронами внутри критической полосы, причем эти связи, по-видимому, имеют преимущественно тормозный характер. Периодичности тормозных входов внутри критической полосы, по-видимому, нет, они непрерывны. Распределение тормозных входов у нейронов с первично-подобными и тормозно-зависимыми рецептивными полями различается. Ослабление торможения наблюдается преимущественно у границ критических полос или за их пределами.
V-образные нейроны отличаются постоянством типа разряда и, как было показано ранее [12, 22], постоянством латентных периодов ответов, т.е. малым влиянием торможения на формирование их активности. Это соответствует выводам о слабости тормозных входов в их рецептивных полях [12, 22].
По всей видимости, выявленные нами свойства динамики временных характеристик ответов нейронов являются следствием особенностей распределения и функционирования в мембранах нейронов рецепторов к медиатору, и в первую очередь, к глутамату – основному возбуждающему нейротрансмиттеру в задних холмах. Для мембран нейронов центрального ядра показаны два основных типа глутаматных рецепторов – NMDA и AMPA [23]. Хорошо известно, что эти типы рецепторов различаются по скорости активации и инактивации [23–25], что делает разным и их вклад в формирование раннего (фазного) и позднего (преимущественно тонического) компонентов ответов нейронов. AMPA-рецепторы имеют наиболее быструю кинетику активации, инактивации и десенсибилизации среди всех типов рецепторов к глутамату, обеспечивая передачу сигнала в глутаматергических синаптических окончаниях в течение 0.3–5 мс [23–25]. Это означает, что с учетом синаптической задержки в восходящем слуховом пути от Кортиева органа к центральному ядру, за счет функционирования только AMPA-рецепторов может быть сформирован ответ нейрона с латентным периодом, не превышающим 10–11 мс. Таким образом, именно активация данных глутаматных рецепторов, по всей видимости, приводит к развитию начального фазного компонента ответа нейронов. С активацией более медленных NMDA-рецепторов [23], по-видимому, связано формирование позднего тонического компонента ответа нейронов задних холмов. Кроме того, по данным Wu и соавт., начальная стадия возникновения позднего компонента ответа также обеспечивается продолжающейся активацией AMPA-рецепторов [25]. В литературе имеются также данные о важной роли тормозных процессов, опосредованных активацией ГАМКА-рецепторов, в формировании свойств ответов нейронов центрального ядра [25–27].
Каждая из трех основных групп нейронов центрального ядра, по всей видимости, обладает характерным только для нее алгоритмом последовательной активации и инактивации AMPA-, NMDA- и ГАМКА-рецепторов в мембранах соответствующих синаптических окончаний и, вероятно, отличается от остальных групп по соотношению вклада этих рецепторов. Очевидно, что у нейронов с V-образными рецептивными полями и фазными разрядами ключевую роль в формировании фазного разряда играет передача сигнала при помощи AMPA-рецепторов к глутамату и тормозных ГАМКА-рецепторов. Полученные нами результаты позволяют предположить полное отсутствие NMDA-рецепторов в мембранах V-образных нейронов, отвечающих на любые сигналы (простые тональные и сложные многокомпонентные) только фазными разрядами [12, 14, 17]. У первично-подобных и тормозно-зависимых нейронов, разряды которых образованы как фазными, так и тоническими компонентами, очевидно, что для формирования ответа принципиальной является передача сигнала посредством активации как АМРА-, так и NMDA-рецепторов. Выявленная в настоящей работе большая доля единиц с фазным разрядом среди тормозно-зависимых нейронов по сравнению с первично-подобными, вероятно, свидетельствует о силе пресинаптического торможения в этой группе нейронов, опосредованно инактивирующего ионные каналы NMDA-рецепторов. Можно предположить, что у нейронов, отвечающих только позднелатентными разрядами, сопряженными с высокой дисперсией латентных периодов ответов [12], в мембране отсутствуют АМРА-рецепторы.
Изменение типа разряда нейрона на фазный или позднелатентный на разном частотном расстоянии от его ХЧ, показанное у первично-подобных и тормозно-зависимых нейронов, свидетельствует о специфике распределения в этих группах пресинаптического торможения на аксонах, возбуждающих АМРА- и NMDA-рецепторы.
Еще одним актуальным вопросом, требующим разрешения, является установление соответствия между результатами нейрофизиологических исследований активности нейронов задних холмов и данными, полученными в ходе их морфологического описания. Так, на сегодняшний день известно, что популяция нейронов центрального ядра, получающих глутаматергические возбуждающие входы от нижележащих центров слуха, может быть подразделена на две группы на основании состава синтезируемых этими клетками белков. Примерно в 60% этих клеток выявлена экспрессия генов, ответственных за биосинтез холецистокинина [28]. При этом нейроны, синтезирующие холецистокинин, отличались параллельной (ламинарной) ориентацией дендритов. Аксоны же данных нейронов формировали основной объем восходящих проекций из центрального ядра задних холмов в вентральный подотдел медиального коленчатого тела [28]. Представляется очевидным, что нейроны центрального ядра, синтезирующие холецистокинин, соответствуют описанным ранее у кошки, крысы и мыши основным (веретеновидным, дисковидным) клеткам [29–31]. Остальную часть популяции возбуждающих нейронов центрального ядра составляли нервные клетки, в которых была отмечена экспрессия генов, обеспечивающих биосинтез вазоактивного интестинального пептида (VIP). Данные клетки, обозначенные как VIP-нейроны, отличались звездчатым морфотипом и располагались диффузно по всему объему центрального ядра, а их аксоны формировали большое количество восходящих и нисходящих проводящих путей, связывающих задние холмы как со специфическими структурами слуховой системы, так и с центрами других сенсорных систем, а также с ассоциативными ядрами в разных отделах мозга [32–34]. По всей видимости, VIP-нейроны соответствуют описанным ранее в центральном ядре звездчатым клеткам [29–31].
Исследования свойств импульсной активности холецистокинин-содержащих нейронов в условиях аппликации блокаторов AMPA- и NMDA-рецепторов позволили авторам предположить, что для развития ответов этих нейронов на звук необходима активация и того и другого типа ионотропных рецепторов к глутамату [26]. Кроме того, в последние годы были получены данные, указывающие на вовлеченность в формирование основных свойств ответов VIP-нейронов задних холмов как глутаматных NMDA- и AMPA-рецепторов, так и никотиновых ацетилхолиновых рецепторов. В частности, было показано, что аппликация блокаторов α3β4-N-ацетилхолиновых рецепторов на поверхность заднего холма мыши приводит к подавлению опосредованного ацетилхолином возбудительного ответа VIP-нейронов [32, 33].
Таким образом, VIP-нейроны задних холмов, по-видимому, получают более разнообразный набор возбуждающих входов, чем “холецистокининовые” нейроны, что, несомненно, должно находить отражение в регистрируемых в физиологическом эксперименте свойствах их ответов на звуковые сигналы [35]. Например, можно предположить, что частотная настройка таких нейронов должна быть шире, а избирательность по частоте ниже, чем у единиц, получающих возбуждающие входы от малого числа источников. Кроме того, недавно в центральном ядре задних холмов мыши был описан другой тип мультиполярных нейронов – так называемые нейропептид-Y-синтезирующие нейроны (NPY-нейроны) [36, 37]. Согласно данным авторов приведенных исследований, они являются ГАМКергическими вставочными нейронами и составляют около 1/6 части популяции нейронов центрального ядра [26, 33, 36]. По всей видимости, NPY-нейроны в задних холмах вовлечены в регуляцию активности других групп единиц слухового центра среднего мозга посредством усиления получаемых ими тормозных входов [36].
С учетом результатов исследований импульсной активности нейронов задних холмов, выполненных на переживающих срезах мозга мыши методом локальной фиксации потенциала на мембране, и выявивших фазные свойства ответов и низкую частотную избирательность у звездчатых нейронов [38], а также сходства частотно-временных характеристик ответов V-образных нейронов центрального ядра и мультиполярных нейронов, обнаруженных в заднем вентральном кохлеарном ядре и названных клетками-октопусами [39, 40], представляется обоснованным идентифицировать V-образные нейроны как звездчатые. В то же время прямых и однозначных доказательств соответствия V-образных нейронов центрального ядра звездчатым клеткам пока не получено, что, вместе с данными о морфологической и функциональной неоднородности мультиполярных нейронов, обнаруженных в этой структуре, приводит нас к заключению о необходимости дальнейших исследований данного вопроса.
ЗАКЛЮЧЕНИЕ
В настоящей работе впервые детально рассмотрена взаимосвязь динамики временных узоров разрядов различных типов нейронов слухового центра среднего мозга мыши с особенностями паттерна активации тормозных входов в их частотных возбудительных рецептивных полях. Нейрофизиологическими методами подтверждена универсальность механизма критических полос слуха их участием не только в частотном, но и во временном анализе звуковых сигналов. Выявленное разнообразие динамики типов разрядов в частотных рецептивных полях исследованных нейронов позволило предположить существование различий в распределении разных типов глутаматных рецепторов в мембранах нейронов с разным строением рецептивных полей.
Список литературы
Гершуни ГВ (1967) О механизмах слуха (в связи с исследованием временных и временно-частотных характеристик слуховой системы). Механизмы слуха. Пробл физиол акустики 5(6): 3–32. [Gershuni GV (1967) On the mechanisms of hearing (in connection with the study of temporal and temporal-frequency characteristics of the auditory system). Mechanisms of hearing. Probl Physiol Acoust 5(6): 3–32. (In Russ)].
Гершуни ГВ, Альтман ЯА, Вартанян ИА, Марусева АМ, Радионова ЕА, Ратникова ГИ (1969) О функциональной классификации нейронов слухового отдела четверохолмия кошки по временным характеристикам. Нейрофизиология 1(2): 137–146. [Gersuni GV, Altman JA, Vartanian IA, Maruseva AM, Radionova EA, Ratnikova GI (1969) Functional classification of the neurons of the inferior colliculi in the cat based on their temporal properties. Neirofiziologia 1(2): 137–146. (In Russ)].
Gersuni GV (ed) (1971) Temporal organization of the auditory function. In: Sensory processes at the neuronal and behavioral levels. NY-London. Acad Press. 85–114.
Ehret G, Moffat AJM (1985) Inferior colliculus of the house mouse. II. Single unit responses to tones, noise and tone-noise combinations as a function of sound intensity. J Comp Physiol 156: 619–635. https://link.springer.com/article/10.1007/BF00619111
Ehret G, Fischer R (1991) Neuronal activity and tonotopy in the auditory system visualized by c-fos gene expression. Brain Res 567: 350–354. https://doi.org/10.1016/0006-8993(91)90819-H
Ehret G (1997) The auditory midbrain, a “shunting yard” of acoustical information processing In: G Ehret and R Romand (Eds) The Central Auditory System. Oxford Univer Press. New York. 259–316.
Egorova M, Ehret G, Vartanian I, Esser K-H (2001) Frequency response areas of neurons in the mouse inferior colliculus. I. Threshold and tuning characteristics. Exp Brain Res 140: 145–161.https://doi.org/10.1007/s002210100786
Vartanian IA, Egorova MA, Ehret G (2000) Critical Bandwidths of Different Types of Neurons in the Mouse Auditory Midbrain. Dokl Biol Sci 373(5): 701–703.
Ehret G, Merzenich MM (1988) Neuronal discharge rate is unsuitable for encoding sound intensity at the inferior colliculus level. Hear Res 35: 1–8. https://doi.org/10.1016/0378-5955(88)90035-4
Егорова МА (2008) Временные свойства импульсной активности одиночных нейронов задних холмов мыши. Сенсорн сист 22(3): 203–213. [Egorova MA (2008) The temporal properties of activity of the mouse inferior colliculus single neurons. Sensorn Sist 22(3): 203–213. (In Russ)].
Egorova MA (2008) Peculiarities of time patterns of discharges of single auditory neurons of mouse inferior colliculi. J Evol Biochem Physiol 44(5): 637. https://doi.org/10.1134/S0022093008050149
Egorova MA, Akimov AG, Khorunzhii GD, Ehret G (2020) Frequency response areas of neurons in the mouse inferior colliculus. III. Time-domain responses: Constancy, dynamics, and precision in relation to spectral resolution, and perception in the time domain. PLoS One 15(10): e0240853. https://doi.org/10.1371/journal.pone.0240853
Egorova MA, Akimov AG (2020) Specialization of Neurons with Different Response Patterns in the Mouse Mus musculus Auditory Midbrain and Primary Auditory Cortex during Communication Call Processing. J Evol Biochem Physiol 56(5): 406–414. https://doi.org/10.1134/S0022093020050038
Akimov AG, Egorova MA, Ehret G (2017) Spectral summation and facilitation in on-and off-responses for optimized representation of communication calls in mouse inferior colliculus. Eur J Neurosci 45(3): 440–459. https://doi.org/10.1111/ejn.13488
Sidman RL, Angewine JB, Pierce ET (1977) In: Atlas of the Mouse Brain and Spinal Cord. Massachusetts. Harvard Univer Press.
Machmerth H, Theiss D, Schnitzler HU (1975) Konstruktion eines Luftschallgebers mit konstantem Frequenzgang im Bereich von 15–130 kHz. Acustica 34: 81–85.
Egorova M, Ehret G (2008) Tonotopy and inhibition in the midbrain inferior colliculus shape spectral resolution of sounds in critical bands. Eur J Neurosci 28: 675–692. https://doi.org/10.1111/j.1460-9568.2008.06376.x
Egorova M, Vartanian I, Ehret G (2006) Frequency response areas of mouse inferior colliculus neurons II. Critical bands. Neuroreport 17(17): 1783–1786. https://doi.org/10.1097/01.wnr.0000239966.29308.fb
Egorova MA, Akimov AG (2013) Spectral coding in auditory midbrain neurons. J Integr Neurosci 12(1): 1–15. https://doi.org/10.1142/S0219635213500027
Егорова МА, Вартанян ИА, Эрет Г (2002) Нейрофизиологические предпосылки слуховых критических полос на уровне среднего мозга. Сенсорн сист 16: 3–12. [Egorova MA, Vartanian IA, Ehret G (2002) Neurophysiological background for auditory critical bands in the auditory midbrain. Sensorn Sist 16: 3–12. (In Russ)].
Malinina ES, Egorova MA, Akimov AG (2015) Neurophysiological approaches to studying the functional role of auditory critical bands. J Evol Biochem Physiol 51(5): 401–411. https://doi.org/10.1134/S0022093015050063
Khorunzhii GD, Egorova MA (2014) Time characteristics of impulse activity of neurons with the V-shaped frequency receptive fields in the house mouse (Mus musculus) auditory midbrain. J Evol Biochem Physiol 50(4): 357–361. https://doi.org/10.1134/S0022093014040097
Kelly JB, Zhang H, Wu SH (2001) Contribution of AMPA and NMDA receptors to the excitatory responses in the inferior colliculus. Hear Res 165: 35–42. https://doi.org/10.1016/S0378-5955(02)00372-6
Erreger K, Chen PE, Wyllie DJ, Traynelis SF (2004) Glutamate receptor gating. Crit Rev Neurobiol 16(3): 187–224. https://doi.org/10.1615/CritRevNeurobiol.v16.i3.10
Wu SH, Ma CL, Kelly JB (2004) Contribution of AMPA, NMDA, and GABAa receptors to temporal pattern of postsynaptic responses in the inferior colliculus of the rat. J Neurosci 24(19): 4625–4634.https://doi.org/10.1523/JNEUROSCI.0318-04.2004
LeBeau FEN, Malmieca MS, Rees A (2001) Iontophoresis in vivo demonstrates a key role for GABAA and glycinergic inhibition in shaping frequency response areas in the inferior colliculus of guinea pig. J Neurosci 21: 7303–7312. https://doi.org/10.1523/JNEUROSCI.21-18-07303.2001
Schofield BR, Beebe NL (2019) Subtypes of GABAergic cells in the inferior colliculus. Hear Res 376: 1–10. https://doi.org/10.1016/j.heares.2018.10.001
Kreeger LJ, Connelly CJ, Mehta P, Zemelman BV, Golding NL (2021) Excitatory cholecystokinin neurons of the midbrain integrate diverse temporal responses and drive auditory thalamic subdomains. Proc Natl Acad Sci U S A 118(10): e2007724118. https://doi.org/10.1073/pnas.2007724118
Oliver DL, Kuwada S, Yin TCT, Haberly LB, Henkel CK (1991) Dendritic and axonal morphology of HRP-injected neurons in the inferior colliculus of the cat. J Comp Neurol 303: 75–100.https://doi.org/10.1002/cne.903030108
Malmierca MS, Blackstad TW, Osen KK, Karagülle T, Molowny RL (1993) The central nucleus of the inferior colliculus in rat: a Golgi and computer reconstruction study of neuronal and laminar structure. J Comp Neurol 333: 1–27. https://doi.org/10.1002/cne.903330102
Malmierca MS, Seip KL, Osen KK (1995) Morphological classification and identification of neurons in the inferior colliculus: a multivariate analysis. Anat Embryol 191: 343–350. https://doi.org/10.1007/BF00534687
Rivera-Perez LM, Kwapiszewski JT, Roberts MT (2021) α3β4* Nicotinic acetylcholine receptors strongly modulate the excitability of VIP neurons in the mouse inferior colliculus. bioRxiv: 1–26. https://doi.org/10.3389/fncir.2021.709387
Kwapiszewski JT, Rivera-Perez LM, Roberts MT (2022) Cholinergic boutons are distributed along the dendrites and somata of VIP neurons in the inferior colliculus. bioRxiv. https://doi.org/10.1101/2022.09.18.508423
Liu M, Dai J, Zhou M, Liu J, Ge X, Wang N, Zhang J (2022) Mini-review: The neural circuits of the non-lemniscal inferior colliculus. Neurosci Lett 136567. https://doi.org/10.1016/j.neulet.2022.136567
Beebe NL, Silveira MA, Goyer D, Noftz WA, Roberts MT, Schofield BR (2022) Neurotransmitter phenotype and axonal projection patterns of VIP-expressing neurons in the inferior colliculus. J Chem Neuroanat 126: 102189. https://doi.org/10.1016/j.jchemneu.2022.102189
Silveira MA, Anair JD, Beebe NL, Mirjalili P, Schofield BR, Roberts MT (2020) Neuropeptide Y expression defines a novel class of GABAergic projection neuron in the inferior colliculus. J Neurosci 40(24): 4685–4699. https://doi.org/10.1523/JNEUROSCI.0420-20.2020
Anair JD, Silveira MA, Mirjalili P, Beebe NL, Schofield BR, Roberts MT (2022) Inhibitory NPY neurons provide a large and heterotopic commissural projection in the inferior colliculus. Front Neur Circ 16. https://doi.org/10.3389/fncir.2022.871924
Peruzzi D, Sivaramakrishnan S, Oliver DL (2000) Identification of cell types in brain slices of the inferior colliculus. Neuroscience 101(2): 403–416. https://doi.org/10.1016/S0306-4522(00)00382-1
Rhode WS, Oertel D, Smith PH (1983) Physiological response properties of cells labeled intracellularly with horseradish peroxidase in cat ventral cochlear nucleus. J Comp Neurol 213(4): 448–463.https://doi.org/10.1002/cne.902130408
Golding NL, Robertson D, Oertel D (1995) Recordings from slices indicate that octopus cells of the cochlear nucleus detect coincident firing of auditory nerve fibers with temporal precision. J Neurosci 15(4): 3138–3153. https://doi.org/10.1523/JNEUROSCI.15-04-03138.1995
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


