Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 3, стр. 300-314
Аргининдеиминаза пиогенного стрептококка M49-16 нарушает структуру актинового цитоскелета и конфлюэнтность монослоя в культуре эндотелиальных клеток
Дж. Т. Маммедова 1, А. Б. Карасева 1, Л. А. Бурова 1, А. В. Соколов 1, Д. А. Переплетчикова 2, А. Б. Малашичева 2, 3, Э. А. Старикова 1, 4, 5, *
1 Институт экспериментальной медицины
Санкт-Петербург, Россия
2 Институт цитологии РАН
Санкт-Петербург, Россия
3 Национальный медицинский исследовательский центр им. В.А. Алмазова
Министерства здравоохранения Российской Федерации
Санкт-Петербург, Россия
4 Первый Санкт-Петербургский государственный медицинский университет
им. акад. И.П. Павлова
Санкт-Петербург, Россия
5 Институт медицинского образования Национального медицинского исследовательского
центра им. В.А. Алмазова Министерства здравоохранения Российской Федерации
Санкт-Петербург, Россия
* E-mail: Starickova@yandex.ru
Поступила в редакцию 23.12.2022
После доработки 27.01.2023
Принята к публикации 30.01.2023
- EDN: FSSGNU
- DOI: 10.31857/S0869813923030056
Аннотация
Регуляция барьерной функции эндотелия зависит от динамики актинового цитоскелета, которая обусловлена биодоступностью аргинина. Патогенные микроорганизмы могут использовать аргинингидролизующие ферменты для нарушения непрерывности эндотелиальной выстилки сосудов и последующей диссеминации. В данном исследовании изучали влияние аргининдеиминазы пиогенного стрептококка на конфлюэнтность монослоя и структуру актинового цитоскелета эндотелиальных клеток вены пупочного канатика человека in vitro. В экспериментах использовали оригинальную методику получения супернатантов разрушенных ультразвуком стрептококковых клеток (СРС) исходного штамма Streptococcus pyogenes M49-16 и его изогенного мутанта с инактивированным геном аргининдеиминазы S. pyogenes М49-16delArcA. Анализ концентрации L-аргинина производили модифицированным колориметрическим методом Сaкагучи. Структуру актинового цитоскелета анализировали с помощью окрашивания клеток фаллоидином, меченным флуоресцирующим красителем. Конфлюэнтность монослоя эндотелиальных клеток оценивали морфологически после окрашивания клеток красителем кристаллическим фиолетовым. Было установлено, что в присутствии СРС исходного штамма достоверное снижение концентрации L-аргинина в культуре эндотелиальных клеток совпадало с динамическими изменениями структуры актинового цитоскелета. Через 48 ч происходило формирование ламелли и стресс фибрилл. Через 72 ч содержание F-актина снижалось, и конфлюэнтность монослоя эндотелиальных клеток нарушалась. Такие изменения не были выявлены при культивировании клеток в стандартных условиях или в присутствии СРС мутантного по гену аргининдеиминазы штамма. Полученные результаты показывают, что патогенные микроорганизмы могут использовать истощение аргинина для регуляции барьерной функции эндотелия и диссеминации в организме хозяина.
Эндотелий сосудов играет активную роль в реализации защитных реакций иммунитета при инфекции за счет регуляции процессов коагуляции, воспаления и проницаемости сосудов [1]. Значительная разбалансировка этих процессов, связанная с нарушением метаболизма аргинина, развитием эндотелиальной дисфункции и нарушением барьерной функции эндотелия, сопровождает такие тяжелые состояния как сепсис [2], синдром диссеминированного внутрисосудистого свертывания [3], острый респираторный дистресс синдром [4]. Аргинин в эндотелиальных клетках регулирует mTOR (механическая цель рапамицина, от англ. mechanical target of rapamicin) метаболический сигнальный каскад [5]. Аргинин также является субстратом для продукции важнейшей регуляторной молекулы оксида азота (NO, nitric oxide) и служит предшественником других важных метаболитов – полиаминов, пролина, агматина и др. [6]. Установлено, что от биодоступности аргинина в разных типах клеток зависит структура, динамика актиновых филаментов и связанные с этим локомоторные функции клетки. В частности, в исследовании влияния дефицита аргинина на морфологию первичных глиальных клеток крысы было показано, что в отсутствие аргинина в этих клетках наблюдались дефекты ламелли движущего края, снижалось количество стресс-фибрилл и кортикального актина, а клетки приобретали вытянутую форму. Внесение добавки аргинина приводило к быстрому восстановлению морфологии клеток и структуры цитоскелета [7]. Предполагают, что влияние аргинина на актиновый цитоскелет может быть связано с активностью кофилина [8], процессами аргинилирования белков [9, 10] и продукцией NO [11, 12]. Точные аргинин-связанные механизмы регуляции актинового цитоскелета остаются малоизученными. Многие микробные патогены в ходе эволюции выработали разнообразные стратегии, позволяющие регулировать барьерную функцию эндотелия и использовать кровоток как магистраль для распространения в организме хозяина [13]. Актиновый цитоскелет играет важную роль в поддержании барьерной функции эндотелия. Формирование межклеточных контактов, контактов с внеклеточным матриксом, поляризация эндотелиальных клеток и поддержание их формы зависят от работы актинового цитоскелета. Межклеточные адгезионные комплексы (прочные контакты и адгезионные контакты), связанные, с одной стороны, с актиновым цитоскелетом, а с другой стороны, с клеточной мембраной, формируют кортикальное актиновое кольцо, которое соединяет соседние клетки и обеспечивает стабильность эндотелиального монослоя [14]. Актиновый цитоскелет часто становится мишенью действия бактериальных факторов патогенности [15]. Аргининдеиминаза (АДИ) – бактериальный фермент, который осуществляет необратимый гидролиз аргинина с образованием цитруллина и аммиака [16]. Бактериальная АДИ впервые была открыта и долгое время изучалась как фермент, подавляющий пролиферацию разных типов клеток [17–19]. Дальнейшие исследования показали, что АДИ также влияет на другие, связанные с работой цитоскелета функции эндотелиальных клеток, такие как миграция [19, 20] и способность формировать капилляроподобные структуры [17, 21]. В наших ранних исследованиях было установлено, что под влиянием АДИ происходит значительное снижение количества фибриллярного актина (F-aктина) в эндотелиальных клетках вены пупочного канатика (human umbilical vein endothelial cells, HUVEC) [22]. В работе Zhuo с соавт. на клетках микрососудов человека было также показано, что ингибирование формирования актиновых фибрилл в присутствии АДИ может служить одним из механизмов нарушения формирования “ведущей” клетки (tip cell) в ходе роста капилляроподобных структур in vitro [20]. Экспрессия аргинингидролизующих ферментов, таких как АДИ, открывает для патогенных микроорганизмов возможность регулировать широкий спектр аргинин-зависимых клеточных функций организма хозяина. Патогены могут использовать активность АДИ для создания дефицита аргинина в очаге воспаления и, наряду с другими биологически активными продуктами Streptococcus pyogenes (S. pyogenes), облегчать инвазию патогена и его диссеминацию через кровеносное русло.
В данной работе исследовали влияние стрептококковой АДИ на морфологию и структуру актинового цитоскелета эндотелия вены пупочного канатика человека в монослое. При сравнении эффектов супернатантов разрушенных стрептококков (СРС) исходного штамма и его изогенного мутанта с инактивированным геном АДИ было установлено, что в присутствии бактериального фермента в культуральной среде снижается концентрация аргинина, изменяется морфология клеток, нарушается структура актиновых филаментов и межклеточные контакты в монослое.
МЕТОДЫ ИССЛЕДОВАНИЯ
Штаммы S. pyogenes. Для изучения влияния АДИ на эндотелиальные клетки в работе использовали ранее охарактеризованный исходный штамм S. pyogenes M49-16, экспрессирующий АДИ, и его изогенный мутант с инактивированным геном АДИ АrcA [23]. Штаммы S. pyogenes M49-16 и М49-16delArcA были любезно предоставлены руководителем отдела молекулярной микробиологии Института экспериментальной медицины профессором А.Н. Суворовым.
Получение супернатанто разрушенных S. pyogenes. Для получения супернатантов разрушенных стрептококков (СРС) бактерии выращивали 18–20 ч в аэробных условиях при 37°C в среде Todd–Hewitt (Difco, США). Далее суспензию бактериальных клеток осаждали центрифугированием и двукратно отмывали раствором PBS (БиолоТ), после чего доводили концентрацию клеток до 2.5–5.0 × 109 КОЕ/мл. Взвесь бактерий в объеме 5 мл в PBS подвергали дезинтеграции ультразвуком при 22 Гц в течение 5 мин при мощности дезинтегратора (MSE) 0.6–0.8 мА. Разрушение клеток контролировали микроскопически. Суспензию микробов центрифугировали 30 мин при 1600 g для получения супернатанта, который стерилизовали с использованием фильтров Filtropure S (Sarstedt, Австрия) с размером пор 0.45мкм.
Получение эндотелиальных клеток вены пупочного канатика (HUVEC). Эндотелиальные клетки выделяли из вены пупочного канатика человека по адаптированной стандартной методике [24]. Пуповины получали из перинатального центра Национального медицинского исследовательского центра им. В.А. Алмазова. Все пациентки подписывали добровольное информированное согласие. С момента родов до выделения клеток проходило не более 48 ч. Вены канюлировали и инкубировали в течение 10 мин на водяной бане при 37°C с коллагеназой второго типа (Worthington, США) 140 ед./мл в DMEM (БиолоТ, Россия). Полученную суспензию клеток осаждали центрифугированием при 300 g в течение 5 мин, далее клетки ресуспендировали в полной культуральной среде ECM (Sciencell, США) и высевали в культуральные флаконы (Sarstedt, Австрия), покрытые 0.2%-ным раствором желатина (Sigma, США). Пересев производили дважды в неделю. Дезинтеграцию монослоя вызывали инкубацией в растворе Трипсин-ЭДТА (Sigma, США) при 37°C. В экспериментах использовали клетки 3–6 пассажей. Клетки культивировали в среде Endothelial Cell Basal Medium-2 (ECBM-2) (Promocell, Германия) с добавлением ростовой добавки Supplement Mix (Promocell, Германия), 10% эмбриональной сыворотки телят (Sigma, США), 2 мМ L-глутамина (БиолоТ, Россия) и 50 мкг/мл гентамицина (БиолоТ, Россия). Пересев культуры производили дважды в неделю. Дезинтеграцию монослоя осуществляли с использованием раствора Трипсин-ЭДТА (Sigma, США). Для проведения экспериментов использовали клетки 3–5 пассажей.
Влияние СРС М49-16 и М49-16delArcA на жизнеспособность HUVEC. Эндотелиальные клетки засевали в 96-луночные планшеты (Sarstedt, Австрия) в концентрации 25 тысяч клеток в 100 мкл и инкубировали 24 ч до образования конфлюэнтного монослоя при температуре 37°С, во влажной атмосфере с 5% СО2. Далее вносили СРС и культивировали 24 или 72 ч. По истечении времени инкубации монослой дезинтегрировали раствором аккутазы (Sigma, США), клетки переносили в микропробирки (Eppendorf, Германия). Пробы центрифугировали 5 мин при 300 g, надосадочную жидкость удаляли. Клетки переносили в пробирки для анализа и производили окрашивание раствором YO-PRO® (Invitrogen, США) в конечной концентрации 100 нМ и раствором йодида пропидия (Sigma, США) в конечной концентрации 2 мкг/мл в течение 5 мин. Анализ образцов проводили с помощью проточного цитометра Navios (Beckman Coulter, США). Апоптотические клетки становятся проницаемыми для YO-PRO®, но остаются непроницаемыми для йодида пропидия, окрашивающего мертвые клетки. Живые клетки не окрашиваются ни YO-PRO®, ни йодидом пропидия.
Анализ концентрации L-аргинина в культуральной среде HUVEC. Анализ концентрации L-аргинина производили модифицированным колориметрическим методом Сакагучи. Реакция основана на образовании окрашенного в красный цвет соединения при реакции аргинина с 8-оксихинолином и гипобромитом натрия в щелочной среде. Клетки засевали в концентрации 5 тысяч в 100 мкл полной культуральной среды и инкубировали сутки с исследуемыми веществами. Для анализа использовали культуральную среду, отобранную через 24, 48 и 72 ч. Образцы среды центрифугировали 5 мин при 300 g в микропробирках (Eppendorf, Германия), далее 50 мкл надосадочной жидкости переносили в 96-луночные планшеты (Sarstedt, Австрия). Объем пробы доводили до 100 мкл с помощью PBS (БиолоТ, Россия). Для анализа концентрации L-аргинина в пробы добавляли 50 мкл 5 мМ 8-оксихинолина и 100 мкл 8 мМ гипобромита натрия в 2 М NaOH. В качестве контрольной пробы использовали PBS, а для получения градуировочного графика – серию проб с двухкратным разбавлением 500 мкМ гидрохлорида аргинина до 4 мкМ в PBS. Оптическую плотность регистрировали с помощью планшетного спектрофотометра ClarioStar (BMG Labtech, Германия) при 495 нм. С помощью программного обеспечения Mars прибора ClarioStar (BMG Labtech, Германия) строили градуировочный график и рассчитывали концентрацию аргинина в пробах культуральной среды, учитывая ее объемную долю в анализируемых пробах.
Анализ влияния СРС на морфологию HUVEC. Для изучения влияния СРС на морфологию HUVEC клеточную суспензию вносили в 96-луночные планшеты (Sarstedt, Австрия) по 25 тысяч клеток в 100 мкл полной культуральной среды. Клетки инкубировали в присутствии CPС 24, 48 или 72 ч при температуре 37°С во влажной атмосфере с 5% СО2. Клетки фиксировали в 0.2%-ном растворе кристаллического фиолетового (SigmaAldrich, Германия) на 10%-ном метаноле (Вектон, Россия). По окончании инкубации избыток красителя удаляли трехкратной отмывкой дистиллированной водой. Препараты анализировали с помощью микроскопа AxioObserver. D1 (Zeiss, Германия) и программы AxioVisionRel. 4.7 (Zeiss, Германия).
Анализ структуры актинового цитоскелета. Для анализа структуры актинового цитоскелета суспензию эндотелиальных клеток в концентрации 50 тыс. в 300 мкл полной культуральной среды вносили в 24-луночные плоскодонные планшеты (Sarstedt, Австрия), на дно которых были предварительно помещены стерильные обезжиренные покровные стекла. Одновременно в лунки планшета вносили исследуемые вещества. Клетки инкубировали 24, 48 или 72 ч при температуре 37°С, во влажной атмосфере с 5% СО2. По окончании инкубации среду удаляли. Покровные стекла фиксировали в 4%-ном параформальдегиде при 25°С. Фиксатор удаляли, стекла промывали PBS. Пермеабилизацию клеток производили 0.01%-ным раствором Тритона Х-100 (Sigma, США) при 25°С. После этого детергент удаляли и стекла промывали PBS (БиолоТ, Россия). Далее вносили раствор AlexaFluor488-фаллоидина в 3.3%-ном метаноле (Invitrogen, США), инкубировали при температуре 37°С, промывали PBS, высушивали и наносили среду для заключения, содержащую краситель для ядер DAPI (Invitrogen, США). Препараты анализировали с помощью микроскопа AxioObserver. D1 (Zeiss, Германия) и программы AxioVisionRel. 4.7 (Zeiss, Германия).
Для количественной оценки содержания F-актина в клетке проводили измерение относительной интенсивности флуоресценции (ИФ) актинового цитоскелета с использованием программы ImageJ (NIH, США). В микрофотографии выделяли слой, содержащий изображение F-актина, переводили его в 8-битный формат, содержащий только оттенки серого, и получали ИФ среднего значения серого (Mean gray value).
Статистическая обработка данных. Полученные данные проверяли на нормальность распределения с помощью теста Шапиро–Уилка. Оценку достоверности различий между контрольными и опытными выборками проводили методом однофакторного дисперсионного анализа (ANOVA), попарное сравнение средних значений производили при помощи апостериорного теста Тьюки. Нулевая гипотеза отвергалась при р < 0.05. Анализ проводился с помощью программ STATISTICA 6.0, Microsoft Office Excel 2010, GraphPad Prism 8 и AxioVision Rel. 4.7.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Сравнение влияния СРС М49-16 и М49-16delArcA на концентрацию аргинина в среде культивируемых клеток
Предварительно проводили оценку способности АДИ вызывать истощение аргинина в образцах среды культур эндотелиальных клеток. Было установлено, что концентрация L-аргинина в культуральной среде до начала эксперимента составляла 113 ± 6 мкM (базовый уровень) (рис. 1), что согласуется с данными исследований по изучению концентрации этой аминокислоты в плазме крови человека [25, 26]. При инкубации клеток в стандартных условиях на протяжении всего эксперимента значения концентрации L-аргинина в культуральной среде на разных сроках культивирования достоверно не отличались. Концентрация L-аргинина в культуральной среде HUVEC в присутствии СРС мутантного штамма также достоверно не изменялась. В присутствии СРС исходного штамма, через 24 ч инкубации, концентрация L-аргинина в культуральной среде достоверно снижалась до 63 ± 9 мкM (p < 0.001) и сохранялась на этом уровне при 72-часовой культивации.
Рис. 1.
Сравнение влияния супернатантов разрушенных S. pyogenes на концентрацию аргинина в культуральной среде HUVEC. Данные представлены как M ± SEM, n = 4 в каждой группе. Отличия от контроля достоверны при *** – p < 0.001, ** – p < 0.005; отличия от СРС S. pyogenes М49-16 достоверны при ### – р < 0.001. Горизонтальная линия – базовый уровень аргинина в культуральной среде.

Сравнение влияния СРС М49-16 и М49-16delArcA на конфлюэнтность монослоя эндотелиальных клеток
Было установлено, что при инкубации в стандартных условиях на сроках 24, 48 и 72 ч эндотелиальные клетки образовывали монослой с хорошо сформированными межклеточными контактами (рис. 2). В присутствии СРС мутантного штамма заметных отличий морфологии монослоя эндотелиальных клеток по сравнению с этим показателем в контроле выявлено не было.
Рис. 2.
Репрезентативные микроскопические фотографии, отражающие морфологические изменения HUVEC в стандартных условиях культивирования и в присутствии СРС S. pyogenes через 24, 48 и 72 ч инкубации; окраска кристаллическим фиолетовым. Увеличение в 100 раз. Стрелки указывают на участки, в которых нарушены межклеточные контакты.
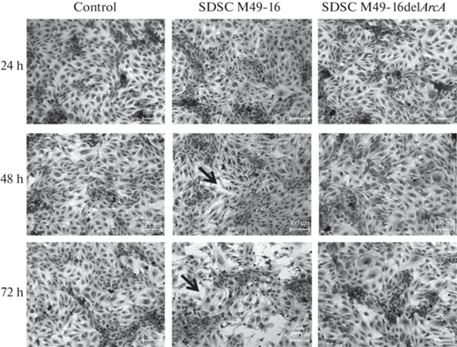
При культивировании клеток в присутствии СРС исходного штамма через 48 ч непрерывность монослоя эндотелиальных клеток нарушалась. Через 72 ч инкубации в этих условиях бóльшая часть клеток формировала тонкие длинные отростки, при этом появлялись отдельные участки, в которых межклеточные контакты были разрушены.
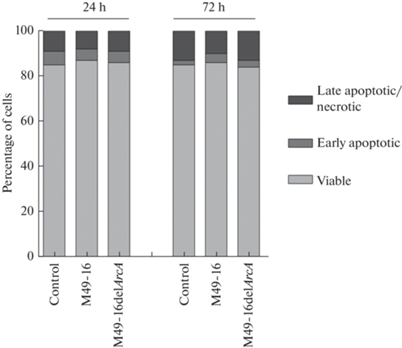
Анализ влияния СРС М49-16 и М49-16delArcA на жизнеспособность HUVEC
Чтобы убедиться, что нарушение конфлюэнтности монослоя эндотелиальных клеток в присутствии СРС исходного штамма не было связано с гибелью клеток, в дальнейших экспериментах изучали влияние СРС на жизнеспособность клеток. Было установлено, что на всех сроках культивирования СРС исходного и мутантного штаммов не влияли на жизнеспособность HUVEC (рис. 3).
Сравнение влияния СРС М49-16 и М49-16delArcA на структуру актинового цитоскелета HUVEC
В стандартных условиях культивирования клетки имели преимущественно полигональную форму. Пучки актиновых филаментов располагались вдоль длинной оси клеток (тонкая стрелка, рис. 4а), а также концентрировались по периферии клетки так, что межклеточные контакты были ярко выражены (наконечник стрелки, рис. 4а). Культивирование клеток в присутствии СРС мутантного штамма не оказывало значительного влияния на структуру актинового скелета. В присутствии СРС исходного штамма уже через 24 ч инкубации происходило разрушение межклеточных контактов, и в этих участках наблюдалось больше имеющих характерные для движущихся клеток волнистых структур – ламеллей, с повышенной концентрацией актина на ведущем крае (толстая стрелка, рис. 4а). Через 48 ч в клетках возрастало количество стресс-фибрилл (стрелка с круглым хвостом, рис. 4b), дезинтеграция монослоя эндотелиальных клеток усиливалась и становилась еще более очевидной к третьим суткам (72 ч). На этом сроке количество F-актина в клетках заметно снижалось, клетки приобретали вытянутую веретенообразную форму с выраженными ламеллиподиями.
Рис. 4.
Репрезентативные микроскопические фотографии и гистограммы, отражающие влияние супернатантов разрушенных S. pyogenes на интенсивность флуоресценции актинового цитоскелета в монослое HUVEC. (a и d) – 24 ч инкубации; (b и e) – 48 ч инкубации; (c и f) – 72 ч инкубации. Увеличение в 200 раз. Актиновый цитоскелет окрашивали фаллоидином, меченным AlexaFluor488 (зеленая флуоресценция), ядра − DAPI (синяя флуоресценция). Стрелками отмечены структуры цитоскелета: тонкая стрелка – F-актин; толстая стрелка – ламеллa; наконечник стрелки – межклеточные контакты; стрелка с круглым хвостом – стресс-фибриллы. Относительную интенсивность флуоресценции F-актина измеряли с использованием программы ImageJ. Данные представлены как M ± SEM, n = 3–5 в каждой группе. Отличия от контроля достоверны при *** – p < 0.001; oтличия от СРС S. pyogenes М49-16 достоверны при ## –р < 0.01; ### – р < 0.001.
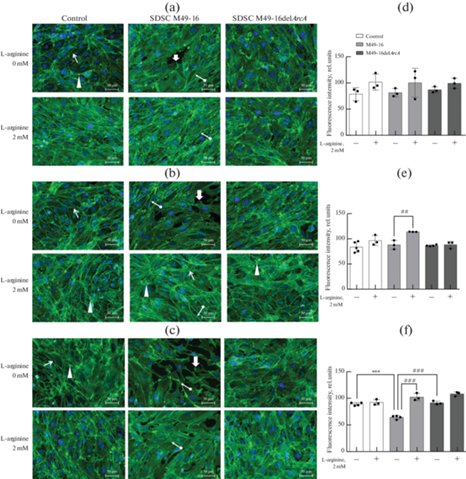
Внесение добавки аргинина (рис. 4a) к клеткам, инкубируемым в стандартных условиях и в присутствии СРС мутантного штамма, не оказывало значимого влияния на структуру актинового цитоскелета. Через 48 ч культивирования в этих условиях межклеточные контакты становились более выраженными за счет усиления кортикального актина (наконечник стрелки, рис. 4b). Введение добавки аргинина к клеткам, которые культивировали в присутствии СРС М49-16, приводило к значительному повышению количества F-актина (тонкая стрелка, рис. 4b), а также концентрации актина, расположенного по периферии клетки в зонах межклеточных контактов, если сравнивать с клетками в тех же условиях без аргинина (наконечник стрелки, рис. 4b). При этом на сроках 24 и 48 ч наблюдалось заметно повышенное по сравнению с контролем и СРС мутантного штамма количество стресс-фибрилл в клетках (стрелка с круглым концом, рис. 4a, 4b). Конфлюэнтность монослоя сохранялась на сроках 24 и 48 ч, нарушалась только через 72 ч инкубации и не так значительно, как без добавки аргинина. Кроме того, при введении добавки аргинина в присутствии СРС исходного штамма сохранялась характерная для эндотелия полигональная форма клеток.
Культивирование клеток в присутствии СРС мутантного штамма не оказывало достоверного влияния на ИФ F-актина клеток на всех сроках эксперимента. Через 24 и 48 ч культивирования в присутствии СРС исходного штамма ИФ F-актина не отличалась от соответствующих значений в контроле (рис. 4d и 4e). Через 72 ч инкубации клеток в присутствии СРС исходного штамма ИФ F-актина была достоверно ниже по сравнению с контролем (при р < 0.001) (рис. 4f). Внесение добавки аргинина к клеткам, инкубируемым в этих условиях, приводило к достоверному повышению относительной ИФ F-актина до значений в контроле (при р < 0.001). Самостоятельного действия добавки аргинина на ИФ F-актина выявлено не было.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В данной работе изучали влияние стрептококковой АДИ на морфологию и цитоскелет эндотелиальных клеток в монослое путем сравнения эффектов СРС исходного штамма S. pyogenes М49-16 и его изогенного мутанта М49-16delArcA с инактивированным геном АДИ ArcA. В ходе экспериментов было установлено, что в присутствии СРС исходного штамма в культуре эндотелиальных клеток происходили изменения конфлюэнтности монослоя, структуры актинового цитоскелета и содержания F-актина, которых не было выявлено при культивировании клеток в стандартных условиях и в присутствии СРС мутантного штамма. Так, через 48 ч культивирования в присутствии СРС исходного штамма в клетках формировались многочисленные ламелли – структуры, которые свидетельствуют об усилении миграции клеток. В наших предыдущих исследованиях в модели “раны” in vitro было доказано, что под действием АДИ происходит снижение миграционной активности эндотелиальных клеток. Однако в этих экспериментах срок наблюдения миграции клеток был ограничен 24 ч [19, 27]. Нельзя исключать, что АДИ по-разному влияет на миграционную активность клеток на разных сроках: через 24 ч – снижает, а через 48–72 ч – усиливает.
В настоящем исследовании было также установлено, что через 48 ч инкубации в присутствии СРС исходного штамма в клетках формировались выраженные стресс-фибриллы (рис. 4b). Такие изменения структуры цитоскелета могут быть связаны с нарушением активности кофилина – белка, регулирующего динамику сборки и разборки актиновых филаментов [28, 29]. Равновесие полимеризации/деполимеризации актина в клетках осуществляется посредством изменения фосфорилирования кофилина. Блокировка этого процесса делает цитоскелет жестким, и клетка теряет способность к локомоции [28]. Ранее на культурах лимфоцитов периферической крови человека было установлено, что в условиях дефицита аргинина дефосфорилирование кофилина блокируется. Регуляция этого процесса в Т-клетках человека находится под контролем Rat sarcoma-mitogen-activated protein kinase (МЕК) [30] и phosphoinositide 3-kinase (PI3K), связанными с внутриклеточными сигнальными каскадами [8]. Было показано, что в дефицитной по аргинину среде наблюдается снижение уровня фосфо-Erk1/2, но повышается уровень фосфо-PKB/Akt фосфокиназ [8]. Исследование влияния аргинина на регуляцию активности кофилина в эндотелиальных клетках до сих пор не проводилось.
Другим вероятным механизмом нарушения структуры цитоскелета в условиях дефицита аргинина может быть остановка посттрансляционного аргинилирования белков. Это перенос аргинина с тРНК на N-концевые аминокислоты белков (аспарагиновая кислота, глутамин и цистеин), который осуществляет фермент аргинил-тРНК-трансфераза (ATE1) [31]. На клеточном уровне аргинилирование регулирует уровень полимерного актина и структуру внутриклеточной актиновой сети [9, 10, 32]. Показано, что делеция гена аргинил-тРНК-трансферазы у эмбрионов мышей приводит к дефектам образования новых сосудов, влияет на их направленность и общую организацию. При этом наблюдаются нарушения процесса ангиогенеза [31, 33] и развития сердечно-сосудистой системы [34]. Недостаток аргинилированных белков нарушает образование актиновой сети на клеточном уровне и снижает уровень полимеров актина, укорачивает актиновые волокона и способствует формированию внутриклеточных агрегатов [35]. Такие изменения, выражающиеся в обеднении структур актинового цитоскелета в эндотелиальных клетках, были зарегистрированы после 72 ч культивирования в присутствии СРС исходного штамма в данном исследовании. Кроме того, аналогичные результаты были получены ранее при изучении влияния АДИ на структуру актинового цитоскелета отдельных эндотелиальных клеток, не находящихся в состоянии монослоя [19, 22].
Продукция NO играет важную роль в биологии эндотелия. В низких концентрациях NO поддерживает гомеостаз сосудов, оказывает вазодиляторное, противовоспалительное и антикогуляторное действие [36, 37]. Высокие концентрации этого метаболита обладают сильными цитотоксическими эффектами. Высказываются мнения, что NO в разных концентрациях также может разнонаправленно влиять на проницаемость сосудов [11]. В литературе встречаются немногочисленные данные, которые указывают на возможную связь между активностью эндотелиальной синтазы оксида азота (endothelial nitric oxide synthase, eNOS), продукцией NO и актиновым цитоскелетом в эндотелиальных клетках. Так, в исследовании, проведенном на эндотелиальных клетках аорты быка (bovine aortic endothelial cells) было показано, что от эндогенной продукции NO зависит распределение F-актина и проницаемость эндотелия [12]. В другом исследовании было установлено, что взаимодействие с β-актином поддерживало ферментативную активность eNOS. Диссоциация eNOS и β-актина в эндотелиальных клетках приводила к снижению продукции NO и усилению генерации супероксида [38]. Подавление продукции NO с использованием неселективных ингибиторов NOS изменяло структуру актинового цитоскелета и повышало проницаемость мезентериальных вен у крыс [11].
Теоретически, бактериальный фермент может как подавлять, так и усиливать продукцию NO, поскольку АДИ катализирует реакцию гидролиза аргинина, в ходе которой образуется цитруллин – предшественник аргинина [39]. В исследованиях влияния бактериальной АДИ на продукцию NO эндотелиальными клетками были получены неоднозначные результаты. На культуре HMEC (human microvascular endothelial cells) было показано, что рекомбинантная АДИ усиливала фосфорилирование eNOS по остаткам серина и тирозина [20]. Изучение влияния АДИ на эндотелиальные клетки линии TR-BBB (transgenic rat blood-brain barrier) показало, что фермент не влияет на индуцированную кальциевым ионофором выработку NO [40]. В исследовании на HUVEC [41] было установлено усиление продукции NO под действием стрептококковой АДИ. Несмотря на крайне малочисленные работы по изучению влияния АДИ на активность NOS и значения NO в регуляции актинового цитоскелета, нельзя исключать, что обнаруженное в наших экспериментах нарушение структуры актиновых филаментов могло быть обусловлено вмешательством бактериального фермента в работу eNOS.
Хорошо известно, что S. pyogenes экспрессирует целый ряд факторов патогенности (SpeB, SpyCEP и др.), способных повреждать эндотелий сосудов и капилляров, что при острой инфекции приводит к воспалению и возможным тромбозам [42, 43]. В данной работе на культуре эндотелиальных клеток HUVEC впервые показано, что АДИ, вызывая динамические изменения актинового цитоскелета и нарушая непрерывность монослоя эндотелиальных клеток, может способствовать усилению проницаемости сосудов и развитию эндотелиальной дисфункции. Проведенные эксперименты подтверждают важную роль биодоступности аргинина для поддержания гомеостаза сосудов. Дальнейшие исследования бактериальной АДИ необходимы для более глубокого понимания патогенетических механизмов развития стрептококковой инфекции и могут способствовать разработке новых методов лечения сепсиса и других тяжелых инфекционных заболеваний.
Список литературы
Shao Y, Saredy J, Yang WY, Sun Y, Lu Y, Saaoud F, Drummer C, Johnson C, Xu K, Jiang X, Wang H, Yang X (2020) Vascular Endothelial Cells and Innate Immunity. Arteriosclerosis, Thrombosis, and Vascular Biol 40: e138–e152. https://doi.org/10.1161/ATVBAHA.120.314330
Lee WL, Slutsky AS (2010) Sepsis and endothelial permeability. N Engl J Med 363: 689–691. https://doi.org/10.1056/NEJMcibr1007320
Toh C-H, Toh JMH, Abrams ST (2019) Disseminated intravascular coagulation – what can we do? Hemasphere 3: 92–94. https://doi.org/10.1097/HS9.0000000000000232
Bannerman DD, Goldblum SE (1999) Direct effects of endotoxin on the endothelium: barrier function and injury. Lab Invest 79: 1181–1199.
Saxton RA, Sabatini DM (2017) mTOR Signaling in Growth, Metabolism, and Disease. Cell 168: 960–976. https://doi.org/10.1016/j.cell.2017.02.004
Morris SM Jr (2016) Arginine Metabolism Revisited. J Nutrition 146: 2579S–2586S. https://doi.org/10.3945/jn.115.226621
Pavlyk I, Rzhepetskyy Y, Jagielski AK, Drozak J, Wasik A, Pereverzieva G, Olchowik M, Kunz-Schugart LA, Stasyk O, Redowicz MJ (2015) Arginine deprivation affects glioblastoma cell adhesion, invasiveness and actin cytoskeleton organization by impairment of β-actin arginylation. Amino Acids 47: 199–212. https://doi.org/10.1007/s00726-014-1857-1
Feldmeyer N, Wabnitz G, Leicht S, Luckner-Minden C, Schiller M, Franz T, Conradi R, Kropf P, Müller I, Ho AD, Samstag Y, Munder M (2012) Arginine deficiency leads to impaired cofilin dephosphorylation in activated human T lymphocytes. Int Immunol 24: 303–313. https://doi.org/10.1093/intimm/dxs004
Karakozova M, Kozak M, Wong CCL, Bailey AO, Yates JR, Mogilner A, Zebroski H, Kashina A (2006) Arginylation of beta-actin regulates actin cytoskeleton and cell motility. Science 313: 192–196. https://doi.org/10.1126/science.1129344
Saha S, Mundia MM, Zhang F, Demers RW, Korobova F, Svitkina T, Perieteanu AA, Dawson JF, Kashina A (2010) Arginylation Regulates Intracellular Actin Polymer Level by Modulating Actin Properties and Binding of Capping and Severing Proteins. Mol Biol Cell 21: 1350–1361. https://doi.org/10.1091/mbc.E09-09-0829
Baldwin AL, Thurston G, Al Naemi H (1998) Inhibition of nitric oxide synthesis increases venular permeability and alters endothelial actin cytoskeleton. Am J Physiol Heart Circul Physiol 274: H1776–H1784. https://doi.org/10.1152/ajpheart.1998.274.5.H1776
Liu SM, Sundqvist T (1997) Nitric Oxide and cGMP Regulate Endothelial Permeability and F-Actin Distribution in Hydrogen Peroxide-Treated Endothelial Cells. Exp Cell Res 235: 238–244. https://doi.org/10.1006/excr.1997.3675
Lubkin A, Torres VJ (2017) Bacteria and endothelial cells: a toxic relationship. Curr Opin Microbiol 35: 58–63. https://doi.org/10.1016/j.mib.2016.11.008
Bogatcheva NV, Verin AD (2008) The role of cytoskeleton in the regulation of vascular endothelial barrier function. Microvasc Res 76: 202–207. https://doi.org/10.1016/j.mvr.2008.06.003
Colonne PM, Winchell CG, Voth DE (2016) Hijacking Host Cell Highways: Manipulation of the Host Actin Cytoskeleton by Obligate Intracellular Bacterial Pathogens. Front Cell Infect Microbiol 22 (6): 107. https://doi.org/10.3389/fcimb.2016.00107
Marquis RE, Bender GR, Murray DR, Wong A (1987) Arginine deiminase system and bacterial adaptation to acid environments. Appl Environment Microbiol 53: 198–200. https://doi.org/10.1128/aem.53.1.198-200.1987
Park I-S, Kang S-W, Shin Y-J, Chae K-Y, Park M-O, Kim M-Y, Wheatley DN, Min B-H (2003) Arginine deiminase: a potential inhibitor of angiogenesis and tumour growth. Br J Cancer 89: 907–914. https://doi.org/10.1038/sj.bjc.6601181
Старикова ЭА, Карасева АБ, Бурова ЛА, Суворов АН, Соколов АВ. Васильев ВБ, Фрейдлин ИС (2016) Роль аргининдеиминазы Streptococcus pyogenes M49-16 в ингибиции пролиферации эндотелиальных клеток человека линии Ea.hy926. Мед иммунол 18(6): 555–562. [Starikova EA, Karaseva AB, Burova LA, Suvorov AN, Sokolov AV, Vasiliev VB, Freidlin IS (2016) The role of arginine deiminase Streptococcus pyogenes M49-16 in inhibition of proliferation of human Ea.hy926 line endothelial cells. Med Immunol 18(6): 555–562. (In Russ)].
Маммедова ДТ, Старикова ЭА, Бурова ЛА, Малашичева АБ, Семёнова ДС, Фрейдлин ИС (2017) Влияние аргининдеиминазы S. pyogenes на пролиферативную и миграционную активность эндотелиальных клеток вены пупочного канатика человека. Цитокины и воспаление 16(3): 48–51. [Mammedova JT, Starikova EA, Burova LA, Malashicheva AB, Semenova DS, Freidlin IS (2017) The effect of S. pyogenes arginine deiminase on the proliferative and migration activity of human umbilical vein endothelial cells. Tsitokiny i vospaleniye [Cytokines and Inflammation] 16(3): 48–51. (In Russ)].
Zhuo W, Song X, Zhou H, Luo Y (2011) Arginine deiminase modulates endothelial tip cells via excessive synthesis of reactive oxygen species. Biochem Soc Trans 39: 1376–1381. https://doi.org/10.1042/BST0391376
Beloussow K, Wang L, Wu J, Ann D, Shen W-C (2002) Recombinant arginine deiminase as a potential anti-angiogenic agent. Cancer Lett 183: 155–162. https://doi.org/10.1016/S0304-3835(01)00793-5
Маммедова ДТ, Старикова ЭА, Бурова ЛА, Малашичева АБ, Семёнова ДС, Фрейдлин ИС (2018) Бактериальная аргининдеиминаза нарушает структуру актинового цитоскелета эндотелиальных клеток. Цитокины и воспаление 18(1-4): 75–79. [Mammedova JT, Starikova EA, Burova LA, Malashicheva AB, Semenova DS, Freidlin IS (2018) Bacterial arginine deiminase disrupts the endothelial cells actin cytoskeleton. Tsitokiny i vospaleniye [Cytokines and Inflammat] 18(1-4): 75–79. (In Russ)].
Starikova EA, Sokolov AV, Vlasenko AY, Burova LA, Freidlin IS, Vasilyev VB (2016) Biochemical and biological activity of arginine deiminase from Streptococcus pyogenes M22. Biochem Cell Biol 94:129–137. https://doi.org/10.1139/bcb-2015-006924
Baudin B, Bruneel A, Bosselut N, Vaubourdolle M (2007) A protocol for isolation and culture of human umbilical vein endothelial cells. Nat Protoc 2: 481–485. https://doi.org/10.1038/nprot.2007.54
Gilinskiĭ OR, Gilinsky M, Krivoschekov S, Latysheva T, Naumenko S, Gilinskaya O, Aizman R, Golovin M, Balioz N, Karmakulova I (2018) L-Arginine and Its Methylated Derivatives in the Blood of Athletes. Human Physiol 44: 679–685. https://doi.org/10.1134/S0362119718060063
Kelly E, Morris JR SM, Billiar TR (1995) Review: Nitric Oxide, Sepsis, and Arginine Metabolism. J Parenter Enter Nutrition 19: 234–238. https://doi.org/10.1177/0148607195019003234
Старикова ЭА, Маммедова ДТ, Бурова ЛА, Соколов АВ, Васильев ВБ, Фрейдлин ИС (2017) Влияние аргининдеиминазы Streptococcus pyogenes на миграционную активность и структуру цитоскелета эндотелиальных клеток человека. Мед иммунол 19(5): 521–528. [Starikova EA, Mammedova JT, Burova LA, Sokolov AV, Vasiliev VB, Freidlin IS (2017) The effect of Streptococcus pyogenes arginine deiminase on the migration activity and structure of the cytoskeleton of human endothelial cells. Med Immunol 19(5): 521–528. (In Russ)].
Wang W, Eddy R, Condeelis J (2007) The cofilin pathway in breast cancer invasion and metastasis. Nat Rev Cancer 7: 429–440. https://doi.org/10.1038/nrc2148
Belvitch P, Htwe YM, Brown ME, Dudek S (2018) Cortical Actin Dynamics in Endothelial Permeability. Curr Top Membr 82: 141–195. https://doi.org/10.1016/bs.ctm.2018.09.003
Samstag Y, John I, Wabnitz GH (2013) Cofilin: a redox sensitive mediator of actin dynamics during T-cell activation and migration. Immunol Rev 256: 30–47. https://doi.org/10.1111/imr.12115
Wong CCL, Xu T, Rai R, Bailey AO, Yates JR, Wolf YI, Zebroski H, Kashina A (2007) Global Analysis of Posttranslational Protein Arginylation. PLoS Biol 5: e258. https://doi.org/10.1371/journal.pbio.0050258
Kurosaka S, Leu NA, Zhang F, Bunte R, Saha S, Wang J, Guo C, He W, Kashina A (2010) Arginylation-Dependent Neural Crest Cell Migration Is Essential for Mouse Development. PLoS Genet 6: e1000878. https://doi.org/10.1371/journal.pgen.1000878
Kwon YT, Kashina AS, Davydov IV, Hu R-G, An JY, Seo JW, Du F, Varshavsky A (2002) An essential role of N-terminal arginylation in cardiovascular development. Science 297: 96–99. https://doi.org/10.1126/science.1069531
Leu NA, Kurosaka S, Kashina A (2009) Conditional Tek Promoter-Driven Deletion of Arginyltransferase in the Germ Line Causes Defects in Gametogenesis and Early Embryonic Lethality in Mice. PLoS One 4: e7734. https://doi.org/10.1371/journal.pone.0007734
Kashina A (2014) Protein arginylation, a global biological regulator that targets actin cytoskeleton and the muscle. Anat Rec (Hoboken) 297: 1630–1636. https://doi.org/10.1002/ar.22969
Cirino G, Fiorucci S, Sessa WC (2003) Endothelial nitric oxide synthase: the Cinderella of inflammation? Trends Pharmacol Sci 24: 91–95. https://doi.org/10.1016/S0165-6147(02)00049-4
Mammedova JT, Sokolov AV, Freidlin IS, Starikova EA (2021) The Mechanisms of L-Arginine Metabolism Disorder in Endothelial Cells. Biochemistry (Moscow) 86: 146–155. https://doi.org/10.1134/S0006297921020036
Kondrikov D, Fonseca FV, Elms S, Fulton D, Black SM, Block ER, Su Y (2010) β-Actin Association with Endothelial Nitric-oxide Synthase Modulates Nitric Oxide and Superoxide Generation from the Enzyme. J Biol Chem 285: 4319–4327. https://doi.org/10.1074/jbc.M109.063172
Su Y (2014) Regulation of Endothelial Nitric oxide Synthase Activity by Protein-Protein Interaction. Curr Pharm Des 20: 3514–3520. https://doi.org/10.2174/13816128113196660752
Shen L-J, Lin W-C, Beloussow K, Hosoya K-I, Terasaki T, Ann DK, Shen W-C (2003) Recombinant arginine deiminase as a differential modulator of inducible (iNOS) and endothelial (eNOS) nitric oxide synthetase activity in cultured endothelial cells. Biochem Pharmacol 66: 1945–1952. https://doi.org/10.1016/S0006-2952(03)00555-0
Mammedova JT, Sokolov AV, Burova LA, Karaseva AB, Grudinina NA, Malashicheva AB, Semenova DS, Kiseleva EP, Starikova EA (2023) Streptococcal arginine deiminase regulates endothelial inflammation, mTOR pathway and autophagy. Immunobiology (In press).
Burns EH, Lukomski S, Rurangirwa J, Podbielski A, Musser JM (1998) Genetic inactivation of the extracellular cysteine protease enhances in vitro internalization of group A streptococci by human epithelial and endothelial cells. Microb Pathog 24: 333–339. https://doi.org/10.1006/mpat.1998.0204
Barnett TC, Cole JN, Rivera-Hernandez T, Henningham A, Paton JC, Nizet V, Walker MJ (2015) Streptococcal toxins: role in pathogenesis and disease. Cell Microbiol 17: 1721–1741. https://doi.org/10.1111/cmi.12531
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова