Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 3, стр. 366-374
Влияние глюкозы на транспорт воды в клетках перитонеального мезотелия крыс
Г. С. Батурина 1, 2, *, Л. Е. Каткова 1, Е. И. Соленов 1, 2, 3
1 Институт цитологии и генетики Сибирского отделения Российской академии наук
Новосибирск, Россия
2 Новосибирский национальный исследовательский государственный университет
Новосибирск, Россия
3 Новосибирский государственный технический университет
Новосибирск, Россия
* E-mail: baturina@bionet.nsc.ru
Поступила в редакцию 22.12.2022
После доработки 27.01.2023
Принята к публикации 30.01.2023
- EDN: FSTGFP
- DOI: 10.31857/S0869813923030081
Аннотация
Глюкоза широко применяется в качестве осмотического агента при изготовлении растворов для перитонеального диализа. Целью данной работы было изучение влияния глюкозы на экспрессию водного канала аквапорина-1 (AQP1) и транскрипционного фактора TonEBP, а также на водную проницаемость плазматической мембраны клеток первичной культуры мезотелия брыжейки крыс линии Вистар. В работе использовали метод флуоресцентной микроскопии с внутриклеточным красителем кальцеином. Содержание мРНК оценивали методом ОТ-ПЦР в реальном времени. Предварительная инкубация клеток в среде DMEM, содержащей глюкозу (2.3%, 24 ч, 37°C, 5% CO2), приводила к снижению экспрессии генов aqp1 в среднем на 60% (контроль 0.87 ± 0.18; глюкоза 0.34 ± 0.12, n = 9, р < 0.05) и tonebp на 20% (контроль 0.37 ± 0.024; глюкоза 0.30 ± 0.01, n = 9, р < 0.05). Обнаружено также снижение проницаемости плазматической мембраны клеток перитонеального мезотелия для воды после суточной предварительной инкубации с глюкозой в среднем на 40% (контроль 7.3Е–3 ± 1.3Е–3 (см/с) (n = 27), глюкоза 4.3Е–3 ± 3.8Е–4 (см/с) (n = 57), p < 0.01). Результаты исследования свидетельствуют о том, что глюкоза может оказывать ингибирующий эффект на транспортные процессы в клетках мезотелия брюшины, что при многократных воздействиях может приводить к структурным и функциональным нарушениям перитонеальной мембраны.
Перитонеальный диализ (ПД) является общепринятой формой заместительной терапии в терминальной стадии почечной недостаточности, при котором происходит обмен растворенными веществами и водой между капиллярной кровью и диализной жидкостью в брюшинной полости через перитонеальную мембрану, состоящую из сосудистого эндотелия, интерстиция и мезотелиального монослоя. Длительное применение перитонеального диализа (по данным ВОЗ, 2‒10 лет) вызывает различные морфофункциональные изменения брюшины, такие как фиброз, ангиогенез, снижение скорости переноса растворенных веществ – недостаточность ультрафильтрации [1, 2]. Одной из основных причин возникающих нарушений, приводящих к отравлениям “уремическими токсинами” и перитониту, считают воздействие диализной жидкости, имеющей низкий pH, повышенную осмолярность за счет содержания высоких концентраций глюкозы и продуктов ее термического распада [3–5]. Для достижения адекватного удаления воды и растворенных веществ из циркулирующей крови, жидкости для ПД содержат глюкозу в высоких концентрациях, создающую гипертоническую среду в диапазоне от 344 до 511 мОсм/кг H2O [6]. Гипертоничность диализных растворов, созданная глюкозой, рассматривается как ключевой фактор, способствующий структурным и функциональным изменениям перитонеальной мембраны [7–9]. Глюкоза требуется большинству клеток для метаболических функций, таких как дыхание, синтез белка или хранение энергии в виде гликогена. Кроме того, в клетке глюкоза играет роль сигнальной молекулы и может оказывать влияние на транскрипцию генов, активность ферментов, секрецию гормонов и другие клеточные функции [10]. Существует множество изоформ переносчиков глюкозы с различными кинетическими свойствами и различной регуляцией экспрессии, что обеспечивает тонкую настройку входа глюкозы в клетку и генерацию сигналов с целью сохранения метаболической целостности клеток и всего организма.
Гипертоническая среда вызывает быстрое снижение объема клетки, в результате чего активируются адаптационные механизмы регуляторного повышения клеточного объема, включающие в себя усиление поступления в клетку воды, органических и неорганических осмолитов и активацию транскрипционного фактора TonEBP. Транскрипционный фактор TonEBP (другое название NFAT5) регулирует экспрессию генов, обеспечивающих выживание клеток при гипертоническом стрессе. Гипертоническое воздействие индуцирует фосфорилирование TonEBP, которое коррелирует с повышенной ядерной локализацией этого фактора [11]. Известно, что осмотическая водная проницаемость клеток перитонеального мезотелия в значительной мере определяется водным каналом аквапорином-1 (AQP1) [12].
Исследование фундаментальных механизмов регуляции транспорта воды в мезотелиальных клетках брюшины является важным для понимания осмопротекторных механизмов и служит теоретической основой для создания более биосовместимых жидкостей для перитонеального диализа. С этой целью в настоящей работе изучался транспорт воды через плазматическую мембрану клеток мезотелиальной выстилки брюшины крыс при воздействии гипертонической среды, содержащей в качестве осмотического агента глюкозу. Кроме того, был проведен анализ содержания мРНК аквапорина 1 (AQP1) и транскрипционного фактора TonEBP при суточном воздействии на клетки перитонеального мезотелия среды, содержащей глюкозу в качестве осмотического агента.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные
В работе использованы ткани взрослых крыс (150–200 г) линии Вистар обоих полов, выращенных на базе Центра генетических ресурсов лабораторных животных Института цитологии и генетики СО РАН.
Выделение мезотелиальных клеток брюшины
Процедуру выделения мезотелиальных клеток брюшины проводили по протоколу, описанному нами ранее [13]. Фрагменты париетальной брюшины (200–300 мг) брали в стерильных условиях и инкубировали с минимальным объемом 0.25%-ного раствора трипсина (раствор трипсина-ЭДТА, Sigma, США) в течение 5 мин при 37°C. Затем ткань переносили в 10–15 мл низкокальциевого фосфатно-солевого буфера (мМ: 137 NaCl; 4.7 Na2HPO4; 2.7 KCl; 1.5 KH2PO4; 0.5 MgCl2; 0.05 CaCl2; 5 глюкоза; 291 мОсм/кг H2O; pH 7.4) и встряхивали в течение 2 мин. Остаточную ткань удаляли из раствора, а суспензию клеток центрифугировали в течение 5 мин при 1500 об./с. Процедуру повторяли 3 раза. Клеточный осадок ресуспендировали в 15 мл культуральной среды DMEM (Sigma Aldrich, США) с 20% эмбриональной бычьей сывороткой (Sigma Aldrich, США), после чего 2 мл аликвоты клеточной суспензии переносили в чашки Петри диаметром 35 мм и выращивали на покровных стеклах (22 × 22 мм) в среде DMEM в инкубаторе с 5%-ным содержанием CO2 при 37°C. За 24 ч до эксперимента в культуральную среду экспериментальной группы клеток добавляли глюкозу до конечной концентрации 2.3%.
Выделение мРНК и ОТ-ПЦР в реальном времени
Выделение тотальной РНК из клеточных культур проводили с помощью реагента TRIzol (Ambion, США) согласно протоколу производителя. Обратную транскрипцию проводили как описано нами ранее [14]. Полимеразную цепную реакцию проводили на амплификаторе CFX96 real-time PCR (BioRad, США) с использованием “Набора реагентов для проведения ПЦР-РВ в присутствии EVA Green” (Синтол, Россия) в объеме 25 мкл. Температурный профиль для проведения ПЦР в реальном времени: 95°C 5 мин, 39 циклов 60°C 45 с, 80°C 5 с, 95°C 15 с. В качестве гена внутреннего контроля использовали гипоксантин фосфорибозил-трансферазу 1 (HPRT1). Данные анализировались с помощью пакета программ CFXQ13 Manager Software version 1.5 (Bio-Rad). Последовательности праймеров для ПЦР приведены в табл. 1. Праймеры на tonebp были сконструированы в ЦКП “Геномика” ИХБФМ СО РАН. Специфичность амплификации фрагментов кДНК интересующих нас генов при проведении ПЦР анализа в режиме реального времени была подтверждена прямым секвенированием продуктов ПЦР по Сэнгеру в ЦКП “Геномика” ИХБФМ СО РАН.
Измерение водной проницаемости плазматической мембраны клеток
Непосредственно перед измерением клетки были сбалансированы в растворе фосфатно-солевого буфера (мМ: 137 NaCl; 4.7 Na2HPO4; 2.7 KCl; 1.5 KH2PO4; 0.5 MgCl2; 1 CaCl2; 5 глюкоза; 280 мОсм/кг H2O; pH 7.4). Гипертонический раствор фосфатно-солевого буфера осмоляльностью 560 мОсм/кг H2O получали добавлением 280 мМ маннитола. Измерения динамики объема клеток при набухании проводили методом, основанном на эффекте гашения флуоресценции красителя кальцеина белками цитоплазмы, как описано ранее [16]. Кривую входа воды в клетки записывали при изменении осмотического давления среды с 280 до 560 мОсм/кг H2O. Начальные участки профилей величин относительной флуоресценции, отражающие процесс входа воды в клетку, аппроксимировали линейной функцией. Расчет коэффициента линейной регрессии проводили, используя линейную аппроксимацию начального участка кривой методом наименьших квадратов. Методика расчета водной проницаемости опубликована нами ранее [17], ниже приведены основные тезисы для расчета.
Осмотическое движение воды представляет собой поток воды через плазматическую мембрану, вызванный градиентом осмотического давления, что приводит к изменению объема клетки:
где (dV/dt) – скорость изменения объема клеток, А – площадь поверхности клетки, Vw – парциальный молярный объем воды (18 см3/моль), Pf – коэффициент осмотической водной проницаемости, ∆C – разность осмотических концентраций $\left( {{{C}_{{{\text{in}}}}} - {{C}_{{{\text{out}}}}}} \right)$.Осмотическую водную проницаемость мембраны клетки рассчитывали по скорости изменения клеточного объема во время осмотического воздействия по формуле:
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Перитонеальный диализ основан на введении гипертонического раствора в брюшную полость пациента с целью удаления избытка воды вместе с ионами и продуктами метаболизма. В этих условиях мезотелиальные клетки брюшины хронически подвергаются воздействию гипертонических условий. Обычные растворы для ПД имеют низкий рН и содержат токсичные продукты разложения глюкозы, образующиеся при температурной стерилизации. Были разработаны “биосовместимые” двухкамерные растворы для ПД, отделяющие глюкозу от буфера во время стерилизации и хранения. Они имеют рН, близкий к физиологическому, и в значительной степени лишены токсичных продуктов термического разложения глюкозы. Тем не менее, оказалось, что и “биосовместимые” диализные жидкости по-прежнему вызывают серьезную трансформацию перитонеальной мембраны во время хронического ПД, что приводит к перитонеальному фиброзу и гиперваскуляризации [18–21]. Механизмы, вовлеченные в структурные и функциональные изменения клеток мезотелия при ПД, остаются неясными, но длительное воздействие на перитонеальную мембрану гипертонического диализного раствора, содержащего глюкозу в высоких концентрациях, может играть важную роль в изменении метаболизма перитонеальных клеток [7–9]. Известно, что гипергликемия приводит к нарушению функции белков в результате процесса неферментативного гликозилирования и образования конечных продуктов ускоренного гликозилирования, тем самым изменяя их функциональные свойства [22]. Как сигнальная молекула, глюкоза может активировать сигнальные механизмы, регулирующие транскрипцию генов, активность ферментов, секрецию гормонов и нейрональную активность. Большинство клеток млекопитающих импортируют глюкозу посредством процесса облегченной диффузии, опосредуемого членами семейства мембранных транспортных белков Glut (SLC2A). Порядка 14 белков Glut экспрессируются в организме человека, и они включают переносчики субстратов, отличных от глюкозы (фруктоза, миоинозитол, урат и др.) [10]. Известно, что гипертоническое воздействие активирует транскрипцию многих транспортеров органических осмолитов, а также некоторых водных и ионных каналов, что рассматривается как общий механизм защиты клеток от снижения объема [23].
В проведенном нами исследовании методом ПЦР в реальном времени были выявлены изменения экспрессии чувствительного к тоничности среды транскрипционного фактора TonEBP и водного канала AQP1 в первичной культуре клеток перитонеального мезотелия после их инкубации в течение 24 ч в культуральной среде DMEM, содержащей глюкозу (2.3%). Результаты измерения уровня мРНК водного канала AQP1, нормализованные к уровню мРНК гена домашнего хозяйства hprt1 свидетельствуют, что глюкоза вызывает подавление его экспрессии в клетках перитонеального мезотелия в среднем на 60% (контроль 0.87 ± 0.18; глюкоза 0.34 ± 0.12, n = 9, р < 0.05) (рис. 1a).
Рис. 1.
Влияние суточной инкубации с глюкозой (2.3%) на уровень мРНК (a) аквапорина-1 (AQP1) и (b) транскрипционного фактора tonebp в мезотелиальных клетках брюшины крыс. *– p < 0.05, n = 9.

Вопрос об экспрессии AQP1 в мезотелиальных клетках брюшины и его функциональной роли при ПД долгое время оставался дискуссионным. Рядом исследователей AQP1 был обнаружен только в эндотелии перитонеальных капилляров, но не в мезотелиальных клетках [24]. Другими авторами на клеточных линиях была обнаружена конститутивная экспрессия AQP1 в мезотелиальных клетках брюшины человека. Кроме того, было продемонстрировано ее повышение под воздействием осмотических агентов (глюкозы и маннитола) [12]. Эксперименты с использованием иммунофлуоресценции подтвердили экспрессию AQP1 в клетках мезотелия [25]. На мышах, нокаутных по гену aqp1, показано снижение водной проницаемости перитонеальной мембраны [26], что подтверждает важную роль этого водного канала в ПД. Механизмы регуляции экспрессии гена aqp1 в клетках перитонеального мезотелия при гипертонических условиях нуждаются в дальнейшем исследовании.
Инкубация клеток перитонеального мезотелия в течение 24 ч в культуральной среде, содержащей 2.3% глюкозы, также приводила к небольшому, но достоверному снижению экспрессии tonebp по сравнению с контролем (контроль 0.37 ± 0.024; глюкоза 0.3 ± 0.012, n = 9, р < 0.05), (рис. 1b). Влияние гипертонической среды, созданной глюкозой, на содержание мРНК транскипционного фактора TonEBP в клетках перитонеального мезотелия в настоящей работе показано впервые. Механизм влияния фактора TonEBP на регуляцию клеточного объема в данных клетках не изучен и требует дальнейшего исследования.
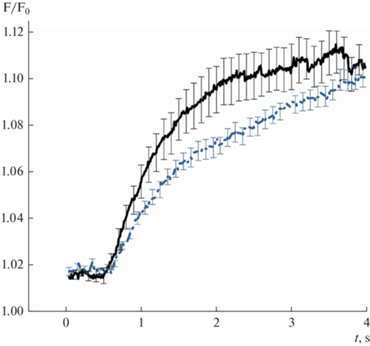
Согласно полученным в настоящей работе данным, предварительная инкубация с глюкозой (2.3%) в течение суток достоверно замедляет поступление воды в мезотелиальные клетки брюшины при гипоосмотическом воздействии. На рис. 2 представлены усредненные кривые флуоресценции, отражающие динамику поступления воды в клетки перитонеального мезотелия при осмотическом воздействии. Водная проницаемость клеток мезотелия брюшины была рассчитана с использованием значений коэффициента линейной регрессии начального участка кривой флуоресценции красителя кальцеина ((F/F0)/c) и составила в контроле 7.3Е–3 ± ± 1.3Е–3 см/с, n = 27, после предварительной инкубации с глюкозой – 4.3Е–3 ± ± 3.8Е–4 см/с, n = 57, p < 0.01.
Рис. 2.
Динамика увеличения клеточного объема, отражающая вход воды в мезотелиальные клетки брюшины, охарактеризованная по усредненным профилям флуоресценции кальцеина (F/F0) (M ± SEM). Контроль – сплошная линия (n = 27). Эффект 24-часовой инкубации в гипертонической среде (2.3% глюкозы) – пунктирная линия (n = 57).
Таким образом, глюкоза приводит к снижению водной проницаемости клеток перитонеального мезотелия, к падению экспрессии водного канала AQP1 и транскрипционного фактора TonEBP. Данные результаты подтверждают факт ингибирующего воздействия глюкозосодержащих растворов на транспортные процессы в клетках перитонеального мезотелия.
Список литературы
Yung S, Chan TM (2012) Pathophysiological changes to the peritoneal membrane during PD-related peritonitis: the role of mesothelial cells. Mediat Inflamm 2012: 484167. https://doi.org/10.1155/2012/484167
Yáñez-Mó M, Lara-Pezzi E, Selgas R, Ramírez-Huesca M, Domínguez-Jiménez BS, Jiménez-Heffernan JA, Aguilera A, Sánchez-Tomero JA, Bajo MA, Álvarez V, Castro MA, del Peso G, Cirujeda A Gamallo CC, Sánchez-Madrid F, López-Cabrera M (2003) Peritoneal dialysis and epithelial-to-mesenchymal transition of mesothelial cells. N Engl J Med 348: 403–413. https://doi.org/10.1056/NEJMoa020809
Davies SJ, Bryan J, Phillips L, Russell GI (1996) Longitudinal changes in peritoneal kinetics: the effects of peritoneal dialysis and peritonitis. Nephrol Dial Transplant 11: 498–506.
Davies SJ, Phillips L, Naish PF, Russell GI (2001) Peritoneal glucose exposure and changes in membrane solute transport with time on peritoneal dialysis. J Am Soc Nephrol 12: 1046–1051. https://doi.org/10.1681/ASN.V1251046
Williams JD, Craig KJ, Topley N, Von Ruhland C, Fallon M, Newman GR, Mackenzie RK, Williams GT (2002) Morphologic changes in the peritoneal membrane of patients with renal disease. J Am Soc Nephrol 13: 470–479. https://doi.org/10.1681/ASN.V132470
Schmitt CP, Bakkaloglu SA, Klaus G, Schröder C, Fischbach M (2011) Solutions for peritoneal dialysis in children: recommendations by the European Pediatric Dialysis Working Group. Pediatr Nephrol 26: 1137–1147. https://doi.org/10.1007/s00467-011-1863-4
Ha H, Lee HB (2000) Effect of high glucose on peritoneal mesothelial cell biology. Peritoneal Dialysis Int 20 (Suppl 2): S15–S18. https://doi.org/10.1177/089686080002002S04
Perl J, Nessim SJ, Bargman JM (2011) The biocompatibility of neutral pH, low-GDP peritoneal dialysis solutions: benefit at bench, bedside, or both? Kidney Int 79: 814–824. https://doi.org/10.1038/ki.2010.515
Htay H, Johnson DW, Wiggins KJ, Badve SV, Craig JC, Strippoli G, Cho Y (2018) Biocompatible dialysis fluids for peritoneal dialysis. Meta-Analysis Cochrane Database Syst Rev 10: CD007554. https://doi.org/10.1002/14651858.CD007554.pub3
Thorens B, Mueckler M (2010) Glucose transporters in the 21st Century. Am J Physiol Endocrinol Metab 298: E141–E145. https://doi.org/10.1152/ajpendo.00712.2009
Kumar R, DuMond JF, Khan SH, Thompson EB, He Y, Burg MB, Ferraris JD (2020) NFAT5, which protects against hypertonicity, is activated by that stress via structuring of its intrinsically disordered domain. Proc Natl Acad Sci U S A 117: 20292–20297. https://doi.org/10.1073/pnas.1911680117
Lai KN, Li FK, Lan HY, Tang S, Tsang AWL (2001) Expression of aquaporin-1 in human peritoneal mesothelial cells and its upregulation by glucose in vitro. JASN 12: 1036–1045. https://doi.org/10.1681/ASN.V1251036
Baturina GS, Katkova LE, Schmitt CP, Solenov EI, Zarogiannis SG (2021) Comparison of Isotonic Activation of Cell Volume Regulation in Rat Peritoneal Mesothelial Cells and in Kidney Outer Medullary Collecting Duct Principal Cells. Biomolecules 11: 1452. https://doi.org/10.3390/biom11101452
Ivanova LN, Babina AV, Baturina GS, Katkova LE (2013) Effect of vasopressin on the expression of genes for key enzymes of hyaluronan turn over in Wistar Albino Glaxo and Brattleboro rat kidneys. Exp Physiol 98: 1608–1619. https://doi.org/10.1113/expphysiol.2013.073163
Yu D, Thelin WR, Randell SH, Boucher RC (2012) Expression profiles of aquaporins in rat conjunctiva, cornea, lacrimal gland and Meibomian gland. Exp Eye Res 103: 22. https://doi.org/10.1016/j.exer.2012.07.005
Solenov E, Watanabe H, Manley GT, Verkman AS (2004) Sevenfold-reduced osmotic water permeability in primary astrocyte cultures from AQP-4-deficient mice, measured by a fluorescence quenching method. Am J Physiol Cell Physiol 286: 426–432. https://doi.org/10.1152/ajpcell.00298.2003
Zarogiannis SG, Ilyaskin AV, Baturina GS, Katkova LE, Medvedev DA, Karpov DI, AP, Ershov, Solenov EI ((2013) Regulatory volume decrease of rat kidney principal cells after successive hypo-osmotic shocks. Math Biosci 2: 176–187. https://doi.org/10.1016/j.mbs.2013.05.007
Schaefer B, Bartosova M, Macher-Goeppinger, Ujszaszi A, Wallwiener M, Nyarangi-Dix J, Sallay P, Burkhardt D, Querfeld U, Pfeifle V (2016) Quantitative Histomorphometry of the Healthy Peritoneum. Nat Publ Gr 6: 21344. https://doi.org/10.1038/srep21344
Schaefer B, Bartosova M, Macher-Goeppinger S, Sallay P, Vörös P, Ranchin B, Vondrak K, Ariceta G, Zaloszyc A, Bayazit AK (2018) Neutral pH and low-glucose degradation product dialysis fluids induce major early alterations of the peritoneal membrane in children on peritoneal dialysis. Kidney Int 94: 419–429. https://doi.org/10.1016/j.kint.2018.02.022
Schmitt CP, Nau B, Gemulla G, Bonzel KE, Hölttä T, Testa S, Fischbach M, John U, Kemper MJ, Sander A et al. (2013) Article Effect of the Dialysis Fluid Buffer on Peritoneal Membrane Function in Children. Clin J Am Soc Nephrol 8: 108–115. https://doi.org/10.2215/CJN.00690112
Blake PG (2018) Is the peritoneal dialysis biocompatibility hypothesis dead? Kidney Int 94: 246–248. https://doi.org/10.1016/j.kint.2018.04.014
Wautier JL, Schmidt AM (2004) Protein glycation: a firm link to endothelial cell dysfunction. Circ Res 95: 233–238. https://doi.org/10.1161/01.RES.0000137876.28454.64
Tian W, Cohen DM (2001) Urea inhibits hypertonicity-inducible TonEBP expression and action. Am J Physiol Renal Physiol 280: F904–F912. https://doi.org/10.1152/ajprenal.2001.280.5.F904
Devuyst O, Nielsen S, Cosyns JP, Smith BL, Agre P, Squifflet JP, Pouthier D, Goffin E. (1998) Aquaporin-1 and endothelial nitric oxide synthase expression in capillary endothelia of human peritoneum. Am J Physiol 275: H234–H242. https://doi.org/10.1152/ajpheart.1998.275.1.H234
Corciulo S, Nicoletti MC, Mastrofrancesco L, Milano S, Mastrodonato M, Carmosino M, Gerbino A, Corciulo R, Russo R, Svelto M, Gesualdo L, Procino G (2019) AQP1-Containing Exosomes in Peritoneal Dialysis Effluent As Biomarker of Dialysis Efficiency. Cells 8: 330. https://doi.org/10.3390/cells8040330
Yang B, Folkesson HG, Yang J, Matthay MA, Ma T, Verkman AS (1999) Reduced osmotic water permeability of the peritoneal barrier in aquaporin-1 knockout mice. Am J Physiol 276: C76–C81. https://doi.org/10.1152/ajpcell.1999.276.1.C76
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


