Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 4, стр. 424-437
Электрическая стимуляция спинного мозга как метод регуляции кинематики ходьбы у постинсультных пациентов
И. Н. Богачева 1, *, Н. А. Щербакова 1, Т. Р. Мошонкина 1, А. А. Гришин 1, Д. В. Скворцов 2, 3, С. Н. Кауркин 2, 3, Ю. П. Герасименко 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 Федеральный научный клинический центр ФМБА России
Москва, Россия
3 Федеральный центр мозга и нейротехнологий ФМБА России
Москва, Россия
* E-mail: bogacheva@infran.ru
Поступила в редакцию 07.02.2023
После доработки 20.02.2023
Принята к публикации 21.02.2023
- EDN: VIYDMZ
- DOI: 10.31857/S0869813923040040
Аннотация
Мультисегментарная чрескожная электрическая стимуляция спинного мозга (ЧЭССМ), воздействующая на спинальные нейронные сети и моторные пулы мышц ног, применялась для коррекции ходьбы по беговой дорожке у пациентов, перенесших инсульт. В исследовании принимали участие 15 пациентов в восстановительном периоде после острого нарушения мозгового кровообращения. Неинвазивный спинальный нейропротез с многоканальным стимулятором для ЧЭССМ и системой детектирования фаз шагательного цикла (“Косима”, Россия) использовался для активации моторных пулов мышц-сгибателей ноги в фазе переноса, активации моторных пулов мышц-разгибателей в фазе опоры в сочетании с непрерывной активацией спинальных локомоторных сетей. Применение ЧЭССМ при ходьбе по беговой дорожке вызывало увеличение амплитуды движений в голеностопном суставе и длины цикла шага на стороне пареза, а также уменьшение асимметрии в фазах шага обеих ног. У 80% пациентов возрастал подъем паретичной ноги над опорой. При сочетании непрерывной и фазозависимой стимуляций увеличение размаха движения в суставах было максимальным по сравнению с только фазозависимой или только постоянной стимуляцией. Полученные данные демонстрируют, что предложенный алгоритм ЧЭССМ модулирует параметры шагательных движений у пациентов с последствиями нарушения мозгового кровообращения и может рассматриваться как перспективный метод двигательной реабилитации.
ВВЕДЕНИЕ
Проблема реабилитации пациентов с двигательными нарушениями после инсульта сохраняет свою актуальность в связи с увеличением инвалидизации населения: во всем мире наблюдается тенденция к уменьшению числа летальных случаев инсульта, при этом количество пациентов, нуждающихся в длительном уходе и восстановлении после инсульта, растет [1]. Одним из распространенных последствий инсульта является нарушение походки, в частности, снижение скорости ходьбы, укорочение длины шага, избыточное перераспределение нагрузки на здоровую ногу. Для восстановления этих параметров используют различные способы тренировки ходьбы, в том числе тренировки с помощью электромеханических и роботизированных средств и тренировки на беговой дорожке с разгрузкой массы тела [2].
Известно, что использование эпидуральной электрической стимуляции спинного мозга (СМ) в сочетании с двигательной локомоторной тренировкой улучшает моторные функции и восстанавливает самостоятельную ходьбу по ровной поверхности у парализованных пациентов с позвоночно-спинномозговой травмой [3, 4]. Показано, что чрескожная электрическая стимуляция спинного мозга (ЧЭССМ) также способна активировать спинальные локомоторные нейронные сети, и, в зависимости от интенсивности, позволяет воздействовать на Ia афференты, афференты группы Ib, кожные афференты, афференты мышечных веретен II группы, а также на спинальные интернейроны и вызывать прямую двигательную активацию моторных пулов [5]. ЧЭССМ может рассматриваться как неинвазивный аналог эпидуральной стимуляции СМ и использоваться для регуляции двигательной активности [6–8]. Показано, что в сочетании с локомоторной тренировкой ЧЭСС-М может улучшить постуральный контроль и равновесие [9] и вызвать восстановление локомоторных функций у пациентов с травмой СМ [10, 11]. Преимуществами ЧЭССМ перед эпидуральной стимуляций СМ являются неинвазивность воздействия и возможность синхронно стимулировать несколько спинальных центров.
Возможность применения ЧЭССМ как метода коррекции локомоторных способностей человека после нарушения церебрального кровообращения ишемического генеза мало исследована. В работе [12] применяли ЧЭССМ на уровне T11–T12 для пациентов с двигательными нарушениями различной степени тяжести, вызванными нарушением кровообращения головного мозга. Стимуляция с частотой 1 Гц вызывала в мышцах нижних конечностей пациентов рефлекторные ответы с моно- и полисинаптическими компонентами, а при стимуляции с частотами 5 и 30 Гц у пациентов возникали непроизвольные движения ног, схожие с локомоторными.
В последние годы нами разработана новая технология мультисегментарной ЧЭССМ, позволяющая адресно активировать флексорные и экстензорные моторные пулы в определенные фазы шагательного цикла, так называемая фазозависимая стимуляция. Проведенные нами исследования с участием здоровых добровольцев показали, что мультисегментарная фазозависимая ЧЭССМ модулирует параметры ходьбы на беговой дорожке [13]. Недавно показано, что мультисегментарная ЧЭССМ безопасна и эффективна для регуляции постурального контроля у спинальных пациентов детского возраста [14], а также для восстановления ходьбы у пациента с полным моторным поражением СМ [15].
Цель данного исследования – изучить влияние фазозависимой ЧЭССМ на функцию ходьбы у больных с гемипарезом в восстановительном периоде после острого нарушения мозгового кровообращения.
МЕТОДЫ ИССЛЕДОВАНИЯ
В исследовании участвовали 15 пациентов, женщины (n = 4) и мужчины, в возрасте от 33 до 79 лет (58.9 ± 14.3 лет; медиана 57.0 лет) после перенесенного инфаркта головного мозга (n = 8) или ишемического инсульта. Период после болезни – от 1 мес. до 1 года (5.1 ± 4.0 мес.; медиана 4.0 мес.). У всех пациентов диагностировали сопутствующие заболевания (гипертоническая болезнь, хроническая сердечная недостаточность, сахарный диабет и др.).
Для стимуляции использовали “Спинальный нейропротез” (“Косима”, Москва), включающий многоканальный стимулятор для ЧЭССМ и датчик для определения фаз переноса и опоры в шагательном цикле [16].
Нейропротез обеспечивает непрерывную ЧЭССМ на уровне позвонков Т11–Т12 и/или фазозависимую стимуляцию корешков СМ на уровне позвонков Т11 и L1 с пораженной стороны в зависимости от фазы движения (перенос/опора) этой конечности (рис. 1a). Электроды (катоды) для непрерывной стимуляции размещали по средней линии позвоночника между позвонками T11–T12. Ритмическая стимуляция осуществлялась через электроды, расположенные на паретичной стороне, латеральнее на ~2 см от средней линии позвоночника, по ходу корешков СМ. Два общих анода фиксировали симметрично над гребнями подвздошных костей. Подробно материалы и методы стимуляции с использованием неинвазивного спинального нейропротеза описаны в [13, 16]. Апробация “Спинального нейропротеза” на здоровых испытуемых – добровольцах [13] и на пациенте с полным моторным поражением спинного мозга [15] показала его эффективность в регуляции локомоторной активности человека.
Рис. 1.
(a) – Схема расположения стимулирующих электродов в разные этапы исследования. Расположение катодов показано относительно позвонков T11, T12, L1, L2. Катоды изображены кругами, белый фон – отсутствие стимуляции, черный фон – непрерывная стимуляция с частотой 30 Гц, косая и вертикальная штриховка – стимуляция в фазы переноса и опоры паретичной ноги с частотой 40 и 20 Гц. Цифры внизу – номера этапов исследования. (b) – Анализируемые циклы шага (по [17]). Черным цветом обозначена правая нога.
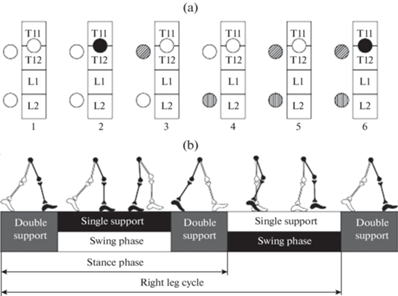
Последовательность этапов исследования:
1. ходьба по тредбану без стимуляции (этап 1);
2. ходьба по тредбану, непрерывная ЧЭССМ на уровне T11–T12 позвонков, частота 30 Гц (этап 2);
3. ходьба по тредбану, стимуляция корешков СМ в области позвонка Т12 на стороне пареза (активация флексорных моторных пулов) во время фазы переноса паретичной ноги, частота 40 Гц (этап 3);
4. ходьба по тредбану, стимуляция корешков СМ в области позвонка L1 на стороне пареза (активация экстензорных моторных пулов) во время фазы опоры паретичной ноги, частота 20 Гц (этап 4);
5. ходьба по тредбану, сочетание типов стимуляции 3 и 4 (этап 5);
6. ходьба по тредбану, сочетание типов стимуляции 2–4 (этап 6).
Схема расположения электродов в этапах исследования представлена на рис. 1a.
Интенсивность стимуляции каждому пациенту подбирали индивидуально, для каждого уровня стимуляции отдельно, сразу после начала ходьбы по беговой дорожке, увеличивая интенсивность по 1 мА. Стимуляция не должна была вызывать неприятных или болезненных ощущений.
Биомеханическое исследование функции ходьбы проводили с помощью комплекса “Стэдис” (“Нейрософт”, Иваново). Инерционные сенсоры “Нейросенс”, входящие в состав “Стэдис”, фиксировали на крестце, а также на обеих конечностях на наружной поверхности средней трети бедра, наружной лодыжке и подъеме стопы. Регистрировали биомеханические параметры походки: скорость ходьбы, длина шага, углы в суставах и др. Положение калибровки соответствовало положению пациента стоя прямо с выпрямленными тазобедренными и коленными суставами. На каждом этапе исследования пациент выполнял не менее 30 циклов шага (ЦШ) – периода от начала контакта с опорой данной ноги до следующего такого же контакта этой же ногой (рис. 1b). Используя программные возможности “Стэдис”, определяли длительности фаз шага для каждой ноги относительно длительности ЦШ одноименной ноги, принимая длительность ЦШ каждой ноги за 100%. Пространственные и кинематические параметры походки также определялись программно для каждой ноги в пределах ЦШ. Асимметрию параметров, характеризующих фазы ходьбы, считали как модуль разности между значениями параметра на здоровой и паретичной стороне.
Для оценки влияния условий стимуляции на кинематику походки проводили сравнение параметров ходьбы при стимуляционных воздействиях и параметров ходьбы без стимуляции (параметры, зарегистрированные на этапах 2–6, сравнивали с параметрами, полученными на этапе 1).
Статистический анализ проводили в программе Excel. Достоверность различий показателей определяли с применением парного t-критерия Стьюдента, различия считали достоверными при p < 0.05. Нормальность распределений проверялась по критерию Шапиро–Уилки. Достоверность коэффициентов корреляции определялась по критерию Пирсона на уровне значимости p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Скорость ходьбы по беговой дорожке без ЧЭССМ варьировала в диапазоне 0.16–0.38 м/с (0.27 ± 0.07 м/с). При ходьбе с ЧЭССМ скорость ходьбы по беговой дорожке достоверно не отличалась от ходьбы без стимуляции (табл. 1). Другие параметры ходьбы зависели от условия стимуляции. Средние значения кинематических параметиров по группе представлены в табл. 1.
Таблица 1.
Биомеханические параметры ходьбы для паретичной и здоровой ноги (верхний и нижний ряд значений соответственно)
| Параметры | Этап 1 | Этап 2 | Этап 3 | Этап 4 | Этап 5 | Этап 6 |
|---|---|---|---|---|---|---|
| ПО (%#) | 71.3 ± 1.0 74.4 ± 1.3 |
72.3 ± 1.1 75.0 ± 1.2 |
72.3 ± 1.1 75.3 ± 2.2 |
72.5 ± 1.3 76.1 ± 1.2 |
72.5 ± 1.3 75.7 ± 1.1 |
72.7 ± 1.3 75.8 ± 1.3 |
| Асимм. ПО (%) | 4.5 ± 1.4 | 3.9 ± 1.3 | 3.6 ± 1.2* | 4.6 ± 1.4 | 4.1 ± 1.1 | 4.0 ± 1.3 |
| ОО (%#) | 25.7 ± 1.1 29.0 ± 1.1 |
25.4 ± 1.1 28.3 ± 1.2 |
24.6 ± 1.1* 27.5 ± 1.1 |
24.3 ± 1.2* 27.8 ± 1.2 |
24. 7 ± 1.1 27.9 ± 1.3 |
24.6 ± 1.2* 27.7 ± 1.2 |
| Асимм. ОО (%) | 5.2 ± 1.5 | 3.7 ± 1.3* | 3.6 ± 1.2 | 4.4 ± 1.3 | 4.1 ± 1.1 | 3.9 ± 1.3* |
| ДО (%#) | 44.8 ± 1.8 44.5 ± 1.8 |
46.7 ± 1.8* 46.6 ± 1.8 |
47.8 ± 1.9* 47.9 ± 1.9* |
48.3 ± 1.9* 48.3 ± 1.8* |
47.9 ± 2.0* 48.1 ± 1.9* |
48.1 ± 2.0* 48.3 ± 2.1* |
| Асимм. ДО (%) | 0.4 ± 0.1 | 0.3 ± 0.1 | 0.4 ± 0.1 | 0.3 ± 0.1 | 0.4 ± 0.1 | 0.2 ± 0.0 |
| НВД (%#) | 46.5 ± 1.2 53.0 ± 1.6 |
49.7 ± 1.5 53.0 ± 1.4 |
47.5 ± 1.4 53.3 ± 1.4 |
47.3 ± 1.6 53.7 ± 1.4 |
47.5 ± 1.5 53.5 ± 1.4 |
47.0 ± 1.6 52.9 ± 1.5 |
| Асимм. НВД (%) | 7.9 ± 2.4 | 6.7 ± 2.6* | 7.0 ± 2.5* | 8.2 ± 2.6 | 8.1 ± 2.4 | 7.9 ± 2.6 |
| ДЦШ (см) | 48.4 ± 3.5 | 52.1 ± 4.00 | 54.1 ± 3.9* | 54.5 ± 4.0* | 54.8 ± 3.8* | 54.7 ± 4.2* |
| СХ (м/c) | 0.3 ± 0.0 | 0.3 ± 0.0 | 0.3 ± 0.0 | 0.3 ± 0.0 | 0.3 ± 0.0 | 0.3 ± 0.0 |
| ВПН (см) | 9.4 ± 0.8 11.7 ± 0.9 |
9.7 ± 0.7 11.8 ± 0.8 |
9.8 ± 0.7 11.6 ± 0.8 |
9.9 ± 0.7 11.8 ± 0.8 |
9.9 ± 0.7 11.8 ± 0.8 |
10.1 ± 0.7 11.6 ± 0.9 |
| ТБС (град.) | 23.0 ± 1.9 29.3 ± 1.3 |
23.9 ± 1.9 29.9 ± 1.3 |
23.2 ± 1.9 30.7 ± 1.6 |
24.0 ± 2.0 30.5 ± 1.6 |
23.7 ± 2.0 30.3 ± 1.6 |
23.9 ± 2.0 30.7 ± 1.8 |
| ТМР (%) | 52.8 ± 1.5 58.0 ± 1.5 |
53.1 ± 2.3 57.8 ± 1.4 |
55.3 ± 1.4* 58.5 ± 1.3 |
55.3 ± 1.7* 59.9 ± 1.4* |
54.9 ± 1.7* 59.9 ± 1.3* |
55.3 ± 1.7* 59.2 ± 1.4* |
| ТМС (%) | 88.5 ± 1.5 89.3 ± 0.8 |
90.0 ± 1.2 91.3 ± 1.1 |
89.8 ± 1.2 91.7 ± 1.2 |
90.0 ± 1.1 91.9 ± 1.1 |
90.1 ± 1.3 92.5 ± 1.0 |
90.1 ± 1.1 92.1 ± 1.1 |
| КС (град.) | 38.9 ± 3.7 48.9 ± 2.1 |
39.9 ± 3.6* 48.8 ± 1.7 |
39.3 ± 3.5 48.2 ± 1.7 |
39.6 ± 3.4 48.3 ± 1.8 |
39.0 ± 3.5 48.0 ± 1.8 |
39.9 ± 3.6 47.9 ± 1.9 |
| КСМР (%) | 40.9 ± 4.7 39.1 ± 1.9 |
39.6 ± 5.0 42.9 ± 1.8 |
40.1 ± 5.2 42.3 ± 2.0 |
41.4 ± 5.2 42.3 ± 1.9 |
42.2 ± 5.3 42.8 ± 2.0 |
41.5 ± 5.5 43.3 ± 2.0* |
| КСС (%) | 76.5 ± 1.1 77.3 ± 2.9 |
77.8 ± 0.8 76.4 ± 2.9 |
77.5 ± 0.9 77.5 ± 3.0 |
77.2 ± 1.1 78.1 ± 2.8 |
76.9 ± 1.1 77.5 ± 3.0 |
77.6 ±1.0 77.5 ± 3.0 |
| ГСС (град) | 15.4 ± 2.0 15.1 ± 1.2 |
17.1 ± 2.1* 15.7 ± 1.1 |
18.1 ± 2.0* 16.7 ± 1.5 |
18.4 ± 2.0* 17.3 ± 1.4* |
19.0 ± 2.0* 17.1 ± 1.5* |
18.3 ± 2.1* 17.3 ± 1.3* |
Непрерывная стимуляция по средней линии спинного мозга на уровне Т11–Т12 (активация локомоторных сетей нижних конечностей, этап 2) увеличивала суммарный период двойной опоры паретичной ноги на 2%, что привело к достоверному уменьшению асимметрии одиночной опоры и асимметрии начала второй двойной опоры. Непрерывная стимуляция на уровне Т11–Т12 достоверно увеличила амплитуду движений в суставах паретичной ноги: на 1 градус в коленном суставе и на 2 градуса в голеностопном суставе.
Фазозависимая стимуляция корешков на стороне пареза на уровне Т11–Т12 (активация сгибателей, этап 3) приводила к увеличению суммарных периодов двойной опоры здоровой и паретичной конечности на 3%, период одиночной опоры на паретичной стороне уменьшился на 1%. Это отразилось в уменьшении асимметрии периода опоры и начала второй двойной опоры на 1%. Амплитуда движений в голеностопном суставе паретичной ноги увеличилась на 2.5 градуса. Длина шага достоверно увеличилась на 5 см, вероятно, это связано с удлинением фазы максимального разгибания тазобедренного сустава паретичной ноги (на 2.5%).
Фазозависимая стимуляция корешков на стороне пареза на уровне L1–L2 (активация разгибателей, этап 4) вызывала увеличение суммарных периодов двойной опоры здоровой и паретичной конечности на 3.5%, уменьшение периода одиночной опоры на 1%. Амплитуды движений в голеностопных суставах паретичной и здоровой ног увеличились на 2–3 градуса. Зарегистрировано увеличение длины шага на 6 см и удлинение фазы максимального разгибания тазобедренного сустава на паретичной и здоровой стороне на 2–3%.
Фазозависимая стимуляция корешков на стороне пареза на уровне L1–L2 и Т11–T12 (этап 5). Зарегистрировано увеличение суммарных периодов двойной опоры здоровой и паретичной конечности на 3%, увеличение амплитуды движений в голеностопных суставах паретичной и здоровой ног на 2–3 градуса. Длина шага увеличилась на 6 см, это сопровождалось удлинением фазы максимального разгибания тазобедренного сустава на паретичной и здоровой стороне на 2%.
Непрерывная стимуляция на уровне Т11–Т12 и фазозависимая стимуляция корешков на стороне пареза на уровне L1–L2 и T11–Т12 (этап 6). Получено увеличение суммарных периодов двойной опоры здоровой и паретичной конечности на ~3.5%, увеличение периода одиночной опоры на паретичной стороне на 1% и уменьшение асимметрии одиночной опоры на 1%. Амплитуды движений в голеностопных суставах паретичной и здоровой ног увеличились на 2–3 градуса. Длина шага увеличилась на 6 см, это сопровождалось удлинением фазы максимального разгибания тазобедренного сустава на паретичной и здоровой стороне на 2% и удлинением фазы максимального разгибания коленного сустава здоровой ноги на 4%.
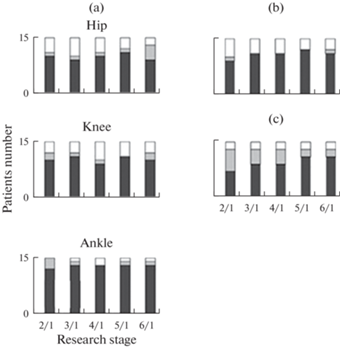
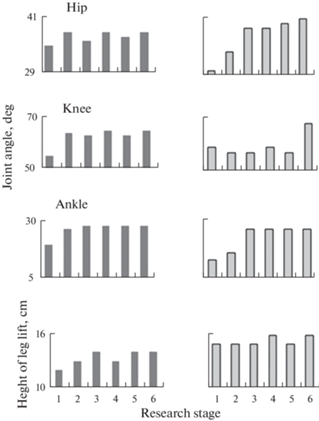
Однонаправленные изменения параметра в группе пациентов являются важным показателем эффективности воздействия стимуляции. Эти данные представлены на рис. 2. Можно видеть, что увеличение размаха движений в суставах и увеличение длины цикла шага наблюдались у большинства пациентов, их число возрастало при ритмической стимуляции. Увеличение высоты подъема ноги отмечено на 5-х и 6-х этапах стимуляции у 11 пациентов.
Рис. 2.
Распределение количества пациентов с изменениями параметров: амплитуды движения в суставах (a), длины цикла шага (b) и высоты подъема (c) паретичной ноги на разных этапах стимуляции (2–6) относительно значения параметра при ходьбе без стимуляции (этап 1). Hip – тазобедренный, Knee – коленный, Ankle – голеностопный сустав. По оси абсцисс – номер этапа стимуляции. По оси ординат – количество пациентов. Черный цвет – увеличение значения параметра, серый – значение параметра осталось без изменения, белый – уменьшение значения параметра.
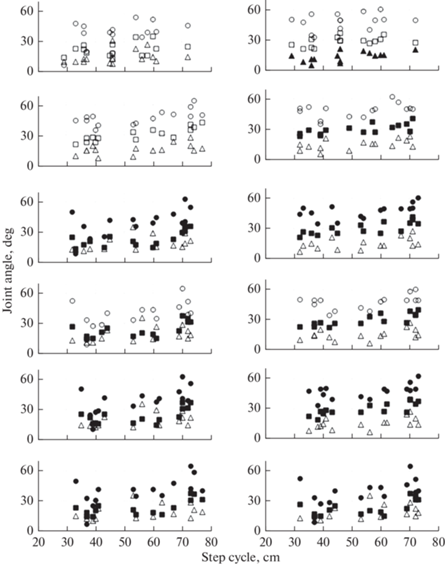
Для выяснения причин увеличения ДЦШ была вычислена корреляция между ДЦШ и амплитудами углов движения в суставах для паретичной и здоровой ноги, поскольку цикл шага складывается из движений обеих ног. Результаты представлены на рис. 3. На рисунке показано, что при ритмической стимуляции сгибателей (этап 3) связь между ДЦШ и движениями в суставах паретичной и здоровой ноги становится схожей. В этом случае достоверная корреляция установлена между ДЦШ и тазобедренным и ДЦШ и коленным суставом для обеих ног так же, как и на этапе 5 – при стимуляции сгибателей и разгибателей. На основании этих данных можно заключить, что ДЦШ в большей мере определяют тазобедренный и коленный суставы, чем голеностопный сустав.
Рис. 3.
Зависимости углов в тазобедренном (◻), коленном (○) и голеностопном (△) суставах от ДЦШ при разных условиях стимуляции. Сверху вниз – этапы исследования 1–6. Слева – паретичная нога, справа – здоровая нога. Черные символы указывают на достоверную корреляцию между величиной угла в суставе и ДЦШ.
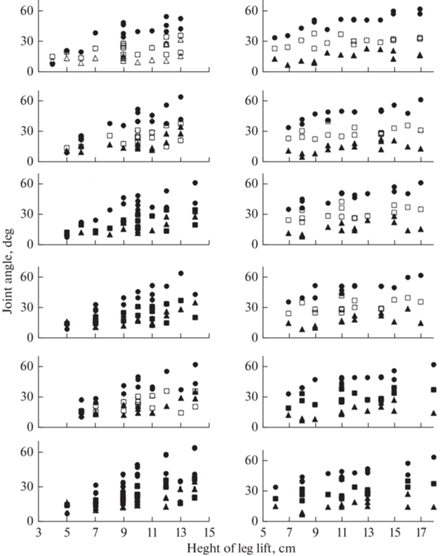
Также была вычислена корреляция между ВПН и размахом движения в суставах. Результаты представлены на рис. 4. При стартовой ходьбе без стимуляции коэффициенты корреляции составляли 0.52 для ТБС, 0.84 для КС и 0.56 для ГСС. Увеличение размаха движений в ГСС под влиянием стимуляции приводило к возрастанию связи между ГСС и ВПН (рис. 4), наибольший коэффициент корреляции между этими величинами при стимуляции сгибателей составлял 0.78, в то время как корреляции с ТБС составляли 0.64 и 0.59 на 4-м и 6-м этапе соответственно. Из рис. 4. можно видеть большее влияние КС и ГСС на ВПН, чем ТБС, как для паретичной, так и для здоровой ноги. Результаты могут являться подтверждением того, что ДЦШ и ВПН определяются движениями во всех трех суставах, однако ВПН больше связана с движениями в коленном и голеностопном суставах, в то время как ДЦШ – в коленном и тазобедренном суставах. Схожесть этой связи для паретичной и здоровой ноги отражает влияние стимуляции (рис. 3–4), что наиболее выражено при фазозависимой стимуляции (рис. 3), а также при сочетании фазозависимой и непрерывной стимуляции (рис. 4).
Рис. 4.
Зависимости углов в тазобедренном (◻), коленном (○) и голеностопном (△) суставах от ВПН при разных условиях стимуляции. Сверху вниз – этапы исследования 1–6. Слева – паретичная нога, справа – здоровая нога. По горизонтали – ВПН, см, по вертикали – амплитуда изменений суставных углов, градусы. Черные символы указывают на достоверную корреляцию между изменением угла и ВПН.
Следует отметить наличие индивидуальных особенностей пациентов, известно, что даже в норме некоторые люди при ходьбе прилагают наибольшие усилия в голеностопном суставе, другие больше задействуют коленный сустав [18], а после перенесенного инсульта, вероятно, будет иметь значение подвижность того или иного сустава. Пример зависимости ВПН от размаха движений в суставах для одного из пациентов приведен на рис. 5. Можно видеть, что увеличение высоты подъема паретичной ноги обусловлено увеличением размаха движений во всех суставах, наиболее выраженная связь наблюдается с ГСС.
Рис. 5.
Изменение средних значений амплитуды движения в суставах и высоты подъема ноги в ходе эксперимента у пациента БВ. Слева – паретичная нога, справа – здоровая нога. По оси Х – номер этапа исследования. По оси Y – амплитуды изменений суставных углов, градусы; ВПН, см. Сверху вниз: суставные углы для ТБС, КС, ГСС и ВПН.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Апробация “Спинального нейропротеза” на здоровых испытуемых – добровольцах [13] и на пациенте с полным моторным поражением спинного мозга [15] показала его эффективность в регуляции локомоторной активности человека. У 80% постинсультных пациентов нарушение походки формируется уже в первые 3 меc. после заболевания [19]. Одним из ее проявлений является укорочение длины шага. Согласно полученным результатам, на разных этапах применения ЧЭССМ длина шага увеличивалась у 60–73% пациентов, при ритмической чередующейся стимуляции сгибателей и разгибателей наблюдалось максимальное увеличение. Скорость ходьбы при этом мало изменялась и была задана скоростью беговой дорожки, увеличение скорости дорожки по просьбе пациента может быть связано с увеличением ДЦШ. Одним из распространенных осложнений после инсульта является так называемая свисающая стопа (foot drop), которая формируется в результате парезов и параличей мышц, участвующих в подъеме передней части стопы, и слабости разгибателя голеностопного сустава [20]. Наши результаты показывают, что ЧЭССМ действует прежде всего на голеностопный сустав, под действием ЧЭССМ размах движений в голеностопном суставе увеличивался у 86% пациентов, среднее по группе достоверно отличалось от среднего без стимуляции, для других суставов подобного эффекта не наблюдалось, хотя на уровне тенденции присутствовало во всех суставах. Так, во время ходьбы по беговой дорожке без стимуляции размах движений в голеностопном суставе на паретичной стороне составлял в среднем 15.4 ± 2.0 град., увеличение этого параметра наблюдалось на всех этапах применения ЧЭССМ, максимально при стимуляции сгибателей и разгибателей (этап 5) на 3.6 град. При включении стимуляции разгибателей достоверное увеличение наблюдалось на 2 град. и на здоровой стороне. В исследовании, проведенном на здоровых испытуемых [13], было получено достоверное увеличение амплитуды сгибания в голеностопном суставе, в среднем по группе на 24%, в нашем исследовании увеличение размаха движений в ГСС составляло 23%. Увеличение коэффициентов корреляции между движениями в суставах и ДЦШ во время ЧЭССМ показывает, что при этом возрастает связь данного параметра с работой ГСС. Схожие результаты были получены ранее: при увеличении длины шага углы в тазобедренном, коленном и голеностопном суставах возрастали, особенно амплитуда разгибания в голеностопном суставе [21].
Переход через препятствие является проблематичным для постинсультных пациентов, поскольку высота подъема паретичной конечности обычно меньше, чем здоровой. Важным результатом действия ЧЭССМ является повышение подъема ноги под действием стимуляции. Если при непрерывной стимуляции увеличение ВПН отмечено у 46% пациентов, то при ритмической стимуляции – у 60–90% пациентов. Мы попытались ответить на вопрос, какой сустав в большей степени определяет подъем ноги у пациентов с гемипарезом. При проведении аналогичных исследований с участием здоровых испытуемых было показано, что подъем ноги определяется работой всех суставов, при этом увеличение амплитуды угла в ТБС с увеличением ВПН отмечалось у всех участников [13]. Наши результаты показывают, что в подъеме ноги у постинсультных пациентов участвуют все суставы, так же, как и у здоровых людей, однако с большим участием КС и ГСС. Схожесть корреляционных зависимостей ДЦШ и ВПН с движениями в суставах для паретичной и здоровой ноги подтверждает возможность регуляции кинематических параметров ходьбы у постинсультных пациентов. Для обоснованного выбора методов лечения и эффективных технологий реабилитации следует учитывать объективные показатели ходьбы [22], анализ индивидуальных особенностей важен в этом случае для каждого пациента.
Слабость мышц, обеспечивающих движения голеностопного сустава и стопы, приводит к снижению скорости ходьбы и асимметрии [20]. Одним из важных критериев эффективности проводимой реабилитации можно считать уменьшение асимметрии при ходьбе [22]. По нашим данным уменьшение асимметрии при ЧЭССМ установлено для таких фаз шага как ПО, ОО и НВД, при этом более выраженные изменения наблюдались при ритмической стимуляции. Так, при стимуляции сгибателей наблюдалось уменьшение асимметрии периода опоры у 13 пациентов, в среднем по группе с 4.48 до 3.61%, уменьшение асимметрии одиночной опоры с 5.19 до 3.71 и 3.88 наблюдалось на этапах 2 и 6 соответственно. При непрерывной стимуляции (этап 2) асимметрия НВД уменьшилась с 7.88 до 6.71, а при стимуляции сгибателей (этап 3) до 6.95. По совокупности влияния на асимметрию фаз шага наибольший вклад вносила стимуляция сгибателей (табл. 1).
Одним из широко применяемых методов реабилитации после инсульта является функциональная электростимуляция мышц (ФЭС), в частности, передней большеберцовой и малоберцовой мышц паретичной конечности при ходьбе во время фазы переноса ноги. При этом могут использоваться как имплантируемые, так и накладываемые электроды. Использование неинвазивной ФЭС у неврологических пациентов оказало положительный эффект на движения в ГСС, а также на увеличение ВПН во время фазы переноса ноги в цикле шага [23]. По мнению Витензона, одного из основоположников ФЭС, цель этой методики состоит в том, чтобы не только восстановить или улучшить биомеханику ходьбы и функциональное состояние мышц, но и внести определенную коррекцию в работу локомоторных центров [24]. Применение ЧЭССМ направлено прежде всего на локомоторные центры спинного мозга. Отличие ФЭС от ЧЭССМ заключается в том, что в первом случае стимулируется нервно-мышечный аппарат, а во втором – воздействие адресуется к задним корешкам, рефлекторно активируя постуральные и локомоторные сети спинного мозга, а при фазовой стимуляции и сгибательные/разгибательные моторные пулы мышц ног. Использование фазовой стимуляции позволяет модулировать их активность в рамках шагательного цикла.
ЗАКЛЮЧЕНИЕ
Однократное применение ЧЭССМ у постинсультных пациентов вызывало положительные изменения кинематических параметров шага. Ритмическая стимуляция, главным образом воздействуя на фазы шага, приводила к уменьшению асимметрии ПО, ОО, и НВД. При ритмической стимуляции у 80% пациентов наблюдалось увеличение ВПН, что связано с увеличением подвижности в ГСС и КС. Достоверное увеличение ДЦШ определялось в большей степени движением ТБС и КС. При сочетании непрерывной и ритмической стимуляции увеличение размаха движения во всех суставах было максимальным. При такой стимуляции показана схожесть корреляционных зависимостей ДЦШ и ВПН с движениями в суставах для паретичной и здоровой ноги, что свидетельствует о возможности ЧЭССМ регулировать кинематические параметры ходьбы у постинсультных пациентов.
Список литературы
Feigin V, Norrving B, Mensah G (2017) Global burden of stroke. Circ Res 120: 439–448. https://doi.org/10.1161/CIRCRESAHA.116.308413
Хатькова СЕ, Костенко ЕВ, Акулов МА, Дягилева ВП, Николаев ЕА, Орлова АС (2019) Современные аспекты патофизиологии нарушений ходьбы у пациентов после инсульта и особенности их реабилитации. Журн неврол психиатр им СС Корсакова 119: 43–50. [Khatkova SE, Kostenko EV, Akulov MA, Diaghileva VP, Nikolaev EA, Orlova AS (2019) Modern aspects of the pathophysiology of walking disorders in patients after stroke and features of their rehabilitation. J Neurol Psychiatry named after SS Korsakov 119: 43–50. (In Russ)]. https://doi.org/10.17116/jnevro20191191214
Angeli CA, Boakye M, Morton RA,Vogt J, Benton K, Chen Y, Ferreira CK, Harkema SJ (2018) Recovery of over-ground walking after chronic motor complete spinal cord injury. N Engl J Med 379: 1244–1250. https://doi.org/10.1056/NEJMoa1803588
Darrow D, Balser D, Netoff Th, Krassioukov A, Phillips A, Parr A, Samadani U (2019) Epidural Spinal Cord Stimulation Facilitates Immediate Restoration of Dormant Motor and Autonomic Supraspinal Pathways after Chronic Neurologically Complete Spinal Cord Injury. J Neurotrauma 36: 2325–2336. https://doi.org/10/1089/neu.2018.6006
Gerasimenko Y, Gorodnichev R, Moshonkina T, Sayenko D, Gad P, Edgerton VR (2015) Transcutaneous electrical spinal-cord stimulation in humans. An Phys Rehabil Med 58: 225–231. https://doi.org/10.1016/j.rehab.2015.05.003
Hofstoetter U, Freundl B, Binder H, Minassian K (2018) Common neural structures activated by epidural and transcutaneous lumbar spinal cord stimulation: elicitation of posterior root-muscle reflexes. PLoS One13: 1–22. https://doi.org/10.1371/journal.pone.0192013
Danner S, Hofstoetter U, Ladenbauer J, Rattay F, Minassian K (2011) Can the human lumbar posterior columns be stimulated by transcutaneous spinal cord stimulation? A modeling study. J Artific Organs 35: 257–282. https://doi.org/10.1111/j.1525-1594.2011.01213.x
Minassian K, Perret I, Hofstoetter U (2021) Epidural and Transcutaneous Spinal Cord Stimulation Strategies for Motor Recovery After Spinal Cord Injur. In: Neuroprosthetics and Brain-Computer Interfaces in Spinal Cord Injury 167–190.
Rath M, Vette AH, Ramasubramaniam S, Li K, Burdick J, Edgerton VR, Gerasimenko YP, Sayenko DG (2018) Trunk Stability Enabled by Noninvasive Spinal Electrical Stimulation after Spinal Cord Injury. J Neurotrauma 21: 2540–2553. https://doi.org/10.1089/neu.2017.5584
Gad P, Gerasimenko Y, Zdunowski S, Turner A, Sayenko D, Lu DC, Edgerton VR (2017) Weight bearing over-ground stepping in an exoskeleton with non-invasive spinal cord neuromodulation after motor complete paraplegia. Front Neurosci 11: 1–8. https://doi.org/10.3389/fnins.2017.00333
Seáñez I, Capogrosso M (2021) Motor improvements enabled by spinal cord stimulation combined with physical training after spinal cord injury: review of experimental evidence in animals and humans. Bioelectron Med 7: 16 https://doi.org/10.1186/s42234-021-00077-5
Балыкин МВ, Якупов РН, Машин ВВ, Котова ЕЮ, Балыкин ЮМ, Герасименко ЮП (2017) Влияние неинвазивной электрической стимуляции спинного мозга на локомоторные функции пациентов с двигательными нарушениями центрального генеза. Вопр курортол физиотер и лечебн физкульт 4: 4–9. [Balykin MV, Yakupov RN, Mashin VV, Kotova EY, Balykin YuM, Gerasimenko UP (2017) The effect of non-invasive electrical spinal cord stimulation on locomotor functions of patients with movement disorders of central origin. Qurortol physiotherap and therap physical education 4: 4–9. (In Russ)].https://doi.org/10.17116/kurort20179444-9
Gorodnichev RM, Pukhov AM, Moiseev SA, Ivanov SM, Markevich VV, Bogacheva IN, Grishin AA, Moshonkina TR, Gerasimenko YP (2021) Regulation of Stepping Phases During Noninvasive Electrical Spinal Cord Stimulation. Human Physiol 47: 60–69. https://doi.org/10.31857/S0131164621010057
Keller A, Singh G, Sommerfeld JH, King M, Parikh P, Ugiliweneza B, D’Amico J, Gerasimenko Y, Behrman AL (2021) Noninvasive spinal stimulation safely enables upright posture in children with spinal cord injury. Nat Commun 12: 5850. https://doi.org/10.1038/s41467-021-26026-z
Siu R, Brown EH, Mesbah S, Gonnelli F, Pisolkar T, Edgerton VR, Ovechkin AV, Gerasimenko YP (2022) Novel Noninvasive Spinal Neuromodulation Strategy Facilitates Recovery of Stepping after Motor Complete Paraplegia. J Clin Med 11: 3670. https://doi.org/10.3390/jcm11133670
Grishin AA, Bobrova EV, Reshetnikova VV, Moshonkina TR (2021) A System for Detecting Stepping Cycle Phases and Spinal Cord Stimulation as a Tool for Controlling Human Locomotion. Biomed Eng 54: 312–316.
Скворцов ДВ (2007) Диагностика двигательной патологии инструментальными методами: анализ походки, стабилометрия. Науч-мед фирма МБН/M 617. [Skvortsov DV (2007) Diagnosis of motor pathology by instrumental methods mi: gait analysis, stabilometry. Scient med firm MBN/M 617. (In Russ)].
Simonsen EB (2014) Contributions to the understanding of gait control. Dan Med J 61: B4823.
Duncan PW, Zorowitz R, Bates B, Choi JY, Glasberg JJ, Graham GD, Katz RC, Lamberty K, Reker D (2005) Management of Adult Stroke Rehabilitation Care: a clinical practice guideline. Stroke 36: 100–143. https://doi.org/10.1161/01.str.0000180861.54180.ff
Гурьянова ЕА, Ковальчук ВВ, Тихоплав ОА, Литвак ФГ (2020) Функциональная электростимуляция при восстановлении ходьбы после инсульта. Физ реабилитац мед, мед реабилит 2: 244–262. [Guryanova EA, Kovalchuk VV, Tikhoplav OA, Litvak FG (2020) Functional electrical stimulation during recovery of walking after stroke. Phys rehabilit med, med rehabilitat 2: 244–262. (In Russ)]. https://doi.org/10.36425/rehab34831
Баскакова НВ, Витензон АС (1975) Влияние темпа и длины шага на основные параметры ходьбы человека. Биомеханика 13: 242–247. [Baskakova NV, Vitenzon AS (1975) The influence of pace and step length on the basic parameters of human walking. Biomechanics 13: 242–247. (In Russ)].
Скворцов ДВ, Королева СВ (2019) Динамика параметров ходьбы в процессе реабилитации после эндопротезирования коленного сустава. Научно-практ ревматол 57: 704–707. [Skvortsov DV, Koroleva SV (2019) Changes in gait parameters during rehabilitation after total knee arthroplasty. Scient Pract Rheumatol 57: 704–707. (In Russ)]. https://doi.org/10.14412/1995-4484-2019-704-707
Gervasoni E, Parelli R, Uszynski M, Crippa A, Marzegan A, Montesano A, Cattaneo D (2017) Effects offunctional electrical stimulation on reducing falls and improving gait parameters in multiple sclerosis and stroke. PMR 4: 339−347.e1.https://doi.org/10.1016/j.pmrj.2016.10.019
Витензон АС, Петрушанская КА (2010) Физиологические обоснования метода искусственной коррекции движений посредством программируемой электростимуляции мышц при ходьбе. Рос журн биомехан 14: 7–27. [Vitenzon AS, Petrushanskaya KA (2010) Physiological substantiations of the method of artificial correction of movements by means of programmable electrical stimulation of muscles during walking. Rus J Biomechan 14: 7–27. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


