Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 4, стр. 438-456
Изучение молекулярно-генетических механизмов действия агониста α2-адренорецепторов мафедина на модели черепно-мозговой травмы у крыс
Ю. И. Сысоев 1, 2, 3, 4, *, М. В. Шустов 1, В. А. Приходько 1, 4, Д. Д. Шиц 1, М. М. Пучик 1, С. В. Оковитый 1, 4
1 Санкт-Петербургский государственный химико-фармацевтический университет
Санкт-Петербург, Россия
2 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
3 Институт трансляционной биомедицины, Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
4 Институт мозга человека им. Н.П. Бехтеревой РАН
Санкт-Петербург, Россия
* E-mail: susoyev92@mail.ru
Поступила в редакцию 18.01.2023
После доработки 20.02.2023
Принята к публикации 21.02.2023
- EDN: VJVJRG
- DOI: 10.31857/S0869813923040118
Аннотация
Неврологические нарушения, возникающие вследствие перенесенных травматических, сосудистых или нейродегенеративных заболеваний головного мозга, имеют высокую распространенность во всем мире. Среди таких нарушений можно выделить двигательные, когнитивные и ментальные расстройства, значительно снижающие трудовую и социальную активность больных. Это обусловливает необходимость поиска и разработки новых эффективных нейропротекторных препаратов. В ранее проведенных исследованиях показано, что пиримидиновый агонист α2-адренорецепторов мафедин демонстрирует высокую эффективность в качестве средства коррекции неврологического дефицита на модели черепно-мозговой травмы (ЧМТ) у крыс. Несмотря на то, что результаты предыдущих исследований говорят в пользу активации этим фармакологическим агентом α2-адренорецепторов как основного механизма нейропротекторного действия, поиск дополнительных молекулярных мишеней является важным этапом разработки лекарственного препарата, который мог бы использоваться в клинической практике. В настоящей работе с помощью метода ПЦР в реальном времени было изучено влияние курсового 7-дневного введения мафедина в дозе 2.5 мг/кг на уровень экспресии генов нейротрофического фактора мозга (BDNF), медиаторов воспаления интерлейкинов ИЛ-1β, -6 и фактора некроза опухоли ФНО-α, а также подтипов α2-адренорецепторов α2A, α2B и α2C в коре головного мозга крыс, перенесших ЧМТ. Травматическое поражение моделировали методом контролируемого кортикального удара по открытому участку зоны сенсомоторной коры левого полушария головного мозга. Поведенческие изменения травмированных животных оценивали в тесте “Открытое поле”, а двигательную функцию передних и задних конечностей – в тестах “Стимулирование конечностей”, “Цилиндр” и “Сужающаяся дорожка”. Проведенными исследованиями установлено, что ЧМТ вызывает у крыс выраженные двигательные нарушения, а также снижает поисково-исследовательскую активность. Также у травмированных животных на 7-е сутки после операции происходит снижение уровня экспрессии всех анализируемых генов, при этом снижение наиболее выражено в контрлатеральном (здоровом) полушарии. Курсовое введение мафедина в дозе 2.5 мг/кг оказывало умеренное стимулирующее действие на поведение крыс с ЧМТ, увеличивая их поисково-исследовательскую активность по сравнению с травмированными животными без лечения, а также снижало степень сенсомоторного дефицита задней контрлатеральной конечности в тесте “Сужающаяся дорожка”. Анализ уровня экспрессии генов показал, что изучаемое соединение способно подавлять экспрессию генов α2B-адренорецепторов, ФНО-α и ИЛ-6 в травмированном полушарии. При этом, в отличие от животных с ЧМТ без лечения, у крыс, которым вводили мафедин, уровень экспрессии генов α2B-адренорецепторов и ИЛ-1β был выше в здоровом полушарии, чем в травмированном. Полученные результаты подтверждают ранее продемонстрированную нейропротекторную активность мафедина и позволяют предположить, что данное соединение может реализовывать свое действие через подавление экспрессии α2B-адренорецепторов и провоспалительных цитокинов в травмированном полушарии при компенсаторном увеличении их экспрессии в здоровом.
ВВЕДЕНИЕ
Травматические, сосудистые и нейродегенеративные заболевания головного мозга затрагивают миллионы людей ежегодно, являясь одной из главных причин инвалидизации населения во всем мире [1–3]. В результате этих заболеваний у больных снижается социальная и трудовая активность, что накладывает материальные обременения на их родственников и на общество в целом [4]. Для эффективного лечения таких пациентов необходимы нейропротекторные препараты, способные действовать на различные звенья патогенеза указанных заболеваний, тем самым предотвращая гибель нейронов и ускоряя функциональное восстановление двигательных, когнитивных и ментальных функций. Несмотря на большое разнообразие предложенных нейропротекторных препаратов, показавших эффективность в экспериментах на животных, только часть из них проходят клинические испытания, и еще меньшее количество оказывается эффективным в клинической практике [5]. Предполагается, что низкий трансляционный потенциал таких исследований связан с тем, что изучаемые средства действуют изолированно на тот или иной механизм патогенеза заболеваний, никак не влияя на параллельно происходящие патологические процессы [6]. Ввиду этого нейропротекторные препараты, имеющие разные молекулярные мишени в механизме действия, представляются наиболее перспективными для изучения и дальнейшей разработки.
Одной из таких групп, для которой показаны разные механизмы нейропротекторного действия, являются агонисты α2-адренорецепторов. В начале 70-х годов прошлого века эта группа активно использовалась в качестве антигипертензивных средств. Позже к их применению в этом качестве охладели, однако расширились перспективы использования их в качестве седативных, противотревожных и антиаддиктивных агентов. В начале 90-х годов появились работы, в которых были продемонстрированы положительные эффекты клонидина на модели ишемического инсульта у крыс [7, 8]. Особенно важно, что его нейропротекторные эффекты блокировались при введении крысам антагониста α2-адренорецепторов атипамезола, это позволило предположить, что именно активация этих рецепторов является причиной наблюдаемых эффектов. В последующих работах на различных моделях ишемического инсульта у грызунов была показана нейропротекторная активность и для других агонистов α2-адренорецепторов, например, тизанидина и дексмедетомидина [9]. Последний из препаратов в настоящий момент является объектом детального изучения многих исследователей, и было неоднократно показано, что при травматических и сосудистых повреждениях головного мозга он способен снижать выраженность воспалительных процессов и окислительного стресса, ингибировать апоптоз нейронов и глиальных клеток, нормализовать барьерную функцию гематоэнцефалического барьера, поддерживать баланс прокоагулянтных и антикоагулянтных систем, а также препятствовать развитию спазмирования церебральных сосудов [10]. Особенно важным является тот факт, что дексмедетомидин показал эффективность в клинической практике, например, при ишемическом инсульте, о чем свидетельствуют результаты метаанализа с участием 879 пациентов [11]. Кроме того, нейропротекторное действие данного препарата было продемонстрировано при удалении глиомы [12] и хирургическом лечении височной эпилепсии [13].
Другой агонист α2-адренорецепторов мафедин, синтезированный в Санкт-Петербургском химико-фармацевтическом университете, показал способность снижать выраженность неврологического дефицита у крыс, перенесших черепно-мозговую травму (ЧМТ). Его курсовое 7-дневное введение в дозе 2.5 мг/кг увеличивало общую двигательную активность травмированных животных, положительно влияло на двигательную функцию передних и задних конечностей, уменьшало объем повреждения головного мозга и снижало выраженность воспалительных процессов в очаге травмы [14]. В последующих экспериментах нейропротекторная активность мафедина на модели ЧМТ у крыс была подтверждена с помощью электрофизиологических методов исследования (электрокортикография, а также анализ зрительных и соматосенсорных вызванных потенциалов). Было установлено, что введение этого соединения приводило к нормализации работы межполушарных связей отделов мозга, отдаленных от области повреждения, а также внутриполушарных связей здорового полушария к 7-му дню после травмы. Кроме того, у животных, которым вводили мафедин, были отмечены положительные изменения ответов коры на фото- и соматосенсорную стимуляцию [15].
Поскольку введение йохимбина в эквимолярных количествах отменяло большую часть положительных эффектов мафедина, можно сделать вывод, что нейропротекторное действие последнего реализуется за счет активации α2-адренорецепторов [14]. Однако для создания препарата, который в дальнейшем мог бы использоваться в клинической практике, необходимо изучение его молекулярных механизмов действия. В связи с этим целью настоящей работы было изучение молекулярно-генетических механизмов действия мафедина на модели ЧМТ у крыс с использованием метода количественной полимеразной цепной реакции с обратной транскрипцией в реальном времени (РРТ-кПЦР). В качестве потенциальных молекулярных мишеней действия изучаемого соединения нами были выбраны нейротрофический фактор мозга BDNF, медиаторы воспаления интерлейкин ИЛ-1β, ИЛ-6 и фактор некроза опухоли ФНО-α, а также подтипы α2-адренорецепторов: α2A, α2B и α2C.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование было выполнено на 30 крысах-самцах линии Вистар в возрасте 3 мес. и массой 250–300 г, полученных из Питомника лабораторных животных “Рапполово” (Ленинградская область, Россия). Крыс содержали по 5 особей в клетке, при температуре в помещении 20–22°C и световом режиме 12 ч свет 750 лк/12 ч темнота. Все животные получали стандартный пищевой рацион (сухой полнорационный гранулированный экструдированный комбикорм рецепт ПК-120, ООО “ЛАБОРОТОРКОРМ”, Россия) и имели доступ к пище и воде ad libitum. Крысы всех экспериментальных групп были взяты из одной партии и прошли карантин в течение 14 сут. Каждому животному присваивали свой идентификационный номер и проводили разделение на 3 группы – контрольные, ЧМТ и ЧМТ + мафедин, путем рандомизации методом случайных чисел. Во всех экспериментальных группах было по 10 животных (рис. 1a).
Рис. 1.
Экспериментальные группы (a), координаты нанесения черепно-мозговой травмы (b), расписание проводимых экспериментов и процедур (с) и схема взятия биоматериала для молекулярно-генетического анализа (d). TBI – черепно-мозговая травма, i/p – внутрибрюшинно, AP – рострокаудально, ML – медиолатерально, RT-qPCR – полимеразная цепная реакция с обратной транскрипцией в режиме реального времени.
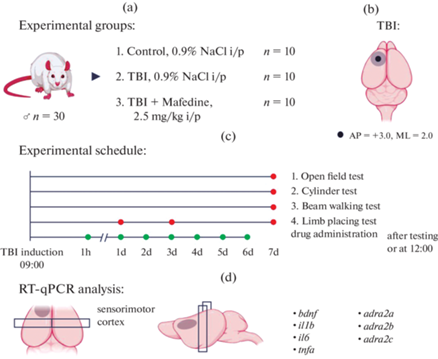
ЧМТ моделировали путем нанесения дозированного удара по участку сенсомоторной коры с помощью травматора (RWD Life Science Inc., США). Локализацию зоны сенсомоторной коры определяли по атласу стереотаксических координат Paxinos и Watson 16]. Перед операцией животных наркотизировали раствором тилетамина/золазепама (Золетил 50®, Virbac, Франция; 30 мг/кг, внутримышечно), после чего проводили трепанацию в левой лобной части черепа над зоной сенсомоторной коры. Центр трепанационного отверстия находился на 3.0 мм ростральнее и 2.0 мм латеральнее брегмы (рис. 1b). После этого в трепанационное отверстие помещали подвижный стальной поршень диаметром 4 мм с ходом 5 мм, по которому с высоты 22 см ударял скользящий в стальной трубке груз массой 60 г. Высверленную пластину возвращали на место и ушивали разрез кожи.
После выхода из наркоза крыс возвращали в домашние клетки со свободным доступом к воде и корму в течение всего периода исследования. Состояние животных отслеживали ежедневно утром и вечером, при необходимости обрабатывали швы раствором 10%-ного бетадина. Антибиотики, анальгетики и противовоспалительные препараты не использовались в настоящем исследовании ввиду того, что большинство из них в той или иной степени могут влиять на течение патологических процессов при травматическом поражении головного мозга, тем самым искажая результаты исследования. Ввиду отсутствия признаков боли, дистресса и развития местных или системных воспалительных реакций, ни одно из животных не было преждевременно выведено из экспериментов.
Мафедин (6-оксо-1-фенил-2-(фениламино)-1,6-дигидропиримидин-4-олят натрия) (2.5 мг/кг внутрибрюшинно (в/б)) [14, 15] или физиологический раствор (0.5 мл в/б) вводили соответствующим группам животных спустя 1 ч после нанесения травмы и далее каждый день согласно расписанию (рис. 1c) в течение 6 дней. Поведенческие и функциональные тесты у экспериментальных животных проводили на 1-е, 3-и и 7-е сутки после операции. Для объективизации полученных результатов была использована маскировка групп (“ослепление” операторов). После тестирования на 7-е сутки крыс эвтанизировали методом декапитации и осуществляли взятие участка коры головного мозга, расположенного каудальнее места травмы (зона сенсомоторной коры), для дальнейшего исследования (рис. 1d).
На 1-е, 3-и и 7-е сутки после травмы у животных оценивали выраженность неврологического дефицита в тесте “Стимулирование конечностей” (Limb placing test). Тест заключался в оценке ответа задних и передних конечностей на тактильную и проприоцептивную стимуляцию. Процесс тестирования состоял из 7 различных испытаний; результаты выражали в сумме баллов. Для оценки нарушений в работе конечностей использовалась следующая система подсчета: 2 балла – крыса полностью выполняла испытание; 1 балл – крыса выполняла испытание с задержкой в более чем 2 с и/или не полностью; 0 баллов – крыса не отвечала на стимулирование конечности. Максимально возможное суммарное количество баллов было равно 14. Результат выражали в сумме баллов [14].
На 7-е сутки оценивали общую двигательную и исследовательскую активность в тесте “Открытое поле” (ОП), фиксируя передвижения животных в установке (ООО “НПК Открытая наука”, Россия) при помощи видеокамеры (Canyon, ASBIS, Кипр) в течение 3 мин. Анализ полученных видеозаписей осуществляли с помощью программы VideoMot2 3.0.1 (TSE Systems, Германия). Оценивали пройденную дистанцию (см), среднюю скорость движения (см/с), число посещенных участков поля, число замираний, суммарное время замираний (с), время нахождения в центре поля (с), количество грумингов, стоек и заглядываний в отверстия – “норки” [17].
В тесте “Цилиндр” оценивали асимметрию использования животным передних конечностей в процессе исследования стенок цилиндра. Крысу помещали в прозрачный пластмассовый цилиндр (ООО “НПК Открытая наука”, Россия) и проводили видеорегистрацию ее движений. Время тестирования не ограничивали, добиваясь не менее 10 касаний стенок цилиндра. Просмотр видеозаписи проводили в покадровом режиме, подсчитывая количество актов независимого использования ипси- и контрлатеральной к месту повреждения конечностей во время исследования стенки цилиндра после подъема на задние лапы, а также одновременного использования обеих конечностей. Результаты представляли как процент использования контрлатеральной конечности от общего числа поведенческих актов (CL, %) и рассчитывали по формуле [17]: CL = (Контр + 0.5 Одновр)/(Ипси + Контр + Одновр) × 100, где Контр – контрлатеральная к месту повреждения конечность; Одновр – одновременное использование обеих передних конечностей; Ипси – ипсилатеральная к месту повреждения конечность.
Тест “Сужающаяся дорожка” (Beam walking) (СД) позволяет оценить выраженность сенсомоторного дефицита передних и задних конечностей. Установка (ООО “НПК Открытая наука”, Россия) представляет собой две плавно сужающиеся дорожки длиной 165 см, располагающиеся непосредственно друг под другом. Нижняя дорожка выполняет функцию платформы, на которой оказываются конечности животного во время соскальзывания с верхней дорожки. В конце дорожек находится черный ящик, который является конечной целью животного. Перед моделированием ЧМТ крыс обучали пересекать СД в течение 3 последовательных дней. Во время тестирования проводили запись движений животных на видеокамеру. Далее в покадровом режиме просмотра подсчитывали количество постановок контралатеральной к месту повреждения конечности на нижнюю дорожку (ошибок), количество соскальзываний с верхней дорожки на нижнюю и общее количество шагов. Подсчет количества ошибок, количества соскальзываний и общее количество шагов для передней и задней контрлатеральных конечностей проводили отдельно. Полученные в результате трех попыток данные усредняли, степень сенсомоторного дефицита (SD, %) вычисляли по формуле и выражали в процентах: SD = Ошибки + 0.5 × Соскальзывания/Общее количество шагов ×100 [17].
После проведения всех поведенческих и сенсомоторных тестов на 7-е сутки после травмы животных, предварительно наркотизированных тилетамином/золазепамом, подвергали декапитации и извлекали область сенсомоторной коры левого и правого полушария головного мозга. Выбор данных областей коры для дальнейшего анализа был обусловлен тем, что в предыдущих исследованиях мафедин был изучен и показал положительные эффекты в большей степени в сенсомоторных тестах. Полученный материал хранили при температуре –80°С, после чего ткани гомогенизировали c помощью 3D-гомогенизатора роторного типа Precellys Evolution (Bertin Technologies, Франция) с целью последующего выделения из гомогенизата нуклеиновых кислот и проведения ПЦР. Для выделения рибонуклеиновой кислоты (РНК) использовали набор БиоМастер LRU-100-50 (ООО “Биолабмикс”, Россия). Выделение РНК проводили согласно протоколу, указанному производителем. После этого измеряли концентрацию РНК с помощью спектрофотометра NanoPhotometer NP80 (Implen, Германия), приводили ее к 0.1 нг/мкл и далее методом обратной транскрипции синтезировали комплементарную дезоксирибонуклеиновую кислоту ДНК (кДНК) с помощью набора реактивов БиоМастер ОТ M-MuLV-RH (ООО “Биолабмикс”, Россия). Концентрацию кДНК после измерения приводили к 50 нг/мкл, затем методом РРТ-кПЦР (амплификатор CFX 96, Bio-Rad, США) определяли относительную степень экспрессии генов bdnf (BDNF), il1b (ИЛ-1β), il6 (ИЛ-6), tnfa (ФНО-α), adra2a, adra2b и adra2c (α2A, α2B, α2C-адренорецептор соответственно) с помощью готовой смеси реактивов БиоМастер Hs-qPCR (2×) (ООО “Биолабмикс”, Россия). Уровень экспрессии генов оценивали относительно экспрессии гена домашнего хозяйства глицеральдегид-3-фосфатдегидрогеназы (GAPDH). Синтез праймеров (табл. 1) осуществляла фирма Beagle (Москва). Специфичность продуктов амплификации контролировали по кривым плавления.
Таблица 1.
Нуклеотидные последовательности использованных праймеров
| Ген | Праймеры | Ссылка |
|---|---|---|
| bdnf | FW: 5′-CCGGTATCCAAAGGCCAACT-3′ RV: 5′-CTGCAGCCTTCCTTGGTGTA-3′ |
[18] |
| il1b | FW: 5′-GTTCTGTCCATTGAGGTG-3′ RV: 5′-ATTGTGGCTGTGGAGAAG-3′ |
[19] |
| il6 | FW: 5′-TACTTCACAAGTCCGGAG-3′ RV: 5′-TCCAGAAGACCAGAGCAG-3′ |
[19] |
| tnfa | FW: 5′-CACGCTCTTCTGTCACTGA-3′ RV: 5′-GGACTCCGTGATGTCTAAGT-3′ |
[20] |
| adra2a | FW: 5′-GGTAAGGTGTGGTGGGAGAT-3′ RV: 5′-CAGCGCCCTTCTTCTCTATG-3′ |
[21] |
| adra2b | FW: 5′-GCACCACACAAAACCTGTTCCT-3′ RV: 5′-TTGTAGATGAGGGGCGGTAG-3′ |
[21] |
| adra2c | FW: 5′-TACTGTGCTGGTTCCCCTTC-3′ RV: 5′-CAGAGGCCCAGTTGTCTCTC-3′ |
[21] |
Статистическую обработку полученных данных проводили с помощью пакета программы GraphPad Prism 9.0.0. Для проверки нормальности распределения данных использовали W-критерий Шапиро–Уилка, значимость различий между группами при нормальном распределении данных оценивали с помощью однофакторного дисперсионного анализа ANOVA c post hoc тестом по Тьюки, а при распределении, отличном от нормального, – с помощью непараметрического критерия Краскела–Уоллиса с post hoc тестом по Данну. Для сравнения относительного уровня экспрессии генов между полушариями в пределах одной группы использовали критерий Вилкоксона–Манна–Уитни. Различия считали статистически значимыми при p < 0.05. Анализ статистической мощности не производили.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Травматическое поражение сенсомоторной коры и нижележащих структур левого полушария приводило у крыс к выраженным поведенческим и двигательным нарушениям, регистрируемым на протяжении всего периода исследования. На 1-е сутки после перенесенной травмы по одному животному из групп ЧМТ и ЧМТ + Мафедин погибли, ввиду этого в данных группах в экспериментах участвовало по 9 крыс.
В тесте ОП на 7-е сутки после операции животные группы ЧМТ реже совершали стойки (p < 0.05) и заглядывания в норки (p < 0.05) по сравнению с контрольной группой (рис. 2). В тесте “Стимулирование конечностей” (рис. 3а) сумма баллов у травмированных животных была меньше (p < 0.01) во все дни тестирования (1-е, 3-и и 7-е сутки после операции) по сравнению со здоровой группой. Стоит отметить, что в данном тесте у животных с ЧМТ было отмечено спонтанное восстановление двигательной функции передних и задних конечностей (p < 0.01 для 1-х суток по сравнению с 3-ми), однако на 7-е сутки оно все еще было неполным, о чем свидетельствует тот факт, что результаты этой группы значимо отличались от результатов контрольных животных. В тесте “Цилиндр” (рис. 3b) травмированные крысы практически в 2 раза реже (p < 0.05) использовали контрлатеральную (правую) лапу в процессе изучения стенки цилиндра по сравнению с животными без травмы. Кроме того, выраженные двигательные нарушения в группе ЧМТ подтверждались в тесте “Сужающаяся дорожка” (рис. 3c), в котором степень их сенсомоторного дефицита была выше как для передней (p < 0.05), так и для задней (p < 0.01) контрлатеральных конечностей по сравнению с контрольной группой.
Рис. 2.
Значения поведенческих показателей крыс контрольной группы (Control, n = 10), группы ЧМТ (TBI, n = 9) и группы ЧМТ + Мафедин (MAF, n = 9) в тесте “Открытое поле”. Данные представлены как медиана (минимальное значение; максимальное значение). Для показателей “число переходов” (F2.25 = 3.972, p < 0.05) и “средняя скорость” (F2.25 = 7.453, p < 0.01) был использован однофакторный дисперсионный анализ ANOVA c post hoc тестом по Тьюки, а для показателей “число стоек” (H = 7.105, p < 0.05) и “число заглядываний” (H = 8.184, p < 0.05) – критерий Краскела–Уоллиса с post hoc тестом по Данну. * p < 0.05, ** p < 0.01 – достоверные различия по сравнению с группой ЧМТ; && p < 0.01 – достоверные различия по сравнению с контрольной группой.
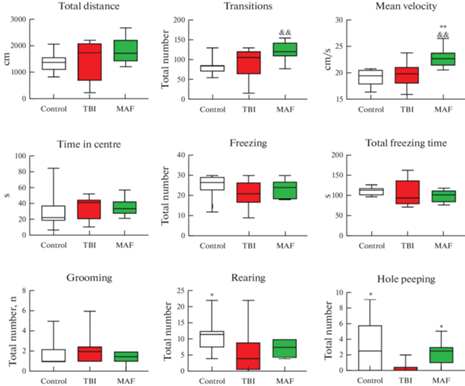
Рис. 3.
Результаты оценки функции передней и задней контрлатеральных конечностей крыс контрольной группы (Control, n = 10), группы ЧМТ (TBI, n = 9) и группы ЧМТ + Мафедин (MAF, n = 9) в тестах “Стимулирование конечностей” (a), “Цилиндр” (b) и “Сужающаяся дорожка” (c). Данные представлены как медиана (минимальное значение; максимальное значение). CL – частота использования контрлатеральной (левой) передней конечности, FL – передняя конечность, HL – задняя конечность, SD – степень сенсомоторного дефицита, %; * p < 0.05, ** p < 0.01 – достоверные различия по сравнению с группой ЧМТ (критерий Краскела–Уоллиса с post hoc тестом по Данну). (a) – H = 22.34, p < 0.01, H = 19.67, p < 0.01 и H = 20.19, p < 0.01 для 1-, 3- и 7-го дня соответственно; (b) – H = 7.158, p < 0.05; (c) – H = 8.964, p < 0.05 и H = 12.1, p < 0.01 для передней и задней лап соответственно.

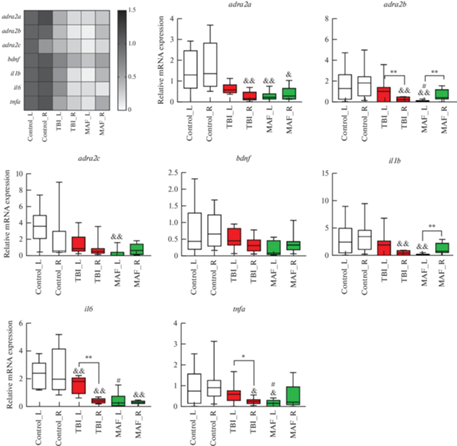
Анализ экспрессии генов методом РРТ-кПЦР (рис. 4) показал, что травматическое поражение левого полушария приводит к снижению относительного уровня экспрессии всех анализируемых генов (bdnf, il1b, il6, tnfa, adra2a, adra2b и adra2c) как в левом (травмированном), так и в правом (здоровом) полушарии на 7-е сутки после травмы. Общей закономерностью было также то, что для всех генов степень экспрессии была ниже в контрлатеральном полушарии, чем в ипсилатеральном (p < 0.05 для tnfa и p < 0.01 для il6 и adra2b). Важно отметить, что у здоровых крыс мы наблюдали выраженную межполушарную ассиметрию уровня экспрессии того или иного гена, однако при усреднении значений не было получено достоверных различий между полушариями.
Рис. 4.
Относительный уровень экспрессии генов adra2a, adra2b, adra2c, bdnf, il6, il1b, tnfa в левом (L) и правом (R) полушариях животных контрольной группы (Control, n = 10), ЧМТ (TBI, n = 9) и группы ЧМТ + Мафедин (MAF, n = 9). Слева представлена тепловая карта уровня экспрессии анализируемых генов, за 100% взяты соответствующие значения левого полушария контрольной группы. Данные на диаграммах представлены как медиана (минимальное значение; максимальное значение). *p < 0.05, **p < 0.01 – достоверные различия между полушариями (критерий Краскела–Уоллиса с post hoc тестом по Данну); & p < 0.05, && p < 0.01 – достоверные различия по сравнению с соответствующим полушарием контрольной группы (критерий Краскела–Уоллиса с post hoc тестом по Данну), # p < 0.05 – достоверное отличие от значений группы ЧМТ в соответствующем полушарии (критерий Краскела–Уоллиса с post hoc тестом по Данну). Для сравнения относительного уровня экспрессии генов между полушариями в пределах одной группы использовали критерий Вилкоксона–Манна–Уитни. adra2a: H = 12.35, p < 0.01 и H = 14.37, p < 0.01 для Control_L vs. TBI_L vs. MAF_L и Control_R vs. TBI_R vs. MAF_R; adra2b: H = 18.83, p < 0.01 и H = 10.97, p < 0.01 для Control_L vs. TBI_L vs. MAF_L и Control_R vs. TBI_R vs. MAF_R; adra2c: H = 16.44, p < 0.01 и H = 2.361, p = 0.3071 для Control_L vs. TBI_L vs. MAF_L и Control_R vs. TBI_R vs. MAF_R; bdnf: H = 4.25, p = 0.119 и H = 4.816, p = 0.09 для Control_L vs. TBI_L vs. MAF_L и Control_R vs. TBI_R vs. MAF_R; il1b: H = 8.352, p < 0.05 и H = 10.71, p < 0.01 для Control_L vs. TBI_L vs. MAF_L и Control_R vs. TBI_R vs. MAF_R; il6: H = 16.47, p < 0.01 и H = 19.22, p < 0.01 для Control_L vs. TBI_L vs. MAF_L и Control_R vs. TBI_R vs. MAF_R; tnfa: H = 8.998, p < 0.05 и H = 7.551, p < 0.05 для Control_L vs. TBI_L vs. MAF_L и Control_R vs. TBI_R vs. MAF_R.
Курсовое 7-дневное введение мафедина увеличивало среднюю скорость передвижения (p < 0.01) и число заглядываний в норки (p < 0.05) в тесте ОП у травмированных крыс по сравнению с животными без лечения. Кроме того, данной группой было совершено большее число переходов (p < 0.01), и у них была выше средняя скорость (p < 0.01) по сравнению с контрольной группой. В тестах “Стимулирование конечностей” и “Цилиндр” не было отмечено значимого положительного эффекта мафедина, однако в последнем случае наблюдалась тенденция к увеличению частоты использования контрлатеральной конечности у группы, получавшей лечение. Степень сенсомоторного дефицита задней контрлатеральной конечности в тесте СД была ниже (p < 0.05) у крыс, которым вводили мафедин, по сравнению с группой ЧМТ.
Аналогично группе травмированных животных без лечения, у крыс, которым после травмы вводили мафедин, было выраженное снижение уровня экспрессии всех анализируемых генов (рис. 4) в обоих полушариях по сравнению с контрольной группой. Однако в противоположность группе ЧМТ у животных, которым вводили мафедин, для большинства генов (за исключением il6) уровень экспрессии был выше в правом, здоровом, полушарии, чем в левом, травмированном (p < 0.01 для adra2b и il1b). При сравнении значений показателей между группами было получено, что уровень экспрессии adra2b, tnfa и il6 в левом полушарии у группы мафедина был значимо ниже (p < 0.05 во всех случаях) по сравнению с группой без лечения.
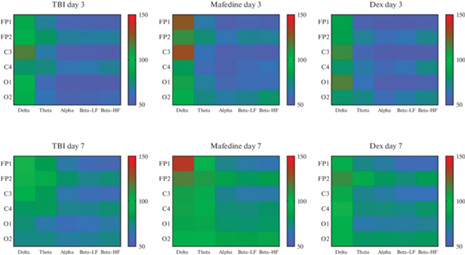
Рис. 5.
Тепловая карта значений средней амплитуды δ-, θ-, α-, а также низко- и высокочастотных β-ритмов в отведениях FP1, FP2, C3, C4, O1 и O2 у животных экспериментальных групп на 3-и и 7-е сутки после травмы. TBI – травмированные крысы без лечения, Mafedine – травмированные крысы, которым ежедневно вводили мафедин в дозе 2.5 мг/кг в течение 7 дней, Dex – травмированные крысы, которым ежедневно вводили агонист α2-адренорецепторов дексмедетомидин (препарат сравнения) в дозе 25 мкг/кг в течение 7 дней. За 100% приняты соответствующие значения группы условно здоровых крыс. Рисунок взят из ранее опубликованной работы авторов [15].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящем исследовании было установлено, что курсовое 7-дневное введение мафедина крысам, перенесшим ЧМТ, увеличивает локомоторную и поисково-исследовательскую активность последних в тесте ОП на 7-е сутки после операции. Эти данные согласуются с результатами, полученными в ходе двух предыдущих серий экспериментов [14], в первой из которых была подобрана эффективная доза мафедина и было проведено сравнение с активностью другого агониста α2-адренорецепторов клонидина, а во второй оценивались эффекты мафедина на фоне введения антагониста α2-адренорецепторов йохимбина. В обоих случаях мафедин в дозе 2.5 мг/кг увеличивал общую двигательную активность (вычисляемую как сумму пересечений квадратов, стоек, заглядываний в норки и грумингов) крыс с ЧМТ в тесте ОП по сравнению с контролем на 3-и сутки после операции.
Стоит отметить, что в данной работе поведение крыс с ЧМТ мало отличалось от такового контрольных животных, и значимые различия между группами были получены только по двум показателям: количеству стоек и заглядываний в норки. В прошлых сериях экспериментов [14] снижение общей двигательной активности у травмированных крыс на 3-и сут после операции всегда было статистически значимо. Аналогичные изменения поведения травмированных животных были получены и при изучении других молекул [17, 21]. Вероятно, это связано с тем, что в настоящей серии мы тестировали крыс в ОП на 7-е, а не на 3-и сут после травмы, и спонтанное восстановление локомоторной активности, характеризуемой такими показателями, как пройденная дистанция, число пересеченных квадратов, средняя скорость, а также число замираний и их общее время, уже произошло [23].
Кроме того, в настоящей работе было еще два дополнительных отличия экспериментальных условий от прошлых серий. Во-первых, используемый инъекционный наркотик хлоралгидрат был заменен на менее токсичный тилетамин/золазепам [24, 25], и, во-вторых, было использовано новое устройство для нанесения дозируемого удара по области сенсомоторной коры (табл. 2). При сопоставлении параметров нанесения травмы можно сделать вывод, что в настоящем исследовании ЧМТ была более тяжелой, а значит, выраженность неврологического дефицита во всех тестах должна была быть выше, чем в прошлых экспериментах. Несмотря на то, что степень сенсомоторного дефицита у крыс с ЧМТ в тесте “Стимулирование конечностей” в данной работе была аналогична таковой в предыдущих сериях (результаты теста были использованы как критерий успешности моделирования ЧМТ), в тесте СД этот показатель был в несколько раз ниже для обеих лап, что свидетельствует о более быстром спонтанном восстановлении сенсомоторных функций. Можно сделать вывод, что в настоящем исследовании было большее повреждение левого полушария, однако к 7-му дню степень восстановления сенсомоторных функций передней и задней контрлатеральных лап была выше. Наиболее вероятным объяснением такой особенности является нейропротекторное действие тилетамина и золазепама, используемых для наркотизации крыс перед операцией. Несмотря на то, что и хлоралгидрат, и тилетамин/золазепам обладают нейропротекторным действием [26, 27], при сравнении их эффективности на модели ишемии–реперфузии методом окклюзии среднемозговой артерии у крыс было показано, что второе средство является более активным [27]. У животных, которым вводили тилетамин/золазепам в дозе 40 мг/кг за 24 ч до моделирования ишемии, происходило более быстрое восстановление двигательных функций в тесте “Стимулирование конечностей”, а также был меньше объем инфаркта и выраженность отека мозга. Таким образом, менее выраженное нейропротекторное действие мафедина в настоящей серии можно связать с тем, что, во первых, тестирование травмированных крыс в тесте ОП проводилось в более поздний период после ЧМТ, а во вторых, используемый наркоз мог маскировать эффекты изучаемого соединения за счет собственного нейропротекторного действия.
Таблица 2.
Сравнение параметров устройств для моделирования черепно-мозговой травмы у крыс, используемых в прошлых экспериментальных сериях [14, 15, 17, 22] и в настоящем исследовании
| Параметр | Прошлые экспериментальные серии | Настоящее исследование |
|---|---|---|
| Диаметр травмирующей поверхности, мм | 3 | 4 |
| Ход травмирующей поверхности, мм | 4 | 5 |
| Высота падения груза, см | 10 | 22 |
| Масса груза, г | 50 | 60 |
| Форма ударной поверхности | Цилиндрическая | Сферическая |
Влияние агонистов α2-адренорецепторов на течение патологических процессов при ишемическом или травматическом поражении головного мозга было неоднократно показано в экспериментах на грызунах [7–9, 28]. Первоначально в качестве предполагаемых механизмов нейропротекторного действия данной группы препаратов рассматривали: снижение избыточного выброса возбуждающих медиаторов за счет действия на пресинаптические α2-адренорецепторы, блокаду потенциалзависимых кальциевых каналов, активацию G-белок-связанных К+-каналов внутреннего выпрямления, ингибирование аденилат- и гуанилатциклазы или развитие системной гипотермии [9, 29]. Позже множество работ продемонстировали способность дексмедетомидина снижать интенсивность воспалительных процессов в области травмы, нормализовать функцию гематоэнцефалического барьера, уменьшать отек головного мозга, а также ингибировать процесс апоптоза нейронов и препятствовать аутофагии [10]. Особое внимание экспериментальные исследования уделили влиянию препарата на работу сигнального пути TLR4/MyD88/NF-κB, продуцирующего цитокины, способные вызывать повреждение нервной системы, такие как ИЛ-1β, ИЛ-6, и ФНО-α [30, 31]. В связи с этим в качестве потенциальных мишеней действия мафедина в настоящем исследовании были выбраны именно эти медиаторы воспаления.
В отличие от данной работы, в большинстве других исследований с использованием модели ЧМТ у крыс экспрессию ИЛ-1β, ИЛ-6 и ФНО-α изучали в течение первых 3 дней после травмы. Это связано с тем, что выброс провоспалительных цитокинов происходит в острый период после ЧМТ, что было наглядно продемонстрировано в работе Dalgard и соавт. [33]. В этом исследовании также было показано, что увеличение количества провоспалительных цитокинов происходит в большей степени в травмированном полушарии. Аналогично в экспериментах на мышах линии C57BL/6 [33] ЧМТ вызывала увеличение уровня ИЛ-1β, ИЛ-6 (и экспрессии генов, и белков) в травмированном полушарии с 1-го по 7-й дни после травмы, однако этот подъем был выше в ипсилатеральном полушарии по сравнению с контрлатеральным. Кроме того, в последней работе было отмечено некоторое снижение уровня мРНК ИЛ-1β к 20-му дню после травмы.
Неожиданное снижение уровня экспрессии провоспалительных цитокинов у крыс с ЧМТ по сравнению с контрольной группой в настоящей работе может быть связано с нейропротекторным действием используемого наркозного агента, о котором было упомянуто ранее. Dalgard и соавт. [33] и Lagraoui и соавт. [34] использовали в своей работе смесь 2% изофлурана и 98% кислорода, которая, вероятно, не оказывает выраженного влияния на экспрессию провоспалительных цитокинов. Тем не менее, несмотря на некоторые отличия в настоящей работе изменений экспрессии ИЛ-1β, ИЛ-6 и ФНО-α у крыс после травмы от результатов работ других авторов, эффекты мафедина являются выраженными и в большинстве случаев статистически значимыми. Изучаемое соединение подавляло уровень ИЛ-1β, ИЛ-6 и ФНО-α в травмированном полушарии у крыс по сравнению с животными без лечения, при этом экспрессия ИЛ-1β в контрлатеральном полушарии увеличивалась по сравнению с ипсилатеральным, Данную особенность действия мафедина, безусловно, нельзя однозначно трактовать как положительный или отрицательный эффект. Тем не менее, полученные данные позволяют предположить, что изучаемое соединение может оказывать влияние на воспалительные процессы в коре головного мозга у крыс после травмы.
Нейротрофические факторы, в особенности нейротрофический фактор мозга BDNF, играют важную роль в восстановительных процессах после ЧМТ, обеспечивая выживание нейронов, аксональный спраутинг и синаптогенез [34]. Ввиду этого данный трофический фактор стал объектом пристального изучения исследователей, занимающихся нейропротекцией. В экспериментальных работах на грызунах была выявлена положительная корреляция между индукцией (белка или мРНК) BDNF в тканях мозга, а также снижением степени неврологического дефицита у животных в поведенческих или функциональных тестах (Neurological severity score, водный лабиринт Морриса, “Сужающаяся дорожка” и др.) [34]. Также было показано, что у людей полиморфизм гена BDNF может влиять на исход перенесенной травмы мозга [35, 36], однако механизмы этого влияния остаются неизученными. Ввиду этого увеличение экспрессии BDNF при терапевтическом или фармакологическом воздействии принято рассматривать как проявление нейропротекторного эффекта. Стоит отметить, что экспрессия BDNF может меняться с течением времени после травмы, а также в зависимости от анализируемой области мозга [34]. Например, показано, что в первые несколько дней после ЧМТ (острый период) она увеличивается в областях коры и гиппокампа, расположенных ипсилатерально к месту повреждения. На 7-е сутки (хронический период) уровень BDNF в указанных областях снижается, что было продемонстрировано и в данном исследовании. Несмотря на то, что в настоящей работе не было получено достоверных различий между экспериментальными группами и полушариями, из приведенных диаграмм видно, что ЧМТ приводит к снижению экспрессии BDNF в обоих полушариях, причем у крыс с травмой без лечения это снижение более выражено в контрлатеральном полушарии. Введение мафедина крысам после ЧМТ обращает данную закономерность, и делает характер изменения экспрессии BDNF схожим с таковым ИЛ-1β, ИЛ-6 и ФНО-α, что можно рассматривать как следствие влияния изучаемого соединения также на BDNF-зависимые нейропластические процессы в головном мозге у крыс после ЧМТ.
На сегодняшний день известно, что различные подтипы α2-адренорецепторов принимают участие в регуляции артериального давления, передачи болевых импульсов на разных уровнях, реализации седативного эффекта агонистов α2-адренорецепторов и в некоторых других физиологических функциях [37]. С точки зрения центральной нервной системы, поведения и когнитивных функций наибольший интерес представляют α2С-адренорецепторы, так как показано, что они участвуют в регуляции локомоторной активности [38], обработке сенсорной информации [39], пространственной и непространственной памяти [40]. Также было показано, что мыши с нокаутом гена α2С-адренорецепторов имеют усиленный стартл-рефлекс, сниженное препульсивное ингибирование и бóльшую агрессию, индуцированную изоляцией [41]. Ввиду вышеперечисленного наиболее вероятно, что нейропротекторные эффекты агонистов α2-адренорецепторов могут быть реализованы за счет активации именно 2С-подтипа. Однако если рассматривать основой нейропротекторного действия данных препаратов блокаду глутаматной эксайтотоксичности, то в таком случае предполагаемыми мишениями становятся не только 2С-рецепторы, но и 2А-, поскольку оба подтипа являются пресинаптически расположенными ауторецепторами [42]. Несмотря на это, в настоящей работе характер экспрессии всех трех подтипов α2-адренорецепторов в головном мозге у крыс после ЧМТ был одинаковым и более того, аналогичен таковому ИЛ-1β, ИЛ-6, ФНО-α и BDNF. Вероятно, это сходство обусловлено тем, что α2-адренорецепторы, медиаторы воспаления и BDNF патогенетически связаны между собой, и индукция их экспрессии происходит последовательно в рамках общего патологического каскада. При этом, исходя из полученных данных, все 3 подтипа практически в равной степени участвуют в данном каскаде. Влияние мафедина было статистически значимо на уровень экспрессии 2B-подтипа, тем не менее для других подтипов общая закономерность также прослеживалась.
В экспериментальной серии, посвященной влиянию мафедина на биоэлектрическую активность головного мозга у крыс, перенесших ЧМТ [15], прослеживалась закономерность, при которой у крыс, которым ежедневно вводили мафедин в дозе 2.5 мг/кг в течение 7 дней была выше средняя амплитуда δ-ритмов в травмированной области (отведения FP1 и C3). При этом к 7-му дню после операции в отдаленных областях от травмы (отведения FP2, C4, O1 и O2) значения регистрируемых ритмов приближались к значениям здоровых крыс. Выраженный подъем активности δ-ритма является индикатором органических поражений (например, ЧМТ или инсульта) головного мозга у крыс [14, 43]. Таким образом, полученные данные показали, что мафедин, с одной стороны, улучшает состояние областей головного мозга, отдаленных от места травмы, а с другой стороны, вероятно, усугубляет течение патологических процессов в области повреждения. Это предположение согласуется с изменениями экспрессии анализируемых генов, представленными в настоящем исследовании. Представляется вероятным вывод, что мафедин способен ухудшать состояние травмированной области головного мозга у крыс при ЧМТ, при этом активируя компенсаторные механизмы в областях, отдаленных от места травмы, например, каудальные области коры травмированного полушария, либо противоположное, нетравмированное полушарие. Возможности функциональной реорганизации и аксонального спраутинга здоровых, сохраненных областей головного мозга грызунов при органических повреждениях были неоднократно показаны, например, на моделях ишемического инсульта [44, 45]. Однако, безусловно, для доказательства способности мафедина влиять на нейропластические процессы в головном мозге после травмы требуются дополнительные исследования с использованием иммуногистохимических методов исследований и применения специальных методов окраски и мечения новых синаптических связей.
Таким образом, проведенными исследованиями установлено, что мафедин при введении в дозе 2.5 мг/кг в течение 7 дней после ЧМТ у крыс уменьшает степень неврологического дефицита у травмированных животных, проявляющегося в снижении исследовательской активности, а также нарушении двигательной функции передних и задних конечностей. При анализе уровня экспрессии генов ИЛ-1β, ИЛ-6, ФНО-α, BDNF, а также подтипов α2-адренорецепторов в коре травмированного и здорового полушарий головного мозга было получено, что изучаемое соединение подавляет экспрессию всех анализируемых генов в травмированном полушарии. При этом в противоположном, здоровом полушарии экспрессия данных генов увеличивается, это, вероятно, связано с развитием компенсаторных механизмов нейропластичности, что в некоторой степени согласуется с ранее полученными данными о влиянии мафедина на биоэлектрическую активность головного мозга у крыс после ЧМТ. Полученные результаты позволяют аргументированно предположить, что дальнейшее изучение молекулярных механизмов действия мафедина должно быть направлено на изучение способности соединения влиять на количество и функциональную активность белков, кодируемых изучаемыми в настоящей работе генами, у крыс при травматическом поражении головного мозга. Особый интерес представляет изучение способности мафедина инициировать в головном мозге после ЧМТ нейропластические изменения, приводящие к положительному функциональному исходу у травмированных животных.
Список литературы
Faul M, Coronado V (2015) Epidemiology of traumatic brain injury. Handb Clin Neurol 127: 3–13. https://doi.org/10.1016/B978-0-444-52892-6.00001-5
Saini V, Guada L, Yavagal DR (2021) Global Epidemiology of Stroke and Access to Acute Ischemic Stroke Interventions. Neurology 97(20 Suppl 2): S6–S16. https://doi.org/10.1212/WNL.0000000000012781
Gao Z, Pang Z, Chen Y, Lei G, Zhu S, Li G, Shen Y, Xu W (2022) Restoring After Central Nervous System Injuries: Neural Mechanisms and Translational Applications of Motor Recovery. Neurosci Bull 38(12): 1569–1589. https://doi.org/10.1007/s12264-022-00959-x
Rochmah TN, Rahmawati IT, Dahlui M, Budiarto W, Bilqis N (2021) Economic Burden of Stroke Disease: A Systematic Review. Int J Environ Res Public Health 18(14): 7552. https://doi.org/10.3390/ijerph18147552
Xu SY, Pan SY (2013) The failure of animal models of neuroprotection in acute ischemic stroke to translate to clinical efficacy. Med Sci Monit Basic Res 19: 37–45. https://doi.org/10.12659/msmbr.883750.
Marklund N, Hillered L (2011) Animal modelling of traumatic brain injury in preclinical drug development: where do we go from here? Br J Pharmacol 164(4): 1207–1229. https://doi.org/10.12659/msmbr.883750
Hoffman WE, Cheng MA, Thomas C, Baughman VL, Albrecht RF (1991) Clonidine decrease plasma catecholamines and improves outcome from incomplete ischemia in the rat. Anesth Analg 73: 460–464. https://doi.org/10.1213/00000539-199110000-00016
Hoffman WE, Kochs E, Werner C, Thomas C, Albrecht RF (1991) Dexmedetomidine improves neurologic outcome from incomplete ischemia in the rat: Reversal by the alpha-2 – adrenergic antagonist atipamezole. Anesthesiology 75: 328–332. https://doi.org/10.1097/00000542-199108000-00022
Zhang Y, Kimelberg HK (2005) Neuroprotection by alpha 2-adrenergic agonists in cerebral ischemia. Curr Neuropharmacol 3(4): 317–323. https://doi.org/10.2174/157015905774322534
Hu Y, Zhou H, Zhang H, Sui Y, Zhang Z, Zou Y, Li K, Zhao Y, Xie J, Zhang L (2022) The neuroprotective effect of dexmedetomidine and its mechanism. Front Pharmacol 13: 965661. https://doi.org/10.3389/fphar.2022.965661
Jiang L, Hu M, Lu Y, Cao Y, Chang Y, Dai Z (2017) The protective effects of dexmedetomidine on ischemic brain injury: A meta-analysis. J Clin Anesth 40: 25–32. https://doi.org/10.1016/j.jclinane.2017.04.003
Luo X, Zheng X, Huang H (2016) Protective effects of dexmedetomidine on brain function of glioma patients undergoing craniotomy resection and its underlying mechanism. Clin Neurol Neurosurg 146: 105–108. https://doi.org/10.1016/j.clineuro.2016.05.004
Bindra A, Kaushal A, Prabhakar H, Chaturvedi A, Chandra PS, Tripathi M, Subbiah V, Sathianathan S, Banerjee J, Prakash C (2019) Neuroprotective role of dexmedetomidine in epilepsy surgery: A preliminary study. Neurol India 67(1): 163–168. https://doi.org/10.4103/0028-3886.253616
Сысоев ЮИ, Дагаев СГ, Кубарская ЛГ, Гайкова ОН, Узуегбунам БЧ, Модисе К, Маквана ТЛ, Оковитый СВ (2019) Нейропротекторная активность агониста альфа-2 адренорецепторов мафедина на модели черепно-мозговой травмы у крыс. Биомедицина 15(1): 62–77. [Sysoev YuI, Dagaev SG, Kubarskaja LG, Gaikova ON, Uzuegbunam BC, Modise K, Makwana TL, Okovitiy SV (2019) Study of the neuroprotective activity of mafedine, an alpha-2 adrenergic receptor agonist, by modeling a traumatic brain injury in rats. J Biomed 15(1): 62–77. (In Russ)]. https://doi.org/10.33647/2074-5982-15-1-62-77
Sysoev YI, Prikhodko VA, Chernyakov RT, Idiyatullin RD, Musienko PE, Okovityi SV (2021) Effects of Alpha-2 Adrenergic Agonist Mafedine on Brain Electrical Activity in Rats after Traumatic Brain Injury. Brain Sci 11(8): 981. https://doi.org/10.3390/brainsci11080981
Paxinos G, Watson C (2013) The Rat Brain in Stereotaxic Coordinates. 7th ed. Cambridge. MA. USA. Acad Press.
Приходько ВА, Кан АВ, Сысоев ЮИ, Титович ИА, Анисимова НА, Оковитый СВ (2021) Оценка нейропротекторной активности нового производного аллилморфолина на модели черепно-мозговой травмы у крыс. Разработка и регистрация лекарственных средств 10(4–1): 179–187. [Prikhodko VA, Kan AV, Sysoev YuI, Titovich IA, Anisimova NA, Okovityi SV (2021) Evaluation of the neuroprotective activity of a new allylmorpholine derivative in a rat model of traumatic brain injury. Drug development & registrat 10(4–1): 179–187. (In Russ)]. https://doi.org/10.33380/2305-2066-2021-10-4(1)-179-187
Rouhani F, Khodarahmi P, Naseh V (2019) NGF, BDNF and Arc mRNA Expression in the Hippocampus of Rats After Administration of Morphine. Neurochem Res 44(9): 2139–2146. https://doi.org/10.1007/s11064-019-02851-z
Lu H, Zhou J (2008) HBV X gene transfection upregulates IL-1beta and IL-6 gene expression and induces rat glomerular mesangial cell proliferation. J Huazhong Univ Sci Technolog Med Sci 28(3): 247–250. https://doi.org/10.1007/s11596-008-0304-5
Wang AL, Yu AC, He QH, Zhu X, Tso MO (2007) AGEs mediated expression and secretion of TNF alpha in rat retinal microglia. Exp Eye Res 84(5): 905–913. https://doi.org/10.1016/j.exer.2007.01.011
Zhang Y, Kolli T, Hivley R, Jaber L, Zhao FI, Yan J, Herness S (2010) Characterization of the expression pattern of adrenergic eceptors in rat taste buds. Neuroscience 169(3): 1421–1437. https://doi.org/10.1016/j.neuroscience.2010.05.021
Sysoev YI, Uzuegbunam BC, Okovityi SV (2019) Attenuation of neurological deficit by a novel ethanolamine derivative in rats after brain trauma. J Exp Pharmacol 11: 53–63. https://doi.org/10.2147/JEP.S199464
Niskanen JP, Airaksinen AM, Sierra A, Huttunen JK, Nissinen J, Karjalainen PA, Pitkänen A, Gröhn OH (2013) Monitoring functional impairment and recovery after traumatic brain injury in rats by FMRI. J Neurotrauma 30(7): 546–556. https://doi.org/10.1089/neu.2012.2416
Fleischman RW, McCracken D, Forbes W (1977) Adynamic ileus in the rat induced by chloral hydrate. Lab Anim Sci 27: 238–243.
Ogino K, Hobara T, Kobayashi H, Iwamoto S (1990) Gastric mucosal injury induced by chloral hydrate. Toxicol Lett 52: 129–133. https://doi.org/10.1016/0378-4274(90)90146-d
Liu JH, Feng D, Zhang YF, Shang Y, Wu Y, Li XF, Pei L (2015) Chloral Hydrate Preconditioning Protects Against Ischemic Stroke via Upregulating Annexin A1. CNS Neurosci Ther 21(9): 718–726. https://doi.org/10.1111/cns.12435
Силачев ДН, Усатикова ЭА, Певзнер ИБ, Зорова ЛД, Бабенко ВА, Гуляев МВ, Пирогов ЮА, Плотников ЕЮ, Зоров ДБ (2017) Влияние наркозных препаратов на эффективность удаленного ишемического прекондиционирования. Биохимия 82(9): 1296–1308. [Silachev DN, Usatikova EA, Pevzner IB, Zorova LD, Babenko VA, Gulyaev MV, Pirogov YA, Plotnikov EY, Zorov DB (2017) Impact of anesthetics on efficiency of remote ischemic preconditioning. Biochemistry (Moscow) 82(9): 1296–1308. (In Russ)].
Liu H, Li J, Jiang L, He J, Zhang H, Wang K (2022) Dexmedetomidine pretreatment alleviates cerebral ischemia/reperfusion injury by inhibiting neuroinflammation through the JAK2/STAT3 pathway. Braz J Med Biol Res 55: e12145. https://doi.org/10.1590/1414-431X2022e12145
Ma D, Rajakumaraswamy N, Maze M (2005) Alpha2-Adrenoceptor agonists: shedding light on neuroprotection? Br Med Bull 71: 77–92. https://doi.org/10.1093/bmb/ldh036
Wang D, Xu X, Wu YG, Lyu L, Zhou ZW, Zhang JN (2018) Dexmedetomidine attenuates traumatic brain injury: Action pathway and mechanisms. Neural Regen Res 13(5): 819–826. https://doi.org/10.4103/1673-5374.232529
Huang GR, Hao FG (2021) Dexmedetomidine inhibits inflammation to alleviate early neuronal injury via TLR4/NF-κB pathway in rats with traumatic brain injury. Crit Rev Eukaryot Gene Expr 31(1): 41–47. https://doi.org/10.1615/CritRevEukaryotGeneExpr.2021037390
Dalgard CL, Cole JT, Kean WS, Lucky JJ, Sukumar G, McMullen DC, Pollard HB, Watson WD (2012) The cytokine temporal profile in rat cortex after controlled cortical impact. Front Mol Neurosci 5: 6. https://doi.org/10.3389/fnmol.2012.00006
Lagraoui M, Latoche JR, Cartwright NG, Sukumar G, Dalgard CL, Schaefer BC (2012) Controlled cortical impact and craniotomy induce strikingly similar profiles of inflammatory gene expression, but with distinct kinetics. Front Neurol 3: 155. https://doi.org/10.3389/fneur.2012.00155
Gustafsson D, Klang A, Thams S, Rostami E (2021) The Role of BDNF in Experimental and Clinical Traumatic Brain Injury. Int J Mol Sci 22(7):3582. https://doi.org/10.3390/ijms22073582
Wang YJ, Chen KY, Kuo LN, Wang WC, Hsu YW, Wong HS, Lin CM, Liao KH, Zhang YF, Chiang YH, Chang WC (2018) The association between BDNF Val66Met polymorphism and emotional symptoms after mild traumatic brain injury. BMC Med Genet 19(1): 13. https://doi.org/10.1186/s12881-017-0518-0
Treble-Barna A, Wade SL, Pilipenko V, Martin LJ, Yeates KO, Taylor HG, Kurowski BG (2022) Brain-derived neurotrophic factor Val66Met and neuropsychological functioning after early childhood traumatic brain injury. J Int Neuropsychol Soc 25: 1–11. https://doi.org/10.1017/S1355617722000194
Philipp M, Brede M, Hein L (2002) Physiological significance of alpha(2)-adrenergic receptor subtype diversity: one receptor is not enough. Am J Physiol Regul Integr Comp Physiol 283(2): R287–R295. https://doi.org/10.1152/ajpregu.00123.2002
Sallinen J, Haapalinna A, Viitamaa T, Kobilka BK, Scheinin M (1998) D-Amphetamine and L‑5-hydroxytryptophan-induced behaviours in mice with genetically-altered expression of the alpha2C-adrenergic receptor subtype. Neuroscience 86: 959–965. https://doi.org/10.1016/s0306-4522(98)00100-6
Scheinin M, Sallinen J, Haapalinna A (2001) Evaluation of the 2C-adrenoceptor as a neuropsychiatric drug target studies in transgenic mouse models. Life Sci 68: 2277–2285. https://doi.org/10.1016/s0024-3205(01)01016-5
Bjorklund M, Sirvio J, Puolivali J, Sallinen J, Jakala P, Scheinin M, Kobilka BK, Riekkinen P Jr (1998) Alpha2C-Adrenoceptor-overexpressing mice are impaired in executing nonspatial and spatial escape strategies. Mol Pharmacol 54: 569–576. https://doi.org/10.1124/mol.54.3.569
Sallinen J, Haapalinna A, Viitamaa T, Kobilka BK, Scheinin M (1998) Adrenergic Alpha2C-receptors modulate the acoustic startle reflex, prepulse inhibition, and aggression in mice. J Neurosci 18: 3035–3042. https://doi.org/10.1523/JNEUROSCI.18-08-03035.1998
Hein L, Altman JD, Kobilka BK (1999) Two functionally distinct alpha2-adrenergic receptors regulate sympathetic neurotransmission. Nature 402: 181–184. https://doi.org/10.1038/46040
Sysoev YI, Prikhodko VA, Kan AV, Titovich IA, Karev VE, Okovityi SV (2022) Changes in Brain Electrical Activity after Transient Middle Cerebral Artery Occlusion in Rats. Neurol Int 14(3): 547–560. https://doi.org/10.3390/neurolint14030044
Okabe N, Shiromoto T, Himi N, Lu F, Maruyama-Nakamura E, Narita K, Iwachidou N, Yagita Y, Miyamoto O (2016) Neural network remodeling underlying motor map reorganization induced by rehabilitative training after ischemic stroke. Neuroscience 339: 338–362. https://doi.org/10.1016/j.neuroscience.2016.10.008
Okabe N, Shiromoto T, Himi N, Lu F, Maruyama-Nakamura E, Narita K, Iwachidou N, Yagita Y, Miyamoto O (2016) Neural network remodeling underlying motor map reorganization induced by rehabilitative training after ischemic stroke. Neuroscience 339: 338–362. https://doi.org/10.1016/j.neuroscience.2016.10.008
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


