Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 4, стр. 545-558
Влияние длительного эмоционально-болевого стресса на экспрессию генов провоспалительных цитокинов у крыс с высокой и низкой возбудимостью нервной системы
И. Г. Шалагинова 1, *, О. П. Тучина 1, А. В. Туркин 1, А. Э. Вылегжанина 1, А. Н. Нагуманова 1, Т. Г. Зачепило 2, М. Б. Павлова 2, Н. А. Дюжикова 2
1 Балтийский федеральный университет им. И. Канта
Калининград, Россия
2 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: shalaginova_i@mail.ru
Поступила в редакцию 24.01.2023
После доработки 14.02.2023
Принята к публикации 14.02.2023
- EDN: VJNHJJ
- DOI: 10.31857/S0869813923040088
Аннотация
Стресс играет важную роль в патогенезе тревожных и депрессивных расстройств. Нейровоспаление рассматривают как один из механизмов, с помощью которых стресс изменяет молекулярную и клеточную пластичность в нервной ткани, что приводит к нарушению функций ЦНС. Вклад генетически детерминированных особенностей нервной системы в развитие постстрессорного нейровоспаления изучен недостаточно. В данном исследовании оценена динамика постстрессорных изменений уровня мРНК генов il1β и tnf провоспалительных цитокинов интерлейкина-1-бета (ИЛ-1β) и фактора некроза опухоли (ФНО) в крови и в головном мозге у двух линий крыс с высоким и низким порогом возбудимости нервной системы (ВП и НП). Изменения уровня мРНК ИЛ-1β и ФНО оценивали с помощью ПЦР в реальном времени через сутки, 7, 24 и 60 дней после длительного эмоционально-болевого стрессирования в крови и трех структурах мозга, вовлеченных в развитие постстрессорной патологии (префронтальная кора, гиппокамп, миндалина). У высоковозбудимых крыс линии НП уровень мРНК ИЛ-1β в гиппокампе и миндалине увеличился по сравнению с контролем через 24 дня после окончания стрессирования, у низковозбудимымых животных линии ВП увеличение уровня мРНК ИЛ-1β обнаружено только в гиппокампе на том же сроке. Уровень мРНК ФНО не менялся ни у одной из линий ни в одной из временных точек после стресса. Генетически детерминированная возбудимость нервной системы является многообещающим маркером индивидуальной уязвимости к стрессу, проявляющейся в постстрессорных нарушениях, связанных с особенностями формирования и течения нейровоспаления.
ВВЕДЕНИЕ
Распространенность тревожных и депрессивных расстройств в мире колеблется от 3% до 18% по оценкам разных авторов [1, 2]. Эти показатели особенно возросли в последние два года из-за развития “постковидного синдрома” у пациентов, перенесших вирусную инфекцию COVID-19 [3].
Несмотря на социальную значимость и высокую распространенность этих расстройств, их нейробиологические механизмы в настоящее время до конца не изучены, поэтому доступные методы лечения не всегда эффективны. Одной из моделей для объяснения патогенеза данных психических расстройств является гипотеза “стресс–диатез”, где под диатезом понимают наличие биологической (генетической) уязвимости, которая может привести к проявлению заболевания под влиянием внешних стрессоров [4]. Однако точные механизмы того, каким образом стресс приводит к постстрессорным патологиям, не выяснены. В последние годы нейровоспаление рассматривают как один из таких механизмов, с помощью которых стрессорная реакция изменяет молекулярную, эпигенетическую и, в конечном счете, клеточную пластичность таким образом, что нарушаются функции ЦНС [5].
В крови умеренные концентрации глюкокортикоидов (ГК), эквивалентные обнаруживаемым в организме во время острой реакции на стресс, оказывают провоспалительное действие, в то время как хронический стресс и высокие уровни ГК вызывают противовоспалительную реакцию. В центральной нервной системе хронический стресс и высокие уровни ГК, напротив, могут усиливать воспаление. Это проявляется как на клеточном уровне (активация микроглии, астроцитов), так и на уровне экспрессии медиаторов воспаления и активации факторов транскрипции [6, 7].
В последние годы все большее число исследований показало возможную вовлеченность постстрессорного воспаления в патогенез психических расстройств, таких как депрессия [8]. У пациентов с клинической депрессией было обнаружено увеличение количества лейкоцитов, моноцитов и нейтрофилов в периферической крови и наблюдалось повышение уровней циркулирующих провоспалительных цитокинов и белков острой фазы [9]. Воспалительная реакция, наблюдаемая в крови, может затрагивать и ЦНС, приводя к активации микроглии и астроцитов в результате инфильтрации моноцитов или из-за проникновения провоспалительных молекул через поврежденный гематоэнцефалический барьер [10]. Медиаторы воспаления, выделяемые активированной микроглией и эндотелиальными клетками мозга, также могут подавлять нейротрансмиссию, способствовать окислительному стрессу и митохондриальным дисфункциям.
Вопросы о том, как нейро-иммунные дисфункции могут быть активированы в головном мозге в отсутствие явного воспаления или инфекции, и какие генетические факторы повышают риск развития постстрессорного нейровоспаления исследованы недостаточно.
Уровень возбудимости, являющийся ключевой характеристикой функционального состояния нервной системы, рассматривается как фактор риска развития постстрессорных расстройств [11]. В Институте физиологии им. И.П. Павлова РАН в результате селекции были получены две линии крыс с разным уровнем возбудимости нервной системы [12]. Было показано, что линии различаются по своим поведенческим реакциям, молекулярным и клеточным изменениям в нервной ткани при развитии постстрессорных состояний. У крыс с низкой возбудимостью (высокий порог, линия ВП) в ответ на длительное эмоционально-болевое стрессорное воздействие наблюдаются отставленные депрессивно-подобные поведенческие симптомы, в то время как у крыс с высокой возбудимостью (низкий порог, линия НП) наряду с депрессивно-подобными, развиваются компульсивные симптомы [13].
Ранее мы показали, что уровень возбудимости нервной системы влияет также на степень проявления и динамику постстрессорного воспаления как в крови, так и в головном мозге в ответ на длительный эмоционально-болевой стресс. У высоковозбудимых животных увеличивается соотношение нейтрофилов/лейкоцитов и число клеток микроглии в гиппокампе по сравнению с контролем [13]. Необходимо уточнить молекулярные механизмы нейровоспаления на уровне экспрессии генов il1β и tnf основных провоспалительных цитокинов интерлейкина-1-бета (ИЛ‑1β) и фактора некроза опухоли (ФНО).
Цель данной работы заключалась в оценке уровня мРНК генов il1β и tnf провоспалительных цитокинов ИЛ-1β и ФНО в крови и в головном мозге (в префронтальной коре, гиппокампе и миндалине, – структурах, вовлеченных в развитие постсрессорной патологии) у крыс двух линий, различающихся по уровню возбудимости нервной системы, в норме и в разные сроки после длительного эмоционально-болевого стрессорного воздействия.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проводили на 5-месячных взрослых самцах крыс двух линий с контрастным (4-кратные различия) уровнем возбудимости периферической и центральной нервной системы [11, 14]. Животные селектированы в течение 80 поколений по величине порога возбудимости большеберцового нерва (n. tibialis) к электрическому току. Линии с высоким порогом (ВП, низкая возбудимость) и низким порогом (НП, высокая возбудимость) включены в Биоколлекцию Института физиологии им. И.П. Павлова РАН (№ ГЗ 0134-2018-0003), патенты на селекционное достижение № 10769 и 10768 выданы Государственной комиссией Российской Федерации по испытанию и охране селекционных достижений, зарегистрированы в Государственном реестре охраняемых селекционных достижений 15 января 2020 г. (Патентообладатель: ФГБУН Институт физиологии им. И.П. Павлова РАН).
Все животные содержались в стандартных условиях в виварии лаборатории генетики ВНД Института физиологии им. Павлова РАН. Экспериментальные животные подвергались длительному эмоционально-болевому стрессовому воздействию в соответствии со схемой К. Гехта [Hecht et al., 1972, цит. по: 12]: каждый день в течение 15 дней животные подвергались воздействию 6 неподкрепляемых (по 10 с каждое) и 6 подкрепляемых током (2.5 мА, 2 мс) световых сигналов. Согласно схеме, комбинации условных и безусловных раздражителей не повторялись, а чередовались с вероятностью 0.5, что не позволяло животным выработать условный рефлекс. В качестве контрольных использовали животных обеих исследуемых линий, не подвергавшихся процедуре стрессорного воздействия. Контрольные животные были декапитированы в те же временные сроки, что и экспериментальные.
После декапитации экспериментальных и контрольных животных кровь от каждого животного собирали в пробирки с антикоагулянтом (ЭДТА – этилендиаминтетраацетат), извлекали мозг и проводили диссекцию исследуемых структур мозга (префронтальная кора, гиппокамп и миндалина) через 24 ч, 7, 24 и 60 дней после окончания стрессового воздействия. Экспериментальные группы в каждой временной точке включали по 6 животных каждой линии. Объединенная контрольная группа линии ВП (контрольные крысы – по 4–6 животных в каждой из 4 временных точек) включала 19 животных, линии НП – 22. Общее количество животных составило 89.
Выделенный биоматериал немедленно помещали в пробирки, содержащие 500 мкл реагента для экстракции суммарной РНК (ExtractRNA, Евроген, Россия). Выделение РНК проводили в соответствии с инструкциями производителя. После этапа выделения суммарной РНК проводили измерения концентрации экстрагированной РНК для каждого отдельного образца методом спектрофотометрии (NanoDrop IMPLEN). Для обратной транскрипции использовали набор реагентов MMLV RT kit (Евроген, Россия). После обратной транскрипции реакционную смесь разбавляли деионизированной водой (5 мкл кДНК: 95 мкл воды).
Относительное количество мРНК для генов il1β и tnf оценивали с помощью ПЦР в реальном времени на приборе Bio Rad CFX96 (Bio Rad, США) с использованием смеси qPCRmix HS SYBR (Евроген, Россия). В качестве референсного использовали ген gapdh. Изменения в уровне мРНК оценивали методом ΔΔCt, основанном на анализе экспрессии целевого гена по отношению к референсному.
В табл. 1 указаны ген-специфические праймеры для генов il1β, tnf и gapdh, подобранные с помощью литературы и проверенные в базе NCBI (BLAST primer).
Таблица 1.
Праймеры к участкам генов
| Ген | Последовательность праймеров | Длина праймера (пн) | Длина продукта (пн) |
|---|---|---|---|
| il1 β | Прямой: 5′- GCAATGGTCGGGACATAGTT-3′ Обратный: 5′- GTAAGTGGTTGCCTGTCAGAG-3′ |
20 21 |
242 |
| tnf | Прямой: 5′- GAACAGCAACTCCAGAACA -3′ Обратный: 5′- CACGAGCAGGAATGAGAAG-3′ |
19 19 |
243 |
| gapdh | Прямой: 5′-GTTTGTGATGGGTGTGAACC-3′ Обратный: 5′-TCTTCTGAGTGGCAGTGATG-3′ |
20 20 |
170 |
Для проверки специфичности полученных продуктов амплификации производили анализ кривых плавления продуктов реакции.
Статистические методы
Для статистического анализа использовали программное обеспечение Prism 7. Нормальность распределения оценивали с применением критерия Шапиро–Уилка. Значимость межлинейных различий в уровне мРНК генов интереса у интактных животных оценивали с помощью критерия Манна–Уитни. При сравнении контрольных и экспериментальных групп применяли непараметрический критерий Краскела–Уоллиса с post hoc тестом Манна–Уитни, использовали поправку на множественность сравнений FDR (false discovery rate).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
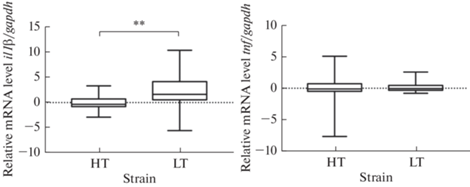
Анализ экспрессии генов провоспалительных цитокинов в крови интактных животных показывает значимо более высокий уровень мРНК гена il1β у высоковозбудимых животных НП по сравнению с низковозбудимыми ВП, разницы в уровне мРНК гена tnf не обнаружено (рис. 1).
Рис. 1.
Уровень мРНК генов il1β и tnf провоспалительных цитокинов ИЛ-1β и ФНО в крови интактных крыс линий ВП и НП с контрастной возбудимостью нервной системы. НT (high threshold, low excitable) – линия ВП( высокий порог, низкая возбудимость) (n = 22), LT (low threshold, high-excitable) – линия НП (низкий порог, высокая возбудимость) ) (n = 19) **p < 0.01 (критерий Манна–Уитни), по вертикальной оси показано относительное значение изменения уровня мРНК (–ΔΔCt), графики представляют медианы, границы квартилей, а также максимальные и минимальные значения анализируемых данных.
Далее сравнение уровня мРНК в каждой структуре мозга в каждом временном сроке после стрессового воздействия проводили по отношению к объединенному контролю, так как контрольные животные, декапитированные в разные сроки не отличались по изучаемому параметру (тест Краскела–Уоллиса).
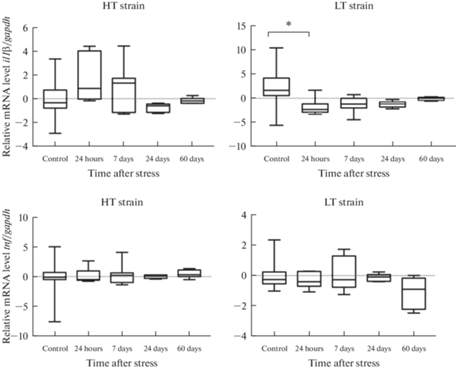
Анализ постстрессорных изменений в крови показал значимое снижение уровня мРНК гена il1β через 24 ч после окончания стрессорного воздействия и только у высоковозбудимых животных линии НП (рис. 2). Во всех остальных временных точках влияния стресса на уровень мРНК исследуемых провоспалительных цитокинов не обнаружено ни у одной из линий животных.
Рис. 2.
Уровень мРНК генов il1β и tnf провоспалительных цитокинов ИЛ-1β и ФНО в крови крыс линий ВП и НП с контрастной возбудимостью нервной системы в разные сроки после длительного эмоционально-болевого стрессорного воздействия. Здесь и далее: НТ strain (high threshold, low excitable – линия ВП – высокий порог, низкая возбудимость (n = 22 в контроле и n = 6 в экспериментальных группах в каждой временной точке), LT strain (low threshold, high excitable – линия НП – низкий порог, высокая возбудимость (n = 18 в контроле и n = 6 в экспериментальных группах в каждой временной точке), по вертикальной оси показано относительное значение изменения уровня мРНК (–ΔΔCt), графики представляют медианы, границы квартилей, а также максимальные и минимальные значения анализируемых данных (критерий Краскела–Уоллиса, post-hoc анализ критерий Манна–Уитни, поправка FDR); *p < 0.05.
Сравнение уровня мРНК исследованных генов провоспалительных цитокинов ИЛ-1β и ФНО в трех структурах мозга у интактных животных двух линий крыс с контрастной возбудимостью нервной системы представлено на рис. 3.
Рис. 3.
Уровень мРНК генов il1β и tnf провоспалительных цитокинов ИЛ-1β и ФНО в префронтальной коре, гиппокампе и миндалине интактных крыс линий ВП и НП с контрастной возбудимостью нервной системы. *p < 0.05 (критерий Манна–Уитни).
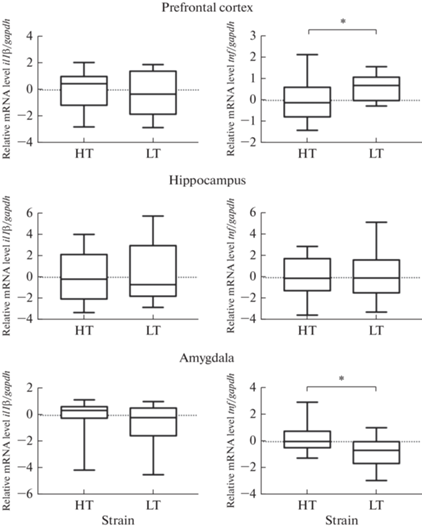
Межлинейные различия в уровне мРНК ФНО выявлены в префронтальной коре и миндалине крыс с различной возбудимостью нервной системы. Высоковозбудимые крысы линии НП имеют повышенный уровень экспрессии гена tnf по сравнению с низковозбудимыми крысами линии ВП в префронтальной коре, тогда как в миндалине, напротив, у высоковозбудимых животных линии НП уровень мРНК ФНО значимо ниже, чем у низковозбудимых линии ВП.
Анализ экспрессии генов провоспалительных цитокинов ИЛ-1β и ФНО в гиппокампе крыс линий ВП и НП показал отсутствие статистически значимых различий.
Постстрессорные изменения в уровне экспрессии генов il1β и tnf провоспалительных цитокинов ИЛ-1β и ФНО в мозге крыс с контрастным уровнем возбудимости нервной системы показаны на рис. 4–6.
Рис. 4.
Уровень мРНК генов il1β и tnf провоспалительных цитокинов ИЛ-1β и ФНО в префронтальной коре крыс линий ВП и НП с контрастной возбудимостью нервной системы в разные сроки после длительного эмоционально-болевого стрессорного воздействия (критерий Краскела–Уоллиса, post-hoc анализ критерий Манна–Уитни, поправка FDR).
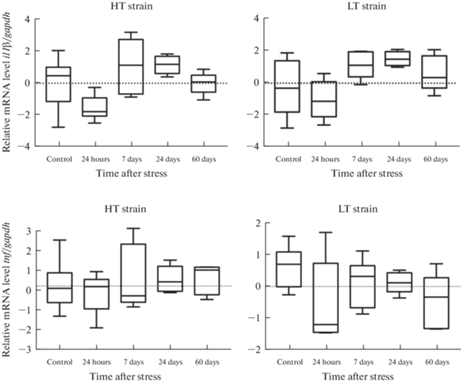
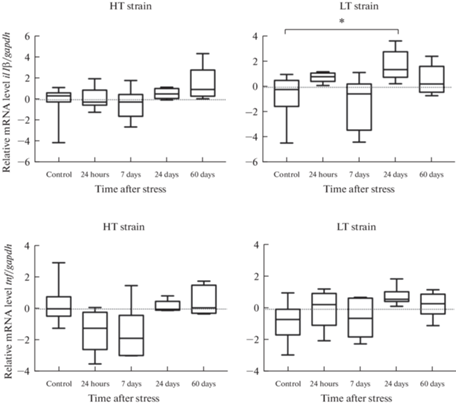
Рис. 5.
Уровень мРНК генов il1β и tnf провоспалительных цитокинов ИЛ-1β и ФНО в гиппокампе крыс линий ВП и НП с контрастной возбудимостью нервной системы в разные сроки после длительного эмоционально-болевого стрессорного воздействия (критерий Краскела–Уоллиса, post-hoc анализ критерий Манна–Уитни, поправка FDR), *p < 0.05.
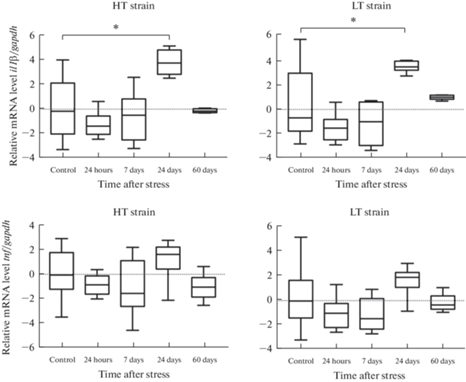
Рис. 6.
Уровень мРНК генов il1β и tnf провоспалительных цитокинов ИЛ-1β и ФНО в миндалине крыс линий ВП и НП с контрастной возбудимостью нервной системы в разные сроки после длительного эмоционально-болевого стрессорного воздействия (критерий Краскела–Уоллиса, post-hoc анализ критерий Манна–Уитни, поправка FDR), *p < 0.05.
В префронтальной коре значимых постстрессорных изменений уровня мРНК исследуемых цитокинов не обнаружено ни у одной из линий (рис. 4).
В гиппокампе через 1 и 7 дней после стресса не было обнаружено значимых различий в уровнях мРНК цитокинов по сравнению с контролем ни у одной из линий животных. Через 24 дня после стрессового воздействия уровень мРНК гена il1β в гиппокампе значимо повысился в экспериментальных группах по сравнению с контрольными у обеих линий, независимо от уровня возбудимости нервной системы крыс, однако к 60-му дню после стресса уровень мРНК гена il1β не отличался от контроля (рис. 5). Значимых постстрессорных изменений в экспрессии гена tnf у экспериментальных животных обеих линий по сравнению с контролем не наблюдали ни в одной временной точке.
У высоковозбудимых крыс линии НП стресс приводил к увеличению экспрессии гена il1β через 24 дня после окончания стрессового воздействия (рис. 6). У низковозбудимых животных линии ВП постстрессорных изменений уровня мРНК исследуемых цитокинов в миндалине не наблюдали ни в одной временной точке.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В данном исследовании выявлены межлинейные различия в уровнях мРНК провоспалительных цитокинов ИЛ-1β и ФНО у интактных крыс линий с контрастной возбудимостью нервной системы. Более высокий уровень экспрессии гена il1β был обнаружен в крови высоковозбудимых крыс линии НП по сравнению с низковозбудимыми крысами линии ВП. Это согласуется с нашими предшествующими данными о том, что у высоковозбудимых крыс развиваются признаки воспаления в крови в ответ на хронический стресс, что проявляется изменением лейкоцитарной формулы [13].
Мы не обнаружили влияния стресса на экспрессию генов изучаемых цитокинов в крови низковозбудимых крыс линии ВП ни сразу, ни в отдаленные сроки после окончания стрессирования. При этом у высоковозбудимых крыс линии НП значимое снижение уровня мРНК гена il1β в крови было выявлено через 24 ч после окончания стрессирования по сравнению с контролем. Последнее согласуется с данными о том, что длительный стресс вызывает противовоспалительную реакцию в периферической крови [7].
Известно, что связывание глюкокортикоидов (ГК) с глюкокортикоидными рецепторами (ГР) приводит к изменениям транскрипции нескольких генов, ответственных за противовоспалительный эффект глюкокортикоидов. Было показано, что противовоспалительный эффект комплекса ГК–ГР связан с репрессией таких факторов транскрипции, как NF-κB (nuclear factor kappa-light-chain-enhancer of activated B cells), активирующий белок-1 (activating protein-1, AP1) и регуляторный фактор интерферона 3 (Interferon Regulatory Factor 3, IRF3) [6]. Подавление транскрипционной активности этих генов подавляет экспрессию провоспалительных молекул.
Действие гормонов ГК в головном мозге и на периферии неодинаково. Несмотря на то, что противовоспалительный эффект ГК в головном мозге неоднократно демонстрировался, имеются данные, показывающие, что в некоторых случаях ГК, напротив, усиливают воспаление в ЦНС [7].
Длительный или очень интенсивный стресс и, соответственно, высокий уровень ГК, усиливают проявления воспаления в центральной нервной системе. Хроническое введение кортикостероидов в высоких дозах усиливает воспаление в гиппокампе животных [14]. Известно, что хронический стресс или повышенная циркуляция ГК оказывает провоспалительное действие и увеличивает экспрессию провоспалительных цитокинов ИЛ-1β и ФНО в префронтальной коре [14]. Существуют также доказательства того, что длительный стресс повышает уровни ИЛ-1β и ФНО и iNOS не только на уровне экспрессии генов, но и на уровне белка, как было продемонстрировано в гиппокампе и коре головного мозга грызунов [14, 16].
Проведенный нами анализ уровня мРНК провоспалительных цитокинов ИЛ-1β и ФНО в мозге животных с различным уровнем возбудимости нервной системы показал временную и региональную гетерогенность постстрессорных изменений. Мы не обнаружили различий в уровнях мРНК цитокинов в гиппокампе крыс двух линий на ранних сроках после стресса. Однако через 24 дня после окончания стрессового воздействия уровень мРНК ИЛ-1β в гиппокампе увеличился у экспериментальных животных обеих линий по сравнению с соответствующими контрольными группами. Полученные результаты хорошо согласуются с имеющимися в литературе данными о том, что в центральной нервной системе, в отличие от периферии, высокие дозы ГК или длительный стресс приводят к повышенной выработке медиаторов воспаления и активации микроглии [7, 17]. Ранее нами показано [13], что увеличение количества клеток микроглии наблюдается через 7 дней после стресса в зубчатой извилине (DG), CA1 и CA3 полях гиппокампа у животных линии НП, и в поле CA1 у крыс линии ВП, что не совпадает по времени с увеличением уровня экспрессии гена il1β в данной работе, которое происходит только на 24‑й день, на фоне нормализации количества клеток микроглии. Активация и пролиферация микроглии и трафик моноцитов из крови в мозг, являясь основными источниками ИЛ-1β и ФНО, происходят с некоторым латентным периодом. С этим может быть связана описанная выше задержка. С другой стороны, возможно на сроке 7 дней, несмотря на увеличение количества микроглии в гиппокампе, адаптивные механизмы позволяют сдерживать экспрессию провоспалительных цитокинов и тормозить развитие нейровоспаления через экспрессию микроРНК, регулирующих воспаление, и/или через экспрессию противовоспалительных цитокинов, например, ИЛ-10, который может стимулировать синтез антагониста ИЛ-1β (IL-1Ra). Для детального прояснения данного вопроса необходимо изучение постстрессорных изменений не только про-, но и антивоспалительных сигналов.
В других изученных областях мозга мы наблюдали линейные особенности в экспрессии генов цитокинов. Различия были обнаружены в префронтальной коре интактных крыс: высоковозбудимые животные имеют значимо более высокий уровень мРНК ФНО по сравнению с низковозбудимыми. В то же время в миндалине у крыс с высокой возбудимостью обнаружен более низкий уровень мРНК этого цитокина по сравнению с альтернативной линией. Известно, что ФНО, секретируемый в головном мозге глиальными клетками, участвует в регуляции экспрессии AMPA-рецепторов в нейронах гиппокампа и коры головного мозга. В культуре и на срезах гиппокампа было показано, что ФНО увеличивает количество AMPA-рецепторов на синаптической мембране [18]. Естественно, такое увеличение количества глутаматных рецепторов приводит к быстрым изменениям возбудимости и синаптической пластичности. ФНО также приводит к усилению эндоцитоза ГАМК-рецепторов, что приводит к снижению тормозных сигналов и также может влиять на возбудимость [19]. Эффекты, описанные выше, действительны для гиппокампа и кортикальных нейронов. Нейроны полосатого тела, напротив, демонстрируют интернализацию AMPA-рецепторов [19] в ответ на ФНО. Стереотаксические инъекции ФНО в миндалину крыс нарушают процессы запоминания страха, вероятно, действуя через NMDA-рецепторы [20].
Таким образом, в литературе описаны региональные различия в воздействии цитокинов на одни и те же физиологические процессы, и, возможно, что действие ФНО в префронтальной коре приводит к повышению возбудимости нейронов, а в миндалине, напротив, к снижению возбудимости. В этом случае можно сформулировать гипотезу о том, что конститутивно более высокий уровень ФНО в коре и более низкий уровень в миндалине у животных линии НП по сравнению с ВП способствует более высокой возбудимости первых. Экспериментальная проверка этой гипотезы представляется многообещающей в связи с тем, что ранее у крыс высоковозбудимой линии НП была обнаружена более высокая фоновая импульсация нейронов миндалины по сравнению с ВП [21].
В миндалине в ответ на стресс мы наблюдали повышенный по сравнению с контролем уровень мРНК ИЛ-1β только у высоковозбудимых животных линии НП через 24 дня после стресса. В префронтальной коре значимых изменений уровня мРНК исследованных провоспалительных цитокинов в ответ на стресс не обнаружили ни у одной из линий.
Имеется информация о специфической экспрессии про- и противовоспалительных цитокинов у двух линий крыс, различающихся по уровню агрессивности. В ответ на введение липополисахарида (ЛПС) у агрессивных крыс наблюдали повышенные уровни ИЛ-1β в гипоталамусе и лобной коре по сравнению с неагрессивными крысами. В гиппокампе уровни ИЛ-1β, ИЛ-2 и ИЛ-6 были ниже у агрессивных крыс, подвергшихся действию ЛПС, чем у неагрессивных животных [22]. Таким образом, генетически детерминированные индивидуальные различия могут быть связаны с региональными изменениями уровня экспрессии провоспалительных цитокинов и их временной изменчивостью.
Кроме того, известно, что в разных областях мозга проницаемость гематоэнцефалического барьера различается в зависимости от свойств эндотелиальных клеток сосудов мозга и клеточной гетерогенности в паренхиме головного мозга [23]. Поскольку стресс влияет на проникновение моноцитов из крови в мозг, этот процесс может в разной степени затрагивать различные области мозга.
Таким образом, результаты выполненного исследования позволили заключить:
1. В нормальных условиях уровень мРНК ИЛ-1β в крови и ФНО в префронтальной коре выше у высоковозбудимых крыс линии НП по сравнению с низковозбудимыми крысами линии ВП. В миндалине, напротив, уровень мРНК ФНО крыс линии ВП превосходит таковой линии НП. Выявленные линейные особенности экспрессии генов провоспалительных цитокинов могут вносить вклад в детерминацию уровня возбудимости нервной системы и влиять на предрасположенность крыс к развитию нейровоспаления, в том числе и под действием стресса.
2. Длительное эмоционально-болевое стрессорное воздействие приводит к специфическим изменениям экспрессии гена il1β, но не tnf у каждой из исследуемых линий крыс. Генетически детерминированные особенности крыс с высоким уровнем возбудимости нервной системы могут повышать риск развития постстрессорных нейровоспалительных реакций за счет увеличения уровня мРНК провоспалительного ИЛ-1β в гиппокампе и миндалине.
Список литературы
Simpson HB, Neria Y, Lewis-Fernández R, Schneier F (2010) Anxiety disorders: Theory, research and clinical perspectives. Cambridge University Press.
Котова ОВ, Беляев АА, Акарачкова ЕС (2021) Современные методы диагностики и лечения тревожных и депрессивных расстройств. РМЖ Мед обозр 5(10): 648–653. [Kotova OV, Belyaev AA, Akarachkova EU (2021) Modern methods of diagnosis and treatment of anxiety and depressive disorders. Breast cancer. Med obozr 5(10):648–653. (In Russ)]. https://doi.org/10.32364/2587-6821-2021-5-10-648-653
Boldrini M, Canoll PD, Klein RS (2021) How COVID-19 affects the brain. JAMA Psychiatry 78(6): 682–683.
Baharikhoob P, Kolla NJ (2020) Microglial dysregulation and suicidality: a stress-diathesis perspective. Front Psychiatry 11: 781.
DiSabato DJ, Quan N, Godbout JP (2016) Neuroinflammation: the devil is in the details. J Neurochem 139: 136–153. https://doi.org/10.1111/jnc.13607
Vandevyver S, Dejager L, Tuckermann J, Libert C (2013) New insights into the anti-inflammatory mechanisms of glucocorticoids: an emerging role for glucocorticoid-receptor-mediated transactivation. Endocrinology 154(3): 993–1007. https://doi.org/10.1210/en.2012-2045
Sorrells SF, Sapolsky RM (2007) An inflammatory review of glucocorticoid actions in the CNS. Brain Behav Immun 21(3): 259–272. https://doi.org/10.1016/J.BBI.2006.11.006
Miller AH, Raison CL (2016) The role of inflammation in depression: from evolutionary imperative to modern treatment target. Nature Rev Immunol 16(1): 22–34. https://doi.org/10.1038/nri.2015.5
Toben C, Baune BT (2018) The Roles of T Cells in Clinical Depression. In Inflammat Immun Depress (pp. 115–133). Acad Press. https://doi.org/10.1016/B978-0-12-811073-7.00007-6.
Wohleb ES, Delpech JC (2017) Dynamic cross-talk between microglia and peripheral monocytes underlies stress-induced neuroinflammation and behavioral consequences. Progr Neuro-Psychopharmacol Biol Psychiatry 79: 40–48. https://doi.org/10.1016/j.pnpbp.2016.04.013
Binder MR (2021) Neuronal hyperexcitability: significance, cause, and diversity of clinical expression. Am J Clin Exp Med 9(5): 157–167. https://doi.org/10.11648/j.ajcem.20210905.16
Вайдо АИ, Ширяева НВ, Павлова МБ, Левина АС, Хлебаева ДА, Любашина ОА, Дюжикова НА (2018) Селектированные линии крыс с высоким и низким порогом возбудимости: модель для изучения дезадаптивных состояний, зависимых от уровня возбудимости нервной системы. Лаб жив научн исслед (3): 12–22. [Vaido A, Shiryaeva N, Pavlova M, Levina A, Khlebaeva D, Lyubashina O, Dyuzhikova NA (2018) Selected rat strains HT, LT as a model for the study of dysadaptation states dependent on the level of excitability of the nervous system. Laboratory Anim Sci 205. (In Russ)]. https://doi.org/10.29296/2618723x-2018-03-02
Shalaginova IG, Tuchina OP, Sidorova MV, Levina AS, Khlebaeva DA, Vaido AI, Dyuzhikova NA (2021) Effects of psychogenic stress on some peripheral and central inflammatory markers in rats with the different level of excitability of the nervous system. PloS One 16(7):e0255380. https://doi.org/10.1371/journal.pone.0255380
Dinkel K, MacPherson A, Sapolsky RM (2003) Novel glucocorticoid effects on acute inflammation in the CNS. J Neurochem 84(4): 705–716. https://doi.org/10.1046/j.1471-4159.2003.01604.x
De Pablos RM, Villaran RF, Argüelles S, Herrera AJ, Venero JL, Ayala A, Machado A. (2006) Stress increases vulnerability to inflammation in the rat prefrontal cortex. J Neurosci 26(21):5709–5719. https://doi.org/10.1523/JNEUROSCI.0802-06.2006
Munhoz,CD, Lepsch LB, Kawamoto EM, Malta MB, de Sá Lima L, Avellar MC, Scavone C (2006) Chronic unpredictable stress exacerbates lipopolysaccharide-induced activation of nuclear factor-κB in the frontal cortex and hippocampus via glucocorticoid secretion. J Neurosci 26(14): 3813–3820. https://doi.org/10.1523/JNEUROSCI.4398-05.2006
Dantzer R (2018) Neuroimmune interactions: from the brain to the immune system and vice versa. Physiol Rev 98(1): 477–504. https://doi.org/10.1152/physrev.00039.2016
Beattie E C, Stellwagen D, Morishita W, Bresnahan JC, Ha BK, Von Zastrow M, Beattie MS, Malenka RC (2002) Control of synaptic strength by glial TNFα. Science 295(5563): 2282–2285. https://doi.org/10.1126/science.1067859
Lewitus GM, Pribiag H, Duseja R, St-Hilaire M, Stellwagen D (2014). An adaptive role of TNFα in the regulation of striatal synapses. J Neurosci 34(18): 6146–6155. https://doi.org/10.1523/JNEUROSCI.3481-13.2014
Jing H, Hao Y, Bi Q, Zhang J, Yang P (2015) Intra-amygdala microinjection of TNF-α impairs the auditory fear conditioning of rats via glutamate toxicity. Neurosci Res 91: 34–40. https://doi.org/10.1016/j.neures.2014.10.015
Sivachenko IB, Pavlova MB, Vaido AI, Shiryaeva NV, Panteleev SS, Dyuzhikova NA, Lyubashina OA (2021) Spike activity and genome instability in neurons of the amygdaloid complex in rats of selected strains with contrasting nervous system arousability in normal conditions and stress. Neurosci Behav Physiol 51(5): 620–628.
Альперина ЕЛ, Жукова ЕН (2019) Содержание цитокинов в структурах мозга крыс с различным уровнем генетически обусловленной агрессии. Мед акад журн 19(S): 9–10. [Alperina EL, Zhukova EN (2019) Cytokine content within brain structures in rats with genetic predisposition to different levels of aggression. Med Acad J 19(1S): 9–10. (In Russ)].
Noumbissi ME, Galasso B, Stins MF (2018) Brain vascular heterogeneity: implications for disease pathogenesis and design of in vitro blood–brain barrier models. Fluids Barr CNS 15(1): 1–12. https://doi.org/10.1186/s12987-018-0097-2
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


