Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 4, стр. 530-544
Исследование экспрессии рецепторов к IL-13, генов IL-13R в бронхах крыс с овальбумин-индуцированной бронхиальной астмой
Л. Е. Блажевич 1, *, О. Е. Смирнова 1, В. М. Кирилина 1, П. М. Маслюков 2
1 Петрозаводский государственный университет, Республика Карелия
Петрозаводск, Россия
2 Ярославский государственный медицинский университет Министерства здравоохранения
Российской Федерации
Ярославль, Россия
* E-mail: lyu15041988@yandex.ru
Поступила в редакцию 18.10.2022
После доработки 12.02.2023
Принята к публикации 14.02.2023
- EDN: VIWGPC
- DOI: 10.31857/S0869813923040039
Аннотация
В статье представлены результаты исследований уровней экспрессии гена рецепторов интерлейкина-13 (IL-13R) и уровней экспрессии IL-13R в бронхах контрольных крыс и крыс с овальбумин-индуцированной астмой. Выбор этих рецепторов обусловлен большим значением данных структур в патогенезе аллергической бронхиальной астмы. Были исследованы биологические материалы 64 крыс линии Вистар при помощи метода ПЦР в режиме реального времени и иммуногистохимическим методом. Установлено, что в условиях развития астмы в тканях бронхов крыс происходит выраженная экспрессия генов IL13R, значительная экспрессия рецептора к IL-13. В участках бронхов, содержащих интрамуральные ганглии (область бифуркации), уровень экспрессии генов IL13R и уровень экспрессии рецептора IL-13R были значительно выше, чем в образцах трахеи без ганглиев. Кромогликат натрия, введенный в организм крыс через 5 ч после последней ингаляции овальбумином, приводил к снижению содержания мРНК в бронхах животных по сравнению с животными, не получавшими обработку стабилизатором тучных клеток.
ВВЕДЕНИЕ
Бронхиальная астма является гетерогенным хроническим воспалительным заболеванием дыхательных путей. Исследования молекулярных и клеточных механизмов бронхиальной астмы установили, что в ее патогенезе участвует широкий спектр иммунных (Т- и В-клетки, эозинофилы, нейтрофилы, макрофаги и др.) и структурных (эпителиальные и эндотелиальные) клеток [1].
Интерлейкин-13 (IL-13) и его рецептор являются важными участниками хронического воспаления дыхательных путей. В модели бронхиальной астмы у мышей отмечается повышенный уровень IL-13 в бронхоальвеолярной жидкости [2].
Цитокин IL-13 был идентифицирован в качестве терапевтической мишени при лечении астмы. Два различных человеческих моноклональных антитела против IL-13 (тралокинумаб и лебрикизумаб) блокируют этот цитокин и, соответственно, делают невозможной передачу сигналов IL-13 его рецепторам – IL-13Ra1 и IL-13Ra2 [3]. При блокаде рецепторов к IL-13 уменьшается бронхиальная гиперреактивность у мышей [3, 4]. Например, блокируют рецептор к IL-13 моноклональные антитела препарата дупилумаб [5]. Дупилумаб – это моноклональное антитело против α-субъединицы рецептора IL-13. Дупилумаб снижает частоту тяжелых обострений астмы, улучшает функцию легких и качество жизни. Важно отметить, что эти эффекты также наблюдаются при снижении поддерживающих доз пероральных кортикостероидов [6].
У многих пациентов с бронхиальной астмой хроническое воспаление дыхательных путей вызывается IL-13, продуцируемым Th2-клетками и тучными клетками [7].
Lentsch и соавт. в экспериментах на животных установили, что IL-13 способен вызывать аллергическую астму, острое воспалительное повреждение легких и образование легочной гранулемы [8]. IL-13 участвует в гиперсекреции слизи в нижних и верхних дыхательных путях, в развитии воспалительных реакций и гиперреактивности [9].
Первый тип рецепторов – IL-13Ra1. Рецептор этого типа состоит из субъединиц IL-4Ra в комплексе с IL-13Ra1 и обнаруживается во многих негемопоэтических клетках (например, эпителиальных клетках бронхов, гладкомышечных клетках, фибробластах, кератиноцитах). Через этот тип рецепторов опосредуют свои сигналы IL-13 и IL-4, что объясняется большим сходством между этими цитокинами на генетическом уровне. Munitz и cоавт. обнаружили, что рецептору IL-13Ra1 принадлежит решающая роль в базовой продукции IgE, развитии гиперчувствительности, выработке слизи и продукции эотаксина [10].
IL-13Ra1 содержат богатые пролином области, которые могут связывать янус-киназы JAK1, JAK2, JAK3 и TYK2 [11, 12]. Связывание IL-13 с этим типом рецепторов активирует JAK1, JAK2 и TYK2. Следствием активации молекул JAK является фосфорилирование цитоплазматических тирозинов, что приводит к привлечению STAT6 и STAT3 к рецептору с последующим их фосфорилированием и активацией [13]. Фосфорилированные мономеры STAT6 и STAT3 димеризуются, а затем перемещаются в ядро, связываются со специфическими элементами ДНК для регуляции транскрипции [12]. Активация STAT6 является основным сигнальным событием в ответе на IL-13 [14]. Мыши, у которых отсутствовал STAT6, были защищены от гиперреактивности, индуцированной IL-13 [13]. Выяснено, что STAT1 и STAT3 также могут быть активированы IL-13 [8, 11, 12]. Цитоплазматический домен человеческого IL-13Ra1 содержит два остатка тирозина, которые могут служить сайтами стыковки для STAT3 [11].
IL-13Ra2 является вторым типом рецепторов для IL-13. Передача сигналов IL-13 через IL-13Ra2 приводит к фосфорилированию ERK1/2 и не зависит от STAT6. Результатом активации ERK1/2-сигнального пути является образование димерного фактора транскрипции AP-1. Фосфорилированный AP-1 транслоцируется в ядро и связывается со специфическими элементами ДНК.
С рецептором IL-13Ra2 связывается только IL-13, в то время как цитокин IL-4 не способен к взаимодейтсвию с ним [15, 16]. Первоначально этот рецептор считался рецептором-приманкой [17], участвующим в удалении IL-13 путем интернализации [18, 19]. Хотя IL-13Ra2 не обладает стандартной сигнальной активностью JAK–STAT, эта гипотеза была поставлена под сомнение, поскольку несколько исследований показали, что при определенных обстоятельствах IL-13Ra2 может опосредовать передачу сигналов IL-13 [20, 21]. В дыхательных путях человека было обнаружено, что IL-13Ra2 участвует в передаче сигналов IL-13 через белок-активатор фактора транскрипции-1 (AP-1), индуцируя активацию TGF-β [22].
У мышей с дефицитом IL-13Ra2 бронхиальная гиперчувствительность и воспаление в ответ на воздействие домашней пыли были ослаблены по сравнению с контрольными мышами [23].
Таким образом, рецепторы к IL-13 играют значительную роль в развитии астмы, и изучение их экспрессии относится к актуальным исследованиям. Исследований, выявляющих влияние стабилизации мембран тучных клеток кромогликатом натрия на степень экспрессии генов IL-13R, ранее не проводилось. При этом тучно-клеточные продукты, высвобождаемые при их дегрануляции, могут играть существенную роль в изменении экспрессии IL-13R. Также в литературе отсутствуют сведения о роли нейронов интрамурального ганглия в степени экспрессии этих рецепторов, в то время как нервные структуры способны участвовать в нейрогенном воспалении, внося вклад в развитие патологического процесса.
Целью данного исследования являлось изучение степени экспрессии генов IL-13R и количества IL-13R-содержащих клеток в бронхах с наличием интрамуральных метасимпатических ганглиев и без них у крыс в нормальных физиологических условиях и в условиях овальбумин-индуцированной бронхиальной астмы. Еще одной задачей исследования явилась оценка уровня экспрессии гена IL-13R в препаратах бронхов у крыс с астмой после обработки их кромогликатом натрия.
МЕТОДЫ ИССЛЕДОВАНИЯ
Схема эксперимента
Исследования были проведены на 64 крысах линии Вистар, полученных из вивария Петрозаводского государственного университета. Возраст крыс – 2–3 мес., для экспериментов брались самцы и самки в период диэструса. Все эксперименты были проведены в соответствии с правилами проведения лабораторных исследований (ГОСТ 33215-2014 “Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур от 01.07.2016”) [24]. Все животные были разделены на несколько групп: контрольная группа (получала физиологический раствор, n = 8), группа животных № 1 (взятие биологического материала после 72 ч с момента последней ингаляции овальбумином, n = 8), группа животных № 2 (забор биоматериала осуществляли после последней ингаляции овальбумином через 10 дней, n = 8), группа животных № 3 (взятие биологического материала производилось на 17-й день после последней ингаляции овальбумином, n = 8).
Для групп № 1, № 2 и № 3 были сформированы аналогичные группы животных, но получавшие кромогликат натрия, который способен снижать аллергический компонент воспаления (n = 8 для каждой из групп).
От каждого животного брали по 3 препарата с ганглиями (в области бифуркаций бронхов) и по 3 препарата без ганглиев (в прямых участках). Для данного исследования брались бронхи 2-го порядка во всех исследуемых образцах. Препараты бронхов были единообразны, выполненные по стандартной методике приготовления изолированных препаратов.
Виварий, где содержались животные, соответствовал требованиям СП 2.2.1.3218-14. С целью получения образцов респираторного тракта производилась декапитация с предварительной анестезией. Общую анестезию проводили при помощи инъекций золетила (Virbac S.A., Франция, 20 мг/кг, внутримышечно). Такой подход обеспечивал быструю эвтаназию животного (рекомендации по эвтаназии экспериментальных животных, Европейская комиссия).
Методика введения и расчет дозы кромогликата натрия
Для данного исследования важно было оценить, насколько стабилизация тучных клеток кромогликатом натрия повлияет на экспрессию исследуемых рецепторов [25]. Выбор препарата обоснован тем, что кромогликат натрия стабилизирует мембраны тучных клеток, предотвращая их дегрануляцию с последующим выходом из них цитокинов, медиаторов, лейкотриенов, усиливающих воспаление в условиях аллергии.
Кромогликат натрия (Aventis Рharma Holmes Chapel, Великобритания) вводили ингаляционно в максимальной концентрации (0.2 мг на 1 кг массы тела), исходя из перерасчета дозы для человека, через 5 ч после последней ингаляции овальбумина. Количество ингаляций – 6 раз в сутки (также максимальное, исходя из инструкции по применению препарата), время каждой ингаляции – 15 мин.
Модель бронхиальной астмы
В исследовании применяли модифицированную методику, предложенную в работе Masakazu [26]. Модифицированная методика проходила верификацию в ранее проведенных научным коллективом сериях экспериментов, в которых исследования были проведены на контрольных крысах (n = 30 животных), на крысах, обработанных по методике Masakazu (n = 30 животных) и на крысах, обработанных по модифицированной методике (n = 30 животных). В тканях трахей и бронхов оценивали количество эозинофилов и тучных клеток, количество слизистого компонента в малых бронхах, количество тучных клеток в лаважной жидкости. Данные показатели в предложенной модификации статистически значимо не отличались от показателей, полученных в методике Masakazu. Поэтому было принято решение оставить предложенную в статье модифицированную методику, поскольку она вызывала развитие бронхиальной астмы у 98% животных (в то время как методика Masakazu вызывала развитие астмы у 86% животных).
Крысы были сенсибилизированы введением овальбумина (Sigma-Aldrich, Германия). Для одноразовой процедуры сенсибилизации 0.5 мг овальбумина растворяли в 1 мл физиологического раствора. Далее раствор овальбумина вводили подкожно по 0.1 мл в шею, спину, обе ступни, пах и 0.5 мл раствора овальбумина дополнительно вводили внутрибрюшинно (общий объем раствора овальбумина, вводимого одному животному, равнялся 1 мл). Процедуру сенсибилизации инъекциями овальбумина проводили на 1-, 14- и 21-й день.
Параллельно с инъекциями осуществляли ингаляцию овальбумином при помощи небулайзера на 14-, 16-, 18-, 21- и 24-й день. Для этого крыс помещали в экспозиционную камеру, подключенную к небулайзеру (Omron, NE C29-E, Япония). Овальбумин в количестве 1 г растворяли в 100 мл физиологического раствора. Раствор овальбумина распыляли в течение 30 мин с выходом 3 мл/мин и со средним размером частиц 3.2 мкм. Последняя ингаляция раствором овальбумина проводилась за 72 ч до эвтаназии животных. Несенсибилизированной группе вводили физиологический раствор внутрибрюшинно в качестве контроля [26].
Статистический анализ
Для оценки значимости различий между группами предварительно осуществляли проверку нормальности распределения данных с использованием W-критерия Шапиро–Уилка. Для оценки значимости различий количественных нормально распределенных признаков применяли параметрический t-критерий Стьюдента, а также критерий Фишера F в ходе однофакторного дисперсионного анализа.
Молекулярно-генетические методы
Для определения уровня транскриптов генов были использованы образцы тканей бронхов с ганглием и бронхов без ганглия. Выделение тотальной РНК осуществляли с помощью PureZOLTM RNA Isolation Reagent (Bio-Rad, США). После центрифугирования (время 15 мин, при 4°С, 14 000 g) осадок тотальной РНК промывали 80%-ным этанолом и снова центрифугировали (время 8 мин, при 4°С, 12 000 g). Далее осадок тотальной РНК подсушивали. Количество и качество тотальной РНК определяли спектрофотометрически на приборе SmartSpecPlus (Bio-Rad, США). Далее синтезировалась первая комплементарная цепь ДНК (кДНК) при помощи набора MMLVRT kit (Евроген, Россия). Прибор LightCycler®96 (Roche, Швейцария) позволял оценить уровень экспрессии генов с помощью ПЦР в режиме реального времени. Для амплификации использовали наборы qPCRmix HS SYBR (Евроген, Россия). Протокол ПЦР был следующим: кДНК денатурировалась при 95°С в течение 5 мин на протяжении 35 циклов; далее денатурация продолжалась при 95°C в течение 15 с; после денатурации производился отжиг при 60°C в течение 15 с; последним этапом была элонгация при 72°C в течение 15 с. Программа Beacon Designer помогала конструировать праймеры для ПЦР.
Нуклеотидные последовательности и размер ПЦР-фрагментов для гена IL13RА (СD231А1) был следующим: 5' AТТGTGCCTACTCCCCCATC 3' (exon 11) и 5' TTCCCCCTCTCAAGCAAATAGG 3' (exon 11), 284 н. п. соответственно [27].
Иммуногистохимические методы
Для иммуногистохимических исследований с флуоресцентной меткой использовали парафиновые срезы бронхов, изготовленные по стандартной методике. Кусочки ткани после предварительной подготовки проходили дегидратацию в спиртах, далее помещались в ксилол и парафин и готовились срезы. Депарафинизацию, регидратацию и демаскировку антигенов проводили с применением раствора TrilogyTM (Cell Marque, Merck, США). Далее срезы промывались в дистиллированной воде и в фосфатно-солевом растворе (PBS). В исследовании использовались неконьюгированные первичные кроличьи поликлональные антитела против рецепторов к IL-13 (антитела кроличьи поликлональные IL-13RА1, IL-13RA1 Polyclonal Antibody, Catalog # PA5-86354, Species Reactivity: Human, Mouse, Rat; BioVitrum, США). Препараты бронхов были оставлены для реакции с первичными антителами в течение 18 ч при 4°С. После этого образцы бронхов промывались в PBS и инкубировались со вторичным антителами, конъюгированными с флуорохромом Alexa Fluor 488 (Thermo Fisher Scientific, США). Ядра всех клеток препарата окрашивались Hoechst 33342 (Invitrogen, Thermo Fisher Scientific, США). Флуоресцентный микроскоп Olympus (Япония) позволил визуализировать полученные результаты, а программа ImageJ – произвести их количественный анализ [28].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Результаты иммуногистохимических исследований
Образцы бронхов для иммуногистохимического исследования брались по истечению 72 ч после последней ингаляции овальбумином (группа крыс с астмой № 1). В препаратах бронхов с ганглиями количество клеток в перерасчете на 100 клеток, экспрессирующих рецептор к IL-13, в группе животных с астмой увеличилось на 160.3% по сравнению с контрольной группой (ошибка среднего арифметического (m) составила 0.36; F > Fкр при уровне значимости α = 0.05). В препаратах бронхов без ганглиев тоже наблюдались изменения в количестве IL-13R-содержащих клеток. Количество таких клеток увеличилось на 90.4% у животных с астмой по сравнению с контролем (m = 0.38; F > Fкр при уровне значимости α = 0.05) (рис. 1–4).
Рис. 1.
Фотографии, полученные с помощью светового микроскопа. Зеленым свечением обозначены клетки, содержащие рецептор к IL-13.
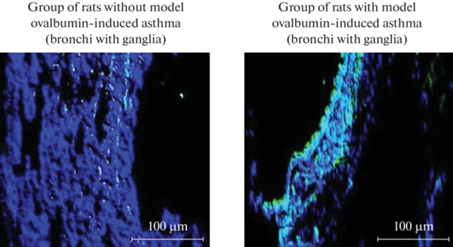
Рис. 2.
Фотографии, полученные с помощью светового микроскопа. Зеленым свечением обозначены клетки, содержащие рецептор к IL-13.
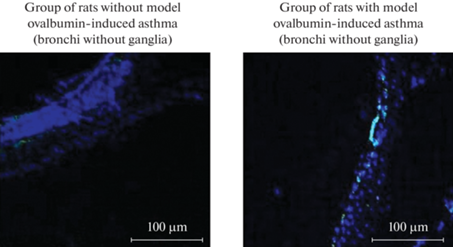
Рис. 3.
Изменения в количестве IL-13R-содержащих клеток в контрольной и экспериментальной группах животных. По оси абсцисс обозначены биологические препараты. По оси ординат – количество клеток, содержащих IL-13R в перерасчет на 100 клеток. * – статистически значимое отличие в количестве клеток, содержащих рецептор к IL-13, между контрольными и экспериментальными препаратами. ˄ – статистически значимое отличие в количестве клеток, содержащих рецептор к IL-13, между экспериментальными препаратами бронхов с ганглиями и бронхов без ганглиев.
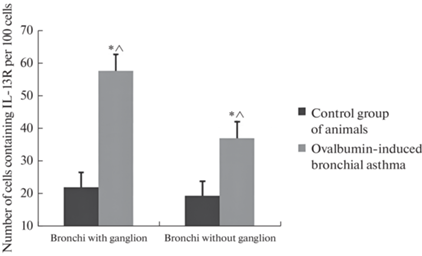
Рис. 4.
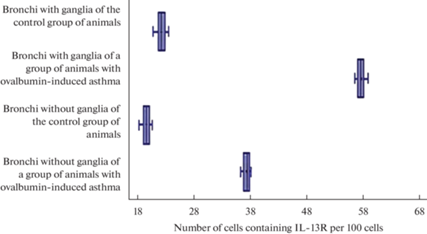
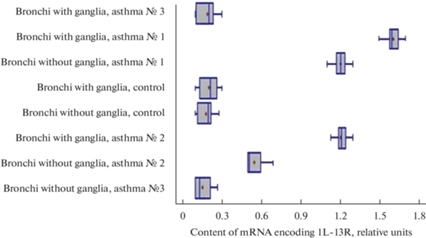
Разброс данных, отражающих количество IL-13R-содержащих клеток в бронхах контрольной группы животных и группы животных с овальбумин-индуцированной астмой. По оси абсцисс обозначено количество клеток, содержащих IL-13R, в перерасчете на 100 клеток. По оси ординат обозначены препараты контрольной группы животных и группы животных с овальбумин-индуцированной астмой.
Результаты молекулярно-генетических исследований
В препаратах бронхов с ганглиями экспрессия генов IL-13R была более выражена по истечению первых трех суток после последней ингаляции овальбумином. По сравнению с контрольными значениями содержание мРНК в группе крыс с астмой № 1 возрастало на 1.4 отн. ед. (m = 0.03; F > Fкр при уровне значимости α = 0.05), в группе крыс с астмой № 2 – на 1.1 отн. ед. (m = 0.02; F > Fкр при уровне значимости α = 0.05). К первоначальным значениям экспрессия генов IL-13R возвращалась на 17-й день после последней ингаляции и равнялась 0.2 отн. ед. (группа крыс с астмой №3) (m = 0.05).
В препаратах бронхов без ганглиев по истечении 72 ч экспрессия увеличилась на 1.1 отн. ед. (группа крыс с астмой № 1) (m = 0.03; F > Fкр при уровне значимости α = 0.05), а по истечении 10 дней – на 0.4 отн. ед. (группа крыс с астмой № 2) (m = 0.02; F > Fкр при уровне значимости α = 0.05). К исходным значениям экспрессия генов IL-13R возвращалась на 17-й день (группа крыс с астмой № 3) (m = 0.04). Различия между препаратми бронхов с ганглиями и без них для групп крыс с астмой №1 и № 2 статистически значимы (F > Fкр при уровне значимости α = 0.05) (рис. 5 и 6).
Рис. 5.
Уровень экспрессии гена IL13R в препаратах бронхов контрольных крыс и крыс с овальбумин-индуцированной бронхиальной астмой. * – статистически значимое отличие в уровне экспресии гена IL13R между контрольными и экспериментальными препаратами. ˄ – статистически значимое отличие в уровне экспрессии гена IL13R между экспериментальными препаратами бронхов с ганглиями и бронхов без ганглиев.
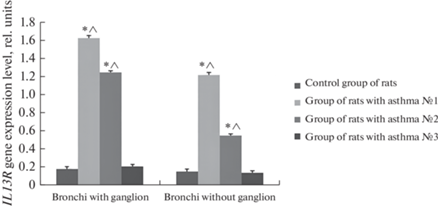
Рис. 6.
Разброс данных, отражающих уровни экспрессии гена IL13R в бронхах контрольной группы животных и группы животных с овальбумин-индуцированной астмой. По оси абсцисс обозначено содержание мРНК, кодирующей IL-13R (в отн. ед.). По оси ординат обозначены препараты контрольной группы животных и группы животных с овальбумин-индуцированной астмой.
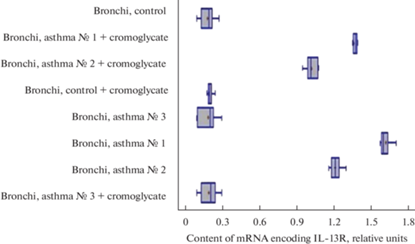
Группа экспериментальных животных с астмой, получавшая кромогликат натрия, продемонстрировала более низкие уровни экспрессии гена IL-13R по сравнению с группой крыс с астмой без обработки кромогликатом натрия. В препаратах бронхов с ганглиями у животных группы № 1, получавших кромогликат натрия, экспрессия гена IL13R была ниже на 0.2 отн. ед. (m = 0.03; F > Fкр при уровне значимости α = 0.05) по сравнению с группой крыс, не получавших кромогликат натрия. В группе животных № 2 это различие составляло 0.1 отн. ед. (m = 0.04; F > Fкр при уровне значимости α = 0.05) (рис. 7 и 8).
Рис. 7.
Уровень экспрессии гена IL13R в препаратах бронхов с ганглиями контрольных крыс, крыс с астмой и крыс с астмой после лечения кромогликатом натрия. * – статистически значимое отличие в уровне экспресии гена IL13R между животными с астмой без лечения и животными с лечением кромогликатом натрия.

Рис. 8.
Разброс данных, отражающих уровни экспрессии гена IL13R в бронхах с ганглиями контрольных крыс, крыс с астмой и крыс с астмой после введения кромогликата натрия. По оси абсцисс обозначено содержание мРНК, кодирующей IL-13R (в отн. ед.). По оси ординат обозначены препараты контрольной группы животных и группы животных с овальбумин-индуцированной астмой.
В препаратах без ганглиев разница между получавшими и не получавшими кромогликат животными по истечении первых трех суток составила 0.2 отн. ед. (группа № 1) (m = 0.02; F > Fкр при уровне значимости α = 0.05), по истечению 10 суток (группа № 2) – также 0.2 отн.ед. (m = 0.03; F > Fкр при уровне значимости α = 0.05) (рис. 9 и 10).
Рис. 9.
Уровень экспрессии гена IL13R в препаратах бронхов без ганглиев контрольных крыс, крыс с астмой и крыс с астмой после лечения кромогликатом натрия. * – статистически значимое отличие в уровне экспресии гена IL13R между животными с астмой без лечения и животными с лечением кромогликатом натрия.
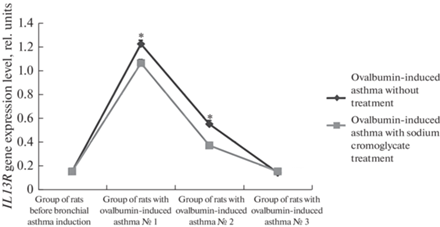
Рис. 10.
Разброс данных, отражающих уровни экспрессии гена IL13R в бронхах без ганглиев контрольных крыс, крыс с астмой и крыс с астмой после введения кромогликата натрия. По оси абсцисс обозначено содержание мРНК, кодирующей IL-13R (в отн. ед.). По оси ординат обозначены препараты контрольной группы животных и группы животных с овальбумин-индуцированной астмой.

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В данном исследовании была использована максимально выраженнная и устойчивая модель астмы. Это связано с применяемой в исследовании методикой. Ингаляции овальбумином осуществляляли в течение 30 мин, это определило возможность максимально равномерного оседания частиц овальбумина (исходя из принципа диффузии газа и размера частиц, растворенных в нем) на поверхности респираторного тракта. Продолжительность ингаляции по времени определила возможность равномерного распределения газовой смеси овальбумина по всему респираторному дереву. Также овальбумин дополнительно вводился подкожно и внутрибрюшинно, что является важным фактором, обусловливающим генерализацию аллергического процесса в организме. Для данного исследования важным было достижение именно максимально выраженной устойчивой аллергии. Поэтому можно предположить, что максимально возможный эффект действия овальбумина был достигнут, а лабораторные условия по оседанию овальбумина были схожими для всех исследуемых образцов респираторного тракта. Таким образом, дальнейшее обсуждение экспрессии гена IL13R и количества клеток, содержащих рецептор IL-13R, будет рассмотрено для модели астмы, характеризующейся выраженными проявлениями.
Экспрессия гена IL13R возрастала в препаратах бронхов крыс с овальбумин-индуцированной астмой по сравнению с контрольными животными. Максимальный уровень экспрессии был в препаратах с ганглиями группы животных № 1 (72 ч после последней ингаляции овальбумином). Затем экспрессия генов постепенно снижалась, и через 10 дней после последней ингаляции овальбумином содержание мРНК уменьшилось на 23.3% в препаратах бронхов с ганглиями и на 54.9% в препаратах бронхов без ганглиев.
Можно предположить, что присутствие интрамурального метасимпатического ганглия оказывает влияние на степень экспрессии гена IL13R. Это можно подтвердить данными Bochner о способности влиянии цитокина IL-13 на сенсорные нейроны [29], а так же способностью нейронов мыши и человека экспрессировать IL-13Ra1 и IL-4Ra [30].
Влияние ганглия прослеживается как на начальных этапах патогенеза аллергической астмы, так и на более поздних сроках (группа животных № 2, забор биоматериала 10 дней спустя последней ингаляции овальбумином). Полученные результаты можно объяснить участием нервных структур в нейрогенном воспалении в патогенезе астмы. Снижение экспрессии мРНК до значений, сопоставимых с контрольными, наблюдалось в группе животных № 3, у которых взятие биологического материала производилось на 17-й день после последней ингаляции овальбумином.
Воздействие кромогликатом натрия приводило к снижению экспрессии гена IL13R. По истечению 72 ч после последней ингаляции овальбумином в образцах бронхов с ганглиями, полученных от крыс, обработанных кромогликатом натрия, содержание мРНК снизилось на 11.7% по сравнению с аналогичными препаратами, полученными от крыс, не получавших кромогликат. В группе животных, у которых биологический материал брался по истечении 10 суток, также наблюдалась разница в экспрессии между препаратами. В препаратах крыс, получавших кромогликат натрия, уровень экспрессии был на 11.2% ниже, чем в бронхах крыс, не прошедших обработку кромогликатом.
В бронхах без ганглиев также наблюдался эффект кромогликата натрия. В группе крыс, эвтаназия которых производилась 72 ч спустя после последней ингаляции овальбумином, содержание мРНК на 13.1% было меньше, чем у тех крыс, которым вводили кромогликат натрия. В группе крыс, эвтаназия которых производилась спустя 10 суток после последней ингаляции овальбумином, воздействие кромогликата натрия приводило к снижению экспрессии исследуемого гена на 32.7%.
Таким образом, в бронхах с ганглиями и без них кромогликат натрия оказывал подавляющий эффект на экспрессию гена IL13R. Эффект препарата направлен на стабилизацию мембран тучных клеток и предотвращение тучно-клеточной дегрануляции с высвобождением медиаторов аллергии, лейкотриенов и цитокинов. Высвобождение этих веществ в организме индуцирует аллергическую реакцию в патогенез астмы и определяет один из основных ее этапов. IL-13 – один из высвобождаемых тучными клетками цитокинов, и вероятнее всего, появление его в тканях способствует индукции экспрессии адекватных ему рецепторов – IL-13R. Косвенно этот результат подтверждается работой Трулева и соавт. [31], которая свидетельствует о высвобождении IL-13 тучными клетками при их дегрануляции и роли тучно-клеточных продуктов в воспалении.
В нашем исследовании кромогликат натрия поступал в организм животных довольно поздно (после фактической индукции аллергии) по сравнению с рекомендациями по его применению (рекомендации предполагают стабилизацию мембран лаброцитов преимущественно до развития аллергической реакции). Тем не менее, даже при позднем введении кромогликата натрия в организм крыс, содержание мРНК в бронхах животных снижалось по сравнению с животными, не получавшими обработку тучно-клеточным стабилизатором (различие было статистически значимым). Такой результат может свидетельствовать о продолжительности тучно-клеточной дегрануляции на поздних этапах модели индуцирования аллергической астмы, а также о роли тучно-клеточных продуктов (в первую очередь IL-13) в индукции экспрессии генов IL-13R.
Список литературы
Nikolskii AA, Shilovskiy IP, Barvinskaia ED, Korneev AV, Sundukova MS, Khaitov MR (2021) Role of STAT3 Transcription Factor in Pathogenesis of Bronchial Asthma. Biochemistry (Mosc) 86(11): 1489–1501. https://doi.org/10.1134/S0006297921110122
Duan W, Aguinaldo AM, Leung BP, Vlahos CJ, Wong WS (2005) An anti-inflammatory role for a phosphoinositide 3-kinase inhibitor LY294002 in a mouse asthma model. Int Immunopharmacol J 5: 495–502. https://doi.org/10.1016/j.intimp.2004.10.015
Marone G, Granata F, Pucino V, Pecoraro A, Heffler E, Loffredo S, Scadding GW, Varricchi G (2019) The Intriguing Role of Interleukin 13 in the Pathophysiology of Asthma. Front Pharmacol 10: 1387. https://doi.org/10.3389/fphar.2019.01387
Eum SY, Maghni K, Tolloczko B, Eidelman DH, Martin JG (2005) IL-13 may mediate allergen-induced hyperresponsiveness independently of IL-5 or eotaxin by effects on airway smooth muscle. Am Physiol Lung Cell Mol Physiol J 288: 576–584. https://doi: 10.1152 /ajplung.00380.2003
Harb H, Chatila Talal A (2019) Mechanisms of Dupilumab. Clin Exp Allergy 50(1): 5–14. https://doi.org/10.1111/cea.13491
Moran A, Pavord ID (2020) Anti-IL-4/IL-13 for the treatment of asthma: the story so far. Expert Opin Biol Ther 20(3): 283–294. https://doi.org/10.1080/14712598.2020.1714027
Hammad H, Lambrecht BN (2021) The basic immunology of asthma. Cell Epub 184(6): 1469–1485. https://doi.org/10.1016/j.cell.2021.02.016
Lentsch AB, Czermak BJ, Jordan JA, Ward PA (1999) Regulation of acute lung injury by endogenous IL-13. J Immunol 162: 1071–1076. PMID: 9916735
Amin K, Janson C, Boman G, Venge P (2005) The extracellular deposition of mast cell products is increased in hypertrophic airways smooth muscles in allergic asthma but not in nonallergic asthma. Allergy J 60: 1241–1247. https://doi: 10.1111 / j.1398-9995.2005.00823.x
Munitz A, Brandt EB, Mingler M, Finkelman FD, Rothenberg ME (2008) Different roles of IL-13 and IL-4 via IL-13 alpha1 receptor and L-4 type II receptor in the pathogenesis of asthma. Proc Natl Acad Sci U S A 105: 7240–7245. https://doi.org/10.1073/pnas.0802465105
Hershey GK (2003) IL-13 receptors and signaling pathways: an evolving web. J Allergy Clin Immunol 111: 677–690. https://doi.org/10.1067/mai.2003.1333
Bhattacharjee A, Shukla M, Yakubenko VP, Mulya A, Kundu S, Cathcart MK (2013) IL-4 and IL-13 employ discrete signaling pathways for target gene expression in alternatively activated monocytes/macrophages. Free Radic Biol Med 54: 1–16. https://doi.org/10.1016/j.freeradbiomed.2012.10.553
Kuperman DA, Huang X, Koth LL, Chang GH, Dolganov GM, Zhu Z (2002) Direct effects of interleukin-13 on epithelial cells cause airway hyperreactivity and mucus overproduction in asthma. Nat Med 8: 885–889. https://doi.org/10.1038/nm734
Cao H, Zhang J, Liu H, Wan L, Zhang H, Huang Q (2016) IL-13/STAT6 signaling plays a critical role in the epithelial-mesenchymal transition of colorectal cancer cells. Oncotarget 7: 61183–61198.https://doi.org/10.18632/oncotarget.11282
Wang IM, Lin H, Goldman SJ, Kobayashi M (2004) STAT-1 is activated by IL-4 and IL-13 in multiple cell types. Mol Immunol 41: 873–884. https://doi.org/10.1016/j.molimm.2004.04.027
Pham TH, Bak Y, Oh JW, Hong J, Lee S, Hong JT (2019) Inhibition of IL-13 and IL-13Ralpha2 Expression by IL-32theta in Human Monocytic Cells Requires PKCdelta and STAT3. Associat Int J Mol Sci 20: 19–49. https://doi.org/10.3390/ijms20081949
Chen W, Sivaprasad U, Tabata Y, Gibson AM, Stier MT, Finkelman FD (2009) IL-13R alpha 2 membrane and soluble isoforms differ in humans and mice. J Immunol 183: 7870–7876. https://doi.org/10.4049/jimmunol.0901028
Chen W, Sivaprasad U, Gibson AM, Ericksen MB, Cunningham CM, Bass SA (2013) IL-13 receptor alpha2 contributes to development of experimental allergic asthma. J Allergy Clin Immunol 132: 951–958. https://doi.org/10.1016/j.jaci.2013.04.016
Ingram JL, Kraft M (2012) IL-13 in asthma and allergic disease: asthma phenotypes and targeted therapies. J Allergy Clin Immunol 130: 829–842. https://doi.org/10.1016/j.jaci.2012.06.034
Lupardus PJ, Birnbaum ME, Garcia KC (2010) Molecular basis for hared cytokine recognition revealed in the structure of an unusually high ffinity complex between IL-13 and IL-13Ralpha2. Structure 18: 332–342. https://doi.org/10.1016/j.str.2010.01.003
Kasaian MT, Raible D, Marquette K, Cook TA, Zhou S, Tan XY (2011) IL-13 antibodies influence IL-13 clearance in humans by modulating scavenger activity of IL-13Ralpha2. J Immunol 187: 561–569. https://doi.org/10.4049/jimmunol.1100467
Fichtner-Feigl S, Strober W, Kawakami K, Puri RK, Kitani A (2006) IL-13 signaling through the IL-13alpha2 receptor is involved in induction of TGF-beta1 production and fibrosis. Nat Med 12: 99–106. https://doi.org/10.1038/nm1332
Fujisawa T, Joshi B, Nakajima A, Puri RK (2009) A novel role of interleukin-13 receptor alpha2 in pancreatic cancer invasion and metastasis. Cancer Res 69: 8678–8685. https://doi.org/10.1158/0008-5472.CAN-09-2100
ГОСТ 33215-2014 Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур от 01.07.2016. [GOST 33215-2014 Guidelines for the maintenance and care of laboratory animals. Rules for equipping premises and organizing procedures dated 01.07.2016. (In Russ)].
Close B, Banister K, Baumans V, Warwick C (1997) Recommendations for euthanasia of experimental animals. Part 2 DGXT of the Eur Commission Lab Animals J 31: 1–32. https://doi.org/10.1258/002367797780600297
Masakazu Y, Osamu S, Kenji N, Tetsuji M, Koji S (2006) Propofol Attenuates Ovalbumin-Induced Smooth Muscle Contraction of the Sensitized Rat Trachea: Inhibition of Serotonergic and Cholinergic Signaling. Anesthesia & Analgesia J 3: 594–600.
Akin Yilmaz, Hacer Ilke Onen, Ebru Alp, Sevda Menevse (2012) Real-Time PCR for Gene Expression Analysis. INTECH 12: 229–254. https://doi.org/10.5772/37356
Masuda N, Mantani Y, Yoshitomi C, Yuasa H, Nishida M, Aral M, KawanoJ, Yokoyama T, Hoshi N, Kitagawa H (2018) Immunohistochemical study on the secretory host defense system with lysozyme and secretory phospholipase A2 throughout rat respiratory tract. J Vet Med Sci 80(2): 323–332. https://doi.org/10.1292/jvms.17-0503
Bochner BS, Klunk DA, Sterbinsky SA, Coffman RL, Schleimer RP (1995) IL-13 selectively induces expression of the vascular cell adhesion molecule-1 in human endothelial cells. J Immunol 154: 799–803.
Oetjen LK, Mack MR, Feng J, Whelan TM, Niu H, Guo CJ (2017) Sensory neurons co-opt classical immune signaling pathways to mediate chronic pruritus. Cell 171: 217–228. https://doi.org/10.1016/j.cell.2017.08.006
Трулев АС, Кудрявцев ИВ, Назаров ПГ (2012) Факторы острой фазы воспаления как модуляторы взаимодействия тучных клеток и фибробластов. Бюл ВСНЦ СО РАМН 85(3): 319–322. [Trulev AS, Kudryavtsev IV, Nazarov PG (2012) Factors of the acute phase of inflammation as modulators of the interaction between mast cells and fibroblasts. Bull VSNC SO RAMS 85(3): 319–322. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


