Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 6, стр. 788-797
Влияние гибернации на электрическую активность и калиевые токи в миокарде длиннохвостого суслика
Т. С. Филатова 1, Д. В. Абрамочкин 1, *
1 Кафедра физиологии человека и животных, биологический факультет,
Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: abram340@mail.ru
Поступила в редакцию 06.04.2023
После доработки 10.05.2023
Принята к публикации 12.05.2023
- EDN: WGZKYU
- DOI: 10.31857/S0869813923060031
Аннотация
Гибернирующие млекопитающие способны снижать температуру своего тела до значений, близких к 0°C. При этом их сердце чрезвычайно устойчиво к развитию аритмий, вызванных снижением температуры. В данной работе впервые были исследованы калиевые токи в миокарде зимоспящего млекопитающего на примере длиннохвостого суслика (Citellus undulatus) и их изменение при гибернации. С помощью метода пэтч-кламп были исследованы транзиторный выходящий ток Ito и фоновый ток входящего выпрямления IK1 в изолированных желудочковых и предсердных кардиомиоцитах летних (активных) и зимних (гибернирующих) сусликов. В работе выявлено, что при комнатной температуре, при положительных поддерживаемых потенциалах пиковая амплитуда тока Ito в кардиомиоцитах гибернирующей группы животных статистически значимо ниже, чем таковая у летней группы. Подавление тока Ito при гибернации было выражено сильнее в желудочковом миокарде по сравнению с предсердным. Фоновый ток входящего выпрямления IK1 при адаптации к гибернации усиливался в желудочковом миокарде зимней группы животных. В предсердном миокарде статистически значимых различий тока IK1 между группами не было обнаружено. Также в работе регистрировали потенциалы действия в изолированных желудочковых кардиомиоцитах. Длительность потенциалов действия на уровнях реполяризации 50 и 90% не различалась между группами, также не было выявлено различий в максимальной скорости нарастания переднего фронта потенциалов действия и уровне потенциала покоя. В совокупности, выявленные различия в амплитуде токов Ito и IK1 между активными и гибернирующими сусликами могут способствовать увеличению длительности рефрактерного периода и поддержанию потенциала покоя при низкой температуре.
ВВЕДЕНИЕ
В умеренных широтах адаптация к низким температурам в зимний период является серьезным испытанием для всех организмов. Некоторые виды млекопитающих развили уникальную стратегию выживания – а именно способность впадать в спячку или гибернировать [1]. При этом температура их тела снижается от физиологического уровня (36–38°C) до значений, близких к 0°C и в некоторых случаях ниже [2], а большая часть физиологических процессов и метаболизм замедляются – так, потребление кислорода может падать до 2–3% от уровня его потребления бодрствующим животным. Сердце гибернирующего животного, однако, продолжает функционировать и сокращаться – хотя и с меньшей частотой: у мелких видов гибернирующих животных (например, сусликов) частота сокращений сердца снижается от 200–300 до 3–10 уд./мин [3]. Способность поддерживать нормальную работу сердца при низких температурах является уникальной для гибернирующих видов среди млекопитающих. У прочих видов млекопитающих при снижении температуры тела (или сердца in situ) ниже 27°C развиваются различные аритмии, вплоть до фибрилляции желудочков [4, 5], а при температуре ниже 17°C работа сердца прекращается [6]. Напротив, сердце гибернирующих видов животных весьма устойчиво к так называемым холодовым аритмиям, в том числе при снижении температуры во время входа в гибернацию и при ее повышении во время пробуждения животного [4, 7].
Физиологические механизмы, стоящие за этим, являются предметом разносторонних исследований. Показано, что одним из факторов, провоцирующих фибрилляцию желудочков при гипотермии является гетерогенность электрической активности, а также неравномерное замедление скорости проведения возбуждения, что значительно сильнее выражено в миокарде не гибернирующих животных [8]. Одним из механизмов, противодействующих этому, может быть увеличение уровня экспрессии коннексинов в миокарде гибернирующих животных [9] – это делает электрические свойства миокарда более гомогенными.
Еще одним возможным противоаритмическим механизмом, предложенным в качестве возможной защиты от холодовых аритмий при гибернации, является экстремальное увеличение длительности рефрактерного периода. Показано, что у гибернирующих млекопитающих длительность рефрактерного периода может превышать длительность потенциалов действия, что, предположительно, может предотвращать замыкание контуров циркуляции возбуждения и препятствовать развитию фибрилляции желудочков при низких температурах [10, 11].
Таким образом, реполяризация миокарда и ее возможное ремоделирование, по всей видимости, играют роль в адаптации к условиям гибернации. Предыдущие исследования показали изменение амплитуды Са2+ тока L-типа в миокарде сусликов при входе в гибернацию [12]. Однако прочие ионные токи, включая калиевые, вносящие основной вклад в реполяризацию миокарда, у гибернирующих видов не были изучены. Данное исследование ставило своей целью изучение возможного изменения в наборе калиевых токов, участвующих в реполяризации миокарда зимоспящих животных, при адаптации к условиям гибернации.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные
Дикие длиннохвостые суслики (Citellus undulatus) обоих полов были пойманы в горах Алтая и транспортированы в лабораторию в Москве. С августа по конец сентября животных содержали в индивидуальных клетках при световом периоде 12 : 12 и температуре 18 ± 1°C. Животных кормили ad libitum зерновой смесью с семенами подсолнечника с добавлением свежих овощей. С начала октября для входа в гибернацию сусликов содержали в металлических боксах, наполненных сеном, которые помещали в холодную комнату с контролем температуры. Температуру постепенно снижали (по 1°C в день) до достижения уровня 2°C при фотопериоде 2 : 22. После одной недели содержания при 2°C освещение полностью выключали. Температуру тела животных измеряли с помощью бесконтактного термометра. Эксперименты на зимних гибернирующих сусликах проводились, когда животные были в состоянии глубокой гибернации. Каждое животное из зимней группы использовали не ранее, чем через 10 дней после последнего эпизода бодрствования. Суслики из летней группы имели массу тела 400–450 г (n = 4), в зимней группе – 350–400 г (n = 4).
Выделение кардиомиоцитов
Кардиомиоциты выделяли с использованием методики, описанной ранее [13]. Животных анестезировали изофлураном (3.5% изофлурана в смеси с кислородом со скоростью 2 л/мин) и декапитировали. Грудную клетку вскрывали, сердце быстро вырезали и помещали на аппарат Лангендорфа. Сердце ретроградно перфузировали через аорту бескальциевым раствором, содержащим (в мМ): NaCl 116; KCl 4; NaH2PO4 1.7; NaHCO3 25; MgCl2 0.55; пируват натрия 5; таурин 20; глюкоза 11; бычий сывороточный альбумин 1 г/мл; pH 7.4 поддерживали путем аэрации карбогеном (95% O2, 5% CO2) при 37°C. После 10 мин перфузии и вымывания крови сердцебиение останавливалось. Перфузию переключали на раствор аналогичного состава с добавлением 0.5 мг/мл коллагеназы II типа (Worthington, США), 0.035 мг/мл протеазы XIV типа (Sigma Aldrich, США) и 7.5 мкM CaCl2. После 40–60 мин обработки ферментами перфузию останавливали. Предсердия и желудочки разделяли, разрезали на мелкие фрагменты и пипетировали, высвобождая изолированные кардиомиоциты в раствор Kraftbrühe содержащий (в мМ): MgSO4 3; KCl 30; KH2PO4 30; ЭГТА 0.5; глутамат калия 50; HEPES 20; таурин 20; глюкоза 10; pH 7.2 доводили с помощью KOH [14]. Изолированные миоциты хранили в растворе Kraftbrühe при комнатной температуре и использовали для работы в течение 8 ч.
Регистрация ионных токов
Ионные токи и потенциалы действия регистрировали в изолированных кардиомиоцитах суслика, используя стандартный метод пэтч-кламп в конфигурации whole-cell в режиме поддержания потенциала (voltage-clamp) или тока (current-clamp), соответственно. Записи были получены с использованием усилителя HEKA EPC 800 (HEKA Elektronik, Германия) и программного обеспечения WinWCP 4.8.7 (University of Strathclyde, Великобритания). Небольшую порцию суспензии клеток помещали в экспериментальную камеру (RC-26; Warner Instrument Corporation, США; объем 150 мкл), монтированную на инвертированном микроскопе, и перфузировали со скоростью около 1.5 мл/мин внешним физиологическим раствором, содержащим (в мМ): NaCl 150; KCl 3; CaCl2 1.8; глюкоза 10; HEPES 10; pH 7.4 доводили с помощью NaOH. Токи и потенциалы действия регистрировали при комнатной температуре (24°C). При регистрации токов Ito и IK1 к внешнему раствору добавляли блокатор Ca2+ каналов нифедипин (20 мкM) для подавления Ca2+ тока L-типа, а также 4-аминопиридин (100 мкM) для блокирования ультрабыстрого тока задержанного выпрямления IKur. Пэтч-пипетки вытягивали из боросиликатных стеклянных капилляров без филамента (Sutter Instrument, США) и заполняли пипеточным раствором. Сопротивление заполненных пипеток составляло 2–3 MΩ. Пипеточный раствор для регистрации K+ токов имел следующий состав (в мМ): KCl 140; MgCl2 1; ЭГТА 5; MgATP 4; Na2GTP 0.3; HEPES 10; pH 7.2 доводили с помощью KOH. Для записи потенциалов действия в режиме поддержания тока использовали пипеточный раствор сходного состава, но со сниженной концентрацией ЭГТА (0.025 мМ), соответствующей буферной емкости цитоплазмы и более подходящей для регистрации мембранного потенциала.
Статистический анализ
Анализ данных осуществляли с использованием программного обеспечения Clampfit 10.3 (Molecular Devices, США); статистический анализ проводили с использованием обеспечения GraphPad Prism 8.0 (GraphPad Software, США). Результаты представлены как среднее ± стандартная ошибка среднего для n клеток. Амплитуду токов нормировали на емкость клеток и выражали в пА/пФ (pA/pF). Нормальность распределения выборок оценивали с помощью теста Шапиро–Уилка. Сравнение между двумя экспериментальными группами проводили с помощью t-теста Стьюдента. Различия считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Транзиторный выходящий ток Ito
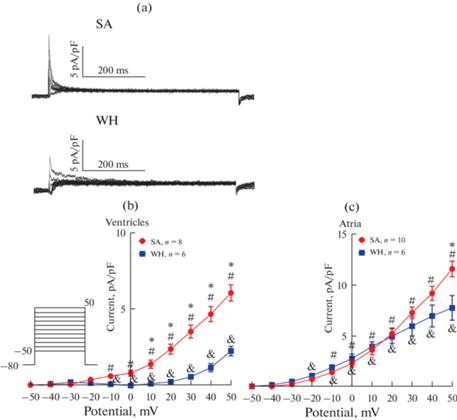
При деполяризации от поддерживаемого потенциала –80 мВ до –40 мВ и более положительных потенциалов в предсердных и желудочковых кардиомиоцитах суслика активировался выходящий, быстро инактивирующийся ток, чувствительный к 4-аминопиридину (3 мМ) и определенный как калиевый транзиторный выходящий ток Ito1 (далее обозначаемый как Ito). Возможно присутствующий хлорный кальцийзависимый ток Ito2 в эксперименте не регистрировали, т.к. вход кальция в кардиомиоциты был подавлен нифедипином во внешнем растворе [15]. Также при деполяризации активировался ультрабыстрый калиевый ток задержанного выпрямления IKur, чувствительный к 100 мкМ 4-аминопиридина – однако ток IKur имел крайне низкую амплитуду по сравнению с током Ito и был исключен из анализа. На рис. 1 представлены репрезентативные записи тока Ito, протокол изменения мембранного потенциала, а также вольт-амперные характеристики Ito в предсердных и желудочковых кардиомиоцитах суслика. В предсердных клетках, полученных как от летних активных (SA) сусликов, так и от зимних гибернирующих (WH) животных, амплитуда тока была выше, чем в желудочковых, при большинстве тестовых потенциалов (рис. 1b, 1c). Адаптация к низким температурам и гибернация приводили к существенному снижению пиковой амплитуды Ito – причем в желудочках оно было выражено сильнее (статистически значимые отличия наблюдались при менее положительных потенциалах), чем в предсердиях.
Рис. 1.
Влияние гибернации на транзиторный выходящий ток Ito. Репрезентативные записи тока Ito в желудочковых кардиомиоцитах суслика (a), а также его вольт-амперные характеристики в желудочковых (b) и предсердных (c) кардиомиоцитах суслика. Протокол изменения мембранного потенциала показан на врезке. * – p < 0.05, различия между SA и WH группами, t-тест Стьюдента; # – p < 0.05, различия между желудочковыми и предсердными миоцитами в SA группе, t-тест Стьюдента; & – p < 0.05, различия между желудочковыми и предсердными миоцитами в WH группе, t-тест Стьюдента.
Фоновый ток входящего выпрямления IK1
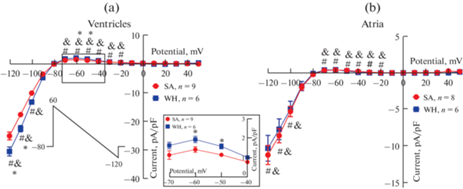
Фоновый ток входящего выпрямления IK1 регистрировали с использованием пилообразного протокола (см. рис. 2) после подавления токов Ito и IKur (3 мМ 4-аминопиридина во внешнем растворе). В предсердных миоцитах SA и WH сусликов амплитуда IK1 (как входящей, так и выходящей компоненты) была статистически значимо ниже, чем в желудочковых клетках. В желудочковых миоцитах гибернирующих сусликов амплитуда IK1 была статистически значимо выше по сравнению с IK1 в желудочковых клетках SA группы (рис. 2a). Однако в предсердных кардиомиоцитах мы не выявили статистически значимых различий в амплитуде как входящей, так и выходящей амплитуды IK1 между SA и WH группами (рис. 2b).
Рис. 2.
Влияние гибернации на фоновый ток входящего выпрямления IK1. Вольт-амперные характеристики тока IK1 в желудочковых (a) и предсердных (b) кардиомиоцитах суслика. На врезке показаны различия в выходящей компоненте IK1 в желудочковых клетках. * – p < 0.05, различия между SA и WH группами, t-тест Стьюдента; # – p < 0.05, различия между желудочковыми и предсердными миоцитами в SA группе, t-тест Стьюдента; & – p < 0.05, различия между желудочковыми и предсердными миоцитами в WH группе, t-тест Стьюдента.
Потенциалы действия
Из-за разницы в плотности фонового тока входящего выпрямления IK1, ответственного за поддержание потенциала покоя в сердечной ткани позвоночных [16], зарегистрировать потенциалы действия (ПД) в режиме поддержания тока было возможно только в желудочковых кардиомиоцитах, где ток IK1 был более выражен (см. рис. 2). Анализировали такие параметры, как длительность ПД на уровнях 50 и 90% реполяризации (ДПД50 и ДПД90 соответственно), а также максимальную скорость нарастания переднего фронта ПД. На рис. 3 представлены репрезентативные записи ПД, а также гистограммы, отражающие сравнение анализируемых параметров.
Рис. 3.
Влияние гибернации на конфигурацию потенциалов действия в желудочковых кардиомиоцитах суслика. Репрезентативные записи ПД (a), сравнение длительности ПД на уровне 50% (b) и 90% (c) реполяризации и максимальной скорости нарастания переднего фронта ПД (d). NS – отсутствие статистически значимых различий, t-тест Стьюдента.
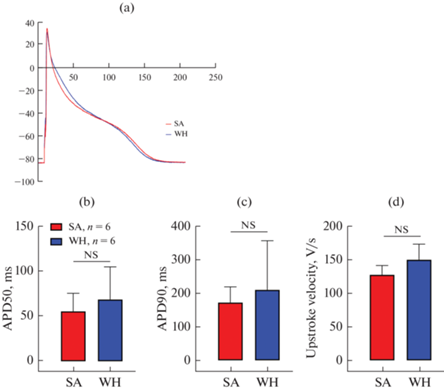
Мы не обнаружили статистически значимых различий между SA и WH группами в конфигурации ПД. Мембранный потенциал покоя также не различался между группами и составлял –82.66 ± 0.72 мВ в кардиомиоцитах от SA сусликов и –81.25 ± 0.93 мВ у WH сусликов (p = 0.3, t-тест Стьюдента).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Данное исследование, помимо рассмотрения влияния гибернации, впервые затрагивает изучение калиевых токов в миокарде одного из наиболее известных гибернирующих видов млекопитающих – длиннохвостого суслика. Мы впервые показали присутствие в миокарде суслика высокоамплитудного тока Ito; прочие мажорные калиевые токи задержанного выпрямления, такие как IKr и IKs, в миокарде суслика обнаружены не были. Это делает электрофизиологический фенотип сердца сусликов весьма сходным с таковым для миокарда лабораторных грызунов – в частности крыс, для которых также характерны большой ток Ito и низкоамплитудный IKur [17]. Таким образом, ввиду того что для разных калиевых токов характерна различная степень температурной зависимости, мы полагаем, что наиболее корректно при сравнении с сусликами в качестве группы не зимоспящих животных использовать именно крыс.
Также в данной работе мы впервые показали, что гибернация приводит к снижению амплитуды транзиторного выходящего тока Ito – который, исходя из его большой амплитуды и сходности электрофизиологических фенотипов миокарда крысы и суслика, может быть основным реполяризующим током в миокарде суслика. При этом, однако, длительность ПД на различных уровнях реполяризации в группе WH осталась неизменной. Более ранние исследования показали, что адаптация к зимнему периоду и гибернация приводят к снижению амплитуды кальциевого тока L‑типа в желудочковом миокарде сусликов [12]. Поскольку кальциевый ток участвует в формировании фазы плато ПД [18], а Ito в миокарде сусликов предположительно (аналогично роли в миокарде крысы) вносит основной вклад в реполяризацию [17], то в совокупности эти разнонаправленные изменения выраженности ICaL и Ito могут привести к тому, что длительность ПД практически не изменяется. Если снижение кальциевого тока при гибернации может предотвращать перегрузку кардиомиоцитов кальцием, то снижение амплитуды Ito может служить механизмом, предотвращающим чрезмерное укорочение ПД и сокращение длительности рефрактерного периода. В свою очередь, увеличение длительности рефрактерного периода, вплоть до развития постреполяризационной рефрактерности, может быть одним из механизмов, предотвращающих возникновений аритмий при снижении температуры [10]. Помимо прямого влияния на длительность ПД, изменение амплитуды Ito у гибернирующих животных может также определять уровень мембранного потенциала в фазе плато [19] – и, соответственно, опосредованно влиять на вход кальция и длительность мембранного потенциала. Также в данной работе мы показали, что гибернация ведет к разнонаправленным изменениям в амплитудах токов Ito и IK1 – что также может быть причиной отсутствия изменений в длительности ПД, регистрируемых в миокарде групп WH и SA.
Мы также впервые показали, что по крайней мере в желудочковом миокарде суслика гибернация приводит к усилению тока IK1. Данная адаптация может быть важна для поддержания нормального уровня потенциала покоя при снижении температуры тела во время гибернации. В самом деле, предыдущие исследования показали, что в миокарде суслика при снижении температуры мембрана деполяризуется по крайней мере в значительно меньшей степени по сравнению с таковым в миокарде не гибернирующих животных [11, 20]. С другой стороны, при анализе зарегистрированных нами потенциалов действия мы не обнаружили заметной гиперполяризации мембраны кардиомиоцитов, полученных от животных в состоянии гибернации – чего можно было бы ожидать при усилении тока IK1. Можно предположить, что изменения в амплитуде тока IK1, вызванные гибернацией, оказались недостаточны для значимого изменения уровня мембранного потенциала. Однако ввиду того, что регистрируемый потенциал покоя при регистрации ПД методом пэтч-кламп в значительной степени зависит от качества контакта между мембраной клетки и пэтч-пипетки, что, в свою очередь, зависит от процесса выделения и качества изолированных кардиомиоцитов [21], результаты данной части исследования должны быть интерпретированы с осторожностью.
Отсутствие различий в длительности ПД на различных уровнях реполяризации в желудочковых кардиомиоцитах хорошо согласуется с полученными ранее данными о длительности ПД в миокарде SA и WH сусликов, а также крыс [11]. С другой стороны, аналогичные исследования, выполненные на предсердном миокарде сусликов, показали некоторое увеличение длительности ПД в миокарде гибернирующей группы при равной температуре и длине цикла стимуляции [10] – предположительно, это может быть связано с изменением амплитуды ультрабыстрого тока задержанного выпрямления IKur, который не рассматривался в данном исследовании. Мы в данной работе показали, что изменение амплитуды мажорных калиевых токов, участвующих в реполяризации и поддержании потенциала покоя (а именно Ito и IK1), в разной степени выражено в желудочковом и предсердном миокарде. В совокупности это может указывать на то, что при гибернации ремоделирование электрической активности миокарда предсердий и желудочков происходит по-разному.
Таким образом, данное исследование впервые рассматривает изменения в выраженности реполяризующих калиевых токов при адаптации к гибернации. Выявленные различия в амплитуде токов Ito и IK1 между активными и гибернирующими сусликами могут предположительно вносить вклад в увеличение длительности рефрактерного периода и поддержание потенциала покоя при низких температурах, предотвращая развитие аритмий и способствуя выживанию животных.
Список литературы
Lyman CP, Chatfield PO (1955) Physiology of Hibernation in Mammals. Phys Rev 35: 403–425. https://doi.org/10.1152/PHYSREV.1955.35.2.403
Barnes BM (1989) Freeze Avoidance in a Mammal: Body Temperatures Below 0°C in an Arctic Hibernator. Science 244: 1593–1595. https://doi.org/10.1126/SCIENCE.2740905
Andrews MT (2007) Advances in molecular biology of hibernation in mammals. BioEssays 29: 431–440. https://doi.org/10.1002/BIES.20560
Johansson BW (1996) The hibernator heart – Nature’s model of resistance to ventricular fibrillation. Cardiovasc Res 31: 826–832. https://doi.org/10.1016/S0008-6363(95)00192-1
Burlington RF, Darvish A (1988) Low-Temperature Performance of Isolated Working Hearts from a Hibernator and a Nonhibernator. Physiol Zool 61: 387–395. https://doi.org/10.1086/PHYSZOOL.61.5.30161260
White JD (1980) Cardiac Arrest in Hypothermia. JAMA 244: 2262–2262. https://doi.org/10.1001/JAMA.1980.03310200014007
Johansson BW (1985) Ventricular Repolarization and Fibrillation Threshold in Hibernating Species. Eur Heart J 6: 53–62. https://doi.org/10.1093/EURHEARTJ/6.SUPPL_D.53
Egorov YV, Glukhov AV, Efimov IR, Rosenshtraukh LV (2012) Hypothermia-induced spatially discordant action potential duration alternans and arrhythmogenesis in nonhibernating versus hibernating mammals. Am J Physiol – Hear Circ Physiol 303(8): H1035–H1046. https://doi.org/10.1152/AJPHEART.00786.2011/ASSET/IMAGES/LARGE/ZH40201205500008.JPEG
Fedorov VV, Glukhov AV, Sudharshan S, Egorov Y, Rosenshtraukh LV, Efimov IR (2008) Electrophysiological mechanisms of antiarrhythmic protection during hypothermia in winter hibernating versus nonhibernating mammals. Hear Rhythm 5: 1587–1596. https://doi.org/10.1016/J.HRTHM.2008.08.030
Kuzmin VS, Abramov AA, Egorov YV, Rosenshtraukh LV (2019) Hypothermia-Induced Postrepolarization Refractoriness Is the Reason of the Atrial Myocardium Tolerance to the Bioelectrical Activity Disorders in the Hibernating and Active Ground Squirrel Citellus undulatus. Dokl Biol Sci 486: 63–68. https://doi.org/10.1134/S0012496619030050/FIGURES/3
Kuz’min VS, Abramov AA, Egorov IV, Rozenshtraukh LV (2014) Hypothermia induced alteration of refractoriness in the ventricular myocardium of ground souirrel Citellus undulatus. Ross Fiziol Zhurnal Im IM Sechenova 100: 1399–1408.
Alekseev AE, Markevich NI, Korystova AF, Terzic A, Kokoz YM (1996) Comparative analysis of the kinetic characteristics of L-type calcium channels in cardiac cells of hibernators. Biophys J 70: 786–797. https://doi.org/10.1016/S0006-3495(96)79618-2
Abramochkin DV, Filatova TS, Pustovit KB, Dzhumaniiazova I, Karpushev AV (2021) Small G—protein RhoA is a potential inhibitor of cardiac fast sodium current. J Physiol Biochem 77: 13–23. https://doi.org/10.1007/s13105-020-00774-w
Isenberg G, Klockner U (1982) Calcium tolerant ventricular myocytes prepared by preincubation in a “KB medium.” Pflügers Arch Eur J Physiol 395: 6–18. https://doi.org/10.1007/BF00584963
Yue L, Feng J, Li GR, Nattel S (1996) Transient outward and delayed rectifier currents in canine atrium: properties and role of isolation methods. Am J Physiol Circ Physiol 270: H2157–H2168. https://doi.org/10.1152/AJPHEART.1996.270.6.H2157
Ibarra J, Morley GE, Delmar M (1991) Dynamics of the inward rectifier K+ current during the action potential of guinea pig ventricular myocytes. Biophys J 60: 1534–1539. https://doi.org/10.1016/S0006-3495(91)82187-7
Apkon M, Nerbonne JM (1991) Characterization of two distinct depolarization-activated K+ currents in isolated adult rat ventricular myocytes. J Gen Physiol 97: 973–1011. https://doi.org/10.1085/JGP.97.5.973
Linz KW, Meyer R (2000) Profile and kinetics of L-type calcium current during the cardiac ventricular action potential compared in guinea-pigs, rats and rabbits. Pflügers Arch 439: 588–599. https://doi.org/10.1007/S004249900212
Dong M, Yan S, Chen Y, Niklewski PJ, Sun X, Chenault K, Wang HS (2010) Role of the Transient Outward Current in Regulating Mechanical Properties of Canine Ventricular Myocytes. J Cardiovasc Electrophysiol 21: 697–703. https://doi.org/10.1111/J.1540-8167.2009.01708.X
Liu B, Arlock P, Wohlfart B, Johansson BW (1991) Temperature effects on the Na and Ca currents in rat and hedgehog ventricular muscle. Cryobiology 28: 96–104. https://doi.org/10.1016/0011-2240(91)90011-C
Wilson JR, Clark RB, Banderali U, Giles WR (2011) Measurement of the membrane potential in small cells using patch clamp methods. Channels 5: 530. https://doi.org/10.4161/CHAN.5.6.17484
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


