Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 6, стр. 760-770
Влияние озона на кислородсвязывающие свойства крови и ее прооксидантно-антиоксидантный баланс в условиях воздействия на H2S-генерирующую систему
В. В. Зинчук 1, *, Е. С. Билецкая 1
1 Гродненский государственный медицинский университет
Гродно, Беларусь
* E-mail: zinchuk@grsmu.by
Поступила в редакцию 03.04.2023
После доработки 11.05.2023
Принята к публикации 12.05.2023
- EDN: WHITZF
- DOI: 10.31857/S0869813923060080
Аннотация
Сероводород относится к группе сигнальных агентов, называемых газотрансмиттерами, и играет важную роль во многих физиологических процессах, в частности в реализации кислородзависимых механизмов. Цель данного исследования – изучить значение сероводорода в эффекте озона на кислородсвязывающие свойства крови и прооксидантно-антиоксидантный баланс в опытах in vitro. Использовались озон (концентрация 6 мг/л) и препараты, влияющие на синтез сероводорода (пропаргилглицин, гидросульфид натрия и его комбинация с нитроглицерином). Применение ингибитора синтеза сероводорода пропаргилглицина приводило к уменьшению эффекта озона на кислородтранспортную функцию крови (снижение РО2, SO2, Р50реал). При добавлении гидросульфида натрия не усиливалось воздействие этого газа на данные параметры, но в его комбинации с нитроглицерином увеличивалось влияние озона на кислородтранспортную функцию крови. Пропаргилглицин не влиял на прооксидантно-антиоксидантный баланс в условиях проведения опытов, а доноры сероводорода и монооксида азота увеличивали активность каталазы. Пропаргилглицин в условиях действия озона приводил к уменьшению уровня нитрат/нитритов, а гидросульфид натрия увеличивал их концентрацию. Комбинация гидросульфида натрия и нитроглицерина способствовала росту сероводорода в плазме крови.
ВВЕДЕНИЕ
Озон используется в реабилитации пациентов, перенесших COVID-19 [1], что связано с его положительным воздействием на функционирование различных систем организма, включающее бактерицидный, фунгицидный, вирулицидный, противовоспалительный, иммунокорригирующий и антигипоксический эффекты, подтвержденные клиническими и экспериментальными наблюдениями [2]. Широко распространен вариант использования озона в качестве аутогемотерапии, основанной на заборе крови у пациента, насыщении ее озоном и последующем обратном введении в организм, однако механизмы действия данного газа в этих условиях (in vitro) остаются не раскрытыми [3].
H2S представляет собой газообразную сигнальную молекулу, играющую важную роль во многих физиологических процессах и относящуюся, как и монооксид азота и монооксид углерода к группе сигнальных агентов, называемых газотрансмиттерами [4]. Данная молекула модулирует разнообразные физиологические функции на различных уровнях в экспериментальных и естественных условиях. Этот газотрансмиттер может образовываться как в ферментативных, так и в неферментативных реакциях. В ферментативной продукции H2S в организме участвуют три фермента: цистатионин-γ-лиаза, цистатионин-β-синтаза (CSE) и 3-меркаптопируватсульфотрансфераза, последняя способствует синтезу H2S в эритроцитах [5]. Сероводород оказывает влияние на механизмы транспорта кислорода кровью в том числе и за счет взаимодействия с монооксидом азота (NO) [6]. В ранее проведенном нами эксперименте озон повышал сродство гемоглобина к кислороду (СГК), при этом отмечался рост уровня H2S [7].
Кроме того, H2S участвует в регуляции окислительно-восстановительного баланса клетки. Снижение его синтеза сопровождается повышенным образованием активных форм кислорода, ростом активности перекисного окисления липидов, а введение доноров H2S подавляет развитие окислительного стресса и активирует антиоксидантные ферменты, такие как супероксиддисмутаза, каталаза и глутатионпероксидаза [8, 6 ].
В связи с этим особый интерес представляет изучение действия озона в условиях модификации синтеза сероводорода. Цель работы – оценить эффект озона на кислородсвязывающие свойства крови и ее прооксидантно-антиоксидантный баланс при влиянии на H2S-генерирующую систему в опытах in vitro.
МЕТОДЫ ИССЛЕДОВАНИЯ
Забор смешанной венозной крови осуществляли в условиях наркоза (50 мг/кг тиопентала натрия, интраперитонеально) из правого предсердия в предварительно подготовленный шприц с гепарином из расчета 50 ЕД на 1 мл крови. Опыты были выполнены на образцах крови, забранных от белых крыс-самцов массой 250–300 г (n = 10), предварительно содержавшихся в стандартных условиях вивария, проводились эксперименты in vitro. Образцы крови были разделены на 5 групп по 3 мл. К каждой аликвоте добавляли озонированный изотонический раствор хлорида натрия в объеме 1 мл (в 1-ю без озонирования) и 0.1 мл растворов, содержащих газотрансмиттеры (в 3-ю – гидросульфид натрия, конечная концентрация 0.38 ммоль/л (Sigma-Aldrich)), в 4-ю – комбинация нитроглицерина (конечная концентрация 0.05 ммоль/л (SchwarzPharma AG)) и гидросульфида натрия 0.38 ммоль/л, в 5-ю – необратимый ингибитор фермента CSE – DL-пропаргилглицин (PAG, конечная концентрация 0.73 ммоль/л, (Chem-Impex International)) и изотонический раствор хлорида натрия (в 1-ю, 2-ю), после чего пробы перемешивались. Время инкубации составляло 60 мин. Изотонический раствор хлорида натрия барбатировался озоно-кислородной смесью, которая создавалась озонотерапевтической установкой УОТА-60-01-Медозон (Россия). В эксперименте использовался озон (концентрация 6 мг/л).
Показатели КТФ (кислородтранспортная функция крови) крови определяли на газоанализаторе Stat Profile pHOx plus L в крови при 37°C после добавления озона: парциальное давление кислорода (РО2), степень оксигенации (SO2) и кислотно-основного состояния: парциальное давление углекислого газа (РСО2), стандартный бикарбонат (SBC), реальный/стандартный недостаток (избыток) буферных оснований (АВЕ/SBE), гидрокарбонат $\left( {{\text{НСО}}_{3}^{ - }} \right){\kern 1pt} ,$ концентрация водородных ионов (рН), общая углекислота плазмы крови (ТСО2). СГК оценивали по показателю Р50реал (РО2 крови при 50%-ном насыщении ее кислородом), рассчитываемого по значениям PO2 и SO2 на основании уравнения Хилла. Значение Р50станд и положение кривой диссоциации оксигемоглобина (КДО) рассчитывали по формулам Severinghaus [9]. Затем центрифугировали кровь 10 мин при 3000 об./мин, отбирали плазму, а эритроциты трижды отмывали изотоническим раствором хлорида натрия.
Процессы свободнорадикального окисления оценивали по концентрации промежуточных и первичных продуктов перекисного окисления липидов в эритроцитарной массе: малонового диальдегида (МДА) и диеновых конъюгатов (ДК). По интенсивности поглощения липидным экстрактом монохроматического светового потока в области спектра 232–234 нм, свойственного для конъюгированных диеновых структур гидроперекисей липидов, выявляли концентрацию ДК. На спектрофлуориметре СМ 2203 “Солар” (Беларусь) при длине волны 233 нм по отношению к контролю измеряли оптическую плотность [10]. По взаимодействию с 2-тиобарбитуровой кислотой, которая в кислой среде при высокой температуре способствует формированию триметинового комплекса розового цвета, определяли уровень МДА. При помощи спектрофотометра PV1251C “Солар” (Беларусь) при длине волны 540 нм по отношению к контролю измеряли интенсивность окраски [11]. Активность каталазы определяли спектрофотометрически (PV1251C “Солар”) в эритроцитарной массе по способности пероксида водорода образовывать с солями молибдена стойко окрашенный комплекс при длине волны 410 нм [12]. По методу Taylor на спектрофлуориметре СМ 2203 “СОЛАР” (Беларусь) регистрировали концентрацию α-токоферола и ретинола [13]. По суммарному содержанию нитрат/нитритов $\left( {{\text{NО}}_{3}^{ - }{\text{/NО}}_{2}^{ - }} \right)$ в плазме крови спектрофотометрическим методом с реактивом Грисса при длине волны 540 нм оценивали продукцию эндогенного NO [14]. В плазме крови определяли уровень эндогенного сероводорода (H2S) спектрофотометрическим методом, основанном на реакции между сульфид-анионом и раствором N,N-диметил-парафенилендиамина солянокислого в присутствии хлорного железа при длине волны 670 нм [15]. Рассчитывали концентрацию газотрансмиттеров по калибровочным графикам и результаты выражали в мкмоль/л.
С использованием критерия Шапиро–Уилка проверяли все показатели на соответствие признака закону нормального распределения. В результате прибегнули к непараметрической статистике с применением программы “Statistica 10.0”. С помощью рангового дисперсионного анализа Крускала–Уоллиса проводили сравнение трех и более независимых групп. С учетом размеров малой выборки, достоверность полученных данных множественных сравнений оценивалась с использованием U-критерия Манна–Уитни. Критерий Вилкоксона использовали при проведении парных сравнений уровней показателей внутри групп при повторных измерениях. Уровень статистической значимости принимали при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Инкубация крови с озоном увеличивает основные показатели кислородтранспортной функции крови (табл. 1) и сопровождается сдвигом КДО вправо (рис. 1).
Таблица 1.
Кислородтранспортная функция крови в условиях изменения активности цистеин/цистин системы в опытах in vitro
| Показатель | Контроль | О3 | NaHS + О3 | PAG + О3 | NaHS + О3 + + нитроглицерин |
|---|---|---|---|---|---|
| n | 10 | 10 | 10 | 10 | 10 |
| SO2, % | 29.75 [29.38; 31.18] |
38.65 [36.80; 44.23] * |
37.30 [35.08; 42.80]* |
30.70 [26.73; 33.78]Ω# |
44.80 [44.10; 46.20]*Ω# Ѱ |
| PO2, мм рт. ст. | 19.65 [19.43; 19.98] |
27.3 [26.23; 27.78]* |
27.80 [24.50; 33.30]* |
20.25 [20.10; 21.88]*Ω# |
31.45 [30.93; 31.58]*Ω Ѱ |
| рН, ед | 7.374 [7.372; 7.377] |
7.414 [7.403; 7.435]* |
7.375 [7.371; 7.382]Ω |
7.381 [7.352; 7.411]Ω |
7.413 [7.395; 7.422]*# Ѱ |
| РСО2, мм рт. ст. | 39.6 [39.40; 39.88] |
34.30 [30.43; 35.90]* |
36.75 [34.15; 37.48]*Ω |
39.15 [37.78; 40.83]Ω |
33.40 [31.05; 35.18]*# Ѱ |
| ${\text{HCО}}_{3}^{ - },$ ммоль/л | 23.55 [23.40; 23.78] |
22.40 [20.88; 22.98]* |
22.05 [22.00; 23.38] |
23.65 [22.63. 23.95] |
20.50 [20; 21.38]*Ω Ѱ |
| ТСO2, ммоль/л | 24.85 [24.63; 24.98] |
23.5 [21.9; 24.08]* |
23.20 [23.10; 24.58] |
24.75 [23.83; 25.05] |
21.70 [21.15; 22.58]*# Ѱ |
| ABE, ммоль/л | –1.70 [–1.80; –1.63] |
–2.20 [–4.075; –1.225] |
–2.70 [–3.38; –1.88]* |
–1.45 [–3.08; –1.03] |
–4.05 [–4.6; –3.28]*Ω# Ѱ |
| SBE, ммоль/л | –0.70 [–0.80; –0.7] |
–1 [–2.55; –0.075] |
–1.75 [–2.10; –0.93]* |
–0.65 [–1.88; 0.10] |
–2.50 [–3.33; –1.78]*Ω Ѱ |
| SBC, ммоль/л | 22.9 [22.8; 22.98] |
22.95 [21.45; 23.58] |
22.10 [21.70; 22.73]* |
22.85 [21.73; 23.58] |
21.40 [20.78; 21.98]*Ω Ѱ |
| Р50реал, мм рт. ст. | 27.63 [27.58; 27.68] |
32.18 [31.58; 32.92]* |
30.44 [29.54; 31.65]* |
27.82 [26.78; 28.34]Ω# |
41.05 [36.80; 43.70]*Ω# Ѱ |
| Р50станд, мм рт. ст. | 26.8 [26.71; 26.82] |
32.5 [31.25; 34.175]* |
31.50 [29.20; 36.50]* |
26.65 [26.50; 26.78]Ω# |
40.65 [36.5; 43.05]*Ω# Ѱ |
Рис. 1.
Эффект озона на положение кривой диссоциации оксигемоглобина при реальных значениях рН и РСО2 в условиях изменения активности цистеин/цистин системы: ▲ –контроль; ◆ – озон; ◻ – пропаргилглицин + озон; ◼ – гидросульфид натрия + озон + нитроглицерин.
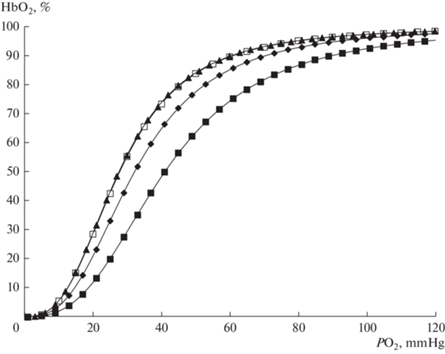
Введение ингибитора синтеза сероводорода (CSE) в этих условиях приводит к уменьшению: PO2 на 25.8% (p < 0.05), SO2 на 20.6% (p < 0.05) по сравнению группой, в которую вводили только озон. Показатель сродства гемоглобина к кислороду Р50реал при этом уменьшается на 13.6% (p < 0.05), КДО в этой серии смещается влево (рис. 1).
При добавлении гидросульфида натрия в кровь, в условиях введения озона, не наблюдается усиления его эффекта на параметры кислородтранспортной функции крови. В то же время введение комбинации нитроглицерина и гидросульфида натрия приводит к увеличению PO2 на 15.2% (p < 0.05), SO2 на 15.9% (p < 0.05). Показатель сродства гемоглобина к кислороду Р50реал растет на 27.6% (p < 0.05) и соответственно КДО сдвигается вправо (рис. 1) по сравнению группой, в которую вводили только озон. Также наблюдается увеличение Р50станд на 25.1% (p < 0.05). Значимых изменений параметров кислотно-основного состояния не отмечается.
В табл. 2 представлены данные о характере изменения показателей процессов перекисного окисления липидов и состояния системы антиоксидантной защиты. Добавление озона в исследуемую кровь проводит к росту активности продуктов перекисного окисления липидов в эритроцитарной массе: МДА на 31.2% (р < 0.05), ДК на 234.9% (р < 0.05). При этом увеличиваются уровни антиоксидантной защиты: в эритроцитарной массе содержание каталазы возрастает на 35.5% (р < 0.05), в плазме количество ретинола повышается на 14.5% (р < 0.05), α-токоферола на 46.3% (р < 0.05) по отношению к контрольной группе.
Таблица 2.
Параметры прооксидантно-антиоксидантного баланса в условиях изменения активности цистеин/цистин системы в опытах in vitro
| Показатель | Контроль | О3 | NaHS + О3 | PAG + О3 | NaHS + О3 + + нитроглицерин |
|---|---|---|---|---|---|
| n | 10 | 10 | 10 | 10 | 10 |
| МДА, мкмоль/л | 18.07 [16.68; 19.10] |
23.71 [21.17; 26.50]* |
23.77 [19.56; 27.83]* |
22.79 [18.96; 26.98]* |
21.91 [20.69; 26.43]* |
| ДК, ЕД/мл | 4.99 [4.54; 5.72] |
16.71 [16.10; 17.95]* |
16.84 [15.15; 17.63]* |
16.31 [12.40; 16.68]* |
16.45 [14.99; 17.42]* |
| Каталаза, ммоль Н2О2/мин/г Hb | 10.86 [10.30; 11.72] |
14.71 [14.21; 15.33] * |
18.69 [18.50; 19.11]*Ω |
14.10 [12.28; 17.80]*# |
18.18 [18.10; 18.29]*Ω# Ѱ |
| Ретинол, мкмоль/л | 0.83 [0.81; 0.84] |
0.95 [0.91; 0.97]* |
0.97 [0.96; 1.04]* |
0.95 [0.94; 0.97]* |
0.98 [0.94; 1.07]* |
| α-токоферол, мкмоль/л | 8.70 [8.52; 8.92] |
12.73 [12.25; 14.91]* |
12.60 [11.49; 12.67]* |
12.40 [11.94; 13.76]* |
12.23 [12.16; 13.23]* |
Введение пропаргилглицина не приводит к существенным изменениям показателей прооксидантно-антиоксидантного баланса в сравнении с группой, в которую добавляли только озон. Добавление донора синтеза сероводорода не потенцирует эффект озона на концентрацию промежуточных и первичных продуктов перекисного окисления липидов. В то же время активность каталазы в группах с гидросульфидом натрия возрастает на 27.1% (р < 0.05), нитроглицерина с гидросульфидом натрия на 23.6% (р < 0.05) по отношению к группе в которую добавляли только озон. Однако уровни ретинола и α-токоферола в данных группах не меняются.
Суммарное содержание ${\text{NО}}_{3}^{ - }{\text{/NО}}_{2}^{ - }$ в плазме крови (табл. 3) под действием О3 возрастает на 41.7%, р < 0.05.
Таблица 3.
Концентрация нитрат/нитритов и сероводорода в плазме крови под действием озона в условиях изменения активности цистеин/цистин системы в опытах in vitro
| Показатель | Контроль | О3 | NaHS + О3 | PAG + О3 | NaHS + О3 + + нитроглицерин |
|---|---|---|---|---|---|
| n | 10 | 10 | 10 | 10 | 10 |
| ${\text{NО}}_{3}^{ - }{\text{/NО}}_{2}^{ - }$мкмоль/л | 16.19 [15.42; 16.81] |
22.94 [22.21; 24.05]* |
37.49 [34.92; 39.15]*Ω |
11.59 [10.89; 12.17]*Ω# |
54.87 [53.47; 56.49]*Ω#Ѱ |
| H2S мкмоль/л |
7.52 [7.19; 8.93] |
11.28 [7.29; 12.44] |
18.55 [15.59; 19.28]*Ω |
9.32 [7.46; 11.52]# |
24.14 [22.74; 25.35]*Ω#Ѱ |
Пропаргилглицин снижает уровни метаболитов NO и H2S на 49.5% (р < 0.05) и на 17.4% (р < 0.05) соответственно по сравнению с группой, в которую вводили только озон. При добавлении гидросульфида натрия в этих условиях концентрация нитрат/нитритов увеличивается на 63.4% (р < 0.05); комбинация нитроглицерина и гидросульфида натрия существенно увеличивает данный параметр на 139.2% (р < 0.05) по сравнению с группой, в которую вводили только озон. Уровень газотрансмиттера H2S (табл. 3) под действием озона возрастает на 50.0%, (р < 0.05) в сравнении с контрольной группой. Добавление гидросульфида натрия увеличивает данный параметр на 64.5% (р < 0.05), а комбинация нитроглицерина и гидросульфида натрия приводит к росту данного показателя на 114.0% (р < 0.05) по сравнению с группой, в которую вводили только озон.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В ряде работ обсуждается возможность изменение СГК под действием озона [16, 17], однако его непосредственного измерения в экспериментальных условиях не осуществлялось. Результаты наших предыдущих исследований свидетельствуют о том, что озон изменяет СГК, реализуя свой эффект за счет газотрансмиттера NO [7].
Согласно полученным нами данным, ингибитор синтеза сероводорода в условиях действия озона уменьшает РО2, SO2, Р50реал крови и сопровождается сдвигом КДО влево, а введение гидросульфида натрия в исследуемый образец, не меняет эффект озона на параметры КТФ крови. Форменные элементы крови и прежде всего эритроциты, а также компоненты плазмы принимают активное участие в метаболизме сероводорода, контролируя его концентрацию [18]. Эта сигнальная молекула метаболизируется в красных кровяных клетках при участии гемоглобина с образованием тиосульфатов и гидрополисульфидов, участвующих в биосигнализация [19].
В частности, сульфид поглощается антипортером AE-1 эритроцитарной мембраны в обмен на Cl– (влияя на СГК), а также сульфид реагирует с метгемоглобином, образуя соответствующий комплекс –SH2/–SH– [20]. Кроме того, эффекты сероводорода связаны с персульфидацией белков (как эритроцитов, так и плазмы) – превращением тиоловой группы цистеина (–SH) в соответствующий персульфид (–SSH) [21], что обеспечивает элиминацию сероводорода. Газотрансмиттер сероводород задействован в реализации эффекта озона на СГК [7]. Как известно, H2S участвует в окислительной модификации белковых молекул посредством сульфгидрации через H2S-опосредованное окисление цистеина до персульфидов, способствуя их химической реорганизации [22]. Кроме того, H2S способствует активации дифосфоглицератмутазы, стимулирующей синтез 2,3-дифосфоглицерата и уменьшающей СГК [23]. Также взаимодействие гемоглобина с данным газом приводит к образованию сульфгемоглобина, который снижает СГК [24]. В основе механизмов действия озона лежит его высокая реакционная способность к соединениям, содержащим двойную углеродную связь [25], в частности фосфолипидов, входящих в состав клеточных мембран. В результате образуются промежуточные перекисные соединения, так называемые озониды [26], которые при введении в организм в малых терапевтических дозах модифицируют липидный бислой мембран эритроцитов, улучшают реологические свойства крови, приводят к активации внутриклеточной защитной антиоксидантной системы по триггерному механизму и кислородзависимых реакций, а также улучшают снабжение тканей кислородом [27]. Можно предположить, судя по нашим результатам, что имеющихся в естественных условиях количеств сероводорода достаточно для реализации эффекта озона на КТФ крови, в связи с чем добавление донора сероводорода не меняет кислородсвязывающих свойств крови, а ингибитор сероводорода увеличивает СГК.
H2S в отличие от NO действует не как типичная сигнальная молекула, но взаимодействуя с ним, может выступать медиатором NO-сигнальной активности [28]. Как показали наши исследования, H2S в комбинации с донором NO (нитроглицерином) приводит к росту РО2, SO2, Р50реал и способствует более выраженному сдвигу КДО вправо, т.е. увеличивает эффект озона на эти показатели крови. Показано, что комбинированная обработка донорами NO и H2S приводит к NO-сигнальной активности за счет образования более активных динитрозильных комплексов железа с персульфидными лигандами в клетке [28]. Молекула NO взаимодействует с цистеином, преобразуя его пространственную структуру и увеличивая энергию химических связей. Также эндогенный сероводород может влиять на различные изоформы NO-синтазы, приводя к взаимоусилению физиологических эффектов [22].
Важно отметить, что введение ингибитора синтеза сероводорода уменьшает концентрацию нитрат/нитритов в плазме крови в сравнении с группой, в которую вводили только озон. Однако содержание метаболитов NO при добавлении гидросульфида натрия в условиях введения озона растет. Механизм данного явления основан на усилении фосфорилирования конститутивной изоформы NO-синтазы с последующим увеличением продукции NO [29]. Также стоит подчеркнуть, что сероводород опосредует восстановление нитритов до NO через ксантиноксидазу [30]. Одним из предполагаемых эффектов озона на реологические свойства крови является активация NO-синтазы, усиливается синтез оксида азота, вследствие чего увеличивается количество транспортируемого кислорода [31].
Ингибирование синтеза H2S в условиях наших опытов не меняет активность процессов перекисного окисления липидов. Газотрансмиттер сероводород может проявлять восстановительные свойства через различные механизмы. H2S преобразовывает липопротеины низкой плотности в липоспирты и ингибирует окисление гемоглобина, предотвращает рост процессов свободно-радикального окисления липидов. Данный газ снижает высвобождение активных форм кислорода за счет стимуляции интерлейкина 6 [6]. Cульфгидрация, опосредованная H2S, представляет собой защитный механизм в условиях окислительного стресса. В нашем исследовании не наблюдается снижения продуктов перекисного окисления липидов. Согласно данным Bieza и соавт. [22], генерация H2S в естественных условиях может быть недостаточной для обеспечения прямого антиоксидантного ответа, что предполагает участие иных механизмов, судя по нашим данным, связанных с кислородсвязывающими свойствами крови, при окислительном стрессе, индуцированным действием озона [32]. В то же время стоит отметить увеличение активности каталазы при введении гидросульфида натрия и его комбинации с нитроглицерином в проведенном нами исследовании, что может быть связано с усилением гидросульфидом натрия эффектов монооксида азота, синтез которого создает условия для поддержания окислительно-восстановительного баланса и сохранения целостности клеточной мембраны [33].
Таким образом, полученные нами данные свидетельствуют о сложном неоднозначном вкладе сероводорода в эффект озона на кислородсвязывающие свойства крови и ее прооксидантно-антиоксидантный баланс:
1. Ингибитор синтеза газотрансмиттера сероводорода приводит к снижению эффекта озона на КТФ крови (уменьшает РО2, SO2, Р50реал, наблюдается сдвиг КДО влево). Введение гидросульфида натрия не усиливает воздействие этого газа на данные параметры. Донор газотрансмиттера NO в комбинации с H2S увеличивает влияние данного газа на КТФ крови.
2. Модификация синтеза газотрансмиттера H2S (использование как ингибитора, так и донора) не влияет на активность процессов перекисного окисления липидов в условиях введения озона. В то же время, доноры H2S и NO увеличивают активность каталазы, не меняя при этом концентрации ретинола и α-токоферола.
3. Введение пропаргилглицина в условиях действия озона приводит к уменьшению уровня нитрат/нитритов, а гидросульфид натрия увеличивает их концентрацию. Комбинация гидросульфида натрия и нитроглицерина способствует росту сероводорода в плазме крови. Полученные данные демонстрируют сложную природу синергичного взаимодействия данных газотрансмиттеров, имеющих значение для модификации КТФ крови.
Список литературы
Tirelli U, Franzini M, Valdenassi L, Pisconti S, Taibi R, Torrisi C, Pandolfi S, Chirumbolo S (2021) Fatigue in post-acute sequelae of SARS-CoV2 (PASC) treated with oxygen-ozone autohemotherapy – preliminary results on 100 patients. Eur Rev Med Pharmacol Sci 25(18): 5871–5875. https://doi.org/10.26355/eurrev_202109_26809
Pchepiorka R, Moreira MS, Lascane NADS, Catalani LH, Allegrini S Jr, de Lima NB, Gonçalves EF (2020) Effect of ozone therapy on wound healing in the buccal mucosa of rats. Arch Oral Biol (119): 104889. https://doi.org/:10.1016/j.archoralbio.2020.104889
Smith NL, Wilson AL, Gandhi J, Vatsia S, Khan SA (2017) Ozone therapy: an overview of pharmacodynamics, current research, and clinical utility. Med Gas Res 7(3): 212–219. https://doi.org/10.4103/2045-9912.215752
Robert B, Subramaniam S (2022) Gasotransmitter-Induced Therapeutic Angiogenesis: A Biomaterial Prospective. ACS Omega 7(50): 45849–45866. https://doi.org/10.1021/acsomega.2c05599
Głowacka U, Brzozowski T, Magierowski M (2020) Synergisms, discrepancies and Interactions between Hydrogen Sulfide and Carbon Monoxide in the Gastrointestinal and Digestive System Physiology, Pathophysiology and Pharmacology. Biomolecules 10(3): 445–460. https://doi.org/10.3390/biom10030445
Yang YW, Deng NH, Tian KJ, Liu LSh, Wang Z, Wei DH, Liu HT, Jiang ZhS (2022) Development of hydrogen sulfide donors for anti-atherosclerosis therapeutics research: Challenges and future priorities. Front Cardiovasc Med (9): 909178. https://doi.org/10.3389/fcvm.2022.909178
Зинчук ВВ, Билецкая ЕС, Гуляй ИЕ (2021) Влияние озона на кислородтранспортную функцию крови и прооксидантно-антиоксидантный баланс в условиях изменения образования монооксида азота в экспериментах in vitro. Рос физиол журн им ИМ Сеченова 107(1): 16–27. [Zinchuk VV, Biletskaya ES, Gulyai IE (2021) Effect of ozone on blood oxygen transport function and pro-oxidant–antioxidant balance in under conditions of changing nitrogen monoxide formation in vitro experiments. Russ J Physiol 107(1): 16–27. (In Russ)]. https://doi.org/10.31857/S0869813921010106
Mys LA, Strutynska NA, Goshovska YV, Sagach VF (2020) Stimulation of the endogenous hydrogen sulfide synthesis suppresses oxidative-nitrosative stress and restores endothelial-dependent vasorelaxation in old rats. Can J Physiol Pharmacol 98(5): 275–281. https://doi.org/10.1139/cjpp-2019-0411
Saveringhaus JW (1966) Blood gas calculator. J Appl Physiol 21(5): 1108–1116. https://doi.org/10.1152/jappl.1966.21.3.1108
Mendes R, Cardoso C, Pestana C (2009) Measurement of malondialdehyde in fish: A comparison study between HPLC methods and the traditional spectrophotometric test. Food Chem (112): 1038–1045. https://doi.org/10.1016/j.foodchem.2008.06.052
Diplock AT, Symons MCR, Rice-Evans CA (1991) Techniques in free radical research. In: Lab Techn in Biochem and Mol Biol (22): 290.
Королюк МА, Иванова ЛИ, Майорова ИГ, Токарева ВЕ (1988) Метод определения активности каталазы. Лаб дело (1): 16–19. [Korolyuk MA, Ivanova LI, Mayorova IG, Tokareva VE (1988) Method for determination of catalase activity. Lab Delo (1): 16–19. (In Russ)]. https://pubmed.ncbi.nlm.nih.gov/2451064/
Taylor SL, Lamden MP, Tappel AL (1976) Sensitive fluorometric method for tissue tocopherol analysis. Lipids 11(7): 530–538. https://doi.org/10.1007/BF02532898
Bryan NS, Grisham MB (2007) Methods to detect nitric oxide and its metabolites in biological samples. Free Radic Biol Med 43(5): 645–657. https://doi.org/10.1016/j.freeradbiomed.2007.04.026
Norris EJ, Culberson CR, Narasimhan S, Clemens MG (2011) The liver as central regulator of hydrogen sulfide. Shock 36(3): 242– 250. https://doi.org/10.1097/SHK.0b013e3182252ee7
Ross BK, Hlastala MP, Frank R. (1979) Lack of ozone effects on oxygen hemoglobin affinity. Arch Environ Health 34(3): 161–163.https://doi.org/10.1080/00039896.1979.10667389
Giunta R, Coppola A, Luongo C, Sammartino A, Guastafierro S, Grassia A, Giunta L, Mascolo L, Tirelli A, Coppola L (2001) Ozonized autohemotransfusion improves hemorheological parameters and oxygen delivery to tissues in patients with peripheral occlusive arterial disease. Ann Hematol 80(12): 745–748.https://doi.org/10.1007/s002770100377
Munteanu C, Rotariu M, Turnea M, Dogaru G, Popescu C, Spînu A, Andone I, Postoiu R, Ionescu EV, Oprea C, Albadi I, Onose G (2022) Recent Advances in Molecular Research on Hydrogen Sulfide (H2S) Role in Diabetes Mellitus (DM)-A Systematic Review. Int J Mol Sci 23(12): 6720. https://doi.org/10.3390/ijms23126720
Fadyukova OE, Koshelev VB Effect of Hydrogen (2020) Sulfide on Deformability of Rat Erythrocytes. Bull Exp Biol Med 169(6): 664–667.https://doi.org/10.1007/s10517-020-04965-9
Cortese-Krott MM (2020) Red Blood Cells as a “Central Hub” for Sulfide Bioactivity: Scavenging, Metabolism, Transport, and Cross-Talk with Nitric Oxide. Antioxid Redox Signal 33(18): 1332–1349.https://doi.org/10.1089/ars.2020.8171
Kolupaev YE, Yemets AI, Yastreb TO, Blume YB (2023) The role of nitric oxide and hydrogen sulfide in regulation of redox homeostasis at extreme temperatures in plants. Front Plant Sci (14): 1128439.https://doi.org/10.3389/fpls.2023.1128439
Bieza S, Mazzeo A, Pellegrino J, Doctorovich F (2022) H2S/Thiols, NO•, and NO–/HNO: Interactions with Iron Porphyrins. ACS Omega 7(2): 1602–1611.https://doi.org/10.1021/acsomega.1c06427
Wang G, Huang Y, Zhang N, Liu W, Wang C, Zhu X, Ni X (2021) Hydrogen Sulfide Is a Regulator of Hemoglobin Oxygen-Carrying Capacity via Controlling 2,3-BPG Production in Erythrocytes. Oxid Med Cell Longev 2021: 8877691.https://doi.org/10.1155/2021/8877691
Kolluru GK, Prasai PK, Kaskas AM, Letchuman V, Pattillo B (2016) Oxygen tension, H2S, and NO bioavailability: is there an interaction? J Appl Physiol 120(2): 263–270.https://doi.org/10.1152/japplphysiol.00365.2015
Hancock SE, Maccarone AT, Poad BLJ, Trevitt AJ, Mitchell TW, Blanksby SJ (2019) Reaction of ionised steryl esters with ozone in the gas phase. Chem Phys Lipids (221): 198–206.https://doi.org/10.1016/j.chemphyslip.2018.12.013
Bocci V, Borrelli E, Travagli V, Zanardi I (2009) The ozone paradox: ozone is a strong oxidant as well as a medical drug. Med Res Rev 29(4): 646–682.https://doi.org/10.1002/med.20150
Wen Q, Chen Q (2020) An Overview of Ozone Therapy for Treating Foot Ulcers in Patients With Diabetes. Am J Med Sci 360(2): 112–119.https://doi.org/10.1016/j.amjms.2020.05.012
Christie AE, Fontanilla TM, Roncalli V, Cieslak MC, Lenz PH (2014) Diffusible gas transmitter signaling in the copepod crustacean Calanus finmarchicus: identification of the biosynthetic enzymes of nitric oxide (NO), carbon monoxide (CO) and hydrogen sulfide (H2S) using a de novo assembled transcriptome. Gen Comp Endocrinol (202): 76–86.https://doi.org/10.1016/j.ygcen.2014.04.003
Feng J, Lu X, Li H, Wang S (2022) The roles of hydrogen sulfide in renal physiology and disease states. Renal Fail 44(1): 1289–1308.https://doi.org/10.1080/0886022X.2022.2107936
Rajendran S, Shen X, Glawe J, Kolluru GK, Kevil CG (2019) Nitric Oxide and Hydrogen Sulfide Regulation of Ischemic Vascular Growth and Remodeling. Compr Physiol 9(3): 1213–1247.https://doi.org/10.1002/cphy.c180026
Colakerol A, Temiz MZ, Tavukcu HH, Aykan S, Ozsoy S, Sahan A, Kandirali E, Semercioz A (2021) Effects of ozone treatment on penile erection capacity and nitric oxide synthase levels in diabetic rats. Int J Impot Res 33(5): 1–8.https://doi.org/10.1038/s41443-020-0301-1
Orlandin JR, Pinto Santos SI, Machado LC, Neto PF, Bressan FF, Godoy Pieri NC, Recchia K, de Paula Coutinho M, Ferreira Pinto PA, Santucci A, Travagli V, Ambrosio CE (2022) Evaluation of targeted oxidative stress induced by oxygen-ozone in vitro after ischemic induction. Redox Rep 27(1): 259–269. https://doi.org/10.1080/13510002.2022.2143104
Sojitra B, Bulani Y, Putcha UK, Kanwal A, Gupta P, Kuncha M, Banerjee SK (2012) Nitric oxide synthase inhibition abrogates hydrogen sulfide-induced cardioprotection in mice. Mol Cell Biochem 360(1–2): 61–69. https://doi.org/10.1007/s11010-011-1044-6
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


