Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 8, стр. 1108-1123
Влияние формирования доминантно-субординантых отношений в модели резидент–интрудер на тестикулярную функцию у лабораторных мышей инбредных линий PT и CBA/Lac
М. А. Клещев 1, *, А. В. Осадчук 1, Л. В. Осадчук 1
1 Федеральный исследовательский центр Институт цитологии и генетики СО РАН
Новосибирск, Россия
* E-mail: max82cll@bionet.nsc.ru
Поступила в редакцию 05.05.2023
После доработки 03.07.2023
Принята к публикации 04.07.2023
- EDN: NOYLJT
- DOI: 10.31857/S0869813923080046
Аннотация
Известно, что репродуктивный успех самца зависит от способности к социальному доминированию, а также качества, количества сперматозоидов и адекватной продукции репродуктивных гормонов. Взаимосвязь между социальным доминированием и тестикулярной функцией может модулироваться генотипом и средовыми условиями формирования иерархии, в частности территориальным статусом самца (резидент или интрудер), однако характер и механизмы этой взаимосвязи недостаточно исследованы. Целью настоящей работы стало исследование влияния предварительного освоения территории и генотипа на тестикулярную функцию при установлении доминантно-субординантных отношений в экспериментальной модели социального доминирования у лабораторных мышей, используя парадигму “резидент–интрудер”. Для этого взрослому самцу-резиденту определенного генотипа (PT или CBA/Lac), который проживал с самкой линии DD/He двое суток в экспериментальной клетке, подсаживали самца-интрудера другой линии (PT или CBA/Lac) и оценивали социальный статус самцов после установления иерархических отношений. Через 5 дней после формирования группы у самцов оценивали уровень тестостерона в сыворотке и содержание его в семенниках, а также сперматогенные параметры. Установлено, что формирование иерархических отношений не оказывает влияния на уровень тестостерона в крови и семенниках и долю морфологически аномальных головок сперматозоидов у самцов мышей обеих линий, но приводит к уменьшению количества эпидидимальных сперматозоидов у доминантов-интрудеров линии РТ по сравнению с субординантами-интрудерами этой линии, а также снижению подвижности сперматозоидов у подчиненных самцов линии CBA/Lac независимо от территориального статуса. Таким образом, установление доминантно-субординантных отношений в этологической модели социальной иерархии у лабораторных мышей оказывает влияние на сперматогенную функцию самцов уже через 5 дней после формирования группы, при этом характер этого влияния зависит от генотипа животного, его социального и территориального статуса (резидент или интрудер).
ВВЕДЕНИЕ
Известно, что репродуктивный успех самца, который определяется как число фертильных потомков за определенный промежуток времени (одну попытку размножения, сезон размножения или всю жизнь животного), зависит от множества взаимодействующих факторов, в числе которых физическое здоровье и продолжительность жизни, способность к социальному доминированию, способность устанавливать взаимоотношения с партнером и многие другие [1]. Важнейшими факторами, предопределяющими репродуктивный успех самца, являются его способность достигать доминирующего положения в системе социальной иерархии и потенциальная фертильность, которая зависит от качества и количества сперматозоидов. Социальная иерархия – система взаимоотношений между особями в социальной группе, при которой одни члены группы (доминанты) получают преимущество в доступе к лимитирующим ресурсам среды по сравнению с другими (субординантами) [2, 3]. Многочисленные исследования показали, что доминанты, как правило, оставляют больше потомков, чем подчиненные животные [4]. Известно, что доминантные самцы имеют преимущественный доступ к самкам и могут чаще спариваться с ними по сравнению с подчиненными самцами [5]. Следовательно, морфологические, физиологические и поведенческие признаки, предопределяющие способность к социальному доминированию, позволяют самцам эффективно передавать генетическую информацию последующим поколениям и поэтому имеют важнейшее эволюционное значение. Кроме того, известно, что репродуктивный успех самца зависит от качества и количества его сперматозоидов, поскольку мужская фертильность напрямую зависит от числа сперматозоидов, их подвижности и морфологии [6]. Кроме того, у видов, для которых характерен промискуитет, в репродуктивном тракте самок наблюдается конкуренция сперматозоидов от нескольких самцов [7, 8]. В этих условиях, высокое качество эякулята в значительной мере предопределяет возможность самца оставить потомство. Поэтому конкуренция сперматозоидов, которая наблюдается у многих видов животных, в том числе и у домовых мышей [5, 9, 10], является важнейшим фактором, обеспечивающим эволюцию различных характеристик эякулята, включая количество, подвижность и морфологию сперматозоидов, а также биохимический состав семенной плазмы [11, 12].
Однако достижение доминирующего положения и продукция большого количества сперматозоидов являются достаточно энергозатратными процессами [13], поэтому в условиях социальной иерархии самцы используют разные стратегии для достижения репродуктивного успеха, находя компромисс (trade-off) между затратами на достижение доминирования и затратами на производство эякулята [12]. У многих видов животных самцы, которые занимают подчиненное положение в системе социальной иерархии, не несут значительных затрат энергии на агрессию и защиту участка обитания и демонстрируют более высокое качество эякулята по сравнению с доминантами. В ряде исследований показано, что по сравнению с доминантами субординанты обладают более богатым биохимическим составом семенной плазмы [5], более высоким качеством сперматозоидов при повторной эякуляции [14], более высокой подвижностью половых клеток [15, 16]. Однако для многих видов животных, включая грызунов, характерна иная картина взаимосвязи социального статуса и качества эякулята, при которой сперматогенные показатели у субординантов ниже таковых у доминантов [17, 18], хотя фертильность подчиненных животных не подавляется полностью [19]. Предполагается, что ухудшение сперматогенной функции у субординантов может происходить либо за счет социального стресса, возникающего при формировании иерархических отношений, либо за счет специфических феромональных влияний доминирующего самца (см. обзор [20]).
Однако следует отметить, что даже у животных одного и того же вида, генотип [21] и средовые условия формирования иерархии [22], а также структура социальной группы в значительной мере предопределяют выбор стратегии достижения репродуктивного успеха и влияют на характер взаимосвязи между социальным статусом и качеством эякулята. Для лучшего понимания механизмов регуляции размножения, как в природных популяциях животных, так и в искусственных группировках, необходимо более глубокое исследование физиологических механизмов достижения компромисса между инвестициями в качество эякулята или поведение доминирования и взаимосвязи социального статуса животного и его репродуктивной функции, включая сперматогенез и секрецию тестостерона.
Знакомство с территорией является одним из наиболее важных факторов, влияющих на поведенческие и физиологические реакции при установлении и поддержании социальной иерархии. Защита территории и полового партнера может значительно усиливать агрессивность резидента [23, 24]. Агрессия резидента и попадание на новую территорию являются аверсивными факторами для интрудера, увеличивая уровень социального стресса [25], что может модифицировать поведенческие и физиологические реакции при установлении иерархических отношений. Таким образом, территориальный статус животного наряду с генотипом может оказать существенное влияние на выбор им определенной репродуктивной стратегии, особенно при установлении иерархии, и модифицировать взаимосвязь между социальным статусом и сперматогенной функцией.
Удобным модельным объектом для исследования взаимосвязи между физиологическими параметрами, социальным доминированием и средовыми условиями формирования иерархии являются лабораторные мыши. Это обусловлено тем, что у этого вида животных в определенных условиях существования формируется четкая иерархическая структура группировок, которая хорошо воспроизводится при клеточном содержании. Кроме того, лабораторные мыши характеризуются сходными с дикими сородичами паттернами поведения при установлении и поддержании социальной иерархии, широким разнообразием инбредных линий, наличием разработанных тестов и моделей для изучения социального поведения. Ранее нами была разработана модель социального доминирования у лабораторных мышей в минимальном социуме. В этой модели пара самцов разных инбредных линий содержится в специальной экспериментальной клетке в течение определенного времени, и животные устанавливают между собой и поддерживают иерархические отношения. Данная модель хорошо воспроизводит паттерны поведения при формировании и поддержании иерархии у домовых мышей [26] и репродуктивные последствия социального доминирования [19, 27], а также позволяет создавать и исследовать разные средовые условия формирования иерархии. С использованием данной модели нами установлено, что поведение при установлении социальной иерархии, а также взаимосвязь между социальным статусом и тестикулярной функцией в значительной степени детерминированы генотипом животного. Однако взаимодействие генотипа и территориальных условий формирования социальной иерархии в регуляции репродуктивной функции при установлении социальной иерархии ранее не исследовалось.
Целью настоящей работы стало исследование влияния предварительного освоения территории и генотипа на тестикулярную функцию при установлении доминантно-субординантных отношений в экспериментальной модели социального доминирования у лабораторных мышей.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные
В работе использовали самцов инбредных линий PT и CBA/Lac, полученных из питомника вивария Института цитологии и генетики СО РАН. Животные этих линий существенно различаются по андрогенному статусу, количеству и качеству сперматозоидов [27], а также способности к социальному доминированию и выраженности агрессивного поведения. По сравнению с самцами линии CBA/Lac, животные линии РТ характеризуются более высоким стероидогенным потенциалом семенников [28], повышенными агрессивностью при формировании социальной иерархии и вероятностью социального доминирования [29].
Все животные содержались в стандартных пластиковых клетках при неинвертированном световом дней (12/12 ч), пищу и воду получали без ограничения.
Проведение эксперимента
Перед проведением эксперимента всех животных содержали в условиях социальной изоляции для снятия эффектов группового содержания. В работе использовали ранее разработанную [26] модель социальной иерархии в минимальном социуме. Однако, в отличие от оригинальной модели, при формировании социальной группы мы использовали экспериментальную парадигму “резидент–интрудер”. К взрослому самцу-резиденту определенного генотипа (PT или CBA/Lac), который проживал в экспериментальной клетке с самкой линии DD/He двое суток, подсаживали самца-интрудера другой линии (PT или CBA/Lac). После этого наблюдали за поведением животных при формировании доминантно-субординантных отношений. Социальный ранг определяли по асимметрии в проявлении агонистического поведения после установления иерархических отношений. В период поддержания иерархии доминанты проявляли только агрессивное поведение (наступательные атаки, биение хвостом и агрессивный груминг), а субординанты – только субмиссивное поведение (вертикальные позы подчинения и бегство). Более подробно методика проведения данного эксперимента, оценки социального статуса и агонистического поведения описана ранее [29]. Мыши содержались в парах в течение 5 дней, в конце этого срока животных декапитировали и оценивали гормональную и сперматогенную функцию семенников.
Оценка морфометрических показателей
Каждого самца взвешивали перед началом эксперимента и сразу после его окончания. Самцов декапитировали в одно и тоже время суток с 13:00 до 14:00 ч, собирали периферическую кровь, выделяли и взвешивали оба семенника и каудальных эпидидимиса на торсионных весах марки ВТ-500.
Исследование качества и количества эпидидимальных сперматозоидов
Исследовали качество и количество сперматозоидов, выделенных из обоих каудальных эпидидимисов и помещенных в культуральную среду DMEM (Медиген, Россия). Подход, основанный на изучении эпидидимальных сперматозоидов, является общепринятым для исследования качества сперматозоидов у грызунов [30, 31]. Недорогая и доступная среда DMEM уже была успешно апробирована на лабораторных мышах. Показано, что в этой культуральной среде подвижность остается стабильной в течение часа и такой же высокой, как и при использовании дорогостоящих сред, предназначенных для оплодотворения in vitro [31]. Немедленно после забоя животного оба каудальных эпидидимиса помещали в 200 мкл среды DMEM. Затем эпидидимисы мелко измельчали и добавляли 800 мкл той же среды. После встряхивания на шейкере в течение 10 мин полученную суспензию фильтровали через нейлоновые фильтры Falcon с диаметром ячейки 70 мкм. Подвижность сперматозоидов определяли с использованием анализатора фертильности спермы SFA 500 (НПФ “Биола” г. Москва). Оценивали общую долю прогрессивно подвижных сперматозоидов и долю половых клеток, обладающих быстрым (>25 мкм/с) прогрессивным движением. Выделение сперматозоидов из каудальных эпидидимисов и измерение доли подвижных половых клеток производили в течение часа после декапитации животного при температуре среды +37°C.
Количество эпидидимальных сперматозоидов подсчитывали в камере Горяева под световым микроскопом (при увеличении ×200), после окраски суспензии сперматозоидов 1%-ным водным раствором эозина в течение ночи.
Оценивали морфологию головок сперматозоидов согласно методике [32]. Для этого 20 мкл окрашенной суспензии сперматозоидов наносили на предметное стекло и делали мазок. Мазок высушивали, фиксировали канадским бальзамом, покрывали покровным стеклом и исследовали под световым микроскопом (×400) первые 300 сперматозоидов, подсчитывая долю морфологически аномальных головок.
Определение содержания тестостерона в сыворотке крови и семенниках
Периферическую кровь центрифугировали в течение 20 мин при 3000 об./мин при 4°C, сыворотку хранили при –20°C. Один семенник от каждого животного, выбранный случайным образом, гомогенизировали в фосфатном буфере и гомогенаты хранили при –20°C. Тестостерон в сыворотке крови и гомогенатах семенников определяли иммуноферментным методом с использованием набора “Стероид ИФА-тестостерон” (фирма “Алкор Био” Санкт-Петербург, Россия), согласно инструкции производителя. Градуировочную кривую для расчета содержания тестостерона в семенниках строили с использованием стандарта тестостерона после разведения фосфатным буфером, а для определения концентрации гормона в сыворотке – разведения бесстероидной мышиной сывороткой. Содержание тестостерона в семенниках выражали в нг/один семенник, а содержание гормона в сыворотке – в нг/мл.
Статистический анализ данных
Статистическую обработку полученных данных проводили с использованием пакета компьютерных программ Statistica (версия 6.0). Поскольку самцы инбредной линии РТ на предварительно освоенной территории почти всегда становились доминантами, а интрудеры CBA/Lac – субординантами, то из-за малого количества животных (одна пара самцов) данные по подчиненным самцам-резидентам линии РТ и доминирующим самцам-интрудерам линии CBA/Lac исключены из анализа и не представлены в статье. Для проверки данных на нормальность распределения использовали критерий Колмогорова–Смирнова. Поскольку распределение всех изучаемых показателей соответствовало нормальному закону, то для сравнения экспериментальных групп использовали параметрический тест множественного сравнения Дункана. Различия считали достоверными при p < 0.05. Данные на рисунках и в тексте представлены как средняя и ее ошибка (Mean ± SE).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Масса тела и репродуктивных органов
На рисунке 1 представлены данные по массе тела самцов линий РТ и CBA/Lac с различным социальным и территориальным статусом до формирования социальной группы (рис. 1a) и на пятый день после формирования экспериментальных групп (рис. 1b). Самцы линии РТ имели достоверно меньшую (p < 0.01) массу тела, чем самцы линии CBA/Lac, как до формирования социальной группы, так и при окончании эксперимента, на пятый день после ссаживания самцов. Масса тела до формирования социальной группы составляла 24.44 ± 0.19 г и 27.05 ± 0.18 г у самцов линии РТ и CBA/Lac соответственно. Масса тела на пятый день после формирования социальной группы составляла 23.82 ± 0.28 г и 25.53 ± 0.20 г у самцов линии РТ и CBA/Lac соответственно.
Рис. 1.
Масса тела до формирования социальной группы (a) и в период стабильных иерархических отношений (b) у самцов линий РТ и CBA/Lac с различным социальным (доминант или субординант) и территориальным (резидент или интрудер) статусом. * – достоверность межранговых различий (p < 0.05). Число животных в группе варьировало от 27 до 52. Данные по подчиненным самцам-резидентам линии РТ и доминирующим самцам-интрудерам линии CBA/Lac не представлены.
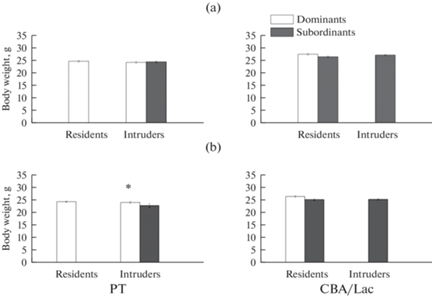
Достоверных различий по массе тела до формирования социальной группы между самцами с различным социальным и территориальным статусом вне зависимости от линии не установлено. В период стабильных иерархических отношений на 5-й день существования социальной группы масса тела (рис. 1b) доминантов-интрудеров линии PT была достоверно (p < 0.05) выше таковой у субординантов-интрудеров этой же линии.
Масса семенников (рис. 2a) и каудальных эпидидимисов (рис. 2b) не отличалась у доминантов и субординантов обеих линий вне зависимости от территориальных условий формирования иерархии, различий между резидентами и интрудерами по данным показателям также не установлено. Самцы линии РТ обладали достоверно (p < 0.05) большей массой семенников (162.06 ± 2.62 мг) и каудальных эпидидимисов (11.99 ± 0.23 мг) по сравнению с самцами линии CBA/Lac, у которых масса семенников составляла 133.19 ± 1.71 мг, а масса каудальных эпидидимисов – 10.40 ± 0.21 мг.
Рис. 2.
Масса семенников (a) и каудальных эпидидимисов (b) у самцов линий РТ и CBA/Lac с различным социальным (доминант или субординант) и территориальным (резидент или интрудер) статусом. Число животных в группе варьировало от 27 до 52. Данные по подчиненным самцам-резидентам линии РТ и доминирующим самцам-интрудерам линии CBA/Lac не представлены.
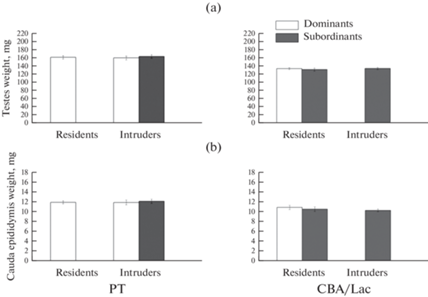
Сперматогенная функция семенников
Число сперматозоидов в обоих каудальных эпидидимисах (рис. 3a) у доминантов-интрудеров линии РТ было достоверно ниже, чем у субординантов-интрудеров и доминантов-резидентов этой же линии. У самцов линии CBA/Lac с различным социальным и территориальным статусом не установлено достоверных различий между группами по числу сперматозоидов в каудальных эпидидимисах. Межлинейных различий по числу эпидидимальных сперматозоидов не установлено.
Рис. 3.
Число сперматозоидов в каудальных эпидидимисах (a) и доля сперматозоидов с аномалиями головки (b) у самцов линий РТ и CBA/Lac с различным социальным (доминант или субординант) и территориальным (резидент или интрудер) статусом. ** – достоверность различий между доминантами и субординантами (p < 0.01). @ – достоверность влияния территориальных условий (p < 0.05). Число животных в группе варьировало от 27 до 52. Данные по подчиненным самцам-резидентам линии РТ и доминирующим самцам-интрудерам линии CBA/Lac не представлены.
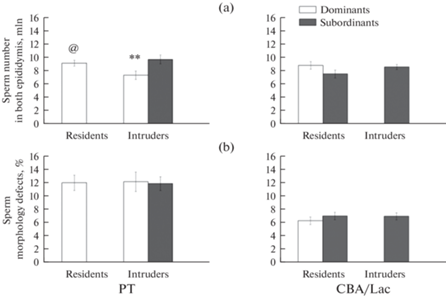
Доля аномальных головок сперматозоидов оказалась достоверно выше у самцов линии РТ (12.38 ± 0.76%), чем у самцов линии CBA/Lac (6.73 ± 0.33%) вне зависимости от социального и территориального статуса. Социальный и территориальный статус не оказали влияния на долю аномальных головок сперматозоидов у самцов обеих линий (рис. 3b).
Доля сперматозоидов с прогрессивным движением (рис. 4a) и быстрым (более 25 мкм/с) прогрессивным движением (рис. 4b) у доминантов-резидентов линии CBA/Lac оказалась достоверно выше, чем у субординантов этой линии, находившихся как на своей, так и на чужой территории. Влияния территориального статуса у субординантов линии CBA/Lac на долю подвижных сперматозоидов не установлено. Доля подвижных сперматозоидов и доля сперматозоидов с быстрым прогрессивным движением не отличалась у доминантов и субординантов линии РТ вне зависимости от территориального статуса животного, различий между резидентами и интрудерами этой линии также не установлено. Межлинейных различий по доле подвижных сперматозоидов не установлено.
Рис. 4.
Доля прогрессивно подвижных сперматозоидов (a) и доля сперматозоидов с быстрым (>25 мкм/с) прогрессивным движением (b) у самцов линий РТ и CBA/Lac с различным социальным (доминант или субординант) и территориальным (резидент или интрудер) статусом. ** – достоверность различий между доминантами и субординантами (p < 0.01); * – достоверность различий между доминантами и субординантами (p < 0.05). Число животных в группе варьировало от 27 до 52. Данные по подчиненным самцам-резидентам линии РТ и доминирующим самцам-интрудерам линии CBA/Lac не представлены.
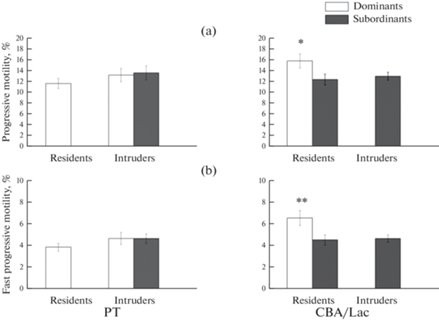
Стероидогенная функция семенников
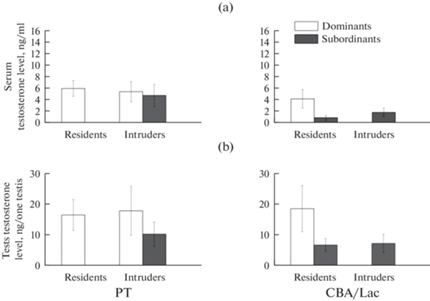
Социальный статус и территориальные условия формирования иерархии не оказали влияния на содержание тестостерона в крови (рис. 5a) и семенниках (рис. 5b) у самцов линий РТ. У резидентов линии CBA/Lac, которые становились доминантами, уровень тестостерона был несколько выше, чем у субординантов этой линии, находившихся на освоенной территории, однако различия между этими группами не достигали статистической достоверности. Межлинейных различий по данным показателям также не установлено.
Рис. 5.
Содержание тестостерона в сыворотке крови (a) и гомогенатах семенников (b) у самцов линий РТ и CBA/Lac с различным социальным (доминант или субординант) и территориальным (резидент или интрудер) статусом. Число животных в группе варьировало от 27 до 52. Данные по подчиненным самцам-резидентам линии РТ и доминирующим самцам-интрудерам линии CBA/Lac не представлены.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Социальное доминирование связано со многими физиологическими признаками организма, в том числе и с тестикулярной функцией, которая включает в себя продукцию гормонов (в том числе тестостерона) и сперматогенез. У взрослых самцов тестостерон необходим для поддержания вторичных половых признаков, нормального протекания сперматогенеза, проявления доминантного и полового поведения. Однако взаимосвязь между тестикулярной функцией и социальным доминированием может быть достаточно сложной и модулироваться генотипом [27], структурой социальной группы и средовыми условиями формирования иерархии [33], в частности территориальным статусом самца.
В проведенном нами исследовании не было выявлено взаимосвязи между базальным уровнем тестостерона, социальным рангом и территориальным статусом самцов мышей на 5-й день после формирования социальной группы, когда устанавливались стабильные доминантно-субординантные отношения. Эти данные соответствуют результатам, полученным ранее с использованием этологической модели минимального социума, где самцы содержались в парах в течение 30 дней [34], и согласуются с “гипотезой вызова”, согласно которой межранговые различия в продукции тестостерона проявляются главным образом в условиях социальной нестабильности, когда уровень тестостерона быстро увеличивается до физиологического максимума, способствуя достижению доминирующего положения, поиску партнера или борьбе за территорию [35].
Однако в нашем исследовании установлены межранговые различия по количеству эпидидимальных сперматозоидов и их подвижности, при этом направленность этих различий зависела от генотипа и территориального статуса самца. А именно, для самцов линии РТ, которые стали доминантами, находясь на территории, освоенной другим самцом, было характерно сниженное количество эпидидимальных сперматозоидов по сравнению с субординантами. С другой стороны, самцы линии CBA/Lac, которые доминировали на своей территории, характеризовались более высокой подвижностью сперматозоидов по сравнению с субординантами. Исследования на разных видах животных показали, что качество и количество сперматозоидов, а также биохимический состав семенной плазмы зависят от социального статуса животного, но направленность этой зависимости является видоспецифичной. В ряде исследований установлено, что самцы, занимающие подчиненное положение, могут иметь более высокое качество эякулята, по сравнению с доминирующими животными. Например, доминирующие самцы арктического гольца (Salvelinus alpinus) продуцировали меньше сперматозоидов с меньшей скоростью движения по сравнению с подчиненными [15]. Качество эякулята снижается к концу сезона спаривания у доминирующих баранов (Ovis aries), но сохраняется у субординантов, обеспечивая им репродуктивный успех [36]. Субдоминанты домовых воробьев (Passer domesticus) обладали более высокой подвижностью сперматозоидов и меньшим уровнем оксидативного стресса половых клеток по сравнению с доминантами и субординантами [16]. Предполагается, что у этих и других видов более высокое качество эякулята у подчиненных животных повышает их шансы на успешное размножение, в то время как доминанты реализуют другую стратегию для достижения репродуктивного успеха, инвестируя в поведение доминирования, что обеспечивает преимущественный доступ к самкам. Однако, по данным многочисленных исследований, для грызунов, включая домовых мышей, характерна противоположная картина – качество эякулята у доминантов выше, чем у субординантов [5, 13, 37]. В исследованиях на моделях социальной иерархии у домовых мышей показано, что доминирующие самцы характеризуются более высоким количеством эпидидимальных сперматозоидов и их подвижностью по сравнению с подчиненными [17]. В нашем исследовании также показано, что доминанты линии СВА/Lac характеризуются более высокой подвижностью сперматозоидов, чем субординанты. Предполагается, что у грызунов социальный стресс и/или специфические хемосенсорные сигналы доминирующего самца могут подавлять сперматогенную функцию субординантов [20, 37], что, вероятно, является одним из механизмов ограничения размножения у подчиненных животных. Однако результаты нашего исследования показывают, что эффекты социального доминирования на сперматогенные показатели у домовых мышей зависят от территориального статуса и генотипа животного. Поскольку направленность эффектов социального доминирования у самцов-интрудеров линии РТ не соответствует классической для домовых мышей картине, возникает вопрос о причине такого несоответствия. В прежних исследованиях с использованием этологической модели социальной иерархии у лабораторных мышей показано, что субординанты линии СВА/Lac характеризовались снижением количества и подвижности сперматозоидов по сравнению с доминантами [38], а кроме того, самцы этой линии демонстрировали увеличение подвижности сперматозоидов при содержании с самкой [39]. Однако сперматогенные показатели у самцов линии РТ в тех же самых условиях оказались резистентны к любым социальным воздействиям, что, как предполагается, обусловлено сниженной чувствительностью самцов этой линии к хемосигналам, несущим информацию о социальном окружении [38]. Кроме того, самцы линии РТ были более агрессивны и чаще становились доминантами, чем самцы линии СВА/Lac при формировании иерархии как на своей, так и на чужой территории [29]. Проявление агрессии и достижение доминирующего положения сопряжено со значительными энергетическими затратами и сопровождаются высоким уровнем социального стресса, который в наибольшей степени выражен у интрудеров [25]. Исходя из наших данных можно предположить, что уменьшение количества эпидидимальных сперматозоидов у доминантов-интрудеров линии РТ, отличавшихся высоким уровнем агрессивности при формировании иерархических отношений даже на чужой территории, могло быть обусловлено высоким уровнем стресса у этих животных. В то же самое время, снижение подвижности сперматозоидов у субординантов линии СВА могло быть обусловлено хемосигналами от доминирующих самцов, либо социальным стрессом, вызванным интенсивной агрессией самца-резидента. Данные предположения, безусловно, нуждаются в экспериментальной проверке и представленная этологическая модель, которая позволяет воспроизводить различные средовые условия формирования иерархии и создавать социальные группы из животных разного генотипа, может быть перспективной для изучения механизмов снижения сперматогенной функции у самцов разного социального статуса.
Интересно, что эффекты социального доминирования на сперматогенез проявлялись за относительно короткое время, уже через 5 дней после формирования группы, в то время как продолжительность сперматогенеза у домовых мышей составляет 35 дней [40]. В настоящее время получен ряд данных, указывающих на то, что количество и качество сперматозоидов у животных может изменяться в зависимости от социального окружения особи за короткое время, меньшее, чем продолжительность сперматогенеза. Предъявление запаха конкурирующего самца в течение 30 мин приводило к увеличению количества сперматозоидов в семявыносящих путях у луговой полевки Microtus pennsylvanicus [41]. Доминанты европейской рыжей полевки (Myodes glareolus) обладали более высоким числом эпидидимальных сперматозоидов, повышенной долей подвижных и морфологически нормальных половых клеток по сравнению с подчиненными животными уже через 7 дней после формирования социальной группы [30]. Подвижность сперматозоидов у лабораторных мышей увеличивалась через 5 дней после подсадки самки [39]. Предполагается, что изменение скорости транспорта сперматозоидов в семявыносящих путях и накопления их в каудальных отделах эпидидимисов, а также модуляция созревания сперматозоидов в эпидидимисах являются основными механизмами быстрого изменения качества эякулята в ответ на социальную конкуренцию [42]. Продвижение сперматозоидов через семявыносящие пути осуществляется благодаря сокращениям гладкой мускулатуры и движениям ресничек эпителия и у домовых мышей занимает около 10 дней [43]. Кроме того, в эпидидимисе осуществляются процессы созревания сперматозоидов, включая приобретение способности к движению и оплодотворению [44]. Работа гладкой мускулатуры семявыносящих протоков, секреция различных факторов, необходимых для созревания сперматозоидов, регулируется вегетативной нервной системой, различными паракринными факторами, а также метаболитами тестостерона – дигидротестостероном и эстрадиолом [45]. Изменения в нервной регуляции, а также секреции гормонов и паракринных факторов под влиянием социального окружения особи могут достаточно быстро влиять на транспорт сперматозоидов в семявыносящих путях и созревание сперматозоидов в эпидидимисах, изменяя скорость их накопления в каудальных отделах, а также влияя на подвижность и морфологию половых клеток.
В настоящем исследовании установлено, что социальный ранг не влиял на долю морфологических аномалий сперматозоидов вне зависимости от территориального статуса самца. Полученные данные соответствуют результатам, полученным ранее [38] с использованием этологической модели минимального социума и свидетельствуют о том, что процессы спермиогенеза, лежащие в основе формирования видоспецифичной формы головки сперматозоида, являются устойчивыми к социальным факторам, влияющим на тестикулярную функцию в условиях доминантно-субординантных отношений. Известно, что встречаемость морфологических аномалий сперматозоидов является важнейшим показателем фертильности самцов [46], поскольку нарушения процесса спермиогенеза приводят не только к появлению морфологических дефектов половых клеток, но и к нарушению компактизации хроматина, увеличению уровня оксидативного стресса и повышению фрагментации ДНК сперматозоидов [47, 48]. Следовательно, устойчивость процессов спермиогенеза к факторам, обуславливающим подавление репродукции у субординантов, повышает их шансы на достижение репродуктивного успеха и позволяет подчиненным животным оставаться в репродуктивном резерве популяции.
ЗАКЛЮЧЕНИЕ
Установление доминантно-субординантных отношений в этологической модели социальной иерархии у лабораторных мышей оказывает влияние на сперматогенную функцию самцов уже через 5 дней после формирования группы, при этом характер этого влияния зависит от генотипа животного, его социального ранга и территориального статуса. Генетически детерминированный высокий уровень агрессивности при формировании социальной иерархии на территории, освоенной другим самцом, может приводить к ослаблению сперматогенной функции у доминантов по сравнению с подчиненными животными.
Список литературы
Moreno J (2019) Reproductive Success. Encyclopedia of Animal Behavior, 2nd edition 2: 94–100.
Громов ВС (2008) Пространственно-этологическая структура популяций грызунов. М.: Товарищество научн издан КМК. [Gromov VS (2008). Spatial and ethological structure of rodent populations. M. Tovarishchestvo nauchnyh izdanij KMK. (In Russ)].
Drews K (1993) The concept and definition of dominance in animal behavior. Behavior 125: 283–313.
Ellis L (1995) Dominance and reproductive success among nonhuman animals: a cross-species comparison. Ethol Sociobiol 164: 257–333.
Bayram HL, Franco C, Brownridge P, Claydon AJ, Koch N, Hurst, JL, Beynon RJ, Stockley P (2020) Social status and ejaculate composition in the house mouse. Philosophical Transact Royal Societ London Series B Biol Sci 375: 20200083. https://doi.org/10.1098/rstb.2020.0083
Cooper TG, Noonan E, von Eckardstein S, Auger J, Baker H, Behre HM, Haugen TB, Kruger T, Wang C, Mbizvo MT, Vogelsong KM (2010) World Health Organization reference values for human semen characteristics. Hum Reproduct Update 16: 231–245. https://doi.org/10.1093/humupd/dmp048
Stockley P (2004) Sperm competition in mammals. Hum Fertility (Cambridge, England) 7: 91–97. https://doi.org/10.1080/14647270410001699054
Firman RC (2020) Of mice and women: advances in mammalian sperm competition with a focus on the female perspective. Philosophical Transact Royal Societ London Series B Biol 375: 20200082. https://doi.org/10.1098/rstb.2020.0082
Dean MD, Ardlie KG, Nachman MW (2006) The frequency of multiple paternity suggests that sperm competition is common in house mice (Mus domesticus). Mol Ecol 15: 4141–4151. https://doi.org/10.1111/j.1365-294X.2006.03068.x
Rolland C, Macdonald DW, Fraipont M, Berdoy M (2003) Free female choice in house mice: leaving best for last. Behaviour 140: 1371–1388.
Ramm SA, Schärer L, Ehmcke J, Wistuba J (2014) Sperm competition and the evolution of spermatogenesis. Mol Hum Reproduct 20: 1169–1179. https://doi.org/10.1093/molehr/gau070
Parker GA (2020) Conceptual developments in sperm competition: a very brief synopsis. Philosophical Transact Royal Societ London Series B Biol 375: 20200061. https://doi.org/10.1098/rstb.2020.0061
Schradin C, Eder S, Müller K (2012). Differential investment into testes and sperm production in alternative male reproductive tactics of the African striped mouse (Rhabdomys pumilio). Horm Behav 61: 686–695. https://doi.org/10.1016/j.yhbeh.2012.03.002
Cornwallis CK, Birkhead TR (2008) Plasticity in reproductive phenotypes reveals status-specific correlations between behavioral, morphological, and physiological sexual traits. Evol Int J Organic Evol 62: 1149–1161. https://doi.org/10.1111/j.1558-5646.2008.00346.x
Rudolfsen G, Figenschou L, Folstad I, Tveiten H, Figenschou M (2006) Rapid adjustments of sperm characteristics in relation to social status. Proceed Biol Sci 273: 325–332. https://doi.org/10.1098/rspb.2005.3305
Mora A, Meniri M, Gning O, Glauser G, Vallat A, Helfenstein F (2017) Antioxidant allocation modulates sperm quality across changing social environments. PloS One 12: e0176385. https://doi.org/10.1371/journal.pone.0176385
Koyama S, Kamimura S (2000) Influence of social dominance and female odor on the sperm activity of male mice. Physiol & Behav 71: 415–422. https://doi.org/10.1016/s0031-9384(00)00361-9
Koyama S, Kamimura S (1999). Lowered sperm motility in subordinate social status of mice. Physiol & Behav 65: 665–669. https://doi.org/10.1016/s0031-9384(98)00205-4
Kleshchev MA, Osadchuk LV (2014) Social domination and reproductive success in male laboratory mice (Mus musculus). J Evol Biochem Physiol, 50: 201–206.
Koyama S (2004) Primer effects by conspecific odors in house mice: a new perspective in the study of primer effects on reproductive activities. Horm Behav 46: 303–310. https://doi.org/10.1016/j.yhbeh.2004.03.002
Neff BD, Svensson EI (2013) Polyandry and alternative mating tactics. Philosophical Transact Royal Societ London Series B Biol 368(1613): 20120045. https://doi.org/10.1098/rstb.2012.0045
Kustra MC, Alonzo SH (2020) Sperm and alternative reproductive tactics: a review of existing theory and empirical data. Philosophical Transact Royal Societ London Series B Biol 375: 20200075. https://doi.org/10.1098/rstb.2020.0075
Koolhaas JM, Coppens CM, de Boer SF, Buwalda B, Meerlo P, Timmermans PJ (2013) The resident-intruder paradigm: a standardized test for aggression, violence and social stress. J Visualiz Exp 77: e4367. https://doi.org/10.3791/4367
Hayashi S, Tomihara K (2000) The influence of female on male territorial dominance and female preference in dwelling place in laboratory mice. J Ethology 18: 47–51.
Martinez M, Calvo-Torrent A, Pico-Alfonso M (1998) Social defeat and subordination as models of social stress in laboratory rodents: a review. Aggressiv Behav 24: 241–256. https://doi.org/10.1002/(sici)1098-2337(1998)24:4<241::aid-ab1>3.0.co;2-m
Bragin AV, Osadchuk LV, Osadchuk AV (2006) The experimental model of establishment and maintenance of social hierarchy in laboratory mice. Zhurn Vyssh Nervn Deiat im IP Pavlova 56: 412–419.
Osadchuk LV, Salomacheva IN, Osadchuk AV (2010) Genotype-related changes in the reproductive function under social hierarchy in laboratory male mice. Zhurn Vyssh Nervn Deiat im IP Pavlova 60: 339–351
Zarubina EA, Osadchuk LV (2011) Phenogenetic analysis of testicular responsiveness to chorionic gonadotropin in inbred mouse strains. Russ J Genet 47: 221–225.
Kleshchev MA, Osadchuk AV, Osadchuk LV (2022) Peculiarities of agonistic and marking behavior in male laboratory mice (Mus musculus) of different inbred strains during the formation of social hierarchy. Biol Bull 49: 1626–1637.
Kruczek M, Styrna J (2009) Semen quantity and quality correlate with bank vole males’ social status. Behav Proc 82: 279–285. https://doi.org/10.1016/j.beproc.2009.07.009
Tayama K, Fujita H, Takahashi H, Nagasawa A, Yano N, Yuzawa K, Ogata A (2006) Measuring mouse sperm parameters using a particle counter and sperm quality analyzer: a simple and inexpensive method. Reproduct Toxicol 22: 92–101. https://doi.org/10.1016/j.reprotox.2005.11.009
Daev EV, Dukel’skaia AV (2003) The female pheromone 2,5-dimethylpyrazine induces sperm head abnormalities in male CBA mice. Russ J Genet 39: 969–974.
Williamson CM, Lee W, Romeo RD, Curley JP (2017) Social context-dependent relationships between mouse dominance rank and plasma hormone levels. Physiol & Behav 171: 110–119. https://doi.org/10.1016/j.physbeh.2016.12.038
Osadchuk LV, Gutorova NV, Kleshchev MA (2014) Testicular testosterone production in male mice of inbred strains PT and CBA/Lac after a long-term period of stable social hierarchy. Ross Fiziol Zhurn im IM Sechenova 100: 465–472.
Wingfield JC, Hegner RE, Dufty AM, Ball GF (1990) The “Challenge Hypothesis”: theoretical implications for patterns of testosterone secretion, mating systems, and breeding strategies. Am Nat 136: 829–846.
Preston BT, Stevenson IR, Pemberton JM, Wilson K (2001) Dominant rams lose out by sperm depletion. Nature 409: 681–682. https://doi.org/10.1038/35055617
Lemaître JF, Ramm SA, Hurst JL, Stockley P (2012) Sperm competition roles and ejaculate investment in a promiscuous mammal. J Evol Biol 25: 1216–1225. https://doi.org/10.1111/j.1420-9101.2012.02511.x
Gutorova NV, Kleshev MA, Osadchuk LV (2012) A role of long-term social interactions in the control of spermatogenesis in male mice of inbred strains pt and CBA/Lac. Russ J Physiol 98: 854–861.
Kleshev MA, Osadchuk LV (2012) Modification of the testicular function in laboratory male mice during social interactions: effect of female presence. Bull Exper Biol Med 153: 240–243. https://doi.org/10.1007/s10517-012-1686-8
Physiology of Reproduction (2014) / Editors: Tony Plant Anthony. Zeleznik Acad Press, 2684 p.
Delbarco-Trillo J, Ferkin MH (2004) Male mammals respond to a risk of sperm competition conveyed by odours of conspecific males. Nature 431: 446–449. https://doi.org/10.1038/nature02845
Parker GA, Pizzari T (2010) Sperm competition and ejaculate economics. Biol reviews Cambridge Philosophical Societ 85: 897–934. https://doi.org/10.1111/j.1469-185X.2010.00140.x
Fernandez CD, Porto EM, Arena AC, Kempinas W (2008) Effects of altered epididymal sperm transit time on sperm quality. Int J Androl 31: 427–437. https://doi.org/10.1111/j.1365-2605.2007.00788.x
James ER, Carrell DT, Aston KI, Jenkins TG, Yeste M, Salas-Huetos A (2020) The role of the epididymis and the contribution of epididymosomes to mammalian reproduction. Int J Mol Sci 21: 5377. https://doi.org/10.3390/ijms21155377
Marchiani S, Tamburrino L, Muratori M, Baldi E (2017) Epididymal sperm transport and fertilization. In: Endocrinology of the testis and male reproduction. M. Simoni, I.T. Huhtaniemi (eds). Springer 457–478.
Teves ME, Roldan ERS (2022) Sperm bauplan and function and underlying processes of sperm formation and selection. Physiol Rev 102: 7–60. https://doi.org/10.1152/physrev.00009.2020
Daris B, Goropevsek A, Hojnik N, Vlaisavljević V (2010) Sperm morphological abnormalities as indicators of DNA fragmentation and fertilization in ICSI. Archiv Gynecol Obstetrics 281: 363–367. https://doi.org/10.1007/s00404-009-1140-y
Oumaima A, Tesnim A, Zohra H, Amira S, Ines Z, Sana C, Intissar G, Lobna E, Ali J, Meriem M (2018) Investigation on the origin of sperm morphological defects: oxidative attacks, chromatin immaturity, and DNA fragmentation. Environment Sci Pollut RES Internat 25: 13775–13786. https://doi.org/10.1007/s11356-018-1417
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


