Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 9, стр. 1217-1232
Функциональное состояние брыжеечных артерий и сосудов микроциркуляторного русла кожи крыс с экспериментальной дисфункцией почек
Г. Т. Иванова 1, *, О. Н. Береснева 2
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет
им. акад. И.П. Павлова
Санкт-Петербург, Россия
* E-mail: ivanovagt@infran.ru
Поступила в редакцию 11.06.2023
После доработки 25.07.2023
Принята к публикации 27.07.2023
- EDN: VPWAXK
- DOI: 10.31857/S0869813923090042
Аннотация
У людей с хронической болезнью почек часто развиваются сердечно-сосудистые осложнения, среди которых отмечаются эндотелиальная дисфункция, артериальная гипертензия и атеросклероз. Целью данной работы было провести сравнительный анализ реактивности сосудов микроциркуляторного русла (МЦР) кожи, оцененной методом лазерной допплеровской флоуметрии и брыжеечных артерий у крыс с резекцией 5/6 массы почек. Крысы Wistar были разделены на две группы: животным NE-группы (n = 15) удаляли 5/6 массы ткани почек, контрольным животным SO-группы (n = 15) выполняли ложную операцию. Через 8 нед. проводили оценку реактивности микрососудов кожи крыс на ионофорез ацетилхолина (ACh) и нитропруссида натрия (NP). Через неделю у крыс в условиях in vivo оценивали влияние нефрэктомии на реактивность предварительно сокращенных фенилэфрином брыжеечных артерий при действии агонистов, используя микрофото- и видеорегистрацию диаметра. Показано, что нефрэктомия не влияет на среднюю величину перфузии в коже крыс в покое, однако изменяет структуру частотного диапазона спектра колебаний показателя МЦР, повышая величину эндотелиального, нейрогенного и миогенного тонуса. NE приводит к развитию эндотелиальной дисфункции брыжеечных артерий и сосудов МЦР кожи, которая выражается в снижении реактивности на действие эндотелий-зависимого (ACh) и независимого от эндотелия (NP) вазодилататоров. Таким образом, развитие экспериментальной дисфункции почек приводит к изменениям спектральных составляющих флуктуаций показателя МЦР в коже, указывающим на повышение тонических влияний различного генеза на сосуды. Нефрэктомия сопровождается снижением реактивности микрососудов кожи и брыжеечных артерий, однако корреляции между увеличением показателя МЦР и амплитудой релаксации брыжеечных артерий при действии вазодилататорных агонистов на данном сроке наблюдения отсутствуют.
ВВЕДЕНИЕ
У людей с хронической болезнью почек (ХБП) высока вероятность развития сердечно-сосудистых заболеваний. Дисфункция почек может приводить к развитию патологических изменений сердца, в частности к усилению гипертрофии левого желудочка, диастолической дисфункции, миокардиальному фиброзу [1]. Установлено, что у людей с нарушением почечной функции риск развития ишемической болезни сердца (ИБС) на 40–50% выше, чем у пациентов с отсутствием заболеваний почек [2]. Общепринятые факторы риска атеросклероза, такие как гиперхолестеринемия, артериальная гипертензия, сахарный диабет, гипергомоцистеинемия, считают причиной формирования дисфункции эндотелия при патологии почек [3, 4]. Атеросклероз и его проявления в коронарных артериях являются ключевым связующим звеном между ХБП и сердечно-сосудистой заболеваемостью и смертностью, однако патофизиологические механизмы изменений функционального состояния сосудов, связанных с ХБП, до конца не изучены. ХБП способствует развитию атеросклероза и ИБС, индуцируя повреждение эндотелиальных клеток [5], а также запускает хронические сосудистые воспалительные процессы, что отражается увеличением маркеров воспаления в крови пациентов [6–8]. Было показано, что повышенные уровни воспалительных биомаркеров, таких как С-реактивный белок, интерлейкин-6 или фактор некроза опухоли, связаны с высоким риском инфаркта миокарда у пациентов со снижением функции почек [9, 10].
Эндотелий участвует в регуляции тонуса кровеносных сосудов посредством выработки биологически активных веществ, которые по своему действию делятся на вазодилататоры и вазоконстрикторы. Чтобы контролировать сосудистый тонус, эндотелий синтезирует и высвобождает сосудорасширяющий оксид азота (NO) из аминокислоты L-аргинин. Кроме того, NO играет важную роль в регуляции проницаемости сосудов, адгезии лейкоцитов и пролиферации гладкомышечных клеток [11, 12]. Показано, что при ХБП эндотелиальная дисфункция развивается в ранние сроки и характеризуется снижением биодоступности NO [13, 14], обусловленном, в частности, снижением синтеза NO вследствие инактивации эндотелиальной NO-синтазы (eNOS) и дефицита L-аргинина [15].
Важными медиаторами эндотелиальной дисфункции при ХБП являются уремические токсины, такие как асимметричный диметиларгинин (АДМА) и индоксилсульфат, накапливающиеся у пациентов при снижении функции почек. Эндотелиальные клетки являются источником АДМА, и его образование повышается в присутствии высоких концентраций метионина или гомоцистеина [16]. АДМА нарушает функцию эндотелия путем конкурентного ингибирования eNOS и тесно связан с наличием ИБС при ХБП [17]. Повышенные уровни АДМА у больных ХБП могут модулировать их атерогенный профиль и способствовать прогрессированию заболевания почек [16, 18]. Имеющиеся в настоящее время данные позволяют полагать, что роль уремических токсинов может также распространяться на участие в сложных взаимоотношениях сердца и почек в качестве медиатора эндотелиальной дисфункции. Таким образом, причинами эндотелиальной дисфункции у больных ХБП могут являться: накопление уремических токсинов, оксидативный стресс, дислипидемия, ингибирование eNОS повышенной продукцией асимметричного диметиларгинина, артериальная гипертензия [19, 20].
Таким образом, несмотря на то, что в последние годы были выявлены различные потенциальные патофизиологические механизмы эндотелиальной дисфункции при ХБП, многие детали остаются неизвестными. Дальнейшее изучение молекулярных механизмов, участвующих в этом сложном процессе, имеет решающее значение для разработки новых терапевтических подходов.
В клинической практике для оценки состояния сосудов часто используют метод лазерной допплеровской флуометрии (ЛДФ) [21, 22], позволяющий регистрировать изменения потока крови в микроциркуляторном русле [23]. Применяют метод ЛДФ и в экспериментальных исследованиях [24]. По состоянию микроциркуляторного русла (МЦР) делают заключение о развитии нарушений регуляции тонуса сосудов [25, 26]. Принято считать, что сосуды МЦР кожи по своим механизмам функционирования сходны с сосудами большего диаметра, и по изменению параметров ЛДФ можно судить о степени эндотелиальной дисфункции в крупных резистивных сосудах [27–29]. При этом наиболее информативными являются исследования динамики ЛДФ-параметров кожного кровотока у человека при проведении функциональных проб, например, постокклюзионной реактивной гиперемии. В нашем исследовании мы оценивали параметры МЦР кожи до и после проведения ионофореза вазодилатирующих агентов - ацетилхолина (ACh) и нитропруссида (NP).
Необходимо отметить, что в настоящее время имеются единичные данные об изменении реактивности МЦР кожи у пациентов с дисфункцией почек [30]. При асимптомной протеинурии было выявлено снижение вазодилататорной реакции на ACh, введенный в кожу ионофорезом. Умеренно увеличенное содержание С-реактивного белка коррелировало с эндотелиальной дисфункцией сосудов кожи [31]. Учитывая универсальность механизмов регуляции тонуса сосудов, можно предположить, что изменения функционального состояния сосудов МЦР может быть сходным с сосудами других бассейнов.
Однако вопрос о том, насколько по изменению реактивности сосудов МЦР кожи можно судить об изменении функционального состояния более крупных сосудов, требует дальнейшего решения [28]. В частности, это относится и к оценке сердечно-сосудистых осложнений у больных с нарушением функции почек. Существенный вклад в решение данной проблемы может внести оценка функционального состояния крупных сосудов и сосудов МЦР кожи у одного и того же животного при экспериментальном моделировании ХБП. Известно, что регуляция сосудистого тонуса осуществляется несколькими механизмами, эффективность которых различается в зависимости от диаметра и типа сосуда. Наши предыдущие исследования (in vitro) на изолированных сегментах крупных сосудов крыс с экспериментальным уменьшением количества функционирующих нефронов показали развитие эндотелиальной дисфункции, проявляющейся, в частности, в снижении ACh-индуцируемой дилатации колец аорты и верхней брыжеечной артерии [32]. В данном исследовании основное внимание уделено оценке реактивности более мелких брыжеечных артерий 2–3 порядка, регуляторные механизмы которых обладают большей схожестью с сосудами МЦР кожи. Кроме того, был выбран режим in vivo, при котором сохраняется естественный кровоток по исследуемому сосуду.
Таким образом, целью данной работы было провести сравнительный анализ реактивности сосудов МЦР кожи, исследованной с помощью ЛДФ, и брыжеечных артерий в условиях in vivo у крыс с резекцией 5/6 массы почек.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты выполнены на половозрелых самцах крыс стока Wistar (Центр коллективного пользования “Биоколлекция” Института физиологии им. И.П. Павлова РАН), исходной массой 280–320 г. Крысы были случайным образом распределены на 2 группы.
Для создания экспериментальной дисфункции почек животным первой группы (n = 15) удаляли 5/6 массы ткани почек (5/6 NE). Операцию выполняли в два этапа с интервалом в одну неделю. На первом этапе осуществляли резекцию 2/3 части левой почки, на втором – полностью удаляли правую почку. Вторую (контрольную) группу составляли ложнооперированные (SO) крысы (n = 15). Во время проведения ложной операции выполняли хирургические манипуляции, аналогичные нефрэктомии, но без удаления почечной ткани. В качестве наркоза использовали тилетамин/золазепам (10 мг/кг, Золетил 100, Virbac Sante Animale, Франция) в комплексе с ксилазин гидрохлоридом (5 мг/кг, Рометар, Bioveta, Чешская республика).
Длительность наблюдения составила 2 месяца после второго этапа операции. Во время эксперимента все животные получали стандартный пищевой рацион и имели доступ к пище и воде ad libitum. Крыс содержали по 5 особей в клетке при температуре 20–22°C и световом режиме 12 ч свет/12 ч темнота.
Перед началом и окончанием эксперимента у бодрствующих животных измеряли артериальное давление (АД) манжеточным методом на хвосте, используя электроманометр фирмы (ELEMA, Швеция). Среднее трех последовательных измерений считали величиной АД. Исходное АД (систолическое) у крыс NE-группы составляло 122 ± 5 мм рт. ст., SO-группы – 120 ± 6 мм рт. ст. (р > 0.05).
Эвтаназию животных осуществляли сразу после исследования реактивности брыжеечных артерий введением избыточной дозы наркоза, после этого отбирали пробу крови для последующего анализа. Концентрацию мочевины в сыворотке крови определяли на биохимическом анализаторе FURUNO-90 (Япония).
За неделю до окончания эксперимента проводили оценку кожной МЦР методом ЛДФ с помощью анализатора лазерной микроциркуляции крови “ЛАКК-ОП” (НПП “Лазма”, Россия). Длина волны исходящего излучения была 1064 нм, мощность лазерного излучения на выходе волоконного оптического зонда – не более 1 мВт. Калибровку “нулевого” показания проводили на специальном диске из фторопласта, встроенном в прибор.
Для исследования МЦР крыс наркотизировали тилетамин/золазепамом (20 мг/кг, Золетил 100, Virbac Sante Animale, Франция). Анализатор размещали на дорзо-латеральной поверхности поясничной части спины крысы, с которой предварительно удаляли шерсть и дезинфицировали. Датчик располагался свободно на поверхности кожи, не сдавливая микрососуды. При записи исходной ЛДФ место расположения датчика фиксировали, чтобы стандартизировать место записи после ионофореза вазоактивных агентов.
В физиологических условиях происходят постоянные изменения радиуса кровеносных сосудов, что вызывает непрерывное колебание интенсивности общей МЦР кожи, которое отражается в соответствующих флуктуациях регистрируемого сигнала. Вейвлет-анализ позволяет оценить характеристики периодических составляющих этих колебаний в различных диапазонах. В зависимости от генеза, для крыс принято выделять 5 диапазонов спектра: 0.01–0.05 Гц – эндотелиальный, 0.15–0.4 Гц – миогенный, 0.05–0.15 Гц – нейрогенный, 2–5 Гц – сердечный и 0.4–2.0 Гц – дыхательный [33]. В наших экспериментах мы оценивали только эндотелиальный, нейрогенный и миогенный диапазоны.
Для оценки функционального состояния сосудов МЦР кожи часто используют тестовые воздействия (ионофорез вазоактивных препаратов, микродиализ) [26]. В нашем исследовании для изучения реактивности сосудов кожи были выбраны обладающие сосудорасширяющим действием АCh (Sigma-Aldrich, США) и NP (ICN Biomedicals, США), которые в течение 2 мин вводили в кожу методом ионофореза 1%-ного раствора соответствующего вазодилататора с помощью прибора для ионофореза “ЭЛФОР-ПРОФ” (Россия). Оценивали изменение показателей МЦР кожи до и после действия АCh и NP.
Исследование показателей МЦР у каждой крысы выполняли в четыре этапа, ЛДФ записывали в течение 8 мин на каждом этапе. Сначала регистрировали исходную МЦР, затем проводили ионофорез АCh на этом же участке кожи, после чего снова записывали МЦР. Аналогичный протокол использовали для исследования реакции МЦР на NP. Зоны оценки МЦР и ионофореза для каждого агониста не перекрывались.
По результатам ЛДФ оценивали следующие показатели. Показатель МЦР – среднее значение амплитуды МЦР за период наблюдения, Кv – коэффициент вариации амплитуды МЦР, максимальные значения колебаний перфузии в эндотелиальном (Аэ), нейрогенном (Ан) и миогенном (Ам) диапазонах. На основе полученных характеристик проводили расчет эндотелиального (ЭТ) компонента сосудистого тонуса по формуле:
Нейрогенный (НТ) и миогенный (МТ) тонус рассчитывали аналогично, заменяя в формуле Аэ на соответствующие тонусу Ан или Ам.
Через неделю после ЛДФ исследовали реактивность брыжеечных артерий, оценивая динамику диаметра сосудов в ответ на действие вазодилататорных агентов в условиях in vivo. Для этого животных наркотизировали тилетамин/золазепамом (20 мг/ кг массы крысы, Золетил 100, Vibrac, Франция). Через разрез стенки брюшной полости выводили петлю тонкого кишечника, расправляли и помещали в специальный желоб, который фиксировали в термостабилизированной при температуре 37°С камере с протекающим раствором следующего состава (ммоль/л): NaCl – 120.4; KCl – 5.9; CaCl2 – 2.5; MgCl2 – 1.2; NaH2PO4 – 1.2; NaHCO3 – 15.5; глюкоза – 11.5. Раствор сатурировали газовой смесью, состоящей из 95% О2 и 5% СО2, рН раствора поддерживали на уровне 7.4. Перед тестированием сосуд 30 мин стабилизировали. Затем проводили исследования согласно выбранному протоколу.
Для оценки эндотелийзависимой и эндотелийнезависимой вазодилатации использовали введение в омывающий сосуд раствор ACh 1 × 10−5 моль/л или NP 1 × 10−6 моль/л на фоне предварительного сокращения сосуда PE (Sigma-Aldrich, США) 1 × 10−5 моль/л. Амплитуду дилатации выражали в процентах от амплитуды констрикции, вызванной PE. Маточные растворы ACh, NP, PE готовили на основе дистиллированной воды.
Микрофото- и видеорегистрацию брыжеечных артерий у крыс in vivo осуществляли с использованием микроскопа Биомед МС-1Т-ZOOM (Россия) и камеры BASLER acA4600-10uc (Германия), измерение диаметра артерий выполняли в программе MultiMedia Catаlog (MMC).
Статистическую обработку полученных данных проводили в программе Statistica v.12. Данные представлены в виде среднего значения ± стандартная ошибка среднего (М ± SЕ). Для сравнения двух выборок с нормальным распределением использовали однофакторный дисперсионный анализ (ANOVA). В случае распределения вариант в выборке, отличном от нормального, при сравнении двух независимых групп применяли U-критерий Манна–Уитни. Различия считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Проведенные исследования показали, что через 2 мес. у нефрэктомированных крыс уровень мочевины крови повышался и составлял 14.2 ± 0.9 ммоль/л по сравнению с контролем (4.9 ± 0.6 ммоль/л, р < 0.001). У животных с уменьшением количества функционирующих нефронов наблюдался также подъем уровня систолического АД (в NE-группе – 152 ± 9 мм рт. ст.; в контрольной группе – 127 ± 8 мм рт. ст., р < 0.001).
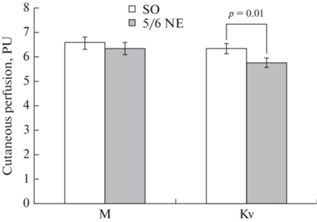
На первом этапе исследования была проведена оценка реактивности сосудов МЦР кожи крыс. Анализ исходных ЛДФ-грамм показал, что среднее значение показателя МЦР у крыс после нефрэктомии значимо не отличалось от показателя у контрольных животных (рис. 1), можно лишь отметить некоторую тенденцию к его снижению, oднако Кv был на 9.4% ниже, чем в контрольной группе.
Рис. 1.
Влияние нефрэктомии на микроциркуляцию кожи крыс. По оси абсцисс – характеристики микроциркуляции: М – среднее значение показателя микроциркуляции, Кv – коэффициент вариации амплитуды МЦР; по оси ординат – показатель микроциркуляции, PU – перфузионные единицы. Экспериментальные группы: SO – ложнооперированные крысы, 5/6 NE – крысы после удаления 5/6 массы действующих нефронов. Данные представлены в виде среднего значения ± стандартная ошибка. р – значимость различий между группами.
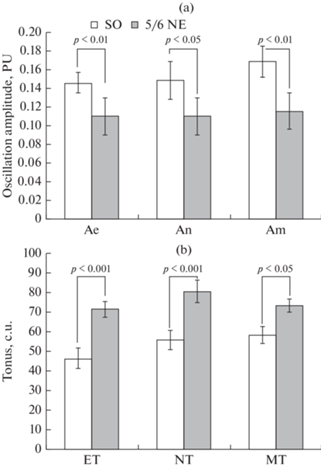
С помощью Вейвлет-анализа спектральных составляющих колебаний показателя МРЦ выявлено, что уменьшение количества функционирующих нефронов приводит к снижению осцилляций перфузии во всех трех исследованных диапазонах: максимальная амплитуда колебаний показателя МЦР снижалась на 26.7% – в эндотелиальном, на 26.4% – в нейрогенном и на 29.4% – в миогенном диапазонах спектра (рис. 2а). Рассчитанные показатели ЭТ, НТ и МТ сосудов кожи крыс, подвергнутых NE, отличались от животных SO-группы (рис. 2b). Величина ЭТ у крыс после удаления 5/6 массы ткани почек была выше аналогичного показателя контрольных животных на 53.1%, НТ – на 43.8%, МТ – на 25.5%.
Рис. 2.
Влияние нефрэктомии на эндотелиальный, нейрогенный и миогенный компоненты тонуса сосудов микроциркуляторного русла кожи крыс. (а): по оси абсцисс – диапазон колебаний (Аe – эндотелиальная, An – нейрогенная, Am – миогенная частотная составляющая спектра), по оси ординат – максимальная амплитуда колебаний показателя микроциркуляции, PU – перфузионные единицы. (b): по оси абсцисс – диапазон ЕТ (эндотелиального), NT (нейрогенного) и МТ (миогенного) тонуса; по оси ординат – величина тонуса, усл. ед. Экспериментальные группы: SO – ложнооперированные крысы, 5/6 NE – крысы после удаления 5/6 массы действующих нефронов. Данные представлены в виде среднего значения ± стандартная ошибка. р – значимость различий между группами.
Для оценки реактивности сосудов МЦР кожи крыс проводили регистрацию ЛДФ-граммы после ионофореза AСh. Эксперименты показали, что показатель перфузии после введения AСh у NE-крыс оказался в среднем на 18.1% ниже, чем в контрольной группе (рис. 3а), при этом его увеличение у животных после нефрэктомии составляло 37.7 ± 4.4% от исходного показателя МЦР, а у контрольных – 58.9 ± 4.2% (р < 0.001). Кроме того, у NE-крыс ионофорез AСh вызвал снижение Кv на 18.7 ± 7.7% по сравнению с исходным значением, тогда как у SО-животных Кv увеличился на 49.3 ± 7.4% по сравнению с величиной до ионофореза.
Рис. 3.
Влияние нефрэктомии на реактивность сосудов микроциркуляторного русла кожи крыc. Среднее значение показателя микроциркуляции (М) и коэффициент вариации (Кv) амплитуды МЦР после ионофореза ацетилхолина (а) и нитропруссида натрия (b). По оси ординат – показатель микроциркуляции, PU – перфузионные единицы. Экспериментальные группы: SO – ложнооперированные крысы, 5/6 NE – крысы после удаления 5/6 массы действующих нефронов. Данные представлены в виде среднего значения ± стандартная ошибка. р – значимость различий между группами.
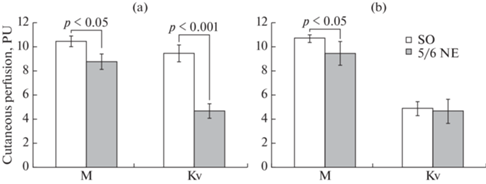
Проведение ионофореза NP также вызывало увеличение показателя МЦР кожи. Однако реактивность на NP различалась у крыс исследованных групп (рис. 3b). Так, величина показателя МЦР при действии NP у животных после нефрэктомии оказалась на 8.4% меньше, чем у SO-животных (р < 0.05), при этом NP у NE-крыс вызвал увеличение показателя микроциркуляции на 47.4 ± 4.7% от исходного уровня, а у животных SO-группы – на 62.7 ± 3.2% – (р < 0.01). Изменение Кv после ионофореза NP было аналогичным у крыс обоих групп, Кv снижался на 19.3 ± 3.4% у животных NE-группы, на 23.1 ± 8.9% у SO-крыс.
На втором этапе исследования (через 5–6 дней после ЛДФ) изучали влияние NE на величину дилатации предварительно сокращенных PE брыжеечных артерий крыс при действии тех же сосудорасширяющих агонистов – AСh и NP, что и при регистрации показателя перфузии МЦР кожи. Однако сначала оценивали констрикторные ответы на PE у животных разных групп, поскольку для стандартизации измерений амплитуду релаксации принято выражать в процентах от величины сокращения сосуда при действии PE. Анализ полученных результатов показал, что на данном сроке эксперимента NE не оказывала влияния на величину вызванной PE констрикции брыжеечных артерий крыс: у животных с NE амплитуда констрикции составляла 63.1 ± 5.4%, у животных SO-группы – 63.9 ± 4.8% (p > 0.05) от исходного диаметра сосудов.
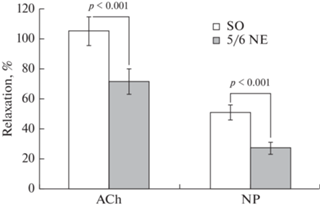
Действие AСh в концентрации 1 × 10−5 моль/л на предварительно сокращенные PE сосуды вызывало их релаксацию, величина которой различалась у крыс исследуемых групп (рис. 4). Нефрэктомия приводила к снижению реактивности сосудов – амплитуда AСh-индуцированной дилатации брыжеечных артерий крыс данной группы была в среднем на 32.5% меньше, чем в контроле.
Рис. 4.
Влияние нефрэктомии на реактивность брыжеечных артерий крыс. Амплитуда дилатации предварительно сокращенных фенилэфрином (1 × 10−6 моль/л) брыжеечных артерий при введении в омывающий раствор: ацетилхолина (ACh, 1 × 10−5 моль/л) и нитропруссида натрия (NP, 1 × 10−6 моль/л). По оси ординат – амплитуда релаксации, выраженная в процентах от амплитуды констрикции сосуда при действии фенилэфрина. Экспериментальные группы: SO – ложнооперированные крысы, 5/6 NE – крысы после удаления 5/6 массы действующих нефронов. Данные представлены в виде среднего значения ± стандартная ошибка. р – значимость различий между группами.
Для оценки реактивности брыжеечных артерий на различные концентрации AСh было проведено исследование кумулятивного эффекта ступенчатого повышения концентрации в пределах 1 × 10−10 моль/л–1 × 10−5 моль/л. Результаты показали, что NE приводит к значительному снижению дилататорной реакции на AСh по сравнению с SO-группой: уже при концентрации 1 × 10−8 моль/л релаксация была значимо ниже, а при повышении концентрации AСh эта разница усиливалась (рис. 5a).
Рис. 5.
Влияние нефрэктомии на АХ-индуцированную реактивность брыжеечных артерий крыс, кумулятивный эффект. (а): амплитуда дилатации предварительно сокращенных фенилэфрином (1 × 10−6 моль/л) брыжеечных артерий при введении в омывающий раствор ацетилхолина в ступенчато повышающейся концентрации (ACh от 1 × 10−10 до 1 × 10−5 моль/л). По оси ординат – амплитуда релаксации, выраженная в процентах от амплитуды констрикции сосуда при действии фенилэфрина. (b): площадь под кривой доза-эффект для ацетилхолина. По оси ординат – площадь под кривой зависимой от концентрации ацетилхолина амплитуды дилатации, усл. ед. Экспериментальные группы: SO – ложнооперированные крысы, 5/6 NE – крысы после удаления 5/6 массы действующих нефронов. Данные представлены в виде среднего значения ± стандартная ошибка. Значимость различий между группами: * – р < 0.05, *** – р < 0.001.
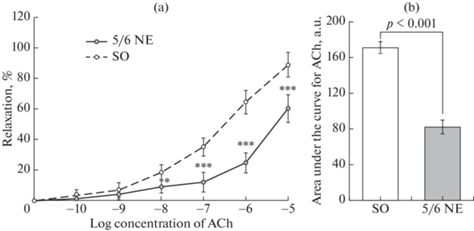
Подсчет площади под кривой для AСh показал, что общая реактивность брыжеечных артерий у животных с дисфункцией почек была в среднем в 2 раза меньше, чем у контрольных крыс (рис. 5b).
Нефрэктомия также вызывала ослабление дилатации брыжеечных артерий в ответ на действие NP (рис. 4b). Введение NP в омывающий раствор приводило к вазодилатации, при этом амплитуда релаксации артерий крыс после нефрэктомии была в среднем на 42.2% меньше, чем у SO животных.
Сравнение двух характеристик реактивности сосудов: амплитуды АХ-индуцированной дилатации брыжеечной артерии и степени увеличения показателя перфузии кожи после ионофореза АХ, полученных для каждой крысы, не выявило значимых корреляционных зависимостей (r = –0.38).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенные исследования показали, что через 2 мес. после удаления 5/6 массы почек у крыс развивалась уремия, сопровождающаяся изменениями сосудистой системы, в частности, подъемом уровня АД, нарушением функционального состояния микрососудов кожи и брыжеечных артерий. Развитие артериальной гипертензии является частым осложнением ХБП у людей [34]. Наши исследования также показали подъем АД у крыс после NE. Однако, несмотря на разницу в уровне АД, средние показатели перфузии в коже между NЕ- и SO-группами не отличались, то есть микрососуды кожи крыс с экспериментальным уменьшением количества функционирующих нефронов на данном сроке наблюдения поддерживали нормальный уровень перфузии. При этом нефрэктомия приводила к снижению эффективности регуляторных влияний на сосуды МЦР кожи, о чем свидетельствует, в частности, статистически значимое уменьшение коэффициента вариации показателя перфузии (Kv).
Следует отметить, что кроме показателей М и Kv, характеризующих общее состояние микроциркуляции, интерес представляет оценка отдельных механизмов регуляции перфузии. Такую возможность дает вейвлет-анализ ЛДФ-граммы, который позволяет рассмотреть параметры различных компонентов спектра, отражающих генез соответствующих флуктуаций показателя МЦР [35]. Результаты наших исследований показали, что у крыс с дисфункцией почек происходит подавление колебаний микроциркуляции в трех диапазонах: эндотелиальном, нейрогенном и миогенном. Поскольку существует обратная зависимость между амплитудой колебаний показателя микроциркуляции и величиной тонуса в каждом спектральном диапазоне, то, соответственно, после нефрэктомии наблюдалось увеличение расчетной величины ЭТ, НТ и МТ.
Принято считать, что флуктуации показателя MЦP в эндотелиальном диапазоне отражают в основном состояние артерий и артериол [36] и связаны с влиянием на тонус сосудов продуцируемых эндотелием вазоактивных веществ, в основном NO [37]. Вероятно, отмеченное в данном исследовании уменьшение амплитуды колебаний показателя перфузии в эндотелиальном диапазоне указывает на нарушение NO-зависимой регуляции тонуса микрососудов кожи крыс, подвергнутых нефрэктомии.
Величина НТ во многом определяется симпатическими влияниями на сосуды МЦР [38]. В настоящее время также имеются экспериментальные данные, свидетельствующие о том, что при нарушениях функции почек определенный вклад в повышение уровня АД может вносить симпатикотония [39]. В связи с этим можно предположить, что рост НТ отражает повышение симпатических регуляторных влияний на микрососуды кожи крыс после нефрэктомии.
Механизм формирования миогенных колебаний показателя перфузии связывают с синусоидальными колебаниями просвета артериол вследствие флуктуации потоков Са2+ через мембраны гладкомышечных клеток (ГМК), опосредованной функционированием локальных пейсмеккеров [40]. Уменьшение максимальной амплитуды в миогенном частотном диапазоне а, следовательно, повышение МТ в покое у крыс с дисфункцией почек свидетельствует о исходно сниженной дилатации микрососудов кожи по сравнению с ложнооперированными животными.
Для оценки реактивности сосудов МЦР кожи крыс было выполнено исследование изменения показателей перфузии кожи после ионофореза ACh и NP. Проведение функциональных проб с вазоактивными агентами дает возможность оценить эффективность механизмов, модулирующих интенсивность кровотока [41]. Наши исследования показали сниженную реакцию на вазодилататорные агонисты у животных после нефрэктомии: величина перфузии в коже NE-крыс после ионофореза АCh увеличилась лишь на 37.7 ± 8.2%, тогда как у SO – на 58.9 ± 6.7% (р < 0.01), после ионофореза NP – на 49.4 ± 4.5% по сравнению с 62.7 ± 5.1% – у SO (р < 0.05). Эти результаты свидетельствуют о нарушениях функционального состояния сосудов МЦР кожи крыс уже через 8 нед. после 5/6 NE и согласуются с клиническими исследованиями, показавшими снижение реактивности сосудов МЦР кожи на ионофорез ACh и NP у людей с дисфункцией почек [42].
Уменьшение реактивности кожного кровотока крыс NE-группы на NP свидетельствует о снижении чувствительности ГМК к NO, что ухудшает возможность МЦР адекватно реагировать на изменение физиологических условий или действие вазодилататоров. И действительно, в данном исследовании отмечено подавление реакции кожных микрососудов на ACh после NE. Известно, что вазодилатация микрососудов кожи при действии ACh осуществляется теми же путями, которые существуют и в крупных сосудах, и опосредованы NO, простагландинами и эндотелиальной гиперполяризацией [43, 44]. Учитывая полученные в исследовании результаты об изменении интенсивности кожной микроциркуляции после действия NP, можно предположить, что одной из причин уменьшения реакции на ACh может быть снижение чувствительности ГМК к NO. Однако наши предыдущие эксперименты на сегментах верхней брыжеечной артерии in vitro показали менее выраженное снижение амплитуды ACh-индуцированной дилатации сосудов после инкубации с блокатором NO-синтазы L-NAME у животных с дисфункцией почек по сравнению с SО-группой [32]. Данные клинических исследований также демонстрируют, что инфузия L-NAME перед проведением функциональной пробы снижает NO-зависимую вазодилатацию у людей с ХБП [34]. Вероятно, в нашем исследовании подавление реакции кожных микрососудов на ACh также частично может быть обусловлено снижением продукции NO эндотелием. Учитывая наши предыдущие исследования in vitro, выявившие снижение эффективности механизма эндотелиальной гиперполяризации в верхней брыжеечной артерии у крыс после нефрэктомии [32], нельзя исключать возможность подавления данного механизма релаксации и для микрососудов кожи.
Таким образом, результаты исследования кожного кровотока методом ЛДФ показали, что уменьшение количества функционирующих нефронов на данном сроке наблюдения не вызывает изменения базового уровня перфузии в коже крыс, однако приводит к подавлению реактивности сосудов МЦР кожи на вазодилататорные воздействия.
У экспериментальных животных также была проведена оценка реактивности более крупных резистивных сосудов на вазодилататорные стимулы. Результаты показали, что, несмотря на рост АД, нефрэктомия не изменяла реактивность брыжеечных артерий к вазоконстрикторным стимулам: амплитуда вызванных РЕ сокращений сосудов крыс NE- и SO-групп не различались. В то же время у крыс с дисфункцией почек наблюдались изменения в реакциях брыжеечных артерий in vivo на вазодилататорные агонисты. Так, у животных, подвергнутых нефрэктомии, была значительно подавлена реакция артерий на действие NP и ACh. Учитывая, что NP-индуцированная дилатация не зависит от синтеза NO эндотелием, а концентрация введенного в ванночку с сосудом NP была одинаковой в обеих группах, то снижение реакции на NP сосудов крыс после нефрэктомии может быть связано с нарушением процессов внутриклеточной сигнализации в ГМК, отвечающей за дилататорное действие NO. Возможность влияния нефрэктомии на связанный с растворимой гуанилатциклазой (рГЦ) путь была показана в экспериментах in vivo, где авторы выявили инверсию ответа мелких пиальных артерий на ACh (с вазодилатации на вазоконстрикцию) у NE-крыс после блокады рГЦ метиленовым синим [45]. В нашем исследовании уменьшение почечной массы приводило к подавлению ACh-индуцированной дилатации брыжеечных артерий, при этом амплитуда релаксации при действии ACh в концентрации 10–5 моль/л у животных NЕ-группы была на 25.2% меньше, чем у SO-крыс.
Известно, что эндотелий-зависимая ACh-индуцированная вазодилатация опосредуется взаимодействием трех основных механизмов: связанных с NO, простагландинами и эндотелиальным гиперполяризующим фактором [46]. Наши предыдущие исследования на сосудах в условиях in vitro показали, что снижение вызванной АХ релаксации верхней брыжеечной артерии происходило вследствие нарушения биодоступности NO (уменьшения синтеза NO-синтазой и снижения чувствительности ГМК к NO), а также меньшей эффективностью механизма эндотелиальной гиперполяризации [32]. Сходные изменения в реактивности сосудов в условиях in vivo и in vitro позволяют предположить, что нефрэктомия приводит к угнетению ACh-индуцированной вазодилатации брыжеечных артерий 2–3-го порядка вследствие повреждения как NO-зависимого механизма, так и механизма эндотелиальной гиперполяризации. Тонус более мелких сосудов МЦР кожи регулируется теми же механизмами, которые характерны для крупных артерий, но выраженность этих влияний может варьировать в зависимости от величины сосуда и его расположения. Вероятно, что различия в выраженности реакции на ACh между более крупными сосудами и микрососудами кожи определяются отличием в эффективности отдельных механизмов вазодилатации в ответ на действие агонистов. Следует подчеркнуть, что функциональное состояние сосудов МЦР крыс после нефрэктомии позволяет поддерживать нормальный уровень перфузии в коже в покое, однако при проведении функциональных и фармакологических проб признаки эндотелиальной дисфункции становятся очевидными.
Причина развития эндотелиальной дисфункции после нефрэктомии может быть связана с действием на эндотелий и ГМК образующихся при ХБП метаболитов, уремических токсинов, активных форм кислорода [34]. В частности, показано, что у пациентов с ХБП продукция эндотелием NO значительно снижается при повышении уровня АДМА [16, 18], а также гомоцистеина [47]. Кроме того, у людей с нарушением функции почек значительно усиливается окислительный стресс, приводящий к избыточному образованию активных форм кислорода и дефициту антиоксидантов [34], что считается одним из факторов риска развития нарушений сердечно-сосудистой системы.
К сожалению, нам не удалось подтвердить предположение о том, что реактивность сосудов МЦР в количественном отношении отражает функциональное состояние более крупных резистивных сосудов. Сравнение амплитуды ACh-индуцированной вазодилатации брыжеечных артерий и степени повышения показателя МЦР кожи после ионофореза NP или ACh не выявило значимой корреляционной зависимости. Причиной различной выраженности реакции на ACh крупных и мелких сосудов могут быть как индивидуальные особенности в строении сосудистого русла кожи и исходном диаметре взятых в исследование брыжеечных артерий, так и степени участия различных механизмов вазодилатации в сосудах разных типов. Так, показано, что в крупных артериях эндотелий-зависимая вазодилатация осуществляется в основном NO-зависимым путем, а при уменьшении диаметра сосудов возрастает роль механизма эндотелиальной гиперполяризации [48].
Таким образом, проведенные эксперименты показали, что удаление 5/6 массы ткани почек у крыс Wistar через 2 месяца приводит к уремии и росту АД. Уменьшение количества функционирующих нефронов на данном сроке эксперимента не оказывает влияния на среднюю величину фоновой перфузии в коже крыс, однако изменяет структуру частотного диапазона спектра колебаний показателя микроциркуляции, что отражает повышение эндотелиального, нейрогенного и миогенного тонуса сосудов МЦР кожи. Нефрэктомия приводит к развитию эндотелиальной дисфункции брыжеечных артерий и сосудов микроциркуляторного русла кожи, выражающейся в снижении их реактивности на действие эндотелий-зависимого и независимого от эндотелия вазодилататоров. Отсутствие прямой корреляции величины ацетилхолин-индуцированной вазодилатации между брыжеечной артерией и сосудами микроциркуляторного русла кожи можно объяснить индивидуальными различиями в исходном диаметре сосудов и архитектуре сосудистой сети, а, следовательно, в степени участия отдельных механизмов в вазодилатации сосудов разных типов.
Список литературы
Webster AC, Nagler EV, Morton RL, Masson P (2017) Chronic kidney disease. Lancet 389: 1238–1252. https://doi.org/10.1016/S0140-6736(16)32064-5
Di Angelantonio E, Danesh J, Eiriksdottir G, Gudnason V (2007) Renal function and risk of coronary heart disease in general populations: new prospective study and systematic review. PLoS Med 4: e270. https://doi.org/10.1371/journal.pmed.0040270
Tyralla K, Amann K (2003) Morphology of the heart and arteries in renal failure. Kidney Int 63(Suppl. 84): 80–85. https://doi.org/10.1046/j.1523-1755.63.s84.1.x
Düsing P, Zietzer A, Goody PR, Hosen MR, Kurts C, Nickenig G, Jansen F (2021) Vascular pathologies in chronic kidney disease: pathophysiological mechanisms and novel therapeutic approaches. J Mol Med 99(3): 335–348. https://doi.org/10.1007/s00109-021-02037-7
Seliger SL, Salimi S, Pierre V, Giffuni J, Katzel L, Parsa A (2016) Microvascular endothelial dysfunction is associated with albuminuria and CKD in older adults. BMC Nephrol 17: 82. https://doi.org/10.1186/s12882-016-0303-x
Tonelli M, Muntner P, Lloyd A, Manns BJ, Klarenbach S, Pannu N, James MT, Hemmelgarn BR (2012) Risk of coronary events in people with chronic kidney disease compared with those with diabetes: a population-level cohort study. Lancet 380: 807–814. https://doi.org/10.1016/S0140-6736(12)60572-8
Jankowski J, Floege J, Fliser D, Böhm M, Marx N (2021) Cardiovascular Disease in Chronic Kidney Disease: Pathophysiological Insights and Therapeutic Options. Circulation 143(11): 1157–1172. https://doi.org/10.1161/CIRCULATIONAHA.120.050686
Schiffrin EL, Lipman ML, Mann JFE (2007) Chronic kidney disease: effects on the cardiovascular system. Circulation.116: 85–97. https://doi.org/10.1161/CIRCULATIONAHA.106.678342
Zoccali C, Vanholder R, Massy ZA, Ortiz A, Sarafidis P, Dekker FW, Fliser D, Fouque D, Heine GH, Jager KJ, Kanbay M, Mallamaci F, Parati G, Rossignol P, Wiecek A, London G (2017) The systemic nature of CKD. Nat Rev Nephrol. 13: 344–358. https://doi.org/10.1038/nrneph.2017.52
Batra G, Ghukasyan Lakic T, Lindbäck J, Held C, White HD, Stewart RAH, Koenig W, Cannon CP, Budaj A, Hagström E, Siegbahn A, Wallentin L (2021) STABILITY Investigators Interleukin 6 and Cardiovascular Outcomes in Patients With Chronic Kidney Disease and Chronic Coronary Syndrome. JAMA Cardiol 6(12): 1440–1445. https://doi.org/10.1001/jamacardio.2021.3079
Martens CR, Edwards DG (2011) Peripheral vascular dysfunction in chronic kidney disease. Cardiol Res Pract 2011: 1–9. https://doi.org/10.4061/2011/267257
Düsing P, Zietzer A, Goody PR, Hosen MR, Kurts C, Nickenig G, Jansen F (2021) Vascular pathologies in chronic kidney disease: pathophysiological mechanisms and novel therapeutic approaches. Int J Mol Sci 22(17): 9221. https://doi.org/10.3390/ijms22179221
Schmidt RJ, Baylis C (2000) Total nitric oxide production is low in patients with chronic renal disease. Kidney Int 58: 1261–1266. https://doi.org/10.1046/j.1523-1755.2000.00281.x
Benchetrit S, Green J, Katz D, Bernheim J, Rathaus M (2003) Early endothelial dysfunction, following renal mass reduction in rats. Eur J Clin Invest 33(1): 26–31. https://doi.org/10.1046/j.1365-2362.2003.01102
Amador-Martínez I, Pérez-Villalva R, Uribe N, Cortés-González C, Bobadilla NA, Barrera-Chimal J (2019) Reduced endothelial nitric oxide synthase activation contributes to cardiovascular injury during chronic kidney disease progression. Am J Physiol Renal Physiol 317: F275–F285. https://doi.org/10.1152/ajprenal.00020.2019
Fliser D, Kielstein JT, Haller H, Bode-Borger SM (2003) Asymmetric dimethylarginine: A cardiovascular risk factor in renal disease? Kidney Int 63(Suppl.84): 37–43. https://doi.org/10.1046/j.1523-1755.63.s84.11.x
Mangiacapra F, Conte M, Demartini C, Muller O, Delrue L, Dierickx K, di Sciascio G, Trimarco B, de Bruyne B, Wijns W, Bartunek J, Barbato E (2016) Relationship of asymmetric dimethylarginine (ADMA) with extent and functional severity of coronary atherosclerosis. Int J Cardiol 220: 629–633. https://doi.org/10.1016/j.ijcard.2016.06.254
Zoccali C, Mallamaci F, Tripepi G (2003) Traditional and emerging cardiovascular risk factors in end-stage renal disease. Kidney Int 63(Suppl 85): 105–111. https://doi.org/10.1046/j.1523-1755.63.s85.25.x
Annuk M, Zilmer M, Fellstrom B (2003) Endothelium-dependent vasodilatation and oxidative stress in chronic renal failure: Impact on cardiovascular disease. Kidney Int 63(suppl 84): 50–54. https://doi.org/10.1046/j.1523-1755.63.s84.2.x
Zannad F, Rossignol P (2018) Cardiorenal Syndrome Revisited Circulation 138(9): 929–944. https://doi.org/10.1161/CIRCULATIONAHA.117.028814
Martens RJH, Stehouwer CDA (2017) Assessing microvascular function in humans from a chronic disease perspective. J Am Soc Nephrol 28(12): 3461–3472. https://doi.org/10.1681/ASN.2017020157
Williams J, Gilchrist M, Strain D, Fraser D, Shore A (2020) The systemic microcirculation in dialysis populations. Microcirculation 27(5): e12613. https://doi.org/10.1111/micc.12613
Roustit M, Cracowski JL (2012) Non-invasive assessment of skin microvascular function in humans: an insight into methods. Microcirculation 19: 47–64 https://doi.org/10.1111/j.1549-8719.2011.00129.x
Wei Y, Chen H, Chi Q, He Y, Mu L, Liu C, Lu Y (2021) Synchronized research on endothelial dysfunction and microcirculation structure in dorsal skin of rats with type 2 diabetes mellitus. Med Biol Eng Comput 59(5): 1151–1166. https://doi.org/10.1007/s11517-021-02363-5
Izjerman RG, de Jongh RT, Beijk MA, vanWeissenbruch MM, Delemarre-van de Waal HA, Serne EH, Stehouwer CD (2016) Individuals at increased coronary heart disease risk are characterized by animpaired microvascular function in skin. Eur J ClinInvest 33: 536–542. https://doi.org/10.1046/j.1365-2362.2003.01179.x
Cracowski JL, Roustit M (2016) Current methods to assess human cutaneous blood flow: an updated focus on laser-based-techniques. Microcirculation 23: 337–344. https://doi.org/10.1111/micc.12257
Stewart J, Kohen A, Brouder D, Rahim F, AdlerS, Garrick R, Goligorsky MS (2004) Noninvasiveinterrogation of microvasculature for signs ofendothelial dysfunction in patients with chronic renalfailue. Am J Physiol Heart Circ Physiol 287: H2687–H2696. https://doi.org/10.1152/ajpheart.00287.2004
Lindstedt IH, Edvinsson ML, Edvinsson L (2006) Reduced responsiveness of cutaneous microcirculation in essential hypertension—a pilotstudy. Blood Pressure 15: 275–280. https://doi.org/10.1080/08037050600996586
Wei Y, Chen H, Chi Q, He Y, Mu L, Liu C, Lu Y (2021) Synchronized research on endothelial dysfunction and microcirculation structure in dorsal skin of rats with type 2 diabetes mellitus. Med Biol Eng Comput 59(5): 1151–1166. https://doi.org/10.1007/s11517-021-02363-5
Smogorzewski MJ (2017) Skin Blood Flow and Vascular Endothelium Function in Uremia. J Ren Nutr 27(6): 465–469. PMID: https://doi.org/10.1053/j.jrn.2017.04.01229056167
Paisley KE, Beaman M, Tooke JE, Mohamed-Ali V, Lowe GD, Shore AC (2003) Endothelial dysfunction and inflammation in asymptomatic proteinuria. Kidney Int 63(2): 624–633.https://doi.org/10.1046/j.1523-1755.2003.00768.x12631127
Иванова ГТ, Лобов ГИ, Береснева ОН, Парастаева ММ (2019) Изменение реактивности сосудов крыс с экспериментальным уменьшением массы функционирующих нефронов. Нефрология 23(4): 88–95. [Ivanova GT, Lobov GI, Beresneva ON, Parastaeva MM (2019) Changes in the reactivity of vessels of rats with an experimental decrease in the mass of functioning nephrons Nephrology (Saint-Petersburg) 23(4): 88–95. (In Russ)]).https://doi.org/10.24884/1561-6274-2019-23-4-88-95
Rossi M, Carpi A, Galetta F, Franzoni F, Santoro G (2006) The investigation of skin blood flowmotion: a new approach to study the microcirculatory impairment in vascular diseases? Biomed Pharmacother 60: 437–442. https://doi.org/10.1016/j.biopha.2006.07.012
DuPont JJ, Ramick MG, Farquhar WB, Townsend RR, Edwards DG (2014) NADPH oxidase-derived reactive oxygen species contribute to impaired cutaneous microvascular function in chronic kidney disease. Am J Physiol Renal Physiol 306(12): F1499–F1506.https://doi.org/10.1152/ajprenal.00058.2014
Houben A, Martens RJH, Stehouwer CDA (2017) Assessing microvascular function in humans from a chronic disease perspective. J Am Soc Nephrol 28: 3461–3472. https://doi.org/10.1681/ASN.2017020157
Sriram K, Salazar Vázquez BY, Tsai AG, Cabrales P, Intaglietta M, Tartakovsky DM (2012) Autoregulation and mechanotransduction control the arteriolar response to small changes in hematocrit. Am J Physiol Heart Circ Physiol 303(9): H1096–H1106. https://doi.org/10.1152/ajpheart.00438.2012
Kvandal P, Stefanovska A, Veber M, Kvernmo HD, Kirkebøen KA (2003) Regulation of human cutaneous circulation evaluated by laser Doppler flowmetry, iontophoresis, and spectral analysis: importance of nitric oxide and prostaglandines. Microvasc Res 65(3): 160–171. https://doi.org/10.1016/s0026-2862(03)00006-2
Крупаткин АИ, Сидоров ВВ (2005) Лазерная доплеровская флоуметрия микроциркуляции крови. М. Медицина. [Krupatkin AI, Sidorov VV (2005) Laser Doppler flowmetry of blood microcirculation. М. Medicine-press. (In Russ)].
Drábková N, Hojná S, Zicha J, Vaněčková I (2020) Contribution of selected vasoactive systems to blood pressure regulation in two models of chronic kidney disease. Physiol Res 69(3): 405–414. https://doi.org/10.33549/physiolres.934392
Stefanovska A., Bravik M (1999) Physics of human cardiovascular system. Contemporary Physics 40(1): 31–35.
Houben A, Martens RJH, Stehouwer CDA (2017) Assessing microvascular function in humans from a chronic disease perspective. J Am Soc Nephrol 28: 3461–3472. https://doi.org/10.1681/ASN.2017020157
Stewart JM, Kohen A, Brouder D, Rahim F, Adler S, Garrick R, Goligorsky MS (2004) Noninvasive interrogation of microvasculature for signs of endothelial dysfunction in patients with chronic renal failure. Am J Physiol Heart Circ Physiol 287: H2687–H2696. https://doi.org/10.1152/ajpheart.00287.2004
Kellogg DL Jr, Zhao JL, Coey U, Green JV (2005) Acetylcholine-induced vasodilation is mediated by nitric oxide and prostaglandins in human skin. J Appl Physiol 98: 629–632. https://doi.org/10.1152/japplphysiol.00728.2004
Gaubert ML, Sigaudo-Roussel D, Tartas M, Berrut G, Saumet JL, Fromy B (2007) Endothelium-derived hyperpolarizing factor as an in vivo back-up mechanism in the cutaneous microcirculation in old mice. J Physiol 585(Pt 2): 617–626. https://doi.org/10.1113/jphysiol.2007.143750
Лобов ГИ, Соколова ИБ (2020) Роль NO и H2S в регуляции тонуса церебральных сосудов при хронической болезни почек. Рос физиол журн им ИМ Сеченова 106(8): 1002–1015. [Lobov GI, Sokolova IB (2020) Role of NO and H2S in the Regulation of the Tone of Cerebral Vessels in Chronic Kidney Disease. Russ J Physiol 106(8): 1002–1015. (In Russ)]. https://doi.org/10.31857/S0869813920080063
Freed JK, Gutterman DD (2017) Communication Is Key: Mechanisms of Intercellular Signaling in Vasodilation. J Cardiovasc Pharmacol 69(5): 264–272. https://doi.org/10.1097/FJC.0000000000000463
Chen CH, Huang SC, Yeh EL, Lin PC, Tsai SF, Huang YC (2022) Indoxyl sulfate, homocysteine, and antioxidant capacities in patients at different stages of chronic kidney disease. Nutr Res Pract 16(4): 464–475.https://doi.org/10.4162/nrp.2022.16.4.464
Brunt VE, Fujii N, Minson CT (2015) Endothelialderived hyperpolarization contributes to acetylcholine-mediated vasodilation in human skin in a dose-dependent manner. J Appl Physiol 119: 1015–1022. https://doi.org/10.1152/japplphysiol.00201.201
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


